Preventie van koemelkallergie
Uitgangsvraag
Wat is het advies ten aanzien van koemelk bevattende kunstvoeding ter preventie van koemelkallergie bij borst gevoede zuigelingen?
De uitgangsvraag omvat de volgende deelvragen:
- Kan vroege blootstelling aan koemelk bevattende kunstvoeding de ontwikkeling van een koemelkallergie voorkomen?
- Spelen de timing, duur en dosering van blootstelling hierin nog een belangrijke rol?
Aanbeveling
De werkgroep ziet geen reden om blootstelling aan koemelk uit te stellen. Voor pinda en kippenei is inmiddels bewezen dat vroege introductie een allergie kan voorkomen; dit is voor koemelk op basis van de huidige literatuur niet bewezen.
Er is op dit moment onvoldoende wetenschappelijk bewijs om het bijvoeden met koemelkbevattende voeding in de eerste levensweken af te raden. Er is eveneens onvoldoende bewijs om advies te geven over het staken of continueren van (reeds gestarte) koemelkbevattende bijvoeding bij borstgevoede kinderen.
Maak indien relevant gezamenlijk met de ouders een beslissing over het wel of niet continueren van eerder gestarte koemelkbevattende bijvoeding bij borstgevoede kinderen (waarin het risico van het individuele kind en alle bovengenoemde overwegingen worden meegenomen).
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Voor de beantwoording van deelvraag 1 is een systematisch literatuuronderzoek verricht naar de effectiviteit van blootstelling aan koemelk bevattende kunstvoeding bij kinderen onder de leeftijd van één jaar. In totaal werden er één systematische review (met daarin drie relevante (quasi-)RCTs) en twee additionele RCTs gevonden die vroege blootstelling aan koemelk bevattende kunstvoeding vergeleken met geen blootstelling aan koemelk bevattende kunstvoeding in kinderen met een laag of hoog risico op het ontwikkelen van een koemelkallergie. Echter, het risico op bias in deze studies is hoog vanwege problemen en/of onduidelijkheden met betrekking tot het randomisatieproces, de blindering van de ouders en beoordelaar van uitkomstmaten, en het niet naleven van het protocol. Bovendien is er in één studie onzekerheid over blootstelling aan koemelk in de periode voor randomisatie (Sakihara, 2021). Verder overlappen de betrouwbaarheidsintervallen met de grenzen van klinische besluitvorming. Het bewijs voor de cruciale uitkomstmaat is daarom voor zowel de hoog-risico als laag-risico populatie beoordeeld als zeer laag. Dit betekent dat toekomstige studies kunnen leiden tot andere resultaten. Op basis van enkel de literatuur kan er op dit moment geen gegronde conclusie worden getrokken over de effectiviteit van vroege blootstelling aan koemelk bevattende kunstvoeding ter preventie van het ontwikkelen van een IgE-gemedieerde koemelkallergie.
Daar komt nog bij dat in de meer dan 30 jaar oude BOKAAL studie (de Jong, 1998; de Jong, 2002), geen effect is gevonden van het kortstondig bijvoeden met koemelk van 1533 borst-gevoede kinderen op de ontwikkeling van allergische ziekten op de leeftijd van 1, 2 en 5 jaar. De BOKAAL studie is een gerandomiseerde Nederlandse studie die is uitgevoerd in de eerste lijn onder pasgeborenen zonder een verhoogd risico op allergie, waarbij de kinderen werden gerandomiseerd voor bijvoeding met standaard flesvoeding (op basis van koemelk) of een hydrolysaat. De aanwezigheid van allergische ziekten werd geblindeerd en anamnestisch vastgesteld. Dit zou eerder een overschatting dan onderschatting van de allergische symptomen hebben gegeven. Een subanalyse onder kinderen met een verhoogd risico op allergie liet eveneens geen effect zien. Hoewel het percentage kinderen met koemelkallergie niet is vermeld, verschilde de sensibilisatie voor koemelk gedurende de eerste 2 levensjaren niet tussen beide groepen (5.8 % in de koemelk groep versus 4,1 % in de placebo groep, RR 1.43 (955 CI 0,90-2.26), noch op de leeftijd van 5 (5.8% in de koemelkgroep versus 3.0% in de placebo groep, RR 1.77 (95% CI 0.93 - 3.37).
Timing, duur en dosering van bloostelling
Het antwoord op deelvraag 2 wordt hieronder uitgewerkt op basis van de gedetailleerde bestudering van de studies die zijn gevonden voor de beantwoording van deelvraag 1 (met name gericht op de mate, timing en duur van blootstelling) (zie Tabel S1). De resultaten van Perkin (2016) zijn hierin ook meegenomen. Deze studie voldeed niet aan de selectiecriteria voor opname in de literatuursamenvatting voor de beantwoording van deelvraag 1 maar is wel relevant voor de beantwoording van deelvraag 2. Tevens is gebruik gemaakt van overige literatuur en expert opinion.
Ten aanzien van de duur en het tijdstip van de blootstelling aan koemelk bevattende bijvoeding lopen de studies uiteen. Juvonen (1996) en Saarinen (1999) onderzochten blootstelling in de eerste levensdagen, Hill (2000) in de eerst levensmaanden als aanvulling op of vervanging van borstvoeding, Urashima (2019) in de eerste 5 maanden, Sakihara (2020) 1 tot 3 maanden en Perkin (2016) van levensmaand 3 tot 6 (Tabel 2, Tabel S1). Waar de studies van Saarinen (1999) (low-risk infants) en Urashima (2019) (high-risk infants) aanwijzingen tonen dat tijdelijke blootstelling aan koemelk in de eerste levensdagen een verhoogde kans op koemelkallergie geeft, geven de studies van Hill (2000) (high-risk infants), Juvonen (1996) (low-risk infants) Sakihara (2021) (low-risk infants) en Perkin (2016) (low-risk infants) aanwijzingen dat latere blootstelling gedurende enkele maanden juist beschermend kan werken.
Daarnaast laten vijf van de zes studies beperkingen in de studieopzet met betrekking tot het tijdstip en de duur van blootstelling zien (Tabel S1). In twee studies is het onduidelijk wat er na blootstelling aan koemelk in de eerste levensdagen heeft plaatsgevonden (Juvonen, 1996; Saarinen, 1999). In de studie van Hill (2000) is het onduidelijk wanneer precies en voor hoe lang de interventie heeft plaatsgevonden. In de studie van Sakihara (2021) (SPADE studie) is het onduidelijk in hoeverre er in de eerste levensmaand al blootstelling is geweest. Daarnaast was een maximum van 10 ml koemelk bevattende voeding toegestaan in de controlegroep. Het is echter onduidelijk hoeveel dit exact is geweest. Dit geldt ook voor de studie van Perkin (2016) waarin ook tot 300 ml koemelk per dag in de controlegroep werd geaccepteerd.
Als we kijken naar de gegeven hoeveelheid koemelk bevattende kunstvoeding, varieert dit ook sterk tussen de verschillende studies. De studies van Hill (2000) en Juvonen (1996) hebben dit niet duidelijk beschreven. In de studie van Saarinen (1999) werd een wisselende hoeveelheid gegeven aan de participanten. De gegeven hoeveelheid koemelk was meer dan 10 ml in de studie van Sakihara (2021) en 5-40 ml in de studie van Urashima (2019) (Tabel 2, Tabel S1). Kortom, de studies laten tegenstrijdige resultaten zien ten aanzien van de duur, het tijdstip en de hoeveelheid koemelk consumptie op het risico op het ontstaan van KMA. Er is onvoldoende bewijs om een uitspraak te doen of en zo ja wanneer blootstelling aan koemelk bevattende kunstvoeding beschermend of juist risico verhogend kan werken ten aanzien van het ontwikkelen van een KMA.
Tabel 2. Effect van koemelkconsumptie op het ontstaan van KMA met betrekking tot het tijdstip (oplopend in leeftijd), de duur en de hoeveelheid blootstelling.
|
Studie |
Populatie |
Koemelk consumptie: duur en tijdstip |
Koemelk consumptie: hoeveelheid |
Risico op KMA |
|
Juvonen (1996) |
Laag risico |
Eerste 3 levensdagen |
Onduidelijk |
Verlaagd |
|
Saarinen (1999) |
Laag risico |
Eerste levensdagen |
Wisselend |
Verhoogd |
|
Hill (2000) |
Hoog risico |
Eerste levensmaanden |
Onduidelijk |
Verlaagd |
|
Sakihara (2020) |
Laag risico |
Maand 1-3 |
>10 ml per dag |
Verlaagd |
|
Urashima (2019) |
Hoog risico |
Eerste 5 maanden |
5-40 ml |
Verhoogd |
|
Perkin (2016) |
Laag risico |
Maand 3-6 |
2 x 40-60 g zuivel per week |
Verlaagd |
|
Afkortingen: KMA = koemelkallergie. |
||||
Op basis van ervaringen uit de praktijk (bij andere allergenen), gaat men er op dit moment van uit dat de kans op het ontwikkelen van een IgE-gemedieerde allergie wordt verhoogd indien een allergeen na introductie voor langere tijd niet meer wordt aangeboden. Kortdurend bijvoeden met standaard flesvoeding vlak na de geboorte zou dan risico verhogend werken. De studies beschreven in de literatuursamenvatting zijn hierover echter niet eenduidig: er is een korte en wisselende follow-up, het is niet altijd duidelijk of het om IgE en niet-IgE gemedieerde KMA gaat, er is grote heterogeniteit in studie design, en de bewijskracht is beoordeeld als zeer laag. Daarnaast mist er relevante informatie over het tijdstip, de duur en de hoeveelheid koemelk voeding die gegeven is.
Overige literatuur
In de meest recente European Academy of Allergy and Clinical Immunology (EAACI)-richtlijn over de preventie van voedselallergie wordt het kortdurend en tijdelijk geven van standaard flesvoeding naast borstvoeding gedurende de eerste levensweek afgeraden (Halken, 2020). Deze aanbeveling is gedaan op basis van de resultaten van de studie van Urashima (2019). De aanbeveling is gebaseerd op een laag niveau van bewijs en slechts op één studie. Andere studies (Saarinen, 1999; Høst, 1988) worden aangehaald als ondersteunend voor het bewijs.
In een recente publicatie verrichtte Sakihara (2022) een subanalyse naar aanleiding van zijn eerder gepubliceerde studie omtrent de mogelijke effectiviteit van vroege blootstelling aan koemelk ter preventie van KMA (Sakihara, 2021). Kinderen die in hun eerste levensdagen waren blootgesteld aan koemelk bevattende voeding werden geïncludeerd. De subanalyse toonde een IgE-gemedieerde koemelkallergie incidentie van 15,2% bij de leeftijd van 6 maanden, indien er in de eerste levensdagen minstens 10 ml koemelk bevattende voeding werd gegeven en dit vervolgens werd gestaakt. Hoe eerder er werd gestaakt en hoe minder koemelk er werd gegeven voor het staken, hoe groter de kans op een KMA. Deze studie geeft aanwijzingen dat koemelk bevattende voeding moet worden gecontinueerd zodra het in de eerste levensdagen eenmaal is gegeven. Het nadeel van deze studie blijft dat er ook in de controlegroep max 10 ml koemelk bevattende voeding per dag was toegestaan, en dat het onduidelijk is hoeveel dit is geweest.
Overige overwegingen
Het geven van flesvoeding naast borstvoeding behoort momenteel tot de standaard zorg. Koemelk bevattende bijvoeding wordt bij 33% van de kinderen in Nederland in de eerste levensdagen aangeboden, vaak naast moedermelk. Op het moment dat het kind voldoende gevoed kan worden met moedermelk, wordt de bijvoeding gestaakt. Bijvoeding kan echter ook middels een intensief hydrolysaat of aminozuurvoeding. Dit zou kunnen worden doorgevoerd in standaard zorg als er voldoende bewijs is dat het kortstondig geven van koemelkvoeding vlak na de geboorte het risico op KMA verhoogt.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het voordeel van het wel of niet aanbieden van koemelk bevattende bijvoeding kan zijn het voorkomen van een IgE-gemedieerde KMA. Dit is een belangrijk voordeel, omdat een IgE-gemedieerde KMA gevaarlijk kan zijn en kan leiden tot anafylaxie. De voorkeur van ouders speelt hierbij ook een rol; vaak is het gewenst om volledig borstvoeding te geven. Ouders moeten daarom in de beslissing meegenomen worden en moeten goed geïnformeerd worden. Daarbij moet ook worden meegewogen dat de prevalentie van IgE gemedieerde KMA laag is, namelijk 0,8% (Schoemaker, 2015). Er kan naar aanleiding van de ontbrekende evidentie geen advies worden gegeven, maar wel een beslissing worden genomen aan de hand van samen beslissen indien er naast borstvoeding moet worden bijgevoed. De verschillende opties zijn: kortstondig koemelk bijgeven, kortstondig intensief hydrolysaat of aminozuurvoeding bijgeven, of koemelk, als die eenmaal is gegeven, regelmatig blijven bijgeven.
Subgroepen kunnen op basis van de huidige literatuur niet onderscheiden worden, hoewel op basis van expert opinie wel het idee heerst dat met name de kinderen met een verhoogd risico op allergie (eerstegraads familielid met een allergie) er meer baat bij zullen hebben als er een duidelijke uitspraak gedaan kan worden over het wel of niet geven van koemelk bevattende bijvoeding.
Kosten (middelenbeslag)
Intensieve hydrolysaten en aminozuurvoedingen zijn duurder in vergelijking met koemelk bevattende bijvoeding. Deze vormen van bijvoeding leiden tot hogere kosten die door de patiënt zelf gedragen moeten worden. Dit zou kunnen leiden tot problemen in de lagere sociaaleconomische klassen. Een goede kosteneffectiviteitsanalyse waarbij de kosten van de verschillende soorten bijvoeding tegenover de kosten van een allergie worden gezet, kan pas worden gemaakt als de optimale timing, de duur en de hoeveelheid van blootstelling duidelijk is.
Aanvaardbaarheid, haalbaarheid en implementatie
Qua zorgproces is het haalbaar om wel of geen koemelk bevattende bijvoeding te introduceren. Dit sluit reeds aan bij de huidige praktijk. Doorvoeren van een advies met betrekking tot de juiste keuze voeding is goed implementeerbaar met goede voorlichting en kan worden opgenomen in richtlijnen.
Rationale van de aanbeveling
Voor ouders die geen bezwaar hebben tegen combineren van borstvoeding/moedermelk en kunstvoeding is er onvoldoende wetenschappelijk bewijs om het bijvoeden met koemelkbevattende voeding in de eerste levensweken af te raden. Voor ouders die ervoor kiezen om bijvoeding met kunstvoeding te willen beperken, is goede voorlichting en begeleiding nodig zodat zij hun eigen doel kunnen halen.
Onderbouwing
Achtergrond
Breastfeeding offers numerous benefits for both infants and mothers (Halken, 2020). However, there are situations where supplemental nutrition is necessary for newborns, especially during the first week when breast milk production has not yet fully commenced or when the newborn loses more than 10% of their body weight. During this time, the mother can pump breast milk to stimulate and establish milk production.
Despite the controversies surrounding this approach – especially as breastfeeding-promoting organizations discourage supplemental feeding due to the risk of breastfeeding discontinuation – supplementing with cow’s milk formula (CMF) is common practice. In fact, 33% of breastfed infants receive CMF supplementation during the first week of life (Bouwmeester, 2024). However, the potential risks and benefits of this practice are not fully understood:
- Potential Benefits: Early exposure to cow’s milk through the digestive system may help prevent the development of a cow’s milk allergy (CMA). For many food allergies, including those to peanuts and hen's egg proteins, the theory suggests that allergies can develop through sensitization via a non-gastrointestinal route, such as the skin. For this reason, eczema is considered a risk factor for the development of CMA. Current recommendations advise introducing allergenic foods into an infant's diet before they are exposed to these allergens through other routes. This approach has been proven effective for preventing hen’s egg and peanut allergies and may also apply to other highly allergenic foods.
- Potential Risks: One possible risk is that the supplemental nutrition might be discontinued once the child is sufficiently nourished by breast milk alone. Temporary supplementation with CMF during the first week after birth, without continued use, could potentially increase the risk of developing CMA, although the mechanism is not understood of this hypothesis
If supplemental CMF proves beneficial, questions arise regarding dosage and duration: What dosage would be adequate? When should supplemental cow’s milk formula be started, and how long should it be continued?
Therefore, this module investigates whether supplementing with formula alongside breastfeeding increases the risk of developing CMA and addresses related dosage and duration issues.
Conclusies / Summary of Findings
1. IgE-mediated CMA development
Low-risk population
|
Very low GRADE |
The evidence is very uncertain about the effect of early exposure to cow’s milk on IgE-mediated CMA development when compared with no exposure in low-risk infants.
Source: Juvonen, 1996; Saarinen, 1999; Sakihara, 2021. |
High-risk population
|
Very low GRADE |
The evidence is very uncertain about the effect of early exposure to cow’s milk on IgE-mediated CMA development when compared with no exposure in high-risk infants.
Source: Hill, 2000; Urashima, 2019. |
Samenvatting literatuur
Description of studies
Osborn (2018) performed a systematic review and meta-analysis to investigate the effects on allergic disease when infants are fed a hydrolyzed formula compared to human breast milk or cow’s milk formula (CMF). The electronic databases Cochrane Central Register of Controlled Trials, Medline and Embase were searched with relevant search terms up to 3 November 2017. (Quasi-)RCTs with ≥80% follow-up that investigated the use of a hydrolyzed formula compared to human milk or CMF in infants (in the first six months of life) on the development of allergic disease were included. Studies were excluded if infants had clinical evidence of allergic disease in the first six months of life or if another allergy prevention intervention (e.g. maternal dietary avoidance) was examined. Eventually, a total of sixteen studies were included, of which three studies are conform the PICO and therefore described and analyzed in this literature analysis (Hill, 2000; Juvonen, 1996; Saarinen, 1999). Characteristics of the individual studies are shown in Table 1.
Sakihara (2021) conducted a RCT to determine whether the early introduction of CMF could serve as an effective strategy in the primary prevention of cow’s milk allergy (CMA) in a general population. In total, 492 newborns were included in this study. Inclusion criteria were 1) gestational age ≥35 weeks, 2) birth weight ≥2000 grams. Participants were excluded if they had complications of any severe underlying disease. A screening oral food challenge (OFC) was performed on all participants at one month of age. Participants with a negative result were randomly assigned to either the CMF ingestion group or the elimination group. Infants in the ingestion group received at least 10 mL of CMF daily between one and three months of age. Participants in the elimination group were assigned to avoid CMF between one and three months of age. When required, breastfeeding could be supplemented with soy-based formula.
Urashima (2019) performed a RCT to determine whether avoidance of CMF supplementation at birth can decrease risks of sensitization to cow’s milk protein and/or cow’s milk allergy. A total of 312 infants at risk for atopy were included in this trial. Exclusion criteria consisted of 1) parents who intended exclusive breastfeeding or exclusive CMF before birth, 2) gestational age < 36 weeks, 3) birth weight < 2000 grams, and 4) serious congenital anomalies. Participants were randomly assigned to either the intervention group (BF/CMF) or control group (BF/EF). Participants in the BF/CMF group received breastfeeding and supplemental CMF from the first day of life to five months of age. Participants in the BF/EF group received breastfeeding with or without amino acid-based elemental formula (EF) for at least the first three days of life.
Additional study characteristics are presented in Table 1.
Table 1. Characteristics of included studies.
|
Study |
Design |
Population |
Intervention |
Comparison |
Follow-up |
||
|
Characteristics |
Type |
Characteristics |
Type |
||||
|
Osborn, 2018 |
|||||||
|
- Hill, 2000 Australia |
RCT |
High risk infants (first-degree relative with a history of eczema, asthma, allergic rhinitis or food allergy) |
n = 206 No other baseline characteristics reported*. |
CMF (NAN; Nestle). Additionally, mothers were encouraged to initiate and maintain breastfeeding for at least six months. |
n = 206 No other baseline characteristics reported*.
|
Partially hydrolyzed whey formula (NAN HA; Nestle). Additionally, mothers were encouraged to initiate and maintain breastfeeding for at least six months. |
7 years |
|
- Juvonen, 1996 Sweden |
Quasi-RCT |
Low risk infants |
n = 39 No other baseline characteristics reported*. |
CMF (Baby Semp) for three days. Subsequently, all infants exclusively breastfed. |
n = 38 No other baseline characteristics reported*. |
Extensively hydrolyzed casein formula (Nutramigen) for three days. Subsequently, all infants exclusively breast fed. |
3 years |
|
- Saarinen, 1999 Finland |
Quasi-RCT |
Low risk infants |
n = 1758 No other baseline characteristics reported*. |
Early supplemental feeding in hospital with CMF (Tutteli, Valio). Mothers were encouraged to breast feed. |
n = 1715 No other baseline characteristics reported*. |
Early supplemental feeding in hospital with extensively hydrolyzed whey formula (Pepti-Junior, Nutricia). Mothers were encouraged to breast feed. |
Mean age follow-up 27 months (range: 18-34 months) |
|
Sakihara, 2021 Japan |
RCT |
Low risk infants |
n = 243 Mean age at enrollment (SD): NR Female (%): 47.7% Median birth weight (IQR): 3026 (2805-3276) grams Median GA (IQR): 39 (38-40) weeks
|
Ingestion group: ingestion of at least 10 mL of CMF daily between one and two months of age, additionally to breastfeeding. |
n = 249 Mean age at enrollment (SD): NR Female (%): 43.0% Median birth weight (IQR): 2995 (2795-3185) grams Median GA (IQR): 39 (38-40) weeks |
Elimination group: avoidance of CMF between one and two months of age. Breastfeeding was supplemented with soy-based formula if needed. |
Age 6 months |
|
Urashima, 2019 Japan |
RCT |
High risk infants (first-degree relative with (a history of) atopic disease) |
n = 156 Mean age at enrollment (SD): NR Female (%): 50.0% Mean birth weight (SD): 2994 (314) grams Median GA (IQR): 39 (38-39) weeks |
BF/CMF group: breastfeeding and supplemental CMF (≥5 mL/day) from the first day of life to five months of age. |
n = 156 Mean age at enrollment (SD): NR Female (%): 52.6% Mean birth weight (SD): 2994 (313) grams Median GA (IQR): 39 (38-39) weeks |
BF/EF group: avoiding supplementation with CMF for at least the first three days of life (i.e., breastfeeding with or without amino acid-based elemental formula (EF)). |
Age 24 months |
|
Abbreviations: BF = breastfeeding; CMF = cow’s milk formula; EF = elemental formula; GA = gestational age; IQR = interquartile range; NR = not reported; RCT = randomized controlled trial; SD = standard deviation. * By Osborn, 2018. |
|||||||
Results
1. IgE-mediated CMA development
All studies reported on IgE-mediated CMA development. Sakihara (2021) defined the outcome measure as CMA confirmed by the second oral food challenge (OFC) at six months of age. Juvonen (1996) did not report criteria for CMA diagnosis. Saarinen (1999) reported on the outcome measure, and used unblinded elimination/challenge to confirm the CMA diagnosis. Urashima (2019) reported on CMA confirmed by an OFC test or by food ingestion in daily life that appeared within minutes to a few hours in combination with serum levels of CM-IgE of ≥ 0.35 UA/mL. Hill (2000) also reported on CMA confirmed by an OFC test.
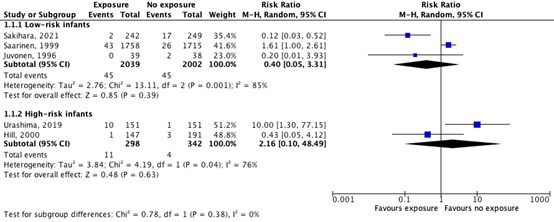
Figure 1 shows IgE-mediated CMA development in 2.2% (45/2039) of low-risk infants who were exposed to cow’s milk and in 2.2% (45/2002) of low-risk infants who were not exposed to cow’s milk. The risk ratio is 0.40 (95%CI 0.05 to 3.31) in favor of exposure. This difference is considered clinically relevant.
For the high-risk infants, IgE-mediated CMA development was reported in 3.7% (11/298) of infants in the CMF exposure group and in 1.2% (4/342) of infants in the unexposed group. The risk ratio is 2.16 (95%CI 0.10 to 48.49) in favor of no exposure. This difference is considered clinically relevant.
Figure 1: The effect of exposure to cow’s milk compared to no exposure on IgE-mediated CMA development.
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: confidence interval.
Level of evidence of the literature
1. IgE-mediated CMA development
Low-risk population
The level of evidence regarding the outcome measure IgE-mediated CMA development in a low-risk population was downgraded by three levels to very low because of issues with randomization, blinding of participants and nonadherence to protocol and missing information about exposure to cow’s milk in the period prior to randomization in one study (Sakihara, 2021) (risk of bias: -1), and confidence interval overlap with both thresholds of clinical decision-making (imprecision: -2).
High-risk population
The level of evidence regarding the outcome measure IgE-mediated CMA development in a high-risk population was downgraded by three levels to very low because of issues with blinding of participants (risk of bias: -1), and confidence interval overlap with both thresholds of clinical decision-making (imprecision: -2).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the favorable and unfavorable effects of exposure to cow’s milk-containing (complementary) foods in the first year of life in breastfed infants on the development of an IgE-mediated cow’s milk allergy (CMA)?
Patients: Breastfed infants under the age of 1 year
Intervention: Exposure to cow’s milk-containing (complementary) foods
Comparison: No exposure to cow’s milk-containing (complementary) foods (exclusive breastfeeding)
Outcomes: IgE-mediated CMA development
Relevant outcome measures
The guideline development group considered IgE-mediated CMA development as a critical outcome measure for decision making.
The working group defined the outcome measures as follows: IgE-mediated CMA development had to be confirmed by an oral food challenge, not only by skin prick testing (SPT).
The working group defined 25% (0.8 ≤ RR ≥ 1.25) as a minimal clinically (patient) important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2005 until 6 September 2023. The detailed search strategy is available upon request. The systematic literature search resulted in 480 hits. Studies were selected based on the following criteria:
- Systematic reviews (searched in at least two databases, detailed search strategy, risk of bias assessment, and results of individual studies available), randomized controlled trials or other comparative studies (case control or cohort studies);
- Full-text English language publication;
- Studies according to the PICO.
29 studies were initially selected based on title and abstract screening. After reading the full text, 26 studies were excluded (see the table with reasons for exclusion under the tab Methods), and three studies were included.
Results
Three studies, including one systematic review and two RCTs, were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Bouwmeester M, Staal I. Rapport peiling melkvoeding. Nederlands Centrum Jeugdgezondheid (NCJ). 2024. NCJ Onderzoeksrapport Peiling Melkvoeding 2024.pdf (voedingscentrum.nl)
- de Jong MH, Scharp-Van Der Linden VT, Aalberse R, Heymans HS, Brunekreef B. The effect of brief neonatal exposure to cows' milk on atopic symptoms up to age 5. Arch Dis Child. 2002 May;86(5):365-9. doi: 10.1136/adc.86.5.365. PMID: 11970933; PMCID: PMC1751102.
- de Jong MH, Scharp-van der Linden VT, Aalberse RC, Oosting J, Tijssen JG, de Groot CJ. Randomised controlled trial of brief neonatal exposure to cows' milk on the development of atopy. Arch Dis Child. 1998 Aug;79(2):126-30. doi: 10.1136/adc.79.2.126. PMID: 9797592; PMCID: PMC1717657.
- Halken S, Muraro A, de Silva D, Khaleva E, Angier E, Arasi S, Arshad H, Bahnson HT, Beyer K, Boyle R, du Toit G, Ebisawa M, Eigenmann P, Grimshaw K, Hoest A, Jones C, Lack G, Nadeau K, O'Mahony L, Szajewska H, Venter C, Verhasselt V, Wong GWK, Roberts G; European Academy of Allergy and Clinical Immunology Food Allergy and Anaphylaxis Guidelines Group. EAACI guideline: Preventing the development of food allergy in infants and young children (2020 update). Pediatr Allergy Immunol. 2021 Jul;32(5):843-858. doi: 10.1111/pai.13496. Epub 2021 Mar 29. PMID: 33710678.
- Høst A, Husby S, Osterballe O. A prospective study of cow's milk allergy in exclusively breast-fed infants. Incidence, pathogenetic role of early inadvertent exposure to cow's milk formula, and characterization of bovine milk protein in human milk. Acta Paediatr Scand. 1988 Sep;77(5):663-70. doi: 10.1111/j.1651-2227.1988.tb10727.x. PMID: 3201972.
- Osborn DA, Sinn JK, Jones LJ. Infant formulas containing hydrolysed protein for prevention of allergic disease. Cochrane Database Syst Rev. 2018 Oct 19;10(10):CD003664. doi: 10.1002/14651858.CD003664.pub6. PMID: 30338526; PMCID: PMC6517017.
- Perkin MR, Logan K, Tseng A, Raji B, Ayis S, Peacock J, Brough H, Marrs T, Radulovic S, Craven J, Flohr C, Lack G; EAT Study Team. Randomized Trial of Introduction of Allergenic Foods in Breast-Fed Infants. N Engl J Med. 2016 May 5;374(18):1733-43. doi: 10.1056/NEJMoa1514210. Epub 2016 Mar 4. PMID: 26943128.
- Sakihara T, Otsuji K, Arakaki Y, Hamada K, Sugiura S, Ito K. Early Discontinuation of Cow's Milk Protein Ingestion Is Associated with the Development of Cow's Milk Allergy. J Allergy Clin Immunol Pract. 2022 Jan;10(1):172-179. doi: 10.1016/j.jaip.2021.07.053. Epub 2021 Aug 14. PMID: 34403836.
- Sakihara T, Otsuji K, Arakaki Y, Hamada K, Sugiura S, Ito K. Randomized trial of early infant formula introduction to prevent cow's milk allergy. J Allergy Clin Immunol. 2021 Jan;147(1):224-232.e8. doi: 10.1016/j.jaci.2020.08.021. Epub 2020 Sep 2. PMID: 32890574.
- Schoemaker AA, Sprikkelman AB, Grimshaw KE, Roberts G, Grabenhenrich L, Rosenfeld L, Siegert S, Dubakiene R, Rudzeviciene O, Reche M, Fiandor A, Papadopoulos NG, Malamitsi-Puchner A, Fiocchi A, Dahdah L, Sigurdardottir ST, Clausen M, Stańczyk-Przyłuska A, Zeman K, Mills EN, McBride D, Keil T, Beyer K. Incidence and natural history of challenge-proven cow's milk allergy in European children--EuroPrevall birth cohort. Allergy. 2015 Aug;70(8):963-72. doi: 10.1111/all.12630. Epub 2015 May 18. PMID: 25864712.
- Urashima M, Mezawa H, Okuyama M, Urashima T, Hirano D, Gocho N, Tachimoto H. Primary Prevention of Cow's Milk Sensitization and Food Allergy by Avoiding Supplementation With Cow's Milk Formula at Birth: A Randomized Clinical Trial. JAMA Pediatr. 2019 Dec 1;173(12):1137-1145. doi: 10.1001/jamapediatrics.2019.3544. PMID: 31633778; PMCID: PMC6806425.
Evidence tabellen
Table S1. Detailed description of the included studies.
|
Study |
Design |
Inclusion and exclusion criteria |
Intervention |
Comparison |
Timing and duration of exposure |
Persistent or intermittent exposure |
Definition outcome CMA + time points of evaluation |
Follow-up |
Comments |
|
Hill, 2000
(NB: data are retrieved from Osborn, 2018; Lowe, 2011) Australia |
RCT n = 620 |
Inclusion: High risk infants: first-degree relative with a history of eczema, asthma, allergic rhinitis or food allergy.
Exclusion: NR |
pHWF (NAN HA; Nestle) n = 206
|
Control CMF (NAN; Nestle) n= 206 |
Study formulas were introduced at (partial) cessation of breast feeding or as a breast milk substitute.
Duration of exposure not reported |
Approximately 50% of infants received some allocated formula by four months of age; 16.5% only breast feeding (13.6%) or use of a non-allocated formula (2.9%). |
Telephone: Food reaction: < 2 hours of ingesting that food: acute skin rash (urticaria, angioedema, erythematous or morbilliform), a flare of pre-existing eczema, signs of anaphylaxis or vomiting.
Any allergic manifestation: presence of eczema or food reaction within first 2 years of life. |
2 years of age. |
Data retrieved from Osborn (2018) and Lowe (2011). |
|
Juvonen, 1996 Sweden |
RCT n = 129
|
Inclusion: Low risk infants: healthy term infants.
Exclusion: NR |
Human milk n = 53
Casein hydrolysate formula n = 37 |
CMF n = 39 |
First three days of life. After the third day all infants were exclusively breastfed. |
Intermittent. |
Visit + total serum IgE: d4/4m/8m/12m/24m
SPT at one and two years of age. |
3 years. |
Small group. Only one child had IgE mediated cow’s milk allergy.
Conclusion: No difference. No power (due to small sample size). |
|
Saarinen, 1999 Finland |
RCT n = 5385
|
Inclusion: Low risk infants: healthy term infants.
Exclusion: NR |
Cow’s milk n = 1758
Human milk n = 1844 Whey hydrolysate (Pepti, supplementary milk) n = 1715
|
Exclusively breast fed infants n = 824 |
Timing: During admission.
Duration: first days of life |
Supplementary to breast feeding. Volume was variable. |
Reaction during (open) challenge test at hospital. |
8 weeks. |
Exposure to CM while in the hospital increased the risk.
However, no data available on the correlation with exposure to CM after admission. |
|
Sakihara, 2021 Japan (SPADE study) |
RCT n = 492 |
Inclusion: Low risk infants: healthy term infants (>35 weeks gestational age; birth weight >2000 grams).
Exclusion: Complications of any severe underlying disease. |
Ingestion group n = 243
Ingestion of at least 10 mL of CMF daily between one and three months of age, additionally to breastfeeding. At least 20 days per months with a max. Interruption of 1 week.
|
Elimination group n = 249
Avoidance of CMF (<10 ml per day) between one and three months of age. Breastfeeding was supplemented with soy-based formula if needed. |
Timing: One to three months of age.
Duration: Two months (but in fact it was longer, see comment).
|
Ingestion group: persistent (one week interruption was allowed).
Because of the intake of cow’s milk in the first month in both groups, the comparison group had become a group with intermitted cow’s milk intake. Volume: >10 ml/day for at least 20 days/month, with a maximum of one week interruption. |
IgE mediated CMA: Three months: SPT and OFC Six months: OFC
Primary outcome: positive OFC at six months. Secondary outcome: sensitization at six months.
|
Age 6 months. |
Baseline characteristics are similar between the two groups. However, although the intake of CM was higher in the ingestion group between 3-5 months, infants in the elimination group also received CM (>10 ml).
Unclear if the children that received >10 ml of CM between 3-5 months in the elimination group were excluded in the per-protocol analyses.
Not clear if there was any CM exposure during the first month of life
|
|
Urashima, 2019 Japan |
RCT n = 312
|
Inclusion: High risk infants: first-degree relative with (a history of) atopic disease.
Exclusion: <36 weeks gestational age. Birth weight < 2000 grams. Serious congenital anomalies. |
BF/CMF group: n = 156
Breastfeeding and supplemental CMF (>5 ml/day) from the first day of life (and <40 mL/day from 1 months old), to five months of age. |
BF/EF group: n = 156
Breastfeeding with or without amino acid-based elemental formula (EF) to five months of age. If infants received > 150 ml AA-EF for 3 consecutive days they were switched to cow’s milk (so only the first three days of life were always without exposure to cow’s milk). |
Timing: From the first day of life.
Duration: Five months. |
Persistent.
Volume: Day 0 at least 5 ml/day. From one month: at least 40 ml/day. |
Primary outcome: sensitization at age 24 months
|
Age of 24 months. |
A lot of children from the BF/EF group were switched to CM because they received >150 ml AA-EF for 3 consecutive days. Therefore, conclusions can only be drawn for the first three days of life.
A post-hoc analysis was performed in which infants were divided into three groups: 1) no exposure to CM until 5 months of age, 2) switched to CM after >15 days, 3) switched to CM after <14 days.
At the age of 5 months, no difference was found between these groups. However, at the age of 2 years a trend towards higher sIgE was found in case of early CM exposure. The risk of developing CMA was not found to be higher. |
|
Perkin, 2016 United Kingdom (EAT study)
|
RCT n = 1303
Recruited from the general population in England and Wales |
Inclusion: Infants who were exclusively breastfed* for three months who were OFC negative.
* Little exposure in the first few days: 2% in the standard-introduction group ever had cow’s milk formula by 4 months and 7% by 5 months.
Exclusion: OFC positive
Note: in the control group no SPT or OFC was conducted, therefore patients were not excluded based on these factors. |
Early introduction group: n = 652
Infants were immediately introduced to allergenic foods, starting with cow’s milk (as yogurt).
|
Standard introduction group: n = 651
Exclusive breastfeeding to 6 months of age before introduction of allergenic foods. |
Timing: Starting at the age of three months.
Duration: Three months (until the age of six months). |
Twice weekly.
Volume: In general: 2 g of the allergen protein. However, for cow’s milk, the early-introduction group recommended dose of cow’s milk protein was 4g per week. (two small 40-60g portions of cow’s milk yogurt). |
The primary outcome was challenge-proven food allergy to one or more of the six early-introduction foods between 1 year and 3 years of age.
Outcome for cow’s milk of intervention vs comparison: (all outcomes were nonsignificant). |
Age 1-3 years. |
Adherence in the intervention group was low: 42.2% of those in whom adherence could be determined, or 34.2% of the enrolled early-introduction group. However, for milk the adherence seemed better (interpretation of the working group) since the n for per protocol is 940 (vs 1166 in ITT). * For pragmatic reasons the authors allowed standard-introduction group participants to remain in the per-protocol analysis if they had consumed up to 300ml of cow’s milk formula per day at any point between 3 and 6 months of age.
General conclusion by working group: Population was really breast fed. The consumption of CMF was low in the standard group until 6 months. Introduction between 3-6 months seems safe in infants who did not have CM until then (general population). |
Evidence table systematic review
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Osborn, 2018
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to 3 November 2017
A: Hill, 2000 B: Juvonen, 1996 C: Saarinen, 1999
Study design: A: RCT B: quasi-RCT C: quasi-RCT
Setting and Country: A: Australia B: Sweden C: Finland
Source of funding and conflicts of interest: A: supported by Nestec Ltd, a subsidiary of Nestle Australia B: supported by several foundations C: supported by Nutricia |
Inclusion criteria SR: - (quasi-)RCTs with ≥80% follow-up that compared the use of a hydrolysed formula versus human milk or cow’s milk formula in infants in the first six months of life without clinical evidence of allergic disease on allergic disease. - Studies had to report one of the following outcomes: all allergic diseases, asthma, atopic dermatitis, eczema, allergic rhinitis, cow’s milk or soy protein allergy, food allergy, urticaria, anaphylaxis.
Exclusion criteria SR: - Other allergy prevention interventions
16 studies included of which three are conform the PICO of the current literature analysis.
Important patient characteristics at baseline: N A: I: 206 | C: 206 | C: 208 B: I: 39| C: 53 | C: 38 C: I: 1758 | C: 1844 | C: 1715
Groups comparable at baseline? Yes |
Describe intervention: A: Cow’s milk formula
B: Cow’s milk formula
C: Cow’s milk formula
|
Describe control: A: C1: Partially hydrolysed whey formula (pHWF) C2: Soy-based formula
B: C1: Pasteurised human milk from milk bank C2: Casein extensively hydrolysed formula (EHF)
C: C1: Pasteurised donor human milk C2: Extensively hydrolysed whey formula (eHWF) |
End-point of follow-up: A: 7 years B: 3 years C: Mean age follow-up 27 months (range 18 to 34 months)
For how many participants were no complete outcome data available? A: 7.3% at two years and 20% at six to seven years B: 10% at three years C: unclear, although all infants were reported to be seen routinely in well-baby clinics
|
Development of CMA Early short-term feeding: hydrolysed formula versus CMF – low risk infants Effect measure: RR [95%CI] B: 5.13 (0.25 to 103.43) C: 0.62 (0.38 to 1.00)
Prolonged feeding: (partially) hydrolysed formula versus CMF – (high risk infants) Effect measure: RR [95%CI] A: 2.31 (0.24 to 21.97)
|
Risk of bias (high, some concerns or low): Tool used by authors: Cochrane Risk of Bias Tool
A: Some concernsb B: Higha,b,c C: Higha,d a Quasi-randomized b No reporting of blinded measurements c Imbalances between groups after randomisation d Insufficient details of baseline characteristics |
Evidence table RCTs
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Sakihara, 2021 |
Type of study: RCT
Setting and country: Multicenter, 4 hospitals in Okinawa, Japan.
Funding and conflicts of interest: This research did not receive any specific grant from funding agencies in the public, commercial, or not-for-profit sectors. The authors declare no relevant conflicts of interest. |
Inclusion criteria: - Gestational age ≥35 weeks - Birth weight ≥2000g
Exclusion criteria: - Complications or severe underlying disease
N total at baseline: Intervention: 243 Control: 249
Important prognostic factors2: Sex: I: 52.3 % M | C: 57.0 % M
Groups comparable at baseline? Yes |
Ingestion of at least 10 mL of cow’s milk formula daily between 1 and 2 months of age (in addition to breastfeeding). |
Describe control (treatment/procedure/test): Avoidance of CMF between 1 and 2 months of age. Breastfeeding was supplemented with soy formula if needed. |
Length of follow-up: 6 months
Loss-to-follow-up: A total of 93.9% of the participants attended their scheduled visit at 6 months
Incomplete outcome data: Intervention: 23 (10.1%) Reasons: nonadherence to the regimens
Control: 40 (17.0%) Reasons: nonadherence to the regimens |
Development of CMA ITT analysis I: 2/242 (0.8%) C: 17/249 (6.8%)
Per protocol analysis I: 0/204 C: 17/195 (8.7%) |
Authors’ conclusion: Daily ingestion of CMF between 1 and 2 months of age prevents CMA development. |
|
Urashima, 2019 |
Type of study: RCT
Setting and country: Single center, hospital in Tokyo, Japan
Funding and conflicts of interest: This research was supported by grants from the Ministry of Education, Culture, Sports, Science, and Technology. Potential conflicts of interest are declared.
|
Inclusion criteria: - Infant at risk for atopy with at least one parent or siblings having current/past atopic diseases
Exclusion criteria: - Parents who intended exclusive breastfeeding or exclusive cow’s milk formula before birth - <36 weeks gestational age - Birth weight < 2000 g - Serious congenital anomalies
N total at baseline: Intervention: 156. | Control: 156
Important prognostic factors2: Sex: I: 50.0 % M | C: 47.4 % M
Groups comparable at baseline? Yes |
Supplement breastfeeding with at least 5 mL CMF from the first day or within the first 24 hours after delivery and with at least 40mL/d after 1month |
Describe control (treatment/procedure/test): Breastfeeding possibly supplemented with amino acid-based elemental formula |
Length of follow-up: 24 months
Loss-to-follow-up: Intervention: 5 (3.2%) Reasons not reported
Control: 5 (3.2%) Reasons not reported
Incomplete outcome data: Not reported, except loss to follow-up as mentioned above.
|
Development of CMA I: 46/143 C: 24/143
|
This study found that not only sensitization to cow’s milk but also clinical food allergies are primarily preventable by avoiding CMF supplementation at birth. |
Risk of bias table RCTs
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Sakihara, 2021 |
Definitely yes
Reason: Block randomization method by a computer-generated random number table |
Definitely no
Reason: The study did not use allocation concealment |
Definitely no
Reason: Allocation was orally communicated to the treating physicians and the participants’ parents |
Definitely yes
Reason: Loss to follow-up was <10% |
Definitely yes
Reason: Trial is registered. Outcomes are reported as prespecified in the protocol. |
Definitely no
Reason: Missing information about exposure to cow’s milk in the month prior to randomization. |
HIGH |
|
Urashima, 2019 |
Definitely yes
Reason: Computer-generated randomization using permuted blocks of 4 |
Definitely yes
Reason: Central allocation |
Definitely no
Reason: Participants were not blinded. Blind outcome assessment was performed. |
Definitely yes
Reason: Loss to follow-up was <10% |
Definitely yes
Reason: Trial is registered. Outcomes are reported as prespecified in the protocol. |
Definitely yes
Reason: None reported. |
HIGH |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Yuan M, Tan M, Moore D, Shen S, Qiu X, Thomas GN, Cheng K. Timing of Cow's Milk or Cow's Milk Formula Introduction to the Infant Diet and Atopic Risk in Children: a Systematic Review and Meta-analysis. Clin Rev Allergy Immunol. 2020 Aug;59(1):46-60. doi: 10.1007/s12016-019-08770-9. PMID: 31768874. |
Wrong intervention (about the effects of timing of CM or CMF introduction to the infant diet), wrong comparison (no comparison without exposure to CM) |
|
Osborn DA, Sinn J. Formulas containing hydrolysed protein for prevention of allergy and food intolerance in infants. Cochrane Database Syst Rev. 2006 Oct 18;(4):CD003664. doi: 10.1002/14651858.CD003664.pub3. Update in: Cochrane Database Syst Rev. 2017 Mar 15;3:CD003664. PMID: 17054180. |
Update available and included (Osborn, 2018) |
|
Osborn DA, Sinn JK, Jones LJ. WITHDRAWN: Infant formulas containing hydrolysed protein for prevention of allergic disease and food allergy. Cochrane Database Syst Rev. 2017 May 25;5(5):CD003664. doi: 10.1002/14651858.CD003664.pub5. Update in: Cochrane Database Syst Rev. 2018 Oct 19;10:CD003664. PMID: 28542713; PMCID: PMC6481394. |
Update available and included (Osborn, 2018) |
|
Boyle RJ, Ierodiakonou D, Khan T, Chivinge J, Robinson Z, Geoghegan N et al. Hydrolysed formula and risk of allergic or autoimmune disease: systematic review and meta- analysis BMJ 2016; 352 :i974 doi:10.1136/bmj.i974 |
Less recent and complete compared to Osborn (2018), includes observational studies |
|
de Silva D, Halken S, Singh C, Muraro A, Angier E, Arasi S, Arshad H, Beyer K, Boyle R, du Toit G, Eigenmann P, Grimshaw K, Hoest A, Jones C, Khaleva E, Lack G, Szajewska H, Venter C, Verhasselt V, Roberts G; European Academy of Allergy, Clinical Immunology Food Allergy, Anaphylaxis Guidelines Group. Preventing food allergy in infancy and childhood: Systematic review of randomised controlled trials. Pediatr Allergy Immunol. 2020 Oct;31(7):813-826. doi: 10.1111/pai.13273. Epub 2020 Jun 18. PMID: 32396244. |
Includes only a few suitable studies according to our PICO which are found in the literature search as well |
|
Obbagy JE, English LK, Psota TL, Nadaud P, Johns K, Wong YP, Terry N, Butte NF, Dewey KG, Fleischer DM, Fox MK, Greer FR, Krebs NF, Scanlon KS, Casavale KO, Spahn JM, Stoody E. Types and Amounts of Complementary Foods and Beverages and Food Allergy, Atopic Dermatitis/Eczema, Asthma, and Allergic Rhinitis: A Systematic Review [Internet]. Alexandria (VA): USDA Nutrition Evidence Systematic Review; 2019 Apr. PMID: 35816599. |
Includes only one suitable study according to our PICO which is found in the literature search as well |
|
Sakihara T, Otsuji K, Arakaki Y, Hamada K, Sugiura S, Ito K. Early Discontinuation of Cow's Milk Protein Ingestion Is Associated with the Development of Cow's Milk Allergy. J Allergy Clin Immunol Pract. 2022 Jan;10(1):172-179. doi: 10.1016/j.jaip.2021.07.053. Epub 2021 Aug 14. PMID: 34403836. |
About timing of (dis)continuation of cow’s milk protein ingestion |
|
Perkin MR, Logan K, Marrs T, Radulovic S, Craven J, Flohr C, Lack G; EAT Study Team. Enquiring About Tolerance (EAT) study: Feasibility of an early allergenic food introduction regimen. J Allergy Clin Immunol. 2016 May;137(5):1477-1486.e8. doi: 10.1016/j.jaci.2015.12.1322. Epub 2016 Feb 17. PMID: 26896232; PMCID: PMC4852987. |
Wrong outcome (primary outcome (= prevalence of IgE-mediated food allergy) of the EAT study is presented in Perkin, 2016 which is included in the literature analysis) |
|
Boutsikou T, Sekkidou M, Karaglani E, Krepi A, Moschonis G, Nicolaou N, Iacovidou N, Pancheva R, Marinova-Achkar M, Popova S, Kapetanaki A, Iliodromiti Z, Papaevangelou V, Sardeli O, Papathoma E, Schaafsma A, Bos R, Manios Y, Xepapadaki P. The Impact of Infant Feeding Regimen on Cow's Milk Protein Allergy, Atopic Dermatitis and Growth in High-Risk Infants during the First 6 Months of Life: The Allergy Reduction Trial. Nutrients. 2023 Jun 3;15(11):2622. doi: 10.3390/nu15112622. PMID: 37299585; PMCID: PMC10255921. |
Not specifically about IgE-mediated CMA |
|
Lowe AJ, Hosking CS, Bennett CM, Allen KJ, Axelrad C, Carlin JB, Abramson MJ, Dharmage SC, Hill DJ. Effect of a partially hydrolyzed whey infant formula at weaning on risk of allergic disease in high-risk children: a randomized controlled trial. J Allergy Clin Immunol. 2011 Aug;128(2):360-365.e4. doi: 10.1016/j.jaci.2010.05.006. Epub 2011 Jun 22. PMID: 21696814. |
Not specifically about IgE-mediated CMA |
|
Tachimoto H, Imanari E, Mezawa H, Okuyama M, Urashima T, Hirano D, Gocho N, Urashima M. Effect of Avoiding Cow's Milk Formula at Birth on Prevention of Asthma or Recurrent Wheeze Among Young Children: Extended Follow-up From the ABC Randomized Clinical Trial. JAMA Netw Open. 2020 Oct 1;3(10):e2018534. doi: 10.1001/jamanetworkopen.2020.18534. PMID: 33006618; PMCID: PMC7532386. |
Wrong outcome |
|
Lachover-Roth I, Cohen-Engler A, Furman Y, Rosman Y, Meir-Shafrir K, Mozer-Mandel M, Farladansky-Gershnabel S, Biron-Shental T, Confino-Cohen R. Food allergy and infant feeding practices: Are they related? Ann Allergy Asthma Immunol. 2023 Sep;131(3):369-375.e3. doi: 10.1016/j.anai.2023.05.031. Epub 2023 Jun 1. PMID: 37270027. |
Development of IgE-mediated CMA can be based solely on SPT |
|
Lachover-Roth I, Cohen-Engler A, Furman Y, Shachar I, Rosman Y, Meir-Shafrir K, Mozer-Mandel M, Farladansky-Gershnabel S, Biron-Shental T, Mandel M, Confino-Cohen R. Early, continuing exposure to cow's milk formula and cow's milk allergy: The COMEET study, a single center, prospective interventional study. Ann Allergy Asthma Immunol. 2023 Feb;130(2):233-239.e4. doi: 10.1016/j.anai.2022.10.013. Epub 2022 Oct 28. PMID: 36441058. |
About timing of exposure |
|
Sakihara T, Sugiura S, Ito K. The ingestion of cow's milk formula in the first 3 months of life prevents the development of cow's milk allergy. Asia Pac Allergy. 2016 Oct;6(4):207-212. doi: 10.5415/apallergy.2016.6.4.207. Epub 2016 Oct 31. PMID: 27803880; PMCID: PMC5088256. |
Wrong population (participants with hen’s egg allergy) |
|
Kelly E, DunnGalvin G, Murphy BP, O'B Hourihane J. Formula supplementation remains a risk for cow's milk allergy in breast-fed infants. Pediatr Allergy Immunol. 2019 Dec;30(8):810-816. doi: 10.1111/pai.13108. Epub 2019 Aug 29. PMID: 31297890. |
Prediction study/models |
|
Tezuka J, Sanefuji M, Ninomiya T, Kawahara T, Matsuzaki H, Sonoda Y, Ogawa M, Shimono M, Suga R, Honjo S, Kusuhara K, Ohga S; Japan Environment, Children’s Study (JECS) Group. Possible association between early formula and reduced risk of cow's milk allergy: The Japan Environment and Children's Study. Clin Exp Allergy. 2021 Jan;51(1):99-107. doi: 10.1111/cea.13761. Epub 2020 Oct 25. PMID: 33053241; PMCID: PMC7821216. |
Wrong outcome (not IgE-mediated), wrong comparison (no comparison without exposure) |
|
Peters RL, Koplin JJ, Dharmage SC, Tang MLK, McWilliam VL, Gurrin LC, Neeland MR, Lowe AJ, Ponsonby AL, Allen KJ. Early Exposure to Cow's Milk Protein Is Associated with a Reduced Risk of Cow's Milk Allergic Outcomes. J Allergy Clin Immunol Pract. 2019 Feb;7(2):462-470.e1. doi: 10.1016/j.jaip.2018.08.038. Epub 2018 Sep 26. PMID: 30267891. |
Development of IgE-mediated CMA is based solely on parent-reported reaction and SPT |
|
Liao SL, Lai SH, Yeh KW, Huang YL, Yao TC, Tsai MH, Hua MC, Huang JL; PATCH (The Prediction of Allergy in Taiwanese Children) Cohort Study. Exclusive breastfeeding is associated with reduced cow's milk sensitization in early childhood. Pediatr Allergy Immunol. 2014 Aug;25(5):456-61. doi: 10.1111/pai.12247. PMID: 25171739. |
Wrong outcome (sensitization) |
|
Ngamphaiboon J, Tansupapol C, Chatchatee P. The efficacy of partially hydrolyzed formulas for allergy prevention in children under five years. Asian Biomedicine. 2009 Jun;3(3):245-254. |
Wrong outcome (not IgE-mediated) |
|
Halken S, Muraro A, de Silva D, Khaleva E, Angier E, Arasi S, Arshad H, Bahnson HT, Beyer K, Boyle R, du Toit G, Ebisawa M, Eigenmann P, Grimshaw K, Hoest A, Jones C, Lack G, Nadeau K, O'Mahony L, Szajewska H, Venter C, Verhasselt V, Wong GWK, Roberts G; European Academy of Allergy and Clinical Immunology Food Allergy and Anaphylaxis Guidelines Group. EAACI guideline: Preventing the development of food allergy in infants and young children (2020 update). Pediatr Allergy Immunol. 2021 Jul;32(5):843-858. doi: 10.1111/pai.13496. Epub 2021 Mar 29. PMID: 33710678. |
Wrong publication type (guideline) |
|
Kopp MV, Muche-Borowski C, Abou-Dakn M, Ahrens B, Beyer K, Blümchen K, Bubel P, Chaker A, Cremer M, Ensenauer R, Gerstlauer M, Gieler U, Hübner IM, Horak F, Klimek L, Koletzko BV, Koletzko S, Lau S, Lob-Corzilius T, Nemat K, Peters EMJ, Pizzulli A, Reese I, Rolinck-Werninghaus C, Rouw E, Schaub B, Schmidt S, Steiß JO, Striegel AK, Szépfalusi Z, Schlembach D, Spindler T, Taube C, Trendelenburg V, Treudler R, Umpfenbach U, Vogelberg C, Wagenmann M, Weißenborn A, Werfel T, Worm M, Sitter H, Hamelmann E. S3 guideline Allergy Prevention. Allergol Select. 2022 Mar 4;6:61-97. doi: 10.5414/ALX02303E. PMID: 35274076; PMCID: PMC8905073. |
Wrong publication type (guideline) |
|
de Silva D, Geromi M, Halken S, Host A, Panesar SS, Muraro A, Werfel T, Hoffmann-Sommergruber K, Roberts G, Cardona V, Dubois AE, Poulsen LK, Van Ree R, Vlieg-Boerstra B, Agache I, Grimshaw K, O'Mahony L, Venter C, Arshad SH, Sheikh A; EAACI Food Allergy and Anaphylaxis Guidelines Group. Primary prevention of food allergy in children and adults: systematic review. Allergy. 2014 May;69(5):581-9. doi: 10.1111/all.12334. Epub 2014 Jan 16. PMID: 24433563. |
Results are narratively described |
|
Mohammed Abouda MKM, Berair R. Association between breastfeeding and prevalence of allergies among children in the Academy Teaching Charity Hospital, Sudan. Qatar Med J. 2023 Nov 26;2023(2):19. doi: 10.5339/qmj.2023.sqac.19. PMID: 38025318; PMCID: PMC10676693. |
Full-text not available |
|
Chafen JJ, Newberry SJ, Riedl MA, Bravata DM, Maglione M, Suttorp MJ, Sundaram V, Paige NM, Towfigh A, Hulley BJ, Shekelle PG. Diagnosing and managing common food allergies: a systematic review. JAMA. 2010 May 12;303(18):1848-56. doi: 10.1001/jama.2010.582. PMID: 20460624. |
Wrong publication type (systematic review of systematic reviews) |
|
Dai NN, Li XY, Wang S, Wang JJ, Gao YJ, Li ZL. [Timing of food introduction to the infant diet and risk of food allergy: a systematic review and Meta-analysis]. Zhonghua Er Ke Za Zhi. 2021 Jul 2;59(7):563-569. Chinese. doi: 10.3760/cma.j.cn112140-20201130-01064. PMID: 34405638. |
Article in Chinese |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 14-07-2025
Beoordeeld op geldigheid : 14-07-2025
Algemene gegevens
De herziening van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor kinderen met een IgE-gemedieerde koemelkallergie.
Werkgroep
- Mevr. dr. E.C. (Eva) Koffeman, kinderarts-allergoloog, namens de Nederlandse Vereniging voor Kindergeneeskunde (NVK) (voorzitter)
- Mevr. dr. L.J. (Lonneke) Landzaat, kinderarts-allergoloog, namens de NVK
- Mevr. dr. M.M.J. (Marjoke) Verweij, kinderarts, namens de NVK
- Mevr. drs. K. (Kelly) van de Vorst-van der Velde, kinderarts-allergoloog, namens de NVK
- Mevr. dr. L. (Lonneke) van Onzenoort-Bokken, kinderarts, namens de NVK
- Mevr. drs. M.F. (Maartje) van Velzen, kinderarts, namens de NVK
- Mevr. dr. B. (Berber) Vlieg-Boerstra, diëtist, namens de Nederlandse Vereniging van Diëtisten (NVD/DAVO)
- Mevr. O. (Olga) Benjamin-Aalst, diëtist, namens de NVD/DAVO
- Mevr. E. (Erna) Botjes, voedselallergie en niet-allergische voedselovergevoeligheid belangenbehartiger, namens Stichting Voedselallergie
- Mevr. C. (Chantal) Janssen, verpleegkundig specialist, namens het Netwerk van Allergie Professionals (NAPRO)
Klankbordgroep
- Mevr. drs. D.A. (Dana-Anne) de Gast-Bakker, kinderarts, namens de NVK
- Mevr. drs. E.A. (Ellen) Croonen, kinderlongarts, namens de NVK
- Mevr. drs. E. (Ester) Rijks, jeugdarts, namens AJN Jeugdartsen Nederland
- Mevr. D.G. (Daphne) Philips, verpleegkundig specialist, namens NAPRO
- Mevr. (M.) Mathilde Serné, lactatiekundige, namens de Nederlandse Vereniging van Lactatiekundigen (NVL)
- Mevr. M. (Maria) Oligschläger-Lindelauf, lactatiekundige, namens de NVL
Met ondersteuning van
- Mevr. dr. M.M.J. (Machteld) van Rooijen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. drs. L.C. (Laura) van Wijngaarden, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Koffeman (voorzitter) |
kinderarts-allergoloog, Rijnstate Arnhem |
Geen. |
Extern gefinancierd onderzoek: 1. Onderzoeksproject SinFoNIA: Specialist Infant Formulas in non-IgE mediated cow's milk allergy. In 2018 financiering toegezegd gekregen (Health Holland met behulp van Nutricia Research) maar geannuleerd door stopzetting project (maart 2020). Het project heeft niet geleid tot publicaties. 2. Lokale hoofdonderzoeker voor BAT koemelk bij koemelkallergie, gefinancierd met de beurs van ZonMW Veelbelovende Zorg.
Presentaties koemelkallergie, voedselallergie en FPIES (in brede zin: het gehele ziektebeeld in het kader van congres of nascholing) wanneer deze onderwijskundig belang dienen. - 2020 Mead Johnson, webinar voor kinderartsen en jeugdartsen - 2021 NVK congres (sessie gesponsord door Nestle) De eventuele honoraria die voortvloeien uit deze presentaties werden tot start van de richtlijn gestort aan het Vriendenfonds Rijnstate t.b.v. opleiding en onderzoek binnen de kinderallergologie. Gedurende voorzitterschap richtlijn is voor deze presentaties geen honorarium meer aangenomen. . |
Geen restricties |
|
Landzaat |
Kinderarts-allergoloog, Elisabeth-Tweesteden ziekenhuis Tilburg |
Geen. |
Geen. |
Geen restricties. |
|
Verweij |
Kinderarts, VieCurie Medisch centrum |
Geen. |
In het VieCurie wordt gewerkt aan uitbreiding van het kinderallergiecentrum. |
Geen restricties. |
|
Van der Vorst- van der Velde |
Kinderarts-allergoloog, Maasstad ziekenhuis Rotterdam |
Geen. |
Geen. |
Geen restricties. |
|
Onzenoort |
Kinderarts, Máxima Medisch centrum Eindhoven |
Financiële vergoeding voor deze werkzaamheden. |
Extern gefinancierd onderzoek: Lokale hoofdonderzoeker voor 3 projecten: 1. D-CAAP studie: onderzoek naar 0- toepassing corticosteroïden naast IVIG en acetylsalicylzuur (gefinancierd door UCL) 2. COPP studie: onderzoek naar covid infecties in kinderen (gefinancierd door LUMC/ ZonMW) 3. SVSpread: observationeel onderzoek naar RSV infecties (gefinancierd door UMCU/ ZonMW)
Presentaties koemelkeiwitallergie (gehele ziektebeeld en behandeling daarvan, geen invloed van sponsor op inhoud) in het kader van scholingen of congressen (Nutricia). |
Geen restricties. |
|
Van Velzen |
Kinderarts, Meander MC Amerstfoort |
Geen. |
Presentaties voedselallergie (gehele ziektebeeld en behandeling daarvan, geen invloed van sponsor op inhoud) in het kader van scholing, waarvoor honorarium beschikbaar werd gesteld. Bewuste samenwerking met alle spelers op de Nederlandse markt om binding met enkel bedrijf te voorkomen (o.a. Nutricia, Mead Johnson, Friso/Hero). |
Geen restricties. |
|
Vlieg-Boerstra |
Diëtist, Rijnstate Arnhem |
Lid Advisory board: Nestle, Nutricia, Vini Mini (producent pindapoeder), tot 1-1-2023: Marfo Food Groups (waarvoor vergoeding) |
Extern gefinancierd onderzoek: 1. Principal investigator van Groei studie: studie over de groei bij kinderen met allergie (sponsoring Nutricia) 2. Principal investigator van studie voeding bij borstvoeding, waarin voedingspatroon van moeder en HMO's in moedermelk worden onderzocht. Studie is volledig onafhankelijk opgezet en de resultaten worden niet beïnvloedt door de sponsor (Nutricia betaalt enkel de HMO bepalingen)
Expertise voedselprovocaties en dieetbehandeling van koemelkallergie via eigen praktijk (maatschap Vlieg Diëtisten)
Presentaties voedselallergie (inclusief koemelkallergie, en indicatie over typen voedingen in het algemeen; vrije invulling van inhoud) in het kader van scholing, waarvoor honorarium beschikbaar werd gesteld (Nestle, Nutricia). |
Geen restricties. Studies (externe onderzoeken) hebben geen invloed op de modules in de richtlijn, De studies gaan over de bestanddelen van moedermelk. |
|
Benjamin- van Aalst |
Diëtist-onderzoeker, OLVG Amsterdam Diëtist, Noordwest ziekenhuisgroep |
Lid dagelijks bestuur Netwerk Kinderdiëtisten. |
Presentaties voedselallergie (gehele ziektebeeld en behandeling daarvan) in het kader van scholing, waarvoor honorarium beschikbaar werd gesteld. Bewuste samenwerking met alle spelers op de Nederlandse markt om binding met enkel bedrijf te voorkomen (Nutricia, Reckitt, Abbott). |
Geen restricties. |
|
Janssen |
Verpleegkundig specialist kinderallergologie, Zuyderland Medisch centrum, Heerlen |
Geen. |
Geen. |
Geen restricties. |
|
Botjes |
Voedselallergie belangenbehartiger, Stichting Voedselallergie |
Geen. |
Geen. |
Geen restricties. |
Overkoepelend: Sommige Nederlandse ziekenhuizen (onder andere een aantal waarin de werkgroepleden werkzaam zijn) hebben een samenwerkingsovereenkomst met Nutricia. Het onderzoek dat door deze werkgroepleden wordt verricht, wordt niet beïnvloed door deze samenwerkingsbijdrage.
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de patiëntenvereniging Stichting Voedselallergie in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kop ‘Waarden en voorkeuren van patiënten’). De conceptrichtlijn is tevens voor commentaar voorgelegd aan Stichting Voedselallergie en Patiëntenfederatie Nederland, en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
|
Module |
Uitkomst raming |
Toelichting |
|
Module Preventie van koemelkallergie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Binnen het SKMS project “Inventarisatie en optimalisatie modulair onderhoud richtlijn kindergeneeskunde” is breed geïnventariseerd welke kindergeneeskundige modules toe waren aan herziening, en er is een onderhoudsplan opgeleverd. De modules van deze richtlijn, herzien in 2022-2024, kwamen uit dit project naar voren. De modules zijn kritisch beoordeeld en de uitgangsvraag en zoekvraag werden aangepast of aangescherpt.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Referenties
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
Algemene informatie
|
Cluster/richtlijn: NVK IgE-gemedieerde koemelkallergie |
|
|
Uitgangsvraag/modules: Wat is het advies t.a.v. koemelkbevattende kunstvoeding ter preventie van KMA bij borstgevoede zuigelingen? |
|
|
Database(s): Embase.com, Ovid/Medline |
Datum: 6 september 2023 |
|
Periode: vanaf 2005 |
Talen: geen restrictie |
|
Literatuurspecialist: Alies van der Wal |
Rayyan review: https://rayyan.ai/reviews/770216 |
|
BMI-zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Voor deze vraag is gezocht op de elementen:
De sleutelartikelen worden gevonden met deze search, m.u.v. PMID 36986127. Deze gaat niet specifiek over zuigelingen. |
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase.com en Ovid/Medline is op 6 september 2023 systematisch gezocht naar systematische reviews, RCTs en observationele studies over het effect van blootstelling aan koemelk bevattende voeding bij zuigelingen op koemelkallergie De literatuurzoekactie leverde 480 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SR |
71 |
48 |
82 |
|
RCT |
144 |
109 |
193 |
|
Observationele studies |
148 |
126 |
205 |
|
Totaal |
363 |
283 |
480* |
*in Rayyan
Zoekstrategie
Embase.com
|
No. |
Query |
Results |
|
#14 |
#11 OR #12 OR #13 |
363 |
|
#13 |
#6 AND (#9 OR #10) NOT (#11 OR #12) = observationeel |
148 |
|
#12 |
#6 AND #8 NOT #11 = RCT |
144 |
|
#11 |
#6 AND #7 = SR |
71 |
|
#10 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
14391990 |
|
#9 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
7821157 |
|
#8 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3867364 |
|
#7 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
958806 |
|
#6 |
#5 AND [2005-2023]/py |
563 |
|
#5 |
#4 NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
822 |
|
#4 |
#1 AND #2 AND #3 |
1211 |
|
#3 |
'milk allergy'/exp OR 'milk intolerance'/exp OR (('cow milk'/exp OR 'whey'/exp OR 'whey protein'/exp OR 'casein'/exp) AND ('allergy'/exp OR 'hypersensitivity'/exp OR 'food allergen'/exp OR 'immunoglobulin e'/exp OR 'ige mediated food allergy'/exp OR 'nutritional intolerance'/de OR 'adverse food reaction'/de OR 'food allergy'/de)) OR ((('cow s milk' OR 'cow* milk' OR casein* OR whey) NEAR/3 (allerg* OR intoleran* OR sensitization OR sensitisation OR hypersensitization OR hypersensitisation OR sensitivity OR hypersensitivity OR anaphyla* OR ige OR 'ig e' OR 'gammaglubulin e' OR 'gamma e' OR 'immunoglobulin gamma e' OR 'immunoglobulin e')):ti,ab,kw) |
10451 |
|
#2 |
'exposure'/exp OR introduction:ti OR (((early OR delay* OR timing OR continu* OR discontinu* OR avoid* OR regular* OR temporary) NEAR/4 (introduc* OR exposure* OR supplement* OR receiv* OR ingest* OR consump* OR formula OR cow* OR cm OR cmf)):ti,ab,kw) OR 'primary prevention'/exp OR prevent*:ti,ab,kw |
3206566 |
|
#1 |
'infant'/exp OR 'infancy'/exp OR 'infant feeding'/exp OR infan*:ti,ab,kw OR newborn*:ti,ab,kw OR 'new born*':ti,ab,kw OR baby*:ti,ab,kw OR babies:ti,ab,kw OR suckling*:ti,ab,kw OR perinat*:ti,ab,kw OR neonat*:ti,ab,kw OR postneonat*:ti,ab,kw OR prematur*:ti,ab,kw OR preterm*:ti,ab,kw OR picu:ti,ab,kw OR nicu:ti,ab,kw |
2008318 |
Ovid/Medline
|
# |
Searches |
Results |
|
14 |
11 or 12 or 13 |
283 |
|
13 |
(6 and (9 or 10)) not (11 or 12) = observationeel |
126 |
|
12 |
(6 and 8) not 11 = RCT |
109 |
|
11 |
6 and 7 = SR |
48 |
|
10 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) |
5503697 |
|
9 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
4524591 |
|
8 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2629272 |
|
7 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
691401 |
|
6 |
limit 5 to yr="2005 -Current" |
459 |
|
5 |
4 not (comment/ or editorial/ or letter/) not ((exp animals/ or exp models, animal/) not humans/) |
720 |
|
4 |
1 and 2 and 3 |
797 |
|
3 |
exp Milk Hypersensitivity/ or ((Milk/ or exp Milk Proteins/ or exp Whey/) and (exp Hypersensitivity/ or exp Allergens/ or exp Immunoglobulin E/)) or (('cow s milk' or 'cow* milk' or casein* or whey) adj3 (allerg* or intoleran* or sensitization or sensitisation or hypersensitization or hypersensitisation or sensitivity or hypersensitivity or anaphyla* or ige or 'ig e' or 'gammaglubulin e' or 'gamma e' or 'immunoglobulin gamma e' or ' immunoglobulin e')).ti,ab,kf. |
6620 |
|
2 |
exp Dietary Exposure/ or introduction.ti. or ((early or delay* or timing or continu* or discontinu* or avoid* or regular* or temporary) adj4 (introduc* or exposure* or supplement* or receiv* or ingest* or consump* or formula or cow* or cm or cmf)).ti,ab,kf. or exp Primary Prevention/ or prevent*.ti,ab,kf. |
2071758 |
|
1 |
exp Infant/ or exp Infant Food/ or (infan* or newborn* or 'new born*' or baby or babies or suckling* or perinat* or neonat* or postneonat* or prematur* or preterm* or picu or nicu).ti,ab,kf. |
1771989 |