Streefbloeddruk bij hypertensieve aandoeningen
Uitgangsvraag
Wat is de streefbloeddruk bij zwangeren met hypertensieve ziekte?
Aanbeveling
Streef in de zwangerschap bij pre-existente hypertensie of zwangerschap geïnduceerde hypertensie naar een bloeddruk van > 80 tot < 100 mmHg diastolisch.
Streef naar een systolische bloeddruk van < 160 mmHg, onafhankelijk van de diastolische bloeddruk.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Op basis van de resultaten van de literatuuranalyse lijken er geen verschillen te zijn in de cruciale of de belangrijke uitkomstmaten tussen het strak of niet strak reguleren van de bloeddruk bij zwangeren met een hoge bloeddruk (pre-existent of zwangerschap geïnduceerd). Er konden drie goed uitgevoerde RCT’s worden geïncludeerd (El Guindy, 2008; Magee, 2007; Magee, 2015), de Magee (2007) was de pilot studie voor Magee (2015). Voor de belangrijke uitkomstmaat NICU opname, is het onduidelijk wat het effect van de streefbloeddruk is, de studie van El Guindy (2008) laat geen verschil tussen de groepen zien, de studie van Magee (2007) laat een mogelijk verhoogd risico op een NICU opname > 48 uur en > 7 dagen. De bewijskracht werd gegradeerd als GRADE ‘very low’ wegens inconsistentie en imprecisie. Magee (2015) rapporteerde niet het aantal NICU opnames, maar het aantal neonaten dat was opgenomen op de high level neonatal care > 48 uur. Er werd geen verschil gezien in het aantal neonaten dat op de high level neonatal care > 48 uur werd opgenomen (GRADE ‘low’). Van de belangrijkste maternale parameters was de incidentie laag, en was ook geen sprake van een trend in een bepaalde richting. De overall bewijskracht is gelijk aan de laagst gevonden bewijskracht voor de cruciale uitkomstmaat (eclampsie) en is daarmee ‘laag’. Voor de belangrijke uitkomstmaten was een aantal parameters gegradeerd als laag en een aantal als redelijk.
Op basis van de cruciale en belangrijke uitkomsten is het niet duidelijk welke interventie de voorkeur heeft. Er werden geen statistisch (of klinisch relevante) verschillen gevonden. De uitkomstmaten pre-eclampsie en geboorte onder 37 weken vertoonden een lichte trend naar minder diagnoses bij een strengere streefbloeddruk. Echter, dit zou ook kunnen betekenen dat alleen de diagnose pre-eclampsie minder vaak gesteld kon worden door een kunstmatig lagere bloeddruk, terwijl vrouwen mogelijk niet minder ziek waren. Aan het aantal maternale complicaties is er geen verschil te zien dat een bepaalde richting uit wijst.
Een uitkomstmaat die door de werkgroep van tevoren niet was geformuleerd maar wel wordt beschreven in de studies is ernstige hypertensie (severe hypertension > 160/110 mmHg). In de minder strakke regulatie groep werd meer ernstige maternale hypertensie gezien dan in de strakke regulatie groep (40.6% versus 27.5%; p < 0.001), en meer vrouwen met trombocyten onder de < 100 × 109/L (4.3% versus 1.6%; p = 0.02) of symptomatisch verhoogde leverenzymen (4.3% versus 1.8%; p = 0.03), met geen verschil in ernstige maternale complicaties (3.7% versus 2.0%; p = 0.17) (Magee, 2015). El Guindy (2008) rapporteerde dezelfde bevinding, het aantal vrouwen met ernstige hypertensie was hoger in de groep met minder strakke regulatie vergeleken met strakke regulatie (RR 3,167 (95%BI 1,36 tot 7,37). In een secundaire analyse van de CHIPS-trial was ernstige hypertensie geassocieerd met meer ernstige maternale en perinatale complicaties (Magee, 2019).
De kleinere kans op ernstige hypertensie in de strenge streefbloeddruk groep maakt dat de CHIPS-groep zelf aanbeveelt om te kiezen voor strenge streefbloeddruk. Dat betekent streven naar een diastole bloeddruk van 85 mmHg. Echter, tijdens de studie was het verschil tussen de twee groepen 5,8 mmHg voor systolische bloeddruk en 4,6 mmHg voor diastolische bloeddruk (Magee, 2015). De streefbloeddruk werd dus niet altijd bereikt.
Voor de besluitvorming rondom de aanbeveling zijn er geen argumenten te ontlenen aan andere patiëntengroepen. Er zijn vanuit de CHIPS-trial geen andere subgroepen aan te wijzen waarvoor een andere afweging zou gelden. Ook is er geen verschil gevonden tussen het soort antihypertensivum dat werd gebruikt.
De resultaten van de Cochrane review uit 2018, “Antihypertensive drug therapy for mild to moderate hypertension during pregnancy” (Abalos, 2018), beschrijft dat met middelmatige zekerheid het gebruik van antihypertensieve medicatie het risico op het ontwikkelen van ernstige hypertensie waarschijnlijk halveert (risk ratio (RR) 0,49; 95%BI 0,40 tot 0,60; 20 trials, 2558 vrouwen), maar weinig of geen effect heeft op het risico op proteïnurie/pre‐eclampsie (gemiddeld risk ratio (aRR) 0,92; 95% CI 0,75 tot 1,14; 23 trials, 2851 vrouwen, lage-zekerheid bewijs). Bewijs van middelmatige zekerheid laat ook zien dat antihypertensiva waarschijnlijk weinig of geen effect hebben op het risico op perinatale sterfte (inclusief miskramen) (aRR 0,72; 95% CI 0,50 tot 1,04; 29 trials, 3365 vrouwen), small‐for‐gestational‐age neonaten (aRR 0,96; 95% CI 0,78 tot 1,18; 21 trials, 2686 neonaten) of preterme geboorte onder 37 weken (aRR 0,96; 95% CI 0,83 tot 1,12; 15 trials, 2141 vrouwen).
De NICE richtlijn uit juni 2019 stelt dat anti-hypertensieve medicatie moet worden aangeboden bij een bloeddruk groter of gelijk aan 140/90 mmHg. Voor zwangerschap geïnduceerde hypertensie geldt een bloeddruk hoger dan 140/90 mmHg als ondergrens om medicatie te starten. Voor zowel pre-existente hypertensie als zwangerschap geïnduceerde hypertensie staat een streefwaarde voor de bloeddruk van kleiner of gelijk aan 135/85 mmHg beschreven (NICE, 2019) In de ACOG richtlijn (American College of Obstetricians and Gynaecologists) uit januari 2019 staat voor zowel pre-existente hypertensie als zwangerschap geïnduceerde hypertensie genoemd dat behandeling moet worden gegeven bij een bloeddruk groter of gelijk aan 160/110 mmHg (ACOG, 2019).
De Canadese richtlijn adviseert antihypertensiva te starten bij een bloeddruk groter of gelijk aan 140/90 mmHg, met een streefbloeddruk van diastolisch 85 mmHg (Butalia, 2018).
In de CHIPS-trial wordt geadviseerd bij een systolische bloeddruk ≥ 160 mmHg sowieso te starten met antihypertensieve behandeling. Verder werd systolische bloeddruk niet mee genomen in het bepalen van beleid (Magee, 2015). Aangezien 160 mmHg systolisch ook door de ACOG wordt aangehouden, en ook in Nederland een veel gebruikte grens is vanaf welke altijd gestart met antihypertensieve medicatie, is deze als extra criterium toegevoegd aan de aanbevelingen.
Al met al is het aannemelijk dat het streven naar een lagere bloeddruk tijdens de zwangerschap een reductie geeft van het aantal vrouwen met ernstige hypertensie (Magee, 2015), of dat daadwerkelijk een verbetering van de uitkomst van de zwangerschap geeft is niet duidelijk. De meeste internationale richtlijnen hebben er voor gekozen om een strenge regulatie aan te bevelen. Het is daarbij opvallend dat er een fors verschil zit tussen de strenge en de losse regulatie, zowel in de CHIPS als tussen de Amerikaans richtlijn en de andere richtlijnen. Er zijn geen onderzoeken naar een tussenliggende streefwaarde gedaan.
Voor de Nederlandse praktijk zou een streefwaarde van lager dan 85 mmHg diastolisch (in CHIPS-trial 81 tot 85mmHg) een forse aanpassing betekenen, in de vorm van toename van medicatiegebruik, terwijl het niet duidelijk is welk voordeel dat oplevert. Echter, het lijkt wel wenselijk om landelijk een universele streefwaarde aan te houden. Enerzijds om het aantal vrouwen met ernstige hypertensie en de noodzaak tot intraveneus behandelen van de bloeddruk daarmee gereduceerd wordt, anderzijds om eenduidig beleid te kunnen voeren. Bij gebrek aan bewijs voor een specifieke waarde of een nauw interval, heeft het de voorkeur om een redelijk ruim interval aan te houden als streefwaarde. Met deze ruimere marge kan ook behandeld worden in de context van de patiënt, onder andere rekening houdend met zwangerschapsduur en aard van de hypertensieve aandoening. Bovendien zullen er bij een nauw interval er waarschijnlijk meer aanpassingen in de medicatie en daarmee gepaard gaande consulten en zorgen
Voor het vaststellen van de optimale streefbloeddruk bij zwangere vrouwen met een pre-existente nierziekten wordt verwezen naar de richtlijn zwangerschap en nierziekten (NVOG: 2020 verwachtte publicatie (invoegen link)). Ook bij vrouwen met andere pre-existente aandoeningen, zoals bepaalde hartziekten, kan een andere streefwaarde van toepassing zijn.
Waarden en voorkeuren van zwangere vrouwen (en eventueel hun verzorgers)
Belangrijkste doel van de interventie is het streven naar een gezonde moeder en een gezond kind. In de CHIPS-trial was er in beide groepen grote tevredenheid over het gevolgde beleid (Magee, 2015). Op de vraag of men bereid was om dezelfde behandeling te ondergaan in een volgende zwangerschap antwoordden de vrouwen bevestigend in 92.4% ‘minder strak’ versus 95.8% in de strakke regulatie groep, p=0.14 (Magee, 2015). Er zijn geen subgroepen bekend waarbij dat anders zou zijn.
Het is belangrijk dat de zwangere vrouw goed geïnformeerd wordt over een behandeling met bloeddrukverlagende middelen, waarbij uitgelegd wordt wat de mogelijke voor- en nadelen zijn voor moeder en kind van het wel of niet behandelen met medicatie. Denk hierbij onder andere aan de veiligheid/ risico’s voor moeder kind, welke belasting dit geeft voor de zwangere vrouw en welke bijwerkingen kunnen optreden. Bij een strengere controle van de bloeddruk moet meer medicatie gebruikt moeten worden, met waarschijnlijk ook meer bijwerkingen van de medicatie tot gevolg. Wanneer een te lage bloeddruk wordt geconstateerd moet de medicatie, in overleg met de zwangere vrouw, worden aangepast.
Kosten (middelenbeslag)
Er is bij de CHIPS-trial een kosteneffectiviteitsanalyse gedaan waarin er geen verschil werd gevonden, maar er zouden mogelijk minder kosten zijn bij de strakke regulatie ten gevolge van minder neonatale kosten (p=0.07) (Ahmed, 2016). Om uitspraak te kunnen doen over de kosteneffectiviteit van de interventie in de Nederlandse gezondheidszorg moet nader onderzoek worden verricht.
Aanvaardbaarheid, haalbaarheid en implementatie
De frequentie van adherentie aan het voorgeschreven schema “tight or less tight” was niet verschillend (Magee, 2015). Voor de meeste ziekenhuizen zou een aanbeveling tot een strakke regulatie betekenen dat er meer medicatie gegeven wordt. Dit terwijl er geen verschil in de hier onderzochte uitkomsten is. Het argument om toch een strengere streefwaarde aan te houden is dat er daarmee minder ernstige hypertensie ontstaat.
De interventie is niet van invloed op de gezondheidsgelijkheid. Bij alle zwangere vrouwen in Nederland wordt een bloeddruk gemeten en de vrouwen die voor behandeling in aanmerking komen hadden reeds een medische indicatie gezien hun hypertensie.
Er zijn geen belemmerende factoren voor de implementatie. De meest gebruikte antihypertensiva in de zwangerschap zijn eenvoudig te gebruiken, goed beschikbaar en niet duur. Elke gynaecoloog is bekend met tenminste het gebruik van een van de beschikbare antihypertensiva.
In de literatuur zijn geen aanwijzingen gevonden voor het optreden van hypotensie die een interventie behoeft. Er is dan ook geen reden om aan te nemen dat er meer opnames zullen plaatsvinden. De verwachting is eerder dat er minder opnames zullen plaatsvinden, gezien er bij strenge controle minder vaak sprake is van ernstige hypertensie die intraveneuze behandeling behoeft.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Er werden geen duidelijke verschillen gevonden tussen de twee behandelstrategieën. Hoewel niet significant verschillend, is er op theoretische gronden, mogelijk grotere kans op groeirestrictie in de strenge regulatie groep. Dit middelt weer uit met de mogelijk wat kleinere kans op een premature geboorte.
De kleinere kans op ernstige hypertensie in de strenge regulatie groep maakt dat de CHIPS-groep zelf aanbeveelt om te kiezen voor de strenge regulatie. Dat betekent streven naar een diastole bloeddruk van 85 mmHg. Echter, tijdens de studie was het verschil tussen de twee groepen 5,8 mm Hg voor systolische bloeddruk en 4,6 mm Hg voor diastolische bloeddruk. De streefbloeddruk werd dus niet altijd bereikt. Wat de exacte ideale streefbloeddruk is, is hiermee nog niet duidelijk. Wel is het aannemelijk dat de ideale streefbloeddruk lager is dan 100 mmHg diastolisch. Het onderzochte flowdiagram, waarbij een streefbloeddruk van 81 tot 85mmHg wordt aangehouden, is mogelijk lager dan de ideale bloeddruk. Bovendien is het interval dat hierbij wordt aangehouden erg smal. Voor de dagelijkse praktijk lijkt het werkbaarder om voor een bredere spreiding van de streefbloeddruk te kiezen. Op basis van de literatuur, met minimale verschillen tussen de strakke en de minder strakke regulatie, is er geen reden om aan te nemen dat dit onwenselijk is. Daarom wordt er pragmatisch gekozen om een streefbloeddruk van diastolisch >80-< 100 mmHg te komen. Net als in de CHIPS-trial wordt geadviseerd bij een systolische bloeddruk van > 160 de medicatie te verhogen.
Gezien de middelmatige sterkte van de conclusies, en een aanbeveling die niet direct volgt uit de bevindingen is de aanbeveling zwak.
Onderbouwing
Achtergrond
Er bestaat momenteel geen richtlijn ten aanzien van de streefwaarde voor de bloeddruk in de zwangerschap bij hypertensieve ziekte. Hierdoor bestaat er aanzienlijke praktijkvariatie. Enerzijds zou het gunstig kunnen zijn om een normale bloeddruk na te streven, om daarmee schade bij de moeder en het ontwikkelen van een zeer hoge bloeddruk en noodzaak tot intraveneuze behandeling te voorkomen. Anderzijds zou het streven naar een lagere bloeddruk tot gebruik van meer medicatie met bijbehorende bijwerkingen kunnen leiden, en is er mogelijk een nadelig effect op de functie van de placenta en de foetale groei.
Conclusies / Summary of Findings
|
Moderate GRADE |
There is no difference in the risk of pre-eclampsia between pregnant women with hypertensive disorders treated with tight (diastolic blood pressure < 85 mmHg) or less-tight control (diastolic blood pressure < 100 mmHg).
Sources: (Magee, 2007; Magee, 2015) |
|
Low GRADE |
There does not seem to be a difference in the risk of eclampsia between pregnant women with hypertensive disorders treated with tight (diastolic blood pressure < 85 mmHg) or less-tight control (diastolic blood pressure < 100 mmHg).
Sources: (El Guindy, 2008; Magee, 2007; Magee, 2015) |
|
Low GRADE |
There does not seem to be a difference in the risk of a pulmonary oedema between pregnant women with hypertensive disorders treated with tight (diastolic blood pressure < 85 mmHg) or less-tight control (diastolic blood pressure < 100 mmHg).
Sources: (Magee, 2007; Magee, 2015) |
|
Low GRADE |
There does not seem to be a difference in the risk of hepatic failure, hepatic haematoma, hepatic rupture or hepatic dysfunction between pregnant women with hypertensive disorders treated with tight (diastolic blood pressure < 85 mmHg) or less-tight control (diastolic blood pressure < 100 mmHg).
Sources: (Magee, 2007; Magee, 2015) |
|
Low GRADE |
There does not seem to be a difference in the risk of renal failure between pregnant women with hypertensive disorders treated with tight (diastolic blood pressure < 85 mmHg) or less-tight control (diastolic blood pressure < 100 mmHg).
Sources: (El Guindy, 2008; Magee, 2007; Magee, 2015) |
|
Low GRADE |
There does not seem to be a difference in the risk of transient ischemic attack or stroke between pregnant women with hypertensive disorders treated with tight (diastolic blood pressure < 85 mmHg) or less-tight control (diastolic blood pressure < 100 mmHg).
Sources: (Magee, 2007; Magee, 2015) |
|
Low GRADE |
There does not seem to be a difference in the risk of placental abruption between pregnant women with hypertensive disorders treated with tight (diastolic blood pressure < 85 mmHg) or less-tight control (diastolic blood pressure < 100 mmHg).
Sources: (El Guindy, 2008; Magee, 2007; Magee, 2015) |
|
Low GRADE |
There does not seem to be a difference in the risk of intra-uterine death (stillbirth) or neonatal death between pregnant women with hypertensive disorders treated with tight (diastolic blood pressure < 85 mmHg) or less-tight control (diastolic blood pressure < 100 mmHg).
Sources: (El Guindy, 2008; Magee, 2007; Magee, 2015) |
|
Very low GRADE |
It is unclear from the evidence what the effect of a tight (diastolic blood pressure < 85 mmHg) compared to less-tight control (diastolic blood pressure < 100 mmHg) is for the risk of a NICU admission.
Sources: (El Guindy, 2008; Magee, 2007) |
|
Low GRADE |
There does not seem to be a difference in the risk for a neonate to be admitted to high level neonatal care > 48 hours between pregnant women with hypertensive disorders treated with tight (diastolic blood pressure < 85 mmHg) compared to less-tight control (diastolic blood pressure < 100 mmHg).
Sources: (Magee, 2015) |
|
Moderate GRADE |
There does not seem to be a difference in the risk of low birth weight for gestational age for neonates between pregnant women with hypertensive disorders treated with tight (diastolic blood pressure < 85 mmHg) or less-tight control (diastolic blood pressure < 100 mmHg).
Sources: (El Guindy, 2008; Magee, 2007; Magee, 2015) |
|
Moderate GRADE |
There does not seem to be a difference in the risk of a preterm birth < 37 weeks between pregnant women with hypertensive disorders treated with tight (diastolic blood pressure < 85 mmHg) or less-tight control (diastolic blood pressure < 100 mmHg).
Sources: (El Guindy, 2008; Magee, 2007; Magee, 2015) |
Samenvatting literatuur
Description of studies
Three studies were included, one trial by El Guindy (2008) and two studies by Magee and colleagues. Magee (2007) reports the results of the pilot study of the Control of Hypertension In Pregnancy Study (CHIPS), Magee (2015) reports the results of the CHIPS trial. Women who were included in the pilot study were not included in the full trial (Magee, 2015).
El Guindy (2008) performed a single centre RCT to study the effects of tight control (defined as target blood pressure < 130/80 mmHg) with less-tight control (defined as 130 to 139/80 to 89 mmHg). Women with a live foetus at 20 to 33+6 weeks of gestation with blood pressure 140 to 159/90 to 99 mmHg due to essential or gestational non-proteinuric hypertension were included. Hypertension was classified as pre-existing if diagnosed before 20 weeks, and gestational if diagnosed for the first time at or after 20 weeks’ gestation. Single and multiple pregnancies were included. In total, 125 women were eligible, 63 were randomly assigned to tight control (n=3 lost to follow-up) and 62 to less-tight control (n=2 lost to follow-up). Therefore, n=60 women in the intervention and n=60 women in the control group were analysed. Mean maternal age was 26.5 (SD 5.5) years in the tight control group and 27.9 (SD 4.4) years in the less-tight control group. Mean week of gestation at inclusion was 30.3 (SD 1.3) in the tight control group and 30.0 (SD 1.5) in the less-tight control group. Multiple pregnancies were reported in n=3 (5%) in the tight control group and n=1 (2%) in the less-tight control group. There were no baseline differences in patient characteristics. Length of follow-up was not specified.
Magee (2007) performed an open, international, multicentre RCT to study the effects of tight (defined as target diastolic blood pressure 85 mmHg, according to flow diagram target 81 to 85mmHg) with less-tight control (defined as target diastolic blood pressure 100 mmHg, according to flow diagram target 100 to 104mmHg)). Women with a live foetus at 20 to 33+6 weeks of gestation with nonproteinuric pre-existing or gestational hypertension were included. To be included, diastolic blood pressure at baseline had to be between 90 to 109 mmHg. Single and multiple pregnancies were included. In total, 194 women were eligible, of which 62 declined participation; 132 women were randomized: 66 in the less-tight control group and 66 in the tight control group (1 woman with missing outcome data). Therefore, 66 women in the less-tight control group and 65 in the tight control group were analysed. Mean maternal age was 33.6 (SD 5.0) years in the less-tight control group and 33.3 (SD 5.8) years in the tight control group. Mean week of gestation at inclusion was 28.1 (SD 4.7) in the less-tight control group and 27.9 (SD 4.5) in the tight control group. Multiple pregnancies (all twins) were reported in the less-tight control group (n=3 (4.6%)), none were reported in the tight control group (0%). It was unclear whether groups differed at baseline (not tested). Length of follow-up was not specified.
Magee (2015) performed an open, international, multicentre RCT to study the effects of tight (defined as target diastolic blood pressure 85 mmHg) with less-tight control (defined as target diastolic blood pressure 100 mmHg). Women with a live foetus at 14+0 to 33+6 weeks of gestation with nonproteinuric pre-existing or gestational hypertension were included. To be included, diastolic blood pressure at baseline had to be 90 to 105 mmHg for women without antihypertensive medication and between 85 to 105 mmHg for women receiving antihypertensive treatment. Multiple pregnancies were excluded.
In total 1030 women were included, of whom 43 from one site were excluded (22 in the less-tight; 21 in tight control group) due to concerns about informed consent and data integrity. After exclusion of the complete study site, 987 women were included: 497 women in the less-tight group (2 women withdrew participation; 2 were lost to follow-up); 490 in the tight control group (1 women withdrew participation; 1 woman was lost to follow-up). Therefore, in total 493 women and neonates in the less-tight group and 488 women and neonates in the tight-control group were analysed in the study. Mean maternal age at expected date of delivery was 34.0 (SD 5.7) years in the less-tight group, and 33.7 (SD 5.8) years in the tight-control group. Mean week of gestation at inclusion was 23.7 (SD 6.3) in the less-tight group and 24.2 (SD 6.3) in the tight-control group. Women did not differ at baseline, except for percentage of women with prior blood pressure ≥ 160 mmHg systolic or ≥ 110 mmHg diastolic during this pregnancy (before inclusion) was higher in the less tight control group (16.5%) compared with the tight control group (12%). Data were collected until at or after 6 weeks postpartum and when the baby was at least 36 weeks of corrected post gestational age. One of the co-authors reported a potential conflict of interest.
Results
Meta-analysis were performed where possible.
1. Pre-eclampsia
Two studies reported the outcome measure pre-eclampsia (Magee, 2007; Magee, 2015), which was defined by Magee (2007) as the development of proteinuria or an adverse maternal sign, defined as seizure, severe hypertension, elevated aspartate transaminase or alanine transaminase greater than twice the upper limit of normal for the reference laboratory, platelet count < 100 000 10^9/l, or pulmonary oedema. Magee (2015) defined this as new proteinuria or one/more pre-eclampsia symptoms, signs, and/or abnormal laboratory tests.
Pre-eclampsia was reported in 257 of 553 women (46.5%) treated with tight control, compared to 282 of 559 women (50.5%) treated with less-tight control (RR 0.92 (95%CI 0.81 to 1.04)) (Figure 1). The risk difference was -0.04 (95%CI -0.10 to 0.02) between groups.
Figure 1 Pre-eclampsia, comparison tight (diastolic blood pressure < 85 mmHg) versus less-tight (diastolic blood pressure <100 mmHg)
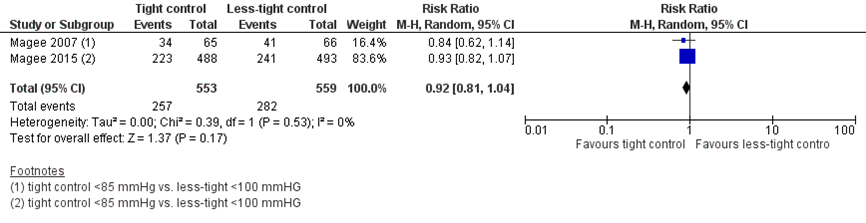
2. Eclampsia
Three studies reported the outcome measure eclampsia (El Guindy, 2008; Magee, 2007; Magee, 2015), which was defined as a generalised convulsion in the absence of a history of epilepsy in both Magee studies. El Guindy (2008) did not define the outcome on forehand.
Eclampsia was not reported in either group: 0 of 613 women (0%) treated with tight control, compared to 0 of 619 women (0%) treated with less-tight control (RR not estimable).
3. Pulmonary oedema
Two studies reported the outcome measure pulmonary oedema (Magee, 2007; Magee, 2015), which was defined by Magee (2015) as by a clinical diagnosis with one/more of oxygen saturation < 95%, diuretic treatment or x‐ray confirmation. Magee (2007) did not define this outcome.
Pulmonary oedema was reported in one of 553 women (0.2%) treated with tight control, compared to four of 559 women (0.7%) treated with less-tight control (RR 0.35 (95%CI 0.05 to 2.32) (Figure 2). The risk difference was -0.01 (95%CI -0.04 to 0.02) between groups.
Figure 2 Pulmonary oedema, comparison tight (diastolic blood pressure < 85 mmHg) versus less-tight (diastolic blood pressure < 100 mmHg)
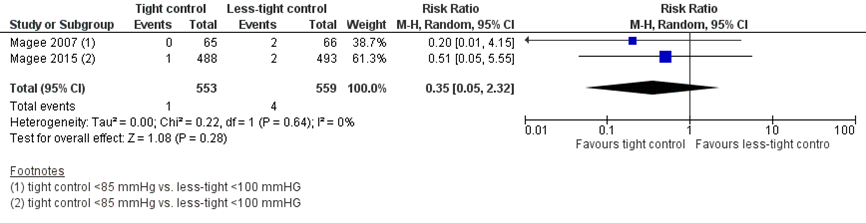
4. Hepatic haemorrhage
No study reported the outcome measure hepatic haemorrhage specifically, Magee (2007) reported the incidence of hepatic failure (not defined) and Magee (2015) reported the incidence of hepatic haematoma/ rupture/ dysfunction (not defined).
Cases of hepatic failure were not reported by Magee (2007): 0 of 65 women (0%) treated with tight control, compared to 0 of 66 women (0%) treated with less-tight control (RR not estimable).
Cases of hepatic haematoma/ rupture/ dysfunction were not reported by Magee (2015): 0 of 488 women (0%) treated with tight control, compared to 0 of 493 women (0%) treated with less-tight control (RR not estimable).
5. Renal insufficiency
No study reported renal insufficiency specifically, Magee (2007) and Magee (2015) reported the outcome measure renal failure, defined as serum creatinine > 200 µM. El Guindy (2008) reported the mean serum creatinine and mean serum uric acid (unit of measurement was not reported).
Renal failure was reported in one of 553 women (0.2%) treated with tight control, compared to 0 of 559 women (0%) treated with less-tight control (RR 3.03 (95%CI 0.12 to 74.21)) (Figure 3). The risk difference was 0.00 (95%CI -0.00 to 0.01) between groups.
El Guindy reported that the mean serum creatinine did not differ between groups: mean 0.9 (SD 0.7) versus mean 1.1 (SD 0.8) (P>0.05). The mean serum uric acid significantly differed between groups: mean 4.6 (SD 1.0) versus mean 5.3 (SD 1.0) (P<0.0001). El Guindy (2008) concluded that the mean serum uric acid was significantly higher in the less-tight group, but did not reach the absolute level to be labelled as hyperuricemia (not specified).
Figure 3 Renal failure, comparison tight (diastolic blood pressure < 85 mmHg) versus less-tight (diastolic blood pressure < 100 mmHg)
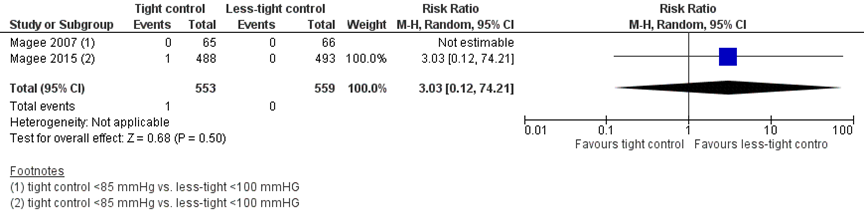
6. Cerebral haemorrhage
No study reported cerebral haemorrhage specifically, Magee (2007) reported the incidence of stroke and Magee (2015) reported the incidence of transient ischemic attacks or stroke.
Transient ischemic attack or stroke (unclear which specifically) was reported in 1 of 553 women (0.2%) treated with tight control, compared to 0 of 559 women (0%) treated with less-tight control (RR 3.03 (95%CI 0.12 to 74.21)) (Figure 4). The risk difference was 0.00 (95%CI -0.00 to 0.01) between groups.
Figure 4 Transient ischemic attack or stroke, comparison tight (diastolic blood pressure < 85 mmHg) versus less-tight (diastolic blood pressure < 100 mmHg)
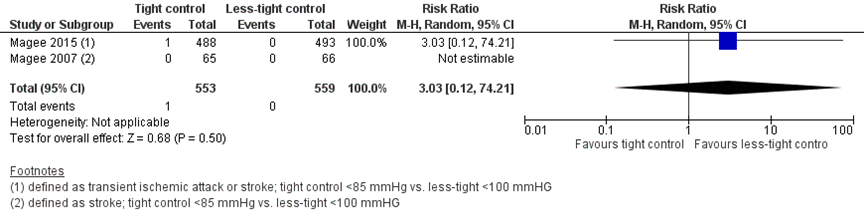
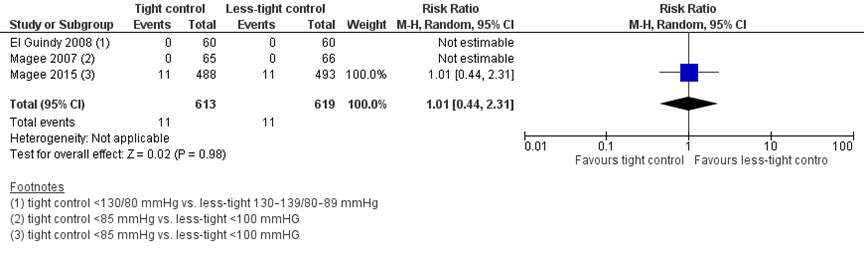
7. Placental abruption
Three studies reported the outcome measure placental abruption (El Guindy, 2008; Magee, 2007; Magee, 2015). Magee (2007) diagnosed this clinically by abdominal pain or uterine contractions with one or more of vaginal bleeding, intrauterine fetal death, and/or disseminated intravascular coagulation; El Guindy (2008) and Magee (2015) did not define this outcome.
Placental abruption was reported in 11 of 613 women (2%) treated with tight control, compared to 11 of 619 women (2%) treated with less-tight control (RR 1.01 (95%CI 0.44 to 2.31)) (Figure 5). The risk difference was 0.00 (95%CI -0.01 to 0.01) between groups.
Figure 5 Placental abruption, comparison tight (diastolic blood pressure < 85 mmHg) versus less-tight (diastolic blood pressure < 100 mmHg)
8. Perinatal death (intra-uterine death and neonatal death)
No studies reported the outcome perinatal death as such, but reported the number of intra-uterine deaths and neonatal deaths separately, which are reported respectively in paragraphs 8.1 and 8.2.
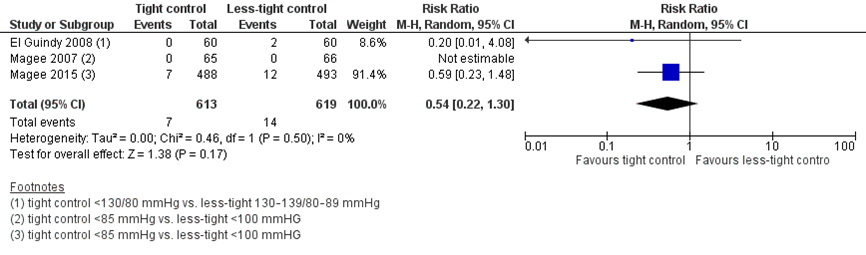
8.1. Intra-uterine death
Three studies reported the outcome measure intra-uterine death. Magee (2007) and Magee (2015) reported this as the incidence of stillbirth, defined as death of a foetus at ≥ 500 g or at ≥ 20 weeks of gestation. El Guindy (2008) did not defined this outcome.
Stillbirth was reported in seven fetuses of 613 women (1.2%) treated with tight control, compared to 14 foetuses of 619 women (2.3%) treated with less-tight control (RR 0.54 (95%CI 0.22 to 1.30)) (Figure 6). The risk difference was -0.01 (95%CI -0.02 to 0.01) between groups.
Figure 6 Stillbirth, comparison tight (diastolic blood pressure < 85 mmHg) versus less-tight (diastolic blood pressure < 100 mmHg)
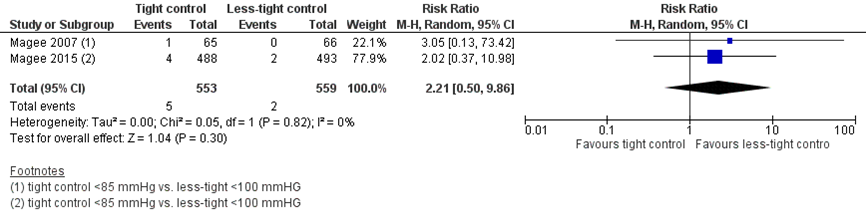
8.2. Neonatal death
Neonatal death was reported by two studies (Magee, 2007; Magee, 2015). Magee (2007) defined this as death of new-born until hospital discharge, Magee (2015) did not define this.
Neonatal death was reported in five neonates of 553 women (0.9%) treated with tight control, compared to two neonates of 559 women (0.4%) treated with less-tight control (RR 2.21 (95%CI 0.50 to 9.86)) (Figure 7). The risk difference was 0.00 (95%CI 0.00 to 0.01) between groups.
Figure 7 Neonatal death, comparison tight (diastolic blood pressure < 85 mmHg) versus less-tight (diastolic blood pressure < 100 mmHg)
9. NICU admission
Three studies reported the outcome measure NICU admission (El Guindy, 2008; Magee, 2007; Magee, 2015). Magee (2007) reported this as > 24 hours NICU stay and as > 7 days NICU stay, both outcome measures excluded cases of neonatal death. Magee (2015) reported the % of high level neonatal care > 48 hours (until primary discharge home or 28 days of life, whichever was later, defined as greater than normal new-born care). NICU admission was not specified herein. El Guindy (2008) did not define the outcome. It was not possible to pool the data because it was unclear to what period of NICU admission was referred. Results are therefore reported descriptively.
El Guindy (2008) reported NICU admission of 0 neonates of 60 women (0%) treated with tight control, compared to two neonates of 60 women (3.3%) treated with less-tight control (RR 0.20 (95%CI 0.01 to 4.08)).
Magee (2007) reported that NICU stay > 24 hours was reported in 21 neonates of 65 women (32.3%) treated with tight control, compared to 12 neonates of 66 women (18.2%) treated with less-tight control (RR 1.78 (95%CI 0.95 to 3.31)). NICU stay > 7 days was reported in 15 neonates of 65 women (23.1%) treated with tight control, compared to 6 neonates of 66 women (9.1%) treated with less-tight control (RR 2.54 (95%CI 1.05 to 6.14)).
Magee (2015) reported that high level neonatal care > 48 hours was reported in 139 neonates of 479 women (29.0%) treated with tight control compared to 141 neonates of 480 women (29.4%) treated with less-tight control (RR 0.99 (95%CI 0.81 to 1.20)).
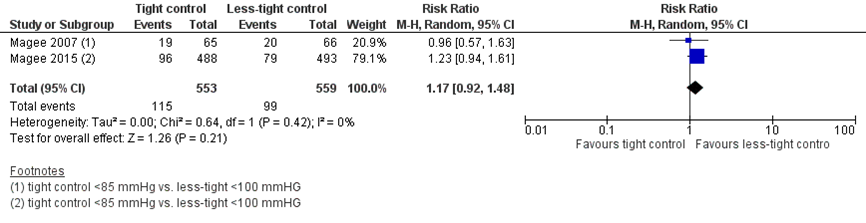
10. Low birth weight for gestational age
Two studies reported the outcome measure low birth weight for gestational age (Magee, 2007; Magee, 2015), which was defined as birth weight < 10th percentile. El Guindy (2008) reported the mean birth weight in kilograms.
Low birth weight for gestational age (< 10th percentile) was reported in 115 neonates of 553 women (20.8%) treated with tight control, compared to 99 neonates of 559 women (16.5%) treated with less-tight control (RR 1.17 (95%CI 0.92 to 1.48)) (Figure 8). The risk difference was 0.03 (95%CI -0.01 to 0.08) between groups.
El Guindy (2008) reported the mean birth weight did not differ between groups: mean 3.0 kg (SD 0.8) versus mean 2.9 kg (0.7) (P>0.05).
Figure 8 Low birth weight for gestational age (< 10th percentile), comparison tight (diastolic blood pressure < 85 mmHg) versus less-tight (diastolic blood pressure < 100 mmHg)
11. Preterm birth < 37 weeks
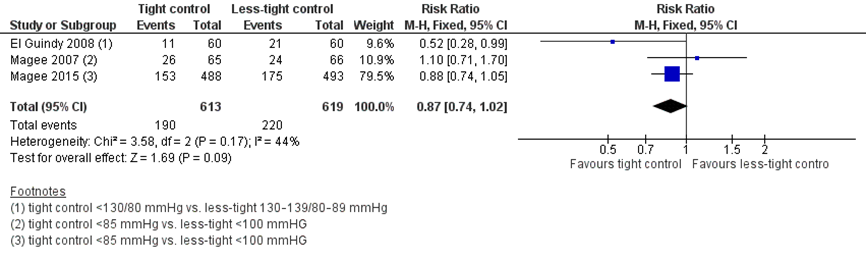
Three studies reported the outcome measure preterm birth < 37 weeks of gestation (El Guindy, 2008; Magee, 2007; Magee, 2015).
Preterm birth < 37 weeks of gestation was reported in 190 neonates of 613 women (31%) treated with tight control, compared to 220 neonates of 619 women (35.5%) treated with less-tight control (RR 0.87 (95%CI 0.74 to 1.02)) (Figure 9). The risk difference was -0.05 (95%CI -0.10 to 0.01) between groups.
Figure 9 Preterm birth < 37 weeks, comparison tight (diastolic blood pressure < 85 mmHg) versus less-tight (diastolic blood pressure < 100 mmHg)
Level of evidence of the literature
According to GRADE, randomized controlled trials (RCTs) start at a high level of evidence.
The level of evidence regarding the outcome measure pre-eclampsia was downgraded by one level to ‘moderate’ because of imprecision (the 95% confidence interval crossed the line of no (clinically relevant) effect).
The level of evidence regarding the outcome measure eclampsia was downgraded by two levels to ‘low’ because of imprecision (no events).
The level of evidence regarding the outcome measure pulmonary oedema was downgraded by two levels to ‘low’ because of imprecision (low number of events, wide 95%CI).
The level of evidence regarding the outcome measure hepatic haemorrhage could not be assessed as no studies reported the outcome. Proxy outcome hepatic failure and hepatic haematoma/ rupture/ dysfunction were downgraded by two levels to ‘low’ because of imprecision (no events).
The level of evidence regarding the outcome measure renal insufficiency could not be assessed as no studies reported the outcome. Proxy outcome renal failure was downgraded by two levels to ‘low’ because of imprecision (low number of events, wide 95%CI).
The level of evidence regarding the outcome measure cerebral haemorrhage could not be assessed as no studies reported the outcome. Proxy outcome transient ischemic attack or stroke was downgraded by two levels to ‘low’ because of imprecision (low number of events, wide 95%CI).
The level of evidence regarding the outcome measure placental abruption was downgraded by two levels to ‘low’ because of imprecision (low number of events, wide 95%CI).
The level of evidence regarding the outcome measures intra-uterine death and neonatal death were downgraded by two levels to ‘low’ because of imprecision (low number of events, wide 95%CI).
The level of evidence regarding the outcome measure neonatal death was downgraded by two levels to ‘low’ because of imprecision (low number of events, wide 95%CI).
The level of evidence regarding the outcome measure NICU admission was downgraded by three levels to ‘very low’ because of inconsistency (El Guindy, 2008 suggests there is no difference in NICU admission between groups; Magee, 2007 suggests there might be a difference) and imprecision (the 95% confidence interval crossed the line of no (clinically relevant) effect).
The level of evidence regarding the outcome measure high level neonatal care >48 hours was downgraded by two levels to ‘low’ because of imprecision (the 95% confidence interval crossed the line of no (clinically relevant) effect).
The level of evidence regarding the outcome measure low birth weight for gestational age was downgraded by one level to ‘moderate’ because of imprecision (the 95% confidence interval crossed the line of no (clinically relevant) effect).
The level of evidence regarding the outcome measure preterm birth <37 weeks was downgraded by one level to ‘moderate’ because of imprecision (the 95% confidence interval crossed the line of no (clinically relevant) effect).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
what is the effect of ‘tight control’ (defined as diastolic blood pressure < 85 mmHg) compared with ‘loose control’ (diastolic blood pressure < 100 mmHg) in pregnant patients with hypertensive disorders on maternal and perinatal outcomes?
P: pregnant patients with hypertensive disorders;
I: tight control: diastolic blood pressure < 85 mmHg;
C: loose control: diastolic blood pressure < 100 mmHg;
O: maternal outcome measures: pre-eclampsia, eclampsia, pulmonary oedema, hepatic haemorrhage, renal insufficiency, cerebral haemorrhage, placental abruption; Perinatal outcome measures: perinatal death (intra-uterine death and neonatal death), NICU admission, low birth weight for gestational age, preterm birth < 37 weeks.
Relevant outcome measures
The guideline development group considered eclampsia as a critical outcome measure for decision making; and pre-eclampsia, pulmonary oedema, hepatic haemorrhage, renal insufficiency, cerebral haemorrhage, placental abruption, perinatal death (intra-uterine death and neonatal death), NICU admission, low birth weight for gestational age, preterm birth < 37 weeks as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above, but used the definitions used in the studies.
For the outcome measures eclampsia, pulmonary oedema, hepatic haemorrhage, renal insufficiency, cerebral haemorrhage, placental abruption, perinatal death (intra-uterine death and neonatal death), and preterm birth any statistically significant difference was considered as a clinically important difference between groups.
For all other outcome measures, the GRADE default- a difference of 25% in the relative risk for dichotomous outcomes (Schünemann, 2013) and 0.5 standard deviation for continuous outcomes - was taken as a minimal clinically important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until October 3rd, 2019. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 164 hits. Studies were selected based on the following criteria:
- the study population had to meet the criteria as defined in the PICO;
- intervention as defined in the PICO;
- original research or systematic review.
Thirty-three studies were initially selected based on title and abstract screening. After reading the full text, 30 studies were excluded (see the table with reasons for exclusion under the tab Methods) and 3 studies were included.
Results
Three randomized controlled trials (RCTs) were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence table. The assessment of the risk of bias is summarized in the risk of bias table.
Referenties
- Abalos E, Duley L, Steyn DW, Gialdini C. Antihypertensive drug therapy for mild to moderate hypertension during pregnancy. Cochrane Database Syst Rev. 2018 Oct 1;10(10):CD002252.
- ACOG. Hypertension in pregnancy. The American College of Obstetricians and Gynaecologists. 2013
- Ahmed RJ, Gafni A, Hutton EK, Hu ZJ, Pullenayegum E, von Dadelszen P, Rey E, Ross S, Asztalos E, Murphy KE, Menzies J, Sanchez JJ, Ganzevoort W, Helewa M, Lee SK, Lee T, Logan AG, Moutquin JM, Singer J, Thornton JG, Welch R, Magee LA. The Cost Implications of Less Tight Versus Tight Control of Hypertension in Pregnancy (CHIPS Trial). Hypertension. 2016 Oct;68(4):1049-55.
- Butalia S, Audibert F, Côté AM, Firoz T, Logan AG, Magee LA, Mundle W, Rey E, Rabi DM, Daskalopoulou S, Nerenberg KA. Hypertension Canada’s 2018 guidelines for the management of hypertension in pregnancy. Can J Cardiol 2018 May;34(5):526-531Magee LA, von Dadelszen P, Chan S, Gafni A, Gruslin A, Helewa M, Hewson S, Kavuma E, Lee SK, Logan AG, McKay D, Moutquin JM, Ohlsson A, Rey E, Ross S, Singer J, Willan AR, Hannah ME; CHIPS Pilot Trial Collaborative Group. The Control of Hypertension In Pregnancy Study pilot trial. BJOG. 2007 Jun;114(6):770, e13-20.
- El Guindy AA, Nabhan AF. A randomized trial of tight versus. less tight control of mild essential and gestational hypertension in pregnancy. J Perinat Med. 2008;36(5):413-8.
- Magee LA, von Dadelszen P, Rey E, Ross S, Asztalos E, Murphy KE, Menzies J, Sanchez J, Singer J, Gafni A, Gruslin A, Helewa M, Hutton E, Lee SK, Lee T, Logan AG, Ganzevoort W, Welch R, Thornton JG, Moutquin JM. Less-tight versus tight control of hypertension in pregnancy. N Engl J Med. 2015 Jan 29;372(5):407-17.
- Magee LA, Rey E, Asztalos E, Hutton E, Singer J, Helewa M, Lee T, Logan AG, Ganzevoort W, Welch R, Thornton JG, von Dadelszen P. Management of non-severe pregnancy hypertension - A summary of the CHIPS Trial (Control of Hypertension in Pregnancy Study) research publications. Pregnancy Hypertens. 2019 Oct;18:156-162.
- NICE. Hypertension in pregnancy: diagnosis and management NICE guideline (NG133). https://www.nice.org.uk/guidance/ng133. Published 25 June 2019.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy - otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question: what is the effect of ‘tight control’ (defined as diastolic blood pressure < 85 mmHg) compared with ‘loose control’ (diastolic blood pressure < 100 mmHg) in pregnant patients with hypertensive disorders on maternal and perinatal outcomes?
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of bias table for intervention studies (randomized controlled trials)
Research question: what is the effect of ‘tight control’ (defined as diastolic blood pressure < 85 mmHg) compared with ‘loose control’ (diastolic blood pressure < 100 mmHg) in pregnant patients with hypertensive disorders on maternal and perinatal outcomes?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
El Guindy, 2008 |
Computer-generated randomization list and contained in a set of consecutively numbered sealed opaque envelopes |
Unlikely |
Unlikely, although participants were not blinded it is not suspected that this affected the outcome. |
Unlikely |
Unlikely, those assessing the outcomes, whether in the laboratory or in the neonatology department, were blinded to group assignment. |
Unlikely |
Unclear, there was minimal loss to follow-up in both groups (n=2/ n=3). |
Unlikely, intention-to-treat was not violated |
|
Magee, 2007 |
Consenting women were randomised to less tight or tight control of BP using random permuted blocks of variable size and a toll-free 24-hour centrally controlled computerised randomisation service (at the Data Coordinating Centre, Maternal, Infant and Reproductive Health Research Unit). |
Unlikely |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely, loss to follow-up was minimal, 1 woman was lost to follow-up with regard to perinatal and maternal outcomes in the tight control group. |
Unlikely. |
|
Magee, 2015 |
Method of randomization was reported as follows: “performed in permuted blocks of random size (2 or 4) by site coordinators at a central site, with the use of a toll-free telephone line (Centre for Mother, Infant, and Child Research, University of Toronto) that was accessible 24 hours a day and backed up by a pager system. The assignment sequence was generated by a programmer who used SAS software, version 9.2 (SAS Institute); the sequences were secured and available only to the system manager, and the telephone line was password protected. Eligible women were randomly assigned in a 1:1 ratio”. |
Unlikely |
Unlikely |
Unlikely |
The primary and secondary outcomes were adjudicated centrally by an expert committee whose members were unaware of the group assignments and were not involved in the care of patients in the cases under review |
Unlikely |
Unlikely, loss to follow-up was minimal in both groups, reasons reported.
One site (in which 43 women were enrolled) was excluded before the analyses on the advice of the CHIPS steering committee and the data and safety monitoring board owing to concerns about informed consent and data integrity.
|
Unlikely.
“Thirteen women assigned to less-tight control and 11 women assigned to tight control were reported to have discontinued their assigned blood-pressure treatment before delivery; they were included in the analyses according to their assigned group”
“After enrollment, 8 women in the less-tight-control group and 13 in the tight-control group were found to have been ineligible, but they all remained in the study” |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Ahmed 2016 |
Voldoet niet aan PICO (kijkt naar uitkomstmaat kosten) |
|
Auteur onbekend 2015 |
Guideline |
|
Bramham 2013 |
Narrative review |
|
Cairns 2017 |
Voldoet niet aan PICO (postpartum management) |
|
Carr 2006 |
Voldoet niet aan PICO. (diabetische nefropathie en andere definitie van tight/loose control) |
|
Coroyannakis 2019 |
Narrative review |
|
Easterling 2016 |
Editorial comment |
|
Jackson 2017 |
Narrative review |
|
James 2004 |
Narrative review |
|
Karthikeyan 2007 |
Narrative review |
|
Kattah 2013 |
Narrative review |
|
Kilpatrick 2016 |
Voldoet niet aan PICO (kijkt niet naar effect streefbloeddruk of iets dergelijks |
|
Luitjes 2018 |
Voldoet niet aan PICO (implementatie van richtlijnen) |
|
Magee 1999 |
Narrative review |
|
Magee 2007 |
Voldoet niet aan PICO (analyse ervaring deelnemers CHIPS) |
|
Magee 2007 |
? |
|
Magee 2009 |
Narrative review |
|
Magee 2012 |
Voldoet niet aan PICO (protocol paper CHIPS-CHILD trial) |
|
Magee 2016 |
Voldoet niet aan PICO (post hoc analyse CHIPs effect ernstige hypertensie) |
|
Magee 2016 |
Voldoet niet aan PICO (secundaire analyse CHIPS trial over labetalol of methyldopa op uitkomsten CHIPS trial) |
|
Magee 2016 |
Voldoet niet aan PICO (secundaire analyse CHIPS trial over labetalol of methyldopa) |
|
Magee 2016 |
Voldoet niet aan PICO (Secundaire analyse CHIPS trial over voorspellende factoren (zoals hoge bloeddruk) voor bijwerkingen (moeder en kind)) |
|
Magee 2018 |
Voldoet niet aan PICO (kijkt naar uitkomstmaten groei van het kind 12 maanden na geboorte) |
|
Masoura 2012 |
Narrative review |
|
Nabhan 2008 |
Oudere versie Nabhan 2011 |
|
Nabhan 2011 |
Cochrane review bevat tussentijdse publicatie van Magee (2007/2009), niet uiteindelijke publicatie in 2015. Andere geïncludeerde studie voldoet niet aan PICO (andere streefwaarden) |
|
Nzelu 2018 |
Voldoet niet aan PICO (geen vergelijking van streefwaarden) |
|
Pels 2018 |
Voldoet niet aan PICO (secundaire analyse CHIPS trial over tijdstip antihypertensieve therapie) |
|
Podymow 2008 |
Narrative review |
|
Podymow 2017 |
Narrative review |
|
Vidler 2016 |
Voldoet niet aan PICO (ervaringen deelnemers CHIPS trial) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 14-06-2021
Beoordeeld op geldigheid : 22-07-2021
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Streefbloeddruk |
NVOG |
2020 |
2025 |
Elke 2 jaar |
NVOG |
Nieuwe literatuur |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Deze richtlijn is ontwikkeld in samenwerking met:
- Patiëntenfederatie Nederland
Doel en doelgroep
Doel
Deze richtlijn beoogt een leidraad te geven voor de dagelijkse praktijk van de zorg van zwangere vrouwen met een hypertensieve aandoening. De richtlijn bespreekt niet de indicaties voor het beëindigen van de zwangerschap op maternale indicatie, maar beperkt zich bij de behandeling tot de medicamenteuze behandeling.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die aan de ontwikkeling van de richtlijn hebben bijgedragen. Deze staan vermeld bij de samenstelling van de werkgroep. Tot de beroepsgroepen die geen zitting hadden in de werkgroep, maar wel beoogd gebruikers zijn van deze richtlijn behoren o.a. klinisch verloskundigen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor vrouwen met hypertensieve aandoeningen in de zwangerschap.
Werkgroep
- Dr. C.J. (Caroline) Bax, gynaecoloog-perinatoloog, werkzaam in het Amsterdam UMC locatie AMC, NVOG, voorzitter stuurgroep.
- Dr. S.V. (Steven) Koenen, gynaecoloog, werkzaam in het ETZ, locatie Elisabeth Ziekenhuis, NVOG, lid stuurgroep.
- Dr. Duvekot, gynaecoloog, werkzaam in het Erasmus MC, NVOG, lid stuurgroep.
- Dr. M.A. (Marjon) de Boer, gynaecoloog-perinatoloog, werkzaam in het Amsterdam UMC, locatie VUmc, NVOG.
- Dr. A.T. (Titia) Lely, gynaecoloog, werkzaam in het UMC Utrecht, NVOG.
- Dr. P.J. (Petra) Hajenius, gynaecoloog-perinatoloog, werkzaam in het Amsterdam UMC locatie AMC, NVOG.
- Dr. J.W.(Wessel) Ganzevoort, gynaecoloog-perinatoloog, werkzaam in het Amsterdam UMC locatie AMC, NVOG.
- Dr. O.W.H. (Olivier) van der Heijden, gynaecoloog-perinatoloog, werkzaam in het Radboud UMC Nijmegen, NVOG.
- MSc F.M. (Fenna) van der Molen, verloskundige, werkzaam in praktijk Veilige Geboorte, KNOV.
- Dr. M.C. (Mignon) van der Horst, klinisch verloskundige, werkzaam in de Gelderse Vallei Ede, KNOV.
- Mw. A.M.M. (Annemijn) Doppenberg, MSc, adviseur, Patiëntenfederatie Nederland.
- Mw. J.C. (Anne) Mooij, MSc, adviseur, Patiëntenfederatie Nederland.
- Mw. K.L.H.E. (Kim) VandenAuweele, beleidsmedewerker HELLP Stichting.
Meelezers
- Leden van de Otterlo - werkgroep (2020)
Met ondersteuning van
- Dr. A. (Anne) Bijlsma-Rutte, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. L. (Laura) Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.A.C. (Marleen) van Son, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- MSc Y. (Yvonne) Labeur, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bax (voorzitter stuurgroep) |
Gynaecoloog-perinatoloog Amsterdam UMC, locatie AMC, 0,8 fte |
Gastvrouw Hospice Xenia Leiden (onbetaald) |
|
geen |
|
Duvekot (lid stuurgroep) |
Gynaecoloog, Erasmus MC (full time) |
Directeur 'medisch advies en expertise bureau Duvekot', Ridderkerk, ZZP'er |
|
geen |
|
Koenen (lid stuurgroep) |
gynaecoloog, ETZ , Tilburg |
incidenteel juridische expertise (betaald) |
|
geen |
|
de Boer |
gynaecoloog-perinatoloog AUMC, locatie Vumc |
geen |
|
geen |
|
Hajenius |
Gynaecoloog (1.0 fte), afdeling Obstetrie Amsterdam Universitair Medische Centra (AUMC), locatie Meibergdreef (AMC). |
geen nevenwerkzaamheden |
De module Geboortezorg - Hypertensieve aandoeningen zal in de praktijk worden vertaald naar een lokaal protocol voor de afdeling Obstetrie van het AUMC waar ik werkzaam ben en de lokale protocollen beheer. In die zin zullen naaste collega's (artsen, klinisch verloskundigen en arts assistenten) "baat" hebben bij de uitkomsten van de module. |
geen |
|
Lely |
Gynaecoloog WKZ |
off-road commissie lid ZonMw (onkostenvergoeding, onbetaald) |
|
geen |
|
Van der Heijden |
Gynaecoloog, perinatoloog |
Lid multidisciplinaire richtlijn commissie (NVOG): |
|
geen |
|
Ganzevoort |
Gynaecoloog , Amsterdam UMC |
Redacteur NTOG, onbetaald |
Ik ben PI van enkele ZonMW gefinancierde studies bij foetale groeirestrictie en centrum-contactpersoon voor enkele andere pre-eclampsie studies. Binnen die studies wordt ook door Roche Diagnostics materiaal in-kind ter beschikking gesteld. Er zijn door het bedrijf hieraan geen inhoudelijke voorwaarden gesteld, op geen enkel vlak. |
geen actie, de richtlijnmodules doen geen uitspraak over welke testapparatuur/-methode gehanteerd moet worden voor het bepalen van proteïnurie, alleen dat men dit middels het eiwit-kreatinine ratio doet. |
|
van der Horst |
Klinisch verloskundige, ziekenhuis Gelderse Vallei, Ede |
PKV, KNOV vacatievergoeding |
|
geen |
|
van der Molen |
eerstelijns verloskundige, KNOV |
Ledenraad Eerstelijns Verloskundigen Amsterdam Amstelland (EVAA) - afwisselend voorzitter, notulist en algemeen lid - onbetaald Commissie Kwaliteit en onderzoek EVAA - afwisselend voorzitter, notulist en algemeen lid - onbetaald |
|
geen |
|
van Son |
Beleidsmedewerker KNOV |
Niet van toepassing |
|
geen |
|
Van den Auweele |
Beleidsmedewerker Hellp Stichting |
|
|
geen |
|
Ensink |
Medior adviseur patiëntbelang Patiëntenfederatie |
Niet van toepassing |
|
geen |
|
Mooij |
adviseur Patientenbelang, Patientenfederatie Nederland |
Niet van toepassing |
|
geen |
|
Doppenberg |
adviseur Patientenbelang, Patientenfederatie Nederland |
Niet van toepassing |
|
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van patiëntvertegenwoordigers van verschillende patiëntverenigingen voor de Invitational conference en afvaardigen van patiëntenverenigingen in de clusterwerkgroep. Het verslag hiervan is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie per module ook ‘Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)’. De conceptrichtlijn wordt tevens ter commentaar voorgelegd aan de betrokken patiëntenverenigingen.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor vrouwen met hypertensieve aandoeningen in de zwangerschap. Tevens zijn er knelpunten aangedragen door patiëntenverenigingen tijdens de Invitational conference. Een verslag hiervan is opgenomen in de bijlagen.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule wordt aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule wordt aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) 1990-okt 2019
|
1 exp Pregnancy/ or exp Pre-Eclampsia/ or exp Hypertension, Pregnancy-Induced/ or exp HELLP Syndrome/ or eclamp*.ti,ab,kw. or preeclamp*.ti,ab,kw. or 'pre-eclamp*'.ti,ab,kw. or preclamp*.ti,ab,kw. or (hypertens* adj3 (pregnan* or gestational or maternal)).ti,ab,kw. or hellp.ti,ab,kw. (878191) 2 ('tight control' or 'tight-control' or 'management of hypertension' or 'maintenance of hypertension' or 'control of hypertension' or 'hypertens* control' or 'hypertens* maintenance' or 'hypertens* management').ti,ab,kw. (13391) 3 1 and 2 (426) 4 limit 3 to (english language and yr="1990 -Current") (320) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (412705) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1900040) 7 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3270791) 8 4 and 5 (21) 9 (4 and 6) not 8 (61) 10 (4 and 7) not (8 or 9) (49) 11 8 or 9 or 10 (131) =131 (67 uniek) |
164 |
|
Embase 1990-okt 2019
|
'pregnancy'/exp/mj OR 'eclampsia and preeclampsia'/exp/mj OR 'maternal hypertension'/exp/mj OR 'hellp syndrome'/exp/mj OR eclamp*:ti,ab OR preeclamp*:ti,ab OR 'pre-eclamp*':ti,ab OR preclamp*:ti,ab OR ((hypertens* NEAR/3 (pregnan* OR gestational OR maternal)):ti,ab) OR hellp:ti,ab
AND
'tight control':ti,ab OR 'tight-control':ti,ab OR 'management of hypertension':ti,ab OR 'maintenance of hypertension':ti,ab OR 'control of hypertension':ti,ab OR 'hypertens* control':ti,ab OR 'hypertens* maintenance':ti,ab OR 'hypertens* management':ti,ab
AND
(english)/lim AND (1990-2019)/py NOT 'conference abstract':it
Gebruikte filters: Sytematische reviews ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)
RCT’s ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it
Observationeel onderzoek 'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)
= 98 (97 uniek) |
