Magnesiumsulfaat bij hypertensieve aandoeningen
Uitgangsvraag
Wanneer dient MgSO4 gegeven te worden bij hypertensie in de zwangerschap?
- Wat is de effectiviteit van behandeling met magnesiumsulfaat bij een pre-eclampsie in de zwangerschap ten aanzien van het voorkomen van insulten bij de moeder?
- Wat zijn de bijwerkingen van gebruik van magnesiumsulfaat voor de moeder?
- Wat is de effectiviteit van magnesiumsulfaat bij het kind?
- Wat zijn de bijwerkingen van gebruik van magnesiumsulfaat voor het kind direct postpartum?
Aanbeveling
Bij behandeling van eclampsie is magnesiumsulfaat het middel van eerste keus.
Vrouwen met een ernstige PE behoren behandeld te worden met magnesiumsulfaat om de kans op een eclamptisch insult te verminderen.
Bij matige PE kan behandeling met magnesiumsulfaat overwogen worden.
Moeders die behandeld worden met magnesiumsulfaat dienen gezien de bijwerkingen geprotocolleerd gecontroleerd te worden.
Overwegingen
- Magnesiumsulfaat lijkt veilig voor moeder en kind. De voordelen bij de moeder wegen ruimschoots op tegen de mogelijk geringe en voorbijgaande bijwerkingen bij het kind. Gezien het duidelijke bewijs bestaat er geen twijfel dat een protocol voor het gebruik van magnesiumsulfaat bij (pre-)eclampsie in elke verloskundige afdeling paraat moet zijn en gebruikt dient te worden.
- In de Magpie Trial was bij ernstige en symptomatische pre-eclampsie het number needed to treat (NNT) 40 terwijl dit in de gehele groep circa 100 was. Aannemende dat vrijwel alle vrouwen met eclampsie daarvoor pre-eclamptische klachten hebben, kan men er voor kiezen om pas bij klachten te behandelen. Magnesium is wel veilig indien geprotocolleerd toegediend, maar de bijwerkingen zijn aanzienlijk.
- Stabilisatie bij ernstige (pre-)eclampsie bestaat uit toediening van magnesium en behandeling van hypertensie (systolisch > 160 mmHg of diastolisch > 110 mmHg). Na eclampsie of niet goed te stabiliseren ernstige PE wordt meestal besloten de graviditeit te beëindigen. Indien na eclampsie goede stabilisatie mogelijk is en de zwangerschapsduur < 30 weken kan overwogen worden af te wachten tot inwerking van de corticosteroïden, en eventueel langer als de matemale conditie duidelijk verbeterd. In 2011 gaat in Nederland de TOTEM-studie van start. Dit is een gerandomiseerde multicenterstudie waarin onderzocht wordt of bij vrouwen met ernstige pre- eclampsie bij een zwangerschapsduur tussen 28 en 34 weken, gestreefd moet worden naar beëindiging of temporiseren van de zwangerschap (http://www.studies-obsgyn.nl/totem).
- Een goede hoge initiële dosering en ook weer op tijd staken van deze behandeling zijn belangrijk voor het voorkomen van complicaties. Uiteraard hoort dit samen te gaan met snelle en adequate behandeling van hypertensie om verdere complicaties te voorkomen. Bij normale nierfunctie, kortdurende behandeling (24 uur) en aanwezig blijven van achilles- of kniepeesreflexen is het bepalen van serumspiegels niet nodig. Bij eclampsie behoort het beëindigen van de zwangerschap na stabilisatie van de moeder overwogen te worden. Bij recidiverende convulsies die niet meer reageren op magnesiumsulfaat kan anesthesie met intubatie uitkomst bieden, maar forse hypertensie tijdens intubatie dient vermeden te worden. De stollingsstatus van de moeder moet hierbij ook niet vergeten worden.
- De patiëntenfocusgroep geeft aan dat informatievoorziening rondom de medicatie over het algemeen summier is en wordt gebracht vanuit wetenschappelijk oogpunt. Zoals eerder genoemd, is er meer behoefte aan informatievoorziening gericht op de patiënt. Patiënten beseffen dat de medicatie nodig is, maar zouden wel graag goed geïnformeerd zijn. Er is goede ervaring met informatie op schrift, bijvoorbeeld ook over de medicatie en bijwerkingen.
Onderbouwing
Achtergrond
In deze module bespreken we de effectiviteit van behandeling met magnesiumsulfaat voor zowel moeder als kind, bij de behandeling van pre-eclampsie. Bovendien komen de bijwerkingen voor beiden aan bod. Voor deze module is gebruikgemaakt van bestaande richtlijnen uit het Verenigd Koninkrijk (NICE guideline 2010, RCOG guideline 2005), de Verenigde Staten (ACOG guideline 2002), Canada (SOGC guideline 2008) en Australië en Nieuw-Zeeland (SOMANZ guideline 2009). Bovendien is in de Cochrane library en in Pubmed gezocht naar relevante studies.
Conclusies / Summary of Findings
|
Niveau 1 |
Het is aangetoond dat bij vrouwen met eclampsie, behandeling met magnesiumsulfaat gedurende 24 uur het risico op een recidief eclamptisch insult substantieel verlaagt.
A1 (Duley 2003) |
|
Niveau 1 |
Het is aangetoond dat bij vrouwen met pre-eclampsie, behandeling met magnesiumsulfaat het risico op het ontstaan van een eclamptisch insult halveert. Het number needed tot treat om 1 eclamptisch insult te voorkomen door te behandelen met magnesiumsulfaat is: Bij ernstige PE 50 (95%-BI 34-100) Bij matige PE 118 (95%-BI 77-255).
A1 (Duley 2003), A2 (Magpie Trial Follow-Up Study Collaborative Group 2002) |
|
Niveau 2 |
Bekende bijwerkingen van magnesiumsulfaat zijn: Voor moeder: Flushing, misselijkheid en braken, spierzwakte, respiratoire nood, dorst, hoofdpijn, hypotensie of palpitaties of tachycardie, duizeligheid, slaperigheid of verwarring, jeuk of tintelingen en branderigheid en pijn bij de insteekopening/injectieplaats. A2 (Magpie Trial Follow-Up Study Collaborative Group 2002)
Voor kind: Met de huidige doseringen bij de moeders lijken er geen aanwijzingen voor risico’s op het kind te zijn. Zelden worden symptomen gezien als spierzwakte en voorbijgaande respiratoire depressie en voedingsproblemen. |
Samenvatting literatuur
1. Wat is de effectiviteit van behandeling met magnesiumsulfaat bij een hypertensieve crisis/pre-eclampsie in de zwangerschap?
(Zie ook pag. 143 NICE-richtlijn)
De effectiviteit van magnesiumsulfaat bij de behandeling van ernstige hypertensie/pre-eclampsie is het beste onderzocht in een meta-analyse uit 2003 (Duley 2003). Deze studie toonde dat bij vrouwen met ernstige of matige pre-eclampsie, behandelen met magnesiumsulfaat significant beter was in het voorkomen van eclampsie dan geen behandeling of placebo. Zes studies (11.444 vrouwen) vergeleken magnesiumsulfaat met placebo of geen anticonvulsivum. Het risico op eclampsie was bij behandeling met magnesiumsulfaat meer dan gehalveerd (RR 0,41, 95%-BI 0,29-0,58; NNT 89 (gecorrigeerde berekening, 95%-BI 50-100) ten opzichte van de controlegroep. Er was echter geen significant verschil in andere uitkomsten, waaronder maternale sterfte en ernstige maternale morbiditeit (gecombineerde uitkomstmaten, waaronder nierfalen, hartstilstand, leverfalen, beroerte, coagulopathie en ademdepressie) (Duley 2003).
Een goed uitgevoerde economische analyse vond dat magnesiumsulfaat vergeleken met placebo bovendien kosteneffectief was in het voorkomen van eclampsie, bij vrouwen met pre-eclampsie. De kosteneffectiviteit verbeterde naarmate de ernst van de pre-eclampsie toenam (Simon 2006).
Magnesiumsulfaat versus diazepam (pag. 143 NICE-richtlijn, en tabel 5.1)
Een cochranereview onderzocht het effect van magnesiumsulfaat (intramusculair of intraveneus) in vergelijking tot diazepam, bij vrouwen met eclampsie (op het moment van inclusie; ante- of postpartum) (Duley 2003). Het behandelingsschema bestond uit een oplaaddosis en onderhoudstherapie.
Zeven RCT’s werden geïncludeerd (n = 1441 vrouwen), waarvan de belangrijkste bijdrage werd geleverd door the Collaborative Eclampsia Trial (910 van de 1441 vrouwen, 63%). In geen van de studies kon worden geblindeerd na randomisatie, vanwege het type interventie (Collaborative Eclampsia Trial 1992). Bij behandeling van vrouwen met eclampsie met magnesiumsulfaat was, in vergelijking met diazepam, de maternale sterfte en de kans op een recidiefinsult lager (maternale sterfte: 6 RCT’s, n = 1336: RR = 0,59, 95%-BI 0,37-0,94; recidief van convulsies: 7 RCT’s, n = 1441: RR = 0,44, 95%-BI 0,34-0,57) (tabel 5.1a). Neonaten van vrouwen die behandeld werden met magnesiumsulfaat hoefden significant minder vaak opgenomen te worden op special care baby units (SCBU) (3 RCT’s, n = 718: RR = 0,66, 95%-BI 0,46-0,95) of geïntubeerd te worden direct postpartum (2 RCT’s, n = 591: RR = 0,67, 95%-BI 0,45-1,00), vergeleken met kinderen die geboren werden nadat hun moeder met diazepam behandeld was.
Bovendien hadden de kinderen uit de magnesiumsulfaatgroep significant minder vaak een apgarscore < 7 na 1 minuut (2 RCT’s, n = 597: RR = 0,75, 95%-BI 0,65-0,87) en na 5 minuten postpartum (2 RCT’s, n = 597: RR = 0,72, 95%-BI 0,55-0,94) (tabel 5.1b).
Tabel 5.1 Magnesiumsulfaat voor eclampsie; (a) maternale uitkomsten; (b) foetale uitkomsten
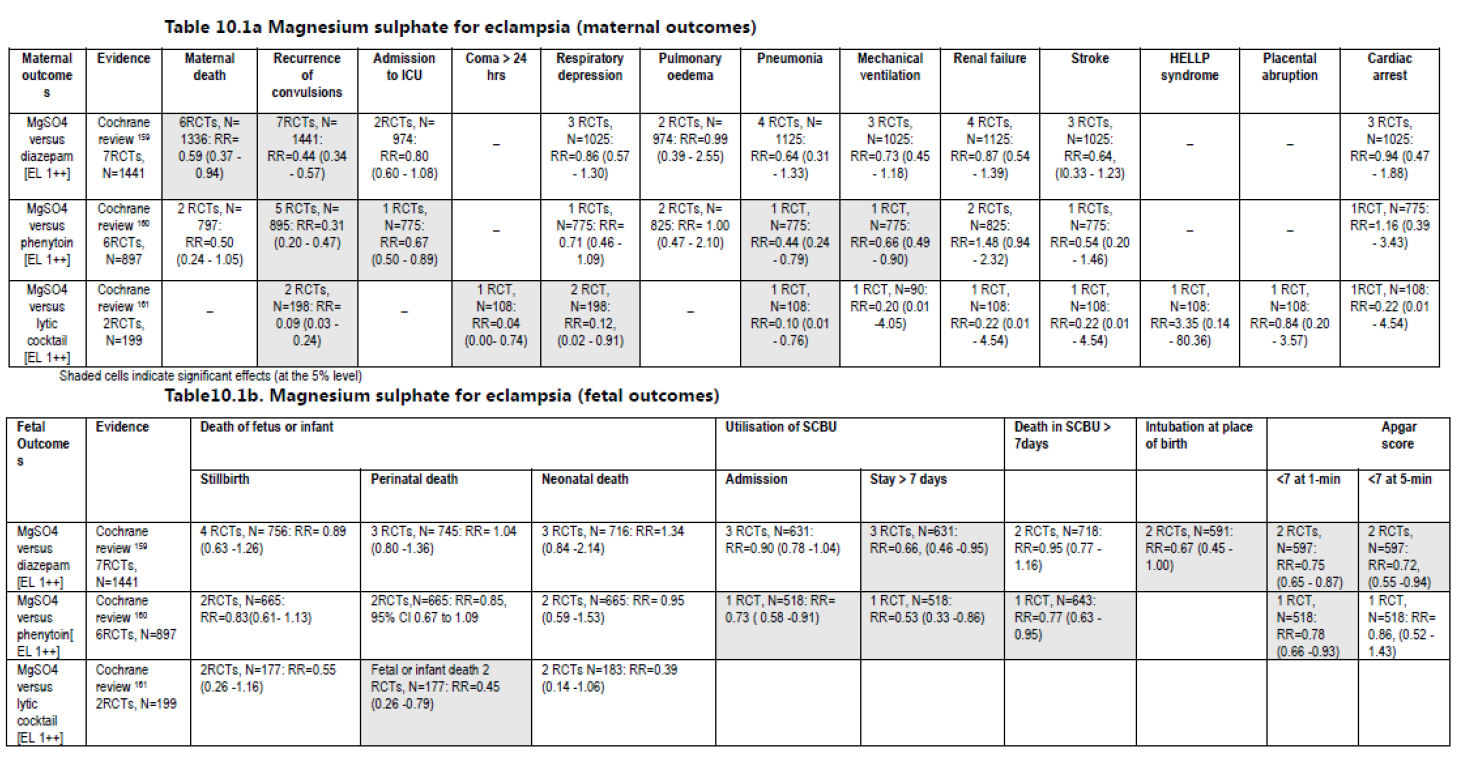
(Bron: NICE-richtlijn Hypertension and pregnancy)
2. Wat zijn de bijwerkingen van gebruik van magnesiumsulfaat voor de moeder?
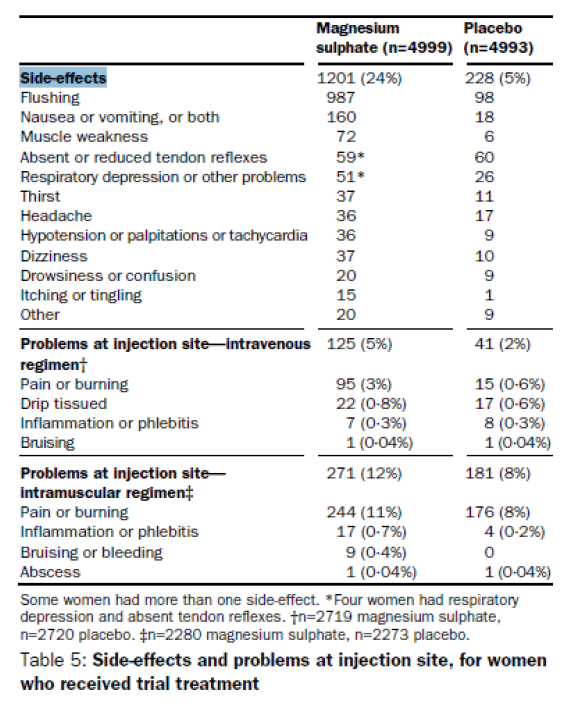
In de Magpie Trial deed men onderzoek naar de bijwerkingen van magnesiumsulfaat (zie tabel 5.2) (Altman 2002). In totaal rapporteerden 1201 van de 4999 (24%) vrouwen die in de magnesiumgroep gerandomiseerd waren bijwerkingen, tegenover 228 van de 4993 (5%) vrouwen uit de placebogroep. Meer vrouwen ervoeren bijwerkingen van de intramusculaire dan van de intraveneuze toediening (i.m.:637 van de 2280 (28%), vs 109 van de 2273 (5%); i.v.: 564 van de 2719 (20%), vs 119 van de 2720 (4%)). Het hebben van opvliegers was de meest gerapporteerde bijwerking en kwam vaker voor bij de i.m. toediening (i.m. 24 vs 2%; i.v. 16 vs 2%). Er was weinig verschil tussen de toedieningsvormen voor de bijwerking misselijkheid of braken (i.m. 3 vs 0,2%; i.v.: 4 vs 0,5%). Respiratoire depressie kwam weinig voor, maar wel significant vaker in de magnesiumsulfaat- dan in de placebogroep (1,0 vs 0,5%; RR 1,98, 95%-BI 1,24-3,15). Magnesiumsulfaat hing samen met een lichte verhoging van het risico op het uitvoeren van een sectio ceasarea (RR 1,05, 95%-BI 1,01-1,10). Ernstige onverwachte complicaties werden gerapporteerd bij 6 vrouwen uit de magnesiumsulfaatgroep en bij 3 vrouwen uit de placebogroep. Bij de magnesiumsulfaatgroep bestonden deze problemen uit lokale irritatie door tijdens de toediening van magnesiumsulfaat via het infuus (2 vrouwen), foetale hartactie gestopt (1 kind), beroerte (1 vrouw), hartstilstand (1 vrouw), en pulmonaal oedeem (1 vrouw). Bij de placebogroep ging het om anafylactische shock (1 vrouw), hartstilstand (1 vrouw) en beroerte (1 vrouw) (Altman 2002). Uit een vervolgstudie bleek er na twee jaar geen verschil meer in ongunstige uitkomsten voor de moeders (Magpie Trial Follow-Up Study Collaborative Group 2007).
Tabel 5.2 Dosering magnesiumsulfaat voor voorkomen van eclamptisch insult (Magpie 2002, Chames 2002)
|
|
Dosering |
Tijd |
|
Oplaaddosering |
4-6 g = 20-30 ml |
in 10-30 min |
|
Onderhoudsdosering |
1 g = 5 ml |
in 60 min |
|
Bij herhaald insult extra (maximaal 2 x) |
2 g = 10 ml |
in 5 min |
Bij het volgen van dit schema, het stoppen van de behandeling na 24 uur en een normale nierfunctie bestaat er geen noodzaak tot bepaling van bloedspiegels (Oplossing : 20% magnesiumsulfaat, intraveneus toedienen met infuuspomp.
In zeldzame gevallen blijven insulten optreden ondanks adequate behandeling met magnesiumsulfaat. Wegens gevaar van ademhalingsdepressie wordt afgeraden om, nadat tweemaal een extra bolus van 2 g is gegeven, de toediening van magnesiumsulfaat nog meer te verhogen als de bloedspiegel onbekend is. Aanvullende bloeddrukverlaging kan noodzakelijk zijn. Eventueel kan lorazepam 4 mg langzaam i.v. gegeven worden, of kan patiënte verder gesedeerd en geïntubeerd worden.
- In principe kan na 24 uur de toediening van magnesiumsulfaat gestaakt worden.
- Bij overdosering 10 ml calciumlevulaat of calciumgluconaat (= 1 g) in 5 minuten intraveneus.
- Bij behandeling volgens het standaardschema en adequate urineproductie is controle van de bloedspiegel niet noodzakelijk.
3. Wat is de effectiviteit van magnesiumsulfaat voor het kind?
Eén grote RCT (Magpie Trial, n = 7927) onderzocht de langetermijneffecten van magnesiumsulfaat toediening bij pre-eclampsie in een cohort vrouwen uit de oorspronkelijke trial (n = 3375) (follow-up 2 jaar) en hun kinderen (follow-up 18 maanden) (Magpie Trial Follow-Up Study Collaborative Group 2007). Er werd geen significant verschil gevonden in primaire uitkomstmaten (mortaliteit of niet aangeboren neurosensorische handicaps bij kinderen van moeders die met magnesiumsulfaat werden behandeld, of met placebo (245/1635 versus 233/1648: RR = 1,10, 95%-BI 0,93-1,29). Een subgroepanalyse naar de ernst van de pre-eclampsie toonde consistente resultaten voor alle groepen (Magpie Trial Follow-Up Study Collaborative Group 2007). Voor magnesiumsulfaat op foetale indicatie (neuroprotectief effect) bij dreigende vroeggeboorte wordt verwezen naar de multidisciplinaire richtlijn dreigende vroeggeboorte (NVOG 2011, in afwachting van publicatie).
4. Wat zijn de bijwerkingen van magnesiumsulfaat voor het kind?
Antenataal kan magnesiumsulfaat leiden tot een lichte daling in de basale foetale hartfrequentie en een verminderde variabiliteit van deze hartfrequentie. Beide zijn echter klinisch niet van betekenis (Atkinson 1994, Hallak 1999). De gecombineerde data van de vijf genoemde RCT’s uit de cochranereview naar het neuroprotectieve effect van magnesiumsulfaat, geven geen aanwijzingen voor een verhoogd risico op foetale, neonatale mortaliteit. Ook werd er geen significant verschil gezien in beide groepen voor wat betreft aanhoudende respiratoire ondersteuning, intraventriculaire bloedingen, periventriculaire leukomalacie, apgarscore 5 minuten postpartum onder de 7, neonatale insulten, hypotonie, of zuurstofbehoefte bij een gemiddelde leeftijd van 28 dagen en een gemiddelde zwangerschapsduur van 36 weken (Doyle 2009).
Incidenteel worden bij kinderen van moeders die met magnesiumsulfaat behandeld zijn mogelijk tekenen van hypermagnesiëmie (Mg > 1,2 mmol/l) gezien. De symptomen treden meestal pas op bij Mg-serumwaarden > 2,5 mmol/l. Symptomen kunnen zijn: spierzwakte en daardoor minder goed doorademen, sloomheid, flushing en daarbij hypotensie, voedingsproblemen. Meestal zijn deze symptomen gering, zelden ernstig.
In de normale zwangerschap wordt tegen het einde van de zwangerschap 4,5-6 mg magnesium per dag over de placenta getransporteerd door een actief transportmechanisme. Bij iatrogene hypermagnesiëmie is de foetus onbeschermd en kan zijn spiegel dus flink stijgen, hetgeen eventueel gevolgen kan hebben voor het calcium- en parathormoonmetabolisme, met soms een op rachitis gelijkend beeld tot gevolg. Daar staat tegenover dat magnesiumsulfaat neuroprotectief zou kunnen zijn voor m.n. ‘very low birth weight ’ (VLBW)-prematuren en er zijn in de ruim 25 jaar dat dit middel gebruikt wordt weinig bijwerkingen gerapporteerd (hoofdstuk 11).
Tot voor kort werden doseringen gebruikt van 6 g als oplaaddosis, gevolgd door 2 g/uur als continu-infuus; het huidige beleid is 4 g oplaaddosis gevolgd door 1 g/uur. Bij de oude dosering werden bij de moeder spiegels rond de 2,5-2,6 mmol/l verkregen. Bij een aantal kinderen geboren in de Isala klinieken bleek bij controle van hun spiegel een een-op-eenrelatie te bestaan vlak na de geboorte waardoor spiegels van 2,6 mmol/l werden gemeten. De kinderen waren verminderd actief c.q. reactief met minder goed doorademen, maar hadden geen tensieproblemen. In de weinige artikelen die er over gebruik bij kinderen zijn (Groenendaal 2002, Levene 1995) wordt gestreefd naar een spiegel van dezelfde orde van grootte (2,4-2,5 mmol/l) in een poging om verbetering te bewerkstelligen bij hypoxisch ischemische encefalopathie. In de studie van Levene werd bij een hoge dosering hypotensie waargenomen, (400 mg/kg eenmalig) en er werd ook respiratoire depressie gemeld.
In de periode na de geboorte wordt voor kinderen met persisterende pulmonale hypertensie van de pasgeborene (PPHN) ook het gebruik van MgSO4 beschreven in doseringen van 200 mg/kg als oplaaddosis, gevolgd door 50-150 mg/kg/uur met als gewenste spiegels 5-7 mmol/l, maar hier is het effect van verlaging van de (pulmonale) bloeddruk juist gewenst.
Conclusie: met de huidige doseringen bij de moeders lijken er geen aanwijzingen voor risico’s bij het kind te zijn, anders dan een voorbijgaande respiratoire depressie.
Tijdsduur behandeling
In de in het voorgaande geciteerde studies werd in het algemeen de behandeling na 24 uur gestaakt. Continuering van de behandeling versus staken na 24 uur is nooit onderzocht. Aangezien vaak na stabilisatie van de bloeddruk en kortdurende magnesiumbehandeling de klinische situatie beduidend verbetert, en de bijwerkingen het maternale welbevinden beïnvloeden, lijkt het rationeel de behandeling na 24 uur te staken, zoals in de boven beschreven studies. Bij opnieuw verslechteren van de PE kan opnieuw gestart worden met magnesiumbehandeling. Bij herhaalde ernstige PE verdient het de voorkeur de zwangerschap te beëindigen.
Contra-indicaties
Gebruik van magnesiumsulfaat is gecontraïndiceerd bij vrouwen met myasthenia gravis. Bovendien dient toediening te worden vermeden bij vrouwen met een bekende hartaandoening (hartfalen, verminderde linker ventrikel functie) of hartgeleidingsstoornis vanwege het negatief inotrope effect. Aangezien magnesiumsulfaat door de nieren wordt uitgescheiden, kunnen vrouwen met een nieraandoening een magnesiumstapeling en daardoor al bij de gebruikelijke onderhoudsdosering toxiciteit ontwikkelen. Er dient bij deze patiënten dus rekening te worden gehouden met de onderhoudsdosering. Als bijwerking van een overdosis magnesiumsulfaat zijn vooral bekend respiratoire depressie/ademstilstand en hypotensie en AV-blok/hartstilstand (in de interne geneeskunde o.a. ook bekend van drenkelingen uit de Dode Zee: deze zee bevat naast veel zout enorm hoge concentraties magnesium). Bij minder hoge dosis kunnen ecg- veranderingen waarneembaar zijn (verlenging PQ-interval en bij hogere dosis verlenging van het QRS- complex) (Agus 1991, Kulick 1988) (zie tabel 5.3).
Tabel 5.3 Aanbevolen en toxische bloedspiegels magnesiumsulfaat
|
Bloedspiegels Aanbevolen waarde:
Bij intoxicatie:
|
(bron: Richtlijn hypertensie NVOG)
Referenties
- ACOG. ACOG practice bulletin. Diagnosis and management of preeclampsia and eclampsia. Number 33, January 2002. American College of Obstetricians and Gynecologists. Int J Gynaecol Obstet 2002; Apr;77(1):67-75.
- Agus ZS, Morad M. Modulation of cardiac ion channels by magnesium. Annu Rev Physiol 1991;53:299- 307.
- Altman D, Carroli G, Duley L, Farrell B, Moodley J, Neilson J, et al. Do women with pre-eclampsia, and their babies, benefit from magnesium sulphate? The Magpie Trial: a randomised placebo-controlled trial. Lancet 2002; Jun 1;359(9321): 1877-90.
- Atkinson MW, Belfort MA, Saade GR, Moise KJ, Jr. The relation between magnesium sulfate therapy and fetal heart rate variability. Obstet Gynecol 1994; Jun;83(6):967-70.
- Collaborative Eclampsia Trial. Which anticonvulsant for women with eclampsia? Evidence from the Collaborative Eclampsia Trial. Lancet 1995; Jun 10;345(8963):1455-63.
- Doyle LW, Crowther CA, Middleton P, Marret S, Rouse D. Magnesium sulphate for women at risk of preterm birth for neuroprotection of the fetus. Cochrane Database Syst Rev 2009;(1):CD004661.
- Duley L, Gulmezoglu AM, Henderson-Smart DJ. Magnesium sulphate and other anticonvulsants for women with pre-eclampsia. Cochrane Database Syst Rev 2003;(2):CD000025.
- Duley L, Henderson-Smart D, Meher S. Altered dietary salt for preventing pre-eclampsia, and its complications. Cochrane Database Syst Rev 2005;(4):CD005548.
- Duley L, Henderson-Smart D. Magnesium sulphate versus diazepam for eclampsia. Cochrane Database Syst Rev 2003;(4):CD000127.
- Duley L, Henderson-Smart DJ, Meher S. Drugs for treatment of very high blood pressure during pregnancy. Cochrane Database Syst Rev 2006;3:CD001449.
- Duley L. Pre-eclampsia, eclampsia, and hypertension. Clin Evid (Online) 2008;2008.
- Groenendaal F, Rademaker CM, Toet MC, de Vries LS. Effects of magnesium sulphate on amplitude- integrated continuous EEG in asphyxiated term neonates. Acta Paediatr 2002;91(10): 1073-7.
- Hallak M, Martinez-Poyer J, Kruger ML, Hassan S, Blackwell SC, Sorokin Y. The effect of magnesium sulfate on fetal heart rate parameters: A randomized, placebo-controlled trial. Am J Obstet Gynecol 1999; Nov;181(5 Pt 1): 1122-7.
- Kulick DL, Hong R, Ryzen E, Rude RK, Rubin JN, Elkayam U, et al. Electrophysiologic effects of intravenous magnesium in patients with normal conduction systems and no clinical evidence of significant cardiac disease. Am Heart J 1988; Feb;115(2):367-73.
- Levene M, Blennow M, Whitelaw A, Hanko E, Fellman V, Hartley R. Acute effects of two different doses of magnesium sulphate in infants with birth asphyxia. Arch Dis Child Fetal Neonatal Ed 1995; Nov;73(3):F174-F177.
- Nederlandse Vereniging voor Obstetrie en Gynaecologie. Hypertensieve aandoeningen in de zwangerschap. Richtlijnen NVOG 2005Available from: URL: http://nvog- documcntcn.nl/indcx.php?pagina = /richtlijn/pagina.php&fSelectTG 62 = 75&fSelectedSub = 62&fSelectedParent = 75
- NICE guideline. National Institute for Health and Clinical Excellence. Hypertension in pregnancy the management of hypertensive disorders during pregnancy.
- RCOG guideline. Royal College of Obstetricians and Gynaecologists. The management of severe pre- eclampsia/eclampsia. Royal College of Obstetricians and Gynaecologists 2006Available from:URL: http://www.rcog.org.uk/files/rcog-corp/uploaded- files/GT10aManagementPreeclampsia2006.pdf
- Simon J, Gray A, Duley L. Cost-effectiveness of prophylactic magnesium sulphate for 9996 women with pre-eclampsia from 33 countries: economic evaluation of the Magpie Trial. BJOG 2006; Feb;113(2):144-51.
- SOGC guideline. Magee LA, Helewa M, Moutquin JM, von Dadelszen P. Diagnosis, Evaluation, and Management of the Hypertensive Disorders of Pregnancy.
- SOMANZ guideline. Lowe SA, Brown MA, Dekker GA, Gatt S, McLintock CK, McMahon LP, et al. Guidelines for the management of hypertensive disorders of pregnancy 2008. Aust N Z J Obstet Gynaecol 2009; Jun;49(3):242-6.
- Magpie Trial Follow-Up Study Collaborative Group. The Magpie Trial: a randomised trial comparing magnesium sulphate with placebo for pre-eclampsia. Outcome for women at 2 years. BJOG 2007; Mar;114(3):300-9.
- Magpie Trial Follow-Up Study Collaborative Group. The Magpie Trial: a randomised trial comparing magnesium sulphate with placebo for pre-eclampsia. Outcome for children at 18 months. BJOG 2007; Mar; 114(3):289-99.
Evidence tabellen
|
Referentie |
Type studie |
In- en exclusie-criteria (studie/ patiënten) |
Kenmerken (studie/ patiënten) |
Interventie (I) |
Controle (C) |
Uitkomstmaten en follow-up duur |
Resultaten |
Opmerkingen |
Bewijs-niveau |
|
Duley 2003 |
Cochrane systematische review, meta- analyse N=11444 vrouwen (6 studies) Doel: evalueren van het effect van anticonvulsiva bij pre-eclampsie op zowel de vrouwen als de kinderen |
Inclusie: RCT’s die anticonvulsiva vergelijken met placebo of geen anticonvulsiva of een ander anticonvulsivum bij vrouwen emt pre-eclampsie. Quasi gerandomiseerde trials werden geëxcludeerd. Populatie: vrouwen met PE, onafhankelijk van of dit voor of na de bevalling is en of het een eenling of meerling zwangerschap is, en of de patient al eerder een behandeling met anticonvulsiva heeft gehad. eview. |
- |
N=5722 Behandeling met een magnesiumsulfaat |
N=5722 Placebo, geen behandeling of een ander anticonvulsivum (phenytoine, diazepam, nimodipine, methyldopa) |
Voor alle vrouwen: eclampsie, ernstige morbiditeit als gevolg van PE of gebruik van anticonvulsiva (zoals nierfalen, hartstilstand, lever falen, beroerte, coagulopathie en ademdepressie) en gebruik van zorgsystemen (zoals dialyse, beademing, opname op de IC, opnameduur). |
6 studies vergeleken magnesiumsulfaat met placebo of geen anticonvulsivum. Het risico op eclampsie was meer dan de helft lager in de magnesiumsulfaat groep RR 0,41 95%-BI 0,29- 0.58; NNT 100 95% BI 50-100. Het risico op sterfte was niet significant verlaagd met 46% bij de vrouwen in de magnesium groep (RR 0,54 95%-BI 0,261,10). Voor ernstige maternale morbiditeit RR 1,08 95%-BI 0,89-1,32. Bijwerkingen werden significant vaker gerapporteerd in de magnesium groep (24% versus 5%; RR 5,26 95%-BI 4,59- 6,03; NNT voor harm = 6, 95%-BI 6-5). De meest voorkomende bijwerking was het optreden van opvliegers. Het risico op abruptio van de placenta was lager in de magnesiumgroep (RR 0,64 95%-BI 0,50-0.83; NNT 100, 95% BI 501000). Vrouwen in de magnesium groep hadden een iets verhoogd risico (5%) op een sectio (95%-BI 1% - 10%). Er was geen verschil in het risico op perinatale sterfte (RR 1,04 95%-BI 0,93-1,15). |
Randomisatie: + Toewijzing verborgen:+ Behandelaar geblindeerd: + Patiënt geblindeerd: + Effectbeoordelaar geblindeerd:+ Interventie- en controlegroep vergelijkbaar:+ Follow-up voldoende (^80%):+ Intention-to-treat analyse:+ Financiering: geen conflict Geplande subgroepanalyse op ernst van de PE |
A1 |
|
Magpie 2002 |
RCT (multicenter) N=10141 vrouwen |
Inclusie: Vrouwen met pre- eclampsie waarbij twijfel bestond over wel of niet behandelen met magnesiumsulfaat. Vrouwen met een eenling of meerling zwangerschap. Eerdere behandeling met een anticonvulsivum was toegestaan. Overige criteria: de vrouw was nog niet bevallen of was <24 uur postpartum; bloeddruk was 90 mm Hg diastolisch of 140 mm Hg systolisch of meer bij minimaal 2 onafhankelijke metingen; proteïnurie was > 1+ . Exclusie: vrouwen met overgevoelgheid voor magnesium, een hepatisch coma, risico op nierfalen, of myastenia gravis. Vrouwen met oligurie (mictie <25 mL/uur) werden geïncludeerd, maar de hoeveelheid medicatie werd gehalveerd bij elke dosis. |
175 2e en 3e lijns ziekenhuisen in 33 landen. Interventie: -Maternale lftd: 27,1 ±6.7 -Primipara: 2604 (52%) -ernstige PE: 1303 (26%) Controle: -Maternale lftd: 27,2 ±6.7 -Primipara: 2591 (51%) -ernstige PE: 1349 (27%) |
N=5068 Magnesiumsulfaat, oplaaddosis van 4 g (verdund en gedurende 10-15 min i.v. toegediend), gevolgd door onderhoudsdosering van 1 g/uur (totaal 24 uur). Indien zorgverlener intramusculaire toediening prefereert is dat ook toegestaan. |
N=5068 Identieke placebo |
Primair: Eclampsie Voor vrouwen die gerandomiseerd werden voor de bevalling waren de uitkomstmaten verder nog perinatale mortaliteit voor ontslag. Maternale sterfte was niet gespecificeerd als primaire uitkomstmaat (onvoldoende power) Lange termijn follow up (aparte studie) Secundair: Ernstige maternale morbiditeit (ademdepressie, pneumonie, hartstilstand, coagulopathie, nierfalen, leverfalen, pulmonaal oedeem, hersenbloeding, toxiciteit, staken behandeling door bijwerkingen, andere bijwerkingen, een samengestelde uitkomstmaat. Overige extra uitkomstmaten zijn terug te lezen in het artikel |
Bijwerkingen: 1201 van de 4999 (24%) vrouwen uit de magnesium groep versus 228 van de 4993 (5%) van de placebo groep. Eclampsie: Magnesium groep had een 58% lager risico op eclampsie (95%- BI 40-71) dan de placebo groep (40; 0,8%, vs 96; 1,9%; 11 vrouwen met eclampsie minder per 1000 vrouwen. Maternale mortaliteit: Lager in de magnesium groep (RR 0,55 95%-BI 0,26-1,14). Neonatale mortaliteit: niet significant verschillend in beide groepen (576; 12,7% vs 558; 12,4%; RR 1,02; 99% BI- 0,92-1,14). Abruptio placentae: significant lager in magnesium groep (RR 0,67; 99% BI 0,45-0,89). |
Randomisatie: + Toewijzing verborgen:+ Behandelaar geblindeerd: + Patiënt geblindeerd: + (10 patienten uiteindelijk toch ingelicht door omstandigheden) Effectbeoordelaar geblindeerd:+ Interventie- en controlegroep vergelijkbaar:+ Follow-up voldoende (^80%):+ (99,7%) Intention-to-treat analyse:+ Financiering: geen conflict |
A2 |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 11-06-2014
Beoordeeld op geldigheid : 01-01-2011
Uiterlijk in 2014 bepaalt het bestuur van de Nederlandse Vereniging voor Obstetrie en Gynaecologie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Obstetrie en Gynaecologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante nieuwe ontwikkelingen.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door de Orde van Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Deze richtlijn beoogt een leidraad te geven voor de dagelijkse praktijk van de zorg van zwangere vrouwen met een hypertensieve aandoening. De richtlijn bespreekt niet de indicaties voor het beëindigen van de zwangerschap op maternale indicatie, maar beperkt zich bij de behandeling tot de medicamenteuze behandeling.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die aan de ontwikkeling van de richtlijn hebben bijgedragen. Deze staan vermeld bij de samenstelling van de werkgroep. Tot de beroepsgroepen die geen zitting hadden in de werkgroep, maar wel beoogd gebruikers zijn van deze richtlijn behoren o.a. klinisch verloskundigen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2009 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de diagnostiek en behandeling van hypertensieve aandoeningen in de zwangerschap. Omdat dezelfde werkgroep ook betrokken was bij het ontwikkelen van de multidisciplinaire aanbevelingen rondom het onderwerp ‘spontane dreigende vroeggeboorte’, is in deze werkgroep ook de medische microbiologie vertegenwoordigd.
De werkgroepleden zijn door de wetenschappelijke verenigingen gemandateerd voor deelname aan deze werkgroep.
Samenstelling van de werkgroep:
- Prof. dr. B.W. Mol, gynaecoloog, Academisch Medisch Centrum, Amsterdam (voorzitter)
- Dr. F.A.B.A. Schuerman, kinderarts, Flevoziekenhuis, Almere
- Dr. R.A. van Lingen, kinderarts, Isala-Klinieken, Zwolle
- Dr. A.H.L.C. van Kaam, kinderarts, Academisch Medisch Centrum, Amsterdam
- Dr. P.H. Dijk, kinderarts, Universitair Medisch Centrum Groningen, Groningen
- Mw. dr. L.M. Kortbeek, medisch microbioloog, RIVM, Bilthoven
- Dr. B.J.H. van den Born, internist, Academisch Medisch Centrum, Amsterdam
- Dr. G.D. Mantel, gynaecoloog, Isala-Klinieken, Zwolle
- Dr. J.J.H.M. Erwich, gynaecoloog, Universitair Medisch Centrum Groningen, Groningen
- Dr. H. Wolf, gynaecoloog, Academisch Medisch Centrum, Amsterdam
- Ir. T.A. van Barneveld, klinisch epidemioloog, Orde van Medisch Specialisten, Utrecht
- Mw. drs. M. Wiegerinck, arts-onderzoeker en richtlijnondersteuner, Nederlandse Vereniging voor Obstetrie en Gynaecologie, Utrecht
Met dank aan: dr. ir. A. Ravelli, Epidemioloog, Academisch Medisch Centrum, Amsterdam, voor het uitvoeren van de data analyse uit de Perinatale Registratie Nederland.
Belangenverklaringen
Geen van de werkgroepleden hebben belangen aan te geven. De originele belangenverklaringen zijn op te vragen bij het secretariaat van de NVOG. De inhoud van de conclusies en aanbevelingen uit deze (concept)richtlijn werd onafhankelijk opgesteld van en niet beoordeeld door de financier van deze richtlijn, de Stichting Kwaliteitsgelden Medisch Specialisten.
(Voorbeeld formulieren bij aanverwante producten)
Inbreng patiëntenperspectief
Voor de ontwikkeling van een kwalitatief goede richtlijn is de input van patiënten nodig. Een behandeling moet immers voldoen aan de wensen en eisen van patiënten en zorgverleners. Patiënten kunnen zorgverleners die een richtlijn ontwikkelen helpen om te begrijpen hoe het is om met een ziekte of aandoening te leven of om er mee geconfronteerd te worden. Op deze manier kan bij het ontwikkelen van een richtlijn beter rekening gehouden worden met de betekenis van verschillende vormen van diagnostiek, behandeling en zorg voor patiënten. Het in kaart brengen van de behoeften, wensen en ervaringen van patiënten met de behandeling biedt tevens de gelegenheid om de knelpunten in kaart te brengen. Wat zou er volgens patiënten beter kunnen? Een patiënt doorloopt het hele zorgtraject, een behandelaar ziet vaak slechts het stukje behandeling waarin hij of zij zich heeft gespecialiseerd. Het is dus heel zinvol om voor verbetering van de kwaliteit van de behandeling ook knelpunten vanuit patiëntenperspectief in kaart te brengen. Bij deze richtlijn is er in de beginfase van de richtlijnontwikkeling een knelpuntenanalyse door middel van een groepsinterview met twee verschillende patiëntengroepen (focusgroepen) gedaan. In de eerste focusgroep waren vrouwen vertegenwoordigd met een hypertensieve aandoening zonder vroeggeboorte. In de tweede focusgroep waren vrouwen aanwezig met een hypertensieve aandoening en bovendien een vroeggeboorte. Een verslag van de focusgroepbijeenkomsten is besproken in de werkgroep en de belangrijkste knelpunten zijn geadresseerd in de richtlijn. Niet alle genoemde knelpunten waren direct van toepassing op deze richtlijn, derhalve wordt verwezen naar de focusgroepverslagen voor het totale overzicht (zie hieronder). De hier voorliggende conceptrichtlijn is voor commentaar voorgelegd aan deelnemers van de focusgroepgesprekken.
focusgroepgesprek hypertensieve aandoening van 17 april 2010.
Doel van het focusgroepgesprek
Vanuit het patiëntenperspectief inzichtelijk maken hoe de zorg aan vrouwen, die een hypertensieve aandoening tijdens de zwangerschap hebben, patiënt gerichter kan.
Deelneemsters aan het focusgroepgesprek
In samenwerking met de stichting HELLP, een patiëntenvereniging specifiek voor deze doelgroep, werden deelnemers benaderd en geselecteerd. Alleen patiënten bij wie de bevalling minder dan 5 jaar geleden had plaatsgevonden, werden geïncludeerd. Er namen in totaal 7 vrouwen deel, van wie er 6 het HELLP-syndroom hadden gehad, en 1 pre-eclampsie. Ten tijde van het gesprek was één vrouw (opnieuw) zwanger.
De gespreksstructuur
Het gesprek werd gestructureerd door chronologisch het zorgproces door te spreken: de begeleiding in de vroege zwangerschap, het moment waarop bekend werd dat sprake was van een hypertensieve aandoening, de verdere zwangerschapsbegeleiding, de partus, het kraambed en de nazorg. De belangrijkste aandachtspunten worden in dit verslag uitgelicht, gegroepeerd naar bovenstaande zorgmomenten.
Algemene punten, voor verbetering van het multidisciplinaire zorgproces
Informatievoorziening in de vroege zwangerschap (voor optreden van klachten)
1. Informatievoorziening over de ernstige gevolgen die hypertensieve aandoeningen in de zwangerschap kunnen hebben.
a. Het merendeel van de deelnemers geeft aan dat zij, voordat de problemen waren opgetreden, niet van de verloskundige hadden gehoord wat (alarm)symptomen waren van hypertensieve aandoeningen in de zwangerschap. De meesten hadden dit toch graag al in een eerder stadium (rond 20 weken) vernomen, zodat ze de klachten hadden kunnen herkennen. Er wordt bediscussieerd dat deze informatieverstrekking niet moet leiden tot onnodige ongerustheid.
b. Deelnemers geven aan dat zij van de zorgverlener verwachten dat zij al vanaf het begin van de zwangerschap oplettend zijn ten aanzien van aanwezige risicofactoren van een patiënt voor het ontwikkelen van een hypertensieve aandoening in de zwangerschap.
2. Een aantal deelnemers is op de hoogte van de blocnotejes met de alarmsymptomen van hypertensieve aandoeningen in de zwangerschap, die sinds enkele maanden worden verspreid door de stichting HELLP, NVOG en KNOV. Zij vinden dit een goed initiatief. Een deelnemer heeft de ervaring dat de verloskundige bij haar praktijk hier niet aan mee wilde werken omdat zij het te confronterend zou vinden voor de patiënten.
De eerste klachten
3. De eerste uitingen van de hypertensieve aandoening waren voor iedereen verschillend. Genoemd worden vooral hoge bloeddruk zonder klachten (toevallig bij controle), sterretjes zien, hoofd- en buikpijn, erge buikpijn met bandgevoel en braken. Deelnemers met klachten hadden dit in sommige gevallen al eerder aangegeven aan de verloskundige, waarbij de klacht niet direct herkend werd (bijv. doordat de bloeddruk de dag ervoor nog goed was).
a. De deelnemers benoemen dat het belangrijk is dat verloskundigen/overige zorgverleners goed op de hoogte zijn van alarmsymptomen, alert zijn, doorvragen en laagdrempelig verwijzen.
4. Opgemerkt wordt dat patiënten zelf ook vaak de neiging hebben om klachten te bagatelliseren (‘je wilt niet zeuren’): ‘dit straal je ook uit naar behandelaar die een besluit moet maken o.b.v. de input die jij geeft.’ Deelnemers vinden het belangrijk dat de zorgverlener zich dat realiseert en dus doorvraagt.
De verdere begeleiding van de zwangerschap
5. Niet bij alle consulten werd proteïnurie of labonderzoek bepaald (deelnemer had bij ondergrens van 90 mmHg toch HELLP ontwikkeld).
6. Meer tijd voor informatievoorziening (‘Al is het maar 10 minuten’) wanneer de diagnose wordt gesteld, om uit te leggen in wat voor situatie je als patiënt terecht bent gekomen en wat de risico’s zijn. Vooral omdat de meeste vrouwen zich helemaal niet ziek voelen, maar er wel gezegd wordt dat ze heel ziek zijn. Dit geeft veel onrust. De uitleg zou helder en rustig verstrekt moeten worden aan zowel patiënt als partner.
a. Op de vraag wie dit zou moeten doen, wordt in eerste instantie wisselend gereageerd. De gynaecoloog is vaak druk, dus misschien zou er iemand voor vrijgemaakt kunnen worden, zoals een verpleegkundige. Na enige discussie is er eenduidigheid: de deelnemers geven de absolute voorkeur aan de directe zorgverlener door wie ze ook in het verdere traject begeleid zullen worden (bij voorkeur de gynaecoloog).
b. Gedoseerde informatievoorziening, gegeven op het moment dat het voor de betreffende patiënt goed begrijpelijk is.
c. Frequent herhalen van informatie.
d. Vaste zorgverleners om naar te vragen. Het wordt steeds lastiger om te concentreren met alle medicatie. structuur is dan belangrijk
e. ‘Partner is vaak ogen en oren’ van patiënt. en ook voor de partner is het heel heftig. Erg belangrijk om deze erbij te betrekken.
f. Er moet betrouwbare informatie zijn waarnaar verwezen wordt. bijvoorbeeld vanaf de website van de NVOG.
g. Informatievoorziening rondom de medicatie is over het algemeen summier. en informatie wordt gebracht vanuit wetenschappelijk oogpunt. Meer behoefte aan informatievoorziening gericht op de patiënt. Patiënten beseffen dat de medicatie nodig is. maar zouden wel graag goed geïnformeerd zijn. Goede ervaring met informatie op schrift. bijvoorbeeld ook over de medicatie en bijwerkingen
7. Patiënten worden zeer regelmatig geprikt. Graag praktisch mee blijven denken over een oplossing zoals bloed via het infuus afnemen. om latere complicaties en klachten te voorkomen.
Partus
8. Er is weinig goede ervaring met inleiden van de baring. Een langdurig proces is zeer onwenselijk. vooral gezien de algemene conditie van de moeder. Graag meer mogelijkheid hierover te spreken met de arts en de individuele situatie van de patiënt te blijven beoordelen.
9. Veel onduidelijkheid en onrust rondom de keuze om niet direct een keizersnede te doen bij deze zieke patiënten. De algemene opvatting heerst dat artsen erg ‘tegen’ het uitvoeren van een keizersnee zijn. Een aantal had graag een sectio gehad omdat ze zo moe. uitgeput en ziek waren. Deze deelnemers misten een goed gesprek met de zorgverlener over dit punt; het was vaak niet duidelijk waarom een vaginale bevalling nou zoveel voordelen had (boven dat het ‘natuurlijk’ was). Deelnemers waren over het algemeen graag beter geïnformeerd hierover en zouden meer betrokken willen zijn bij de afweging. Dit blijkt een terugkerend discussiepunt.
Kraamperiode
10. Risico op eclamptisch insult postpartum.
a. Rust voor moeder is heel belangrijk. Het zou mogelijk moeten zijn om de baby ’s nachts even apart te leggen. Er zou dus een keuze moeten zijn of je je kind wel of niet bij je wilt houden.
b. De patiënt zou in ieder geval meer tegen overprikkeling beschermd moeten worden. Het zou ook fijn zijn als het bezoek strenger geregeld wordt (‘En nu allemaal eruit! ’), dat is lastig om zelf te doen.
c. Mogelijkheid tot kamer alleen (in overleg met patiënt). De overgang van verloskamer/medium care/intensive care naar kraamafdeling wordt als groot ervaren.
d. De overgang van ziekenhuis naar huis is soms erg groot. De deelnemers met wie het tijdstip van ontslag besproken werd en in overleg plaatsvond, hebben hiermee zeer goede ervaring en zij adviseren dit. Voor deelnemers die ‘naar huis gestuurd werden’, was dit een hele onplezierige ervaring, leidend tot stress.
Nazorg
11. Nazorg is heel belangrijk.
a. Een nagesprek met de zorgverleners (degene die je begeleid heeft tijdens de ziekenhuisperiode) is van belang, waarbij specifiek wordt ingegaan op de hypertensieve aandoening, hoe het proces verlopen is en waarom bepaalde beslissingen genomen werden. Als daar behoefte aan is, kan een bezoek aan de verloskamer onderdeel uitmaken van de verwerking.
b. Deelnemers achten het van belang dat extra hulpverlening wordt aangeboden (psycholoog, maatschappelijk werk).
c. Belangrijk is ook in ieder geval om de werksituatie van een vrouw te bekijken (wanneer hervatten?) en eventueel de rol van de bedrijfsarts.
d. Er zijn deelnemers die het medisch dossier hebben opgevraagd of aangeboden hebben gekregen en hier positief over zijn. Dit zou wat extra houvast kunnen bieden.
e. Het is belangrijk om de mogelijkheid te bieden dat als je vragen hebt over een tweede zwangerschap, je daarover in gesprek kunt gaan. Er is over het algemeen veel stress rondom deze afweging, hierbij zou ook meer rekening kunnen worden gehouden met de angsten en voorkeuren van de patiënt (‘Had de gynaecoloog gezegd over een eventuele tweede zwangerschap ‘je krijgt een keizersnee’, dan had ik het misschien wel overwogen.’)
12. Huisarts: Het lijkt niet altijd duidelijk wat de huisarts voor nacontroles moet doen. Het zou fijn zijn als duidelijk was vastgelegd hoe vaak deze controles plaats dienen te vinden, of de nierfunctie bepaald dient te worden, de leverfunctie, proteïnurie, etc. (Twee deelnemers hebben hier zelf actief achteraan moeten gaan, nadat ze erover op internet hadden gelezen).
13. Er is behoefte aan specialistische kraamzorg, door iemand die bekend is met het HELLP- syndroom.
14. Ervaren wordt dat er soms onbegrip is t.a.v. aanhoudende klachten na de kraamperiode, zoals vermoeidheid.
focusgroepgesprek (dreigende) vroeggeboorte van 26 april 2010.
Doel van het focusgroepgesprek
Vanuit het patiëntenperspectief inzichtelijk maken hoe de zorg aan vrouwen met een (dreigende) vroeggeboorte, patiëntgerichter kan.
Deelneemsters aan het focusgroepgesprek
In samenwerking met de Vereniging voor Ouders van Couveusekinderen en de stichting HELLP, werden deelnemers benaderd en geselecteerd. Alleen patiënten bij wie de bevalling minder dan 5 jaar geleden had plaatsgevonden, werden geïncludeerd. Er namen in totaal 7 vrouwen deel, van wie er 2 een spontane vroeggeboorte hadden en 5 een geïnduceerde vroeggeboorte wegens een hypertensieve aandoening. Ten tijde van het gesprek was één van de deelnemers (opnieuw) zwanger.
De gespreksstructuur
Het gesprek werd gestructureerd door chronologisch het zorgproces door te spreken: de begeleiding in de vroege zwangerschap, het moment waarop duidelijk werd dat het kind te vroeg geboren zou worden, de begeleiding tot aan de partus, de partus zelf, het kraambed, en de nazorg. De belangrijkste aandachtspunten worden in dit verslag uitgelicht, gegroepeerd naar bovenstaande zorgmomenten.
Algemene punten, voor verbetering van het multidisciplinaire zorgproces
Informatievoorziening in de vroege zwangerschap (voor optreden van klachten)
- Aan geen van de deelnemers was, voordat complicaties van de zwangerschap optraden, informatie verstrekt over symptomen (zoals van hypertensie) waarop de zwangeren bedacht zouden moeten zijn.
- Deelnemers zijn het erover eens dat er wel behoefte is aan informatie vooraf, maar goed getimed, zonder dat er angst ontstaat, en met mededeling van de belangrijkste klachten die je in je zwangerschap tegen kan komen.
- De meeste deelnemers zijn op de hoogte van de blocnotejes die sinds enkele maanden door de stichting HELLP (in samenwerking met KNOV en NVOG) worden verstrekt, en waarop alarmsymptomen van hypertensieve aandoeningen vermeld staan. Deze worden als een positieve ontwikkeling gezien.
- Er wordt aangegeven dat zorgverleners zich wel goed moeten realiseren dat veel vrouwen eventuele klachten niet durven aan te geven (‘Ik stel me aan’), of aan kunnen geven omdat ze niet weten wat belangrijke klachten zijn, waardoor het extra van belang is om goed door te vragen. Het is erg belangrijk dat er een goede vertrouwensband is, en voldoende gelegenheid om alles te durven zeggen.
- Niet alleen de zwangeren, maar ook de verloskundigen moeten uiteraard de klachten zoals aangegeven door de vrouwen goed kunnen herkennen.
De begeleiding van de zwangerschap nadat de eerste complicaties opgetreden zijn
- De wens is dat je als patiënt zoveel mogelijk door één persoon gevolgd wordt. Het is belangrijk voor de continuïteit van zorg en voor de vertrouwensband.
- Ook het goed informeren van de partner wordt als zeer belangrijk benoemd. Dat is wisselend gegaan, bij de een beter dan bij de ander. De zwangere is niet altijd even helder van geest door alles wat er gebeurt, en de partner kan dan nog informatie voor patiënte onthouden en herhalen. Ook was er een positieve ervaring van het bijhouden van een dagboek en het maken van foto’s voor de latere verwerking.
- Eenduidige informatie van de verschillende zorgverleners (o.a. verpleegkundigen), om onrust en onzekerheid bij de patiënt te voorkomen. Daarbij ook rekening houdend met de situatie van de vrouw (begrijpt ze wat er verteld wordt?).
- Informatievoorziening over de prognose van het kind werd bij vrijwel alle deelnemers verstrekt door de neonatoloog. Dit werd als erg prettig ervaren. De ene deelnemer had behoefte aan duidelijke rechttoe rechtaan informatie, terwijl andere deelnemers liever een wat genuanceerder gesprek hadden. Er dient dus ook rekening te worden gehouden met het type patiënt. De deelnemers geven aan dat zij voor het gesprek met de neonatoloog nauwelijks informatie over de prognose van het kind hadden gekregen van de gynaecoloog, maar dat zij deze informatie ook niet gemist hebben.
- ‘Het is de arts die je maakt of breekt, zo is het. En je moet maar net die klik hebben. Dat maakt heel veel uit.’
Partus
- Het is essentieel dat je partner erbij kan zijn.
- Duidelijkheid over wanneer de inleiding gaat starten (‘als ze zeggen dat je die dag ingeleid wordt, dat ze dat dan ook doen’). En als de bevalling begint, zet dan ook door.
- Het werd door deelnemers erg gewaardeerd dat de verpleging/artsen zorgde dat er een fototoestel was bij de partus, aangezien zij deze in alle haast vergeten waren (acute situatie). Het is zo belangrijk voor ouders, en dus fijn dat er meegedacht wordt.
Na de bevalling/kraamperiode
- Het wordt als erg belangrijk benoemd dat de partner bij de opvang van het kind mag zijn, en ook bij het installeren op de NICU. Hierdoor kan de partner ook de vrouw inlichten over alles wat er gebeurd en gedaan is. Dat geeft veel rust.
- Er is behoefte aan direct, zo spoedig mogelijk na de bevalling of keizersnee, een gesprek over hoe het is gegaan.
- Er wordt aangegeven dat patiënten het belangrijk vinden dat er nagedacht wordt over op welke kamer, met wat voor patiënten zij worden geplaatst als zij terugkeren naar de afdeling (‘niet naast een blakende baby’). Bij voorkeur in overleg met patiënt (omgekeerd wil bijvoorbeeld ook niet iedereen op een kamer alleen).
- Er zou goede mogelijkheid moeten zijn om je kind op de couveuseafdeling te bezoeken, en dat er niet hoeft te worden gewacht op de partner ’s middags.
- Er is wisselende ervaring met het videosysteem waarmee moeders vanaf de kraamafdeling hun kind op de NICU kunnen zien op scherm. Op zich wordt het als heel prettig ervaren dat je je kind ook vanaf de afdeling kan zien, maar in sommige gevallen kan het ook juist voor onrust zorgen (bijvoorbeeld door de ervaring dat er af en toe een doek over de camera werd gehangen, zonder dat duidelijk was waarom en wat er gebeurde).
- Het gaat uiteindelijk om de menselijke maat. Kijk niet alleen naar de medische problemen, maar ook naar de angst en de zorg eromheen. Want die vrouw is in een roes. Het zou fijn zijn als er een vertrouwenspersoon was, dat zou in principe iedereen kunnen zijn (‘Hoe voel je je, trek je het nog wel’). Als voorbeeld wordt ook gegeven dat het al veel zou schelen als de arts bij de informatievoorziening een stoel zou pakken (zij die daar goede ervaring mee hebben beamen dat).
- Deelnemers verwachten van professionals dat zij rekening houden met belangrijke pijlers voor ouders en hen daarbij betrekken, zoals het eerste badje en eerste flesje. Dat is voor alle ouders belangrijk, maar in ieder geval voor ouders die een heftige situatie rondom de geboorte hebben meegemaakt extra emotioneel.
- Probeer, als een kind van de NICU overgeplaatst moet worden naar een ander ziekenhuis, de ouders op deze overplaatsing voor te bereiden en als zorgverlener bewust te zijn wat dit voor impact op ouders kan hebben.
Nazorg
- De meeste deelnemers hebben ervaren dat er nauwelijks nazorg is. Bij de nacontrole zou meer aandacht moeten zijn voor het bespreken van de gebeurtenissen en hoe het nu gaat, en niet alleen de bloeddruk meten en de wond bekijken. Zo’n nagesprek zou standaard aangeboden moeten worden. Ook voorlichting over wat voor effect zo een ervaring op je kan hebben is belangrijk, zowel geestelijk als lichamelijk met eventueel aanbieden van extra hulpverlening.
- De overgang van ziekenhuis naar huis wordt als groot ervaren. De patiënten bij wie het ontslag in overleg had plaatsgevonden, vonden dit erg prettig. Het ontslaggesprek is ook erg belangrijk.
- Kraamzorg: wanneer kinderen na langdurige opnamen naar huis mogen, wordt er meestal geen kraamzorg meer vergoed, terwijl hier vaak wel veel behoefte aan is.
- Een van de deelnemers heeft in onderzoeksverband wel een nazorgtraject doorlopen, en zij heeft dit als zeer prettig ervaren. Het ging dan vooral om ‘Hoe gaat het? Niet medisch, maar hoe gaat het met jou?’ en ‘Als je je over een jaar niet goed voelt en alles komt weer naar boven, dan is dat normaal, dat hoort erbij ’. Ook een andere deelnemer had een duidelijk nazorgtraject als routinezorg met psychologische begeleiding en maatschappelijk werk, en beoordeelde dit zeer positief. Er werd begeleiding geboden aan het hele gezin. Er wordt geconcludeerd dat dit eigenlijk in ieder ziekenhuis routine zou moeten zijn.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is geprobeerd rekening te houden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Aangezien de gemaakte aanbevelingen niet in een op zichzelf staande richtlijn zullen worden aangeboden, maar geïntegreerd in de nog te ontwikkelen richtlijn over hypertensieve aandoeningen, zal implementatie van deze aanbevelingen afhangen van de implementatie van de nog te maken richtlijnen. Wel zal een samenvatting van het in dit project gemaakte document worden gepubliceerd in het Nederlands Tijdschrift voor Geneeskunde of het Nederlands Tijdschrift voor Obstetrie en Gynaecologie. Bovendien zal het document te downloaden zijn via de website van de Vereniging van Obstetrie en Gynaecologie (www.nvog.nl).
De bestaande NVOG kwaliteitsindicatoren op het gebied van zorg tijdens de zwangerschap blijven van kracht en zijn niet verder aangevuld (zie website www.nvog.nl).
Werkwijze
De werkgroep werkte gedurende 1 jaar aan de totstandkoming van de conceptrichtlijn. De richtlijnondersteuner en werkgroepleden zochten systematisch literatuur en beoordeelden de kwaliteit en inhoud ervan. Zij gingen hierbij uit van de NICE guideline. Vervolgens schreven de richtlijnondersteuner en werkgroepleden een module of submodule voor de conceptrichtlijn, waarin de beoordeelde literatuur werd verwerkt. Tijdens vergaderingen lichtten zij hun teksten toe, dachten mee en discussieerden over andere (sub)modules. De conceptteksten werden aan de betrokken verenigingen aangeboden voor commentaar. De uiteindelijke aangepaste teksten vormen samen de hier voorliggende richtlijn.
Methode richtlijnontwikkeling
Deze (concept)richtlijn is opgesteld aan de hand van het ‘Appraisal of Guidelines for Research & Evaluation’(AGREE)-instrument. Dit instrument is een breed (internationaal) geaccepteerd instrument voor de beoordeling van de kwaliteit van richtlijnen.
Richtlijn van het National Institute for Health and Clinical Excellence (NICE, UK)
Gedurende de periode van richtlijnontwikkeling verscheen de NICE-richtlijn. De methodologische kwaliteit van deze richtlijn werd door de werkgroep als ‘zeer goed’ gekwalificeerd. De werkgroep heeft met toestemming gebruikgemaakt van deze richtlijn om hun eigen onderzoek en suggesties voor de tekst aan te spiegelen. Voor de vragen die zowel in de NICE-richtlijn als in deze richtlijn behandeld worden, zijn de evidencetabellen van de NICE-richtlijn met toestemming (nog achteraangaan) overgenomen.
Strategie voor zoeken naar literatuur
Er werd eerst oriënterend gezocht naar bestaande richtlijnen (https://www.ahrq.gov/ , http://www.nice.org.uk/, SUM searchen http://www.sign.ac.uk/) en naar systematische reviews in de Cochrane Library en via SUMsearch. Indien deze van goede kwaliteit werden geacht (AGREE-methode voor richtlijnen) werd besloten een nieuwe zoekopdracht uit te voeren vanaf de in de studie genoemde einddatum van de zoekopdracht. Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in de elektronische databases PubMed of Medline en Embase (1966-2010). Tevens werd er aanvullend handmatig gezocht naar studies aan de hand van de literatuurlijsten van de opgevraagde artikelen. In eerste instantie werd gezocht naar (systematische reviews of meta-analyses van) gerandomiseerde gecontroleerde onderzoeken (RCT’s). In afwezigheid van RCT’s werd verder gezocht naar prospectieve gecontroleerde onderzoeken, vergelijkende onderzoeken en prospectieve niet-vergelijkende onderzoeken.
Beoordeling van de kwaliteit van studies
Na selectie door de werkgroepleden bleven de artikelen over die als onderbouwing bij de verschillende conclusies staan vermeld. De geselecteerde artikelen zijn vervolgens door de werkgroepleden beoordeeld op kwaliteit van het onderzoek en gegradeerd naar mate van bewijskrachtniveau. Hierbij is de indeling gebruikt zoals weergegeven in tabel 1. De beoordeling van de verschillende artikelen vindt u in de verschillende teksten terug onder andere in de evidencetabellen. De belangrijkste literatuur waarop deze conclusie is gebaseerd, staat bij de conclusie vermeld, inclusief het niveau van bewijskracht (zie tabel 2).
Tabel 1 Indeling van methodologische kwaliteit van individuele studies
|
Bewijskrachtniveau |
Interventieonderzoek |
Onderzoek naar diagnostische accuratesse |
Schade of bijwerkingen, etiologie, prognose |
|
A1 |
systematische review/meta-analyse van ten minste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
||
|
A2 |
gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang |
onderzoek t.o.v. een referentietest (‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van resultaten, met voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
prospectief cohortonderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten |
|
B |
vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (ook patiënt- controleonderzoek, cohortonderzoek) |
onderzoek t.o.v. een referentietest, maar niet met alle kenmerken die onder A2 zijn genoemd |
prospectief cohortonderzoek, maar niet met alle kenmerken als genoemd onder A2 of retrospectief cohortonderzoek of patiënt-controleonderzoek |
|
C |
Niet-vergelijkend onderzoek |
||
|
D |
Mening van deskundigen |
||
Tabel 2 Niveau van bewijskracht van de conclusie op basis van het aan de conclusie ten grondslag liggend bewijs
|
Niveau |
Conclusie gebaseerd op |
|
1 |
onderzoek van niveau A1 of ten minste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2 (Het is aangetoond dat...) |
|
2 |
1 onderzoek van niveau A2 of ten minste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B (Het is aannemelijk dat.) |
|
3 |
1 onderzoek van niveau B of C (Er zijn aanwijzingen dat.) |
|
4 |
mening van deskundigen (De werkgroep is van mening dat.) |
Formuleren van aanbevelingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs vaak nog andere aspecten van belang, zoals patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische aspecten. Bij de overwegingen spelen de ervaring en opvattingen van de werkgroepleden een rol. De ‘aanbevelingen’ geven een antwoord op de uitgangsvraag en zijn gebaseerd op zowel het beschikbare wetenschappelijke bewijs als de belangrijkste overwegingen. De gebruikte methodiek voor richtlijnontwikkeling verhoogt de transparantie van de totstandkoming van de aanbevelingen in deze richtlijn.
