Calciumsuppletie tijdens de zwangerschap
Uitgangsvraag
Wat is de waarde van calciumsuppletie ter preventie van pre-eclampsie en vroeggeboorte?
Aanbeveling
Vraag bij de eerste zwangerschapscontrole van de vrouw de calcium intake uit.
Adviseer zwangere vrouwen met een lage calcium intake om 1 gram calcium per dag in te nemen, ter preventie van pre-eclampsie. Bij voorkeur wordt dit uit de voeding gehaald. Indien dit niet haalbaar is voor de zwangere vrouw, schrijf 1 gram calciumsuppletie voor vanaf 20 weken zwangerschap.
Schrijf bij zwangere vrouwen met een hoog risico op hypertensieve aandoeningen, dat wil zeggen indicatie voor profylactisch laag gedoseerd aspirine, 1 gram calciumsuppletie voor mits de totale dagelijkse calcium intake van 2,5 gram niet wordt overschreden. Start de calciumsuppletie vóór 16 weken zwangerschap.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De literatuuranalyse werd gebaseerd op de Cochrane meta-analyse van Hofmeyr (2018) waarin calciumsuppletie in een hoge dosering (≥ 1 g dagelijks) is vergeleken met calciumsuppletie in een lage dosering (< 1 g dagelijks) voor de uitkomsten pre-eclampsie en vroeggeboorte < 37 weken. Alleen studies die calciumsuppletie sec beschreven (17 van de 27 studies) werden geselecteerd voor de analyse. De analyse is uitgesplitst in van tevoren gedefinieerde subgroepen op basis van het calciumdieet (adequate of lage intake) en het risico van de vrouw op een hypertensieve aandoening in de zwangerschap (laag of hoog risico).
Lage dosis calciumsuppletie (< 1 g dagelijks)
Alle geïncludeerde literatuur over het effect van lage dosis calciumsuppletie (< 1 g dagelijks; 4 trials) betroffen studies met vrouwen met een laag calcium dieet en een laag risico op een hypertensieve aandoeningen. De bewijskracht voor de uitkomstmaten pre-eclampsie en vroeggeboorte was beoordeeld als zeer laag, door een hoog risico op bias (niet gerandomiseerd en geblindeerd onderzoek) en mogelijke publicatiebias. Op basis van de literatuur is het onzeker wat het effect van lage dosis is. Er werd geen literatuur gevonden voor het effect van lage dosis calciumsuppletie bij een adequaat calcium dieet en/of een hoog risico op hypertensieve aandoeningen voor de uitkomstmaat pre-eclampsie. De overall bewijskracht voor behandeling met lage dosis calciumsuppletie (< 1 g dagelijks) is gelijk aan de laagst gevonden bewijskracht voor de cruciale uitkomstmaat pre-eclampsie en dat is in dit geval ‘zeer laag’.
Hoge dosis calciumsuppletie (≥ 1 g dagelijks)
Het Voedingscentrum geeft advies over de dagelijkse aanbevolen hoeveelheid calcium voor de populatie (https://www.voedingscentrum.nl/encyclopedie/calcium.aspx). Voor zwangere vrouwen is dit 1 g per dag. Dit is conform het advies van de gezondheidsraad (Gezondheidsraad, 2021). Hoewel de gemiddelde calcium intake in Nederland hoog is vergeleken met veel andere landen (gemiddeld 1102 mg per dag (Balk, 2017)), zijn er ook in Nederland veel zwangere vrouwen die niet aan de benodigde 1000 mg per dag komen. Daarom wordt geadviseerd de calcium intake bij alle zwangeren uit te vragen. De WHO adviseert in haar gereviseerde richtlijn van 2018 om aan alle zwangere vrouwen met een lage calcium intake calciumsuppletie aan te bieden (1.5 tot 2 g dagelijks) (WHO, 2018). Daarom wordt in de overwegingen hieronder gefocust op de uitkomsten van de literatuuranalyse van calciumsuppletie in een hoge dosering (≥ 1 g dagelijks). Statistisch significante verschillen zijn aangemerkt als klinisch relevant verschillen voor beide uitkomstmaten.
Uit de literatuuranalyse komt naar voren dat calciumsuppletie met ≥ 1 g dagelijks pre-eclampsie significant verlaagt met 55% in vergelijking met placebo (RR 0,45 (95%BI 0,31 tot 0,65)). Het effect wordt gezien bij vrouwen met een lage calcium intake (reductie 64%, RR 0,36 (95%BI 0,20 tot 0,65)), bij vrouwen met een laag risico op een hypertensieve aandoening in de zwangerschap (reductie 41%, RR 0,59 (95%BI 0,41 tot 0,83)), maar vooral bij vrouwen met een hoog risico op een hypertensieve aandoening in de zwangerschap (reductie 78%, RR 0,22 (95%BI 0,12 tot 0,42)). De overall bewijskracht voor behandeling met hoge dosis calciumsuppletie (≥ 1 g dagelijks) is gelijk aan de laagst gevonden bewijskracht voor de uitkomstmaat pre-eclampsie en dat is ‘laag’.
Uit de literatuuranalyse komt naar voren dat calciumsuppletie met ≥ 1 g dagelijks vroeggeboorte significant verlaagt met 25% in vergelijking met placebo (RR 0,76 (95%BI 0,60 tot 0,97)). Dit effect treedt vooral op bij vrouwen met een hoog risico op een hypertensieve aandoening in de zwangerschap (reductie 55%, RR 0,45 (95%BI 0,24 tot 0,83)). De overall bewijskracht voor behandeling met hoge dosis calciumsuppletie (≥ 1 g dagelijks) is gelijk aan de laagst gevonden bewijskracht voor de uitkomstmaat vroeggeboorte en dat is ‘laag’.
Er is nog onvoldoende bewijs of het preconceptioneel starten van calciumsuppletie slechte maternale en perinatale uitkomsten reduceert (Hofmeyer, 2019).
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
De zwangere vrouw is gemotiveerd om gezond zwanger te worden en te blijven. De website Zwanger wijzer wijst op gezonde voeding en extra vitamines (foliumzuur, vitamine D) en leefstijl, zoals het staken van middelengebruik (roken, alcohol en drugs) (https://www.zwangerwijzer.nl/). Preconceptioneel of bij de eerste zwangerschapscontrole kan de (zwangere) vrouw een online vragenlijst doen op deze site. Ongeveer 60 procent van de zwangere vrouwen neemt dagelijks voedingssupplementen in de vorm van multivitaminen. Hoewel deze supplementen een goede aanvulling zijn op de voeding, bevatten ze slechts een fractie (of soms zelfs helemaal niets) van de aanbevolen dagelijkse hoeveelheid calcium (Willemse, 2020). Bij de eerste zwangerschapscontrole kan de zwangere vrouw worden verwezen naar online zelftest van het Voedingscentrum “Krijg ik genoeg Calcium binnen?” (https://www.samengezond.nl/eet-jij-genoeg-calcium/). Ook geeft het Voedingscentrum advies over gezond eten tijdens de zwangerschap (https://www.voedingscentrum.nl/nl/zwanger-en-kind/zwanger/gezond-eten-tijdens-de-zwangerschap.aspx) en kan via het Voedingscentrum de eetmeter worden ingevuld (https://mijn.voedingscentrum.nl/nl/eetmeter/). Voor zwangere vrouwen wordt de dagelijkse inname van 1 gram calcium geadviseerd, met een bovengrens van 2,5 gram (EFSA upper levels, 2006). Aanbevolen wordt om 2 tot 3 porties melk/yoghurt/kwark en 40 gram kaas per dag in te nemen voor adequate calcium intake. Wanneer intake van calcium via de voeding onvoldoende is, dient calciumsuppletie nog apart ingenomen te worden. In het review van Hoymeyr (2018) werd in vrijwel alle RCT’s vanaf 20 weken of later met het calciumsupplement gestart. Omdat de evidentie betrekking heeft op supplementgebruik vanaf de 20e zwangerschapsweek, wordt geadviseerd om eventuele calciumsuppletie vanaf 20 weken te beginnen. Calciumsuppletie is verkrijgbaar bij de drogist in tabletvorm en in verschillende doseringen. In a modified discrete-choice trial onderzoek ging de voorkeur van zwangere vrouwen uit naar calcium in tabletvorm (Baxter, 2014). Wanneer suppletie wordt aanbevolen is het belangrijk om de zwangere vrouw goed te informeren over de reden van de suppletie, de geadviseerde dosering calciumsuppletie en de duur van de suppletie.
Kosten (middelenbeslag)
Calciumsuppletie (1 g dagelijks) is een kosteneffectieve interventie voor de preventie van pre-eclampsie met inherente kosten op de korte en lange termijn. In Nederlands onderzoek werd via een beslissingsanalyse in een hypothetisch cohort van 100.000 zwangere vrouwen de impact van calciumsuppletie onderzocht indien dit aan (1) alle zwangere vrouwen, (2) aan vrouwen met een risico op een hypertensieve aandoening in de zwangerschap en (3) aan vrouwen met een lage calcium intake werd voorgeschreven. De analyse liet een reductie van pre-eclampsie zien van respectievelijk 25%, 8%, en 13%. De financiële voordelen werden berekend op respectievelijk €4,621,465, €2,059,165, en €2,822,115 per 100,000 zwangere vrouwen (Meertens, 2018).
De kosten van calciumsuppletie worden geschat op ongeveer 10 euro voor de gehele zwangerschap. De zwangere moet dit zelf bij de drogist aanschaffen (Calcium 1000mg).
Aanvaardbaarheid, haalbaarheid en implementatie
Er worden geen barrières verwacht voor de aanvaardbaarheid, haalbaarheid en implementatie van de aanbeveling. Naar verwachting zal de aanbeveling van deze richtlijn voor zwangere vrouwen met een hoog risico op hypertensieve aandoeningen in de verloskundige keten in Nederland goed worden geïmplementeerd. Deze aanbeveling sluit nauw aan bij de aanbeveling uit de Ascal profylaxe (acetylsalicylzuur 80 tot 150 mg voor 16 weken zwangerschap) ter preventie van het ontwikkelen van pre-eclampsie die is opgenomen in de richtlijnen database in de richtlijn Hypertensieve aandoeningen in de zwangerschap. Deze richtlijn is zowel binnen de eerste lijn als binnen de tweede lijn goed geïmplementeerd (NVOG, 2018).
De KNOV verwijst zwangere vrouwen naar de eerder genoemde website van het Voedingscentrum om te kijken of zij voldoende calcium binnenkrijgen of dat zij extra calcium nodig hebben (KNOV, 2016). In de WHO richtlijn worden aanbevelingen gedaan voor de aanvaardbaarheid, haalbaarheid en implementatie. Voorbeelden zijn het afnemen van een voedingsanamnese bij de intake van de zwangere vrouw en dieetadviezen te geven over calciumrijke voeding (zoals melk en kaasproducten). Indien suppletie noodzakelijk is om dan de tabletten in te nemen verdeeld over de dag (ontbijt-lunch-avondeten), niet tegelijk met eventuele ijzersuppletie gezien de negatieve interactie. Calcium kan de ijzerabsorptie verlagen. Neem calcium daarom niet in combinatie met ijzersuppletie in. Ook moet rekening worden gehouden met medicamenten die calcium bevatten en vaak in de zwangerschap worden gebruikt, zoals antacida. Suppletie tot 2.5 g lijkt geen negatieve effecten te hebben (WHO, 2018). De poliverpleegkundige kan een rol spelen bij het voorlichten van de zwangere vrouw. Deze invulling moet worden uitgewerkt op lokaal niveau.
Rationale van de aanbeveling
In de literatuur, hoewel de overall level of evidence laag is, wordt met calciumsuppletie (≥ 1 g per dag) een reductie gevonden van pre-eclampsie bij zwangere vrouwen met een lage calcium intake en bij zwangere vrouwen met een hoog risico op hypertensieve aandoeningen. De kosten van calciumsuppletie zijn gering en levert een kostenbesparing op de lange termijn door preventie van pre-eclampsie en (inherente) vroeggeboorte. Bij zwangere vrouwen met een hoog risico op hypertensieve aandoeningen kan calciumsuppletie (1 g per dag) direct worden aangevangen in combinatie met laag gedoseerd aspirine (80 tot 150 mg per dag) ter preventie van pre-eclampsie, mits de totale dagelijkse inname van 2,5 gram niet wordt overschreden.
Onderbouwing
Achtergrond
Calcium is een van de meest voorkomende mineralen in ons lichaam. Calcium is noodzakelijk voor onder andere de opbouw en onderhoud van botten, goede werking van spieren en zenuwen, hormoonstofwisseling en het transport van andere mineralen in het lichaam. In de zwangerschap neemt de absorptie van calcium toe. Onvoldoende calcium intake door zwangere vrouwen kan leiden tot ongunstige maternale en perinatale uitkomsten. Calciumsuppletie kan deze ongunstige uitkomsten verminderen, vooral het risico op hypertensieve aandoeningen die geassocieerd zijn met maternale morbiditeit en mortaliteit en het risico op vroeggeboorte, de belangrijkste oorzaak van perinatale morbiditeit en mortaliteit.
Hoewel de World Health Organisation (WHO, 2013) al sinds 2013 calciumsuppletie aanraadt voor zwangere vrouwen, vooral die met een lage calciumintake en/of een hoog risico op hypertensieve aandoeningen in de zwangerschap, wordt in Nederland calciumsuppletie nog niet routinematig geadviseerd aan zwangere vrouwen. Omdat een teveel aan calcium kan leiden tot nierstenen en urineweginfecties en een negatieve interactie met de absorptie van andere mineralen en nutriënten is het noodzakelijk die vrouwen te selecteren die baat hebben bij calciumsuppletie.
In deze richtlijn wordt het effect van calciumsuppletie voor de zwangere vrouw beschreven, zowel een in een hoge dosering (≥ 1.0 g dagelijks) als een lage dosering (< 1.0 g dagelijks) en gestratificeerd voor calcium intake (adequaat versus laag) en het risico op hypertensieve aandoeningen in de zwangerschap (laag versus hoog), op het voorkomen van pre-eclampsie en vroeggeboorte.
Conclusies / Summary of Findings
1. Pre-eclampsia defined as high blood pressure with significant proteinuria
1.1 High dose calcium supplementation (≥ 1 g daily)
Subgroups based on calcium diet
|
Low GRADE |
High dose calcium supplementation (≥ 1.0 g daily) may result in little to no difference in pre-eclampsia in pregnant women with an adequate calcium diet.
Sources: (Hofmeyr, 2018) |
|
High dose calcium supplementation (≥ 1.0 g daily) likely results in a large reduction in pre-eclampsia in pregnant women with a low calcium diet.
Sources: (Hofmeyr, 2018) |
Subgroups based on risk for hypertensive disorder of pregnancy
|
Moderate GRADE |
High dose calcium supplementation (≥ 1.0 g daily) likely results in a reduction in pre-eclampsia in a population with low risk for hypertensive disorder of pregnancy.
Sources: (Hofmeyr, 2018) |
|
Moderate GRADE |
High dose calcium supplementation (≥ 1.0 g daily) likely results in a large reduction in pre-eclampsia in a population with high risk for hypertensive disorder of pregnancy.
Sources: (Hofmeyr, 2018) |
1.2 Low dose supplementation (< 1 g daily) and pre-eclampsia
|
Very low GRADE |
The evidence is uncertain about the effect of low dose calcium supplementation (< 1.0 g daily) on the prevention of pre-eclampsia in pregnant women with a low calcium diet and low risk for hypertensive disorders of pregnancy.
Sources: (Hofmeyr, 2018) |
|
- GRADE |
It is unclear what the effect is of low dose calcium supplementation (< 1.0 g daily) on the prevention of pre-eclampsia in pregnant women with an adequate calcium diet and/or high risk for hypertensive disorders of pregnancy. |
2. Preterm birth < 37 weeks
2.1 High dose supplementation (≥ 1 g daily)
Subgroups based on calcium diet
|
Low GRADE |
High dose calcium supplementation (≥ 1.0 g daily) may result in little to no difference in preterm birth in pregnant women with an adequate calcium diet.
Sources: (Hofmeyr, 2018) |
|
Low GRADE |
High dose calcium supplementation (≥ 1.0 g daily) may result in little to no difference in preterm birth in pregnant women with an low calcium diet.
Sources: (Hofmeyr, 2018) |
Subgroups based on risk for hypertensive disorder of pregnancy
|
Moderate GRADE |
High dose calcium supplementation (≥ 1.0 g daily) likely results in little to no difference in preterm birth in pregnant women with a low risk for hypertensive disorder of pregnancy.
Sources: (Hofmeyr, 2018) |
|
Low GRADE |
High dose calcium supplementation (≥ 1.0 g daily) may results in a large reduction in preterm birth in pregnant women with a high risk for hypertensive disorder of pregnancy.
Sources: (Hofmeyr, 2018) |
2.2 Low dose supplementation (< 1 g daily)
|
Very low GRADE |
The evidence is uncertain about the effect of low dose calcium supplementation (< 1.0 g daily) in the prevention of preterm birth in pregnant women with a low calcium diet and low risk for hypertensive disorders of pregnancy.
Sources: (Hofmeyr, 2018) |
|
- GRADE |
It is unclear what the effect is of low dose calcium supplementation (< 1.0 g daily) in the prevention of preterm birth in pregnant women with an adequate calcium diet and/or high risk for hypertensive disorders of pregnancy. |
Samenvatting literatuur
Description of studies
The Cochrane review by Hofmeyr (2018) investigated the effect of calcium supplementation during pregnancy on hypertensive disorders of pregnancy and related maternal and perinatal outcomes. The Cochrane Pregnancy and Childbirth’s Trial Register (including detailed strategies for CENTRAL, MEDLINE, Embase and CINAHL) was searched for relevant studies until September,18th 2017. Hofmeyr (2018) included all pregnant women regardless of their background risk to develop hypertensive disorders of pregnancy. Women with diagnosed hypertensive disorders of pregnancy were excluded. Pre-eclampsia was defined as high blood pressure with significant proteinuria (Hofmeyr, 2018), and preterm birth as birth < 37 weeks. For the primary analysis on the effect of high dose calcium supplementation (≥ 1 g daily) only placebo-controlled RCTs were included. For the secondary analysis about low dose calcium supplementation (< 1 g daily) also quasi-randomized trials and trials without a placebo intervention were included. The reason to do so was that there was an appropriate amount of data from randomized, placebo-controlled trials for the high dose calcium supplementation, but not for the low dose calcium supplementation analysis. Hofmeyr (2018) also included studies on calcium supplementation with cointerventions (e.g. vitamin D, linoleic acid, anti-oxidants and anti-platelet agents), but for the purpose of our research question and literature study, those studies were excluded from analysis (n=10). Of the 27 studies Hofmeyr included in his Cochrane review, 17 were included for our literature analysis: 13 high dose and four low dose calcium supplementation trials. Trials were performed in USA (n=4), Australia (n=1), Ecuador (n=3), India (n=2), Argentina (n=1), Iran (n=2) Trinidad (n=1), China (n=1), Hong Kong (n=1) and one multicentre trial in Argentina, Egypt, India, Peru, South Africa and Vietnam.
Hofmeyr (2018) predefined subgroup analyses based on the calcium diet of the population: an adequate calcium diet (as defined by trial authors, or if not defined, a mean intake equal to or greater than 900 mg per day), and a low calcium diet (as defined by trial authors, or if not defined, a mean intake of less than 900 mg per day). Furthermore, Hofmeyr (2018) predefined subgroup analyses based on low versus high risk for developing hypertensive disorders of pregnancy. High risk were women selected by the trial authors with one or more risk factors, e.g. teenagers or women older than 40 years old, women with previous pre-eclampsia, women with increased sensitivity to angiotensin II and women with pre-existing hypertension.
Results
Pooled analyses were performed where possible. All analyses were performed separately for women with high dose (≥1 g daily) and low dose (< 1 g daily) calcium supplementation. Subgroup analyses stratified for dietary calcium intake and baseline risk for hypertensive disorders of pregnancy were performed where possible.
1. Outcome measure pre-eclampsia (defined as high blood pressure with significant proteinuria)
1.1 High dose calcium supplementation (≥ 1 g daily)
Hofmeyr (2018) included 13 placebo-controlled trials (15.730 women) that investigated the effect of routine high dose daily calcium supplementation (≥ 1 g daily) on the risk of pre-eclampsia. Overall, high dose calcium supplementation (≥ 1 g daily) significantly reduced pre-eclampsia with 55% compared to placebo (13 trials, 15.730 women, RR 0.45, 95%CI 0.31 to 0.65).
Subgroups based on calcium diet
Prespecified subgroup analyses based on calcium diet were performed (Figure 1).
In women with an adequate dietary calcium intake, no significant difference in pre-eclampsia was reported (4 trials, 5022 women, RR 0.62, 95%CI 0.32 to 1.20).
In women with a low dietary calcium intake, pre-eclampsia was significantly reduced with 64% compared to placebo (8 trials, 10.678 women, RR 0.36, 95%CI 0.20 to 0.65).
In the one trial that did not specify calcium diet (Niromanesh, 2001) an non-significant protective effect of calcium supplementation was reported (1 trial, 30 women, RR 0.13, 95%CI 0.02 to 1.02).
Figure 1 Outcome pre-eclampsia comparison: high dose calcium supplementation (≥ 1 g daily) versus placebo supplementation stratified by calcium diet
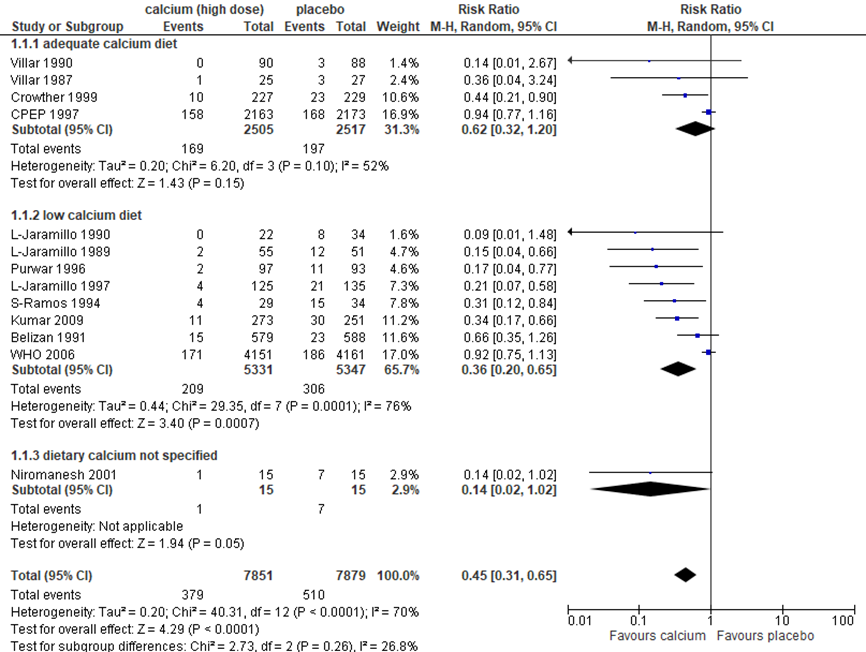
Source: Hofmeyr (2018), Z: p-value of the pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Subgroups based on baseline risk for hypertensive disorders of pregnancy
Prespecified subgroup analyses based on baseline risk for hypertensive disorders during pregnancy were performed (Figure 2).
In women at low risk for hypertensive disorder of pregnancy, pre-eclampsia was significantly reduced with 41% compared to placebo (8 trials, 15.143 women, RR 0.59, 95%CI 0.41 to 0.83).
In women at high risk for hypertensive disorder in pregnancy, pre-eclampsia was significantly reduced with 78% compared to placebo (5 trials, 587 women, RR 0.22, 95%CI 0.12 to 0.42).
Figure 2 Outcome pre-eclampsia comparison: high dose calcium supplementation (≥ 1 g daily) versus placebo supplementation stratified by hypertensive disorder risk
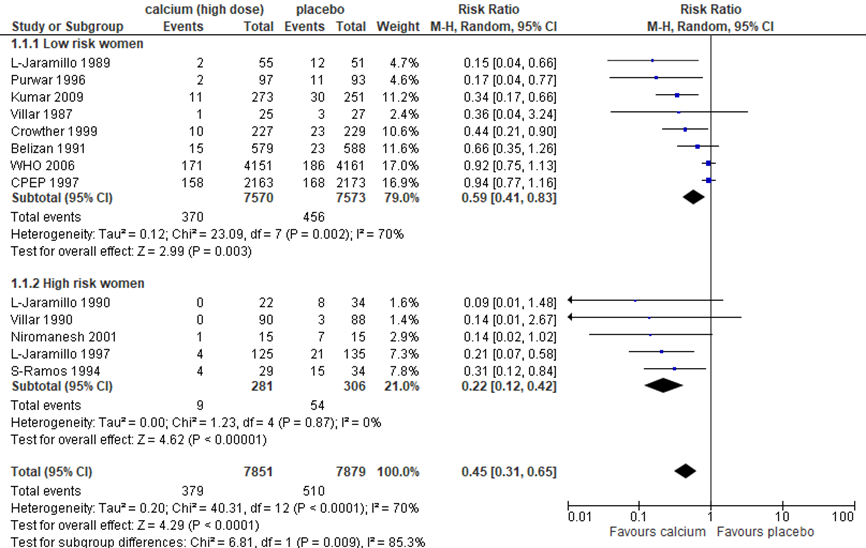
Source: Hofmeyr (2018), Z: p-value of the pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
1.2 Low dose calcium supplementation (< 1 g daily)
Hofmeyr (2018) included four studies (980 women) that examined the effect of low dose supplementation (≤ 1.0 g daily) on pre-eclampsia (Figure 3). In all four studies, all women had a low dietary calcium diet and were of low risk for hypertensive disorders of pregnancy. Low dose calcium (< 1.0 g daily) supplementation significantly reduced pre-eclampsia with 64% compared to controls with no supplementation (4 trials, 1.000 women, RR 0.36, 95%CI 0.23 to 0.57) (Figure 3).
No studies on women with adequate dietary calcium diet or high risk for hypertensive disorders of pregnancy and low dose calcium supplementation (< 1 g daily) were included.
Figure 3 Outcome pre-eclampsia comparison low dose calcium supplementation (< 1 g daily) versus control (no intervention)
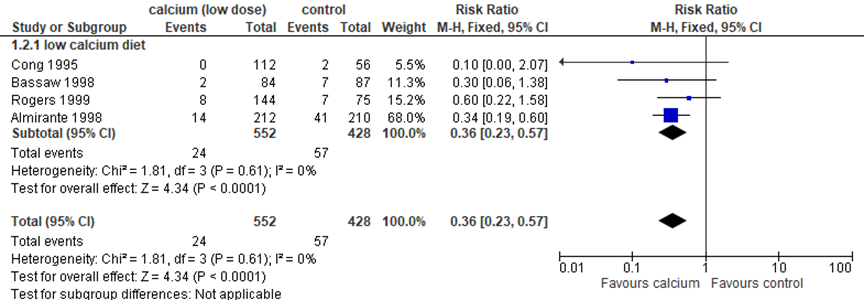
Source: Hofmeyr (2018) Z: p-value of the pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
2. Preterm birth < 37 weeks
2.1 High dose calcium supplementation (≥ 1 g daily)
Hofmeyr (2018) included 11 studies (15.275 women) that examined the effect of high dose calcium supplementation (≥ 1 g daily) on preterm birth. Overall, high dose calcium supplementation (≥ 1 g daily) reduced preterm birth with 24% compared to placebo (11 trials, 15.275 women, RR 0.76, 95%CI 0.60 to 0.97).
Subgroups based on calcium diet
Prespecified subgroup analyses based on calcium diet were performed (Figure 4).
In women with an adequate dietary calcium intake, no significant difference in preterm birth risk was reported compared to placebo (4 trials, 5.033 women, RR 0.59, 95%CI 0.26 to 1.33).
In women with a low dietary calcium intake a non-significant reduction in preterm birth was reported compared to placebo (7 trials, 10.242 women, RR 0.81, 95% CI 0.64 to 1.02).
Figure 4 Outcome preterm birth comparison high dose calcium supplementation (≥ 1 g daily) versus placebo supplementation stratified by calcium diet
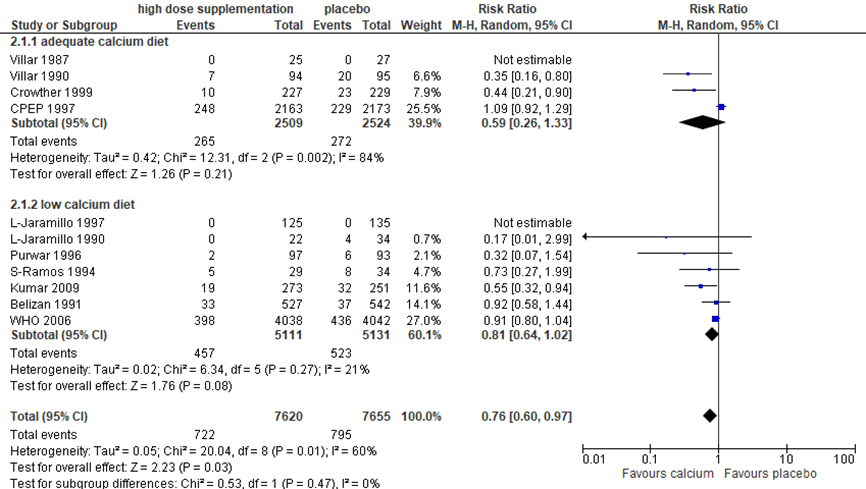
Source: Hofmeyr (2018) Z: p-value of the pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Subgroups based on baseline risk for hypertensive disorders of pregnancy
Prespecified subgroup analyses based on baseline risk for hypertensive disorders during pregnancy were performed (Figure 5).
In women at low hypertensive disorder risk, preterm birth was not significantly reduced compared to placebo (7 trials, 14.707 women, RR 0.84 95%CI 0.67 to 1.05).
In women at high hypertensive disorder risk, a significant reduction of 55% in preterm birth was reported (4 trials, 568 women, RR 0.45, 95%CI 0.24 to 0.83).
Figure 5 Outcome preterm birth comparison high dose calcium supplementation (≥ 1 g daily) versus placebo supplementation stratified by hypertensive disorder risk
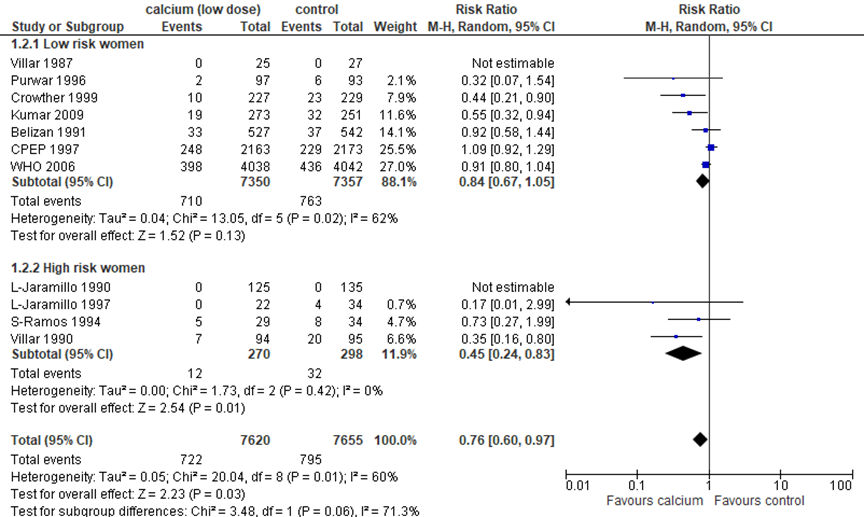
Source: Hofmeyr (2018) Z: p-value of the pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
2.2 Low dose calcium supplementation (< 1 g daily)
Hofmeyer (2018) included one study that examined the effect of low dose calcium supplementation (< 1 g daily) on preterm birth in 422 women. In this study, all women had a low dietary calcium intake and a low risk for hypertensive disorders of pregnancy (Almirante, 1998). Low dose calcium supplementation significantly reduced preterm birth with 60% compared to controls with no supplementation (1 trial, 422 women, RR 0.40, 95%CI 0.21 to 0.75).
No studies on women with adequate dietary calcium diet or high risk of hypertensive disorders and low dose calcium supplementation (< 1 g daily) were included.
Figure 6 Outcome preterm birth comparison: low dose calcium supplementation (< 1 g daily) versus control
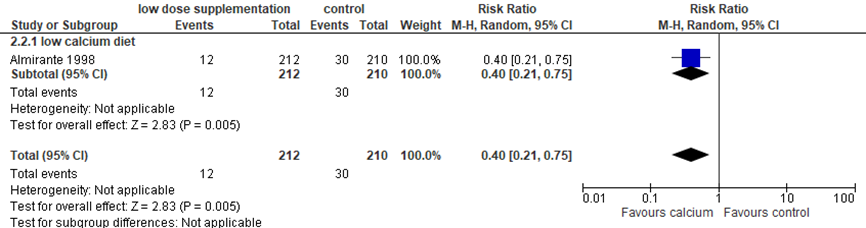
Source: Hofmeyr (2018), Z: p-value of the pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval.
Level of evidence of the literature
Studies with a randomized, placebo-controlled design start at a high GRADE.
1. Pre-eclampsia
1.1 High dose calcium supplementation (≥ 1 g daily)
Subgroups based on calcium diet
The level of evidence regarding the outcome measure pre-eclampsia in women with an adequate calcium diet treated with high dose calcium supplementation is downgraded with two levels to a low GRADE due to imprecision (confidence interval of pooled effect includes no significant effect (RR=1) and no clinically relevant effect (RR≤0.8) and publication bias (asymmetric funnel plots, performed by Hofmeyr 2018, confirmed treatment effects might be overestimated due to small study effects or publication bias).
The level of evidence regarding the outcome measure pre-eclampsia in women with a low calcium diet treated with high dose calcium supplementation is downgraded with one level to a moderate GRADE due to publication bias (asymmetric funnel plots, performed by Hofmeyr (2018) confirmed treatment effects might be overestimated due to small study effects or publication bias).
Subgroups based on risk for hypertensive disorder of pregnancy
The level of evidence regarding the outcome measure pre-eclampsia in women with a low risk for hypertensive disorder of pregnancy treated with high dose calcium supplementation is downgraded with one level to a moderate GRADE due to publication bias (asymmetric funnel plots, performed by Hofmeyr 2018, confirmed treatment effects might be overestimated due to publication bias).
The level of evidence regarding the outcome measure pre-eclampsia in women with a high risk for hypertensive disorders of pregnancy treated with high dose calcium supplementation is downgraded one level to a moderate GRADE due to publication bias (asymmetric funnel plots, performed by Hofmeyr (2018) confirmed treatment effects might be overestimated due to publication bias).
1.2 Low dose supplementation (< 1 g daily) and pre-eclampsia
The level of evidence regarding the outcome measure pre-eclampsia in women treated with low dose calcium supplementation is downgraded with three levels to a very low GRADE due to risk of bias (2 level downgrade because of high risk of bias in three of the four included studies (Almirante, 1998; Cong, 1995; Rogers, 1999) on all domains of the risk of bias assessment, performed by Hofmeyr 2018) and publication bias (asymmetric funnel plots, performed by Hofmeyr (2018) confirmed treatment effects might be overestimated due to publication bias). In all these studies women had a low dietary calcium intake and a low risk for hypertensive disorders of pregnancy.
There were no studies included on the effect of low dose calcium supplementation in women with adequate calcium diet and/or high risk for hypertensive disorders of pregnancy and pre-eclampsia risk. This outcome measure could therefore not be assessed in these subgroups with GRADE.
2. Preterm birth < 37 weeks
2.1 High dose supplementation (≥ 1 g daily)
Subgroups based on calcium diet
The level of evidence regarding the outcome measure preterm birth in women with an adequate calcium diet and comparing high dose calcium supplementation versus placebo supplementation is downgraded with two levels to a low GRADE due to imprecision (confidence interval of pooled effect includes no significant effect (RR=1) and no clinically relevant effect (RR≤0.8) and publication bias (asymmetric funnel plots, performed by Hofmeyr (2018) confirmed treatment effects might be overestimated due to publication bias).
The level of evidence regarding the outcome measure preterm birth in women with a low calcium diet and comparing high dose calcium supplementation versus placebo calcium supplementation is downgraded with two levels to a low GRADE due to imprecision (confidence interval of pooled effect includes no significant effect (RR=1) and no clinically relevant effect (RR≤0.8) and publication bias (asymmetric funnel plots, performed by Hofmeyr (2018) confirmed treatment effects might be overestimated due to publication bias).
Subgroups based on risk for hypertensive disorder of pregnancy
The level of evidence regarding the outcome measure preterm birth in women with a low risk for hypertensive disorder of pregnancy is downgraded one level to a moderate GRADE due to publication bias (asymmetric funnel plots, performed by Hofmeyr (2018) confirmed treatment effects might be overestimated due to publication bias).
The level of evidence regarding the outcome measure preterm birth in women with a high risk for hypertensive disorder of pregnancy is downgraded with two levels to a low GRADE due to imprecision (confidence interval of pooled effect includes no clinically relevant effect RR≤0.8) and publication bias (asymmetric funnel plots, performed by Hofmeyr (2018) confirmed treatment effects might be overestimated due to publication bias).
2.2 Low dose supplementation (< 1 g daily) and preterm birth
The level of evidence regarding the outcome measure preterm birth in women with a low calcium diet and low risk for hypertensive disorders of pregnancy receiving low dose calcium supplementation versus controls with no supplementation is downgraded with three levels to a very low GRADE due to risk of bias (2 level downgrade because of high risk of bias in study of Almirante 1998, assessed by Hofmeyr (2018)) and imprecision (1 trial, optimal information size was not achieved (n=400)).
There were no studies included on the effect of low dose calcium supplementation in women with adequate calcium diet and/or high risk for hypertensive disorders of pregnancy on preterm birth risk. This outcome measure could therefore not be assessed in these subgroups with GRADE.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effect of calcium supplementation in pregnant women to prevent pre-eclampsia and premature birth?
P: pregnant women;
I: Calcium supplementation;
C: no calcium supplementation or placebo;
O: pre-eclampsia and premature birth < 37 weeks.
Relevant outcome measures
The guideline working group considered both pre-eclampsia end premature birth as critical outcome measures for decision making. Any statistically significant difference in the outcome measures was considered as a clinically important difference between groups.
The working group defined the outcome pre-eclampsia as gestational hypertension and significant proteinuria. Preterm birth was defined as birth before 37 weeks of gestation. The working group did not define these outcome measures but used the definitions used in the studies.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until October, 3rd 2019. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 428 hits. Studies were selected based on the following criteria: pregnant women treated with calcium supplementation versus. placebo or no treatment and at least one outcome measure reported, either pre-eclampsia or preterm birth. Only systematic reviews and meta analyses or randomized controlled trials (RCTs), involving the original study data were included. Studies on calcium supplementation in combination with other supplements, such as vitamin D supplements, linoleic acid and antioxidants were excluded. Seventy-four studies were initially selected based on title and abstract screening. After reading the full text, 73 studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study was included.
Results
One systematic review and meta-analysis (Cochrane review) was included in the analysis of the literature (Hofmeyr, 2018). This review included 13 studies on the effect of high dose supplementation (≥ 1.0 g daily) and four studies on the effect of low dose supplementation (< 1 g daily). Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Balk EM, Adam GP, Langberg VN, Earley A, Clark P, Ebeling PR, Mithal A, Rizzoli R, Zerbini CAF, Pierroz DD, Dawson-Hughes B; International Osteoporosis Foundation Calcium Steering Committee. Global dietary calcium intake among adults: a systematic review. Osteoporos Int. 2017 Dec;28(12):3315-3324.
- Baxter JA, Roth DE, Al Mahmud A, Ahmed T, Islam M, Zlotkin SH. Tablets are preferred and more acceptable than powdered prenatal calcium supplements among pregnant women in Dhaka, Bangladesh. J Nutr. 2014;144(7):1106‐1112.
- Gezondheidsraad. Voedingsaanbevelingen voor zwangere vrouwen. Den Haag: Gezondheidsraad 2021; publicatienr. 2021/26, Den Haag, 22 juni 2021.
- Hofmeyr GJ, Lawrie TA, Atallah ÁN, Torloni MR. Calcium supplementation during pregnancy for preventing hypertensive disorders and related problems. Cochrane Database Syst Rev. 2018 Oct 1;10:CD001059.
- Hofmeyr GJ, Manyame S, Medley N, Williams MJ. Calcium supplementation commencing before or early in pregnancy, for preventing hypertensive disorders of pregnancy. Cochrane Database Syst Rev. 2019 Sep 16;9(9):CD011192.
- KNOV (2016). https://www.knov.nl/actueel-overzicht/nieuws-overzicht/detail/advies-over-calciumgebruik-om-zwangerschapsvergiftiging-te-voorkomen/1798. Bezocht op11-6-2020.
- Meertens LJE, Scheepers HCJ, Willemse JPMM, Spaanderman MEA, Smits LJM. Should women be advised to use calcium supplements during pregnancy? A decision analysis. Matern Child Nutr. 2018;14(1):e12479.
- NVOG richtlijn Hypertensieve aandoeningen in de zwangerschap, module Acetylsalicylzuur pre-eclampsie zwangerschap, NVOG, 2018.
- Scientific Committee on Food; Scientific Panel on Dietetic Products. Tolerable upper levels for vitamins and minerals. Parma: European Food Safety Authority, 2006.
- Willemse JPMM, Meertens LJE, Scheepers HCJ, Achten NMJ, Eussen SJ, van Dongen MC, Smits LJM. Calcium intake from diet and supplement use during early pregnancy: the Expect study I. Eur J Nutr. 2020 Feb;59(1):167-174.
- World Health Organization. Guideline: Calcium supplementation in pregnant women. World Health Organization, 2013.
- World Health Organization. WHO recommendation: calcium supplementation during pregnancy for prevention of pre-eclampsia and its complications. World Health Organization, 2018.
Evidence tabellen
Research question: What is the effect of calcium prophylaxis in pregnant women to prevent pre-eclampsia and preterm birth?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Hofmeyr, 2018
|
SR and meta-analysis of RCTs
Literature search up to September 18th, 2017
13 studies high dose (>1g/day) supplementation:
A: Villar 1987 B: Villar 1990 C: Crowther 1999 D: CPEP 1997 E: L-Jaramillo 1990 F: S-Ramos 1994 G: L-Jaramillo 1989 H: Purwar 1996 I: L-Jaramillo 1997 J: Belizan 1991 K: WHO 2006 L: Kumar 2009 M: Niromanesh 2001
4 studies low dose (<1g/day) supplementation: N: Bassaw 1998 O: Cong 1995 P: Rogers 1999 Q: Almirante 1998
Setting and Country: A: USA C: Australia D: USA E: Ecuador F: USA G: Ecuador H: India I: Ecuador J: Argentina K: Multicentre trial in Argentina, Egypt, India, Peru, South Africa and Vietnam L: India M: Iran N: Trinidad O: China P: Hong Kong Q: Iran
Source of funding and conflicts of interest: 10 A: grants from the National Dairy Board and the National Dairy Council. CoI: not stated. B: grants from the National Dairy Board and the National Dairy Council. CoI: not stated. C: a grant from the Queen Victoria Hospital Foundation and The Women’s and Children’s Hospital Foundation, Australia CoI: not stated. D: supported by The National Institute of Child Health and Human Development and the National Heart, Lung and Blood Institute. Study medications were industry provided CoI: not stated. E: not stated. CoI: not stated. F: Source of funding: not stated. CoI: not stated. G: the study was supported by the Consejo Nacional de Ciencia y Technologia and Consejo Nacional de Universidades y Escuclas Polieenicas, Ecuador CoI: not stated. H: not stated. Supplements and placebos were provided by a pharmaceutical company CoI: not stated. I: supported by the Safe Motherhood Program, World Health Organization CoI: not stated. J: Funded by a research grant from The International Development Research Centre, Canada CoI: not stated. K: the study was supported by UNDP/UNFPA/World Health Organization/ World Bank Special Programme of Research, Development and Research Training CoI: not stated. L: University Grant Commission, New Delhi, India CoI: not stated. M: not stated; supplements and placebo tablets were provided by a pharmaceutical company CoI: not stated. N: Source of funding: not stated. CoI: not stated. O: Source of funding: not stated. CoI: not stated. P: Source of funding: not stated. CoI: not stated. Q: Abstract only |
Inclusion criteria SR: all RCTs and quasirandomised trials. Including pregnant women, regardless of the risk on hypertensive disorders. Using high dose, low dose or different calcium dosages. Examing one of the 15 prespecified outcome measures (including preeclampsia and preterm birth)
Exclusion criteria SR: women with diagnosed hypertensive disorders, studies without a placebo group, non randomised design.
17 studies included
Important patient characteristics at baseline:
N, calcium diet, high/low risk to develop preeclampsia during pregnancy A: 52 patients, adequate calcium diet, low risk B: 178 patients, adequate calcium diet, high risk because of age <17 years old C: 456 patients, adequate calcium diet, low risk D: 4336 patients, adequate calcium diet, low risk E: 56 patients, low calcium diet, high risk because of positive roll-over test at 28-30 weeks’ gestational age F: 63 patients, low calcium diet, high risk because of positive roll-over test and positive angiotensin II infusion test at 20-24 weeks’ gestation G: 106 patients, low calcium diet, low risk H: 190 patients, low calcium diet, low risk I: 260 patients, low calcium diet, high risk J: 1167 patients, low calcium diet, low risk K: 8312 patients, low calcium diet, low risk L: 524 patients, low calcium diet, low risk M: 30 patients, calcium diet unknown, high risk because of positive ’roll-over’ test and at least 1 risk factor for pre-eclampsia; 28-32 weeks’ pregnant N: 171 patients, low dose calcium diet, low risk O: 168 patients, low dose calcium diet, low risk P: 219 patients, low dose calcium diet, low risk Q: 422 patients, low dose calcium diet, low risk |
A: 1.5 g daily; from 26 weeks’ gestation until delivery B: 2.0 g daily C: 1.8 g daily D: 2.0 g daily (+50mg normal supplementation) E: 2.0 g daily; from 28-32 weeks gestation until delivery F: 2.0 g daily G: 2.0 g daily; from 23 weeks’ gestation until delivery H: 2.0 g daily I: 2.0 g daily; from 20 weeks’ gestation until delivery J: 2.0 g daily; from 20 weeks gestation until delivery K: 1.5 g daily L: 2.0 g daily M: 2.0 g daily N: 2 calcium tablets (1200 mg elemental calcium), a combination of 1 calcium tablet and 1 baby Cafenol (80 mg aspirin) or 1 baby Cafenol daily O: 120 mg daily or 240 mg daily P: 600 mg daily; from 22 to 32 weeks then 1200 mg daily until delivery Q: 500 mg daily; from 16-20 weeks’ gestation until delivery
|
A: placebo; daily B: placebo; daily C: placebo; daily D: placebo; daily (+50mg normal supplementation) E: placebo; daily F: placebo; daily G: placebo; daily H: placebo daily I:placebo; daily J: placebo; daily K: placebo; daily L: placebo; daily M: placebo; daily N: no calcium O: no calcium P: no calcium Q: no calcium
|
Endpoint follow-up: A-Q: follow up until delivery J: follow up of subset women recruited in private clinics until children were 5-9 years old
For how many participants were no complete outcome data available: risk attrition/amount attrition? Defined as: 1.) low risk of bias (e.g. no missing outcome data; missing outcome data balanced across groups); 2.) high risk of bias (e.g. numbers or reasons for missing data imbalanced across groups; ‘as treated’ analysis done with substantial departure of intervention received from that assigned at randomisation); 3.) unclear risk of bias. A: Low risk; < 10% attrition B: Low risk; < 10% attrition C: Low risk; Attrition < 10% D: Low risk; Attrition < 10% E: Unclear risk; Not clear F: Low risk; < 10% attrition G: High risk; 14 women excluded from the report because they delivered before 38 weeks leaving 43/49 women in the calcium and placebo groups respectively. Data from the 14 excluded women are included in this review H: Low risk; Attrition < 10% I: Unclear risk; 274 recruited, 260 analysed J: Low risk; All or partial data available for 579/593 (Ca) and 588/601 (Pl) respectively. Delivery data were available for 544 and 554 respectively K: Low risk; 143/4151 and 155/4161 women in calcium and placebo groups respectively were missing delivery data but were included in other analyses L: Low risk; Attrition < 10% M: Low risk; No incomplete outcome data (sample size = 30) N:High risk; 8 participants were unavailable for analysis. O: Unclear risk; Loss to follow-up not reported P: High risk; 10% loss to follow-up Q: Unclear risk; No record of loss to follow-up
|
Outcome measure-1 Preeclampsia 17 studies, 16.710 patients
Pre-eclampsia was defined by authors as: high blood pressure with a significant proteinuria during the pregnancy. Ideally, proteinuria was defined as 2+ by dipstick testing, equal to or greater than 300 mg per 24 hours or equal to or greater than 500 mg per liter.
13 studies high dose (>1g/day) supplementation (15.730 patients): Subgroups based on calcium diet:
Adequate calcium diet: A: 0.36 ( 0.04, 3.24 ) B: 0.14 ( 0.01, 2.67 ) C: 0.44 ( 0.21, 0.90 ) D: 0.94 ( 0.77, 1.16 ) Total adequate calcium diet: 0.62 ( 0.32, 1.20 )
Low calcium diet: E: 0.09 ( 0.01, 1.48 ) F: 0.31 ( 0.12, 0.84 ) G: 0.15 ( 0.04, 0.66 ) H: 0.17 ( 0.04, 0.77 ) I: 0.21 ( 0.07, 0.58 ) J: 0.66 ( 0.35, 1.26 ) K: 0.92 ( 0.75, 1.13 ) L: 0.34 ( 0.17, 0.66 ) Total low calcium diet: 0.36 ( 0.20, 0.65 )
Calcium diet not specified: M: 0.14 ( 0.02, 1.02 )
Pooled effect RR (95% CI) (random effects model): 0.45 (0.31-0.65) favoring calcium supplementation Heterogeneity (I2): not applicable
Subgroups based on hypertensive disorder risk:
Low hypertensive disorder risk: A: 0.36 ( 0.04, 3.24 ) C: 0.44 ( 0.21, 0.90 ) D: 0.94 ( 0.77, 1.16 ) G: 0.15 ( 0.04, 0.66 ) H: 0.17 ( 0.04, 0.77 ) J: 0.66 ( 0.35, 1.26 ) K: 0.92 ( 0.75, 1.13 ) L: 0.34 ( 0.17, 0.66 ) Total low hypertensive disorder risk: 0.59 ( 0.41, 0.83 ) High hypertensive disorder risk: B: 0.14 ( 0.01, 2.67 ) E: 0.09 ( 0.01, 1.48 ) F: 0.14 ( 0.01, 2.67 ) M: 0.14 ( 0.02, 1.02 ) I: 0.21 ( 0.07, 0.58 ) Total high hypertensive disorder risk:0.22 ( 0.12, 0.42 )
Pooled effect RR (95% CI) (random effects model): 0.45 (0.31-0.65) favoring calcium supplementation Heterogeneity (I2): not applicable
4 studies low dose (<1g/day) supplementation (980 patients):
N: 0.30 ( 0.06, 1.38 ) O: 0.10 ( 0.00, 2.07 ) P: 0.60 ( 0.22, 1.58 ) 0.34 ( 0.19, 0.60 )
Pooled effect RR (95% CI) (fixed effects model): 0.36 (0.23-0.57) favoring calcium supplementation Heterogeneity (I2): 0.0%
Outcome measure-2 Preterm birth Preterm birth was by the authors defined as birth before 37 weeks
11 studies high dose, 15.275 women
Adequate calcium diet: A: not estimable (0 in both groups B: 0.35 ( 0.16, 0.80 ) C: 0.44 ( 0.21, 0.90 ) D: 1.09 ( 0.92, 1.29 ) Total adequate calcium diet: 0.59 ( 0.26, 1.33 )
Low calcium diet: E: 0.17 ( 0.01, 2.99 ) F: 0.73 ( 0.27, 1.99 ) H: 0.32 ( 0.07, 1.54 ) I: not estimable (0 in both groups) J: 0.92 ( 0.58, 1.44 ) K: 0.91 ( 0.80, 1.04 ) L: 0.55 ( 0.32, 0.94 ) Total low calcium diet: 0.81 ( 0.64, 1.02 )
Pooled effect RR (95% CI) (random effects model): 0.76 ( 0.60, 0.97) favoring calcium supplementation Heterogeneity (I2): 60%
1 study low-dose, 422 women
Q: 0.40 ( 0.21, 0.75 )
Pooled effect RR (95% CI) (random effects model): 0.40 ( 0.21, 0.75 ) favoring calcium supplementation Heterogeneity (I2): not applicable
|
Facultative: Overall there is a reduction in the average risk of pre-eclampsia. This reduction in RR was greatest in women at high risk for pre-eclampsia. Pre-eclampsia was not reduced in the subgroup with adequate dietary calcium, but was for those with low baseline calcium intake (8 trials, 10.678 women). Asymmetric funnel plots for these analyses suggest that the treatment effect may be overestimated due to small-study effects or publication bias.
Calcium supplementation reduced the average risk of preterm birth overall (11 trials, 15.275 women), and amongst women at high risk of developing pre-eclampsia (4 trials, 568).Asymmetric funnel plots for these analyses suggest that the treatment effect may be overestimated due to small-study effects or publication bias.
The evidence on the effect of high dose calcium supplementation on pre-eclampsia and preterm birth is of LOW GRADE quality due to heterogeneity and small study effects. Small study effects (with small studies having the most positive results) and heterogeneity indicate publication bias.
Implications for practice: high dose calcium supplementation should be considered during the pregnancy, particularly for those with a high risk on pre-eclampsia and with low dietary calcium intake.
|
Table of quality assessment
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Hofmeyr 2018 |
Yes |
Yes |
Yes |
Yes (only description of individual calcium regimes is missing) |
Not applicable |
Yes |
Yes |
Yes |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Table of excluded studies
|
Alzate, 2015 |
Case control studie |
|
An, 2015 |
Oudere meta-analyse dan Hofmeyr 2018 |
|
Asemi, 2012 |
RCT valt binnen search Hofmeyr 2018 |
|
Atallah, 2000 |
Duplicate met Hofmeyr 2014 |
|
Atallah, 2002 |
Duplicate met Hofmeyr 2014 |
|
Atallah, 2006 |
Commentary paper |
|
Auteur onbekend, 1996 |
Duplicate met Bucher 1996 |
|
Baba Dizavandy, 1998 |
RCT valt binnen search Hofmeyr 2018 |
|
Bassaw, 1998 |
RCT valt binnen search Hofmeyr 2018 |
|
Belizan, 1991 |
RCT valt binnen search Hofmeyr 2018 |
|
Bucher, 1996 |
ouder review dan Hofmeyr 2018 |
|
Buppasiri, 2011 |
oudere meta-analyse dan Hofmeyr 2018 |
|
Camargo, 2013 |
Voldoet niet aan PICO (andere uitkomsten) + cross-sectionele studie/kwalitatief design |
|
Carroli, 1994 |
oudere meta-analyse dan Hofmeyr 2018 |
|
Cong, 1995 |
RCT valt binnen search Hofmeyr 2018 |
|
Crowther, 1999 |
RCT reeds geïncludeerd in Hofmeyr 2018 |
|
Dodd, 2014 |
commentary paper |
|
Duvekot, 2002 |
Case control studie |
|
Goldberg, 2013 |
RCT valt binnen search Hofmeyr 2018 |
|
Herrera, 1998 |
RCT valt binnen search Hofmeyr 2018 |
|
Herrera, 2005 |
RCT valt binnen search Hofmeyr 2018 |
|
Herrera, 2006 |
RCT valt binnen search Hofmeyr 2018 |
|
Hofmeyr, 2003 |
oudere versie van Cochrane review Hofmeyr 2018 (reeds geïncludeerd) |
|
Hofmeyr, 2006 |
Duplicate met Hofmeyr 2014 |
|
Hofmeyr, 2007 |
oudere versie van Cochrane review Hofmeyr 2018 (reeds geïncludeerd) |
|
Hofmeyr, 2010 |
Duplicate met Hofmeyr 2015 |
|
Hofmeyr, 2014 |
oudere versie van Cochrane review Hofmeyr 2018 (reeds geïncludeerd) |
|
Hofmeyr, 2014 |
oudere versie van Cochrane review Hofmeyr 2018 (reeds geïncludeerd) |
|
Hofmeyr, 2014 |
Duplicate met Hofmeyr 2016 |
|
Hofmeyr, 2015 |
RCT valt binnen search Hofmeyr 2018 |
|
Hofmeyr, 2017 |
oudere versie van Cochrane review Hofmeyr 2019 (reeds geïncludeerd) |
|
Hofmeyr, 2019 |
voldoet niet aan PICO betreft Cochrane review met 1 studie van Hofmeyr 2019 met vrouwen die preconceptie tot 20 weken zwangerschap calciumprofylaxe krijgen. |
|
Hofmeyr, 2019 |
RCT valt binnen search Hofmeyr 2018 |
|
Hofmeyr, 2019 |
Duplicate met Hofmeyr 2019 (RCT) |
|
Imdad, 2011 |
ouder review dan Hofmeyr 2018 |
|
Imdad, 2012 |
ouder review dan Hofmeyr 2018 |
|
Khaing, 2017 |
voldoet aan PICO, echter bevat minder studies (n=19 versus. 27) dan geïncludeerd door Hofymeyr 2018 en focust in netwerkmeta-analyse op associatie tussen calcium, vitamine d en placebo/geen behandeling. |
|
Khan, 2013 |
RCT valt binnen search Hofmeyr 2018 |
|
Khanam, 2018 |
voldoet niet aan PICO (verkeerde uitkomstmaten) + retrospectieve studie |
|
Kisters, 2006 --> López-Jamarillo 2005 |
commentary paper |
|
Knight, 1992 |
RCT valt binnen search Hofmeyr 2018 |
|
Kumar, 2009 |
RCT valt binnen search Hofmeyr 2018 |
|
Levine, 1997 |
RCT valt binnen search Hofmeyr 2018 |
|
Levine,1996 |
protocol paper |
|
Li, 2018 |
artikel niet fulltekst beschikbaar |
|
Lopez-Jaramillo, 1997 |
RCT valt binnen search Hofmeyr 2018 |
|
López-Jaramillo, 2000 |
narrative review |
|
Mackillop, 2015 |
ouder review dan Hofmeyr 2018 |
|
Masse, 1996 |
commentary paper |
|
Melnikow, 1996 |
commentary paper |
|
Niromanesh, 2001 |
RCT valt binnen search Hofmeyr 2018 |
|
Omotayo, 2015 |
protocol paper |
|
Patrelli, 2012 |
oudere meta-analyse dan Hofmeyr 2018 |
|
Poropat, 2018 |
Voldoet niet aan PICO (meta-analyse waarin geen interventiestudies naar calciumprofylaxe bij zwangeren zijn geïncludeerd) |
|
Purwar, 1996 |
RCT valt binnen search Hofmeyr 2018 |
|
Richardson, 1995 |
cohort studie |
|
Ritchie, 2000 |
narrative review |
|
Roberts, 1996 |
commentary paper |
|
Rogers, 1999 |
RCT valt binnen search Hofmeyr 2018 |
|
Sanchez-Ramos, 1994 |
RCT valt binnen search Hofmeyr 2018 |
|
Schoenaker, 2014 |
Voldoet niet aan PICO (meta-analyse waarin geen interventiestudies naar calciumprofylaxe bij zwangeren zijn geïncludeerd) |
|
Sibai, 2011 |
comment on Sibai 2010 |
|
Souza, 2014 |
RCT valt binnen search Hofmeyr 2018 |
|
Sun, 2019 |
voldoet aan PICO, echter bevat geen nieuwe literatuur t.o.v. Cochrane review Hofymeyr 2018. |
|
Taherian, 2002 |
RCT valt binnen search Hofmeyr 2018 |
|
Tang, 2015 |
ouder review dan Hofmeyr 2018 |
|
Trumbo, 2007 |
narrative review |
|
Uusi-Rasi, 2013 |
voldoet niet aan PICO (andere patiëntpopulatie en uitkomsten) |
|
Villar, 2000 |
narrative review |
|
Villar, 2006 |
RCT valt binnen search Hofmeyr 2018 |
|
Villar,2003 |
narrative review |
|
Wanchu, 2001 |
RCT valt binnen search Hofmeyr 2018 |
|
Yabes-Almirante, 1998 |
narrative review |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 14-06-2021
Beoordeeld op geldigheid : 22-07-2021
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Calciumsuppletie |
NVOG |
2020 |
2025 |
Elke 2 jaar |
NVOG |
Nieuwe literatuur |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Deze richtlijn is ontwikkeld in samenwerking met:
- Patiëntenfederatie Nederland
Doel en doelgroep
Doel
Deze richtlijn beoogt een leidraad te geven voor de dagelijkse praktijk van de zorg van zwangere vrouwen met een hypertensieve aandoening. De richtlijn bespreekt niet de indicaties voor het beëindigen van de zwangerschap op maternale indicatie, maar beperkt zich bij de behandeling tot de medicamenteuze behandeling.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die aan de ontwikkeling van de richtlijn hebben bijgedragen. Deze staan vermeld bij de samenstelling van de werkgroep. Tot de beroepsgroepen die geen zitting hadden in de werkgroep, maar wel beoogd gebruikers zijn van deze richtlijn behoren o.a. klinisch verloskundigen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor vrouwen met hypertensieve aandoeningen in de zwangerschap.
Werkgroep
- Dr. C.J. (Caroline) Bax, gynaecoloog-perinatoloog, werkzaam in het Amsterdam UMC locatie AMC, NVOG, voorzitter stuurgroep.
- Dr. S.V. (Steven) Koenen, gynaecoloog, werkzaam in het ETZ, locatie Elisabeth Ziekenhuis, NVOG, lid stuurgroep.
- Dr. Duvekot, gynaecoloog, werkzaam in het Erasmus MC, NVOG, lid stuurgroep.
- Dr. M.A. (Marjon) de Boer, gynaecoloog-perinatoloog, werkzaam in het Amsterdam UMC, locatie VUmc, NVOG.
- Dr. A.T. (Titia) Lely, gynaecoloog, werkzaam in het UMC Utrecht, NVOG.
- Dr. P.J. (Petra) Hajenius, gynaecoloog-perinatoloog, werkzaam in het Amsterdam UMC locatie AMC, NVOG.
- Dr. J.W.(Wessel) Ganzevoort, gynaecoloog-perinatoloog, werkzaam in het Amsterdam UMC locatie AMC, NVOG.
- Dr. O.W.H. (Olivier) van der Heijden, gynaecoloog-perinatoloog, werkzaam in het Radboud UMC Nijmegen, NVOG.
- MSc F.M. (Fenna) van der Molen, verloskundige, werkzaam in praktijk Veilige Geboorte, KNOV.
- Dr. M.C. (Mignon) van der Horst, klinisch verloskundige, werkzaam in de Gelderse Vallei Ede, KNOV.
- Mw. A.M.M. (Annemijn) Doppenberg, MSc, adviseur, Patiëntenfederatie Nederland.
- Mw. J.C. (Anne) Mooij, MSc, adviseur, Patiëntenfederatie Nederland.
- Mw. K.L.H.E. (Kim) VandenAuweele, beleidsmedewerker HELLP Stichting.
Meelezers
- Leden van de Otterlo - werkgroep (2020)
Met ondersteuning van
- Dr. A. (Anne) Bijlsma-Rutte, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. L. (Laura) Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.A.C. (Marleen) van Son, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- MSc Y. (Yvonne) Labeur, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bax (voorzitter stuurgroep) |
Gynaecoloog-perinatoloog Amsterdam UMC, locatie AMC, 0,8 fte |
Gastvrouw Hospice Xenia Leiden (onbetaald) |
|
geen |
|
Duvekot (lid stuurgroep) |
Gynaecoloog, Erasmus MC (full time) |
Directeur 'medisch advies en expertise bureau Duvekot', Ridderkerk, ZZP'er |
|
geen |
|
Koenen (lid stuurgroep) |
gynaecoloog, ETZ , Tilburg |
incidenteel juridische expertise (betaald) |
|
geen |
|
de Boer |
gynaecoloog-perinatoloog AUMC, locatie Vumc |
geen |
|
geen |
|
Hajenius |
Gynaecoloog (1.0 fte), afdeling Obstetrie Amsterdam Universitair Medische Centra (AUMC), locatie Meibergdreef (AMC). |
geen nevenwerkzaamheden |
De module Geboortezorg - Hypertensieve aandoeningen zal in de praktijk worden vertaald naar een lokaal protocol voor de afdeling Obstetrie van het AUMC waar ik werkzaam ben en de lokale protocollen beheer. In die zin zullen naaste collega's (artsen, klinisch verloskundigen en arts assistenten) "baat" hebben bij de uitkomsten van de module. |
geen |
|
Lely |
Gynaecoloog WKZ |
off-road commissie lid ZonMw (onkostenvergoeding, onbetaald) |
|
geen |
|
Van der Heijden |
Gynaecoloog, perinatoloog |
Lid multidisciplinaire richtlijn commissie (NVOG): |
|
geen |
|
Ganzevoort |
Gynaecoloog , Amsterdam UMC |
Redacteur NTOG, onbetaald |
Ik ben PI van enkele ZonMW gefinancierde studies bij foetale groeirestrictie en centrum-contactpersoon voor enkele andere pre-eclampsie studies. Binnen die studies wordt ook door Roche Diagnostics materiaal in-kind ter beschikking gesteld. Er zijn door het bedrijf hieraan geen inhoudelijke voorwaarden gesteld, op geen enkel vlak. |
geen actie, de richtlijnmodules doen geen uitspraak over welke testapparatuur/-methode gehanteerd moet worden voor het bepalen van proteïnurie, alleen dat men dit middels het eiwit-kreatinine ratio doet. |
|
van der Horst |
Klinisch verloskundige, ziekenhuis Gelderse Vallei, Ede |
PKV, KNOV vacatievergoeding |
|
geen |
|
van der Molen |
eerstelijns verloskundige, KNOV |
Ledenraad Eerstelijns Verloskundigen Amsterdam Amstelland (EVAA) - afwisselend voorzitter, notulist en algemeen lid - onbetaald Commissie Kwaliteit en onderzoek EVAA - afwisselend voorzitter, notulist en algemeen lid - onbetaald |
|
geen |
|
van Son |
Beleidsmedewerker KNOV |
Niet van toepassing |
|
geen |
|
Van den Auweele |
Beleidsmedewerker Hellp Stichting |
|
|
geen |
|
Ensink |
Medior adviseur patiëntbelang Patiëntenfederatie |
Niet van toepassing |
|
geen |
|
Mooij |
adviseur Patientenbelang, Patientenfederatie Nederland |
Niet van toepassing |
|
geen |
|
Doppenberg |
adviseur Patientenbelang, Patientenfederatie Nederland |
Niet van toepassing |
|
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van patiëntvertegenwoordigers van verschillende patiëntverenigingen voor de Invitational conference en afvaardigen van patiëntenverenigingen in de clusterwerkgroep. Het verslag hiervan is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie per module ook ‘Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)’. De conceptrichtlijn wordt tevens ter commentaar voorgelegd aan de betrokken patiëntenverenigingen.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor vrouwen met hypertensieve aandoeningen in de zwangerschap. Tevens zijn er knelpunten aangedragen door patiëntenverenigingen tijdens de Invitational conference. Een verslag hiervan is opgenomen in de bijlagen.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule wordt aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule wordt aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) 1990-okt 2019 |
1 exp Calcium/ or exp Calcium, Dietary/ or ((calcium or ca or ca2+) adj6 (supplement* or prophylaxis or intake or level* or serum or diet* or use* or oral* or therap*)).ti,ab,kw. (330830) 2 exp Pre-Eclampsia/ or exp Hypertension, Pregnancy-Induced/ or exp HELLP Syndrome/ or eclamp*.ti,ab,kw. or preeclamp*.ti,ab,kw. or 'pre-eclamp*'.ti,ab,kw. or preclamp*.ti,ab,kw. or (hypertens* adj3 (pregnan* or gestational or maternal)).ti,ab,kw. or hellp.ti,ab,kw. (54147) 3 1 and 2 (859) 4 limit 3 to (english language and yr="1990 -Current") (660) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (413444) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1901849) 7 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3274082) 8 4 and 5 (84) 9 (4 and 6) not 8 (125) 10 (4 and 7) not (8 or 9) (113) 11 8 or 9 or 10 (322)
= 322 (85 uniek) |
428 |
|
Embase 1990-okt 2019
|
'eclampsia and preeclampsia'/exp/mj OR 'maternal hypertension'/exp/mj OR 'hellp syndrome'/exp/mj OR eclamp*:ti,ab OR preeclamp*:ti,ab OR 'pre-eclamp*':ti,ab OR preclamp*:ti,ab OR ((hypertens* NEAR/3 (pregnan* OR gestational OR maternal)):ti,ab) OR hellp:ti,ab
AND
'calcium'/exp/mj OR 'calcium supplementation'/exp OR (((calcium OR ca OR ca2+) NEAR/6 (supplement* OR prophylaxis OR intake OR level* OR serum OR diet* OR use* OR oral* OR therap*)):ti,ab)
AND
(english)/lim AND (1990-2019)/py NOT 'conference abstract':it
Gebruikte filters: Sytematische reviews ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)
RCT’s ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it
Observationeel onderzoek 'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)
= 354 (343 uniek) |
