Het meten van de lichtintensiteit van fototherapie
Uitgangsvraag
Wat is de meerwaarde van het meten van de lichtintensiteit van fototherapie?
Aanbeveling
Meet de lichtintensiteit van de fototherapielamp op de plek waar het kind ligt tenminste eenmaal voor de start van de behandeling. De aanbevolen lichtintensiteit bedraagt 30 µW/cm2/nm.
Geef dubbelzijdige fototherapie met een intensiteit van 50 µW µW/cm2/nm (per zijde) bij een TSB > 90% van WT-grens.
Meet de lichtintensiteit op de plek waar het kind ligt ook als fototherapie niet leidt tot een verlaging van het totaal serum bilirubine.
Maak bij het meten van de lichtintensiteit op de plek waar het kind ligt gebruik van een fotoradiometer die past bij de gebruikte apparatuur.
Verklein de afstand tussen de pasgeborene en de lamp bij een te lage lichtintensiteit en let er op dat dit in overeenstemming is met de aanbevelingen van de producent.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De werkgroep heeft een oriënterende literatuuranalyse verricht met betrekking tot eventuele effecten van het meten van lichtintensiteit. Hierbij is met name gelet op de effectiviteit van fototherapie voor en na het meten van de lichtintensiteit.
De werkgroep achtte het relevant wanneer de intensiteit van fototherapie en/ of de behandeling van kinderen met geelzien (snellere daling van TSB, kortere duur van fototherapie en/ of minder wisseltransfusies) zou verbeteren na de metingen.
Gehanteerde zoektermen waren “phototherapy” and “irradiance” and “neonatal hyperbilirubinemia”. Literatuur vanaf 2008 werd geselecteerd. Dit leverde 45 resultaten op waarvan 13 geselecteerd werden.
Beschrijving studies
Er zijn in de literatuur diverse studies verschenen waarin de lichtintensiteit van de gebruikte fototherapie apparatuur wordt geanalyseerd. Van de zogenaamde low income countries is al langer bekend dat de lichtintensiteit van de fototherapielampen dikwijls te laag is. Beschrijvende studies verricht in Brazilië, India, Nigeria, Kameroen en Indonesië bevestigen dat (Ferreira, 2009; Subramanian, 2010; Owa, 2011; Cline, 2013; Satrom, 2014; Olusanya, 2016; Diala, 2017; Sampurna, 2019). Het is echter veel minder bekend dat ook in de high-income countries de lichtintensiteit frequent te laag is, incluis de lichtintensiteit van de fototherapie apparatuur op de IC Neonatologie afdelingen (Van Imhoff, 2013; Borden, 2018). Er zijn beperkte data die laten zien dat er een verbetering van de intensiteit is een aantal jaren na de eerste inventarisatie (Hulzebos, 2017). Ook in de low-income countries is deze verbetering zichtbaar na soms kleine aanpassingen (Cline, 2013; Satrom, 2014; Olusanya, 2016; Diala, 2017) en kan leiden tot een betere behandeling met een hogere intensiteit fototherapie en - indien voldoende goede lampen beschikbaar - ook tot minder wisseltransfusies (Arnolda, 2015). In geen van de hierboven genoemde studies betreffende de lichtintensiteit is het effect op de concentratie van het totaal serum bilirubine (TSB) beschreven. Deze dosis-effect relatie is wel beschreven in de studie van Vandborg (2012). Dit is een RCT met vier armen waarin LED fototherapie gedurende 24 uur op vier verschillende afstanden van de pasgeborenen werd vergeleken. De afstand van fototherapie lamp tot het matras was respectievelijk 20, 29, 38 en 47 centimeter met gemiddelde intensiteiten van 44 (42 tot 48), 39 (36 tot 40), 31 (29 tot 33) en 25 (23 tot 26) µW/cm2/nm. Vandborg (2012) includeerde gezonde pasgeborenen geboren na een zwangerschapsduur van tenminste 33 weken met een ongecompliceerde hyperbilirubinemie, zonder aanwijzingen voor bloedgroepantagonisme en niet ernstig genoeg voor dubbelzijdige fototherapie of wisseltransfusie (n=83). De resultaten werden ook weergegeven uitgesplitst op die verschillende intensiteitsniveaus, respectievelijk < 30 µW/cm2/nm (n=52), 30 tot 45 µW/cm2/nm (n=78) en > 45 µW/cm2/nm (n=21). Er werd in deze studie gekeken naar de standaard 24 uur fototherapiebehandeling, de duur van fototherapie was geen uitkomstmaat van deze studie.
Resultaten
De lichtintensiteit varieert enorm in de diverse beschrijvende studies die de lichtintensiteit hebben geanalyseerd, waarbij de intensiteit vaak te laag (< 10 µW/cm2/nm) is. De manier waarop de metingen verricht zijn (een centraal punt, meerdere meetpunten in craniocaudale richting of op een raster) en de gebruikte spectroradiometer zijn veelal niet identiek in de diverse studies wat het vergelijken van de gemeten gemiddelde en de (gemiddelde) maximale intensiteiten tussen de studies lastig maakt. Een overeenkomst tussen de diverse studies is dat de lage lichtintensiteit vaak veroorzaakt wordt door een te grote afstand tussen fototherapielamp en kind en/of door verouderde of defecte lampen.
Er zijn twee studies die het effect van meten van de lichtintensiteit beschrijven. Eén uitgevoerd in Myanmar (Arnolda, 2015) en één Nederlandse studie (Hulzebos, 2017), allebei in tertiaire NICUs.
De studie uit Myanmar beschrijft het risico op een wisseltransfusie (WT) voor en na een interventie in vier ziekenhuizen. Twee ervan behandelden alleen patiënten die in het ziekenhuis waren geboren (inborn) en de twee andere ziekenhuizen behandelden alleen patiënten die elders waren geboren (outborn). De interventie bestond uit het de beschikbaarheid van twee high-intensity LED fototherapielampen, een spectroradiometer en training van personeel. Er waren 118 WT in inborn neonaten en 140 in outborn neonaten. Het aantal WT was ongewijzigd in één van de twee ziekenhuizen die inborn neonaten behandelden (RR 1,07; 95 % CI 0,80 tot 1,43; p = 0,67) - hier waren te weinig LED lampen beschikbaar om het grote aantal patiënten te behandelen. De kans op een WT was afgenomen met 69 % in het andere “inborn” ziekenhuis (RR 0,31; 95 % CI 0,17-0,57; p < 0.0001). Uit de gepoolde schatting van de kans op een WT in de beide ziekenhuizen die outborn patiënten behandelden, bleek dat de postinterventiekans 33 % lager was (RR = 0.67; 95 % CI: 0.52 tot 0.87; p = 0.002).
De Nederlandse studie beschrijft een toename van de lichtintensiteit vijf jaren na een eerste meting van de lichtintensiteit (Hulzebos, 2017). Hulzebos en collega’s (2017) analyseerden de lichtintensiteit van 36 fototherapielampen in 10 NICUs in 2008 en 2013. Significant meer fototherapielampen leverden de minimaal aanbevolen intensiteit: 80% in 2013 versus ~45% in 2008 (p=0,002) en in 2013 was de intensiteit van de fototherapie apparatuur (lampen en blankets) gestegen in zeven ziekenhuizen. De mediane (spreiding) intensiteit steeg van 9,7 (4,3 tot 32,6) naar 16,4 (6,8 tot 41) μW/cm2/nm voor de 24 geteste fototherapielampen (p=0,004) en van 6,8 (0,8 tot 15,6) tot 22,3 (1,1 tot 36,3) μW/cm2/nm voor de 12 geteste biliblankets (p=0,014). Er werden in 2013 vijf typen LED lampen gebruikt, terwijl dat er in 2008 nog maar één was. Ook was de gemiddelde afstand tussen kind en de fototherapielampen ~9 cm kleiner geworden (p<0,001). De gedachte achter de verbetering van de intensiteit is dat er een toegenomen bewustwording (“awareness”) ontstaan is over factoren van belang voor de effectiviteit van fototherapie (zoals de afstand lamp - kind en de beschikbaarheid van goede LED lampen).
Behalve de studie van Vandborg (2012) is er geen studie na 2008 gepubliceerd over de dosis-effect relatie. Vandborg (2012) rapporteerde het gemiddelde percentage verandering in totaal serum bilirubine (TSB) waarden over een periode van 24 uur bij verschillende lichtintensiteiten (door de afstand kind-lamp te variëren). De TSB waarden namen af bij alle gemeten afstanden: 34% bij een afstand van 47 cm, 41% bij een afstand van 38 cm, 40% bij een afstand van 29 cm en 49% bij een afstand van 20 cm. Er was een statistisch significant grotere afname van de TSB bij een afnemende afstand van de apparatuur (47cm ten opzichte van 38 cm, 29 cm ten opzichte van 20 cm), er werd geen verschil gevonden tussen een afstand van 38 cm versus 29 cm. Er werden in de studie van Vandborg (2012) geen complicaties gerapporteerd anders dan als bijwerking diarree (“losse stools”).
Er zijn geen studies van hoge kwaliteit die het meten van de lichtintensiteit ondersteunen met betrekking tot een hogere lichtintensiteit na de meting of een snellere TSB daling, een kortere fototherapieduur of het aantal wisseltransfusies. Het is in meerder studies wel overduidelijk aangetoond dat de lichtintensiteit vaak te laag is. Er is wel een duidelijke dosis-effect relatie (Vandborg, 2012), die ook al eerder aangetoond is. Sisson (1972) ontdekte deze relatie en Mims (1973) beschreef een bijna lineaire relatie tussen de lichtintensiteit (4 tot 14 µW/cm2) en de daling van TSB in de eerste 24 uur (23 tot 88 µmol/L) bij 44 (premature) kinderen. Tan (1977,1982) beschreef een daling van TSB in de eerste 24 uur (ΔTsB0 tot 24) van 37% en 50% bij een intensiteit van respectievelijk ∼10 tot 12 µW/cm2/nm en ∼30 µW/cm2/nm. Solana (2010) beschreef een grotere daling van TSB bij 40 µW/cm2/nm dan bij 30 µW/cm2/nm. Gezien de bewezen dosis - effect relatie tussen de lichtintensiteit en de mate van TSB daling zal - indien de lichtintensiteit te laag is - het kind langer blootgesteld zijn aan een te hoge TSB, de behandeling langer duren, of een wisseltransfusie nodig zijn om het gewenste effect te bereiken (daling TSB en reductie van het risico op bilirubine toxiciteit).
Rationale/ balans tussen de argumenten voor en tegen de interventie
Het meten van de lichtintensiteit op de plek waar het kind ligt tijdens fototherapie is logisch. Zo wordt de zorgprofessional geïnformeerd over de toegediende dosis fototherapie en werking van de apparatuur, waarmee het kind behandeld wordt. En kunnen aanpassingen van de intensiteit conform voorschriften van de producent uitgevoerd worden. Het gaat hierbij vooral om aanpassingen die de intensiteit kunnen verhogen, zoals het verkleinen van de afstand tussen lamp en kind, en in overeenstemming zijn met de aanbevolen mate van intensiteit.
Onderbouwing
Achtergrond
De huidige aanbevelingen in de te reviseren richtlijn Hyperbilirubinemie betreffende het meten van de lichtintensiteit van fototherapie bestaan uit “regelmatig” (tijdens gebruik) en “jaarlijks” (bij de technische controle), wat onvoldoende is. Dat blijkt bijvoorbeeld uit Nederlandse data van te lage intensiteitsmetingen op de IC Neonatologie afdelingen. Momenteel wordt slechts incidenteel de lichtintensiteit van fototherapie gemeten: tijdens onderhoud of inspectie van de fototherapielampen en bijna nooit op de afdeling, voor of tijdens de behandeling met fototherapie. Het knelpunt is dat men zonder de intensiteit te meten, niet weet of het kind wel juist behandeld wordt. Zonder intensiteitsmeting is men niet geïnformeerd over de werkzaamheid van het apparaat. De aanbevelingen voor de minimale werkzame fototherapie intensiteit is 8-10 μW/cm2/nm, terwijl dat voor intensieve fototherapie 30 μW/cm2/nm is (AAP richtlijn, 2004). Uit onderzoek blijkt dat te lage intensiteiten regelmatig voorkomen. Daarmee neemt de zogenaamde “spectral irradiance” af. Dat is de lichtintensiteit vermenigvuldigd met de huidoppervlakte waarmee de effectiviteit van fototherapie uitgedrukt wordt.
Fysische parameters die de lichtintensiteit bij fototherapie bepalen:
- Fototherapie lamp:
- Intensiteit van de lamp.
- Leeftijd van de lamp. Een van de belangrijkste voordelen van LED lampen is de langere levensduur ten opzichte van conventionele lichtbronnen als halogeen lampen, respectievelijk ~50.000 uur ten opzichte van ~2.000 branduren. Hoe ouder de fototherapie lamp hoe lager de intensiteit van de fototherapie lamp. Onderstaande figuur is exemplarisch voor de afname de lichtintensiteit. In het geval van LED apparatuur is de levensduur ~8.000 tot 10.000 branduren, waarna de lamp met 25% qua intensiteit achteruit gaat.
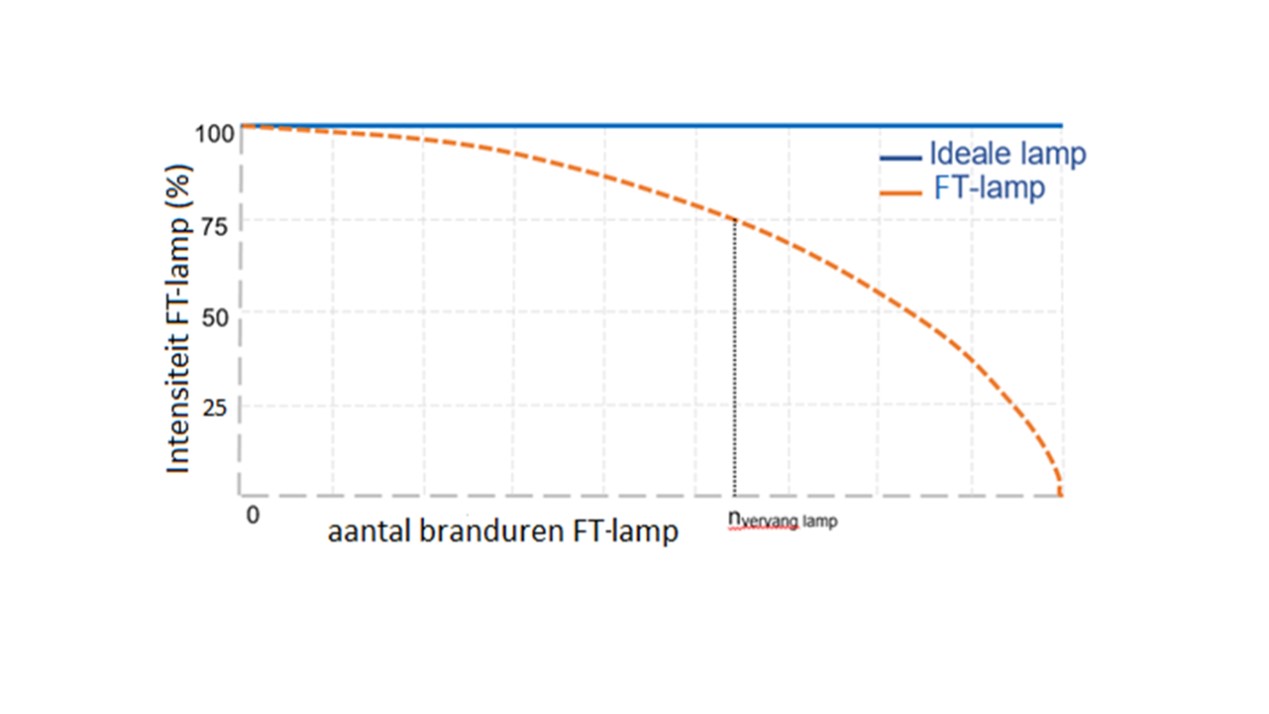
Figuur. Lichtintensiteit van fototherapielampen in de tijd. Door het gebruik van een FT-lamp neemt de lichtintensiteit af (oranje curve). De lichtintensiteit bij aanschaf van een FT-lamp en de afname van de lichtintensiteit van een FT-lamp tijdens het gebruik is afhankelijk van het merk en type van de FT-lamp. Daarom is op de x-as geen schaalverdeling van het aantal branduren vermeld. Verschillende leveranciers adviseren om bij een intensiteit afname van 25%, dus bij de output van 75% van de oorspronkelijke output, de lamp (nvervang lamp) te vervangen.
- Gebruikersaspecten:
- Afstand lamp tot kind. Variatie in afstand van fototherapie lamp tot baby.
- Verstrooiing/absorptie licht. Condens in de couveuse zorgt ervoor dat het licht gedeeltelijk verstrooid en/of geabsorbeerd wordt waardoor de licht intensiteit die het kind bereikt lager zal zijn.
Conclusies / Summary of Findings
De lichtintensiteit van fototherapie apparatuur is vaak te laag. Er is een beperkt aantal studies die laten zien dat na het meten van de (vaak te lage) lichtintensiteit, de intensiteit toeneemt en het risico op WT lager wordt. Hierbij is het essentieel dat er (LED) fototherapielampen zijn, waarmee een zeer hoge intensiteit gegeven kan worden. Er bestaat namelijk, zoals bij veel geneesmiddelen, een duidelijke dosis-effect relatie bij fototherapie.
De specificaties van de fototherapielamp zijn hierbij belangrijk, maar ook gebruikerskenmerken - zoals de afstand waarop de lamp van het kind wordt geplaatst.
Een kleinere afstand tussen fototherapielamp en kind resulteert in een hogere lichtintensiteit en daarmee een snellere daling van het TSB.
Het meten van de lichtintensiteit van fototherapie apparatuur is klinisch zeer relevant.
Door te analyseren wat de intensiteit van fototherapielampen is weten we dat die intensiteit vaak te laag is. Oorzaken hiervoor zijn onder andere een te grote afstand tussen kind en lamp en het gebruik van conventionele fototherapielampen. Deze lampen (vaak met speciale TL buizen) verouderen snel en produceren vaak een insufficiënte lichtintensiteit. LED lampen zijn stabieler en verouderen minder snel en geven daardoor vaker wel voldoende lichtintensiteit. Men zou kunnen redeneren dat controle van de intensiteit tijdens de behandeling op de afdeling daarom niet nodig is. Echter, na het meten van een te lage lichtintensiteit zijn ad hoc aanpassingen noodzakelijk om de intensiteit te verhogen. Bijvoorbeeld door de afstand kind - lamp te verkleinen, of een andere (LED) FT lamp te gebruiken, of een extra (LED) FT lamp. Ook kan door het meten beoordeeld worden of op de plaats waar het kind ligt de hoogste lichtintensiteit is. En zo niet, de positie van de lamp (of van het kind) dienovereenkomstig aan te passen.
Omdat bekend is dat er een positief verband is tussen de mate van effect van fototherapie en de lichtintensiteit, is het wenselijk om de lichtintensiteit te meten en te beoordelen of het kind de juiste intensiteit danwel “dosis fotonen” krijgt. Het meten van de lichtintensiteit van fototherapie past onder het goed gebruik van medische apparatuur. Het is essentieel om te weten aan welke intensiteit fototherapie de patiënt blootgesteld wordt (conform de dosis van een geneesmiddel), of die voldoet aan de aanbevolen intensiteit, en of een effect verwacht mag worden gezien de positieve dosis-effect relatie.
Als de intensiteit onvoldoende is, loopt het kind een onnodig risico op hersenschade door langduriger blootstelling aan te hoge bilirubine concentraties. Als de intensiteit voldoende hoog is, is het risico op een wisseltransfusie lager.
Een niet onderzocht voordeel van het meten kan bestaan uit het vergroten van de awareness van de factoren die nodig zijn voor de werking van fototherapie.
Er is een Nederlandse follow-up studie die laat zien dat de lichtintensiteit een paar jaren na een eerste meting is toegenomen en er is een studie in Myanmar die een afname van wisseltransfusies beschrijft nadat metingen van lichtintensiteit en LED lampen geïntroduceerd zijn. Een hogere lichtintensiteit leidt tot een snellere daling van het TSB.
Het is conform goed gebruik van apparatuur logisch de lichtintensiteit te meten met een fotoradiometer die bij de lamp past. Dat wil zeggen dat de fotoradiometer gevoelig is voor het spectrum van golflengtes van licht die de fototherapielamp uitzendt. Het is dus belangrijk te realiseren dat niet elke willekeurige fotoradiometer passend is voor alle fototherapielampen.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Het belangrijkste voordeel van het meten van de lichtintensiteit van fototherapielampen op de plek waar het kind ligt tijdens de behandeling is dat een niet-effectieve behandeling voorkomen wordt. Zo wordt voorkomen dat er minder dan de geadviseerde lichtintensiteit gegeven wordt. In geval van een te lage intensiteit moet de lichtintensiteit aangepast worden aan het gewenste niveau. Er is zo: minder risico op verdere stijging van de bilirubine concentratie of: een snellere daling en minder kans op hersenschade. Bovendien wordt de behandelduur korter, hetgeen voor kind en ouders prettiger is.
Kosten (middelenbeslag)
Een fotoradiometer is niet duur. De kosten ervan bedragen tussen de €1000,- en €1500,- waarbij jaarlijks hercallibratie noodzakelijk is. Deze kosten vallen mee gezien de kosten van een ziekenhuisopname en de mogelijke langere opnameduur bij onderbehandeling ten gevolge van een behandeling met een te lage lichtintensiteit. En ze vallen in het niet bij de kosten die gepaard kunnen gaan met neurologische schade bij onderbehandelde ernstige hyperbilirubinemie.
Aanvaardbaarheid voor de overige relevante stakeholders
Het meten van de lichtintensiteit voor en tijdens fototherapie is een korte handeling (kost minder dan 1 minuut tijd); dat is geen groot nadeel gezien de vele voordelen.
Haalbaarheid en implementatie
Momenteel is het zo dat in veel ziekenhuizen de afdeling Medische Techniek de verantwoordelijkheid heeft voor de technische controle van de fototherapielampen. En in het kader daarvan dus de lichtintensiteit van de fototherapielampen meten. Meestal gebeurt dat jaarlijks. Dit is gebleken onvoldoende om een goede werking van de fototherapie lampen te garanderen. De werkgroep geeft daarom de aanbeveling om voor het starten van iedere fototherapie de lichtintensiteit tenminste eenmaal te meten op de plek waar het kind ligt.
Samenvatting literatuur
Bij deze uitgangsvraag is geen systematisch literatuuronderzoek verricht.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er geen systematische literatuuranalyse verricht. De werkgroep heeft een oriënterende literatuuranalyse verricht met betrekking tot eventuele effecten van het meten van lichtintensiteit. Gehanteerde zoektermen waren “phototherapy” and “irradiance” and “neonatal hyperbilirubinemia” Hierbij is met name gelet op de effectiviteit van fototherapie voor en na het meten van de lichtintensiteit.
Referenties
- Ferreira AL, Nascimento RM, Veríssimo RC. Irradiance of phototherapy equipment in maternity wards in Maceió. Rev Lat Am Enfermagem. 2009 Sep-Oct;17(5):695-700. PubMed PMID: 19967220.
- Subramanian S, Sankar MJ, Deorari AK, Velpandian T, Kannan P, Prakash GV, Agarwal R, Paul VK. Evaluation of phototherapy devices used for neonatal hyperbilirubinemia. Indian Pediatr. 2011 Sep;48(9):689-96. Epub 2010 Nov 30. PubMed PMID: 21169641.
- Owa JA, Adebami OJ, Fadero FF, Slusher TM. Irradiance readings of phototherapy equipment: Nigeria. Indian J Pediatr. 2011 Aug;78(8):996-8. doi:10.1007/s12098-011-0382-4. Epub 2011 Feb 22. PubMed PMID: 21340724.
- van Imhoff DE, Hulzebos CV, van der Heide M, van den Belt VW, Vreman HJ, Dijk PH; BARTrial Study Group. High variability and low irradiance of phototherapy devices in Dutch NICUs. Arch Dis Child Fetal Neonatal Ed. 2013 Mar;98(2):F112-6. doi: 10.1136/archdischild-2011-301486. Epub 2012 May 18. PubMed PMID: 22611115.
- Cline BK, Vreman HJ, Faber K, Lou H, Donaldson KM, Amuabunosi E, Ofovwe G, Bhutani VK, Olusanya BO, Slusher TM. Phototherapy device effectiveness in Nigeria: irradiance assessment and potential for improvement. J Trop Pediatr. 2013 Aug;59(4):321-5. doi: 10.1093/tropej/fmt027. Epub 2013 May 10. PubMed PMID: 23666953.
- Satrom K, Slusher T, Satrom J. Effectiveness of phototherapy units in Cameroon. J Trop Pediatr. 2014 Jun;60(3):264-6. doi: 10.1093/tropej/fmt110. Epub 2014 Jan 10. PubMed PMID: 24415750.
- Olusanya BO, Osibanjo FB, Emokpae AA, Slusher TM. Irradiance Decay in Fluorescent and Light-emitting Diode-based Phototherapy Devices: A Pilot Study. J Trop Pediatr. 2016 Oct;62(5):421-4. doi: 10.1093/tropej/fmw022. Epub 2016 Apr 26. PubMed PMID: 27118821.
- Diala UM, Ofakunrin AO, Toma BO, Shwe DD, Yilgwan CS, Bode-Thomas F. Factors influencing irradiance of locally fabricated phototherapy devices in Jos, north-central Nigeria. Trop Doct. 2018 Apr;48(2):142-146. doi: 10.1177/0049475517740491. Epub 2017 Nov 19. PubMed PMID: 29153050.
- Borden AR, Satrom KM, Wratkowski P, George TN, Adkisson CA, Vreman HJ, Johnson AP, Nichols KJ, Slusher TM. Variation in the Phototherapy Practices and Irradiance of Devices in a Major Metropolitan Area. Neonatology. 2018;113(3):269-274. doi: 10.1159/000485369. Epub 2018 Jan 31. PubMed PMID:29393277; PubMed Central PMCID: PMC5860931.
- Sampurna MTA, Ratnasari KA, Saharso D, Bos AF, Sauer PJJ, Dijk PH, Hulzebos CV. Current phototherapy practice on Java, Indonesia. BMC Pediatr. 2019 Jun 8;19(1):188. doi: 10.1186/s12887-019-1552-1.
- Arnolda G, Thein AA, Trevisanuto D, Aung N, Nwe HM, Thin AA, Aye NS, Defechereux T, Kumara D, Moccia L. Evaluation of a simple intervention to reduce exchange transfusion rates among inborn and outborn neonates in Myanmar, comparing pre- and post-intervention rates. BMC Pediatr. 2015 Dec 17;15:216. doi: 10.1186/s12887-015-0530-5.
- Hulzebos CV, Van't Klooster SJ, Lorenz K, Vreman HJ, Dijk PH. Irradiance levels of phototherapy devices: a national study in Dutch neonatal intensive care units. J Perinatol. 2017 Jul;37(7):839-842. doi: 10.1038/jp.2017.13. Epub 2017 Mar 2. PubMed PMID: 28252660.
- Vandborg PK, Hansen BM, Greisen G, Ebbesen F. Dose-response relationship of phototherapy for hyperbilirubinemia. Pediatrics. 2012 Aug;130(2):e352-7. doi: 10.1542/peds.2011-3235. Epub 2012 Jul 16. PubMed PMID: 22802603.
- Sisson TR, Kendall N, Shaw E, Kechavarz-Oliai L. Phototherapy of jaundice in the newborn infant. II. Effect of various light intensities. J Pediatr. 1972 Jul;81(1):35-8.
- Mims LC, Estrada M, Gooden DS, Caldwell RR, Kotas RV. Phototherapy for neonatal hyperbilirubinemia--a dose: response relationship. J Pediatr. 1973 Oct;83(4):658-62.
- Tan KL. The nature of the dose-response relationship of phototherapy for neonatal hyperbilirubinemia. J Pediatr. 1977 Mar;90(3):448-52.
- Tan KL. The pattern of bilirubin response to phototherapy for neonatal hyperbilirubinaemia.
Pediatr Res. 1982 Aug;16(8):670-4. - Solana C, Meritano J Efficacy of LEDs phototherapy Pediatric Academic Society, Vancouver, Canada; May 1–4, 2010
- Vreman HJ, Wong RJ, Murdock JR, Stevenson DK. Standardized bench method for evaluating the efficacy of phototherapy devices. Acta Paediatr. 2008 Mar;97(3):308-16. doi: 10.1111/j.1651-2227.2007.00631.x. Epub 2008 Jan 31. PubMed PMID: 18241292.
- Clarkson DM, Satodia P. Use of a hand-held spectroradiometer for the measurement of neonatal phototherapy lamp outputs. Med Eng Phys. 2019 Jul 25. pii: S1350-4533(19)30126-2. doi: 10.1016/j.medengphy.2019.07.001.
- Kuboi T, Kusaka T, Yasuda S, Okubo K, Isobe K, Itoh S. Management of phototherapy for neonatal hyperbilirubinemia: is a new radiometer applicable for all wavelengths and light source types? Pediatr Int. 2011 Oct;53(5):689-693. doi: 10.1111/j.1442-200X.2011.03353.x. PubMed PMID: 21410595.
- Kato S, Iwata O, Yamada Y, Kakita H, Yamada T, Nakashima H, Sugiura T, Suzuki S, Togari H. Standardization of phototherapy for neonatal hyperbilirubinemia using multiple-wavelength irradiance integration. Pediatr Neonatol. 2019 Aug 12. pii: S1875-9572(19)30487-5. doi: 10.1016/j.pedneo.2019.07.002. (Epub ahead of print) PubMed PMID: 31473126.
- Reda SM, AbdElmageed AA, Monem AS, El-Gebaly RH, Faramawy SM. Estimation of spectral mismatch correction factor f1' indicated by radiometer responsivity toward phototherapic infant devices. Appl Opt. 2018 Nov 10;57(32):9615-9619. doi:10.1364/AO.57.009615. PubMed PMID: 30461742.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 29-06-2022
De Nederlandse Vereniging voor Kindergeneekunde (NVK) is regiehouder van deze richtlijn en eindverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijnmodules. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied. De geldigheid van richtlijnmodules zal bij herbeoordeling komen te vervallen wanneer nieuwe ontwikkelingen aanleiding geven om een herzieningstraject te starten.
Het meten van de lichtintensiteit van fototherapie
|
Module[1] |
Regiehouder(s)[2] |
|
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Het meten van de lichtintensiteit van fototherapie |
NVK |
2022 |
2027 |
5 jaar |
NVK |
|
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor pasgeborenen ≥ 35 weken zwangerschap met hyperbilirubinemie.
Werkgroep
- Dr. C.V. Hulzebos, Kinderarts-neonatoloog, NVK (voorzitter)
- H. Burggraaff, Huisarts, NHG
- Ir. A.J. Dam-Vervloet, Klinisch fysicus, NVKF
- Dr. P.H. Dijk, Neonatoloog, NVK
- G. Fokkens (†2021), Zorgdeskundige, Kraamzorg Het Groene Kruis, B. de Vries beleidsmedewerker KCKZ
- M.C. Hootsen MSc, Verloskundige, KNOV
- Dr. A.R. Hulsmann, Neonatoloog, NVK
- Dr. F.C.J.M Klumper, Gynaecoloog-perinatoloog, NVOG
- Drs. E.A. van der Linden, Arts Maatschappij en Gezondheid, AJN Jeugdartsen Nederland
- R. Mevius, Verpleegkundige, V&VN Vrouw & Kind
- Dr. C.H.H. Schoenmakers, Laboratoriumspecialist klinische chemie/ medisch manager, NVKC
- Dr. T.W. de Vries, Kinderarts, NVK
Meelezers
- Ir. M.S. Toll, Klinisch fysicus audioloog, NVKF
- Stichting Kind en Ziekenhuis
Met ondersteuning van
- Dr. L. Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J.H. van der Lee, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie |
|
Mevius |
O&G/OHC verpleegkundige UMCG |
Bestuurslid/penningmeester beroepsvereniging V&VN VOG |
Geen persoonlijke en/of financiële belangen |
Nee |
Nee |
Geen intellectuele belangen |
Nee |
27-8-2018 |
Geen actie |
|
Van der Linden |
Jeugdarts, fulltime verband, Jeugdgezondheidszorg Zuid-Holland West |
Taskforce Rookvrije start Alliantie Nederland Rookvrij deelnemer namens AJN onbetaald, beide |
Geen |
Geen, normaal professioneel niet persoonlijk |
Nee |
Geen |
Nee |
10-10-2018 |
Geen actie |
|
Schoenmakers |
klinisch chemicus Elkerliek |
Stafvoorzitter Elkerliek betaald |
Geen |
Geen |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
24-9-2018 |
Geen actie |
|
Burggraaff |
Praktijkhouder verloskundige huisartspraktijk De Stethoscoop te Weesp |
Huisartsopleider Vumc 0.10 |
Geen |
Geen |
Geen |
Geen |
Geen |
6-11-2018 |
Geen actie |
|
Klumper |
LUMC: gynaecoloog-perinatoloog (100 %) |
Stichting Perined: bestuurslid (onbetaald) |
Geen (financieel) belang bij te formuleren advies, anders dan betere patiëntenzorg. |
Geen |
Geen |
Vanuit betrokkenheid bij foetale therapie, specifiek foetale problematiek tgv erytrocyten-immunisaties (met mogelijk gevolg neonatale bilirubinemie) heeft de afdeling Obstetrie en Foetale Therapie bijzondere expertise opgebouwd. Van directe belangenverstrengeling of van bescherming reputatie/erkenning lijkt me geen sprake. |
Geen |
1-11-2018 |
Geen actie |
|
Hootsen |
1e lijns verloskundige, werkzaam als zelfstandig verloskundig waarneemster bij twee verloskundige praktijken in regio Utrecht en Gelderland. |
Lid van communicatie werkgroep binnen VSV (verloskundig samenwerkingsverband), onbetaald |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
28-11-2018 |
Geen actie |
|
de Vries (TW) |
Kinderarts, Medisch Centrum Leeuwarden. |
onbetaald: redactielid Praktische Pediatrie; lid Wetenschappelijke Advies Raad Geneesmiddelenbulletin, bestuurslid NKFK. |
Geen |
Geen |
Op dit moment participeer ik in onderzoek, een wordt gefinancierd door Zon Mw, de ander door het Longfonds. Beide onderzoeken richten zich niet op het onderwerp |
Geen |
Geen |
24-11-2018 |
Geen actie |
|
Hulzebos* |
Kinderarts-neonatoloog UMC Groningen |
NLS en NALS instructeur (onbetaald) |
Geen |
Neen |
Geen deelname aan voor dit onderwerp relevante onderzoeken. |
Neonatale icterus heeft al enkele jaren mijn aandacht, zoals ook blijkt uit een aantal publicaties in de afgelopen jaren. Ik werk voor het "bilirubine onderzoek" samen met diverse (inter)nationale collega's. Het is mogelijk dat deze publicaties meer aandacht krijgen door het werk van de commissie. |
Neen |
4-12-2018 |
Geen actie |
|
Fokkens |
Zorgdeskundige 24 uur per week Praktijkopleider 8 uur per week Werkgever is Kraamzorg Het Groene Kruis B.V. |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
6-12-2018 |
Geen actie |
|
De Vries (B) |
Beleidsmedewerker 24 uur per week bij KCKZ |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
6-9-2021 |
Geen actie |
|
Dijk |
Kinderarts-neonatoloog, Beatrix Kinderziekenhuis, UMCGroningen. 0.9 FTE, betaald. |
Neonatologie Netwerk Nederland (N3): lid Nederlands Neonatologie Research Netwerk (NNRN) en lid werkgroep benchmarking namens UMC Groningen en lid Raad van Advies N3. onbetaald. Voor aantal multicenterstudies van het NNRN principle investigator in UMCG. onbetaald. Lid Zonmw Cie programma Zwangerschap en Geboorte waarvoor vacatiegelden en reiskostenvergoeding. Lid werkgroep Netwerk Algemene Kindergeneeskunde (Nederlandse Vereniging voor Kindergeneeskunde). onbetaald. Lid Nederlands Kennisnet Farmacotherapie voor kinderen (NKFK) en Kinderformulatium. onbetaald. Lid PEDMED-NL- netwerk voor geneesmiddelen onderzoek met kinderen in Nederland. onbetaald. |
Geen dienstverbanden met bedrijven. Geen betaald adviseurschap. Geen directe financiële belangen. Geen eigendom van patent of product |
Er zijn geen mensen in mijn directe omgeving die baat kunnen hebben bij mijn deelname aan deze richtlijn werkgroep. |
Geen deelname aan onderzoek dat gefinancierd wordt door overheid, fondsen of industrie waarbij de financier belang kan hebben mij de uitkomsten van deze richtlijn ontwikkeling. In 2007-2011 Zonmw doelmatigheidssubsidie en VIMP voor multicenter studie naar de Bilirubine-Albumine Ratio in prematuren (BARTrial) nr: 94507407. |
Als voorzitter van de werkgroep huidige CBO Richtlijn Hyperbilirubinemie heb ik wel een duidelijke relatie met de huidige richtlijn, na het implementatieproces, op praktische wijze weergegeven wordt. De website wordt door mij beheerd en betaald, en kan gezien worden als intellectueel eigendom. ik wordt landelijk en internationaal gezien als expert op gebied van de inhoud van die richtlijn. |
Wij doen in het UMCGroningen, als lever-transplantatie-centrum, uitgebreid onderzoek naar verschillende aspecten van hyperbilirubinemie en leverfalen, zowel bij pasgeborenen, kinderen en volwassenen. Bij pasgeborenen ben ik betrokken bij onderzoek naar hyperbilirunemie zowel qua diagnostiek als behandeling. Via de perinatale audit Nederland hebben wij het thema 'ernstige hyperbilirubinemie' ingebracht, met als doel de oorzaken van ernstige hyperbilirubinemie en de suboptimale zorgaspecten te vinden. Ik maak ook deel uit van de werkgroep. |
16-1-2019 |
Geen actie |
|
Hulsmann |
Kinderarts-neonatoloog , Amphia Ziekenhuis te Breda |
Geen |
Ik verricht wetenschappelijk onderzoek naar fotometrtische bepaling (huidskleur) bij hyperbilirubinemie. Er is een externa partij betrokken maar ik ontvang hievoor geen vergoeding. De methode/techniek zal mogelijk op enig moment (jaren) tot de ontwikkeling van het commercieel verkrijgbaar instrumentarium (transcutane bepaling bilirubinegehalte) leiden. Mijns inziens geen invloed op de richtlijn en geen financieel voordeel voor mij te verwachten. |
Neen |
zie boven |
De literatuursearch en de bijeenkomsten van de commissie helpen mij bij mijn onderzoek: “Skin colour measurements of jaundiced neonates over 30 weeks as an indication of development of hyperbilirubinemia”; een onderzoek naar fotometrische bepaling van hyperbilirubinemia bij zuigelingen”. |
Neen |
23-1-2019 |
Geen actie |
|
Dam-Vervloet |
klinisch fysicus Isala (Zwolle) |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
11-7-2019 |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van patiëntorganisaties voor de Invitational conference. Het verslag hiervan (zie aanverwante producten) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland en Stichting Kind en Ziekenhuis en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor pasgeborenen met hyperbilirubinemie. Tevens zijn er knelpunten aangedragen via een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De module 1 van de richtlijn hyperbilirubinemie is niet officieel gautoriseerd door de KNOV.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
