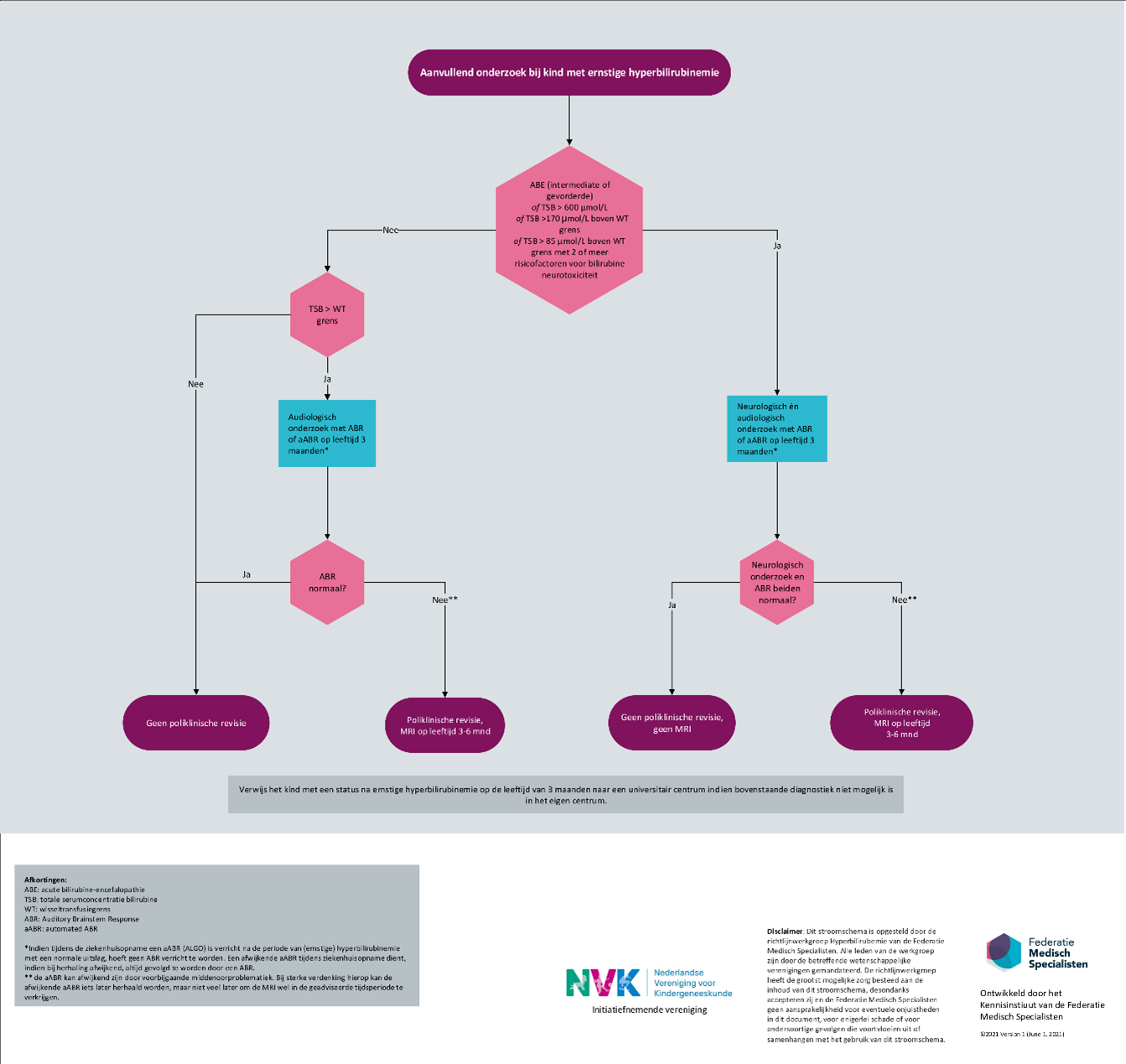
Aanvullend onderzoek
Uitgangsvraag
Bij welke kinderen die hyperbilirubinemie hebben (gehad) moet aanvullend onderzoek (neurologisch, beeldvormend (MRI), audiologisch ((a)ABR)) worden verricht om tijdig gehoorschade en ontwikkelingsstoornissen op te sporen?
Aanbeveling
Realiseer u dat de kans op kernicterus spectrum stoornissen (KSD) toeneemt bij ernstige hyperbilirubinemie.
Ernstige hyperbilirubinemie is gedefinieerd als:
- elke TSB concentratie met symptomen passend bij intermediate of gevorderde ABE (BIND(-M) score ≥ 4);
- een TSB > 600 µmol/L;
- een TSB > 170 µmol/L boven de wisseltransfusiegrens; of
- een TSB > 85 µmol/L boven de wisseltransfusiegrens met 2 of meer risicofactoren voor bilirubine neurotoxiciteit.
Realiseer u dat een OAE nooit voldoet als audiologisch onderzoek bij de hier beschreven aanbevelingen.
Realiseer u dat een aABR met een normaal resultaat (‘PASS’) na de periode van (ernstige) hyperbilirubinemie wel volstaat als audiologisch onderzoek bij de hier beschreven aanbevelingen.
Verricht neurologisch onderzoek én audiologisch onderzoek (aABR of ABR) op de leeftijd van 3 maanden bij elk kind met een status na een ernstige hyperbilirubinemie in de neonatale fase.
Verricht een MRI- hersenen op de leeftijd van 3 tot 6 maanden indien voorgaand onderzoek niet-normaal is (verdacht, licht afwijkend of afwijkend).
Verwijs een kind met een unilaterale of bilaterale uitval bij aABR of ABR naar een audiologisch centrum.
Verwijs het kind met een status na ernstige hyperbilirubinemie op de leeftijd van 3 maanden naar een universitair centrum indien bovenstaande diagnostiek niet mogelijk is in het eigen centrum.
Verricht audiologisch onderzoek (aABR of ABR) bij elk kind met een TSB concentratie boven de wisseltherapiegrens. En als dit afwijkend is, is poliklinische revisie en een MRI geïndiceerd (op de leeftijd van 3 maanden) net als verwijzing naar een audiologisch centrum.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is geen relevante literatuur gevonden die voldoet aan de PICO. De beschikbare publicaties betreffen vooral retrospectieve populatiestudies, waarbij kinderen die ernstige hyperbilirubinemie in de eerste levensweek doormaakten worden vergeleken met een al dan niet gematchte controlegroep zonder ernstige hyperbilirubinemie. De studies tonen heterogeniteit in de definitie van ernstige hyperbilirubinemie en de gebruikte onderzoekstechnieken. Er kan derhalve volgens de gehanteerde methodologie geen sluitende conclusie met betrekking tot de cruciale en belangrijke uitkomstmaten worden getrokken. Hier ligt een kennislacune. De literatuur die de aanbevelingen ondersteunt wordt hieronder besproken.
Uit een aantal studies blijkt dat kernicterus alleen optreedt als TSB > 600 µmol/L (Johnson, 2009; Ebbesen, 2012; Kuzniewicz, 2014). Uit ander onderzoek blijkt dat het risico op CP toeneemt bij kinderen met een TSB > 170 µmol/L boven de wisseltransfusiegrens en kernicterus alleen optreedt bij een TSB concentratie > 85 µmol/L boven de wisseltransfusiegrens in de aanwezigheid van twee of meer risicofactoren (prematuriteit, sepsis, asfyxie, G6PD deficiëntie, hemolyse, hypo-albuminemie en acidose, zoals gedefinieerd in de richtlijn van de American Academy of Paediatrics (AAP) uit 2004 (AAP, 2004; Wu, 2015). Dat kernicterus vooral optreedt in patiënten met hemolyse of sepsis wordt door meerdere studies bevestigd (Manning, 2007; Gamaleldin/ Iskander 2011; Ebbesen, 2012; Sgro, 2012). Er worden dus zeer waarschijnlijk geen kinderen met kernicterus gemist als men bovenstaande bevindingen volgt. Verder blijkt uit een Zweedse population-based studie dat indien er geen symptomen zijn van ABE er nauwelijks risico bestaat voor lange termijn schade (Vandborg, 2014). Dit komt overeen met eerdere data uit de USA. Bij 140 pasgeborenen met TSB concentraties tussen de 428 en 778 µmol/L (92% tussen 428 en 513 µmol/L) was geen associatie met een ongunstige neurologische uitkomst (Newman, 2006). De meerderheid (95%) van deze kinderen was behandeld met fototherapie. Het is ook beschreven dat uitkomsten van kinderen met ernstige hyperbilirubinemie die wel symptomen hebben van ABE toch gunstig kunnen zijn. ABE blijkt derhalve reversibel te kunnen zijn, mits maar een snelle en effectieve behandeling gegeven wordt (Hansen, 2009).
Afwijkingen op de MRI verricht in de eerste dagen of weken na ABE bestaan onder andere uit een bilaterale hyperintense globus pallidus en subthalame kernen op T1 gewogen opnames (Shapiro, 2010, Yan, 2018). Een MRI in de neonatale fase kan geïndiceerd zijn bij pasgeborenen met een hyperbilirubinemie en symptomen van intermediate of gevorderde ABE, een afwijkend neurologisch onderzoek of een gestoorde ABR, of bij een TSB > 425 µmol/L (Watchko, 2013; Wisnowksi, 2016). Een MRI in de neonatale fase kan - ook bij ABE -normaal zijn (Yuan, 2019), maar kan ook vals-positief zijn (hyperintense globus pallidus en subthalame nucleus op T1 gewogen opnames ten gevolge van de aanwezigheid van vetrijk myeline) (Wisnowski, 2014). Bij een pasgeborene met een afwijkend neurologisch onderzoek en/ of ABR is een normale MRI geruststellend, maar niet conclusief. Een langere follow-up is geïndiceerd. Als er cerebrale afwijkingen op de MRI gevonden worden in de neonatale fase bij een pasgeboren kind met een afwijkend neurologisch onderzoek en/ of ABR, is dat wel verontrustend (Wisnowski, 2014). De klassieke afwijkingen op een later verrichte MRI bestaan uit hyperintense globus pallidus en subthalame nucleus op T2 gewogen opnames.
Sensorineural hearing loss (SNHL) of perceptief gehoorverlies betekent dat het gehoorverlies zowel in het sensorische als het neurale deel kan zitten en kan veroorzaakt worden door ernstige hyperbilirubinemie (Shapiro, 2001; Smith, 2005; Saluja, 2010; Johnson, 2011). Een intermezzo over gehoorverlies en hyperbilirubinemie vindt u in de bijlage. De door bilirubine veroorzaakte beschadiging van de retrocochleaire (neurale) structuren kan worden gedetecteerd met een ABR (Gupta, 1990; Ip, 2004; Sharma, 2006; Shapiro, 2011; Amin, 2017). Met de gangbare neonatale gehoorscreening (otoakoestische emissie (OAE)) voor de reguliere populatie wordt het sensorische gedeelte getest en is retrocochleair gehoorverlies niet aantoonbaar en derhalve niet geschikt voor deze populatie. De NICU-populatie wordt (indien > 24 uur opgenomen op de NICU) met een automated ABR (aABR, merknaam van apparatuur die veel gebruikt wordt: ALGO) gescreend. Ook deze aABR volstaat voor deze populatie. De ALGO gebeurt overigens ook door de JGZ als een OAE tweemaal afwijkend is. Op indicatie zal er een formele ABR moeten worden verricht door een audiologisch centrum.
In de neonatale fase varieert de incidentie van SNHL bij kinderen met (overigens wisselende definities van) hyperbilirubinemie tussen de 13% tot 83%. Dit is veel lager, namelijk 7% tot 14% bij de follow-up op de leeftijd van 3 maanden (Akinpelu, 2013). De ABR normaliseert dus vaak als de TSB concentratie daalt (Ip, 2004; Sharma, 2006).
De incidentie van SNHL in populatie studies met een langere follow-up inclusief audiologisch onderzoek is veel lager: 2.2 % op 8-jarige leeftijd zonder dat er sprake was van een verhoogd risico bij TSB ≥ 340 µmol/L (RR 1; 95% CI 0,3 tot 3) (Newman, 1993). Ook in een ander cohort was er geen verhoogd risico op doofheid bij TSB ≥ 325 µmol/L (RR 1,3; 95% CI 0,8 tot 2,1) (Jangaard, 2008). Uit data van 110 kinderen met een ernstige hyperbilirubinemie (> 510 µmol/L) in Ierland en de UK bleek SNHL te bestaan in 3 van de 14 kinderen met een KSD. Zij hadden een TSB concentratie tussen de 547 µmol/L en 664 µmol/L en hadden extra risicofactoren (< 38 weken, hemolyse (G6PD deficiëntie, AB0 incompatibiliteit)) (Manning 2007). Deze data sluiten aan bij een recente studie uit de Verenigde Staten: piek TSB concentraties tot 600 µmol/L waren niet geassocieerd met een verhoogd risico op SN gehoorverlies (Wickremasinghe, 2015). Een verhoogd risico op SNHL bij gezonde à terme pasgeborenen bleek pas bij een TSB concentratie > 600 µmol/L of 170 µmol/L boven de wisseltransfusiegrens (grenzen conform de richtlijnen van de AAP uit 2004). De auteurs concluderen zelfs dat bij een TSB concentratie tot 85 µmol/L boven de wisseltransfusiegrens het risico van een wisseltransfusie niet opweegt tegen het risico op gehoorverlies. Immers, de morbiditeit van een wisseltransfusie bedraagt tot 5% en de mortaliteit tot 1.9% (Ip, 2004). Hierbij is het wel belangrijk op te merken dat de wisseltransfusie procedure niet om die reden uitgesteld moet worden. Het duurt immers een tijd voordat het wisselbloed gearriveerd is en de TSB concentratie kan nog doorstijgen.
Auditory neuropathy spectrum disorder (ANSD) of het auditieve neuropathie spectrum, een voor hyperbilirubinemie typerende gehoordisfunctie werd niet onderzocht in laatstgenoemde artikel. Kinderen met ANSD kunnen doof zijn, maar dat hoeft niet. Ze hebben een normale cochleaire functie (en normale OAE), maar disfunctie van de N. acusticus (N VIII) en een afwijkende ABR. ANSD kan leiden tot spraak- taalstoornissen en vroege opsporing en behandeling kan de gevolgen beperken. Omdat ANSD alleen met een (a)ABR op te sporen is en het kind na een neonatale hyperbilirubinemie op de leeftijd van 3 maanden een normaal neurologisch onderzoek kan hebben, is het advies om op de leeftijd van 3 maanden een ABR te verrichten, maar niet als er een aABR of een ABR is verricht die normaal is (zie schema en aanbevelingen).
Bilirubine-geïnduceerde gehoorschade kan volgens sommige onderzoekers wel optreden onder de wisseltransfusiegrens vooral indien er co-morbiditeit (infectie, hypoxie) bestaat. De TSB drempelwaarde waarboven dit optreedt wordt wisselend aangegeven in de literatuur.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
- Ten aanzien van ontwikkelingsstoornissen inclusief kernicterus spectrum stoornissen: het is essentieel dat ontwikkelingsstoornissen vroegtijdig opgespoord worden. Ouders kunnen eerder worden ingelicht over de te verwachten restschade en er kan fysiotherapie en (hoor)revalidatie worden opgestart om de ouders en verzorgers vroegtijdig te ondersteunen bij de ontwikkeling van hun kind.
- Ten aanzien van MRI: een MRI-hersenen kan restschade meestal (dus niet altijd) voorspellen, maar deze schade is vervolgens niet te voorkomen. Een MRI in de neonatale fase kan vals-positief zijn: het hoge vetgehalte van myeline in de basale kernen geeft een hoog T1 signaal hetgeen kan worden verward met hyperintensiteit door beschadiging (Wisnowski, 2014). Voor een MRI is procedurele sedatie of narcose noodzakelijk en het verrichten van een MRI is in de meeste algemeen ziekenhuizen niet eenvoudig te realiseren.
- Ten aanzien van gehoorschade: vroegtijdige onderkenning van gehoorstoornissen maakt het mogelijk dat vroegtijdig gerichte behandeling wordt gegeven. Bijvoorbeeld plaatsing van hoortoestellen of een cochleair implantaat waardoor de spraak- taalontwikkeling bevorderd wordt. Een tijdige/spoedige interventie zorgt dat optimaal gebruik gemaakt wordt van de gevoelige periode. Het auditief functioneren van kinderen met CI’s die later zijn geplaatst, is minder goed en met name de complexere spraaktaal ontwikkeling blijft achter. De voor de normale /gezonde populatie gehoorscreeningsmethode OAE is echter niet geschikt voor het opsporen van bilirubine-geïnduceerde gehoorschade. Daarover moeten ouders geïnformeerd worden als er op indicatie een hersenstam audiometrie (Brainstem Evoked Response Audiometry (BERA) ook wel Auditory Brainstem Response (ABR) genoemd) moet worden verricht. Dit onderzoek is niet duur en niet erg belastend, maar de literatuur is niet eenduidig wanneer en met welk interval (bij welke patiënt en bij welke bilirubinewaarde) dit geïndiceerd is. Over de timing van de ABR adviseert de werkgroep om dit op de leeftijd van 3 maanden te verrichten. Gehoorstoornissen worden zo vroegtijdig opgespoord en de kans van slagen van een ABR is groter bij een jonge baby, die meer en dieper slaapt.
Er is nog wel een uitzondering, namelijk als er een aABR verricht is ten tijde van de ziekenhuisopname. Bij alle kinderen die > 24 uur op een IC Neonatologie afdeling hebben gelegen wordt een aABR (ALGO) screening verricht. De ALGO wordt hier ingezet als screenend instrument. Als de ALGO uitslag bij herhaling afwijkend is, dient een ABR verricht te worden (en een verwijzing naar een audiologisch centrum). Bij een normale eerste ALGO uitslag (‘beiderzijds pass’), hoeft dit niet en ook niet als de ALGO pas bij de tweede keer na de periode van (ernstige) hyperbilirubinemie normaal is.
Kosten (middelenbeslag)
- Follow-up door neurologisch onderzoek vereist gespecialiseerde zorgmedewerkers (kinderartsen, neonatologen, kinderneurologen, fysiotherapeuten) en is daardoor duur.
- Een MRI onder procedurele sedatie of narcose vereist een gespecialiseerd team en speciale apparatuur (anti-magnetisch). De kosten van een MRI-onderzoek zullen enkele honderden euro’s bedragen.
- Een (a)ABR is niet kostbaar. Hoortoestellen zijn relatief goedkoop. Een cochleair implantaat en de ambulante vervolgbehandeling zijn duur, maar goedkoper dan kosten op de langere termijn van aangepast onderwijs en -werk (los van het persoonlijk leed bij ernstig gehoorverlies).
Aanvaardbaarheid, haalbaarheid en implementatie
De meeste kinderen met hyperbilirubinemie worden behandeld in een algemeen (perifeer) ziekenhuis. De behandeling (fototherapie en soms een wisseltransfusie) is relatief eenvoudig, goedkoop en effectief. Kernicterus is een zeldzame complicatie en aanvullend onderzoek hiernaar wordt zelden noodzakelijk geacht door de behandelend arts. Dientengevolge zijn er geen epidemiologische data van kernicterus in Nederland, behoudens casuïstische mededelingen. Daarom wil de werkgroep graag een advies geven over het te verrichten aanvullend onderzoek. We weten dat de meeste algemeen ziekenhuizen niet beschikken over de benodigde apparatuur noch over gespecialiseerde zorgverleners voor het verrichten van audiologisch onderzoek en een MRI-hersenen bij zuigelingen. Implementatie van deze onderzoekstechnieken vereist forse investeringen die voor de meeste ziekenhuizen niet haalbaar/realistisch zijn mede gezien het geringe aantal patiënten. Daarom is het logisch om op indicatie het aanvullend onderzoek in universitaire centra te laten verrichten. Dat zal dan een verwijzing van het betreffende kind inhouden.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Bij wie en wanneer wordt aanvullend onderzoek (neurologisch onderzoek, MRI, ABR) geadviseerd?
1. Verricht een MRI-hersenen op de leeftijd van 3-6 maanden bij ernstige hyperbilirubinemie bij een kind met:
- symptomen van intermediate of gevorderde ABE (BIND(-M) score ≥ 4 ongeacht de hoogte van TSB)
- een TSB > 600 µmol/L;
- een TSB > 170 µmol/L boven de wisseltransfusiegrens;
- een TSB > 85 µmol/L boven de wisseltransfusiegrens met 2 of meer risicofactoren voor bilirubine neurotoxiciteit);
- als neurologisch follow-up onderzoek op de leeftijd van 3 maanden niet normaal is (verdacht/ licht afwijkend/ afwijkend).
2. Verricht audiologisch onderzoek (aABR of ABR) op de leeftijd van 3 maanden ongeacht het neurologisch follow-up onderzoek op de leeftijd van 3 maanden (dus ook als het normaal is) bij een kind met:
- symptomen van intermediate of gevorderde ABE (BIND(-M) score ≥ 4 ongeacht de hoogte van TSB);
- een TSB > 600 µmol/L;
- een TSB 170 µmol/L boven de wisseltransfusiegrens;
- een TSB > 85 µmol/L boven de wisseltransfusiegrens in aanwezigheid van 2 of meer risicofactoren
Indien tijdens de ziekenhuisopname een AABR (ALGO) is verricht na de periode van ernstige hyperbilirubinemie met een normale uitslag, hoeft geen ABR verricht te worden. Bij een afwijkende ALGO (=aABR) screening na een periode van ernstige hyperbilirubinemie is, indien bij herhaling afwijkend, een ABR wel geïndiceerd, ook op de leeftijd van 3 maanden.
Indien aanvullend onderzoek (MRI, ABR) geïndiceerd is, maar niet mogelijk is in een ziekenhuis, geldt aanbeveling 3.
Indien een ABR wel mogelijk is (bijvoorbeeld in een audiologisch centrum) en afwijkend is en een MRI niet verricht kan worden, geldt aanbeveling 3.
3. Verwijs het kind met een status na ernstige hyperbilirubinemie (kind met symptomen van intermediaire of gevorderde ABE (BIND(-M) score ≥ 4) ongeacht de TSB concentratie ,TSB > 600 µmol/L of een TSB > 170 µmol/L boven de wisseltransfusiegrens of een TSB > 85 µmol/L boven de wisseltransfusiegrens met 2 of meer risicofactoren voor bilirubine neurotoxiciteit) op de leeftijd van 3 maanden naar een universitair centrum.
Voor het doorverwijzen naar een universitair centrum bestaan een aantal argumenten. Allereerst is dat de mogelijkheid van specifieke ontwikkelingstesten en aanvullend onderzoek (ook een audiologisch centrum is ‘in huis’) en ten tweede de mogelijkheid om met meer experts de diagnose kernicterus spectrum stoornissen te overwegen. Daarnaast kan - indien er afwijkingen zijn - gerichte begeleiding gegeven worden.
De werkgroep heeft overwogen om bij deze kinderen al in de neonatale fase aanvullend onderzoek (ABR en MRI) te adviseren. Als er cerebrale afwijkingen op de MRI gevonden worden in de neonatale fase bij een pasgeboren kind met een afwijkend neurologisch onderzoek (dus symptomen van (ABE) en/ of een afwijkende ABR, is dat wel verontrustend (Wisnowski, 2014). De uiteindelijke conclusie om een advies over aanvullend onderzoek in de neonatale fase achterwege te laten berust op de overweging dat dit een beperkte klinische meerwaarde heeft (ABR afwijkingen kunnen transient zijn) en in veel centra logistiek ingewikkeld is, danwel niet mogelijk (zoals een MRI). De werkgroep vindt het dan beter om deze kinderen op de leeftijd van 3 maanden te (laten) onderzoeken of eerder als een kind zich afwijkend ontwikkelt. Wel is er een rol voor de ALGO screening in de neonatale fase bij de kinderen opgenomen op de IC Neonatologie (zie Aanbeveling 2).
4. Verricht audiologisch onderzoek (aABR of ABR) bij elk kind met een hyperbilirubinemie, die niet aan de definitie ernstig voldoet, maar waarbij de bilirubineconcentratie tot boven de wisseltransfusiegrens is gestegen. Indien dit normaal is, hoeft er geen verdere poliklinische controle. Poliklinische controle en een MRI is wel geïndiceerd als audiologisch onderzoek afwijkend is. Als er tijdens de ziekenhuisopname en na de episode van hyperbilirubinemie een ALGO screening verricht is die normaal is, dan vervalt de indicatie voor een ABR. Een afwijkende aABR dient, indien bij herhaling afwijkend, altijd gevolgd te worden door een ABR.
De werkgroep doet de aanbeveling van een poliklinische revisie, omdat het betreffende kind een zeer hoge bilirubineconcentratie heeft gehad. Deze is zelfs zo hoog geweest dat er een zeer intensieve behandeling is uitgevoerd en er een indicatie heeft bestaan voor een wisseltransfusie of deze mogelijk zelfs uitgevoerd is. De werkgroep stelt voor om als termijn voor de revisie 3 maanden aan te houden.
Onderbouwing
Achtergrond
Ernstige hyperbilirubinemie kan resulteren in hersenschade met handicaps tot gevolg. De kans op hersenschade is multifactorieel en wordt bepaald door de hoogte van de piekbilirubine concentratie, de duur en de oorzaak van de hyperbilirubinemie, de aanwezigheid van co-morbiditeit en het neurologisch onderzoek bij presentatie. Neurologische verschijnselen bij pasgeborenen met ernstige hyperbilirubinemie in de acute fase worden ook wel omschreven als acute bilirubine-encefalopathie (ABE; zie bijlage tabel ABE). De symptomen van ABE kunnen worden geclassificeerd met de zogenaamde ‘bilirubin-induced neurological dysfunction (BIND) score’ (Johnson, 1999; Bahr, 2019); een klinische score, waarbij 0-3 punten worden gegeven aan drie parameters: huilen, gedrag en spiertonus (zie bijlage tabel BIND score). Ook is er een gemodificeerde BIND-M score, waarbij ook de oogstand en oogbewegingen beoordeeld worden (Radmacher, 2015; zie bijlage tabel BIND-M score). ABE wordt ingedeeld in drie fasen (Volpe, 2008). Vroege ABE met lethargie, hypotonie en slecht drinken (BIND-(M) score 1, 2 of 3). Intermediaire ABE met agitatie, abnormaal huilgedrag, wisselende spiertonus met hypertonie, retrocollis, en opisthotonus en koorts. En vergevorderde ABE met sunset fenomeen, apneu-aanvallen, convulsies, coma en overlijden. De incidentie van ABE neemt toe bij een TSB ≥ 599 µmol/L tot wel ~30% (Manning, 2007; Ebbesen, 2012; Gotink, 2013; Kusniewicz, 2014). Pasgeborenen ≥ 35 weken die zich presenteren met ernstige hyperbilirubinemie en symptomen van intermediaire of gevorderde ABE (BIND(-M) score ≥ 4) kunnen chronische gevolgen ontwikkelen (Ebbesen, 2000; Bhutani, 2009). Deze chronische gevolgen worden tegenwoordig aangeduid met de term ‘kernicterus spectrum disorders’ (KSD) oftewel kernicterus spectrum stoornissen, omdat het beeld kan variëren van lichte afwijkingen tot het beeld van klassieke kernicterus. Klassieke kernicterus bestaat uit blijvende restschade bestaande uit gehoorverlies, verticale blikparese, motorische stoornissen (dystonie, choreoathetosis, spastische diplegie/tetraplegie) en tandglazuurafwijkingen van het melkgebit. Ook kan psychomotore retardatie optreden (Mwaniki, 2012). De incidentie van KSD is veel lager dan die van ABE en varieert per land (bijvoorbeeld: ~ 1/100.000 in de USA, UK, Ierland (Manning, 2007; Kuzniewics, 2014) en 2.3/100.000 in Canada (Sgro, 2012). Of en in welke mate KSD in Nederland voorkomt, is niet bekend. Er wordt weinig follow-up onderzoek gedaan bij kinderen die een ernstige hyperbilirubinemie hebben gehad. Bij de revisie van de richtlijn Hyperbilirubinemie heeft de werkgroep zich ten doel gesteld om te beschrijven bij wie en wanneer welk aanvullend onderzoek geadviseerd wordt na een ernstige hyperbilirubinemie in de neonatale fase. Onder aanvullend onderzoek valt de neurologische follow-up, beeldvorming (MRI) en audiologisch onderzoek (ABR) van deze patiënten. Het doel hiervan is de KSD vroeg op te sporen en de eventuele gevolgen ervan te beperken.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Bij welke kinderen met hyperbilirubinemie is aanvullend onderzoek nodig om evt. gevolgen (gehoor- en ontwikkelingsproblematiek (kernicterus spectrum stoornissen)) tijdig op te sporen?
P: Neonaten met hyperbilirubinemie;
I: Prognostische factoren: hoogste bilirubinewaarde, fototherapie, wisseltransfusies;
C: Afwezigheid van deze prognostische factoren;
O: Ontwikkelingsproblematiek (kernicterus spectrum stoornissen), abnormale MRI, gehoorschade.
Relevante uitkomstmaten
De werkgroep achtte ontwikkelingsstoornissen bijvoorbeeld vastgesteld met de Gross Motor Function Classification System (GMFCS) schaal of Bayley-test, een afwijkende MRI en/ of een abnormale ABR voor de besluitvorming cruciale uitkomstmaten.
De werkgroep definieerde a priori niet de uitkomstmaten en klinisch (patiënt) relevante verschillen.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 12 juli 2019 met relevante zoektermen gezocht naar systematische reviews, RCTs en observationele studies. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 505 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: vergelijking van uitkomsten tussen kinderen met hyperbilirubinemie bij wie al dan niet prognostische factoren aanwezig waren zoals hoge piekwaarde serumbilirubine, behandeling, andere prognostische factoren (bloedgroepantagonisme, sepsis, asfyxie, G6PD deficiëntie, pre-/dysmaturiteit) en bij wie aanvullend onderzoek is gedaan. Op basis van titel en abstract werden in eerste instantie 33 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens alle 33 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording).
Resultaten
Er zijn geen onderzoeken opgenomen in de literatuuranalyse, omdat er geen studies zijn gevonden die antwoord gaven op de zoekvraag.
Referenties
- Akinpelu OV, Waissbluth S, Daniel SJ. Auditory risk of hyperbilirubinemia in term newborns: a systematic review. Int J Pediatr Otorhinolaryngol. 2013 Jun;77(6):898-905. doi: 10.1016/j.ijporl.2013.03.029. Epub 2013 Apr 30. PMID: 23642487.
- Amin SB, Saluja S, Saili A, Laroia N, Orlando M, Wang H, Agarwal A. Auditory toxicity in late preterm and term neonates with severe jaundice. Dev Med Child Neurol. 2017 Mar;59(3):297-303. doi: 10.1111/dmcn.13284. Epub 2016 Oct 8. PMID: 27718221; PMCID: PMC5288130.
- Bahr TM, Christensen RD, Agarwal AM, George TI, Bhutani VK. The Neonatal Acute Bilirubin Encephalopathy Registry (NABER): Background, Aims, and Protocol. Neonatology. 2019;115(3):242-246. doi: 10.1159/000495518. Epub 2019 Jan 22. PMID: 30669144.
- Gkoltsiou K, Tzoufi M, Counsell S, Rutherford M, Cowan F. Serial brain MRI and ultrasound findings: relation to gestational age, bilirubin level, neonatal neurologic status and neurodevelopmental outcome in infants at risk of kernicterus. Early Hum Dev. 2008 Dec;84(12):829-38. doi: 10.1016/j.earlhumdev.2008.09.008. Epub 2008 Oct 11. PMID: 18851903.
- Gupta AK, Raj H, Anand NK. Auditory brainstem responses (ABR) in neonates with hyperbilirubinemia. Indian J Pediatr. 1990 Sep-Oct;57(5):705-11. doi: 10.1007/BF02728718. PMID: 2094672.
- Hansen TW, Nietsch L, Norman E, Bjerre JV, Hascoet JM, Mreihil K, Ebbesen F. Reversibility of acute intermediate phase bilirubin encephalopathy. Acta Paediatr. 2009 Oct;98(10):1689-94. doi: 10.1111/j.1651-2227.2009.01409.x. Epub 2009 Jul 6. PMID: 19583707.
- Ip S, Chung M, Kulig J, O'Brien R, Sege R, Glicken S, Maisels MJ, Lau J; American Academy of Pediatrics Subcommittee on Hyperbilirubinemia. An evidence-based review of important issues concerning neonatal hyperbilirubinemia. Pediatrics. 2004 Jul;114(1):e130-53. doi: 10.1542/peds.114.1.e130. PMID: 15231986.
- Jangaard KA, Fell DB, Dodds L, Allen AC. Outcomes in a population of healthy term and near-term infants with serum bilirubin levels of >or=325 micromol/L (>or=19 mg/dL) who were born in Nova Scotia, Canada, between 1994 and 2000. Pediatrics. 2008 Jul;122(1):119-24. doi: 10.1542/peds.2007-0967. PMID: 18595994.
- Johnson L, Brown AK, Bhutani V. BINDA clinical score for bilirubin induced neurologic dysfunction in newborns. Pediatrics. 1999;104(suppl 4):746747. Conference abstract.
- Johnson L, Bhutani VK. The clinical syndrome of bilirubin-induced neurologic dysfunction. Semin Perinatol. 2011 Jun;35(3):101-13. doi: 10.1053/j.semperi.2011.02.003. PMID: 21641482.
- Lunsing RJ, Pardoen WF, Hadders-Algra M. Neurodevelopment after moderate hyperbilirubinemia at term. Pediatr Res. 2013 May;73(5):655-60. doi: 10.1038/pr.2013.28. Epub 2013 Feb 13. PMID: 23407118.
- Manning D, Todd P, Maxwell M, Jane Platt M. Prospective surveillance study of severe hyperbilirubinaemia in the newborn in the UK and Ireland. Arch Dis Child Fetal Neonatal Ed. 2007 Sep;92(5):F342-6. doi: 10.1136/adc.2006.105361. Epub 2006 Oct 30. PMID: 17074786; PMCID: PMC2675352.
- Newman TB, Liljestrand P, Jeremy RJ, Ferriero DM, Wu YW, Hudes ES, Escobar GJ; Jaundice and Infant Feeding Study Team. Outcomes among newborns with total serum bilirubin levels of 25 mg per deciliter or more. N Engl J Med. 2006 May 4;354(18):1889-900. doi: 10.1056/NEJMoa054244. PMID: 16672700.
- Newman TB, Klebanoff MA. Neonatal hyperbilirubinemia and long-term outcome: another look at the Collaborative Perinatal Project. Pediatrics. 1993 Nov;92(5):651-7. PMID: 8414851.
- Radmacher PG, Groves FD, Owa JA, Ofovwe GE, Amuabunos EA, Olusanya BO, Slusher TM. A modified Bilirubin-induced neurologic dysfunction (BIND-M) algorithm is useful in evaluating severity of jaundice in a resource-limited setting. BMC Pediatr. 2015 Apr 1;15:28. doi: 10.1186/s12887-015-0355-2. PMID: 25884571; PMCID: PMC4389967.
- Saluja S, Agarwal A, Kler N, Amin S. Auditory neuropathy spectrum disorder in late preterm and term infants with severe jaundice. Int J Pediatr Otorhinolaryngol. 2010 Nov;74(11):1292-7. doi: 10.1016/j.ijporl.2010.08.007. Epub 2010 Sep 15. PMID: 20832127; PMCID: PMC2962441.
- Shapiro SM, Popelka GR. Auditory impairment in infants at risk for bilirubin-induced neurologic dysfunction. Semin Perinatol. 2011 Jun;35(3):162-70. doi: 10.1053/j.semperi.2011.02.011. PMID: 21641490.
- Shapiro SM, Nakamura H. Bilirubin and the auditory system. J Perinatol. 2001 Dec;21 Suppl 1:S52-5; discussion S59-62. doi: 10.1038/sj.jp.7210635. PMID: 11803418.
- Shapiro SM. Chronic bilirubin encephalopathy: diagnosis and outcome. Semin Fetal Neonatal Med. 2010 Jun;15(3):157-63. doi: 10.1016/j.siny.2009.12.004. Epub 2010 Jan 29. PMID: 20116355.
- Shapiro SM. Chapter 11. Kernicterus. In: Stevenson DK, Maisels M, Watchko JF. eds. Care of the Jaundiced Neonate. McGraw Hill; 2012. Accessed February 24, 2023. https://accesspediatrics.mhmedical.com/content.aspx?bookid=528§ionid=41538467
- Sharma P, Chhangani NP, Meena KR, Jora R, Sharma N, Gupta BD. Brainstem evoked response audiometry (BAER) in neonates with hyperbilirubinemia. Indian J Pediatr. 2006 May;73(5):413-6. doi: 10.1007/BF02758564. PMID: 16741327.
- Sgro M, Campbell DM, Kandasamy S, Shah V. Incidence of chronic bilirubin encephalopathy in Canada, 2007-2008. Pediatrics. 2012 Oct;130(4):e886-90. doi: 10.1542/peds.2012-0253. Epub 2012 Sep 10. PMID: 22966025.
- Smith RJ, Bale JF Jr, White KR. Sensorineural hearing loss in children. Lancet. 2005 Mar 5-11;365(9462):879-90. doi: 10.1016/S0140-6736(05)71047-3. PMID: 15752533.
- Soorani-Lunsing I, Woltil HA, Hadders-Algra M. Are moderate degrees of hyperbilirubinemia in healthy term neonates really safe for the brain? Pediatr Res. 2001 Dec;50(6):701-5. doi: 10.1203/00006450-200112000-00012. PMID: 11726727.
- Volpe JJ. Neurology of the newborn. Major Probl Clin Pediatr. 1981;22:1-648. PMID: 7022034.
- Wang X, Wu W, Hou BL, Zhang P, Chineah A, Liu F, Liao W. Studying neonatal bilirubin encephalopathy with conventional MRI, MRS, and DWI. Neuroradiology. 2008 Oct;50(10):885-93. doi: 10.1007/s00234-008-0423-5. Epub 2008 Jun 19. PMID: 18563403.
- Watchko JF, Tiribelli C. Bilirubin-induced neurologic damage--mechanisms and management approaches. N Engl J Med. 2013 Nov 21;369(21):2021-30. doi: 10.1056/NEJMra1308124. PMID: 24256380.
- Wisnowski JL, Panigrahy A, Painter MJ, Watchko JF. Magnetic Resonance Imaging Abnormalities in Advanced Acute Bilirubin Encephalopathy Highlight Dentato-Thalamo-Cortical Pathways. J Pediatr. 2016 Jul;174:260-3. doi: 10.1016/j.jpeds.2016.03.065. Epub 2016 Apr 22. PMID: 27113379.
- Wickremasinghe AC, Risley RJ, Kuzniewicz MW, Wu YW, Walsh EM, Wi S, McCulloch CE, Newman TB. Risk of Sensorineural Hearing Loss and Bilirubin Exchange Transfusion Thresholds. Pediatrics. 2015 Sep;136(3):505-12. doi: 10.1542/peds.2014-3357. Epub 2015 Aug 17. PMID: 26283777.
- Wu YW, Kuzniewicz MW, Wickremasinghe AC, Walsh EM, Wi S, McCulloch CE, Newman TB. Risk for cerebral palsy in infants with total serum bilirubin levels at or above the exchange transfusion threshold: a population-based study. JAMA Pediatr. 2015 Mar;169(3):239-46. doi: 10.1001/jamapediatrics.2014.3036. PMID: 25560920.
- Yan R, Han D, Ren J, Zhai Z, Zhou F, Cheng J. Diagnostic value of conventional MRI combined with DTI for neonatal hyperbilirubinemia. Pediatr Neonatol. 2018 Apr;59(2):161-167. doi: 10.1016/j.pedneo.2017.07.009. Epub 2017 Aug 3. PMID: 28864243.
Evidence tabellen
Fasen en Symptomen van Acute Bilirubine Encefalopathie (ABE)
|
Vroege ABE |
Intermediaire ABE |
Vergevorderde ABE |
|
Lethargie Slaperig Milde hypotonie Slecht drinken |
Abnormale spiertonus (initieel hypotonie gevolgd door hypertonie) Hard huilen met hoge frequentie (‘high-pitched cry’) |
Opisthotonus (‘truncal arching’) Retrocollis (‘neck extension’) Snerpend huilen (‘shrill cry’) Koorts Apnoe Convulsies |
N.B. Symptomen van ABE uit een mildere (vaak eerdere) fase kunnen ook voorkomen in een verder gevorderd stadium van ABE (Volpe, 2018)
Bijlage tabel klinische Bilirubin-Induced Neurological Dysfunction (BIND) score.
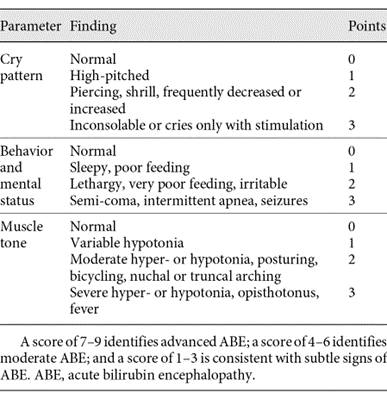
(Johnson, 1999)
Bijlage tabel modified ‘bilirubin-induced neurological dysfunction’ (BIND-M) score.
|
CLINICAL SIGN |
SCORE |
SEVERITY |
Date/Time |
|
MENTAL STATUS |
|||
|
ÿ Normal |
0 |
None |
|
|
ÿ Sleepy but arousable ÿ Decreased feeding |
1 |
Mild |
|
|
ÿ Lethargy ÿ Poor suck and/or ÿ Irritable/jittery with short-term strong suck |
2 |
Moderate |
|
|
ÿ Semi-coma ÿ Apnea ÿ Seizures ÿ Coma |
3 |
Severe |
|
|
MUSCLE TONE |
|||
|
ÿ Normal |
0 |
None |
|
|
ÿ Persistent mild hypotonia |
1 |
Mild |
|
|
ÿ Moderate hypotonia ÿ Moderate hypertonia ÿ Increasing arching of neck and trunk on stimulation without spasms of arms and legs and without trismus |
2 |
Moderate |
|
|
ÿ Persistent retrocolis ÿ Opisthotonus ÿ Crossing or scissoring of arms or legs but without spasms of arms and legs and without trismus |
3 |
Severe |
|
|
CRY PATTERN |
|||
|
ÿ Normal |
0 |
None |
|
|
ÿ High pitched |
1 |
Mild |
|
|
ÿ Shrill |
2 |
Moderate |
|
|
ÿ Inconsolable crying or ÿ Cry weak or absent in child with previous history of high pitched or shrill cry |
3 |
Severe |
|
|
OCCULOMOTOR OR EYE MOVEMENTS |
|||
|
ÿ Normal |
0 |
None, Mild |
|
|
ÿ Sun-setting ÿ Paralysis of Upward Gaze |
3 |
Severe |
|
|
Total ABE Score |
|
|
|
|
MD signature:
|
ÿ I believe this infant has clinical signs/symptoms of ABE despite BIND score. |
||
BIND-M score 1-3: vroege ABE. BIND-M score ≥ 4: intermediaire of vergevorderde ABE (Radmacher, 2015).
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Ahlfors, 2009 |
voldoet niet aan PICO (predictie gehoorproblemen door totaal en ongebonden bilirubine) |
|
Akinpelu, 2013 |
voldoet niet aan de PICO (vergelijking tussen kinderen met en zonder hyperbilirubinemie) |
|
Alkén, 2019 |
voldoet niet aan de PICO (incidentiestudie) |
|
Amin, 2017 |
voldoet niet aan PICO (vergelijking predictieve waarde van ongeconjugeerd bilirubine, totaal serum bilirubine en bilirubine/albumine ratio) |
|
Bhutani, 2015 |
editorial |
|
Boo, 2008 |
voldoet niet aan PICO (diagnostische waarde van otoacoustic emissions en automated auditory brainstem response) |
|
Boskabadi, 2018 |
voldoet niet aan PICO (vergelijking kinderen met en zonder gehoorproblemen) (NB. 25% van de kinderen met gehoorproblemen had chronische kernicterus) |
|
Burgos, 2012 |
narrative review/didactisch paper |
|
Can, 2015 |
voldoet niet aan PICO (vergelijking tussen kinderen met ernstige versus matige hyperbilirubinemie) |
|
Cortey, 2017 |
voldoet niet aan taal (Frans) |
|
El Houchi, 2017 |
voldoet niet aan PICO (predictieve waarde van de BIND score) |
|
Falcón González, 2017 |
studie design compleet onduidelijk |
|
Heimler, 2010 |
voldoet niet aan de PICO (vergelijking tussen kinderen met en zonder hyperbilirubinemie) |
|
Hulzebos, 2013 |
voldoet niet aan PICO (vergelijking voor en na invoeren lagere behandeldrempel) |
|
Jangaard, 2008 |
I, C voldoet niet aan de PICO |
|
Jiang, 2007 |
voldoet niet aan de PICO (vergelijking tussen kinderen met en zonder hyperbilirubinemie) |
|
Kuzniewicz, 2009 |
I, C voldoet niet aan PICO |
|
Manchanda, 2013 |
case report |
|
Nabavi, 2011 |
congres abstract; onvoldoende informatie |
|
Newman, 2002 |
letter to the editor; toegevoegde gestratificeerde analyse met/zonder wisseltransfusie |
|
Newman, 2015 |
commentaar op Vandborg 2015 |
|
Nickisch, 2009 |
case series |
|
Panahi, 2013 |
case series |
|
Saluja, 2010 |
voldoet niet aan PICO (geen follow-up na ontslag) |
|
Sgro, 2012 |
case series |
|
Taghdiri, 2008 |
P voldoet niet aan PICO |
|
Van Toorn, 2016 |
case series |
|
Vandborg, 2012 |
voldoet niet aan de PICO (vergelijking tussen kinderen met en zonder hyperbilirubinemie, leeftijd 1-5 jaar) |
|
Vandborg, 2015 |
voldoet niet aan de PICO (vergelijking tussen kinderen met en zonder hyperbilirubinemie, leeftijd 5-10 jaar) |
|
Vinodh, 2014 |
I, C voldoet niet aan PICO (Brainstem Evoked Response Audiometry in neonaten met hyperbilirubinemie) (NB. 60% van de BERA afwijkingen bleken reversibel na 3 maanden) |
|
Watchko, 2013 |
narrative review |
|
Watchko, 2014 |
reply to letter to the editor |
|
Wickremasinghe, 2015 |
voldoet niet aan PICO (geen follow-up na ontslag) |
|
Wisnowski, 2014 |
didactisch paper |
|
Wu, 2015 |
voldoet niet aan de PICO (vergelijking tussen kinderen met en zonder hyperbilirubinemie) |
|
Xu, 2019 |
I, C voldoet niet aan PICO |
|
Yuan, 2019 |
voldoet niet aan PICO (prognostische waarde van aEEG) (NB opvallend veel adverse outcomes na 12 maanden). |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 29-06-2022
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Aanvullend onderzoek |
NVK |
2022 |
2027 |
5 jaar |
NVK |
|
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor pasgeborenen ≥ 35 weken zwangerschap met hyperbilirubinemie.
Werkgroep
- Dr. C.V. Hulzebos, Kinderarts-neonatoloog, NVK (voorzitter)
- H. Burggraaff, Huisarts, NHG
- Ir. A.J. Dam-Vervloet, Klinisch fysicus, NVKF
- Dr. P.H. Dijk, Neonatoloog, NVK
- G. Fokkens (†2021), Zorgdeskundige, Kraamzorg Het Groene Kruis, B. de Vries beleidsmedewerker KCKZ
- M.C. Hootsen MSc, Verloskundige, KNOV
- Dr. A.R. Hulsmann, Neonatoloog, NVK
- Dr. F.C.J.M Klumper, Gynaecoloog-perinatoloog, NVOG
- Drs. E.A. van der Linden, Arts Maatschappij en Gezondheid, AJN Jeugdartsen Nederland
- R. Mevius, Verpleegkundige, V&VN Vrouw & Kind
- Dr. C.H.H. Schoenmakers, Laboratoriumspecialist klinische chemie/ medisch manager, NVKC
- Dr. T.W. de Vries, Kinderarts, NVK
Meelezers
- Ir. M.S. Toll, Klinisch fysicus audioloog, NVKF
- Stichting Kind en Ziekenhuis
Met ondersteuning van
- Dr. L. Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J.H. van der Lee, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie |
|
Mevius |
O&G/OHC verpleegkundige UMCG |
Bestuurslid/penningmeester beroepsvereniging V&VN VOG |
Geen persoonlijke en/of financiële belangen |
Nee |
Nee |
Geen intellectuele belangen |
Nee |
27-8-2018 |
Geen actie |
|
Van der Linden |
Jeugdarts, fulltime verband, Jeugdgezondheidszorg Zuid-Holland West |
Taskforce Rookvrije start Alliantie Nederland Rookvrij deelnemer namens AJN onbetaald, beide |
Geen |
Geen, normaal professioneel niet persoonlijk |
Nee |
Geen |
Nee |
10-10-2018 |
Geen actie |
|
Schoenmakers |
klinisch chemicus Elkerliek |
Stafvoorzitter Elkerliek betaald |
Geen |
Geen |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
24-9-2018 |
Geen actie |
|
Burggraaff |
Praktijkhouder verloskundige huisartspraktijk De Stethoscoop te Weesp |
Huisartsopleider Vumc 0.10 |
Geen |
Geen |
Geen |
Geen |
Geen |
6-11-2018 |
Geen actie |
|
Klumper |
LUMC: gynaecoloog-perinatoloog (100 %) |
Stichting Perined: bestuurslid (onbetaald) |
Geen (financieel) belang bij te formuleren advies, anders dan betere patiëntenzorg. |
Geen |
Geen |
Vanuit betrokkenheid bij foetale therapie, specifiek foetale problematiek tgv erytrocyten-immunisaties (met mogelijk gevolg neonatale bilirubinemie) heeft de afdeling Obstetrie en Foetale Therapie bijzondere expertise opgebouwd. Van directe belangenverstrengeling of van bescherming reputatie/erkenning lijkt me geen sprake. |
Geen |
1-11-2018 |
Geen actie |
|
Hootsen |
1e lijns verloskundige, werkzaam als zelfstandig verloskundig waarneemster bij twee verloskundige praktijken in regio Utrecht en Gelderland. |
Lid van communicatie werkgroep binnen VSV (verloskundig samenwerkingsverband), onbetaald |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
28-11-2018 |
Geen actie |
|
de Vries (TW) |
Kinderarts, Medisch Centrum Leeuwarden. |
onbetaald: redactielid Praktische Pediatrie; lid Wetenschappelijke Advies Raad Geneesmiddelenbulletin, bestuurslid NKFK. |
Geen |
Geen |
Op dit moment participeer ik in onderzoek, een wordt gefinancierd door Zon Mw, de ander door het Longfonds. Beide onderzoeken richten zich niet op het onderwerp |
Geen |
Geen |
24-11-2018 |
Geen actie |
|
Hulzebos* |
Kinderarts-neonatoloog UMC Groningen |
NLS en NALS instructeur (onbetaald) |
Geen |
Neen |
Geen deelname aan voor dit onderwerp relevante onderzoeken. |
Neonatale icterus heeft al enkele jaren mijn aandacht, zoals ook blijkt uit een aantal publicaties in de afgelopen jaren. Ik werk voor het "bilirubine onderzoek" samen met diverse (inter)nationale collega's. Het is mogelijk dat deze publicaties meer aandacht krijgen door het werk van de commissie. |
Neen |
4-12-2018 |
Geen actie |
|
Fokkens |
Zorgdeskundige 24 uur per week Praktijkopleider 8 uur per week Werkgever is Kraamzorg Het Groene Kruis B.V. |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
6-12-2018 |
Geen actie |
|
De Vries (B) |
Beleidsmedewerker 24 uur per week bij KCKZ |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
6-9-2021 |
Geen actie |
|
Dijk |
Kinderarts-neonatoloog, Beatrix Kinderziekenhuis, UMCGroningen. 0.9 FTE, betaald. |
Neonatologie Netwerk Nederland (N3): lid Nederlands Neonatologie Research Netwerk (NNRN) en lid werkgroep benchmarking namens UMC Groningen en lid Raad van Advies N3. onbetaald. Voor aantal multicenterstudies van het NNRN principle investigator in UMCG. onbetaald. Lid Zonmw Cie programma Zwangerschap en Geboorte waarvoor vacatiegelden en reiskostenvergoeding. Lid werkgroep Netwerk Algemene Kindergeneeskunde (Nederlandse Vereniging voor Kindergeneeskunde). onbetaald. Lid Nederlands Kennisnet Farmacotherapie voor kinderen (NKFK) en Kinderformulatium. onbetaald. Lid PEDMED-NL- netwerk voor geneesmiddelen onderzoek met kinderen in Nederland. onbetaald. |
Geen dienstverbanden met bedrijven. Geen betaald adviseurschap. Geen directe financiële belangen. Geen eigendom van patent of product |
Er zijn geen mensen in mijn directe omgeving die baat kunnen hebben bij mijn deelname aan deze richtlijn werkgroep. |
Geen deelname aan onderzoek dat gefinancierd wordt door overheid, fondsen of industrie waarbij de financier belang kan hebben mij de uitkomsten van deze richtlijn ontwikkeling. In 2007-2011 Zonmw doelmatigheidssubsidie en VIMP voor multicenter studie naar de Bilirubine-Albumine Ratio in prematuren (BARTrial) nr: 94507407. |
Als voorzitter van de werkgroep huidige CBO Richtlijn Hyperbilirubinemie heb ik wel een duidelijke relatie met de huidige richtlijn, na het implementatieproces, op praktische wijze weergegeven wordt. De website wordt door mij beheerd en betaald, en kan gezien worden als intellectueel eigendom. ik wordt landelijk en internationaal gezien als expert op gebied van de inhoud van die richtlijn. |
Wij doen in het UMCGroningen, als lever-transplantatie-centrum, uitgebreid onderzoek naar verschillende aspecten van hyperbilirubinemie en leverfalen, zowel bij pasgeborenen, kinderen en volwassenen. Bij pasgeborenen ben ik betrokken bij onderzoek naar hyperbilirunemie zowel qua diagnostiek als behandeling. Via de perinatale audit Nederland hebben wij het thema 'ernstige hyperbilirubinemie' ingebracht, met als doel de oorzaken van ernstige hyperbilirubinemie en de suboptimale zorgaspecten te vinden. Ik maak ook deel uit van de werkgroep. |
16-1-2019 |
Geen actie |
|
Hulsmann |
Kinderarts-neonatoloog , Amphia Ziekenhuis te Breda |
Geen |
Ik verricht wetenschappelijk onderzoek naar fotometrtische bepaling (huidskleur) bij hyperbilirubinemie. Er is een externa partij betrokken maar ik ontvang hievoor geen vergoeding. De methode/techniek zal mogelijk op enig moment (jaren) tot de ontwikkeling van het commercieel verkrijgbaar instrumentarium (transcutane bepaling bilirubinegehalte) leiden. Mijns inziens geen invloed op de richtlijn en geen financieel voordeel voor mij te verwachten. |
Neen |
zie boven |
De literatuursearch en de bijeenkomsten van de commissie helpen mij bij mijn onderzoek: “Skin colour measurements of jaundiced neonates over 30 weeks as an indication of development of hyperbilirubinemia”; een onderzoek naar fotometrische bepaling van hyperbilirubinemia bij zuigelingen”. |
Neen |
23-1-2019 |
Geen actie |
|
Dam-Vervloet |
klinisch fysicus Isala (Zwolle) |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
11-7-2019 |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van patiëntorganisaties voor de Invitational conference. Het verslag hiervan (zie aanverwante producten) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland en Stichting Kind en Ziekenhuis en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor pasgeborenen met hyperbilirubinemie. Tevens zijn er knelpunten aangedragen via een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De module 1 van de richtlijn hyperbilirubinemie is niet officieel gautoriseerd door de KNOV.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
