Profylactische behandeling migraine
Uitgangsvraag
Wat zijn effectieve en efficiënte opbouwschema’s, inclusief targetdoseringen voor de verschillende middelen die ingezet worden voor preventieve behandeling van migraine? Is er bewijs voor add-on medicatie?
Aanbeveling
- De praktijk leert dat bij het voorschrijven van profylactica het adagium‘ begin laag en verhoog traag’ het meeste kans van slagen heeft omdat de kans op onverdraaglijke bijwerkingen hiermee verminderd wordt.
- Titreer naar de ondergrens van de geadviseerde therapeutische breedte, evalueer het effect niet eerder dan na 2-3 maanden behandeling, primair op geleide van frequentie; dit kan gedocumenteerd worden in een dagboek of kalender.
- Behandel eerst eventueel overmatig gebruik van aanvalsmedicatie d detoxificatie (zie ook de module medicatieovergebruikshoofdpijn).
- Wanneer er sprake is van zwangerschapswens moet het gebruik van preventieve medicatie gestaakt of niet gestart worden. Omdat bij de meerderheid van de zwangerschappen de frequentie en ernst van migraine beduidend afneemt is er in het algemeen geen indicatie voor preventieve behandeling tijdens de zwangerschap.
- De volgorde van voorkeur wordt mede bepaald door het bijwerkingenprofiel van het profylacticum, comorbiditeit en voorkeur van de patient.
- Blijf actief en kritisch evalueren over effect en bijwerkingen en bespreek hoe lang de behandeling voortgezet kan worden.
Onderstaande doseringsschema’s kunnen gezien worden als een suggestie voor een opbouwschema, waarbij het accent ligt op het zoveel mogelijk vermijden van bijwerkingen. Als gevolg daarvan geschiedt de doseringsescalatie traag, wat in de praktijk ongewenst kan zijn of minder geaccepteerd door de patiënt. In die gevallen kan een sneller schema gevolgd worden.
|
OPBOUWSCHEMA BIJ KINDEREN |
Geneesmiddel |
|
Episodische migraine |
|
|
Effectief, in studies bij volwassenen en bij kinderen, matig- geen bewijs |
Propranolol:hiervoor wordt een opbouwschema geadviseerd, oraal: 8 tot 12 jaar: 40 mg/dag in 2 doses. 12 tot 18 jaar: 80 mg/dag in 2 doses. Valproaat MGA met opbouw naar dosis van 10 mg/kg |
|
Effectief,in studies bij volwassenen, bij kinderen niet onderzocht |
Candesartan: ≥ 6 jaar en < 50 kg: 4-8 mg/dag in 1 dosis; ≥ 6 jaar en ≥ 50 kg: 4-16 mg/dag in 1 dosis |
|
Effectief, slechts in een trial onderzocht |
Flunarizine 1 dd 5 mg (= max bij G < 40 kg) , opvoeren per maand tot 1 dd 10 mg bij kinderen van > 40 kg |
|
Gering effectief, in studies onvoldoende bewijs |
Amitriptyline a.n. start: 1 dd 10 mg, opvoeren met 10 mg per 4-6 weken; doel: 1 dd 25-30 mg Pizotifeen 1 dd 0,5 mg, opvoeren per week tot 1 dd 1,5 mg (max 2,0 mg) Topiramaat start: 1 dd 15/25 mg, per week of per 2 weken opvoeren; doel 2 dd 50 mg (kan verder tot max 200 mg maar geen verschil in effect met 100 mg aangetoond) |
|
OPBOUWSCHEMA BIJ VOLWASSENEN |
Geneesmiddel |
|
Episodische migraine |
|
|
Effectief, gunstig veiligheidsprofiel |
Candesartan start: 1 dd 4 mg, per maand opvoeren; doel: 1 dd 8-16 mg (max 32 mg) Metoprolol start: 1dd 50 mg, opbouwen per 2 weken tot 1 dd 100 mg; doel: 1 dd 100-200 mg (max 200 mg) Propranolol start 2 dd 10 mg, opbouwen 20 mg per 2 weken tot 2 dd 40 mg, vanaf 80 mg retardvorm, doel: 1 dd 80-160 mg Topiramaat start: 1 dd 15/25 mg, per week of per 2 weken opvoeren; doel 2 dd 50 mg (kan verder tot max 200 mg maar geen verschil in effect met 100 mg aangetoond) Valproaat MGA (mannen) start 1 dd 300 mg, opvoeren per 2 weken; doel 2 dd 300-500 mg (max 1500 mg) |
|
Effectief, ongunstig veiligheidsprofiel |
Valproaat MGA (vrouwen: zie richtlijn CBG) Flunarizine 1 dd 5 mg, opvoeren per maand tot 1 dd 10 mg Amitriptyline a.n. start: 1 dd 10 mg, opvoeren met 10 mg per 4-6 weken; doel: 1 dd 40 mg (max 75-100 mg) |
|
Gering effectief |
Pizotifeen 1 dd 0,5 mg, opvoeren per week tot 1 dd 1,5 mg (max 4,5 mg) |
|
Chronische migraine, behandel eerst overmatig gebruik aanvalsmedicatie door detoxificatie |
|
|
Gering effectief |
Topiramaat Valproaat Botulinetoxine A |
Overwegingen
Kinderen
Factoren die ontbreken om van goed bewijs naar een aanbeveling te komen zijn: het ontbreken van voldoende goede studies naar het effect van profylactische behandeling van migraine bij kinderen. Reden waarom deze studies niet worden uitgevoerd zijn mogelijk gelegen in de regelgeving die jarenlang zeer streng was voor het ondernemen van medicatiestudies bij kinderen, het grote placebo effect bij kinderen, de kleinere patiëntenaantallen, het grotere risico op voortijdig beëindigen van deelname aan een studie. Omdat de determinanten van deze hoge placeborespons bij kinderen (in afwijking van volwassenen) grotendeels onbekend zijn is de vertaling van de studieresultaten naar de klinische praktijk vaak lastig. Het is mogelijk dat variabelen samenhangend met het studiedesign (maar afwijkend van de klinische realiteit) een bepalende invloed op de uitkomst hebben, waardoor een effect van de farmacologische interventie in de setting van de dagelijkse praktijk niet uitgesloten is. De hoge placeborespons kan echter ook een indicatie zijn van afwijkende biologische kenmerken van migraine bij kinderen, wat zou verklaren waarom de middelen die werkzaam zijn bij volwassenen bij kinderen niet effectief zijn. Hoewel bekend is dat de aanvalsduur bij kinderen korter is dan bij volwassenen zijn er geen goede bewijzen die deze hypothese ondersteunen. Er zijn aanwijzingen dat meer aandacht voor begeleiding, educatie en gedragsmatige aspecten een prominente rol in de behandeling verdienen ten faveure van medicamenteuze interventie, echter een soldide onderbouwing voor zo’n aanpak ontbreekt op dit moment.(103) Overigens is het belangrijk te realiseren dat het gros van de kinderen in de klinische trials tussen 12-18 jaar oud was waardoor weinig gegevens voor kinderen <12 jaar beschikbaar zijn. De aanbeveling is dus grotendeels gebaseerd op studies met zwak bewijs bij kinderen en verder een afgeleide van de studie resultaten bij volwassenen. Daarnaast speelt expert opinion een rol.
Volwassenen
De middelen die voor de preventieve behandeling van migraine worden gebruikt zijn geen van alle met dit doel ontwikkeld en er is geen goede verklaring voor het werkingsmechanisme van deze geneesmiddelen. De rationale voor gebruik en effectiviteit moet daarmee volledig gestoeld zijn op en gesteund worden door de uitkomsten van gerandomiseerde en gecontroleerde studies.
De mate van effectiviteit is in de meeste placebo-gecontroleerde studies beperkt hetgeen weerspiegeld wordt in het geringe verschil in afname van het aantal hoofdpijndagen, doorgaans minder dan 1 of 2 dagen per maand. Daarbij moeten drie overwegingen in overweging genomen worden. Ook in de placebogroep is er vaak sprake van een aanzienlijke behandelrespons, die na 16 weken weer stabiliseert op het uitgangsniveau. De meeste placebo-gecontroleerde trials kennen echter een onderzoeksduur korter dan deze 16 weken. Voorts blijkt het verschil aanzienlijk groter in studies bij chronische dan episodische migraine, wat suggereert dat de effectiviteit afhankelijk is van de hoofdpijnfrequentie. Studies die een intention-to-treat analyse aanwenden kennen doorgaans een lagere mate van effect wanneer er een groot verschil in uitvallers tussen interventie en placebo bestaat, iets wat in migrainestudies vaak het geval is.
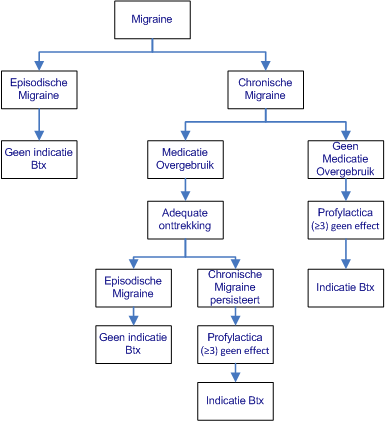
Per jaar hebben zo’n 500.000 patiënten in Nederland chronische migraine, wat betekent dat zij minimaal 15 dagen per maand hoofdpijn hebben waarvan minstens 8 dagen migraine. Meer dan de helft van deze patiënten gebruikt teveel medicatie om deze hoofdpijn (tijdelijk) te onderdrukken. In de neurologenpraktijk kan dit percentage nog veel hoger zijn, tot wel 90%. Hiermee wordt chronische migraine zonder medicatie overgebruik eerder uitzondering dan regel. Zie flow chart voor behandeling van chronische migraine (en de module 'Medicatieovergebruikhoofdpijn'). Zie ook in de flow chart de indicatie voor Botuline toxine A. Botuline toxine A is niet effectief bij episodische migraine.(102)
De kwaliteit van bewijs is laag tot zeer laag vanwege heterogentiteit tussen de verschillende studies, samenhangend met variabele methodologische kwaliteit, grote verschillen in de omvang van de studiepopulaties, verschillen in financiele onafhankelijkheid van de studies en verschillen in al dan niet gerapporteerde bronnen voor bias. Bovendien zijn er grote verschillen in bijwerkingen (zowel naar aard als naar aantal) en het percentage uitvallers en ontbreken van affectiviteit.
Er zijn onvoldoende overtuigende argumenten om op basis van de beschikbare gegevens een voorkeur voor een van de middelen uit te spreken wat betreft hun effectiviteit. Bijwerkingen worden bij alle middelen in meer of mindere mate gerapporteerd, er zijn onvoldoende vergelijkende data tussen middelen beschikbaar om de keuze voor een middel op te baseren. Het bijwerkingenprofiel van de middelen is doorgaans erg verschillend en kan meegewogen worden bij de keuze.
Omdat de middelen voor een andere indicatie ontwikkeld zijn (doorgaans aandoeningen die geassocieerd zijn met migraine) kan men zich bij de keuze van een middel mede laten leiden door eventuele comorbide aandoeningen.
Er is geen bewijs voor voordeel van bepaalde opbouwschema’s ten opzichte van andere. Opbouwschema’s in trials zijn (medisch) ingegeven door de duur van de trial, de prakijk leert dat ‘ begin laag en verhoog traag’ het meeste kans van slagen heeft omdat de kans op onverdragelijke bijwerkingen hiermee verminderd wordt.
Rationale
Kinderen
Goed bewijs voor het effect van profylactische behandeling van migraine bij kinderen ontbreekt. Wel is er recent een goede studie gedaan, de CHAMP studie, waaruit blijkt dat migraine profylaxe bij kinderen met topiramaat en amitriptyline geen duidelijk beter effect geeft in reductie van het aantal migraine aanvallen ten opzichte van placebo.(100) In deze studie waren er bij de patiënten die met actieve medicatie werden behandeld meer bijwerkingen gerapporteerd, waarvan 5 matig-ernstig. Op grond van deze bevindingen lijkt enige terughoudendheid bij de keuze voor deze middelen gegrond te zijn, hoewel aangemerkt moet worden dat er wel een heel hoog placebo effect van 61 % was in deze studie, en daarmee de conclusie dat de actieve medicatie geen effect heeft minder hard gesteld kan worden.
Helaas is er geen goede studie naar het effect van propranolol bij kinderen. Op dit moment vormt dit middel wel een middel van eerste keus in de richtlijn als het gaat om profylaxe van migraine, hoewel goed bewijs bij kinderen hiervoor tot dusver ontbreekt.
Verder is er nog geen literatuur over de effectiviteit van het wat nieuwere middel candesartan als migraine profylacticum bij kinderen. Wel wordt, mede gezien het toedieningsgemak en het relatief gunctige bijwerkingprofiel, en de positieve resultaten bij volwassenen in de praktijk gebruik gemaakt van dit middel.
Volwassenen
Gebaseerd op de kwaliteit van bewijs (grootte van de onderzoekspopulatie, methodologische kwaliteit, consistentie van verschillende bevindingen, financiële onafhankelijk en andere potentiële bronnen van bias) is er enig bewijs voor de effectiviteit van topiramaat, valproaat en betablokkers (propranolol, metoprolol en atenolol) en in mindere mate ook voor amitriptyline, candesartan, flunarizine, methysergide en pizotifeen. De werkzaamheid van captopril, fluoxetine, levetiracetam en lisinopril is onvoldoende onderbouwd en derhalve onzeker.
Teratogeniteit en het risico op ontwikkelingsstoornissen beperken de bruikbaarheid van valproaat bij vrouwen in de vruchtbare leeftijd tenzij adequate anticonceptie verzekerd is, en is derhalve een relevant probleem bij deze patiëntengroep. Het College ter Beoordeling van Geneesmiddelen (CBG) ontraadt het gebruik van valproaat bij meisjes, vrouwelijke adolescenten, vrouwen die zwanger kunnen worden en zwangere vrouwen tenzij de andere mogelijke behandelingen ondoeltreffend zijn of niet verdragen worden (http://db.cbg-meb.nl/ARMs/h13157_armm.pdf). Voorts zijn er voorlichtingsmaterialen beschikbaar die door de arts actief gebruikt moeten worden bij het voorschrijven van valproaat aan de genoemde risicogroep. Ook aan topiramaat zijn teratogene risico’s verbonden. Gebruik van candesartan, flunarizine en methysergide tijdens de zwangerschap wordt ontraden. De conclusie is dus dat in het algemeen geldt dat, wanneer er sprake is van zwangerschapswens, het gebruik van preventieve medicatie gestaakt of niet gestart moet worden. Omdat bij de meerderheid van de zwangerschappen de frequentie en ernst van migraine beduidend afneemt is er in het algemeen geen indicatie voor preventieve behandeling tijdens de zwangerschap.
Zowel uit de klinische trials als klinische ervaring blijkt dat bijwerkingen divers zijn (afhankelijk van de interventie), vaak gerapporteerd worden en niet zelden reden zijn om de behandeling na kortere of langere tijd te staken. Hoewel er geen betrouwbare vergelijkende gegevens zijn is de ervaring in de Nederlandse praktijk dat uitval het geringst is met candesartan en behandeling met dit middel het langst kan worden gecontinueerd.
Bij patiënten met migraine waarbij hinderlijke aura’s op de voorgrond staan is de hoofdpijn vaak minder uitgesproken. In die situaties gaat de voorkeur uit naar behandeling met lamotrigine, acetazolamide, valproaat, topiramaat of levetiracetam. (104)
In de aanbeveling zijn middelen opgenomen, gerangschikt naar de mate van bijwerkingen. Een belangrijk deel van deze middelen zijn off-label. Voor meer informatie hierover verwijst de werkgroep naar het Farmacotherapeutisch Kompas.
Onderbouwing
Achtergrond
Profylactische behandeling bij migraine kan overwogen worden bij patiënten met één of meer van de volgende kenmerken:
- Een aanvalsfrequentie van twee of meer per maand gedurende minimaal drie maanden
- Migraineaanvallen van ernstige intensiteit of lange duur, die onvoldoende reageren op adequaat gedoseerde en gebruikte aanvalsbehandeling
Profylactica worden meestal gegeven in langzaam oplopende dosering totdat een acceptabele werkzaamheid is vastgesteld of bijwerkingen het verdere gebruik beperken. Profylactica voorkomen zeer zelden alle migraineaanvallen. Een medicament dat 50 tot 60% reductie in de aanvalsfrequentie geeft wordt in trials als succesvol beschouwd. Behalve op het aantal hoofdpijndagen kan een profylacticum een gunstig effect hebben op de ernst van de hoofdpijn en de bijverschijnselen zoals aura-verschijnselen, foto- en fonofobie, misselijkheid of braken, de duur van de hoofdpijn en het optreden van recurrences (terugkomen van migraine aanval binnen 24-48 uur na aanvankelijk goede respons). Het wordt aangeraden deze verwachtingen met de patiënt te bespreken.. Wanneer het effect van een profylacticum onvoldoende is, ondanks adequate dosering en therapietrouw, kan een medicament met een ander werkingsmechanisme worden voorgeschreven.(11) Het is onbekend of de kans op succes afneemt met het aantal geprobeerde behandelingen en of er een strategie kan worden aanbevolen voor de selectie van profylactica. Waarschijnlijk is het (verwachte) bijwerkingenprofiel de enige rationele manier om een keuze te maken tussen de profylactische opties.
Conclusies / Summary of Findings
|
Zeer laag |
Uitkomstmaat aantal hoofdpijndagen bij kinderen Er is voor kinderen met migraine die preventieve behandeling behoeven geen meerwaarde aangetoond van propranolol, flunarizine, pizotifeen, nimodipine, papaverine, trazodone, L-5-hydroxytryptofaan, clonidine Topiramaat had geen groter effect ten opzichte van placebo in een studie, maar gaf mogelijk een reductie van het aantal migraineaanvallen bij kinderen in een andere studie. Barnes,2015; Victor, 2003; Powers, (85, 98, 100) |
|
Zeer laag |
Uitkomstmaat aantal hoofdpijndagen bij volwassenen Voor volwassen met migraine die preventieve behandeling behoeven is geen meerwaarde aangetoond van alfablokkers, acetazolamide, carbamazepine, carisbamate, clonazepam, gabapentin(-enacarbil), oxcarbazepine, vigabatrin, acebutolol, alprenolol, oxprenolol, pindolol, calciumkanaalblokkers, SSRI’s, SNRI’sen doxepin, ten opzichte van placebo. Mogelijk is er een meerwaarde van lisinopril, captopril, levetiracetam en bisoprolol ten opzichte van placebo voor de preventieve behandeling van migraine bij volwassenen, maar dit is niet zeker vanwege methodololgische tekortkomingen of beperkte omvang van de studiepopulaties. Mogelijk kan er een positief effect verwacht kan worden van de preventieve behandeling van migraine bij volwassenen met atenolol, metoprolol, amitriptyline, clomipramine, flunarizine, propranolol, pizotifeen en candesartan. De gevonden effecten zijn echter gering, en de bevindingen onzeker. Jackson, 2015(90) |
|
Laag |
Valproaat Er zijn aanwijzingen dat valproaat effectief is als migraineprofylaxe bij volwassenen, wanneer gekeken wordt naar het aantal hoofdpijndagen per maand en ten minste 50% reductie van het aantal hoofdpijnaanvallen. Linde, 2013(94) |
|
Matig |
Topiramaat Uitkomstmaat aantal hoofdpijndagen bij volwassenen Topiramaat reduceert het aantal hoofdpijndagen bij volwassenen. Het gevonden effect is klinisch relevant. Uitkomstmaat ≥50% reductie aantal hoofdpijnaanvallen bij volwassenen Topiramaat is effectief in het reduceren van het aantal hoofdpijnaanvallen bij volwassenen. Om 50% reductie van het aantal hoofdpijnaanvallen te bereiken bij één patiënt moeten vier patiënten behandeld worden. Linde, 2013(93) |
|
Laag |
Chronische migraine Uitkomstmaat aantal hoofdpijndagen bij volwassenen Er is geen meerwaarde aangetoond van behandeling van chronische migraine met atenolol, propranolol en tizanidine, ten opzichte van placebo. Er lijkt wel een meerwaarde aangetoond van behandeling van chronische migraine topiramaat of valproaat, ten opzichte van placebo. Dit geldt ook voor geprotocolleerde behandeling met botulinetoxine-A. Voor al deze studies geldt echter dat bij veel patiënten met chronische migraine er ook sprake was van overmatig gebruik van aanvalsmedicatie. |
|
Algehele kwaliteit van bewijs = zeer laag
|
|
Samenvatting literatuur
Zie de bij deze uitgangsvraag opgestelde GRADE evidence profielen.
Beschrijving studies
Na de literatuurselectie zijn 15 artikelen overgebleven, die zijn bestudeerd.(84-98) Bij de verdere analyse hiervan is onderscheid gemaakt tussen artikelen over kinderen,(85-88, 98) en artikelen over volwassenen.(84, 89-97) Een zeer recent gepubliceerde Cochrane systematische review over anti-epileptica is nadien nog toegevoegd.(99)
Kinderen
De systematische reviews van Bonfert et al., Damen et al. en El-Chammas et al. zijn verschenen vóór publicatie van de systematische review van Barnes over dezelfde patiëntenpopulatie en interventie; deze artikelen zijn derhalve niet nader geanalyseerd.(86-88) Barnes schreef een Clinical Evidence rapport over de behandeling van migraine bij kinderen, inclusief GRADE beoordeling.(85) In deze evidence review zijn alleen de resultaten die betrekking hebben op de profylactische behandeling nader betrokken. Victor et al. publiceerden een Cochrane systematische review over de profylactische behandeling van migraine bij kinderen.(98) In deze evidence review zijn alleen resultaten beschreven van interventies die niet zijn geïncludeerd in de veel nieuwere analyse van Barnes. Zeer recent verscheen een trial waarin amitriptyline werd vergeleken met topiramaat en placebo voor de behandeling van migraine bij kinderen. Deze studie is alsnog geïncludeerd.(100)
Volwassenen
Een aantal van de gevonden studies bleek geen systematisch opgezet onderzoek te betreffen,(95) geen uitkomstmaten te evalueren die van belang zijn voor de beantwoording van deze uitgangsvraag,(84, 89) of een onderzoekspopulatie te betreffen die niet alleen uit patiënten met migraine bestond (en waarbij hiervoor ook geen separate analyses te maken waren).(97) Jackson et al. schreven een systematische review met meta-analyses over de effectiviteit van de profylactische behandeling van migraine bij volwassenen.(90) Voor de bewijsvoering over valproaat en topiramaat is gebruik gemaakt van de twee Cochrane systematische reviews van Linde et al.(93, 94) De twee overige systematische reviews van Linde et al. en die van Shamlyan et al. zijn verschenen vóór publicatie van de systematische review van Jackson et al. over dezelfde patiëntenpopulatie en interventie; deze artikelen zijn derhalve niet nader geanalyseerd.(91, 92, 96)
Kwaliteit van het bewijs
Kinderen
De kwaliteit van het bewijs is zeer laag, vanwege de observationele opzet van een deel van de studies, het beperkte aantal patiënten in de geïncludeerde studies (hetgeen leidt tot onvoldoende precisie), en omdat er sprake is van deels indirect en inconsistent bewijs. In de gerandomiseerde studies die in de review van Victor zijn geanalyseerd, is sprake van problemen met randomisatie en blindering. Bovendien zijn in deze systematische review oude studies geïncludeerd, waardoor er mogelijk sprake is van indirect bewijs (ander ‘soort’ patiënten, bijvoorbeeld vanwege andere diagnostische criteria, of andere standaard behandeling dan tegenwoordig gebruikelijk is).(98) De toegevoegde studie van Powers et al. is van hogere kwaliteit, dan de studies in de review van Victor et al., vanwege het gerandomiseerde, dubbelblinde, placebogecontroleerde design, voldoende aantal patiënten en adequate follow-up.(100)
Volwassenen
De kwaliteit van bewijs wordt bepaald door de methodologische kwaliteit, het risico op bias en de omvang van de studiepopulatie en deze aspecten variëren aanzienlijk tussen de verschillende geneesmiddelen en individuele studies. Methodologische tekortkomingen blijken deels samen te hangen met de leeftijd van individuele studies en zijn een weerspiegeling van ontwikkelingen in de definitie van het begrip ‘migraine’ alsook het design van clinical trials. Het zal geen verbazing wekken dat de grote studies financieel mogelijk zijn gemaakt door de patenthouder van het onderzochte middel en inherent daaraan een potentieel risico op selectieve rapportage en publicatiebias hebben.
Chronische migraine
In de review van Jackson et al. was een beperkt aantal studies opgenomen dat is uitgevoerd bij patiënten met chronische migraine (> 15 dagen per maand): 1 studie met alfablokkers van matige kwaliteit, 4 studies met topiramaat van matige kwaliteit, een studie met valproaat van slechte kwaliteit en een studie met bètablokkers (propranolol) van slechte kwaliteit.(90)
Effectiviteit
Middelen die in Nederland niet geregistreerd zijn voor de behandeling van migraine, zijn in dit overzicht niet besproken.
Kinderen
Er is geen significant voordeel aangetoond voor de preventieve behandeling van migraine bij kinderen met propranolol ten opzichte van placebo voor wat betreft het aantal hoofdpijnaanvallen per maand (gemiddeld verschil: -1,38; 95%BI: -4,41 tot 1,65). Twee RCT’s die propranolol vergelijken met topiramaat laten tegenstrijdig resultaat zien en zijn derhalve niet conclusief. Datzelfde geldt voor de vergelijking van flunarizine en placebo; hierbij zijn in de review van Barnes twee tegenstrijdige systematische reviews gevonden.(85) Bij vergelijking van flunarizine met propranolol wordt geen significant verschil gevonden wanneer gekeken wordt naar reductie van hoofdpijndagen (OR: 0,81; 95%BI: 0,15 – 4,40). Voor de evaluatie van de effectiviteit van pizotifeen zijn geen geschikte onderzoeken gevonden. Bij vergelijking van topiramaat met placebo werd een absoluut verschil in aantal hoofdpijnaanvallen per maand gevonden van 0,71, in het voordeel van topiramaat (95%BI: -1,19 tot -0,24).
De analyses in de systematische review van Victor et al. hebben betrekking op weinig patiënten, en hebben brede betrouwbaarheidsintervallen. De volgende middelen bleken hierbij niet bewezen effectief: nimodipine, papaverine, trazodone, L-5-hydroxytryptofaan, clonidine, metoclopramide, en domperidon. (98)
De RCT van Powers et al. liet geen verschil in effectiviteit zien tussen amitriptyline, topiramaat en placebo.(101) hierbij moet worden opgemerkt dat er in die studie een placebo effect was van 62%, dus dat hiermee werkzaamheid van een van beide middelen zeer moeilijk aantoonbaar is. Dit hoge placebo effect wordt regelmatig gezien bij medicatie studies bij kinderen.
Volwassenen
In de review van Jackson et al. zijn separate analyses uitgevoerd per behandelduur en weergegeven per 4 weken.(90) Samenvattend is er goed bewijs gevonden voor de effectiviteit van amitriptyline, atenolol, flunarizine, fluoxetine, metoprolol, pizotifeen, propranolol, topiramaat en valproaat. Dit effect is voor de meeste interventies gezien op de uitkomst ‘gemiddeld aantal hoofdpijndagen per maand’, maar ook voor het aantal patiënten met 50% of meer afname van hoofdpijndagen. Voorts is er enig bewijs gevonden voor effectiviteit van candesartan, lisinopril, captopril en bisoprolol, echter het aantal studies hiernaar is beperkt. Er is onvoldoende bewijs voor effectiviteit van de volgende middelen: alfablokkers, acetazolamide, carbamazepine, carisbamate, clonazepam, gabapentine, oxcarbazepine, vigabatrine, acebutolol, alprenolol, oxprenolol, pindolol, calciumkanaalblokkers (exclusief flunarizine), SSRI’s, SNRI’s en doxepine. Er is enige controverse gevonden tussen de systematische reviews omtrent de plaatsbepaling van levetiracetam. Waar Jackson et al. concludeerden dat dit middel aangetoond effectief is, is het in de Cochrane review in de categorie ‘onvoldoende bewijs’ geplaatst.(99)
Voor captopril, lisinopril, bisoprolol en flunarizine wordt een significant voordeel van behandeling pas na langdurigere behandeling gezien, variërend van 8 tot 16 weken. Netwerk meta-analyse (vergelijking van meerdere interventies met elkaar) suggereerde dat amitriptyline effectiever is dan de overige middelen, maar dit bleek niet uit de individuele studies en deze bevinding is daardoor erg onzeker.
Positieve resultaten ten opzichte van placebo op het aantal aanvallen per maand zijn gevonden bij: levetiracetam (MD (mean difference = gemiddeld verschil): -2,7; 95%BI: -4,4 tot -0,97), atenolol (MD: -2,2; 95%BI: -3,7 tot -0,37), metoprolol (MD: -0,94; 95%BI: -1,4 tot -0,46), amitiptyline (MD: -0,94; 95%BI: -1,79 tot -0,46), clomipramine (MD: -0,46; 95%BI: -0,74 tot -0,18), propranolol (MD na 20 weken: -1,0; 95%BI: -1,7 tot -0,37), valproaat (MD na 12 weken: -1,5 (95%BI: -2,1 tot -0,80)), pizotifen (SMD: -0,44; 95%BI: -0,69 tot -0,20) en angiotensine receptor blokkers (SMD: -1,12 (95%BI: -1,97 tot -0,27)). Bij behandeling met flunarizine is bij korte onderzoeksduren geen verschil met placebo gevonden, bij langere onderzoeksduren was dit wel het geval (bijvoorbeeld bij 16 weken: MD: -1,2; 95% BI: -2,0 tot -0,38). Omdat het gaat om profylactische behandeling, wordt meer waarde gehecht aan de resultaten van het langduriger gebruik.
Uit de review van Linde et al. bleek dat topiramaat het aantal hoofdpijndagen per maand reduceerde met 1,20 (95%BI: -1,59 tot -0,80). Daarnaast bleek hieruit dat topiramaat in vergelijking met placebo leidt tot een hoger percentage patiënten met ten minste 50% reductie van het aantal hoofdpijnaanvallen per maand (RR: 2,02; 95%BI: 1,57-2,60). De NNT is hierbij 4. Er zijn aanwijzingen dat een hogere dosering (200 of 100 mg) daarbij effectiever is dan een lage dosering (50 mg).(93)
De andere review van Linde et al. liet een gunstig effect zien van valproaat in vergelijking met placebo. Divalproex sodium bleek geassocieerd met een groter percentage patiënten dat ten minste 50% reductie van het aantal hoofdpijnaanvallen kreeg (RR: 2,18; 95%BI: 1,28-3,72). De NNT was 5. Wanneer werd gekeken naar natrium valproaat werd een vergelijkbaar effect gevonden (RR: 2,83; 95%BI: 1,27-6,31; NNT: 3). Het aantal hoofdpijndagen per maand nam hierbij gemiddeld af met 4,31 (-8,32 tot -0,30).(94)
Chronische migraine
In de studie van Jackson kon geen meerwaarde aangetoond worden van behandeling van patiënten met chronische migraine gericht op het verminderen van het aantal hoofdpijndagen per maand met atenolol (MD: 0,32; 95% BI: -0,73 tot 1,38), propranolol (MD -0,34; 95% BI: -1,23 tot 0,56) en tizanidine (MD bij 12 weken behandeling -0,50; 95%BI: -1,6 tot 0,62). Topiramaat was bij alle onderzoeksduren wel gunstiger dan placebo wanneer gekeken werd naar het aantal hoofdpijndagen per maand (bijv. bij 12 weken behandeling: MD -8,4; 95%BI: -14,3 tot -2,5). Dat zelfde geldt voor valproaat (MD: -10,9; 95% BI: -18,5 tot -3,4). In een nadien toegevoegde meta-analyse van Jackson bleek botulinetoxine-A significant beter dan placebo (MD -2,3; 95%BI: -3,7 - -0,9).(102) Aangetekend dient te worden dat het grootste deel van de behandelde groep overmatige hoeveelheden aanvalsmedicatie gebruikten. Tevens moet aangetekend worden dat bij de meta-analyses van topiramaat en valproaat studies ontbreken die een minder groot gunstig effect lieten zien.
Zoeken en selecteren
P: Patiënten (kinderen en volwassenen) met migraine, bij wie preventieve behandeling geïndiceerd is
I: Combinatie van preventieve behandeling
C: -
O: Verandering in aantal hoofdpijndagen
De setting voor deze uitgangsvraag is zowel de eerste als tweedelijns gezondheidszorg in Nederland.
Cruciale uitkomstmaten zijn verandering van aantal hoofdpijndagen.
Voor deze uitgangsvraag is in Medline gezocht naar literatuur op 20 november 2015.
De literatuur is vervolgens geselecteerd op basis van onderwerp (sluit het artikel aan bij de uitgangsvraag?) en studiekenmerken (systematisch opgezet vergelijkend onderzoek (bijvoorbeeld systematische reviews, randomized controlled trials en cohortonderzoeken)).
Referenties
- Launer LJ, Terwindt GM, Ferrari MD. The prevalence and characteristics of migraine in a population-based cohort: the GEM study. Neurology. 1999;53(3):537-42.
- Jensen R, Stovner LJ. Epidemiology and comorbidity of headache. Lancet Neurol. 2008;7(4):354-61.
- Global Burden of Disease Study C. Global, regional, and national incidence, prevalence, and years li-ved with disability for 301 acute and chronic diseases and injuries in 188 countries, 1990-2013: a syste-matic analysis for the Global Burden of Disease Study 2013. Lancet. 2015;386(9995):743-800.
- Steiner TJ, Stovner LJ, Vos T. GBD 2015: migraine is the third cause of disability in under 50s. J Head-ache Pain. 2016;17(1):104.
- Headache Classification Committee of the International Headache S. The International Classification of Headache Disorders, 3rd edition (beta version). Cephalalgia. 2013;33(9):629-808.
- Bigal ME, Serrano D, Reed M, Lipton RB. Chronic migraine in the population: burden, diagnosis, and satisfaction with treatment. Neurology. 2008;71(8):559-66.
- Schwedt TJ. Chronic migraine. BMJ. 2014;348:g1416.
- Wiendels NJ, Knuistingh Neven A, Rosendaal FR, Spinhoven P, Zitman FG, Assendelft WJ, et al. Chro-nic frequent headache in the general population: prevalence and associated factors. Cephalalgia. 2006;26(12):1434-42.
- Pijpers JA, Louter MA, de Bruin ME, van Zwet EW, Zitman FG, Ferrari MD, et al. Detoxification in medication-overuse headache, a retrospective controlled follow-up study: Does care by a headache nurse lead to cure? Cephalalgia. 2016;36(2):122-30.
- Evers S, Marziniak M. Clinical features, pathophysiology, and treatment of medication-overuse headache. Lancet Neurol. 2010;9(4):391-401.
- Neurologie NVv. Richtlijnen diagnostiek en behandeling chronisch recidiverende hoofdpijn zonder neurologische afwijkingen. 1e herziening. 2007.
- Patiënten NVvH. Chronische aangezichtspijn. Multidisciplinaire richtlijn. 2013.
- Martin PR, Reece J, Callan M, MacLeod C, Kaur A, Gregg K, et al. Behavioral management of the trig-gers of recurrent headache: a randomized controlled trial. Behav Res Ther. 2014;61:1-11.
- GRADE_NL. Toepassen GRADE in Nederland. 2012.
- Rabbie R, Derry S, Moore RA. Ibuprofen with or without an antiemetic for acute migraine headaches in adults. Cochrane Database Syst Rev. 2013(4):CD008039.
- Kirthi V, Derry S, Moore RA. Aspirin with or without an antiemetic for acute migraine headaches in adults. Cochrane Database Syst Rev. 2013(4):CD008041.
- Law S, Derry S, Moore RA. Naproxen with or without an antiemetic for acute migraine headaches in adults. Cochrane Database Syst Rev. 2013(10):CD009455.
- Derry S, Rabbie R, Moore RA. Diclofenac with or without an antiemetic for acute migraine headaches in adults. Cochrane Database Syst Rev. 2013(4):CD008783.
- Ferrari MD, Roon KI, Lipton RB, Goadsby PJ. Oral triptans (serotonin 5-HT(1B/1D) agonists) in acute migraine treatment: a meta-analysis of 53 trials. Lancet. 2001;358(9294):1668-75.
- Kirthi V, Derry S, Moore RA, McQuay H. Aspirin for acute migraine headaches in adults. J Neurol Neurosurg Psychiatry. 2013;84(5):585-6.
- Ferrari MD, Goadsby PJ, Roon KI, Lipton RB. Triptans (serotonin, 5-HT1B/1D agonists) in migraine: detailed results and methods of a meta-analysis of 53 trials. Cephalalgia. 2002;22(8):633-58.
- Bijl D. The serotonin syndrome. Neth J Med. 2004;62(9):309-13.
- Shapiro RE, Tepper SJ. The serotonin syndrome, triptans, and the potential for drug-drug interac-tions. Headache. 2007;47(2):266-9.
- Sclar DA, Robison LM, Castillo LV, Schmidt JM, Bowen KA, Oganov AM, et al. Concomitant use of triptan, and SSRI or SNRI after the US Food and Drug Administration alert on serotonin syndrome. Headache. 2012;52(2):198-203.
- Putnam GP, O'Quinn S, Bolden-Watson CP, Davis RL, Gutterman DL, Fox AW. Migraine po-lypharmacy and the tolerability of sumatriptan: a large-scale, prospective study. Cephalalgia. 1999;19(7):668-75.
- Hall GC, Brown, M.M., Mo, J., MacRae, K.D. Triptans in migraine. The risks of stroke, cardiovascular disease, and death in practice. Neurology. 2004;62(563-568).
- Dodick DW, Martin, V.T., Smith, T., Silberstein, S. Cardiovascular tolerability and safety of triptans: a review of clinical data. Headache. 2004;44(Suppl 1):S20-S30.
- Kurth T, Winter AC, Eliassen AH, Dushkes R, Mukamal KJ, Rimm EB, et al. Migraine and risk of cardio-vascular disease in women: prospective cohort study. BMJ. 2016;353:i2610.
- Schurks M, Rist PM, Bigal ME, Buring JE, Lipton RB, Kurth T. Migraine and cardiovascular disease: systematic review and meta-analysis. BMJ. 2009;339:b3914.
- Kruit MC, van Buchem MA, Hofman PA, Bakkers JT, Terwindt GM, Ferrari MD, et al. Migraine as a risk factor for subclinical brain lesions. JAMA. 2004;291(4):427-34.
- Bigal ME, Kurth T, Hu H, Santanello N, Lipton RB. Migraine and cardiovascular disease: possible mechanisms of interaction. Neurology. 2009;72(21):1864-71.
- Linstra K, Wermer M, Terwindt GM. Vrouwen met migraine hebben verhoogd risico op hart- en vaatziekten. Ned Tijdschr Geneeskd. [accepted].
- Palm-Meinders IH, Koppen H, Terwindt GM, Launer LJ, Konishi J, Moonen JM, et al. Structural brain changes in migraine. JAMA. 2012;308(18):1889-97.
- David PS, Kling JM, Starling AJ. Migraine in pregnancy and lactation. Curr Neurol Neurosci Rep. 2014;14(4):439.
- Elkind AH, Satin, L.Z., Nila, A., Keywood, C. Frovatriptan use in migraineus with or at high risk of coronary artery disease. Headache. 2004;44:403-10.
- Gnecchi-Ruscose T, Bernard, X., Pierre, P., Anderson, D., Legg, N., Enahoro, H., Winter, P.D.O., Crisp, A., Melin, J.A., Camici, P.G. Effect of naratriptan on myocardial blood flow and coronary vasodilator reserve in migraineurs. Neurology. 2000;55:95-9.
- Lugardon S, Roussel H, Sciortino V, Montastruc JL, Lapeyre-Mestre M. Triptan use and risk of cardio-vascular events: a nested-case-control study from the French health system database. Eur J Clin Pharmacol. 2007;63(8):801-7.
- Mathew NT, Hettiarachchi, J., Alderman, J. Tolerability and safety of eletriptan in the treatment of migraine: a comprehensive review. Headache. 2003;43:962-74.
- Roberto G, Piccinni C, D'Alessandro R, Poluzzi E. Triptans and serious adverse vascular events: data mining of the FDA Adverse Event Reporting System database. Cephalalgia. 2014;34(1):5-13.
- Tomita MS, N., Igarashi, H., Endo, M., Sakai, F. . Evidence against strong correlation between chest symptoms and ischemic coronary changes after subcuteaneous sumatriptan injection. Internal Medicine. 2002;41:6225-625.
- Velentgas P, Cole, J.A., Mo, J, Sikes, C.R., Walker, A.M. Severe vascular events in migraine patients. Headache. 2004;44:642-51.
- Wammes-van der Heijden EA, Rahimtoola, H., Leufkens, H.G.M., Tijssen, C.C., Egberts, A.C.G. Risk of ischemic complications related to the intensity of triptan and ergotamine use. . Neurology. 2006;67:1128-34.
- Berard A, Kori S. Dihydroergotamine (DHE) use during gestation and the risk of adverse pregnancy outcomes. Headache. 2012;52(7):1085-93.
- Cunnington M, Ephross S, Churchill P. The safety of sumatriptan and naratriptan in pregnancy: what have we learned? Headache. 2009;49(10):1414-22.
- Ephross SA, Sinclair SM. Final results from the 16-year sumatriptan, naratriptan, and treximet preg-nancy registry. Headache. 2014;54(7):1158-72.
- Evans EW, Lorber KC. Use of 5-HT1 agonists in pregnancy. Ann Pharmacother. 2008;42(4):543-9.
- Hilaire ML, Cross LB, Eichner SF. Treatment of migraine headaches with sumatriptan in pregnancy. Ann Pharmacother. 2004;38(10):1726-30.
- Källen B, Nilsson, E., Otterblad Olausson, P. . Delivery outcome after maternal use of drugs for mi-graine. A register study in Sweden. Drug Saf. 2011;34(8):691-703.
- Marchenko A, Etwel F, Olutunfese O, Nickel C, Koren G, Nulman I. Pregnancy outcome following prenatal exposure to triptan medications: a meta-analysis. Headache. 2015;55(4):490-501.
- Nezvalová-Henriksen K, Spigset, O., Nordeng, H. Triptan safety during pregnancy: a Norwegian population registry study. Eur J Epidemiol. 2013;28:759-69.
- Berenson F, Vasconcellos E, Pakalnis A, Mao L, Biondi DM, Armstrong RB. Long-term, open-label safety study of oral almotriptan 12.5 mg for the acute treatment of migraine in adolescents. Headache. 2010;50(5):795-807.
- Curran M.P. EHC, Wagstaff A.J. Intranasal sumatriptan in adolescents with migraine. CNS Drugs. 2005;19(4):335-43.
- Damen L, Bruijn JK, Verhagen AP, Berger MY, Passchier J, Koes BW. Symptomatic treatment of mi-graine in children: a systematic review of medication trials. Pediatrics. 2005;116(2):e295-302.
- Evers S, Rahmann, A., Kraemer, C., Kurlemann, G., Debus, O., Husstedt, I.W., Frese, A. Treatment of childhood migraine attacks with oral zolmitriptan and ibuprofen. Neurology. 2006;67:497-9.
- Evers S. The efficacy of triptans in childhood and adolescence migraine. Curr Pain Headache Rep. 2013;17(7):342.
- Fraser IP, Han L, Han TH, Li CC, Hreniuk D, Stoch SA, et al. Pharmacokinetics and tolerability of riza-triptan in pediatric migraineurs in a randomized study. Headache. 2012;52(4):625-35.
- Hewitt DJ, Pearlman E, Hamalainen M, Lewis D, Connor KM, Michelson D, et al. Long-term open-label safety study of rizatriptan acute treatment in pediatric migraineurs. Headache. 2013;53(1):104-17.
- Ho TW, Pearlman E, Lewis D, Hamalainen M, Connor K, Michelson D, et al. Efficacy and tolerability of rizatriptan in pediatric migraineurs: results from a randomized, double-blind, placebo-controlled trial using a novel adaptive enrichment design. Cephalalgia. 2012;32(10):750-65.
- Linder SL, Mathew NT, Cady RK, Finlayson G, Ishkanian G, Lewis DW. Efficacy and tolerability of almotriptan in adolescents: a randomized, double-blind, placebo-controlled trial. Headache. 2008;48(9):1326-36.
- Major PW, Grubisa, H.S.I., Thie, N.M.R. Triptans for treatment of acute pediatric migraine: a systematic literature review. Pediatr Neurol. 2003;29:425-9.
- McDonald SA, Hershey, A.D., Pearlman, E., Lewis, D., Winner, P.K., Rothner, D., Linder, S.L., Runken, C., Richard, N.E., Derosier, F.J. Long-term evaluation of sumatriptan and naproxen sodium for the acute treatment of migraine in adolescents. Headache. 2011;51:1374-87.
- Natarajan S, Jabbour, J.T., Webster, C.J., Richardson, M.S. Long-term tolerability of sumatriptan nasal spray in adolescent patients with migraine. Headache. 2004;44:969-77.
- Rothner AD, Winner, P., Nett, R., Asgharnejad, M., Laurenza, A., Austin, R., Peykamian, M. . One-year tolerability and efficacy of sumatriptan nasal spray in adolescents with migraine: results of a multicenter, open-label study. Clin Ther. 2000;22:1533-46.
- Rothner AD, Wasiewski W, Winner P, Lewis D, Stankowski J. Zolmitriptan oral tablet in migraine treatment: high placebo responses in adolescents. Headache. 2006;46(1):101-9.
- Winner P, Rothner, D., Saper, J., Nett, R., Asgharnejad, M., Laurenza, A., Austin, R., Peykamian, M. A randomized, double-blind, placebo-controlled study of sumatriptan nasal spray in the treatment of acute migraine in adolescents. Pediatrics. 2000;106:989-97.
- Winner P, Lewis, D., Visser, H., Jiang, K., Ahrens, S., Evans, J.K. Rizatriptan 5 mg for the acute treat-ment of migraine in adolescents: a randomized, double-blind, placebo-controlled study. Headache. 2002;42:49-55.
- Winner P, Linder SL, Lipton RB, Almas M, Parsons B, Pitman V. Eletriptan for the acute treatment of migraine in adolescents: results of a double-blind, placebo-controlled trial. Headache. 2007;47(4):511-8.
- Winner P, Rothner AD, Wooten JD, Webster C, Ames M. Sumatriptan nasal spray in adolescent mi-graineurs: a randomized, double-blind, placebo-controlled, acute study. Headache. 2006;46(2):212-22.
- Richer L, Billinghurst L, Linsdell MA, Russell K, Vandermeer B, Crumley ET, et al. Drugs for the acute treatment of migraine in children and adolescents. Cochrane Database Syst Rev. 2016;4:CD005220.
- Aurora SK, Barrodale PM, McDonald SA, Jakubowski M, Burstein R. Revisiting the efficacy of suma-triptan therapy during the aura phase of migraine. Headache. 2009;49(7):1001-4.
- Bates D, Ashford, E., Dawson, R., Ensink, F-B.M., Gilhus, N.E., Olesen, J., Pilgrim, A.J., Shevlin, P. Subcutaneous sumatriptan during the migraine aura. Neurology. 1994;44:1587-15892.
- Cady RK, Freitag FG, Mathew NT, Elkind AH, Mao L, Fisher AC, et al. Allodynia-associated symptoms, pain intensity and time to treatment: predicting treatment response in acute migraine intervention. Headache. 2009;49(3):350-63.
- Diaz-Insa S, Goadsby PJ, Zanchin G, Fortea J, Falques M, Vila C. The impact of allodynia on the efficacy of almotriptan when given early in migraine: data from the "Act when mild" study. Int J Neurosci. 2011;121(12):655-61.
- Dowson AJ, Mathew, N.T., Pascual, J. Review of clinical trials using early acute intervention with oral triptans for migraine management. Int J Clin Pract. 2006;60(6):698-706.
- Evers S, Savi, L., Omboni, S., Lisotto, C., Zanchin, G., Pinessi, L. Efficacy of frovatriptan as compared to other triptans in migraine with aura. J Headache Pain. 2015;16(28):1-5.
- Hu XH, Ng-Mak D, Cady R. Does early migraine treatment shorten time to headache peak and reduce its severity? Headache. 2008;48(6):914-20.
- Lampl C, Huber G, Haas S, Rittberger E, Diener HC. Difference in triptan effect in patients with mi-graine and early allodynia. Cephalalgia. 2008;28(10):1031-8.
- Landy S, Hoagland R, Hoagland NA. Sumatriptan-naproxen migraine efficacy in allodynic patients: early intervention. Headache. 2012;52(1):133-9.
- Landy SH, McGinnis JE, McDonald SA. Clarification of developing and established clinical allodynia and pain-free outcomes. Headache. 2007;47(2):247-52.
- Lanteri-Minet M, Mick G, Allaf B. Early dosing and efficacy of triptans in acute migraine treatment: the TEMPO study. Cephalalgia. 2012;32(3):226-35.
- Olesen J, Diener, H.C., Schoenen, J., Hettiarachchi, J. No effect of eletriptan administration during the aura phase of migraine. Eur J Neurol. 2004;11:671-7.
- Burstein R, Collins B, Jakubowski M. Defeating migraine pain with triptans: a race against the devel-opment of cutaneous allodynia. Ann Neurol. 2004;55(1):19-26.
- Burstein R, Cutrer MF, Yarnitsky D. The development of cutaneous allodynia during a migraine attack clinical evidence for the sequential recruitment of spinal and supraspinal nociceptive neurons in migraine. Brain. 2000;123 ( Pt 8):1703-9.
- Adelman J, Freitag FG, Lainez M, Shi Y, Ascher S, Mao L, et al. Analysis of safety and tolerability data obtained from over 1,500 patients receiving topiramate for migraine prevention in controlled trials. Pain Med. 2008;9(2):175-85.
- Barnes NP. Migraine headache in children. Clinical Evidence. 2015;6(318):1-33.
- Bonfert M, Straube A, Schroeder AS, Reilich P, Ebinger F, Heinen F. Primary headache in children and adolescents: update on pharmacotherapy of migraine and tension-type headache. Neuropediatrics. 2013;44(1):3-19.
- Damen L, Bruijn J, Verhagen AP, Berger MY, Passchier J, Koes BW. Prophylactic treatment of migrai-ne in children. Part 2. A systematic review of pharmacological trials. Cephalalgia. 2006;26(5):497-505.
- El-Chammas K, Keyes, J., Thompson, N., Vijayakumar, J., Becher, D., Jackson, J.L. A comparative effectiveness meta-analysis of drugs for the prophylaxis of pediatric migraine headache. JAMA Pediatr. 2013;167(3):250-8.
- Huang Y, Cai X, Song X, Tang H, Huang Y, Xie S, et al. Steroids for preventing recurrence of acute se-vere migraine headaches: a meta-analysis. Eur J Neurol. 2013;20(8):1184-90.
- Jackson JL, Cogbill E, Santana-Davila R, Eldredge C, Collier W, Gradall A, et al. A Comparative Effec-tiveness Meta-Analysis of Drugs for the Prophylaxis of Migraine Headache. PLoS One. 2015;10(7):e0130733.
- Linde K, Rossnagel K. Propranolol for migraine prophylaxis. Cochrane Database Syst Rev. 2004(2):CD003225.
- Linde M, Mulleners WM, Chronicle EP, McCrory DC. Gabapentin or pregabalin for the prophylaxis of episodic migraine in adults. Cochrane Database Syst Rev. 2013(6):CD010609.
- Linde M, Mulleners WM, Chronicle EP, McCrory DC. Topiramate for the prophylaxis of episodic mi-graine in adults. Cochrane Database Syst Rev. 2013(6):CD010610.
- Linde M, Mulleners WM, Chronicle EP, McCrory DC. Valproate (valproic acid or sodium valproate or a combination of the two) for the prophylaxis of episodic migraine in adults. Cochrane Database Syst Rev. 2013(6):CD010611.
- Pringsheim T, Davenport WJ, Becker WJ. Prophylaxis of migraine headache. CMAJ. 2010;182(7):E269-76.
- Shamliyan TA, Choi JY, Ramakrishnan R, Miller JB, Wang SY, Taylor FR, et al. Preventive pharmacologic treatments for episodic migraine in adults. J Gen Intern Med. 2013;28(9):1225-37.
- Tomkins GE, Jackson, J.L., O'Malley, P.G., Balden, E., Santoro, J.E. Treatment of chronic headache with antidepressants: a meta-analysis. . Am J Med. 2001;111:54-63.
- Victor S, Ryan, S. Drugs for preventing migraine headaches in children (review). Cochrane Database Syst Rev. 2003(4).
- Linde M, Mulleners WM, Chronicle EP, McCrory DC. Antiepileptics other than gabapentin, prega-balin, topiramate, and valproate for the prophylaxis of episodic migraine in adults. Cochrane Database Syst Rev. 2013(6):CD010608.
- Powers SW, Coffey CS, Chamberlin LA, Ecklund DJ, Klingner EA, Yankey JW, et al. Trial of Amitripty-line, Topiramate, and Placebo for Pediatric Migraine. N Engl J Med. 2016.
- Classification and diagnostic criteria for headache disorders, cranial neuralgias and facial pain. Headache Classification Committee of the International Headache Society. Cephalalgia. 1988;8 Suppl 7:1-96.
- Jackson JL, Kuriyama A, Hayashino Y. Botulinum toxin A for prophylactic treatment of migraine and tension headaches in adults: a meta-analysis. JAMA. 2012;307(16):1736-45.
- Kroon Van Diest AM, Ramsey R, Kashikar-Zuck S, Slater S, Hommel K, Kroner JW, et al. Treatment Adherence in Child and Adolescent Chronic Migraine Patients: Results from the Cognitive Behavioral Therapy and Amitriptyline Trial. The Clinical Journal of Pain. 9000;Publish Ahead of Print.
- Vongvaivanich K, Lertakyamanee P, Silberstein SD, Dodick DW. Late-life migraine accompa-niments: A narrative review. Cephalalgia. 2015;35(10):894-911.
- Vetvik KG, MacGregor EA. Sex differences in the epidemiology, clinical features, and pathophysiology of migraine. Lancet Neurol. 2016.
- Macgregor EA. Headache in pregnancy. Continuum (Minneap Minn). 2014;20(1 Neurology of Preg-nancy):128-47.
- Ripa P, Ornello R, Degan D, Tiseo C, Stewart J, Pistoia F, et al. Migraine in menopausal women: a systematic review. Int J Womens Health. 2015;7:773-82.
- Vetvik KG, Macgregor EA, Lundqvist C, Russell MB. Prevalence of menstrual migraine: a po-pulation-based study. Cephalalgia. 2014;34(4):280-8.
- Couturier EG, Bomhof MA, Neven AK, van Duijn NP. Menstrual migraine in a representative Dutch population sample: prevalence, disability and treatment. Cephalalgia. 2003;23(4):302-8.
- Hu Y, Guan X, Fan L, Jin L. Triptans in prevention of menstrual migraine: a systematic review with meta-analysis. J Headache Pain. 2013;14:7.
- Etminan M, Takkouche B, Isorna FC, Samii A. Risk of ischaemic stroke in people with migraine: sys-tematic review and meta-analysis of observational studies. BMJ. 2005;330(7482):63.
- Spector JT, Kahn SR, Jones MR, Jayakumar M, Dalal D, Nazarian S. Migraine headache and ischemic stroke risk: an updated meta-analysis. Am J Med. 2010;123(7):612-24.
- Chang CL, Donaghy M, Poulter N. Migraine and stroke in young women: case-control study. The World Health Organisation Collaborative Study of Cardiovascular Disease and Steroid Hormone Contra-ception. BMJ. 1999;318(7175):13-8.
- Bigal ME, Rapoport AM, Sheftell FD, Tepper SJ, Lipton RB. Transformed migraine and medication overuse in a tertiary headache centre--clinical characteristics and treatment outcomes. Cephalalgia. 2004;24(6):483-90.
- Brandes JL. The influence of estrogen on migraine. A systematic review. JAMA 2006;295(15):1824-30.
- Calhoun A. A novel specific prophylaxis for menstrual-associated migraine. South Med J. 2004;97(9):819-22.
- Calhoun A. Combined hormonal contraceptives: is it time to reassess their role in migraine? Head-ache. 2012;52(4):648-60.
- Calhoun A, Ford S, Pruitt A. The impact of extended-cycle vaginal ring contraception on migraine aura: a retrospective case series. Headache. 2012;52(8):1246-53.
- Calhoun AH, Hutchinson, S. Hormonal therapies for menstrual migraine. Curr Pain Headache Rep. 2009;13:381-5.
- De Leo V, Scolaro V, Musacchio MC, Di Sabatino A, Morgante G, Cianci A. Combined oral contraceptives in women with menstrual migraine without aura. Fertil Steril. 2011;96(4):917-20.
- Goldstein LB, Adams R, Alberts MJ, Appel LJ, Brass LM, Bushnell CD, et al. Primary Prevention of Ischemic Stroke: A Guideline From the American Heart Association/American Stroke Association Stroke Council: Cosponsored by the Atherosclerotic Peripheral Vascular Disease Interdisciplinary Working Group; Cardiovascular Nursing Council; Clinical Cardiology Council; Nutrition, Physical Activity, and Me-tabolism Council; and the Quality of Care and Outcomes Research Interdisciplinary Working Group: The American Academy of Neurology affirms the value of this guideline. Stroke. 2006;37(6):1583-633.
- Guidotti M, Mauri M, Barrila C, Guidotti F, Belloni C. Frovatriptan vs. transdermal oestrogens or naproxen sodium for the prophylaxis of menstrual migraine. J Headache Pain. 2007;8(5):283-8.
- MacGregor EA. Menstrual migraine: a clinical review. J Fam Plann Reprod Health Care. 2007;33(1):36-47.
- Martin VT, Pavlovic J, Fanning KM, Buse DC, Reed ML, Lipton RB. Perimenopause and Menopause Are Associated With High Frequency Headache in Women With Migraine: Results of the American Mi-graine Prevalence and Prevention Study. Headache. 2016;56(2):292-305.
- Merki-Feld GS, Imthurn, B., Langner, R., Seifert, B., Gantenbein, A.R. Positive effects of the progestin desogestrel 75 ug on migraine frequency and use of acute medication are sustained over a treatment period of 180 days. J Headache Pain. 2015;16(39):1-7.
- Merki-Feld GS, Imthurn B, Seifert B, Merki LL, Agosti R, Gantenbein AR. Desogestrel-only contraception may reduce headache frequency and improve quality of life in women suffering from migraine. Eur J Contracept Reprod Health Care. 2013;18(5):394-400.
- Morotti M, Remorgida V, Venturini PL, Ferrero S. Progestin-only contraception compared with ex-tended combined oral contraceptive in women with migraine without aura: a retrospective pilot study. Eur J Obstet Gynecol Reprod Biol. 2014;183:178-82.
- Nappi RE, Sances G, Allais G, Terreno E, Benedetto C, Vaccaro V, et al. Effects of an estrogen-free, desogestrel-containing oral contraceptive in women with migraine with aura: a prospective diary-based pilot study. Contraception. 2011;83(3):223-8.
- Nappi RE, Terreno E, Sances G, Martini E, Tonani S, Santamaria V, et al. Effect of a contraceptive pill containing estradiol valerate and dienogest (E2V/DNG) in women with menstrually-related migraine (MRM). Contraception. 2013;88(3):369-75.
- Nierenburg Hdel C, Ailani J, Malloy M, Siavoshi S, Hu NN, Yusuf N. Systematic Review of Preventive and Acute Treatment of Menstrual Migraine. Headache. 2015;55(8):1052-71.
- Pringsheim T, Davenport, W.J., Dodick, D. Acute treatment and prevention of menstrually related migraine headache. Neurology. 2008;70:1555-63.
- Shuster LT, Faubion SS, Sood R, Casey PM. Hormonal manipulation strategies in the management of menstrual migraine and other hormonally related headaches. Curr Neurol Neurosci Rep. 2011;11(2):131-8.
- Silberstein SD, Elkind, A.H., Schreiber, C., Keywood, C. A randomized trial of frovatriptan for the in-termittent prevention of menstrual migraine. Neurology. 2004;63:261-9.
- Sulak P, Willis S, Kuehl T, Coffee A, Clark J. Headaches and oral contraceptives: impact of eli-minating the standard 7-day placebo interval. Headache. 2007;47(1):27-37.
- Vetvik KG, MacGregor, E.A., Lundqvist, C., Russel, M.B. Contraceptive-induced amenorrhoea leads to reduced migraine frequency in women with menstrual migraine without aura. J Headache Pain. 2014;15(30):1-5.
- Pavlovic JM, Allshouse AA, Santoro NF, Crawford SL, Thurston RC, Neal-Perry GS, et al. Sex hor-mones in women with and without migraine: Evidence of migraine-specific hormone profiles. Neurology. 2016;87(1):49-56.
- Mercante JP, Peres MF, Guendler V, Zukerman E, Bernik MA. Depression in chronic migraine: severity and clinical features. Arq Neuropsiquiatr. 2005;63(2A):217-20.
- Fuh JL, Wang SJ, Lu SR, Juang KD. Does medication overuse headache represent a behavior of de-pendence? Pain. 2005;119(1-3):49-55.
- Bigal ME, Serrano D, Buse D, Scher A, Stewart WF, Lipton RB. Acute migraine medications and evo-lution from episodic to chronic migraine: a longitudinal population-based study. Headache. 2008;48(8):1157-68.
- Scher AI, Stewart WF, Ricci JA, Lipton RB. Factors associated with the onset and remission of chronic daily headache in a population-based study. Pain. 2003;106(1-2):81-9.
- Ashina S, Serrano D, Lipton RB, Maizels M, Manack AN, Turkel CC, et al. Depression and risk of transformation of episodic to chronic migraine. J Headache Pain. 2012;13(8):615-24.
- Louter MA, Wardenaar KJ, Veen G, van Oosterhout WP, Zitman FG, Ferrari MD, et al. Allodynia is associated with a higher prevalence of depression in migraine patients. Cephalalgia. 2014;34(14):1187-92.
- Breslau N, Lipton RB, Stewart WF, Schultz LR, Welch KM. Comorbidity of migraine and depression: investigating potential etiology and prognosis. Neurology. 2003;60(8):1308-12.
- Hung CI, Wang SJ, Yang CH, Liu CY. The impacts of migraine, anxiety disorders, and chronic depres-sion on quality of life in psychiatric outpatients with major depressive disorder. J Psychosom Res. 2008;65(2):135-42.
- Louter MA, Bosker JE, van Oosterhout WP, van Zwet EW, Zitman FG, Ferrari MD, et al. Cutaneous allodynia as a predictor of migraine chronification. Brain. 2013;136(Pt 11):3489-96.
- Altieri M, Di Giambattista R, Di Clemente L, Fagiolo D, Tarolla E, Mercurio A, et al. Combined phar-macological and short-term psychodynamic psychotherapy for probable medication overuse heada-che: a pilot study. Cephalalgia. 2009;29(3):293-9.
- Boe MG, Mygland, A., Salvesen, R. Prednisolone does not reduce withdrawal headache. Neu-rology. 2007;69:26-31.
- Descombes S, Brefel-Courbon, C., Thalamas, C., Albucher, J.F., Rascol, O., Montastruc, J.L., Senard, J.M. Amitriptyline treatment in chronic drug-induced headache: a double-blind comparative pilot study. Headache. 2001;41:178-82.
- Diener HC. Detoxification for medication overuse headache is not necessary. Cephalalgia. 2012;32(5):423-7.
- Johnson JL, Kwok YH, Sumracki NM, Swift JE, Hutchinson MR, Johnson K, et al. Glial Attenuation With Ibudilast in the Treatment of Medication Overuse Headache: A Double-Blind, Randomized, Pla-cebo-Controlled Pilot Trial of Efficacy and Safety. Headache. 2015;55(9):1192-208.
- Kristoffersen ES, Straand, J., Russell, M.B., Lundqvist, C. Disability, anxiety and depression in pa-tients with medication-overuse headache in primary care - the BIMOH study. Eur J Neurol. 2015;23(Suppl.1):28-35.
- Kristoffersen ES, Straand, J., Vetvik, K.G., Benth, J.S., Russel, M.B., Lundqvist, C. Brief intervention by genral practitioners for medication-overuse headache, follow-up after 6 months: a pragmatic cluster-randomised controlled trial. J Neurol 2016;263:344-53.
- Kristoffersen ES, Straand J, Vetvik KG, Benth JS, Russell MB, Lundqvist C. Brief intervention for medication-overuse headache in primary care. The BIMOH study: a double-blind pragmatic cluster randomised parallel controlled trial. J Neurol Neurosurg Psychiatry. 2015;86(5):505-12.
- Krymchantowski AV, Moreira, P.F. Out-patient detoxification in chronic migraine: comparison of strategies. Cephalalgia. 2003;23:982-93.
- Munksgaard SB, Jensen, R.H. Medication overuse headache. Headache. 2014:1251-7.
- Munksgaard SB, Bendtsen L, Jensen RH. Detoxification of medication-overuse headache by a multidisciplinary treatment programme is highly effective: a comparison of two consecutive treatment methods in an open-label design. Cephalalgia. 2012;32(11):834-44.
- Negro A, Curto, M., Lionetto, L., Martelletti, P. A two-years open-label prospective study of OnabotulinumtoxinA 195U in medication overuse headache: a real-world experience. J Headache Pain. 2016;17(1):1-9.
- Pageler L, Katsarava Z, Diener HC, Limmroth V. Prednisone vs. placebo in withdrawal therapy fol-lowing medication overuse headache. Cephalalgia. 2008;28(2):152-6.
- Rabe K, Pageler L, Gaul C, Lampl C, Kraya T, Foerderreuther S, et al. Prednisone for the treatment of withdrawal headache in patients with medication overuse headache: a randomized, double-blind, placebo-controlled study. Cephalalgia. 2013;33(3):202-7.
- Rizzato B, Leone G, Misaggi G, Zivi I, Diomedi M. Efficacy and tolerability of pregabalin versus topir-amate in the prophylaxis of chronic daily headache with analgesic overuse: an open-label prospective study. Clin Neuropharmacol. 2011;34(2):74-8.
- Rossi P, Faroni, J.V., Tassorelli, C., Nappi, G. Advice alone versus structured detoxification pro-grammes for complicated medication overuse headache (MOH): a prospective, randomized, open-label trial. J Headache Pain. 2013;14(10):1-8.
- Sarchielli P, Messina P, Cupini LM, Tedeschi G, Di Piero V, Livrea P, et al. Sodium valproate in mi-graine without aura and medication overuse headache: a randomized controlled trial. Eur Neuropsychopharmacol. 2014;24(8):1289-97.
- Taghdiri F, Togha M, Razeghi Jahromi S, Paknejad SM. Celecoxib vs prednisone for the treatment of withdrawal headache in patients with medication overuse headache: a randomized, double-blind clinical trial. Headache. 2015;55(1):128-35.
- Hagen K, . Stovner, L.J. A randomized controlled trial on medication-overuse headache: outcome after 1 and 4 years. Acta Neurol Scand. 2011;124(Suppl 191):38-43.
- Zeeberg P, Olesen J, Jensen R. Probable medication-overuse headache: the effect of a 2-month drug-free period. Neurology. 2006;66(12):1894-8.
- Rossi P, Faroni JV, Nappi G. Short-term effectiveness of simple advice as a withdrawal strategy in simple and complicated medication overuse headache. Eur J Neurol. 2011;18(3):396-401.
- Diener HC, Gaul C, Jensen R, Gobel H, Heinze A, Silberstein SD. Integrated headache care. Cephalalgia. 2011;31(9):1039-47.
- Steiner TJ, World Headache A. Lifting the burden: The global campaign against headache. Lancet Neurol. 2004;3(4):204-5.
- Gaul C, Liesering-Latta E, Schafer B, Fritsche G, Holle D. Integrated multidisciplinary care of head-ache disorders: A narrative review. Cephalalgia. 2015.
- Dekker F, Wiendels NJ, de Valk V, van der Vliet C, Knuistingh Neven A, Assendelft WJ, et al. Triptan overuse in the Dutch general population: a nationwide pharmaco-epidemiology database analysis in 6.7 million people. Cephalalgia. 2011;31(8):943-52.
- Disease GBD, Injury I, Prevalence C. Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet. 2016;388(10053):1545-602.
- Gunreben-Stempfle B, Griessinger N, Lang E, Muehlhans B, Sittl R, Ulrich K. Effectiveness of an in-tensive multidisciplinary headache treatment program. Headache. 2009;49(7):990-1000.
- Jensen R, Zeeberg P, Dehlendorff C, Olesen J. Predictors of outcome of the treatment programme in a multidisciplinary headache centre. Cephalalgia. 2010;30(10):1214-24.
- Soon YY, Siow HC, Tan CY. Assessment of migraineurs referred to a specialist headache clinic in Sin-gapore: diagnosis, treatment strategies, outcomes, knowledge of migraine treatments and satisfaction. Cephalalgia. 2005;25(12):1122-32.
- Wallasch TM, Angeli A, Kropp P. Outcomes of a headache-specific cross-sectional multidisciplinary treatment program. Headache. 2012;52(7):1094-105.
- Wallasch TM, Hermann C. Validation of criterion-based patient assignment and treatment effec-tiveness of a multidisciplinary modularized managed care program for headache. J Headache Pain. 2012;13(5):379-87.
- Zeeberg P, Olesen J, Jensen R. Efficacy of multidisciplinary treatment in a tertiary referral headache centre. Cephalalgia. 2005;25(12):1159-67.
- Dekker F, van Duijn NP, Ongering JEP, Bartelink MEL, Boelman L, Burgers J, et al. NHG-Standaard Hoofdpijn (derde herziening). Huisarts Wet 2014;57(1):20-31.
- Linden van der MW, Westert GP, Bakker de DH, Schellevis FG. Tweede Nationale Studie naar ziek-ten en verrichtingen in de huisartspraktijk. Klachten en aandoeningen in de bevolking en in de huisartspraktijk. Utrecht/Bilthoven: NIVEL/RIVM; 2004.
- Ridsdale L, Clark LV, Dowson AJ, Goldstein LH, Jenkins L, McCrone P, et al. How do patients referred to neurologists for headache differ from those managed in primary care? BrJGenPract. 2007;57(538):388-95.
- Latinovic R, Gulliford M, Ridsdale L. Headache and migraine in primary care: consultation, prescrip-tion, and referral rates in a large population. Journal of neurology, neurosurgery, and psychiatry. 2006;77(3):385-7.
- Lipton RB, Bigal ME, Steiner TJ, Silberstein SD, Olesen J. Classification of primary headaches. Neu-rology. 2004;63(3):427-35.
- Rasmussen BK. Epidemiology of headache. Cephalalgia. 2001;21(7):774-7.
- Schwartz BS, Stewart WF, Simon D, Lipton RB. Epidemiology of tension-type headache. JAMA. 1998;279(5):381-3.
- Rasmussen BK, Jensen R, Olesen J. Impact of headache on sickness absence and utilisation of medical services: a Danish population study. J Epidemiol Community Health. 1992;46(4):443-6.
- Stovner L, Hagen K, Jensen R, Katsarava Z, Lipton R, Scher A, et al. The global burden of headache: a documentation of headache prevalence and disability worldwide. Cephalalgia. 2007;27(3):193-210.
- Bendtsen L. Central sensitization in tension-type headache--possible pathophysiological mecha-nisms. Cephalalgia. 2000;20(5):486-508.
- Jensen R. Mechanisms of tension-type headache. Cephalalgia. 2001;21(7):786-9.
- Jensen R. Peripheral and central mechanisms in tension-type headache: an update. Cephalalgia. 2003;23 Suppl 1:49-52.
- Dowson AJ, Dodick DW, Limmroth V. Medication overuse headache in patients with primary head-ache disorders: epidemiology, management and pathogenesis. CNS Drugs. 2005;19(6):483-97.
- Holroyd KA. Behavioral and psychologic aspects of the pathophysiology and management of ten-sion-type headache. Curr Pain Headache Rep. 2002;6(5):401-7.
- Blanchard EB. Psychological treatment of benign headache disorders. J Consult Clin Psychol. 1992;60(4):537-51.
- Kaushik R, Kaushik RM, Mahajan SK, Rajesh V. Biofeedback assisted diaphragmatic breathing and systematic relaxation versus propranolol in long term prophylaxis of migraine. Complement Ther Med. 2005;13(3):165-74.
- Melchart D, Streng A, Hoppe A, Brinkhaus B, Witt C, Wagenpfeil S, et al. Acupuncture in patients with tension-type headache: randomised controlled trial. BMJ. 2005;331(7513):376-82.
- Diener HC, Kronfeld K, Boewing G, Lungenhausen M, Maier C, Molsberger A, et al. Efficacy of acu-puncture for the prophylaxis of migraine: a multicentre randomised controlled clinical trial. Lancet Neu-rol. 2006;5(4):310-6.
- Karst M, Reinhard M, Thum P, Wiese B, Rollnik J, Fink M. Needle acupuncture in tension-type headache: a randomized, placebo-controlled study. Cephalalgia. 2001;21(6):637-42.
- Boline PD, Kassak K, Bronfort G, Nelson C, Anderson AV. Spinal manipulation vs. amitriptyline for the treatment of chronic tension-type headaches: a randomized clinical trial. J Manipulative Physiol Ther. 1995;18(3):148-54.
- Migliardi JR, Armellino JJ, Friedman M, Gillings DB, Beaver WT. Caffeine as an analgesic adjuvant in tension headache. Clin Pharmacol Ther. 1994;56(5):576-86.
- Koch GG, Amara IA, MacMillan J. Evaluation of alternative statistical models for crossover studies to demonstrate caffeine adjuvancy in the treatment of tension headache. J Biopharm Stat. 1994;4(3):347-410.
- Lance JW, Curran DA. Treatment of Chronic Tension Headache. Lancet. 1964;1(7345):1236-9.
- Diamond S, Baltes BJ. Chronic tension headache--treated with amitriptyline--a double-blind study. Headache. 1971;11(3):110-6.
- Gobel H, Hamouz V, Hansen C, Heininger K, Hirsch S, Lindner V, et al. Chronic tension-type head-ache: amitriptyline reduces clinical headache-duration and experimental pain sensitivity but does not alter pericranial muscle activity readings. Pain. 1994;59(2):241-9.
- Goadsby PJ. Chronic tension-type headache: where are we? Brain. 1999;122 ( Pt 9):1611-2.
- Jackson JL, Shimeall W, Sessums L, Dezee KJ, Becher D, Diemer M, et al. Tricyclic antidepressants and headaches: systematic review and meta-analysis. BMJ. 2010;341:c5222.
- Verhagen AP, Damen L, Berger MY, Passchier J, Koes BW. Lack of benefit for prophylactic drugs of tension-type headache in adults: a systematic review. Fam Pract. 2010;27(2):151-65.
- Ashina M. Neurobiology of chronic tension-type headache. Cephalalgia. 2004;24(3):161-72.
- Tomkins GE, Jackson JL, O'Malley PG, Balden E, Santoro JE. Treatment of chronic headache with antidepressants: a meta-analysis. Am J Med. 2001;111(1):54-63.
- Fogelholm R, Murros K. Tizanidine in chronic tension-type headache: a placebo controlled double-blind cross-over study. Headache. 1992;32(10):509-13.
- Morland TJ, Storli OV, Mogstad TE. Doxepin in the prophylactic treatment of mixed 'vascular' and tension headache. Headache. 1979;19(7):382-3.
- Moja PL, Cusi C, Sterzi RR, Canepari C. Selective serotonin re-uptake inhibitors (SSRIs) for preventing migraine and tension-type headaches. Cochrane Database Syst Rev. 2005(3):CD002919.
- Manna V, Bolino F, Di Cicco L. Chronic tension-type headache, mood depression and serotonin: therapeutic effects of fluvoxamine and mianserine. Headache. 1994;34(1):44-9.
- Zissis NP, Harmoussi S, Vlaikidis N, Mitsikostas D, Thomaidis T, Georgiadis G, et al. A randomized, double-blind, placebo-controlled study of venlafaxine XR in out-patients with tension-type headache. Cephalalgia. 2007;27(4):315-24.
- Langemark M, Olesen J. Sulpiride and paroxetine in the treatment of chronic tension-type head-ache. An explanatory double-blind trial. Headache. 1994;34(1):20-4.
- Langemark M, Loldrup D, Bech P, Olesen J. Clomipramine and mianserin in the treatment of chronic tension headache. A double-blind, controlled study. Headache. 1990;30(3):118-21.
- Bendtsen L, Jensen R. Mirtazapine is effective in the prophylactic treatment of chronic tension-type headache. Neurology. 2004;62(10):1706-11.
- Bendtsen L, Buchgreitz L, Ashina S, Jensen R. Combination of low-dose mirtazapine and ibuprofen for prophylaxis of chronic tension-type headache. Eur J Neurol. 2007;14(2):187-93.
- Holroyd KA, O'Donnell FJ, Stensland M, Lipchik GL, Cordingley GE, Carlson BW. Management of chronic tension-type headache with tricyclic antidepressant medication, stress management therapy, and their combination: a randomized controlled trial. JAMA. 2001;285(17):2208-15.
- Padberg M, de Bruijn SF, de Haan RJ, Tavy DL. Treatment of chronic tension-type headache with botulinum toxin: a double-blind, placebo-controlled clinical trial. Cephalalgia. 2004;24(8):675-80.
- Evers S, Olesen J. Botulinum toxin in headache treatment: the end of the road? Cephalalgia. 2006;26(7):769-71.
- Evers S, Rahmann A, Vollmer-Haase J, Husstedt IW. Treatment of headache with botulinum toxin A--a review according to evidence-based medicine criteria. Cephalalgia. 2002;22(9):699-710.
- Fumal A, Schoenen J. Tension-type headache: current research and clinical management. Lancet Neurol. 2008;7(1):70-83.
- Hamalainen ML, Hoppu K, Santavuori P. Sumatriptan for migraine attacks in children: a randomized placebo-controlled study. Do children with migraine respond to oral sumatriptan differently from adults? Neurology. 1997;48(4):1100-3.
- Lewis D, Ashwal S, Hershey A, Hirtz D, Yonker M, Silberstein S, et al. Practice parameter: pharmacological treatment of migraine headache in children and adolescents: report of the American Academy of Neurology Quality Standards Subcommittee and the Practice Committee of the Child Neurology Society. Neurology. 2004;63(12):2215-24.
- Evers S, Rahmann A, Kraemer C, Kurlemann G, Debus O, Husstedt IW, et al. Treatment of childhood migraine attacks with oral zolmitriptan and ibuprofen. Neurology. 2006;67(3):497-9.
- Toldo I, Rattin M, Perissinotto E, De Carlo D, Bolzonella B, Nosadini M, et al. Survey on treatments for primary headaches in 13 specialized juvenile Headache Centers: The first multicenter Italian study. Eur J Paediatr Neurol. 2017;21(3):507-21.
- Silver S, Gano D, Gerretsen P. Acute treatment of paediatric migraine: a meta-analysis of efficacy. J Paediatr Child Health. 2008;44(1-2):3-9.
- Ahonen K, Hamalainen ML, Rantala H, Hoppu K. Nasal sumatriptan is effective in treatment of mi-graine attacks in children: A randomized trial. Neurology. 2004;62(6):883-7.
- Christensen ML, Eades SK, Fuseau E, Kempsford RD, Phelps SJ, Hak LJ. Pharmacokinetics of naratriptan in adolescent subjects with a history of migraine. J Clin Pharmacol. 2001;41(2):170-5.
- Elkind AH, Wade A, Ishkanian G. Pharmacokinetics of frovatriptan in adolescent migraineurs. J Clin Pharmacol. 2004;44(10):1158-65.
- Eiland LS, Hunt MO. The use of triptans for pediatric migraines. Paediatr Drugs. 2010;12(6):379-89.
- Eiland LS, Jenkins LS, Durham SH. Pediatric migraine: pharmacologic agents for prophylaxis. Ann Pharmacother. 2007;41(7):1181-90.
- Olness K, MacDonald JT, Uden DL. Comparison of self-hypnosis and propranolol in the treatment of juvenile classic migraine. Pediatrics. 1987;79(4):593-7.
- Forsythe WI, Gillies D, Sills MA. Propanolol ('Inderal') in the treatment of childhood migraine. Dev Med Child Neurol. 1984;26(6):737-41.
- Ludvigsson J. Propranolol used in prophylaxis of migraine in children. Acta Neurol Scand. 1974;50(1):109-15.
- Salmon MA. Pizotifen (BC.105. Sanomigran) in the profylaxis of childhood migraine. Cephalalgia. 1985;5(3 suppl.).
- Gillies D, Sills M, Forsythe I. Pizotifen (Sanomigran) in childhood migraine. A double-blind controlled trial. Eur Neurol. 1986;25(1):32-5.
- Pandina GJ, Ness S, Polverejan E, Yuen E, Eerdekens M, Bilder RM, et al. Cognitive effects of topir-amate in migraine patients aged 12 through 17 years. Pediatr Neurol. 2010;42(3):187-95.
- Lewis D, Winner P, Saper J, Ness S, Polverejan E, Wang S, et al. Randomized, double-blind, placebo-controlled study to evaluate the efficacy and safety of topiramate for migraine prevention in pediatric subjects 12 to 17 years of age. Pediatrics. 2009;123(3):924-34.
- Lakshmi CV, Singhi P, Malhi P, Ray M. Topiramate in the prophylaxis of pediatric migraine: a double-blind placebo-controlled trial. J Child Neurol. 2007;22(7):829-35.
- Winner P, Pearlman EM, Linder SL, Jordan DM, Fisher AC, Hulihan J, et al. Topiramate for migraine prevention in children: a randomized, double-blind, placebo-controlled trial. Headache. 2005;45(10):1304-12.
- Bakola E, Skapinakis P, Tzoufi M, Damigos D, Mavreas V. Anticonvulsant drugs for pediatric migraine prevention: an evidence-based review. Eur J Pain. 2009;13(9):893-901.
- Apostol G, Lewis DW, Laforet GA, Robieson WZ, Fugate JM, Abi-Saab WM, et al. Divalproex sodium extended-release for the prophylaxis of migraine headache in adolescents: results of a stand-alone, long-term open-label safety study. Headache. 2009;49(1):45-53.
- Bidabadi E, Mashouf M. A randomized trial of propranolol versus sodium valproate for the prophylaxis of migraine in pediatric patients. Paediatr Drugs. 2010;12(4):269-75.
- Kroner JW, Hershey AD, Kashikar-Zuck SM, LeCates SL, Allen JR, Slater SK, et al. Cognitive Be-havioral Therapy plus Amitriptyline for Children and Adolescents with Chronic Migraine Reduces Headache Days toKim H, Byun SH, Kim JS, Lim BC, Chae JH, Choi J, et al. Comparison of flunarizine and topiramate for the prophylaxis of pediatric migraines. Eur J Paediatr Neurol. 2013;17(1):45-9.Peer Mohamed B, Goadsby PJ, Prabhakar P. Safety and efficacy of flunarizine in childhood migraine: 11 years' experience, with emphasis on its effect in hemiplegic migraine. Dev Med Child Neurol. 2012;54(3):274-7.Kacperski J, Bazarsky A. New Developments in the Prophylactic Drug Treatment of Pediatric Mi-graine: What Is New in 2017 and Where Does It Leave Us? Curr Pain Headache Rep. 2017;21(8):38.
Evidence tabellen
Kinderen
|
Eerste auteur, jaartal |
Type studie |
Setting |
Patiënten |
Follow-up |
Interventie |
Controle |
Uitkomstmaten |
Resultaten |
Kwaliteit |
|
Barnes, 2015 |
Systematische review met GRADE evaluatie |
Kinderen |
Diverse studies, zowel voor aanvalsbehandeling als profylactische behandeling met diverse interventies en diverse ptn |
|
Betablokkers , flunarizine, pizotifen, topiramate |
Placebo of andere interventie behandeling |
Preventie migraine hoofdpijn |
Niet bekend of betablokkers beter zijn dan placebo, zwak inconsistent bewijs. Niet bekend of flunarizine beter is dan placebo voor duur migraine en frequentie aanvallen, zeer lage kwaliteit bewijs. Geen bewijs voor effect pizotifen als profylaxe. Topiramaat kan nuttig zijn als profylaxe vgl met placebo, beperkt bewijs |
Weinig ptn met weinig events per onderzoeksarm, gedeeltelijk observationeel onderzoek, indirect bewijs, inconsistent bewijs |
|
Bonfert, 2013 |
Systematische review |
|
|
|
|
|
|
|
Oudere systematische review dan Barnes, 2015, met vergelijkbare uitgangsvraag à exclusie |
|
Damen, 2006 |
Systematische review |
|
|
|
|
|
|
|
Oudere systematische review dan Barnes, 2015, met vergelijkbare uitgangsvraag à exclusie |
|
El-Chammas, 2013 |
|
|
|
|
|
|
|
|
Oudere systematische review dan Barnes, 2015, met vergelijkbare uitgangsvraag à exclusie |
|
Victor, 2003 |
Cochrane systematische review met meta-analyses |
Kinderen |
RCT’s met kinderen met episodische migraine en profylaxe indicatie |
|
Hier gerapporteerd: nimpdipine, papaverine, trazodone, L-5-hydroxytryptofaan, clonidine, metoclopramide, domperidon |
Placebo |
Hier gerapporteerd: aantal aanvallen |
Geen sign verschillen in aantal aanvallen tussen placebo en nimodipine, papaverine, trazodone, L-5-hydroxytriptofaan, clonidine, metoclopramide, en domperidon |
Oudere studie dan Barnes, 2015, geen rapportage resultaten zelfde ptn en interventies. Wel rapportage overige interventies. Goed opgezette systematische review, forse risk of bias in geïncludeerde studies, vanwege randomisatie en blindering. Oude studies (1974-1993), mogelijk ander ‘soort’ ptn, weinig ptn per arm (zeer grote imprecision) |
|
Powers, 2016 |
Dubbelblinde placebogeonctroleerde RCT |
Kinderen, VS |
361 kinderen met migraine, gem lft 14,2 (sd 2,4), 68% meisjes |
24 wkn |
Amitriptyline 1 mg/kg |
Topiramaat 2 mg/kg Placebo |
Reductie 50% afname aantal hoofdpijndagen, hinder van hoofdpijn, reductie aantal hoofdpijndagen, adverse events |
Geen verschil in ≥50% reductie hoofdpijnaanvallen, hoofdpijndagen en kwaliteit van leven tussen de drie groepen. |
Veel uitval, weinig patiënten in placebo-arm |
Afkortingen: gem: gemiddelde; kg: kilogram; lft: leeftijd; mg: milligram; ptn: patiënten, RCT: randomized controlled trial, sd: standaarddeviatie; sign: significant, vgl: vergelijking; VS: Verenigde Staten
Volwassenen
|
Eerste auteur, jaartal |
Type studie |
Setting |
Patiënten |
Follow-up |
Interventie |
Controle |
Uitkomstmaten |
Resultaten |
Kwaliteit |
|
Adelman, 2008 |
Post hoc analyse 4 RCT’s |
Multicenter, wereldwijd |
1.580 ptn, gem lft 40,1 (sd 11,5), 85% vrouw |
Mediaan: 141-176 dgn |
Topiramaat 50mg, 100 mg, of 200mg/dag |
Placebo |
Veiligheid |
Geen uitkomsten van belang voor deze uitgangsvraag |
Auteurs vanuit fabrikant, post hoc analyse (mogelijk selectief) Geen studie over effectiviteit profylaxe à exclusie |
|
Huang, 2013 |
Systematische review met meta-analyse |
|
8 RCT’s, 905 ptn acute ernstige migraine |
24-72 uur |
Steroids (dexamethason 10-24 mg, oraal, i.v.) |
Placebo |
Relapse matige/ ernstige hoofdpijn 24-72 uur na behandeling |
Geen uitkomsten van belang voor deze uitgangsvraag |
Geen studie over profylaxe à exclusie |
|
Jackson, 2015 |
Systematische review met meta-analyse |
|
179 RCT’s met migraine ptn met profylaxe behandeling |
4-82 wkn |
ACE-remmers, alpha blokkers, angiotensine receptor blocker, anticonvulsive, betablokker, calciumkanaalblokker, flunarizine, pizotifen, tricyclische antidepressiva, SSRI/SNRI |
Placebo of directe vergelijking |
Aantal aanvallen/ mnd, >50% verbetering |
Vgl met placebo Episodische migraine (< 15 aanvallen/mnd) Aantal aanvallen/mnd: Alfablokkers: geen sign verschil; Aceremmers: bij 4 en 8 wkn gebruik enalapril geen sign verschl; bij 12 wkn lisinopril: MD: -1,4 (95%BI: -2,6 tot -0,2); 16 wkn captopril: MD: -0,86 (95%BI: -1,5 tot -0,21); Angiotensine receptor blokkers: geen sign verschil; Anticonvulsiva: geen sign verschil met acetazolamide, carbamazipine, carisbamate, clonazepam, gabapentin, oxcarbazepine en vigabatrin. Lamotrigine: verschil bij 4 wkn gebruik (MD: -1,2; 95%BI: -2,2 tot -0,18), maar geen sign verschil bij 12 wkn gebruik. Levetiracetam: MD -2,7 (95%BI: -4,4 tot -0,97). Topiramaat: sign verschillen bij alle doseringen en alle onderzoeksduren, bijv. 24 weken: MD: -1,1 (95%BI: -1,4 tot -0,77); Betablokkers: geen sign verschil met acebutolol, alprenonol, oxprenolol, en pindolol. Atenolol: MD: -2,2 (95%BI: -3,7 tot -0,37). Bispolol: geen sign verschil bij 4 wkn, bij 8 wkn: MD: -0,61 (95%BI: -1,1 tot -0,16). Metoprolol: MD: -0,94 (95% BI: -1,4 tot -0,46). Propranolol: sign verschillen bij alle onderzoeksduren, bijv. 20 wkn: MD: -1,0 (95%BI: -1,7 tot -0,37). Tomolol: geen sign verschil bij 8 wkn, bij 12 wkn: MD: -1,7 (95% BI: -2,7 tot -0,7); Calciumkanaalblokkers: geen sign verschillen; Flunarizine: geen sign verschil bij onderzoeksduren 4, 8 en 20 wkn. Bij 12 wkn: MD: -1,1 (95%BI: -1,6 tot -0,67), 16 wkn: MD: -1,2 (95%BI: -2,0 tot -0,38); SSRI: geen sign verschillen; SNRI: geen sign verschil; Pizotifen: sign verschillen bij alle onderzoeksduren, bijv. 12 wkn: MD: -0,43 (95%BI: -0,66 tot -0,21); TCA: amitriptyline: 24 wkn: MD: -1,29 (95%BI: -1,79 tot -0,46); clomipramine: MD: -0,46 (95%BI: -0,74 tot -0,18); opipramol: sign verschillen bij 4 en 12 wkn, 12 wkn: MD: -1,3 (95%BI: -2,5 tot -0,12). Geen sign verschil doxepine; >50% verbetering: geen sign verschillen met ACE remmers, angiotensine receptor blokkers, calciumkanaalblokkers en tetracyclische middelen. Anticonvulsiva: geen sign verschil met acetazolamide, carisbamate, lamotrigeine, levetiracetam, oxcarbazepine; topiramate: sign verschillen bij alle onderzoeksduren, bijv. 26 wkn: RR: 1,8 (95%BI: 1,5-2,2); Betablokkers: sign verschillen propranolol bij alle onderzoeksduren, bijv. 26 wkn: RR: 2,0 (95%BI: 1,4-2,9); timolol, bijv. 12 wkn: RR: 1,9 (95%BI: 1,4-2,5), geen sign verschil met metoprolol. TCA: wel sign verschil bij 4 wkn (RR: 1,7; 95%BI: 1,2-2,6), geen sign verschillen bij 8, 12 en 26 wkn. Directe vgl Geen sign verschillen aangetoond (div vgl) |
Goed opgezette systematische review met meta-analyses, geïncludeerde studies van wisselende kwaliteit (laag tot matig), vanwege problemen met randomisatie, blindering, incomplete outcome data, selectieve rapportage, sponsoring door fabrikant, geen intention-to-treat analyse; omrekenen in absolute data bij RR’s niet mogelijk vanwege gebrek aan gegevens |
|
Linde, 2004 |
Cochrane systematische review met meta-analyses |
|
58 RCT’s met 5072 ptn |
|
Propranolol |
Placebo of andere medicatie |
Aanvallen, hoofdpijndagen, pijnintensiteit, hoofdpijn index, globale respons |
Zelfde uitkomstmaten als Jackson, 2015. Oudere studie dan Jackson, 2015. Daarom resultaten hier niet gerapporteerd, vanwege duplicatie |
Goed opgezette systematische review, wel forse risk of bias in de geïncludeerde studies (problemen met randomisatie, blindering, geen intention-to-treat analyses) |
|
Linde, 2013 |
Cochrane systematische review met meta-analyses |
|
6 RCT’s met 1009 ptn met migraine en profylaxe |
|
Gabapentine |
Placebo |
Frequentie hoofdpijn, >50% reductie, kwaliteit van leven, adverse events |
Zelfde uitkomstmaten als Jackson, 2015. Oudere studie dan Jackson, 2015. Daarom resultaten hier niet gerapporteerd, vanwege duplicatie |
Goed opgezette systematische review, forse risk of bias in geïnclueerde studies, vanwege problemen met randomisatie, blindering, en forse dropout |
|
Linde, 2013 |
Cochrane systematische review met meta-analyses |
|
17 RCT’s met 3543 ptn met migraine en profylaxe |
|
Topiramaat |
Placebo, of andere medicatie, of topiramaat in versch doseringen |
Frequentie hoofdpijn, >50% reductie, kwaliteit van leven, adverse events |
Topiramaat (alle doseringen) vs placebo: afname aanvallen per maand: -1,20 (95%BI: -1,59 tot -0,80). ≥50% reductie hoofdpijnaanvallen: RR: 2,02 (95%BI: 1,57-2,60); NNT: 4 Dosisvergelijking: afname aanvallen per maand: 100 mg vs 50 mg: -0,71 (95%BI: -1,32 tot -0,10); 200 mg vs 50 mg: -0,96 (95%BI: -1,53 tot -0,40); 200 mg vs 100 mg: 0,03 (95%BI: -0,55 tot 0,61); ≥50% reductie hoofdpijnaanvallen: 100 mg vs 50 mg: OR: 1,80 (95%BI: 1,25-2,60); 200 mg vs 50 mg: OR: 1,66 (95%BI: 1,15-2,41); 200 mg vs 100 mg: OR: 0,93 (95%BI: 0,69-1,24) |
Goed opgezette systematische review, met risk of bias in geïncludeerde studies vanwege problemen met randomisatie, blindering, incomplete data, selectieve rapportage |
|
Linde, 2013 |
Cochrane systematische review met meta-analyses |
|
10 RCT’s met 848 ptn met migraine en profylaxe |
|
Valproate |
Placebo, of topiramaat, of valproate in andere dosering |
Frequentie hoofdpijn, >50% reductie, kwaliteit van leven, adverse events |
Divalproex sodium vs placebo: ≥50% reductie hoofdpijnaanvallen: RR: 2,18 (95%BI: 1,28-3,72); NNT: 5; Sodium valproaat vs placebo: afname aantal hoofdpijndagen per maand: -4,31 (95%BI: -8,32 tot -0,30); ≥50% reductie hoofdpijnaanvallen: RR: 2,83 (95%BI: 1,27-6,31) |
Goed opgezette systematische review, maar risk of bias, vanwege problemen met randomisatie, blindering en incomplete outcome data, imprecision in resultaten |
|
Pringsheim, 2010 |
Review |
|
|
|
|
|
|
|
Auteurs geven aan dat het een systematische review betreft. Echter, geen transparante beschrijving methodiek t.a.v. kwaliteit en inclusie onderzoeken, geen meta-analyse. Bovendien oudere studie met zelfde interventies als Jackson, 2015 à exclusie |
|
Shamlyan, 2013 |
Systematische review met meta-analyses |
|
125 RCT’s en 76 niet gerandomiseerde studies |
|
Anti-epileptica, betablokkers, ACE-remmers, angiotensine II blokkers, calciumkanaalblokkres |
Placebo |
>50% reductie aanvallen of behandelingssucces |
Zelfde uitkomstmaten als Jackson, 2015. Oudere studie dan Jackson, 2015. Daarom resultaten hier niet gerapporteerd, vanwege duplicatie |
Redelijk opgezette systematische review, forse risk of bias in geïncludeerde studies, vanwege problemen met randomisatie |
|
Tomkins, 2001 |
Systematische review met meta-analyses |
|
38 RCT’s, ptn met chronische hoofdpijn |
4-27 wkn |
Antidepressiva |
Placebo |
Globale verbetering, hoofdpijn last |
Geen onderscheid in typen chronische hoofdpijn; resultaten voor alleen migraine dus niet gerapporteerd |
Migraine ptn niet separaat geanalyseerd, daarnaast forse risk of bias in opzet systematische review, en in onderliggende studies à exclusie |
Afkortingen: 95%BI: 95% betrouwbaarheidsinterval, ACE: angiotensine converting enzyme, bijv: bijvoorbeeld, dgn: dagen, div: diverse, gem: gemiddelde, i.v.: intraveneus, jr: jaar, lft: leeftijd, MD: mean difference = gemiddeld verschil, mg: milligram, mnd: maand, ptn: patiënten, RCT: randomized controlled trial, RR: relatief risico, sd: standaarddeviatie, sign: significant, SNRI: serotonine en noradrenalineheropnameremmer, SSRI: selectieve serotonine heropnameremmer, TCA: tricyclische antidepressiva, vgl: vergelijking, wkn: weken
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 11-01-2018
Beoordeeld op geldigheid : 17-12-2017
Jaarlijks wordt door de commissie richtlijnen van de Nederlandse Vereniging voor Neurologie bepaald of actualisatie van de richtlijn nodig is. Indien dit wenselijk wordt geacht, dan spant de Nederlandse Vereniging voor Neurologie zich ervoor in de herziening te realiseren (bijvoorbeeld in organisatie en door hiervoor de financiële middelen te vergaren). Een eventuele herziening kan ook modulair, dus per module/uitgangsvraag, plaatsvinden.
Algemene gegevens
Deze richtlijnontwikkeling werd ondersteund door de Nederlandse Vereniging voor Neurologie en PROVA en gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van deze richtlijn is de kwaliteit van zorg en patiëntveiligheid van patiënten met migraine en/of medicatieovergebruikshoofdpijn te waarborgen en waar mogelijk te verbeteren. In deze richtlijn worden aanbevelingen geformuleerd die professionals in de zorg hiertoe de handvaten geven.
Doelgroep
De primaire doelgroep van deze richtlijn zijn neurologen, kinderneurologen en kinderartsen. Ook anderen kunnen hun voordeel doen met deze richtlijn.
Samenstelling werkgroep
- Mw. dr. Gisela Terwindt, neuroloog, Leids Universitair Medisch Centrum, Leiden, namens Nederlandse Vereniging voor Neurologie, voorzitter
- Dhr. dr. Wim Mulleners, neuroloog, Canisius-Wilhelmina Ziekenhuis, Nijmegen, namens Nederlandse Vereniging voor Neurologie, voorzitter
- Mw. drs. Mariska Tuut, epidemioloog / richtlijnmethodoloog, PROVA, Varsseveld, secretaris
- Dhr. dr. Peter van den Berg, neuroloog, Isala Klinieken, Zwolle, namens Nederlandse Vereniging voor Neurologie
- Dhr. dr. Hans Carpay, neuroloog, Ziekenhuis Tergooi, Hilversum en Blaricum, namens Nederlandse Vereniging voor Neurologie
- Dhr. drs. Emile Couturier, neuroloog, Medisch Centrum Boerhaave, Amsterdam, namens Nederlandse Vereniging voor Neurologie
- Dhr. dr. Frans Dekker, huisarts, Huisartsenpraktijk Molentocht, Purmerend, namens Nederlands Huisartsen Genootschap
- Dhr. dr. Joost Haan, neuroloog, Alrijne Ziekenhuis, Leiderdorp / Leids Universitair Medisch Centrum, Leiden, namens Nederlandse Vereniging voor Neurologie
- Dhr. drs. Hille Koppen, neuroloog, Hagaziekenhuis, Den Haag, namens Nederlandse Vereniging voor Neurologie
- Mw. dr. Jikke-Mien Niermeijer, kinderneuroloog, Elisabeth-Tweesteden Ziekenhuis, Tilburg, namens Nederlandse Vereniging voor Kinderneurologie
- Mw. Judith Pijpers, MSc., arts-onderzoeker, Leids Universitair Medisch Centrum, Leiden
- Dhr. dr. Guus Schoonman, neuroloog, Elisabeth-Tweesteden Ziekenhuis, Tilburg, namens Nederlandse Vereniging voor Neurologie
- Mw. dr. Natalie Wiendels, neuroloog, Medisch Centrum Slotervaart, Amsterdam, namens Nederlandse Vereniging voor Neurologie
Toehoorder
Mw. Jos Geijer, bureau Stichting Kwaliteitsgelden Medisch Specialisten, Utrecht
Belangenverklaringen
|
Naam |
Namens |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie-management |
Extern gefinancierd onderzoek |
Kennis-valorisatie |
Overige belangen |
|
Wim Mulleners |
NVN |
Klinisch neuroloog |
Chief Medical Information Officer, bestuurslid NHV, lid-beroepsgenoot regionaal tuchtcollege, beroepsbelangencommissie neurologie, raad beroepsbelangen |
Geen |
Geen |
Beroepsbelangencommissie neurologie, raad beroepsbelangen |
Industry sponsored geneesmiddelenonderzoek MS |
Geen |
Geen |
|
Gisela Terwindt |
NVN |
Staflid neurologie LUMC |
Vice-voorzitter WAR Hersenstichting (onbetaald), commissielid klinische fellowships/TOP subsidies NWO/ZonMW (onbetaald/betaald), bestuurslid NHV en voorzitter WAR Nederlandse Hoofdpijn Vereniging (onbetaald), WAR Orphanet Nederland (onbetaald), Board of trustees International Headache Society (onbetaald), Member of Classification Committee International Headache Classification (onbetaald) |
Geen |
Geen |
Adviserend bij Nederlandse Hoofdpijn Patiëntenvereniging, bij HCHWA-D patiëntenvereniging, bij ontwikkelen kwaliteitsindicatoren hoofdpijnzorg |
Financiering voor deelprojecten vanuit NWO/ ZonMW, Nederlandse hartstichting, Hersenstichting, Europese subsidie (FP7) |
Momenteel bezig met onafhankelijke trial (in kader van VIDI project) naar het effect van Botox op afkicken van medicatie-overgebruik bij chronische migraine. Financiering vanuit ZonMw en Hersenstichting, die geen inspraak/invloed hebben op trial. Geen co-financiering vanuit farmacie voor deze studie. In 1996 patent op FHM1=CACNA1a gen aangevraagd |
In het LUMC gaan we op korte termijn nieuwe trials doen naar de effectiviteit van CRGP-antibodies. Ook loopt er een trial naar n. occipitalis stimulatie bij clusterhoofdpijn (ICON studie). Er worden regelmatig trials opgestart in samenwerking met neurostimulatiebedrijven, cq. farmaceutische industrie. Prof. Ferrari is hier eerste aanspreekpunt voor, maar het betreft dus wel onderzoek in onze Leidse hoofdpijn onderzoeksgroep. Op DIT moment loopt er alleen CHARM studie (onafhankelijk onderzoek naar effect Botox bij afkicken medicatie bij chronische migraine, PI Terwindt) en ICON studie (n.occipitalis stimulatie bij clusterhoofdpijn (PI Ferrari). Na de zomervakantie zal naar verwachting CGRP studie bij migraine starten in samenwerking met farmacie (PI Ferrari) |
|
Mariska Tuut |
PROVA |
Eigenaar PROVA |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Hans Carpay |
NVN |
Neuroloog/maat MSB Gooi en Eemland (in Tergooi Ziekenhuis) |
Lid RVT Epilepsiefonds (onbetaald), onderzoeker neurologie LUMC (0,1 FTE, betaald) |
Geen |
Geen |
Lid redactie Hoofdzaken (blad NVVHP), vice-voorziter stafbestuur Tergooi |
n.v.t. |
n.v.t. |
geen |
|
Emile Couturier |
NVN |
Klinisch neuroloog, Medisch Centrum Boerhaave |
Onbetaalde bestuurlijke functies: Nederlandse Hoofdpijn Vereniging, Anglo Dutch Migraine Association, Vereniging Nederlandse Hoofdpijn Centra |
Geen |
Geen |
Geen |
CINTHA-trial, deels gefinancierd door Innovatiefonds zorgverzekeraars |
Geen |
Geen |
|
Joost Haan |
NVN |
Neuroloog, vakgroeplid Alrijne ziekenhuis Leiderdorp; part-time wetenschappelijke aanstelling LUMC Leiden |
geen |
geen |
geen |
geen |
Begeleider van onderzoekster (I de Coo) bij het ICON onderzoek (occipitale stimulatie bij cluster hoofdpijn) in het LUMC |
geen |
geen |
|
Guus Schoonman |
NVN |
Neuroloog ETZ Tilburg |
Onbetaald: Secretaris en medeoprichter werkgroep acute neurologie NVN, co-organisatie NHV jaarvergadering november 2015 Tilburg, lid redactieraad E-learning acute neurologie voor aios neurologie, co-organisatie hoofdpijn IN-zicht: jaarlijks landelijk aios hoofdpijnonderwijs (LUMC), onderzoeker LUMC Leiden en ETZ Tilburg, lid 'education subcommittee' international headache society (tussen 2010-2015 voorzitter) |
Geen |
Geen |
Geen |
Principal investigator center-TBI: europees neurotrauma onderzoek. Geen relatie met hoofdpijn |
Geen |
Geen |
|
Peter van den Berg |
NVN |
Neuroloog |
Geen |
Geen |
Geen |
Geen |
Geen |
2014: praktisch neurologisch onderzoek video voor MSD gemaakt - dienstverlening consultancy; 2014: geaccrediteerde nascholing migraine en hoofdpijn voor huisartsen - MSD - dienstverlening spreker; 2012: geaccrediteerde nascholing migraine en hoofdpijn voor huisartsen - MSD - dienstverlening spreker |
|
|
Natalie Wiendels |
NVN |
Neuroloog, chef de clinique op afdeling kinische neurofysiologie |
Redactie Nervus, nascholing neurologie, uitgeverij Prelum Houten, betaald |
Geen |
Geen |
Geen |
Geen |
||
|
Hille Koppen |
NVN |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
||
|
Frans Dekker |
NHG* |
Huisarts te Purmerend |
Onderzoeker LUMC afdeling public health en eerstelijnsgeneeskunde; voorzitter commissie wetenschappelijk onderzoek Nederlands Huisartsen Genootschap |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Zwany Metting |
Kinderneurologie |
Neuroloog/kinderneuroloog |
geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Judith Pijpers |
VAAN |
Arts onderzoeker |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Jikke-Mien Niermeijer |
NVKN |
Kinderneuroloog ETZ Tilburg |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Methode ontwikkeling
Evidence based
Implementatie
Gedurende het hele proces van richtlijnontwikkeling is rekening gehouden met implementatie van de richtlijn in de praktijk, bijvoorbeeld bij de samenstelling van de werkgroep, de brede knelpunteninventarisatie en de uitge-breide commentaarronde.
Na autorisatie van de richtlijn wordt deze ten minste op de website van de Nederlandse Vereniging voor Neurologie gepubliceerd. Ook andere deelnemende partijen zijn vrij de richtlijn op hun website te publiceren. De richtlijn wordt ter publicatie aangeboden aan www.richtlijnendatabase.nl. Daarnaast wordt getracht samenvattingen van de richtlijn in Nederlandse tijdschriften te publiceren, om zo de implementatie van de richtlijn te bevorderen.
Werkwijze
Totstandkoming werkgroep
Voor de ontwikkeling van deze richtlijn is een werkgroep geformeerd, onder voorzitterschap van mw. dr. Gisela Terwindt, neuroloog, en dhr. dr. Wim Mulleners, neuroloog. In de werkgroep hadden gemandateerde vertegenwoordigers van de Nederlandse Vereniging voor Neurologie, de Vereniging Arts-Assistenten in opleiding tot Neuroloog, de Nederlandse Vereniging voor Kinderneurologie en het Nederlands Huisartsen Genootschap zitting. De werkgroep wordt procedureel en methodologisch ondersteund door PROVA en logistiek door het bureau van de Nederlandse Vereniging voor Neurologie. De ontwikkeling van deze richtlijn wordt gefinancierd vanuit een projectbudget door de Stichting Kwaliteitsgelden Medisch Specialisten. Als toehoorder was een bureaumedewerker van deze Stichting bij de vergaderingen van de werkgroep aanwezig.
Knelpuntenanalyse
De richtlijnwerkgroep heeft in de eerste werkgroepvergadering knelpunten in de zorg voor patiënten met migraine en medicatieovergebruikshoofdpijn geïdentificeerd. In een invitational conference zijn deze knelpunten ten commentaar en aanvulling voorgelegd aan de volgende stakeholders:
- Bijwerkingencentrum Lareb
- Nederlands Huisartsen Genootschap
- Nederlandse Vereniging van Hoofdpijn Patiënten
- Nederlandse Vereniging voor Kindergeneeskunde
- Nederlandse Vereniging voor Kinderneurologie
De richtlijnwerkgroep heeft de input vanuit deze invitational conference geanalyseerd en in de tweede werkgroepvergadering de knelpunten en uitgangsvragen vastgesteld.
Methode richtlijnontwikkeling
Om de uitgangsvragen te beantwoorden is op systematische wijze per uitgangsvraag de evidence beoordeeld (zie hiervoor de inhoudelijke modules). Hierbij is gebruik gemaakt van de GRADE methodiek. Voor achtergrondinformatie hierover wordt verwezen naar de Nederlandse handleiding voor het gebruik van GRADE.(14) De evidence is samengevat door de epidemioloog in de werkgroep, met inhoudelijke input en feedback van de inhoudelijk experts in de werkgroep. Per uitgangsvraag was hiervoor een aantal ‘ambassadeurs’ aangewezen. De praktische overwegen en conceptaanbevelingen zijn voorbereid door deze ‘ambassadeurs’ per uitgangsvraag. De aanbevelingen, en de gehele conceptrichtlijn, is plenair door de werkgroep vastgesteld.
Procedure voor commentaar en autorisatie
De conceptrichtlijn is ter commentaar aangeboden aan alle leden van de Nederlandse Vereniging voor Neurologie en de overige verenigingen die bij de ontwikkeling van de richtlijn betrokken zijn. Daarnaast is de conceptrichtlijn ter commentaar verstuurd aan alle partijen die bij de knelpunteninventarisatie om input gevraagd zijn. Het binnengekomen commentaar is door de werkgroep beoordeeld en verwerkt in de richtlijn. Daarbij is beargumenteerd welke commentaren wel en welke niet zijn opgenomen.
Daarna is de richtlijn ter autorisatie voorgelegd aan de partijen die in de werkgroep vertegenwoordigd zijn. De richtlijn is geautoriseerd door de Nederlandse Vereniging voor Neurologie, de Nederlandse Vereniging voor Kinderneurologie en de Nederlandse Vereniging voor Kindergeneeskunde.
Zoekverantwoording
|
|
Naam file |
Aantal hits uit literatuursearch |
Geselecteerd |
|
Uitgangsvraag contra-indicaties aanvalsbehandeling migraine |
med20151027 vraag1 pregnancy |
27 |
Cardiovasculair: 1o Zwangerschap: 8 Kinderen: 18 |
|
med20151027 vraag1 cardiovascular |
62 |
||
|
med20151027 vraag1 child |
147 |
||
|
Aanvulling 4-4-2016 |
22 |
||
|
Uitgangsvraag timing aanvalsbehandeling migraine |
med20151027 vraag2 early treatment |
34 |
Allodynie: 5 Moment inname: 2 Aura: 4 Triptanen & andere medicatie: 1 |
|
med20151027 vraag2 early treatment child |
7 |
||
|
Uitgangsvraag opbouwschema’s preventieve behandeling migraine |
med20151102vraag3 systrev |
8 |
15 |
|
med20151102vraag3 alle systrev |
119 |
||
|
med20151102vraag3 rct vanaf 2005 |
86 |
||
|
Uitgangsvraag geslachtshormonen en migraine |
med20160420 migraine menopause etc systrev |
11 |
22 |
|
med20160420 migraine menopause etc observat |
24 |
||
|
med20160420 migraine anticonceptives systrev |
26 |
||
|
med20160420 migraine anticonceptives trials observat |
162 |
||
|
med20160420 migraine middelen hormonen extra |
6 |
||
|
med20160420 hormonal prophylaxe systrev |
18 |
||
|
med20160420 hormonal prophylaxe trials observat |
180 |
||
|
Uitgangsvraag medicatieovergebruikshoofdpijn |
med20151102 vraag5 |
212 |
20 |
|
Uitgangsvraag doelmatige organisatie van zorg |
med20151102 vraag 6 |
45 |
7 |
Literatuursearch 27 oktober 2015 en 20 november 2015
Medline zoekstrategie
Database: Ovid MEDLINE(R) In-Process & Other Non-Indexed Citations, Ovid MEDLINE(R) Daily, Ovid MEDLINE(R) and Ovid OLDMEDLINE(R) <1946 to Present>
Search Strategy:
1 "hoofdpijn NVN".ti. (0)
2 "38".fc_vol. and "sumatriptan".fc_titl. and "1998".fc_pubyr. and "184".fc_pg. (1)
3 "22".fc_vol. and "zolmitriptan".fc_titl. and "2002".fc_pubyr. and "101".fc_pg. (1)
4 exp Migraine Disorders/ (23148)
5 migraine.tw. (26287)
6 migraine.kf. (2496)
7 or/4-6 (31127)
8 "concept P".ti. (1)
9 (dutch or english or german or french).la. (22512576)
10 7 and 9 (28242)
11 limit 10 to yr="2000 -Current" (17229)
12 triptan*.ti. (489)
13 10 and 12 (403)
14 limit 13 to medline (379)
15 from 14 keep 3 (1)
16 from 13 keep 2 (1)
17 Tryptamines/ (4723)
18 Sumatriptan/ (2120)
19 zolmitriptan.ti. (221)
20 zolmitriptan.rn. (373)
21 zolmitriptan.kf. (9)
22 zolmitriptan.tw. (461)
23 rizatriptan.rn,kf. (315)
24 naratriptan.rn,kf. (174)
25 almotriptan.rn,kf. (169)
26 exp Serotonin Receptor Agonists/ (83414)
27 eletriptan.rn,kf. (150)
28 frovatriptan.rn,kf. (113)
29 ergotamin*.rn,kf. (2396)
30 Ergotamine/ (2128)
31 naproxen.rn,kf. (3619)
32 Naproxen/ (3561)
33 or/17-32 (89636)
34 11 and 33 (2234)
35 ae.fs. (1467182)
36 ct.fs. (18056)
37 to.fs. (352660)
38 (adverse adj3 (effect? or event?)).tw. (230456)
39 contra?indicat*.tw. (36052)
40 contraindicat*.tw. (36047)
41 toxic*.tw. (473757)
42 (adverse adj3 (effect? or event?)).kf. (2656)
43 contra?indicat*.kf. (561)
44 contraindicat*.kf. (561)
45 toxic*.kf. (42089)
46 or/35-45 (2244665)
47 34 and 46 (918)
48 Abnormalities, Drug-Induced/ (14356)
49 pregnancy complications/ or abortion, spontaneous/ or fetal death/ (109904)
50 congenital abnormalities/ or abnormalities, drug-induced/ or exp abnormalities, severe teratoid/ (50944)
51 exp Pregnancy/de [Drug Effects] (11881)
52 Stillbirth/ (2580)
53 (pregnancy or congenital or abnormalities or teratoid or stillbirth).kf. (89427)
54 or/48-53 (233259)
55 47 and 54 (24)
56 46 or 54 (2443568)
57 34 and 56 (920)
58 "55".fc_vol. and "pregnancy outcome".fc_titl. and "2015".fc_pubyr. and "490".fc_pg. (1)
59 "50".fc_vol. and "triptan exposure".fc_titl. and "2010".fc_pubyr. and "563".fc_pg. (1)
60 "28".fc_vol. and "triptan safety".fc_titl. and "2013".fc_pubyr. and "759".fc_pg. (1)
61 "54".fc_vol. and "sumatriptan".fc_titl. and "2014".fc_pubyr. and "1158".fc_pg. (1)
62 or/58-61 (4)
63 55 and 62 (3)
64 62 not 63 (1)
65 malformations.kf. (647)
66 53 or 65 (89907)
67 54 or 65 (233724)
68 47 and 67 (24)
69 triptan?.kf. (64)
70 69 or 33 (89662)
71 11 and 70 and 67 (27) med20151027 vraag1 pregnancy
72 exp Stroke/ (97229)
73 (cardiovascular adj3 event?).ti. (3998)
74 exp Myocardial Ischemia/ (378020)
75 (cardiovascular adj3 event?).kf,tw. (26600)
76 (myocard* adj3 infarct*).tw,kf. (163286)
77 (angina adj3 pectoris).tw,kf. (18894)
78 (cardiovascular adj3 ischem*).tw,kf. (1208)
79 stroke.kf,tw. (167895)
80 or/72-79 (606877)
81 11 and 70 and 80 and 46 (62) med20151027 vraag1 cardiovascular
82 11 and 70 and 46 (922)
83 (child??? or childhood or infant* or p?ediatr* or perinat* or neonat* or newborn* or infan* or boy? or girl? or kid? or schoolage* or juvenil* or adolescen* or toddler?).tw. (1857903)
84 exp Child/ (1640456)
85 exp infant/ (994388)
86 "Adolescent"/ (1719747)
87 or/83-86 (3565125)
88 82 and 87 (198)
89 (child??? or childhood or p?ediatr* or boy? or girl? or kid? or schoolage* or juvenil* or adolescen*).tw. (1408203)
90 84 or 86 or 89 (2995976)
91 11 and 70 and 46 and 90 (185)
92 exp Case Reports/ (1787491)
93 case report?.tw,kf. (295393)
94 92 or 93 (1856855)
95 91 not 94 (175)
96 exp *Migraine Disorders/ (18891)
97 migraine.ti. (16430)
98 migraine.kf. (2496)
99 96 or 97 or 98 (20793)
100 95 and 99 (153) med20151027 vraag1 child
101 from 81 keep 1-62 (62)
102 from 100 keep 1-153 (153)
103 early treatment.mp. (14292)
104 "32".fc_vol. and "early dosing".fc_titl. and "2012".fc_pubyr. and "226".fc_pg. (1)
105 ad.fs. (1195764)
106 (early adj3 (adminis* or dos*)).tw. (7027)
107 105 or 106 (1200602)
108 11 and 70 and 107 (631)
109 exp Drug Administration Schedule/ (91763)
110 105 or 106 or 109 (1221559)
111 11 and 70 and 110 (653)
112 111 and 90 (151)
113 attack?.tw,kf. (96831)
114 111 and 113 (306)
115 106 and 114 (22)
116 early.tw,kf. (1158818)
117 111 and 116 (104)
118 early.ti,kf. (236359)
119 117 and 118 (34) med20151027 vraag2 early treatment
120 90 and 111 and 116 (27)
121 120 not 119 (20)
122 (early adj3 (treat* or dos* or administrat*)).tw,kf. (62860)
123 117 and 122 and 90 (12)
124 123 not 119 (7) med20151027 vraag2 early treatment child
125 from 124 keep 1-7 (7)
126 exp Migraine Disorders/pc (1984)
127 exp *Migraine Disorders/pc (1298)
128 ad.fs. (1196648)
129 127 and 128 (236)
130 prophyla*.kf. (1739)
131 Drug Therapy, Combination/ (147580)
132 (drug adj3 therap* adj3 combinat*).tw. (1497)
133 (drug adj3 therap* adj3 combinat*).kf. (42)
134 (polytherap* adj3 drug).tw. (74)
135 (polytherap* adj3 drug).kf. (2)
136 add?on.tw. (14)
137 "add on".tw. (5595)
138 or/131-137 (152757)=drug combination
139 adrenergic beta-antagonists/ or alprenolol/ or metipranolol/ or nadolol/ or oxprenolol/ or pindolol/ or propranolol/ (66235)
140 (beta adj3 blocker?).kf. (470)
141 ((adrenergic adj3 beta-antagonist?) or (alprenolol or metipranolol or nadolol or oxprenolol or pindolol or propranolol)).tw. (34796)
142 ((adrenergic adj3 beta-antagonist?) or (alprenolol or metipranolol or nadolol or oxprenolol or pindolol or propranolol)).kf. (323)
143 (metoprolol or atenolol or timolol or acebutolol).tw. (16194)
144 (metoprolol or atenolol or timolol or acebutolol).kf. (282)
145 or/139-144 (85947)
146 anticonvulsants/ or valproic acid/ (50676)
147 gamma-Aminobutyric Acid/ (35012)
148 "linde$".fc_auts. and "topiramate for the prophylaxis".fc_titl. (1)
149 (Anticonvulsants or topiramate or Fructose).rn. (57225)
150 tu.fs. (1921129)
151 126 and 128 and 150 (180)
152 prophyla*.tw. (132039)
153 11 and (130 or 152) (1429)
154 126 or 153 (2895)
155 138 or 150 (1968626)
156 154 and 155 (1671)
157 (drug adj3 dos*).tw. (20998)
158 (drug adj3 dos*).kf. (48)
159 Drug Administration Schedule/ (90264)
160 (drug adj3 administr* adj3 schedul*).tw. (301)
161 (drug adj3 administr* adj3 schedul*).kf. (21)
162 ad.fs. (1196648)
163 or/157-162 (1230792)
164 154 and 155 and 163 (265)=P +pc + tu +ad
165 164 and 9 (244)
166 limit 165 to yr="2000 -Current" (157) P +pc + tu +ad + talen vanaf 2000
167 "sensitief filter voor RCT's van Cochrane".ti. (0)
168 randomized controlled trial.pt. (415159)
169 controlled clinical trial.pt. (91997)
170 (randomized or randomised).ab. (404327)
171 placebo.ab. (169196)
172 drug therapy.fs. (1851501)
173 randomly.ab. (243059)
174 trial.ab. (350969)
175 groups.ab. (1513850)
176 or/168-175 (3698744)
177 176 not (exp animals/ not humans/) (3183016)=rct
178 "filter rct cochrane sensitief".ti. (0)
179 "filter systematic reviews".ti. (0)
180 meta analysis.pt. (61474)
181 (meta-anal$ or metaanal$).af. (108411)
182 (quantitativ$ adj10 (review$ or overview$)).tw. (5480)
183 (systematic$ adj10 (review$ or overview$)).tw. (83495)
184 (methodologic$ adj10 (review$ or overview$)).tw. (7306)
185 medline.tw. and review.pt. (49885)
186 (pooled adj3 analy*).tw. (10532)
187 or/180-186 (194801)
188 "filter systematic reviews".ti. (0)
189 "cochrane$".fc_jour. (12007)
190 187 or 189 (196124)=systrev
191 166 and 190 (8) med20151102vraag3 systrev
192 166 and 177 (134)= med20151102vraag3 rct vanaf 2005
193 148 (1)
194 154 and 190 and 9 (141)
195 194 (141)
196 limit 195 to yr="2000 -Current" (133) med20151102vraag3 alle systrev
197 192 not 196 (126)
198 197 (126)
199 limit 198 to yr="2005 -Current" (88)
200 from 199 keep 1-88 (88)
201 "pijpers$".fc_auts. and "detoxification in medication*".fc_titl. and "2015".fc_pubyr. (0)
202 "discontinuation of medicat*".fc_titl. and "2006".fc_pubyr. and "1192".fc_pg. (1)
203 "advice alone ".fc_titl. and "2006".fc_pubyr. and "1097".fc_pg. (1)
204 "onabotulin*".fc_titl. and "2010".fc_pubyr. and "921".fc_pg. (1)
205 "topiramat*".fc_titl. and "2009".fc_pubyr. and "1153".fc_pg. (1)
206 202 or 203 or 204 or 205 (4)
207 headache disorders/ or headache disorders, secondary/ (2135)
208 (headache? adj3 (secondary or rebound or overuse or drug?induced or (drug adj induced))).tw. (1392)
209 (headache? adj3 (secondary or rebound or overuse or drug?induced or (drug adj induced))).kf. (53)
210 (headache adj3 depend*).tw. (114)
211 (headache adj3 depend*).kf. (0)
212 or/207-211 (3179)
213 (headache adj5 medication-over*).tw. (560)
214 (headache adj5 analgesic* adj5 adverse).tw. (1)
215 exp Analgesics/ae [Adverse Effects] (62381)
216 headache?.tw,kf. (65849)
217 215 and 216 (1300)
218 207 or 208 or 209 or 210 or 211 or 213 or 214 or 217 (4151)
219 218 and 9 (3903)
220 limit 219 to yr="2000 -Current" (3287)=P vraag5
221 Substance Withdrawal Syndrome/ (20097)
222 withdrawal.tw. (74176)
223 withdrawal.kf. (892)
224 detox*.tw. (33774)
225 detox*.kf. (449)
226 or/221-225 (113557)=I
227 220 and 226 (247)
228 227 and (190 or 177) (147)
229 227 not 228 (100)
230 (headache? adj3 (secondary or rebound or overuse or drug?induced or (drug adj induced))).ti. (472)
231 209 or 210 or 230 (614)
232 Headache Disorders, Secondary/ (394)
233 231 or 232 (811)
234 227 and 233 (156)
235 228 or 234 (217)= med20151102 vraag5
237 exp Headache Disorders/ (28680)
238 Headache/ (23720)
239 7 or 216 or 218 or 237 or 238 (90755)
240 239 and 9 (80437)
241 limit 240 to yr="2000 -Current" (49432)=P alle hoofdpijn
242 "referral and consultation"/ or secondary care/ or tertiary healthcare/ (55218)
243 (multidisciplina* adj3 care).tw. (3938)
244 (multidisciplina* adj3 care).kf. (95)
245 (multidiscipli* adj3 (team or treatment)).tw. (13184)
246 (multidiscipli* adj3 (team or treatment)).kf. (174)
247 Pain Clinics/ (1254)
248 (pain adj3 clinic?).tw. (2353)
249 (pain adj3 clinic?).kf. (20)
250 (headache adj3 (clinic? or centre? or center?)).tw. (907)
251 (headache adj3 (clinic? or centre? or center?)).kf. (3)
252 "Delivery of Health Care, Integrated"/ (9323)
253 (integrated adj3 health adj3 care).tw. (1787)
254 (integrated adj3 health adj3 care).kf. (37)
255 ((tertiary or sec?ndary) adj3 (care or center? or centre? or clinic?)).tw. (56594)
256 ((tertiary or sec?ndary) adj3 (care or center? or centre? or clinic?)).kf. (82)
257 (integrated adj3 care).tw. (5598)
258 (integrated adj3 care).kf. (296)
259 or/242-258 (141669)
260 259 and 241 (1685)
261 "Quality of Life"/ (133128)
262 treatment outcome/ or treatment failure/ (737069)
263 (quality adj3 life).tw. (179214)
264 (quality adj3 life).kf. (7509)
265 (treatment adj3 (outcome or failure)).tw. (64660)
266 (treatment adj3 (outcome or failure)).kf. (1324)
267 or/261-266 (965412)
268 260 and 267 (385)
269 268 and 190 (9)
270 exp *Migraine Disorders/ (18898)
271 migraine.ti. (16427)
272 headache?.ti. (19213)
273 headache?.kf. (3264)
274 exp *Headache Disorders/ (24044)
275 *Headache/ (12794)
276 6 (2496)
277 or/270-276 (39897)
278 268 and 277 (253)
279 278 and 9 (253)
280 limit 279 to yr="2000 -Current" (253)
281 tr.fs. (124462)
282 og.fs. (404483)
283 281 or 282 (528838)
284 280 and 283 (10)
285 ut.fs. (152462)
286 281 or 282 or 285 (664620)
287 *"referral and consultation"/ or *secondary care/ or *tertiary healthcare/ (20690)
288 (multidisciplina* adj3 care).ti. (652)
289 (headache adj3 (clinic? or centre? or center?)).ti. (169)
290 *Pain Clinics/ (648)
291 (pain adj3 clinic?).ti. (531)
292 (multidiscipli* adj3 (team or treatment)).ti. (1492)
293 (integrated adj3 health adj3 care).ti. (455)
294 ((tertiary or sec?ndary) adj3 (care or center? or centre? or clinic?)).ti. (7999)
295 (integrated adj3 care).ti. (1809)
296 252 or 244 or 246 or 251 or 254 or 256 or 258 (9899)
297 or/287-296 (42034)=organisatie focus
298 280 and 297 (45) med20151102 vraag 6
Aanvulling 4 april 2016
1 "hoofdpijn NIV".ti. (0)
2 "38".fc_vol. and "sumatriptan".fc_titl. and "1998".fc_pubyr. and "184".fc_pg. (1)
3 "22".fc_vol. and "zolmitriptan".fc_titl. and "2002".fc_pubyr. and "101".fc_pg. (1)
4 exp Migraine Disorders/ (23044)
5 migraine.tw. (26173)
6 migraine.kf. (2685)
7 or/4-6 (30956)
8 "concept P".ti. (1)
9 (dutch or english or german or french).la. (22551772)
10 7 and 9 (28257)
11 limit 10 to yr="2000 -Current" (17515)
12 triptan*.ti. (478)
13 10 and 12 (392)
14 limit 13 to medline (376)
15 from 14 keep 3 (1)
16 from 13 keep 2 (1)
17 Tryptamines/ (4853)
18 Sumatriptan/ (2059)
19 zolmitriptan.ti. (222)
20 zolmitriptan.rn. (365)
21 zolmitriptan.kf. (12)
22 zolmitriptan.tw. (458)
23 rizatriptan.rn,kf. (313)
24 naratriptan.rn,kf. (170)
25 almotriptan.rn,kf. (166)
26 exp Serotonin Receptor Agonists/ (83610)
27 eletriptan.rn,kf. (149)
28 frovatriptan.rn,kf. (115)
29 ergotamin*.rn,kf. (2560)
30 Ergotamine/ (2280)
31 naproxen.rn,kf. (3631)
32 Naproxen/ (3567)
33 or/17-32 (89938)
34 11 and 33 (2238)
35 ae.fs. (1452230)
36 ct.fs. (17902)
37 to.fs. (353399)
38 (adverse adj3 (effect? or event?)).tw. (234098)
39 contra?indicat*.tw. (36290)
40 contraindicat*.tw. (36285)
41 toxic*.tw. (477487)
42 (adverse adj3 (effect? or event?)).kf. (3093)
43 contra?indicat*.kf. (557)
44 contraindicat*.kf. (557)
45 toxic*.kf. (42483)
46 or/35-45 (2235984)
47 34 and 46 (913)
48 Abnormalities, Drug-Induced/ (14010)
49 pregnancy complications/ or abortion, spontaneous/ or fetal death/ (113445)
50 congenital abnormalities/ or abnormalities, drug-induced/ or exp abnormalities, severe teratoid/ (50939)
51 exp Pregnancy/de [Drug Effects] (11856)
52 Stillbirth/ (3288)
53 (pregnancy or congenital or abnormalities or teratoid or stillbirth).kf. (90506)
54 or/48-53 (235431)
55 47 and 54 (25)
56 46 or 54 (2437331)
57 34 and 56 (915)
58 "55".fc_vol. and "pregnancy outcome".fc_titl. and "2015".fc_pubyr. and "490".fc_pg. (1)
59 "50".fc_vol. and "triptan exposure".fc_titl. and "2010".fc_pubyr. and "563".fc_pg. (1)
60 "28".fc_vol. and "triptan safety".fc_titl. and "2013".fc_pubyr. and "759".fc_pg. (1)
61 "54".fc_vol. and "sumatriptan".fc_titl. and "2014".fc_pubyr. and "1158".fc_pg. (1)
62 or/58-61 (4)
63 55 and 62 (4)
64 62 not 63 (0)
65 malformations.kf. (732)
66 53 or 65 (91048)
67 54 or 65 (235954)
68 47 and 67 (25)
69 triptan?.kf. (69)
70 69 or 33 (89961)
71 11 and 70 and 67 (28)
72 exp Stroke/ (99103)
73 (cardiovascular adj3 event?).ti. (4064)
74 exp Myocardial Ischemia/ (377391)
75 (cardiovascular adj3 event?).kf,tw. (27068)
76 (myocard* adj3 infarct*).tw,kf. (163287)
77 (angina adj3 pectoris).tw,kf. (18840)
78 (cardiovascular adj3 ischem*).tw,kf. (1240)
79 stroke.kf,tw. (169454)
80 or/72-79 (608476)
81 11 and 70 and 80 and 46 (64)
82 11 and 70 and 46 (918)
83 (child??? or childhood or infant* or p?ediatr* or perinat* or neonat* or newborn* or infan* or boy? or girl? or kid? or schoolage* or juvenil* or adolescen* or toddler?).tw. (1858540)
84 exp Child/ (1651249)
85 exp infant/ (999292)
86 "Adolescent"/ (1712900)
87 or/83-86 (3554249)
88 82 and 87 (204)
89 (child??? or childhood or p?ediatr* or boy? or girl? or kid? or schoolage* or juvenil* or adolescen*).tw. (1410902)
90 84 or 86 or 89 (2988684)
91 11 and 70 and 46 and 90 (191)
92 exp Case Reports/ (1771926)
93 case report?.tw,kf. (297601)
94 92 or 93 (1844025)
95 91 not 94 (181)
96 exp *Migraine Disorders/ (18848)
97 migraine.ti. (16252)
98 migraine.kf. (2685)
99 96 or 97 or 98 (20679)
100 95 and 99 (158)
101 from 81 keep 1-62 (62)
102 from 100 keep 1-153 (153)
103 early treatment.mp. (14319)
104 "32".fc_vol. and "early dosing".fc_titl. and "2012".fc_pubyr. and "226".fc_pg. (1)
105 ad.fs. (1187771)
106 (early adj3 (adminis* or dos*)).tw. (7045)
107 105 or 106 (1192623)
108 11 and 70 and 107 (646)
109 exp Drug Administration Schedule/ (90697)
110 105 or 106 or 109 (1213212)
111 11 and 70 and 110 (668)
112 111 and 90 (152)
113 attack?.tw,kf. (96928)
114 111 and 113 (311)
115 106 and 114 (23)
116 early.tw,kf. (1163473)
117 111 and 116 (109)
118 early.ti,kf. (237421)
119 117 and 118 (35)
120 90 and 111 and 116 (27)
121 120 not 119 (20)
122 (early adj3 (treat* or dos* or administrat*)).tw,kf. (63354)
123 117 and 122 and 90 (12)
124 123 not 119 (7)
125 from 124 keep 1-7 (7)
126 (risk adj3 ischaemic adj3 complicat*).tw. (38)
127 *Risk Assessment/ (20899)
128 *Brain Ischemia/ (31240)
129 (isch?emic adj3 complicat*).tw. (3117)
130 (isch?emic adj3 complicat*).kf. (5)
131 (risk adj5 isch?emic adj5 complicat*).tw. (352)
132 risk.kf. (27124)
133 risk.ti. (318175)
134 127 or 132 or 133 (345347)
135 128 or 129 or 130 (34140)
136 134 and 135 (1446)
137 11 and 70 and (80 or isch?emic.kf,tw.) and (46 or complicat*.tw,kf.) (86)
138 137 not 81 (22)
139 11 and 70 and 136 (2)
Literatuursearch 20 april 2016
Medline strategie
Database: Ovid MEDLINE(R) In-Process & Other Non-Indexed Citations, Ovid MEDLINE(R) Daily and Ovid MEDLINE(R) <1946 to Present>
Search Strategy:
1 "hoofdpijn NIV".ti. (0)
2 "38".fc_vol. and "sumatriptan".fc_titl. and "1998".fc_pubyr. and "184".fc_pg. (1)
3 "22".fc_vol. and "zolmitriptan".fc_titl. and "2002".fc_pubyr. and "101".fc_pg. (1)
4 exp Migraine Disorders/ (23144)
5 migraine.tw. (26289)
6 migraine.kf. (2722)
7 or/4-6 (31093)=P
8 "concept P".ti. (1)
9 (dutch or english or german or french).la. (22676639)= talen
10 7 and 9 (28381)
11 limit 10 to yr="2000 -Current" (17633)
12 triptan*.ti. (478)
13 10 and 12 (392)
14 limit 13 to medline (377)
15 from 14 keep 3 (1)
16 from 13 keep 2 (1)
17 Tryptamines/ (4863)
18 Sumatriptan/ (2066)
19 zolmitriptan.ti. (222)
20 zolmitriptan.rn. (365)
21 zolmitriptan.kf. (12)
22 zolmitriptan.tw. (459)
23 rizatriptan.rn,kf. (315)
24 naratriptan.rn,kf. (171)
25 almotriptan.rn,kf. (166)
26 exp Serotonin Receptor Agonists/ (83805)
27 eletriptan.rn,kf. (149)
28 frovatriptan.rn,kf. (115)
29 ergotamin*.rn,kf. (2563)
30 Ergotamine/ (2284)
31 naproxen.rn,kf. (3644)
32 Naproxen/ (3578)
33 or/17-32 (90153)
34 11 and 33 (2243)
35 "56".fc_vol. and "perimenopause".fc_titl. and "2016".fc_pubyr. and "292".fc_pg. (1)
36 "positive effects".fc_titl. and "2015".fc_pubyr. and "522".fc_pg. (1)
37 35 or 36 (2)
38 34 and 37 (1)
39 menopause/ or menopause, premature/ or perimenopause/ or postmenopause/ or premenopause/ (50133)
40 Amenorrhea/ (9469)
41 (menopaus* or perimenopaus* or postmenopaus* or premenopaus* or amenorhe*).tw. (83099)
42 (menopaus* or perimenopaus* or postmenopaus* or premenopaus* or amenorhe*).kf. (3379)
43 or/39-42 (102725)
44 estrogens/ or progestins/ (59642)
45 (?estrogen? or progesteron*).tw. (168322)
46 (?estrogen? or progesteron*).kf. (17373)
47 or/44-46 (197154)
48 43 or 47 (271045)
49 7 and 9 and 48 (585)
50 49 (585)
51 limit 50 to yr="2004 -Current" (284)
52 "filter medline observationele studies".ti. (0)
53 epidemiologic studies/ (7092)
54 exp case-control studies/ (773330)
55 exp cohort studies/ (1523876)
56 cross-sectional studies/ (212612)
57 (case adj3 control).af. (248796)
58 (cohort adj5 (study or studies or analy$)).af. (282487)
59 (cohort adj5 (study or studies or analy$)).af. (282487)
60 (follow-up adj5 (study or studies)).af. (576765)
61 (longitudinal or retrospective or prospective or (cross adj5 sectional)).af. (1643475)
62 (observational adj5 (study or studies)).af. (90936)
63 or/53-62 (2329727)
64 "filter observationele studies einde".ti. (0)
65 "sensitief filter voor RCT's van Cochrane".ti. (0)
66 randomized controlled trial.pt. (413927)
67 controlled clinical trial.pt. (90558)
68 (randomized or randomised).ab. (411099)
69 placebo.ab. (169007)
70 drug therapy.fs. (1846948)
71 randomly.ab. (247378)
72 trial.ab. (355979)
73 groups.ab. (1544081)
74 or/66-73 (3729876)
75 74 not (exp animals/ not humans/) (3209765)
76 "filter rct cochrane sensitief".ti. (0)
77 "filter systematic reviews".ti. (0)
78 meta analysis.pt. (64634)
79 (meta-anal$ or metaanal$).af. (114005)
80 (quantitativ$ adj10 (review$ or overview$)).tw. (5682)
81 (systematic$ adj10 (review$ or overview$)).tw. (90108)
82 (methodologic$ adj10 (review$ or overview$)).tw. (7553)
83 medline.tw. and review.pt. (52551)
84 (pooled adj3 analy*).tw. (11078)
85 or/78-84 (204905)
86 "filter systematic reviews".ti. (0)
87 "cochrane$".fc_jour. (12089)
88 85 or 87 (206186)
89 51 and 88 (17)
90 (51 and 75) not 88 (99)
91 (51 and 63) not (88 or 75) (34)
92 from 89 keep 1-17 (17)
93 from 90 keep 1-99 (99)
94 from 91 keep 1-34 (34)
95 exp Contraceptives, Oral/ (43107)
96 (oral adj5 contraceptiv*).tw. (22800)
97 (oral adj5 contraceptiv*).kf. (6776)
98 hormone replacement therapy/ or estrogen replacement therapy/ (22330)
99 ((hormone or ?estragen?) adj3 replace* adj3 therap*).tw. (11980)
100 ((hormone or ?estragen?) adj3 replace* adj3 therap*).kf. (217)
101 44 or 45 or 46 or 95 or 96 or 97 or 98 or 99 or 100 (248715)
102 7 and 9 and 101 (824)
103 (migraine adj5 course).ti. (27)
104 course.kf. (1053)
105 103 or 104 (1080)
106 102 and 105 (1)
107 102 and 43 (166)
108 49 and 43 (271)
109 108 and 88 (11)= vraag a systrev
110 (108 and 75) not 88 (108)= vraag a trials
111 110 (108)
112 limit 111 to yr="2004 -Current" (41) vraag a trials vanaf 2004
113 (108 and 63) not (88 or 75) (39)= vraag a observat
114 113 (39)
115 limit 114 to yr="2004 -Current" (24) )= vraag a observat vanaf 2004
116 109 (11)
117 limit 116 to yr="2004 -Current" (11)
118 exp Contraceptives, Oral, Combined/ (4570)
119 (oral adj3 contracept* adj3 combin*).tw. (2951)
120 (oral adj3 contracept* adj3 combin*).kf. (1724)
121 (oral adj3 contracept* adj3 combin*).ti. (854)
122 121 and 7 (24)
123 101 or 118 or 119 or 120 (248728) middelen
124 7 and 9 and 43 and 123 (166)
125 124 (166)
126 limit 125 to yr="2004 -Current" (72)
127 126 and 88 (7)= systrev
128 (126 and (75 or 63)) not 88 (41)
129 7 and 9 and 43 and 33 (17)= P + talen + menopause + middelen
130 129 (17)
131 limit 130 to yr="2004 -Current" (6)
132 7 and 9 and 33 and 123 (70)= P + talen + middelen
133 132 not 124 (63)
134 133 (63)
135 limit 134 to yr="2004 -Current" (32)= P + talen + middelen vanaf 2004
136 exp Migraine Disorders/dt (6863)
137 (menstrual* adj5 migraine).tw. (424)
138 (menstrual* adj5 migraine).kf. (15)
139 (menstrual* adj5 headache*).tw. (239)
140 (menstrual* adj5 headache*).kf. (2)
141 estrogens/tu or progestins/tu (8503) therapeutisch hormoongebruik
142 exp Contraceptives, Oral, Combined/tu (649) therapeutisch hormoongebruik
143 136 or (7 and 33) or (7 and tu.fs.) (10373) therapeutisch hormoongebruik
144 137 or 138 or 139 or 140 (587)
145 144 and (143 or 142 or 141) (238)
146 ((perimenstrual adj3 prophyla*) or (cycle* adj5 prophyla*)).tw. (230)
147 (menstrual adj3 prophyla*).tw. (22)
148 144 or 146 or 147 (800)
149 148 and (143 or 142 or 141) (240)
150 36 and 149 (0)
151 36 (1)
152 (premenopaus* adj5 migraine).tw. (6)
153 7 and 9 and (141 or 142 or 143) (9458)
154 exp Migraine Disorders/pc [Prevention & Control] (1984)
155 prophyla*.tw. (132758)
156 prophyla*.kf. (2097)
157 154 or 155 or 156 (134228)
158 153 and 157 (2070)
159 (fluctuati* adj3 (?estrogen or progest* or hormon*) adj3 level?).tw. (189)
160 exp Menstrual Cycle/ (31521)
161 146 or 147 or 159 or 160 (31884)= cyclus gerelateerd
162 (161 or 144 or 146 or 147) and (141 or 142 or 143) (581)
163 162 (581)
164 limit 163 to yr="2004 -Current" (233)
165 164 and 88 (18)= vraag c systrev
166 (164 and (75 or 63)) not 88 (180)= vraag c trials observat
167 7 and 9 and 101 (824)= P + talen + hormonen
168 167 (824)
169 limit 168 to yr="2004 -Current" (350)
170 169 and 88 (26) vraag b systrev
171 (169 and (75 or 63)) not 88 (162) vraag b trials observat
Spanningshoofdpijn
