Migraine: Monoklonale antilichamen
Uitgangsvraag
Wat is de plaats van het gebruik van monoklonale CGRP antilichamen bij de profylactische behandeling van patiënten met chronische migraine?
Aanbeveling
Overweeg CGRP-mAbs als profylaxe bij patiënten met refractaire chronische migraine zonder MOH, waarbij de behandeling met tenminste 3 profylactica (waaronder topiramaat en/of valproinezuur) en onabotulinetoxine-A gefaald heeft.
Controleer de bloeddruk voorafgaand en tijdens het eerste jaar van toediening regelmatig, en vervolgens jaarlijks.
Bespreek met patiënten dat er onvoldoende gegevens beschikbaar zijn over de veiligheid op lange termijn.
Voor patiënten met ernstige cardiovasculaire aandoeningen zijn er geen veiligheidsgegevens.
Gebruik tijdens de zwangerschap is gecontra-indiceerd.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Het doel van deze module is om de plaats te bepalen van CGRP-mAbs in de profylactische behandeling van patiënten met chronische migraine. Er werden 13 studies gevonden die de effectiviteit van CGRP-mAbs hebben vergeleken met een placebo. Voor de kritieke uitkomstmaat ‘30% reduction in MMD’ is geen conclusie mogelijk wegens gebrek aan data. Op basis van de literatuur blijkt dat behandeling met CGRP-mAbs in vergelijking met placebo waarschijnlijk niet leidt tot klinisch relevante vermindering van het aantal migrainedagen per maand (MMD), maar waarschijnlijk wél leidt tot een verhoogde kwaliteit van leven (GRADE-bewijskracht: gemiddeld).
De geïncludeerde studies zijn goed opgezet en uitgevoerd. Alle studies zijn gesponsord door de industrie. De rol van de sponsor varieerde per studie, maar in een aantal studies lijkt de industrie relatief veel invloed gehad te hebben op de analyse en de beschrijving van de resultaten (Bigal, 2015; Dodick, 2019; Lipton, 2019; Mulleners, 2020; Silberstein, 2020; Tepper, 2017). Om deze reden is bij alle conclusies afgewaardeerd van hoge tot gemiddelde bewijskracht.
Met de komst van de CGRP-mAbs is er voor het eerst profylactische medicatie beschikbaar welke specifiek voor de behandeling van migraine is ontworpen. In Nederland worden voor de behandeling van chronische migraine momenteel drie CGRP-mAbs onder voorwaarden vergoed, namelijk erenumab, fremanezumab en galcanezumab (Rijksoverheid, 2021). De actuele medicijnkosten in Nederland zijn beschikbaar via https://www.medicijnkosten.nl. Verschillende studies tonen dat patiënten met deze middelen per maand gemiddeld twee migrainedagen minder zullen krijgen in vergelijking met placebo, een statistisch significant verschil (Dodick, 2019; Detke, 2018; Lipton, 2020a; Mulleners, 2020; Sakai, 2021; Silberstein, 2017; Takeshima, 2021; Tepper, 2017). Deze uitkomst is vergelijkbaar met de gangbare profylactica voor chronische migraine, zoals topiramaat en onabotulinumtoxine type A (Linde, 2013; Herd, 2019). Doordat de werkgroep tevoren heeft vastgelegd dat een gemiddeld verschil van -3 maandelijksen migraine dagen ten opzichte van placebo als een klinisch relevant verschil zou worden aangemerkt, wordt op basis van de GRADE-methode geconcludeerd dat CGRP-mAbs waarschijnlijk geen tot weinig verschil in het aantal migrainedagen per maand geven vergeleken met placebo (zie de literatuursamenvatting). De werkgroep stelt echter dat vermindering van aantal migrainedagen niet per se het belangrijkste effect van medicatie hoeft te zijn. Zo kan vermindering in ernst van de migraineaanvallen en verbetering in kwaliteit van leven zwaar meewegen in de behandelkeuze. Verschillende studies (Ford, 2021; Lipton, 2019; Mulleners, 2020; Lipton, 2020b; Silberstein, 2020) tonen een statistisch significant en klinisch relevant gunstig effect op kwaliteit van leven ten opzichte van placebo. Dit strookt met de ervaringen uit klinische praktijk waarbij veel patiënten die voorheen geen baat hadden bij de gangbare profylactica, wel tevreden zijn met de monoklonale antilichamen. De medicatie is eenvoudig door patiënt zelf thuis toe te dienen (in tegenstelling tot de behandeling met onabotulinumtoxine type A welke in het ziekenhuis plaatsvindt). De therapietrouw is relatief hoog doordat maar één keer per maand een injectie nodig is (in tegenstelling tot de dagelijkse orale medicatie candesartan en topiramaat). Real-world data tonen over het algemeen dat 40-60% van de patiënten met chronische migraine meer dan 50% reductie in aantal migrainedagen per maand ervaart en dat er weinig bijwerkingen worden vermeld (Vernieri, 2021; Straube, 2021a; Straube, 2021b; Pozo-Rosich, 2022).
Wat betreft veiligheid op lange termijn is er nog weinig data beschikbaar. De meest voorkomende bijwerkingen zijn huidirritatie op de injectieplaats en obstipatie (wwww.lareb.nl). Enkele studies laten zien dat een deel van de patiënten hypertensie ontwikkelt onder het gebruik van erenumab en fremanezumab (de Vries Lentsch, 2021; Sealy, 2021). Verhoging van de bloeddruk treedt veelal op in de eerste week na de eerste injectie en houdt aan als deze onbehandeld blijft. Aangezien dit waarschijnlijk een klasse effect betreft, lijkt het zinvol om de bloeddruk te voorafgaand en tijdens het gebruik van CGRP-mAbs te controleren volgens de CVRM-richtlijn (link: Bloeddrukmeting bij CVRM). Voor de bloeddrukbehandeling kan samenwerking met de huisarts of internist gezocht worden. Hier ligt een kennislacune.
Er is geen data bekend over veiligheid tijdens de zwangerschap, de werkgroep ziet dit daarom als contra-indicatie. Voor patiënten met ernstige cardiovasculaire aandoeningen zoals myocardinfarct of herseninfarct zijn er geen veiligheidsgegevens; deze waren uitgesloten in de klinische onderzoeken.
Mede door het relatief gunstige bijwerkingenprofiel en de vergelijkbare effectiviteit met topiramaat en onabotulinumtoxine type A, is de European Headache Federation (EHF) van mening dat CGRP-mAbs als eerste keus behandeling bij patiënten met chronische migraine gekozen zou moeten worden (Sacco, 2022). Echter, door de relatief hoge kosten van CGRP-mAbs wordt het in veel landen alleen onder strikte voorwaarden vergoed. In Nederland geldt dat patiënten met chronische migraine tenminste tenminste 3 profylactica (waaronder topiramaat/valproïnezuur) en onabotulinumtoxine type A geprobeerd moeten hebben voor zij in aanmerking komen voor de CGRP-mAbs. Bij de werkgroep zijn er geen head-to-head trials bekend waarbij de CGRP-mAbs worden vergeleken met andere profylactica voor de behandeling van chronische migraine, waardoor de plaatsbepaling wordt bemoeilijkt.
Waarden en voorkeuren van patiënten (en evt. hun naasten)
De belangrijkste behandeldoelen voor patiënten zijn veelal het verminderen van het aantal migraine dagen, het verbeteren van kwaliteit van leven en het weer mee kunnen doen in de samenleving. De keuze voor het type profylactische behandeling is voorkeursgevoelig en vanzelfsprekend beslist de arts samen met de patiënt. De volgorde van voorkeur wordt mede bepaald door het bijwerkingenprofiel van het profylacticum en comorbiditeit. Patiënten met migraine zijn over het algemeen gevoelig voor bijwerkingen (Luykx, 2009). Nu er voor het eerst profylactische medicatie beschikbaar is die aangrijpt op het pathofysiologisch mechanisme van migraine (met relatief weinig bijwerkingen), is het voor een deel van de patiënten moeilijk te accepteren dat ze eerst andere profylactica moeten proberen (met een mogelijk grotere kans op bijwerkingen). Ook is aangetoond dat een aanzienlijk deel van patiënten met chronische migraine die refractair zijn voor alle gebruikelijke profylactica, wel een goede respons kan hebben op de CGRP-mAbs (Mulleners, 2020; Ferrari, 2009; Reuter, 2018). De CGRP-mAbs kunnen in de thuissituatie worden toegediend, wat het gebruikersgemak en therapietrouw optimaliseert. Tot zover de werkgroep bekend, ervaren patiënten de injectie veelal als niet-belastend of weinig nadelig. Gezien het feit dat de lange termijn effecten nog niet duidelijk zijn, zouden sommige jonge patiënten wellicht toch liever willen wachten.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
De werkgroep acht dat CGRP-mAbs een belangrijke aanvulling zijn bij de profylactische behandeling van chronische migraine. De zorgverlener zal bij het voorschrijven van deze middelen niet alleen het gunstige effect op kwaliteit van leven en relatief gunstige bijwerkingenprofiel maar ook de hoge kosten en het gebrek aan veiligheidsdata op de lange termijn in ogenschouw moeten nemen. De onderstaande aanbevelingen zijn geformuleerd binnen de kaders van het huidige vergoedingssysteem.
Onderbouwing
Achtergrond
Migraine is een aanvalsgewijze hersenziekte die gekenmerkt wordt door hevige, bonzende, eenzijdige hoofdpijn gedurende 4 tot 72 uur, die gepaard gaat met misselijkheid, braken en/of overgevoeligheid voor licht en geluid (migraine zonder aura). Bij één op de drie patiënten is er sprake van auraverschijnselen voorafgaand aan de hoofdpijn (IHS, 2018; Ashina, 2021a; Ashina, 2021b). Deze verschijnselen zijn meestal visueel en kortdurend (5-60 minuten). De hoofdpijn na een aura is vaak milder of kan zelfs geheel afwezig zijn.
Bij de meeste patiënten is er sprake van episodische migraine (<15 hoofdpijndagen per maand). Elk jaar transformeert echter 2,5% van de patiënten naar chronische migraine (≥15 hoofdpijndagen per maand, waarvan ≥8 migraine dagen, > 3 maanden), een proces dat migraine chronificatie wordt genoemd (IHS, 2018). Het onderscheid met episodische migraine wordt gemaakt omdat de behandeling van chronische migraine anders is. In Nederland zijn dit gemiddeld 50.000 patiënten per jaar. Een belangrijke risicofactor is het frequente gebruik van acute hoofdpijnmedicatie, en als zodanig komt medicatieovergebruik bij twee derde van de chronische migraine patiënten voor, maar in de neurologenpraktijk waarschijnlijk nog meer (Pijpers, 2018; Louter, 2013). De diagnose chronische migraine (CM) en medicatieovergebruikshoofdpijn (MOH) kunnen volgens de huidige classificaties dan ook naast elkaar bestaan. MOH is gedefinieerd als een hoofdpijn op ≥15 dagen per maand met overgebruik van acute hoofdpijnmedicatie, (gebruik op ≥10 dagen per maand voor triptanen of combinatie van medicaties, of ≥15 dagen bij alleen gebruik van eenvoudige pijnstillers zoals paracetamol of NSAIDS), gedurende >3 maanden (IHS, 2018).
Volgens de huidige standaard moeten patiënten met CM en MOH eerst het medicatie-overgebruik staken (gedurende 2 maanden bij triptanovergebruik en 3 maanden bij overgebruik andere pijnstillers) alvorens preventieve medicatie gestart kan worden (Pijpers, 2016; Pijpers, 2019; Pijpers, 2022).
De preventieve behandeling van CM bestaat uit dezelfde preventieve middelen als bij episodische migraine (waaronder ook bètablokkers en candesartan), waarbij het bewijs van effectiviteit bij CM met name voor topiramaat, valproaat en onabotulinumtoxine type A onderzocht is (Kennis, 2013; Bendtsen, 2018; Linde, 2013; Herd, 2019) ). Recent is een nieuwe klasse van preventieve middelen op de markt verschenen, de zogenaamde anti-CGRP-(receptor) antilichamen, afgekort CGRP-mAbs. Deze middelen zijn inmiddels goedgekeurd en worden ook vergoed in Nederland voor chronische migraine. Deze module evalueert de effectiviteit en positionering van de CGRP-mAbs in de behandeling voor patiënten met chronische migraine.
Conclusies / Summary of Findings
reduction in migraine days per month (critical)
|
No GRADE |
No evidence was found regarding the effect of monoclonal antibodies on 30% responder rate when compared with placebo in patients with chronic migraine.
Source: - |
2. Monthly migraine days (MMD, important)
|
Moderate GRADE |
Considering a minimal clinically relevant difference of ≥3 days, monoclonal antibodies likely result in little to no difference in MMD when compared with placebo in patients with chronic migraine
Sources: Lu, 2021; Mulleners, 2020; Sakai, 2021; Takeshima, 2021 |
3. Quality of Life (QoL, important)
|
Moderate GRADE |
Monoclonal antibodies likely increase QoL when compared with placebo in patients with chronic migraine.
Sources: Ford, 2021; Lipton, 2019; Lipton, 2020b; Mulleners, 2020 |
4. 50% reduction in MMD (important)
|
Moderate GRADE |
Monoclonal antibodies likely increase 50% responder rate when compared with placebo in patients with chronic migraine.
Sources: Lu, 2021; Mulleners, 2020 |
5. Monthly headache days (MHD, important)
|
Moderate GRADE |
Monoclonal antibodies likely result in little to no difference in MHD when compared with placebo in patients with chronic migraine.
Sources: Lu, 2021 |
6. Acute medication days per month (MaMD, important)
|
Moderate GRADE |
Monoclonal antibodies likely result in little to no difference in MaMD when compared with placebo in patients with chronic migraine.
Sources: Lu, 2021; Mulleners, 2020; Sakai, 2021 |
7. Disability (important)
|
Moderate GRADE |
Monoclonal antibodies likely reduce disability when compared with placebo in patients with chronic migraine.
Sources: Ford, 2021; Lipton, 2019 and Mulleners, 2020 |
8. Impact (important)
|
Low GRADE |
Monoclonal antibodies may result in little to no difference in impact when compared with placebo in patients with chronic migraine.
Sources: Lu, 2021; Dodick, 2019; Sakai, 2021 |
9. Adverse events (important)
|
Low GRADE |
Monoclonal antibodies may increase treatment related adverse events when compared with placebo in patients with chronic migraine.
Sources: Lu, 2021; Mulleners, 2020 |
10. Consistency of response (important)
|
No GRADE |
No evidence was found regarding the effect of monoclonal antibodies on consistency of response when compared with placebo in patients with chronic migraine.
Source: - |
Samenvatting literatuur
Description of studies
The selection by Lu (2021) was performed in August 2020, and all outcomes were combined in meta-analysis. Six RCTs were included (Bigal, 2015; Detke, 2018, Dodick, 2019; Lipton, 2020a; Silberstein, 2017 and Tepper, 2017). Participants were diagnosed with CM with or without medication overuse headache (MOH) according to the IHS, and only placebo controlled RCTs were included. Furthermore, efficacy and safety of a CGRP monoclonal antibody or botulinum toxin had to be assessed, and at least one of the targeted outcomes had to be assessed (migraine frequency, migraine days, responder rate, headache intensity or adverse events). Case reports/reviews, post hoc analyses, retrospective studies, and cohort studies were excluded, as were studies from which data for meta-analysis could not be extracted.
Silberstein (2020) evaluated efficacy and safety of eptinezumab for CM, based on the RCT from Lipton (2020a) which is included in Lu (2021). The RCT was performed in 13 countries. Patients were 18 to 65 years of age, and with a migraine history of CM for at least 12 months (40% with acute medication overuse). Patients were allowed to use barbiturates or prescription opioids (≤4 days per month) if use was stable for at least two month before screening until study-week 24. Other medications for migraine (e.g. triptans, nonsteroidal anti-inflammatory drugs, simple analgesics) were not restricted. After randomization, 9 participants in the placebo group (2.4%), and 40 participants in the intervention groups (5.4%) did not receive treatment. A total of 693 participants in the intervention groups (92.9%) and 356 in the placebo group (94.9%) completed week 12. This study was sponsored by H. Lundbeck A/S (Copenhagen, Denmark).
Lipton (2019) evaluated patient-reported outcomes of erenumab for CM, based on the RCT from Tepper (2017) which is included in Lu (2021). The RCT was performed in 69 headache/ clinical centres in North America and Europe. Patients were 18 to 65 years of age, and migraine onset had to be before the age of 50 years, 41% of the participants had medication overuse. Preventive drugs for migraine were not allowed from 2 months before baseline during the study period, neither were botulinum toxin injections. After randomization, 4 participants in the placebo group (1.4%) and 3 participants in the intervention groups (0.8%) did not receive treatment. A total of 375 (98%) completed 3 months. This study was sponsored by Amgen.
Lipton (2020b) evaluated the effect of fremanezumab on quality of life and productivity in patients with CM, based on the RCT from Silberstein (2017) which is included in Lu (2021). The RCT was performed at 132 sites in nine countries. Patients were 18 to 70 years of age, and had CM for at least 12 months. The number of participants with medication overuse headache was not stated. Participants were not allowed to use Onabotulinumtoxin type A (up to 4 months before screening) or barbiturates (up to 4 days before treatment). Patients with a lack of efficacy of two or more specific clusters of migraine preventive treatments were excluded. A total of 692 participants in the intervention groups (91.7%) and 342 in the placebo group (91.2%) completed week 12. This study was sponsored by Teva Pharmaceuticals.
Ford (2021) evaluated functioning and disability associated with galcanezumab in patients with CM, based on the RCT from Detke (2018) which is included in Lu (2021). The RCT was performed at 116 headache and clinical research centres in 12 countries. Patients were 16 to 65 years of age, with CM (64% with acute medication overuse), and with migraine onset before the age of 50 years. Patients who previously did not respond to trials of migraine preventives (Level A or level B evidence) from over three different medication classes were not included (based on the list published by the American Academy of Neurology’s evidence-based guidelines). Approximately 15% of the participants continued concurrent preventive medication (propranolol or topiramate).
Patients received monthly injections of galcanezumab or placebo during 3 months of double-blind treatment. A total of 529 (95.3%) participants in the intervention group, and 508 (91%) in the placebo group completed 3 months. The study was sponsored by Eli Lilly and Company.
Sakai (2021) performed an RCT to determine the efficacy and safety of fremanezumab administration in Japanese and Korean patients with CM. Patients were 18 to 70 years of age, had a history of migraine (age at onset ≤50 years), and experienced a headache on ≥15 days or used a triptan or ergot derivative to treat an established headache on ≥8 days. The amount of participants with medication overuse headache was not stated. Patients who failed at least two out of four clusters of preventive medication were not included. A total of 362 (95%) participants in the intervention groups, and 179 (93.7%) in the placebo group completed week 12. The study was sponsored by Otsuka Pharmaceutical.
Mulleners (2020) performed an RCT to assess the safety and efficacy of galcanezumab, at 64 sites (hospitals, clinics, or research centres) in 12 countries. Patients were 18 to 75 years of age, with episodic or CM (64% with acute medication overuse at baseline (CM subgroup)), with migraine onset before the age of 50 years, who had a documented failure of 2-4 standard-of-care migraine preventive medications in the past 10 years owing to lack of efficacy or tolerability, or both. In this module, we specifically focus on patients with CM. This study was sponsored by Eli Lilly.
Takeshima (2021) performed an RCT to evaluate efficacy and safety of erenumab in patients with episodic or CM. Participants were 20 to 65 years of age, had history of episodic or CM of at least 12 months before study-onset, with migraine onset before the age of 50 years. Subgroup analyses were performed for participants with CM. Patients were not eligible when they failed >3 migraine preventive treatment categories. The amount of participants with medication overuse headache was not stated. A total of 127 (97.7%) participants in the intervention group, and 127 (96.9%) in the placebo group completed week 24. This study was sponsored by Amgen.
Table 1 Summary of included studies
|
Study |
Intervention |
Comparator |
Follow-up |
Outcomes |
||||
|
|
Characteristics |
Type of monoclonal antibody, dose |
Characteristics |
Type of monoclonal antibody, dose |
Placebo/ usual care |
Dose |
|
|
|
Lu, 2021 |
- |
- |
- |
- |
- |
- |
- |
- |
|
Bigal, 2015 |
Arm 1 (n=88) Mean age (SD): 40.0 (11.6) Female: 86% Baseline MMD (SD): 17.2 (5.4) |
Fremanezumab
3 injections of 225 mg fremanezumab and 1 placebo at beginning of each cycle |
Arm 2 (n= 86) Mean age (SD): 41.5 (12.9) Female: 86% Baseline MMD (SD): 16.4 (5.3) |
Fremanezumab
4 injections (total 900 mg) subcutaneous at beginning of each cycle |
Arm 3 (n= 89) Mean age (SD): 40.7 (11.5) Female: 85% Baseline MMD (SD): 16.8 (5.0) |
Placebo
4 injections at each cycle |
3 x 28 days cycles |
AE |
|
Dodick, 2019 |
Arm 1 (n= 121) Mean age (SD): 37.2 (10.0) Female: 81% Baseline MMD (SD): 16.5 (4.8) |
Eptinezumab (IV)
Single infusion of 300 mg/100 mL at baseline |
Arm 3 (n= 122) Mean age (SD): 35.7 (9.4) Female: 91% Baseline MMD (SD): 16.2 (5.1) |
Eptinezumab (IV)
Single infusion of 30 mg/100 mL at baseline |
Arm 5 (n=121) Mean age (SD): 37.2 (9.2) Female: 90% Baseline MMD (SD): 16.4 (5.1) |
Placebo
Single infusion of 100 mL at baseline
|
3 months |
MMD, MHD, MaMD, impact (HIT-6) 50% responder rate, AE |
|
Arm 2 (n= 122) Mean age (SD): 36.7 (9.4) Female: 85% Baseline MMD (SD): 16.9 (4.8) |
Eptinezumab (IV)
Single infusion of 100 mg/100 mL at baseline |
Arm 4 (n= 130) Mean age (SD): 36.4 (10.3) Female: 87% Baseline MMD (SD): 16.4 (5.4) |
Eptinezumab (IV)
Single infusion of 10 mg/100 mL at baseline |
|||||
|
Lipton, 2020a & Silberstein, 2020 |
Arm 1 (n= 356) Mean age (SD): 41.0 (11.7) Female: 86.2% Baseline MMD (SD): 16.1 (4.6) MOH diagnosis: 39% |
Eptinezumab (IV)
100 mg |
Arm 2 (n= 350) Mean age (SD): 41.0 (10.4) Female: 89.7% Baseline MMD (SD): 16.1 (4.8) MOH diagnosis: 42% |
Eptinezumab (IV)
300 mg |
Arm 3 (n=366) Mean age (SD): 39.6 (11.3) Female: 88.8% Baseline MMD (SD): 16.1 (4.6) MOH diagnosis: 39.6% |
Placebo |
3 months |
Lipton, 2020a MMD, MHD, MaMD, impact (HIT-6), 50% responder rate, AE |
|
Silberstein, 2020 Quality of life (PGIC) |
||||||||
|
Tepper, 2017 & Lipton, 2019 |
Arm 1 (n= 191) Mean age (SD): 41.4 (11.3) Female: 86% Baseline MMD (SD): 17.9 (4.4) MOH diagnosis: 41% |
Erenumab
70 mg monthly |
Arm 2 (n=190) Mean age ± SD: 42.9 (11.1) (11.3) Female: 84% Baseline MMD (SD): 17.8 (4.7) MOH diagnosis: 41% |
Erenumab
140 mg monthly |
Arm 3 (n= 286) Mean age ± SD: 42.1 (11.3) Female: 79% Baseline MMD (SD): 18.2 (4.7) MOH diagnosis: 41% |
Placebo |
3 months |
Tepper, 2017 MMD, MaMD, 50% responder rate |
|
Lipton, 2019 Quality of life (MSQ-EF, MSQ-RFR, MSQ-RFP), disability (MIDAS), impact (HIT-6) |
||||||||
|
Silberstein, 2017 & Lipton 2020b |
Arm 1 (n= 376) Mean age (SD): 42.0 (12.4) Female: 88% Baseline MMD (SD): 16.2 (4.9) |
Fremanezumab
675 mg at baseline, placebo at weeks 4 and 8 |
Arm 2 (n= 379) Mean age (SD): 40.6 (12.0) Female: 87% Baseline MMD (SD): 16.0 (5.2) |
Fremanezumab
675 mg at baseline, 225 mg at weeks 4 and 8 |
Arm 3 (n= 375) Mean age (SD): 41.4 (12.0) Female: 88% Baseline MMD (SD): 16.4 (5.2) |
Placebo
At baseline, weeks 4 and 8 |
12 weeks after first dose 4 weeks after last dose (HIT-6)
4 weeks after first dose (MHD) |
Silberstein, 2017 MMD, MHD, MaMD, Impact (HIT-6) |
|
|
Lipton, 2020b Quality of life (MSQ-EF, MSQ-RFR, MSQ-RFP, PGIC, EQ-5D-5L) |
|
||||||||
|
Detke, 2018 & Ford 2021 |
Arm 1 (n= 278) Mean age (SD): 39.7 (11.9) Female: 85% Baseline MMD (SD): 19.4 ± 4.3 MOH diagnosis: 64% |
Galcanezumab (subcutaneous injections)
240 mg at baseline, 120 mg at month 1 and 2 |
Arm 2 (n= 277) Mean age (SD): 41.1 (12.4) Female: 82% Baseline MMD (SD): 19.2 (4.6) MOH diagnosis: 64% |
Galcanezumab (subcutaneous injections)
240 mg at baseline, month 1 and 2 |
Arm 3 (n= 558) Mean age (SD): 41.6 (12.1) Female: 87% Baseline MMD (SD): 19.6 (4.6) MOH diagnosis: 63% |
Placebo (subcutaneous injections)
Placebo at baseline, month 1 and 2 |
3 months |
Detke, 2018 MMD, MHD, MaMD, 50% responder rate, Disability (MIDAS) |
|
|
Ford, 2021 QoL (MSQ-RFR, MSQ-RFP, MSQ-EF) |
|
||||||||
|
Sakai, 2021 |
Arm 1 (n=189) Mean age (SD): 42.7y (10.2) Female: 86% Baseline MMD (SD): 16.4 (5.3) |
Fremanezumab
3x 225 mg (1.5 mL) at baseline, 225 mg (1.5 mL) at month 1 and month 2 |
Arm 2 (n=191) Mean age (SD): 43.5y (10.2) Female: 86% Baseline MMD (SD): 15.2 (5.0) |
Fremanezumab
3x 225 mg (1.5 mL) at baseline, placebo (1.5 mL) at month 1 and month 2 |
Arm 3 (n= 191) Mean age (SD): 42.1y (10.2) Female: 85% Baseline MMD (SD): 15.4 (5.0) |
Placebo
3x 1.5 mL placebo at baseline, 1,5 mL placebo at month 1 and month 2 |
12 weeks |
MMD, MaMD |
|
|
Mulleners, 2020 |
Arm 1 (n= 95) Mean age (SD): 41.05 (12.4) Female: 82% Baseline MMD (SD): 19.2 (4.6) MOH diagnosis: 65% |
Galcanezumab
120 mg monthly. Total: 480 mg |
- |
- |
Arm 2 (n= 98) Mean age (SD): 44.8 (13.1) Female: 87% Baseline MMD (SD): 18.1 (4.7) MOH diagnosis: 68% |
Placebo |
3 months |
MMD, MaMD, Disability (MIDAS), 50% responder rate, quality of life (MSQ-RFR) |
|
|
Takeshima, 2021* |
Arm 1 (n= 130) Mean age (SD): 44.2 (8.5) Female: 85.4% |
Erenumab (subcutaneous injections)
Once a month 70 mg |
- |
- |
Arm 2 (n= 131) Mean age (SD): 44.2 (8.5) Female: 85.4% |
Placebo (subcutaneous injections)
|
24 weeks |
MMD |
|
|
Abbreviations: AE, Adverse events; EQ-5D-5L, EuroQoL-5; HIT-6, The Headache Impact Test–6; MHD, monthly headache days; MIDAS, The Migraine Disability Assessment; MaMD, monthly acute medication days; MMD, monthly migraine days; MHD, monthly headache days; MSQ, Migraine-Specific Quality-of-Life Questionnaire (RFR, role function-restrictive; RFP, role function-preventive; EF, emotional function); PGIC, Patient global impression of change; QoL, Quality of Life. * No subgroup baseline characteristics for chronic migraine were available |
|||||||||
Results
1. 30% reduction in MMD (critical)
None of the RCTs assessed the effect of monoclonal antibodies on 30% reduction in MMD or consistency of response in patients with chronic migraine.
1. Level of evidence of the literature (30% reduction in MMD, critical)
The level of evidence regarding the outcome measure 30% reduction in MMD were not graded because of lack of data.
2. Monthly migraine days (MMD, important)
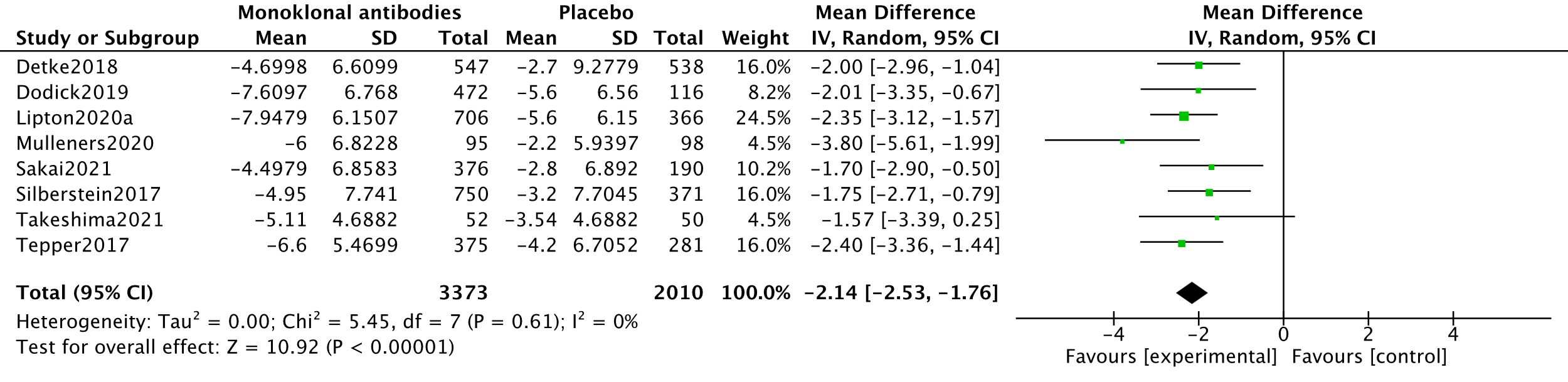
In the systematic review by Lu (2021), five studies measuring MMDs were combined in a meta-analysis (Dodick, 2019; Detke, 2018; Lipton, 2020a; Silberstein, 2017; Tepper, 2017). This meta-analysis was updated using data from two other RCTs (Mulleners, 2020; Sakai, 2021; Takeshima, 2021). The analysis resulted in a mean difference of -2.14 (95%CI -2.53 to -1.76), favouring the intervention group. This difference was not clinically relevant (as defined by our criteria). Results are shown in a forest plot (Figure 1).
2. Level of evidence of the literature (MMD, important)
The level of evidence regarding the outcome measure MMD started as high because it was based on RCTs and was downgraded by one level to moderate because of influence of the industry (Dodick, 2019; Lipton, 2020a; Mulleners, 2020 and Tepper, 2017) (-1, risk of bias).
3. Quality of life (important)
Quality of life was not reported by the systematic review of Lu (2021). This outcome was reported by 5 RCTs (Ford, 2021; Lipton, 2019; Mulleners, 2020; Lipton, 2020b; Silberstein, 2020), using the Patient Global Impression of change (PGIC) (Silberstein, 2020) and with the MSQ- role function-restrictive domain (MSQ-RFR) (Ford, 2021; Lipton, 2019; Mulleners, 2020; Lipton, 2020b). The EQ-5D-5L was not included in analysis.
In the study by Silberstein (2020), 395 (58%) participants in the intervention groups improved much or very much. In the placebo group, 37.9% improved much or very much). Categorized PGIC results by Silberstein (2020) could not be graded.
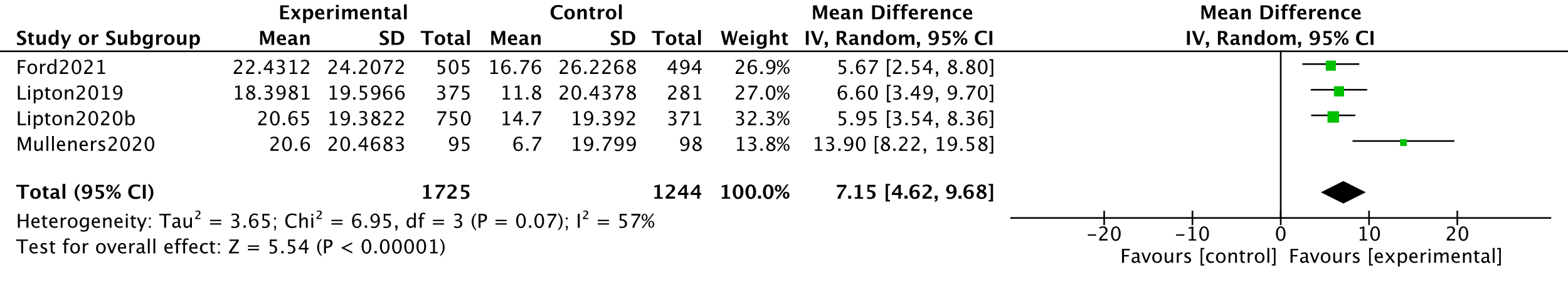
Outcomes of the MSQ-RFR subscale were reported by three studies (Ford, 2021; Lipton, 2020b and Mulleners, 2020). One study reported mean differences and SEs between the intervention and placebo groups. Differences between the groups were converted to means and SDs using RevMan calculator. The analysis resulted in a mean difference of 7.15 (95%CI 4.62 to 9.68), favouring the intervention group. This difference was clinically relevant. Results are shown in a forest plot (Figure 2).
3. Level of evidence of the literature (Quality of life, important)
The level of evidence regarding the outcome measure quality of life (MSQ-RFR) started as high because it was based on RCTs and was downgraded by one level to moderate because of influence of the industry (Lipton, 2019; Mulleners, 2020) and selective reporting (Lipton, 2020b) (-1, risk of bias). For instance, the sponsor was involved in the study design, data collection, data analysis, data interpretation, and writing of all related reports and publications (Mulleners, 2020).
4. 50% reduction in MMD (important)
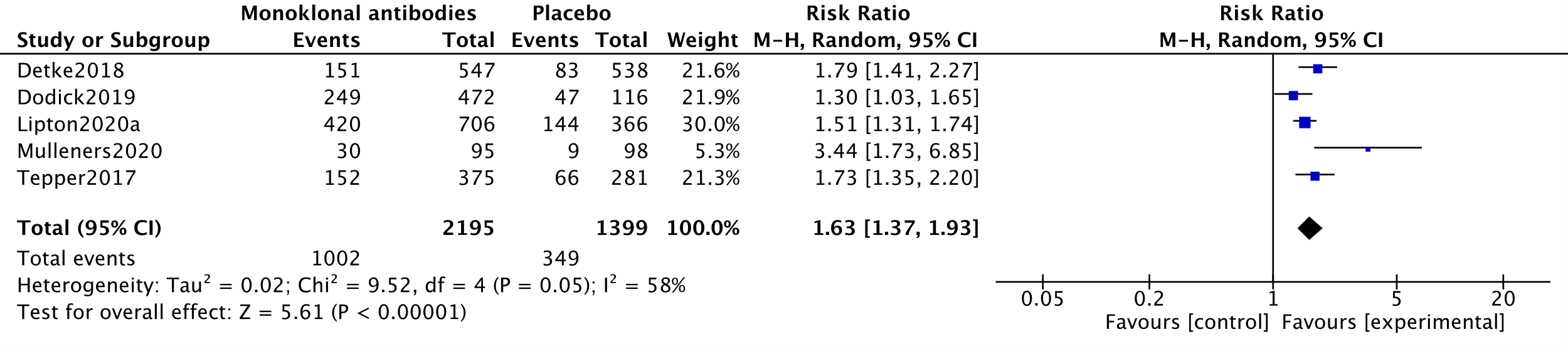
In the systematic review by Lu (2021), four studies measuring 50% responder rates were combined in a meta-analysis (Dodick, 2019; Detke, 2018; Lipton, 2020a; Tepper, 2017). This meta-analysis was updated using data from one other RCT (Mulleners, 2020). The analysis resulted in a Risk ratio of 1.63 (95%CI 1.37 to 1.93), favouring the intervention group. This difference was clinically relevant. Results are shown in a forest plot (Figure 3).
4. Level of evidence of the literature (50% reduction in MMD, important)
The level of evidence regarding the outcome measure 50% reduction in MMD started as high because it was based on RCTs and was downgraded by one level to moderate because of influence of the industry (Detke, 2018; Dodick, 2019; Lipton, 2020a; Mulleners, 2020; Tepper, 2017) (-1, risk of bias).
5. Monthly headache days (MHD, important)
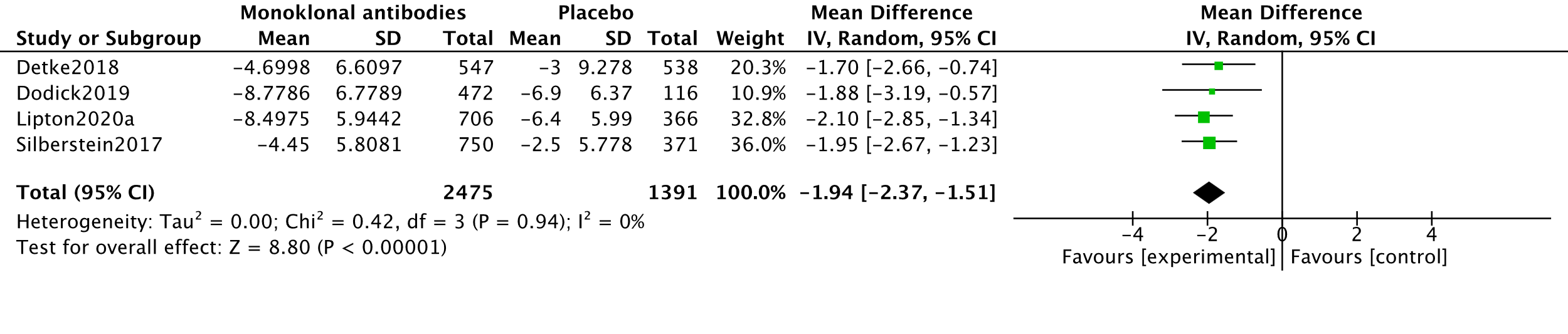
In the systematic review by Lu (2021), four studies measuring MHDs with 2794 participants were combined in meta-analysis (Detke, 2018; Dodick, 2019; Lipton, 2020a and Silberstein, 2017). The analysis resulted in a mean difference of -1.94 (95%CI -2.37 to -1.51), favouring the intervention group. This difference was not clinically relevant. Results are shown in a forest plot (Figure 4).
5. Level of evidence of the literature (MHD, important)
The level of evidence regarding the outcome measure MHD started as high because it was based on RCTs and was downgraded by one level to moderate because of influence of the industry (Dodick, 2019; Lipton, 2020a) (-1, risk of bias).
6. Acute medication days per month (MaMD, important)
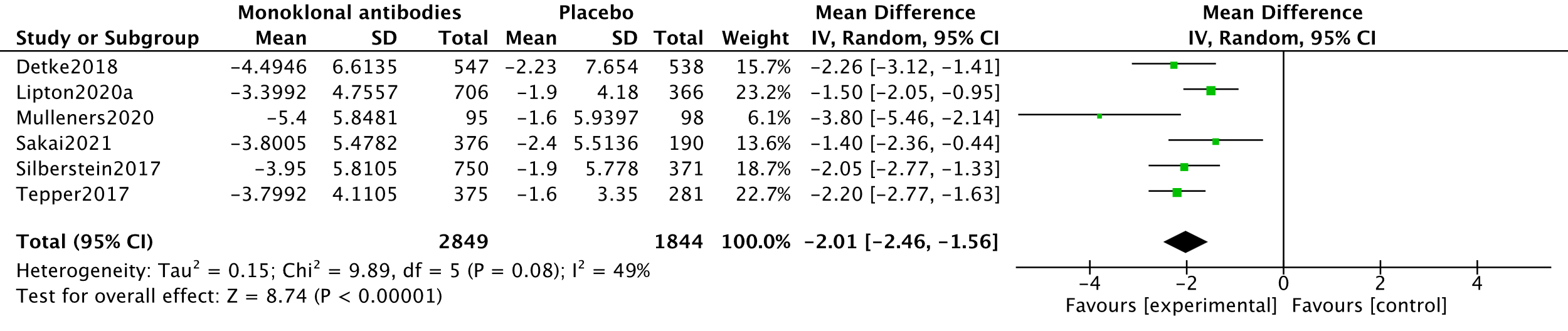
In the systematic review by Lu (2021), four studies measuring MaMD’s with x participants were combined in meta-analysis (Detke, 2018; Lipton, 2020a, Silberstein, 2017 and Tepper, 2017). This meta-analysis was updated using data from two other RCTs (Mulleners, 2020 and Sakai, 2021). The analysis resulted in a mean difference of -2.01 (95%CI -2.46 to -1.56), favouring the intervention group. This difference was not clinically relevant. Results are shown in a forest plot (Figure 5).
6. Level of evidence of the literature (MaMD, important)
The level of evidence regarding the outcome measure MaMD started as high because it was based on RCTs and was downgraded by one level to moderate because of influence of the industry (Lipton, 2020a; Mulleners, 2020; Tepper, 2017) (-1, risk of bias).
7. Disability (important)
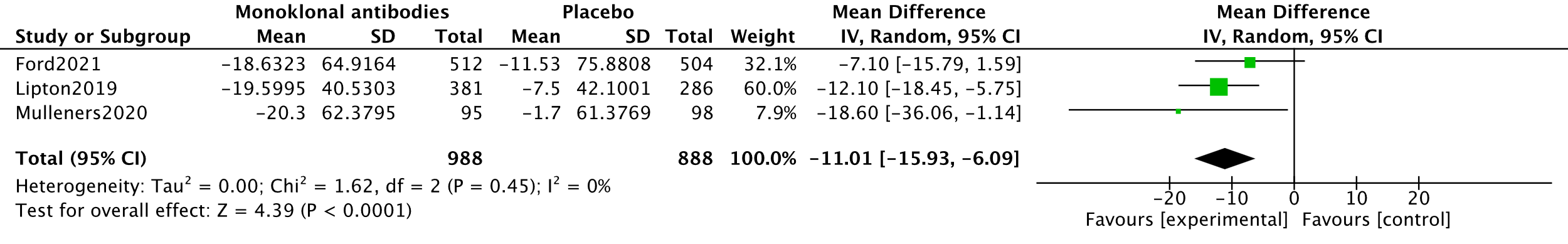
Disability was not reported by the systematic review of Lu (2021). For the outcome disability, three studies measuring disability with 1876 participants were combined in meta-analysis (Lipton, 2019; Ford, 2021; Mulleners, 2020). Disability was measured using the Migraine Disability Assessment total score (MIDAS). All studies reported mean change scores from baseline. The analysis resulted in a mean difference of -11.01 (95%CI -15.93 to -6.09), favouring the intervention group. This difference was clinically relevant. Results are shown in a forest plot (Figure 6).
7. Level of evidence of the literature (disability, important)
The level of evidence regarding the outcome measure disability started as high because it was based on RCTs and was downgraded by one level to moderate because of influence of the industry (Lipton, 2019; Mulleners, 2020) (-1, risk of bias).
8. Impact (important)
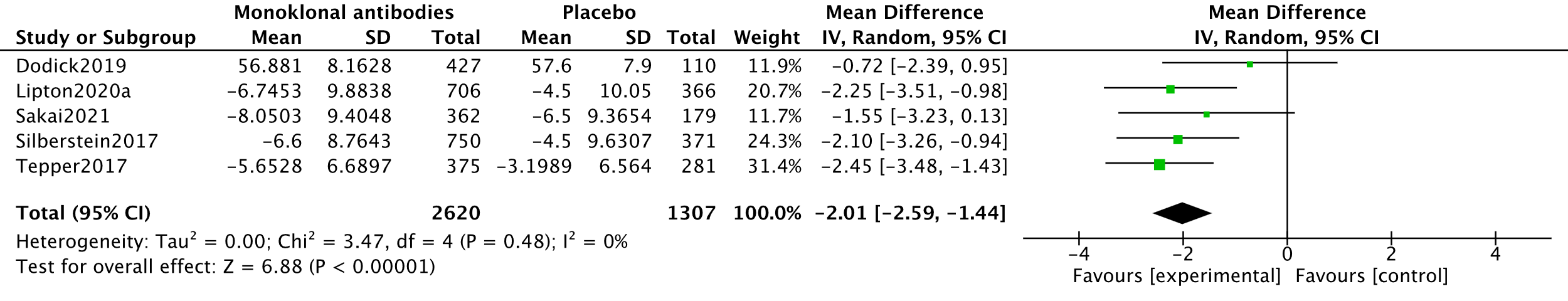
In the systematic review by Lu (2021), three studies measuring impact with 3927 participants were combined in meta-analysis (Lipton, 2020a, Silberstein, 2017 and Tepper, 2017). This meta-analysis was updated using data from two other RCTs (Dodick, 2019 and Sakai, 2021).
Impact was measured using the Headache Impact Test-6 (HIT-6). Analysis was performed conform Cochrane Handbook section 10.5.2 (Higgins, 2022). Thus, endpoint values (Dodick, 2019) were extracted and combined with changes from baseline (Lipton, 2020a; Sakai, 2021; Silberstein, 2017). The analysis resulted in a mean difference of -2.01 (95%CI -2.59 to -1.44), favouring the intervention group. This difference was not clinically relevant. Results are shown in a forest plot (Figure 7).
8. Level of evidence of the literature (impact, important)
The level of evidence regarding the outcome measure impact started as high because it was based on RCTs and was downgraded by two levels to low because of influence of the industry (Dodick, 2019; Lipton, 2020a and Tepper, 2017) (-1, risk of bias); and confidence interval overlap with threshold of clinical decision-making (-1, imprecision).
9. Adverse events (important)
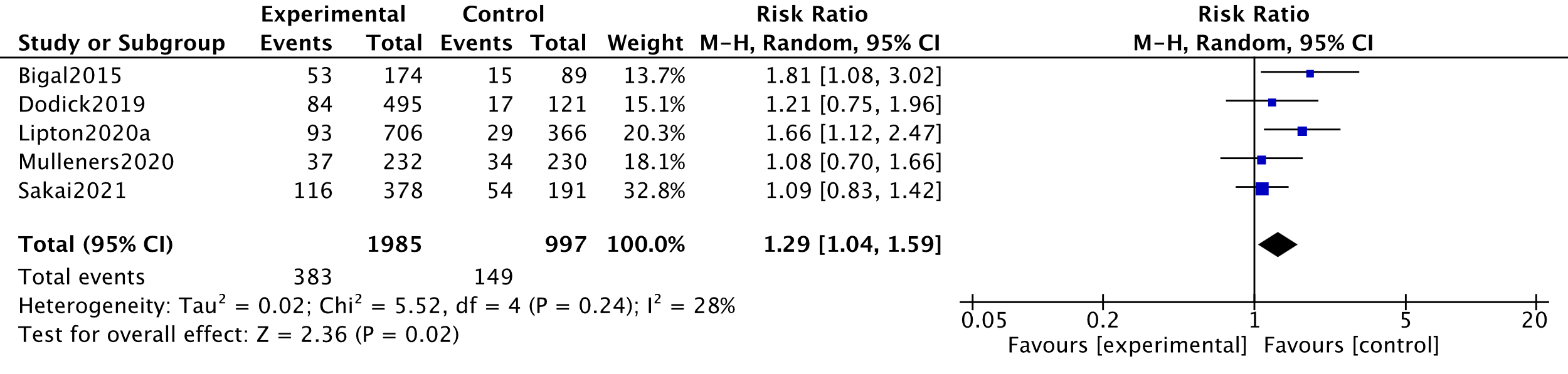
In the systematic review by Lu, four studies measuring treatment-related adverse events were combined in a meta-analysis (Bigal, 2015; Dodick, 2019; Lipton, 2020a). This meta-analysis was updated using data from two other RCTs (Mulleners, 2020; Sakai, 2021). The analysis resulted in a risk ratio of 1.29 (95%CI 1.04 to 1.59), favouring the placebo group. This difference was clinically relevant. Results are shown in a forest plot (Figure 8).
Regarding treatment-related serious adverse events, one serious adverse event was treatment related, in a participant who developed a single episode of worsening migrainous visual phenomena (Lipton, 2020a). This participant had a history of migraine with visual aura. This event (lasting 4 days) emerged 126 days after the second dose. Other serious adverse events were not considered to be treatment related (Lu, 2021; Mulleners, 2020).
9. Level of evidence of the literature (adverse events, important)
The level of evidence regarding the outcome measure adverse events started as high because it was based on RCTs and was downgraded by two levels to low because of influence of the industry (Bigal, 2015; Dodick, 2019; Lipton, 2020a; Mulleners, 2020) (-1, risk of bias); and confidence interval overlap with border of no clinical effect (-1, imprecision). The evidence was not downgraded for indirectness, because the group with episodic migraine in the study by Mulleners (2020) was not expected to bias the result.
10. Consistency of response (important)
None of the RCTs assessed the effect of monoclonal antibodies on consistency of response in patients with chronic migraine.
10. Level of evidence of the literature (Constistency of response, important)
The level of evidence regarding consistency of response were not graded because of lack of data.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What is the effectiveness of monoclonal antibodies compared to placebo or usual care in patients with chronic migraine?
P: Patients with chronic migraine (≥15 headache days/month, of which at least 8 migraine days/month), possibly in combination with a diagnosis of MOH (medication overuse headache).
I: Monoclonal antibodies (erenumab, fremanezumab, galcanezumab, eptinezumab)
C: Placebo or usual care (e.g. topiramate, valproate)
O: Number of monthly migraine days (MMD), number of monthly headache days (MHD), number of monthly days with acute headache medication use (MaMD), number of monthly migraine attacks, quality of life (e.g. EQ-5D, SF-36), disability (e.g. MIDAS), impact (e.g. HIT-6), 50% reduction in MMD, 30% reduction in MMD, consistency of response of 30% reduction in MMD for multiple months, adverse events
Relevant outcome measures
The guideline development group considered 30% reduction in MMD as critical outcome measures for decision making; and number of MMD, MHD, quality of life, MaMD, disability, impact, 50% reduction in MMD, consistency of response, and adverse events as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies. Quality of life (e.g. EQ-5D, SF-36), disability (e.g. MIDAS), impact (e.g. HIT-6) had to be assessed using validated instruments.
Based on expert opinion the working group defined the following minimal clinically (patient) important differences between active treatment and placebo:
Continuous outcomes:
- Number of monthly migraine headache days (MMD): ≥3 dagen
- Number of monthly headache days (MHD): ≥3 dagen
- Number of monthly days with acute headache medication use (MaMD): ≥3 dagen
- Quality of life: ≥10% difference on a scale, or previously defined minimal important differences (e.g. EQ-5D-3L: 0.07, SF-12 physical: 1, SF-12-mental: 4 (Hao, 2019), MSQ-RFR: 3.2, MSQ-RFP: 4.6, MSQ-EF: 7.5 (Lipton, 2019))
- Disability: ≥5 points (MIDAS, Lipton, 2019)
- Impact: ≥2.3 points (HIT, Lipton, 2019)
Dichotomous outcomes (yes/no):
- 50% reduction in monthly migraine headache days (MMD): ≥30% (ZiN, 2021)
- 30% reduction in monthly migraine headache days (MMD): ≥30%
- Consistency of response (30% reduction in MMD) for all months with treatment/or 3 out of 6 months of treatment: ≥30%
- Adverse events: ≥25% (ZiN, 2021; GRADE-default)
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2000 until 5 October 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 374 hits. Studies were selected based on the following criteria:
- Systematic review (searched in at least two databases, and detailed search strategy, risk of bias assessment and results of individual studies available), randomized controlled trial comparing monoclonal antibodies with placebo or usual care;
- Patients aged ≥ 18 years;
- Minimal follow-up period of ≥ 3 months;
- Full-text English language publication;
- Studies including ≥ 20 (ten in each study arm) patients; and
- Studies according to PICO.
A total of 102 studies were initially selected based on title and abstract screening. After reading the full text, 89 studies were excluded (see the table with reasons for exclusion under the tab Methods), one systematic review and 13 RCTs were included. One systematic review with meta-analysis (Lu, 2021) was found, which included 6 out of 13 studies (Bigal, 2015; Detke, 2018, Dodick, 2019; Lipton, 2020a; Silberstein, 2017 and Tepper, 2017). The meta-analysis by Lu (2021) was used and updated for the outcomes MMD, MHD, MaMD, impact, 50% responder rate, and adverse events. For the outcomes quality of life, disability, 30% responder rate and consistency of response, data from individual trials was used.
Results
A total of 14 studies were included in the analysis of the literature. Important study characteristics and results are summarized in tables (see Table 1). The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Ashina, 2021a. Ashina M, Terwindt GM, Al-Karagholi MA, de Boer I, Lee MJ, Hay DL, Schulte LH, Hadjikhani N, Sinclair AJ, Ashina H, Schwedt TJ, Goadsby PJ. Migraine: disease characterisation, biomarkers, and precision medicine. Lancet. 2021 Apr 17;397(10283):1496-1504. doi: 10.1016/S0140-6736(20)32162-0. Epub 2021 Mar 25. PMID: 33773610.
- Ashina, 2021b. Ashina M, Buse DC, Ashina H, Pozo-Rosich P, Peres MFP, Lee MJ, Terwindt GM, Halker Singh R, Tassorelli C, Do TP, Mitsikostas DD, Dodick DW. Migraine: integrated approaches to clinical management and emerging treatments. Lancet. 2021 Apr 17;397(10283):1505-1518. doi: 10.1016/S0140-6736(20)32342-4. Epub 2021 Mar 25. PMID: 33773612.
- Bendtsen L, Sacco S, Ashina M, Mitsikostas D, Ahmed F, Pozo-Rosich P, Martelletti P. Guideline on the use of onabotulinumtoxinA in chronic migraine: a consensus statement from the European Headache Federation. J Headache Pain. 2018 Sep 26;19(1):91. doi: 10.1186/s10194-018-0921-8. PMID: 30259200; PMCID: PMC6755553.
- BPLTTC, 2021. Blood Pressure Lowering Treatment Trialists' Collaboration. Pharmacological blood pressure lowering for primary and secondary prevention of cardiovascular disease across different levels of blood pressure: an individual participant-level data meta-analysis. Lancet. 2021 May 1;397(10285):1625-1636. doi: 10.1016/S0140-6736(21)00590-0. Erratum in: Lancet. 2021 May 22;397(10288):1884. PMID: 33933205; PMCID: PMC8102467.
- Buelt A, Richards A, Jones AL. Hypertension: New Guidelines from the International Society of Hypertension. Am Fam Physician. 2021 Jun 15;103(12):763-765. PMID: 34128614.
- Farmacotherapeutisch kompas - Erenumab, 2022. Link: https://www.farmacotherapeutischkompas.nl/bladeren/preparaatteksten/e/erenumabGeraadpleegd op: 9 juni 2022.
- Farmacotherapeutisch kompas - Botulinetoxine A, 2022. Link: https://www.farmacotherapeutischkompas.nl/bladeren/preparaatteksten/b/botulinetoxine_a. Geraadpleegd op: 6 september 2022.
- Ferrari MD, Diener HC, Ning X, Galic M, Cohen JM, Yang R, Mueller M, Ahn AH, Schwartz YC, Grozinski-Wolff M, Janka L, Ashina M. Fremanezumab versus placebo for migraine prevention in patients with documented failure to up to four migraine preventive medication classes (FOCUS): a randomised, double-blind, placebo-controlled, phase 3b trial. Lancet. 2019 Sep 21;394(10203):1030-1040. doi: 10.1016/S0140-6736(19)31946-4. Epub 2019 Aug 16. Erratum in: Lancet. 2019 Oct 29;: PMID: 31427046.
- Herd CP, Tomlinson CL, Rick C, Scotton WJ, Edwards J, Ives NJ, Clarke CE, Sinclair AJ. Cochrane systematic review and meta-analysis of botulinum toxin for the prevention of migraine. BMJ Open. 2019 Jul 16;9(7):e027953. doi: 10.1136/bmjopen-2018-027953. PMID: 31315864; PMCID: PMC6661560.
- IHS, 2018. Headache Classification Committee of the International Headache Society (IHS) The International Classification of Headache Disorders, 3rd edition. Cephalalgia. 2018 Jan;38(1):1-211. doi: 10.1177/0333102417738202. PMID: 29368949.
- Kennis K, Kernick D, O'Flynn N. Diagnosis and management of headaches in young people and adults: NICE guideline. Br J Gen Pract. 2013 Aug;63(613):443-5. doi: 10.3399/bjgp13X670895. PMID: 23972191; PMCID: PMC3722827.
- Linde M, Mulleners WM, Chronicle EP, McCrory DC. Topiramate for the prophylaxis of episodic migraine in adults. Cochrane Database Syst Rev. 2013 Jun 24;2013(6):CD010610. doi: 10.1002/14651858.CD010610. PMID: 23797676; PMCID: PMC7388931.
- Louter MA, Bosker JE, van Oosterhout WP, van Zwet EW, Zitman FG, Ferrari MD, Terwindt GM. Cutaneous allodynia as a predictor of migraine chronification. Brain. 2013 Nov;136(Pt 11):3489-96. doi: 10.1093/brain/awt251. Epub 2013 Sep 29. PMID: 24080152.
- Luykx J, Mason M, Ferrari MD, Carpay J. Are migraineurs at increased risk of adverse drug responses? A meta-analytic comparison of topiramate-related adverse drug reactions in epilepsy and migraine. Clin Pharmacol Ther. 2009 Mar;85(3):283-8. doi: 10.1038/clpt.2008.203. Epub 2008 Nov 5. PMID: 18987621.
- Mulleners WM, Kim BK, Láinez MJA, Lanteri-Minet M, Pozo-Rosich P, Wang S, Tockhorn-Heidenreich A, Aurora SK, Nichols RM, Yunes-Medina L, Detke HC. Safety and efficacy of galcanezumab in patients for whom previous migraine preventive medication from two to four categories had failed (CONQUER): a multicentre, randomised, double-blind, placebo-controlled, phase 3b trial. Lancet Neurol. 2020 Oct;19(10):814-825. doi: 10.1016/S1474-4422(20)30279-9. Epub 2020 Sep 16. PMID: 32949542.
- Patricia Pozo-RosichD, Holland C. Detke, Shufang Wang, David Doleil, Lily Q. Li, Sheena K. Aurora & Uwe Reuter (2022) Long-term treatment with galcanezumab in patients with chronic migraine: results from the open-label extension of the REGAIN study, Current Medical Research and Opinion, 38:5, 731-742, DOI: 10.1080/03007995.2022.2059975
- Pijpers JA, Wiendels NJ, Koppen H, Ferrari MD, Haan J, Terwindt GM. Hoofdpijn door overgebruik van pijnmedicatie [Medication-overuse headache]. Ned Tijdschr Geneeskd. 2018;162:D1749. Dutch. PMID: 29350119.
- Pijpers JA, Kies DA, Louter MA, van Zwet EW, Ferrari MD, Terwindt GM. Acute withdrawal and botulinum toxin A in chronic migraine with medication overuse: a double-blind randomized controlled trial. Brain. 2019 May 1;142(5):1203-1214. doi: 10.1093/brain/awz052. PMID: 30982843; PMCID: PMC6511115.
- Pijpers JA, Kies DA, van Zwet EW, Rosendaal FR, Terwindt GM. Behavioural intervention in medication overuse headache: A concealed double-blind randomized controlled trial. Eur J Neurol. 2022 May;29(5):1496-1504. doi: 10.1111/ene.15256. Epub 2022 Feb 10. PMID: 35064733.
- Pijpers JA, Louter MA, de Bruin ME, van Zwet EW, Zitman FG, Ferrari MD, Terwindt GM. Detoxification in medication-overuse headache, a retrospective controlled follow-up study: Does care by a headache nurse lead to cure? Cephalalgia. 2016 Feb;36(2):122-30. doi: 10.1177/0333102415583146. Epub 2015 Apr 22. PMID: 25903762.
- Reuter U, Goadsby PJ, Lanteri-Minet M, Wen S, Hours-Zesiger P, Ferrari MD, Klatt J. Efficacy and tolerability of erenumab in patients with episodic migraine in whom two-to-four previous preventive treatments were unsuccessful: a randomised, double-blind, placebo-controlled, phase 3b study. Lancet. 2018 Nov 24;392(10161):2280-2287. doi: 10.1016/S0140-6736(18)32534-0. Epub 2018 Oct 22. PMID: 30360965.
- Rijksoverheid. (2021, 5 november). Regeling van de Staatssecretaris van Volksgezondheid, Welzijn en Sport van 27 oktober 2021, kenmerk 3270909-1017996-Z, houdende wijziging van de bijlagen 1, 2 en 3 van de Regeling zorgverzekering in verband met de maandelijkse wijziging van de aanspraak op geregistreerde geneesmiddelen. Geraadpleegd op 12 december 2022, van https://zoek.officielebekendmakingen.nl/stcrt-2021-45411.html
- Sacco S, Amin FM, Ashina M, Bendtsen L, Deligianni CI, Gil-Gouveia R, Katsarava Z, MaassenVanDenBrink A, Martelletti P, Mitsikostas DD, Ornello R, Reuter U, Sanchez-Del-Rio M, Sinclair AJ, Terwindt G, Uluduz D, Versijpt J, Lampl C. European Headache Federation guideline on the use of monoclonal antibodies targeting the calcitonin gene related peptide pathway for migraine prevention - 2022 update. J Headache Pain. 2022 Jun 11;23(1):67. doi: 10.1186/s10194-022-01431-x. PMID: 35690723; PMCID: PMC9188162.
- Saely S, Croteau D, Jawidzik L, Brinker A, Kortepeter C. Hypertension: A new safety risk for patients treated with erenumab. Headache. 2021 Jan;61(1):202-208. doi: 10.1111/head.14051. Epub 2021 Jan 10. PMID: 33423274.
- Straube, 2021a. Straube A, Stude P, Gaul C, Schuh K, Koch M. Real-world evidence data on the monoclonal antibody erenumab in migraine prevention: perspectives of treating physicians in Germany. J Headache Pain. 2021 Nov 6;22(1):133. doi: 10.1186/s10194-021-01344-1. PMID: 34742252; PMCID: PMC8572451.
- Straube, 2021b. Straube, A., Broessner, G., Gaul, C., Hamann, X., Kraya, T., Schauerte, I., & Neeb, L. (2022). Fremanezumab for Preventive Treatment in Migraine: The FINESSE Study (P16-2.001).
- Vernieri F, Altamura C, Brunelli N, Costa CM, Aurilia C, Egeo G, Fofi L, Favoni V, Pierangeli G, Lovati C, Aguggia M, d'Onofrio F, Doretti A, Di Fiore P, Finocchi C, Rao R, Bono F, Ranieri A, Albanese M, Cevoli S, Barbanti P; GARLIT Study Group. Galcanezumab for the prevention of high frequency episodic and chronic migraine in real life in Italy: a multicenter prospective cohort study (the GARLIT study). J Headache Pain. 2021 May 3;22(1):35. doi: 10.1186/s10194-021-01247-1. PMID: 33941080; PMCID: PMC8091153.
- de Vries Lentsch S, Verhagen IE, van den Hoek TC, MaassenVanDenBrink A, Terwindt GM. Treatment with the monoclonal calcitonin gene-related peptide receptor antibody erenumab: A real-life study. Eur J Neurol. 2021 Dec;28(12):4194-4203. doi: 10.1111/ene.15075. Epub 2021 Sep 7. PMID: 34424593; PMCID: PMC9291504.
- Zorgverzekeraars Nederland. (2022, 22 november). Artsenverklaring CGRP-Remmers (erenumab, fremanezumab, galcanezumab), versie 1.1. Geraadpleegd op 12 december 2022, van https://www.znformulieren.nl/formulieren/documenten?folderid=6856736768&title=CGRP-remmers
Evidence tabellen
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
|
Study reference
|
Was the allocation sequence adequately generated?
|
Was the allocation adequately concealed?
|
Blinding: Was knowledge of the allocated interventions adequately prevented? |
Was loss to follow-up (missing outcome data) infrequent?
|
Are reports of the study free of selective outcome reporting?
|
Was the study apparently free of other problems that could put it at a risk of bias?
|
Overall risk of bias If applicable/necessary, per outcome measure
|
|
Dodick, 2019 |
Probably yes
Stratified, permuted block randomization from interactive web response system. |
Probably no
Unknown whether allocation could be foreseen or how this was prevented. |
Probably yes;
Not stated which parties were blinded. |
Probably no;
Due to ‘multiple protocol violations’, all participants in one site were excluded (n= 28), MNAR. 95% of other participants completed week 12 measurement. |
Probably yes
All prespecified outcomes were reported. |
Definitely no;
“The sponsor participated in the design and conduct of the study; data collection, management, analysis, and interpretation; and preparation, review, and approval of the manuscript.”
Appendix: “Alder BioPharmaceuticals, Inc. (Bothell, Washington, USA) sponsored this study. The sponsor, in collaboration with the academic advisors, designed the study. The sponsor conducted the data analyses and all authors were provided full access to the data. The authors vouch for the completeness and accuracy of the data. All authors reviewed and provided feedback on subsequent manuscript drafts and agreed to submit the final version for publication.
|
HIGH concerns (all outcomes)
|
|
Lipton, 2020a |
Probably no
Unknown way of randomization sequence generation |
Probably no
Unknown whether allocation could be foreseen or how this was prevented. |
Probably yes
Participants, clinicians and research personnel were blinded during entire trial. |
Probably yes
No high amounts of missing data, no difference between groups. |
Probably no
Not all prespecified (secondary) outcomes were reported (e.g. SF-36, EQ-5D-5L) |
Probably no
Silberstein 2020: “The sponsor participated in the design and conduct of the study; data collection, management, analysis, and interpretation; and preparation, review, and approval of the manuscript.”
|
HIGH concerns (all outcomes)
|
|
Silberstein, 2020 |
Probably no
Unknown way of randomization sequence generation |
Probably no
Unknown whether allocation could be foreseen or how this was prevented. |
Probably yes
Participants, clinicians, and research personnel were blinded during entire trial. |
Probably yes
No high amounts of missing data, no difference between groups. |
Probably no
Not all prespecified (secondary) outcomes were reported (e.g. SF-36, EQ-5D-5L) |
Definitely no
“The sponsor participated in the design and conduct of the study; data collection, management, analysis, and interpretation; and preparation, review, and approval of the manuscript.” |
HIGH concerns (all outcomes)
|
|
Tepper, 2017 |
Probably yes
Sponsor-generated randomization sequence |
Probably yes
Treatment allocation through interactive web response system/voice response, centrally performed |
Probably yes
Patients, sponsor site personnel, and study personnel were masked |
Probably yes
No high amounts of missing data, no difference between groups. |
Probably yes
All prespecified outcomes were reported. |
Definitely no “The study sponsor, in collaboration with investigators, developed the protocol. The study sponsor provided study drug, managed study sites, and did the statistical analysis according to a prespecified statistical analysis plan.” |
HIGH concerns (all outcomes)
|
|
Lipton, 2019 |
Probably yes
Sponsor-generated randomization sequence |
Probably yes
Treatment allocation through interactive web response system/voice response, centrally performed |
Probably yes
Patients, sponsor site personnel, and study personnel were masked |
Probably yes
No high amounts of missing data, no difference between groups. |
Probably yes
All prespecified outcomes were reported. |
Definitely no
No statement from sponsor, however in Tepper (2017): “The study sponsor, in collaboration with investigators, developed the protocol. The study sponsor provided study drug, managed study sites, and did the statistical analysis according to a prespecified statistical analysis plan.” |
HIGH concerns (all outcomes)
|
|
Takeshima, 2021 |
Probably yes
Randomization code with interactive-response technology |
Probably yes
“Treatment assignment and future assignments were blinded to all patients, site personnel and sponsor” |
Probably yes
Patients, site personnel and sponsor were blinded. |
Probably yes
No high amounts of missing data, no difference between groups. |
Probably yes
All prespecified outcomes were reported. |
Probably no
First author had nothing to disclose (analysis of data and revised manuscript for intellectual content). However, acquisition of data and drafting of the manuscript was only performed by employees of Amgen who were also stockholders. |
Some concerns (all outcomes)
|
|
Bigal, 2015 |
Probably yes
Randomization code with interactive-response technology |
Probably yes
Central randomization process |
Probably yes
Assessors, administrators, patients were blinded. |
Probably no
High amounts of dropout: 12 (13,5%) dropout in placebo, 27 (14.9%) dropout in intervention groups. |
Probably yes
All prespecified outcomes were reported. |
Definitely no “The protocol was designed and the study was conducted by the funder with input from all authors. The funder was responsible for data collection, data analysis, data interpretation, and writing the Article. All authors had full access to all the data in the study and the corresponding author had final responsibility for the decision to submit for publication” |
HIGH concerns (all outcomes)
|
|
Silberstein, 2017 |
Probably yes
Randomization with interactive-response technology |
Probably yes
No open randomization schedule or other ways to foresee randomization |
Probably yes
Patients, investigators, sponsor and trial staff were blinded |
Probably yes:
No high amounts of missing data, no difference between groups. |
Probably yes
All prespecified outcomes were reported. |
Probably no
All authors are employees or consultants at Teva Pharmaceuticals. |
Some concerns (all outcomes)
|
|
Lipton, 2020b |
Probably yes
Randomization with interactive-response technology |
Probably yes
No open randomization schedule or other ways to foresee randomization |
Probably yes
Patients, investigators, sponsor and trial staff were blinded |
Probably yes:
No high amounts of missing data, no difference between groups. |
Probably no
Patient reported outcomes for MSQoL and EQ-5D-5L were not prespecified in study protocol. |
Probably yes
“The authors maintained full editorial control of the manuscript and decision to submit for publication” |
Some concerns (all outcomes)
|
|
Sakai, 2021 |
Probably yes:
Randomization code with interactive-response technology |
Probably yes
Randomization was administered by external party |
Probably yes:
“Both patients and all parties involved in the investigation were blinded to the trial-group assignments” |
Probably yes:
No high amounts of missing data, no difference between groups. |
Probably yes:
All prespecified outcomes were reported. |
Probably no
“All authors contributed to writing the Introduction and Discussion sections.” Also, all authors are employees or received personal fees from the sponsor. |
Some concerns (all outcomes)
|
|
Detke, 2018 |
Probably yes:
“Computer-generated random sequence with interactive web-response system.” |
Probably yes:
No open randomization schedule or other ways to foresee randomization |
Probably no:
Were patients blinded? yes Were healthcare providers blinded? unknown Were data collectors blinded? unknown Were outcome assessors blinded? unknown Were data analysts blinded? unknown |
Probably yes:
No high amounts of missing data, no difference between groups. |
Probably yes:
All prespecified outcomes were reported. |
Probably no:
All authors are full-time employees, minor shareholders or received consultant fees from the sponsor. |
Some concerns (all outcomes)
|
|
Mulleners, 2020 |
Probably yes:
Computer generated random sequence |
Probably yes:
No open randomization schedule or other ways to foresee randomization |
Probably yes:
Sponsor, investigators, study staff and participants were masked during the entire trial. |
Probably yes:
No high amounts of missing data, no difference between groups |
Probably yes:
All prespecified outcomes were reported. |
Definitely no:
“The funder of the study and its employees and assignees were involved in study design, data collection, data analysis, data interpretation, and writing of all related reports and publications. All authors, including non sponsor authors, had full access to all study data and had final responsibility for the decision to submit for publication.” |
HIGH concerns (all outcomes)
|
|
Ford, 2020 |
Probably yes:
“Computer-generated random sequence with interactive web-response system.” |
Probably yes:
No open randomization schedule or other ways to foresee randomization |
Probably no:
Were patients blinded? yes Were healthcare providers blinded? unknown Were data collectors blinded? unknown Were outcome assessors blinded? unknown Were data analysts blinded? unknown |
Probably yes:
No high amounts of missing data, no difference between groups. |
Probably yes:
All prespecified outcomes were reported. |
Probably no:
“Data analyses were performed by Eli Lilly and Company.”
Two authors (CT and EL) were not employees/minor shareholders from sponsor, but were both cunsultants at Eli Lilly and Co. |
Some concerns (all outcomes)
|
Randomization: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
Allocation concealment: refers to the protection (blinding) of the randomization process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomization (performed at a site remote from trial location). Inadequate procedures are all procedures based on inadequate randomization procedures or open allocation schedules..
Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments, but this should not affect the risk of bias judgement. Blinding of those assessing and collecting outcomes prevents that the knowledge of patient assignment influences the process of outcome assessment or data collection (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is usually not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary. Finally, data analysts should be blinded to patient assignment to prevents that knowledge of patient assignment influences data analysis.
Lost to follow-up: If the percentage of patients lost to follow-up or the percentage of missing outcome data is large, or differs between treatment groups, or the reasons for loss to follow-up or missing outcome data differ between treatment groups, bias is likely unless the proportion of missing outcomes compared with observed event risk is not enough to have an important impact on the intervention effect estimate or appropriate imputation methods have been used.
Selective outcome reporting: Results of all predefined outcome measures should be reported; if the protocol is available (in publication or trial registry), then outcomes in the protocol and published report can be compared; if not, outcomes listed in the methods section of an article can be compared with those whose results are reported.
Other biases: Problems may include: a potential source of bias related to the specific study design used (e.g. lead-time bias or survivor bias); trial stopped early due to some data-dependent process (including formal stopping rules); relevant baseline imbalance between intervention groups; claims of fraudulent behavior; deviations from intention-to-treat (ITT) analysis; (the role of the) funding body (see also downgrading due to industry funding). Note: The principles of an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Overall judgement of risk of bias per study and per outcome measure, including predicted direction of bias (e.g. favors experimental, or favors comparator). Note: the decision to downgrade the certainty of the evidence for a particular outcome measure is taken based on the body of evidence, i.e. considering potential bias and its impact on the certainty of the evidence in all included studies reporting on the outcome.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 04-12-2023
Beoordeeld op geldigheid : 18-10-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodules is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de ‘samenstelling van de werkgroep’) die betrokken zijn bij de zorg voor patiënten met migraine of clusterhoofdpijn.
Samenstelling van de werkgroep
WERKGROEP
- Mevr. prof. dr. Gisela Terwindt (voorzitter), neuroloog, Leids Universitair Medisch Centrum, Leiden; NVN
- Dhr. dr. Wim Mulleners (voorzitter), neuroloog, Canisius-Wilhelmina Ziekenhuis, Nijmegen; NVN
- Mevr. drs. Judith Pijpers, neuroloog-in-opleiding, Leids Universitair Medisch Centrum, Leiden; NVN (tot oktober 2022)
- Dhr. dr. Guus Schoonman, neuroloog, Elisabeth-Tweesteden Ziekenhuis, Tilburg; NVN
- Mevr. dr. Natalie Wiendels, neuroloog/somnoloog, Zaans Medisch Centrum, Zaandam; NVN
- Dhr. dr. Rolf Fronczek, neuroloog/somnoloog, Leids Universitair Medisch Centrum, Leiden en Slaap-Waakcentrum, SEIN, Heemstede; NVN
- Mevr. dr. Poldi Wilbrink, neuroloog, Zuyderland ziekenhuis, Heerlen; NVN
- Mevr. Jennifer Trouerbach, verpleegkundige, Leids Universitair Medisch Centrum, Leiden; V&VN
- Mevr. Mieke Heitkamp, verpleegkundig specialist , Canisius Wilhelmina Ziekenhuis; V&VN
- Mevr. Lisette Verharen, verpleegkundig specialist (MANP), Elisabeth-TweeSteden Ziekenhuis, Tilburg; V&VN
- Mevr. dr. Attie Tuinenburg, ervaringsdeskundige; Patiëntenvereniging Hoofdpijnnet
- Mevr. Esmee Mulder, ervaringsdeskundige; Patiëntenvereniging Hoofdpijnnet
KLANKBORDGROEP
- Dhr. prof. dr. Frank Huygen, anesthesioloog, Erasmus MC, Rotterdam; NVA
- Mevr. dr. Fleur Sprangers, kinderneuroloog, Elisabeth-Tweesteden Ziekenhuis, Tilburg; NVK
- Mevr. drs. Arianne Verburg-Oorthuizen, huisarts; NHG
Met ondersteuning van:
- Dhr. drs. Toon Lamberts, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. dr. Charlotte Michels, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. drs. Beatrix Vogelaar, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigden van de patiëntenvereniging Hoofdpijnnet te betrekken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kop “Waarden en voorkeuren van patiënten”). De conceptrichtlijn is tevens voor commentaar voorgelegd aan Hoofdpijnnet en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Gemelde belangen |
Ondernomen actie |
|
Mulleners (voorzitter) |
Functie: neuroloog |
|
|
Geen restrictie |
|
Terwindt (voorzitter) |
Functie: neuroloog, hoogleraar neurologie Werkgever: LUMC, Leiden |
Betrokken bij:
|
|
Extra kritisch commentaar gevraagd van onafhankelijke reviewers tijdens commentaarfase |
|
Fronczek |
Functie: 0.8fte - neuroloog (LUMC). 0.2fte - neuroloog/somnoloog Werkgever: LUMC, Leiden en Slaap-Waakcentrum, SEIN, Heemstede
|
|
CHIANTI en REGON trial: De middelen zijn nog niet geregistreerd voor clusterhoofdpijn in Nederland; trials zijn nog niet gepubliceerd. |
Extra kritisch commentaar gevraagd van onafhankelijke reviewers tijdens commentaarfase |
|
Heitkamp-van Deursen |
Functie: Verpleegkundig Specialist (specialisatie Hoofdpijn) Werkgever: CWZ, Nijmegen |
Geen |
Geen |
Geen restrictie |
|
Huygen (klankbord groep) |
Functie: hoogleraar anesthesiologie pijngeneeskunde Werkgever: 0.9fte ErasmusMC Rotterdam, 0.1fte UMC Utrecht |
|
Geen |
Geen restrictie |
|
Mulder |
Ervaringsdeskundige; Hoofdpijnnet
|
Geen |
Geen |
Geen restrictie |
|
Pijpers (tot oktober 2022) |
Functie: AIOS Neurologie Werkgever: LUMC, Leiden |
PhD kandidaat Neurologie bij het LUMC (onbetaald) Titel: 'The clinical aspects and management of chronic migraine' Financiering: werd betaald vanuit een persoonlijke LUMC beurs en een VIDI beurs van Gisela Terwindt (91711319). |
Geen |
Geen restrictie |
|
Schoonman |
Functie: Neuroloog Werkgever: ETZ, Tilburg |
Onderzoeker digitale communicatie in de zorg, TU Tilburg (onbetaald) |
Aantal jaar geleden local PI bij twee clinical trials naar het effect van CGRP Antagonisten:
|
Geen restrictie |
|
Sprangers (klankbord groep) |
Functie: Kinderarts, kinderneuroloog Werkgever: Spaarne Gasthuis, Haarlem |
Geen |
Geen |
Geen restrictie |
|
Trommelen-Verharen |
Functie: verpleegkundig specialist Werkgever: ETZ, Tilburg |
|
Geen |
Geen restrictie |
|
Trouerbach-Kraan |
Functie: verpleegkundig consulent Werkgever: LUMC, Leiden |
|
Geen |
Geen restrictie |
|
Tuinenburg |
Ervaringsdeskundige; Hoofdpijnnet
|
|
Als ZZP’er literatuuronderzoek gedaan m.b.t. meest recente richtlijnen over de behandeling van hemofilie en van immuun trombocytopenie (ITP).
|
Geen restrictie |
|
Verburg-Oorthuizen (klankbord groep) |
Functie: 0.4fte - huisarts, 0.4fte - senior wetenschappelijk medewerker NHG |
Geen |
Geen |
Geen restrictie |
|
Wiendels |
Functie: neuroloog Werkgever: Zaans Medisch Centrum, Zaandam |
|
Geen |
Geen restrictie |
|
Wilbrink |
Functie: neuroloog Werkgever: Zuyderland, Heerlen |
lid adviesraad Teva (betaald) |
Geen. Eerste auteur bij publicatie over ONS: Wilbrink, et al. "Safety and efficacy of occipital nerve stimulation for attack prevention in medically intractable chronic cluster headache (ICON): a randomised, double-blind, multicentre, phase 3, electrical dose-controlled trial." Lancet Neurology (2021). DOI: 10.1016/S1474-4422(21)00101-0. |
Extra kritisch commentaar gevraagd van onafhankelijke reviewers tijdens commentaarfase |
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module 1 Gon-injecties |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen financiële gevolgen verwacht.
|
|
Module 2 Neuromodulatie |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen financiële gevolgen verwacht.
|
|
Module 3 Beeldvorming |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen financiële gevolgen verwacht.
|
|
Module 4 organisatie van zorg - clusterhoofdpijn |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen financiële gevolgen verwacht.
|
|
Module 5 Monoklonale antilichamen - migraine |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht.
|
|
Module 6 organisatie van zorg - migraine |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht.
|
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met migraine of clusterhoofdpijn. Tevens zijn er knelpunten aangedragen door het Nederlands Huisartsen Genootschap, Vereniging innovatieve Geneesmiddelen, Hoofdpijnnet, Nederlandse Vereniging voor Kindergeneeskunde, Inspectie Gezondheidszorg en Jeugd, Nederlandse Vereniging van Ziekenhuizen, Zelfstandige Klinieken Nederland, Zorgverzekeraars Nederland, via enquête. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan alle betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Table of excluded studies
|
Author, year |
Reason for exclusion |
|
Siddigui2021 |
CGRP versus botox (wrong control) |
|
Diener2021 |
subgroup (chronic migraine with MOH) from Lipton2020 (no original trial-data) |
|
Kudrow2021 |
open label, no placebo/usual care group (wrong control) |
|
Tepper2019 |
subgroup (chronic migraine with MOH) from Tepper2017 (no original trial-data) |
|
Lipton2021 |
additional analysis on Lipton2020, outcomes were most bothersome symptom, patient global impression of change (very much improvement) (wrong outcome) |
|
Marmura2021 |
subgroup (chronic migraine with MOH) from Lipton2020 (no original trial-data) |
|
Frattale2021 |
observational, no controlgroup with placebo/usual care (wrong design, wrong control) |
|
Lipton2021 |
additional analysis on Tepper2017, outcomes per subtype (no allodynia, moderate-to-severe allodynia) (wrong outcome) |
|
Ferrari2019 |
mixed episodic and chronic migraine, no subgroup analysis |
|
de Icco2020 |
no controlgroup with placebo/usual care (wrong control) |
|
Tepper2020 |
no controlgroup with placebo/usual care (wrong control) |
|
Tepper2021 |
additional analysis on Goadsby2017(episodic) and Tepper2017, outcomes for different types of headache medication users (wrong outcome) |
|
Lipton2021 |
additional analysis on Goadsby2017(episodic) and Tepper2017(chronic), new outcomes were pain intensity (wrong outcome) |
|
Lipton2021 |
additional analysis on Tepper2017, outcomes were different types of reversion from chronic to episodic migraine |
|
Brandes2020 |
additional analysis on Tepper2017, no new outcomes (wrong outcome) |
|
Tepper2021 |
additional analysis on Tepper2017, outcomes per response category (wrong outcome) |
|
Lipton2021 |
subgroup (chronic migraine and comorbid depression) from Silberstein2017 (no original trial) |
|
Spierings2021 |
subgroup (per country) from Ferrari2019 (wrong outcome) |
|
Pazdera2021 |
subgroup (per number of prior preventive treatments) from Ferrari2019 (wrong outcome) |
|
Friedman2020 |
narrative review (wrong study design) |
|
Silberstein2020 |
subgroup (chronic migraine with MOH) from Silberstein2017 (no original trial-data) |
|
Fiedler-Kelly2020 |
pooled analysis, no original trial data from Dodick2018, Silberstein2017 and Bigal2015 (wrong study design) |
|
Ashina2021 |
Open label extentsion phase of Ferrari2019, no comparison with placebo and CM/EM mixed (wrong design, wrong population) |
|
Weatherall2021 |
Overview article, no original trial data (wrong design) |
|
Spierings2021 |
Open label extentsion phase of Ferrari2019, no comparison with placebo and CM/EM mixed (wrong design, wrong population) |
|
Ashina2021 |
pooled analysis, no original trial data from Silberstein2017 and Ferrari2019 (wrong study design) |
|
Lipton2020 |
additional analysis on Silberstein2017, outcomes were different types of reversion from chronic to episodic migraine |
|
Silberstein2021 |
additional analysis on Silberstein2017, outcomes were results for responders and non-responders, no original trial data (wrong outcome) |
|
Citrome2021 |
pooled analysis, no original trial data from Detke2018, Mulleners2020, Skljarevski2018 (EM) and Stauffer2018 (EM) (wrong study design) |
|
Schwedt2021 |
additional analysis on Mulleners2020 (EM+CM), no outcomes per subgroup (wrong population) |
|
Ament2021 |
additional analysis on Detke2018, outcomes were reduction in number of severe MMD, and mean severity of not-severe MMDs (wrong outcome) |
|
Smitherman2020 |
pooled subgroup analysis on Detke2018 and EVOLVE (EM), outcomes for patients with history of anxiety/depression (wrong population) |
|
Okonkwo2021 |
subgroup (history of failure of 3-4 preventive medication categories) from Mulleners2020 (wrong population) |
|
Kuruppu2021 |
subgroup (no benefit from commonly prescribed preventive treatments) from Mulleners2020 (wrong population) |
|
Oakes2020 |
additional analysis on Detke2018, and EVOLVE I&II (EM), cardiovascular outcomes (wrong population, wrong outcome) |
|
Stauffer2020 |
additional analysis on Detke2018, and EVOLVE I&II (EM), injection-site-related adverse events (wrong population, wrong outcome) |
|
Pozo-Rosich2020 |
additional analysis on Detke2018, and EVOLVE I&II (EM), consistency of treatment effect (weekly migraine headache days, wrong outcome) |
|
Tatsuoka2021 |
patients with episodic migraine (wrong population) |
|
Ailani2020 |
additional analysis on Detke2018, and EVOLVE I&II (EM), outcome total pain burden (combination of frequency, duration and severity, wrong outcome) |
|
Scott2020 |
non-systematic review (wrong study design) |
|
Reuter2021 |
results from open-label period of mulleners2020, no control group with placebo/usual care (wrong comparison) |
|
Cosslett2021 |
scholarly review of recently published JNeurosci articles, non-systematic review (wrong study design) |
|
Hirata2021 |
open label extension phase of Sakai2020, no controlgroup with placebo/usual care (wrong comparison) |
|
Ailani2020 |
additional analysis on Detke2018, and EVOLVE I&II (EM), on patients with previously failed onabotulinumtoxinA (wrong population) |
|
Yang2020 |
subgroup analysis (taiwanese students) from Detke2018 and EVOLVE II (EM) (wrong population) |
|
Bangs2020 |
pooled analysis on Dodick2014, Skljarevski2018, Stauffer2018, Skljarevski2018 (all EM) and Detke2018. No original trial data on adverse events. |
|
australian prescriber2020 |
overview article, no original trial data (wrong publication type) |
|
Nichols2019 |
pooled analysis on Detke2018 and EVOLVE I&II (EM), subset with good early improvement (no original trial data, wrong population) |
|
Vo2019 |
Search to 2017 only for erenumab, less complete than Soni2021 (not recent enough) |
|
Mitsikostas2017 |
narrative review (wrong study design) |
|
Winner2019 |
additional analysis on Silberstein2017, pain-related clinical measures (no original trial data, wrong outcome) |
|
Ashina2018 |
additional analysis on Tepper2017, no new outcomes (wrong outcome) |
|
Ruff2019 |
additional analysis on Detke2018, on patients with a history of preventive treatment failure (no original trial data, wrong population) |
|
Garland2019 |
Included only trials with episodic migraine (wrong population) |
|
Cohen2017 |
additional analysis on Bigal2015, subgroup of patients treated with other migraine preventive medicines (no original trial data, wrong population) |
|
VanderPluym2018 |
additional analysis on Bigal2015, subgroup of patients treated with other migraine preventive medicines (no original trial data, wrong population) |
|
Lionetto2019 |
narrative review (wrong study design) |
|
Bigal2016 |
additional analysis on Bigal2015, early outcomes for number of headache hours and headache days of at least moderate severity (wrong outcome) |
|
Overeem2019 |
on patients with episodic migraine (wrong population) |
|
Israel2018 |
non-systematic review (wrong study design) |
|
Lamb2019 |
non-systematic review (wrong study design) |
|
Di Tanna2019 |
utility outcomes patients from Tepper2017 (wrong outcome) |
|
|
Conference abstracts (wrong study design) |
|
Raffaelli2019 |
non-systematic review (wrong study design) |
|
Bigal2014 |
|
|
Förderreuther2018 |
additional analysis on Detke2018, and EVOLVE I&II (EM), outcome was maintenance of effect (no original trial data, wrong outcome) |
|
Halker2019 |
additional analysis on Bigal2015, sustained 50% responder rate and other outcomes not selected for PICO (wrong outcome) |
|
Frank2021 |
minder recent gezocht dan Lu2021 (-) minder uitkomsten dan Lu2021 |
|
Yan2021 |
less relevant studies than Lu, 2021 |
|
Soni2021 |
only outcomes until week 12 (+) RoB assessment |
|
Masoud2021 |
less outcomes than Lu2021, (-) only outcomes for after 6, 8 and 12 weeks of treatment (+) RoB assessment |
|
Soni2021 |
No transparant data-extraction reported for meta-analysis |
|
Omaer2021 |
less relevant studies than Lu, 2021 |
|
Yang2021 |
less relevant studies than Lu, 2021 |
|
Binceno-Casado2020 |
less relevant studies than Lu, 2021 |
|
Alasad2020 |
less relevant studies than Lu, 2021 |
|
Arca2020 |
less relevant studies than Lu, 2021 |
|
Drellia2021 |
less relevant studies than Lu, 2021 |
|
Gao2020 |
less relevant studies than Lu, 2021 |
|
Forbes2020 |
less relevant studies than Lu, 2021 |
|
Zhao2021 |
only galcanezumab |
|
Chen2021 |
less relevant studies than Lu, 2021 |
|
Kokoti2020 |
less relevant studies than Lu, 2021 |
|
Han2018 |
less relevant studies than Lu, 2021 |
|
Khan2019 |
less relevant studies than Lu, 2021 |
|
Lattanzi2019 |
less relevant studies than Lu, 2021 |
|
Zhu2019 |
less relevant studies than Lu, 2021 |
Literature search strategy
Zoekverantwoording
Algemene informatie
|
Richtlijn: NVN Hoofdpijn |
|
|
Uitgangsvraag: Wat zijn de effecten van monoklonale antilichamen in vergelijking met placebo of standaard zorg in de behandeling van patiënten met chronische migraine? |
|
|
Database(s): Ovid/Medline, Embase |
Datum: 5-10-2021 |
|
Periode: 2000- |
Talen: n.v.t. |
|
Literatuurspecialist: Ingeborg van Dusseldorp |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting:
Voor deze vraag is gezocht met de volgende elementen:
Chronische migraine EN monoklonale antilichamen
De sleutelartikelen worden gevonden |
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase en Ovid/Medline is op 5 oktober 2021 met relevante zoektermen gezocht naar systematische reviews, RCTs en observationele studies over effecten van monoklonale antilichamen in vergelijking met placebo of standaard zorg in de behandeling van patiënten met chronische migraine. De literatuurzoekactie leverde 374 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
70 |
50 |
75 |
|
RCTs |
215 |
169 |
245 |
|
Observationele studies |
59 |
40 |
54 |
|
Overig |
|
|
|
|
Totaal |
|
|
374 |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#18 |
#16 AND #17 sleutelartikelen gevonden |
3 |
|
#17 |
#8 OR #9 OR #10 |
344 |
|
#16 |
#13 OR #14 OR #15 |
3 |
|
#15 |
safety AND efficacy AND of AND galcanezumab AND in AND patients AND for AND whom AND previous AND migraine AND preventive AND medication AND from AND two AND to AND four AND categories AND had AND failed AND mulleners |
1 |
|
#14 |
fremanezumab AND for AND the AND preventive AND treatment AND of AND chronic AND migraine AND silberstein AND 2017 NOT aycardi |
1 |
|
#13 |
safety AND efficacy AND erenumab AND for AND preventive AND treatment AND of AND chronic AND migraine AND tepper AND 2017 AND lancet NOT wang |
1 |
|
#12 |
#10 NOT #9 NOT #8 OBS |
59 |
|
#11 |
#9 NOT #8 RCT |
215 |
|
#10 |
#4 AND #7 |
191 |
|
#9 |
#4 AND #6 |
258 |
|
#8 |
#4 AND #5 SR |
70 |
|
#7 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6719582 |
|
#6 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3302394 |
|
#5 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#4 |
#3 AND [1-1-2000]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
551 |
|
#3 |
#1 AND #2 |
1526 |
|
#2 |
'calcitonin gene related peptide'/exp OR 'monoclonal antibody'/exp OR 'erenumab'/exp OR 'fremanezumab'/exp OR 'galcanezumab'/exp OR 'eptinezumab'/exp OR 'cgrp*':ti,ab,kw OR 'calcitonin gene related peptide*':ti,ab,kw OR 'aimovig':ti,ab,kw OR emgality:ti,ab,kw OR 'amg 334':ti,ab,kw OR 'amg334':ti,ab,kw OR 'erenumab':ti,ab,kw OR 'ajovy':ti,ab,kw OR 'fremanezumab':ti,ab,kw OR 'lbr 101':ti,ab,kw OR 'lbr101':ti,ab,kw OR 'pf 04472429':ti,ab,kw OR 'pf 4472429':ti,ab,kw OR 'pf04472429':ti,ab,kw OR 'pf4472429':ti,ab,kw OR 'rn 307':ti,ab,kw OR 'rn307':ti,ab,kw OR 'tev 48125':ti,ab,kw OR 'tev48125':ti,ab,kw OR 'emgality':ti,ab,kw OR 'galcanezumab':ti,ab,kw OR 'ly 2951742':ti,ab,kw OR 'ly2951742':ti,ab,kw OR 'ald 403':ti,ab,kw OR 'ald403':ti,ab,kw OR 'eptinezumab':ti,ab,kw OR 'vyepti':ti,ab,kw |
666521 |
|
#1 |
'transformed migraine'/exp OR ('migraine'/mj AND 'chronic disease'/mj) OR (((chronic* OR transformed) NEAR/3 migraine*):ti,ab,kw) |
8221 |
|
# |
Searches |
Results |
|
13 |
11 not 10 not 9 OBS |
40 |
|
12 |
10 not 9 RCT |
169 |
|
11 |
5 and 8 |
77 |
|
10 |
5 and 7 |
207 |
|
9 |
5 and 6 SR |
50 |
|
8 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
3957302 |
|
7 |
(exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) |
2173284 |
|
6 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
522688 |
|
5 |
4 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
373 |
|
4 |
limit 3 to yr="2000 -Current" |
418 |
|
3 |
1 and 2 |
418 |
|
2 |
Calcitonin Gene-Related Peptide/ or exp Antibodies, Monoclonal/ or erenumab.rn. or fremanezumba.rn. or galcanezumab.rn. or eptinezumab.rn. or cgrp*.ti,ab,kf. or calcitonin gene related peptide*.ti,ab,kf. or aimovig.ti,ab,kf. or amg 334.ti,ab,kf. or amg334.ti,ab,kf. or erenumab.ti,ab,kf. or ajovy.ti,ab,kf. or fremanezumab.ti,ab,kf. or lbr 101.ti,ab,kf. or lbr101.ti,ab,kf. or "pf 04472429".ti,ab,kf. or pf 4472429.ti,ab,kf. or pf04472429.ti,ab,kf. or pf4472429.ti,ab,kf. or rn 307.ti,ab,kf. or rn307.ti,ab,kf. or tev 48125.ti,ab,kf. or tev48125.ti,ab,kf. or emgality.ti,ab,kf. or galcanezumab.ti,ab,kf. or ly 2951742.ti,ab,kf. or ly2951742.ti,ab,kf. or ald 403.ti,ab,kf. or ald403.ti,ab,kf. or eptinezumab.ti,ab,kf. or vyepti.ti,ab,kf. |
270076 |
|
1 |
(exp Migraine Disorders/ and chronic disease/) or ((chronic* or transformed) adj3 migraine*).ti,ab,kf. |
4029 |