Effectiviteit van high flow bij kinderen
Uitgangsvraag
Wat is de plaats van de high flow nasale canule bij patiënten met dreigende respiratoire insufficiëntie?
Aanbeveling
Overweeg high flow bij patiënten met een dreigende respiratoire insufficiëntie bij bronchiolitis wanneer:
- De zuurstofbehoefte meer dan 2L/ minuut met 100% toegediende O2 is.
- Er bij klinische beoordeling een toename in de respiratoire distress is. (Zie de module 'Monitoring').
Wees terughoudend met high flow toediening bij patiënten met luchtweg- en longaandoeningen anders dan bronchiolitis.
Overwegingen
De onderstaande overwegingen gelden in principe voor kinderen met bronchiolitis. Voor de subgroepen ‘kinderen met een status astmaticus ’en ‘kinderen met een dreigende respiratoire insufficiëntie ten gevolge van pneumonie’ zijn echter afwijkende en aanvullende overwegingen van belang met betrekking tot de voor- en nadelen van de interventie en kwaliteit van het bewijs. Daarnaast is er voor deze groep een afzonderlijke aanbeveling geformuleerd.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Wanneer gekeken wordt naar de effectiviteit van de high flow bij de behandeling van patiënten met bronchiolitis en een dreigende respiratoire insufficiëntie, ten aanzien van therapiefalen (cross-over naar een andere beademings-ondersteuning, opname op een kinder-IC), mortaliteit, comfort en het voorkomen van ernstige complicaties dan kan op basis van de huidige literatuur worden gesteld dat de behandeling met high flow mogelijk leidt tot een kleinere kans op therapiefalen in vergelijking met low flow zuurstoftherapie. Op grond van de literatuur is er geen sprake van een lager aantal opnames op de kinder-IC door high flow. Er wordt geen toename in complicaties gezien zoals air-leak syndroom in vergelijking met low flow zuurstoftherapie.
In de IC-setting lijkt high flow in vergelijking met CPAP een hogere kans op therapiefalen te geven, waarbij er wel een grotere mate van comfort werd gezien in de high flow groep.
Er zijn geen studies beschikbaar over het vóórkomen van therapiefalen bij patiënten met status astmaticus, pneumonie, preschool wheeze, luchtweginfecties en virale wheeze of peuterastma. De werkgroep is dan ook van mening dat terughoudendheid is geboden bij starten met high flow bij patiënten met een andere luchtweg- of longaandoeningen dan bronchiolitis. Er is een risico op verslechtering van het onderliggend probleem en het niet adequaat behandelen van het primaire probleem.
De bewijskracht voor vrijwel alle cruciale uitkomstmaten is laag. Dit komt voornamelijk door het beperkt aantal studies met tevens kleine patiëntaantallen. Bij de helft van de studies werd onderzoek gedaan op de spoedeisende hulp en/of kinderafdeling en de andere helft van de studies werd uitgevoerd op de (kinder-)intensive care, waardoor de resultaten maar beperkt samen konden worden geanalyseerd. Tevens gebruikten de studies verschillende scores om de mate van respiratoire distress te meten, waarbij geen enkele score daarvoor gevalideerd was.
Tenslotte zijn de studies niet geblindeerd waardoor er een verhoogd risico op bias bestaat bij het vaststellen van de overwegend subjectieve cruciale uitkomstmaten.
Bij patiënten die zich presenteren met een bronchiolitis waarbij de zuurstofbehoefte meer dan 2 liter/minuut 100% O2 bedraagt en met een verhoogde ademarbeid, is de werkgroep van mening dat behandeling met zuurstof middels high flow op de kinderafdeling wel een plaats heeft. Het voordeel ten opzichte van low flow is dat er minder kans is op therapiefalen.
Voor de behandeling van andere luchtweg- en longproblemen zoals astma, en een pneumonie, is de effectiviteit van high flow onduidelijk. De werkgroep is van mening dat bij een hoge zuurstofbehoefte en ademarbeid high flow een alternatief kan zijn voor het non-rebreathing masker. Of dit een gunstig effect heeft zal per patiënt beoordeeld moeten worden.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Wanneer gekeken wordt naar het patiënt-perspectief is het comfort van de geboden interventie een cruciale uitkomstmaat. Hoewel de literatuur slechts zeer beperkt bewijs geeft, wordt in de praktijk bij patiënten met bronchiolitis gezien dat de high flow meer comfort biedt dan CPAP. Wanneer de patiënt high flow toelaat en de mate van respiratoire insufficiëntie intensievere ondersteuning vergt, verdient high flow dan ook de voorkeur boven CPAP voor wat betreft comfort. Bij een andere medische indicatie dan bronchiolitis is geen onderzoek beschikbaar en is de expert opinion te beperkt. Er kan dan ook geen nadere aanbeveling gedaan worden.
Kosten (middelenbeslag)
Er zijn geen gegevens over de kosteneffectiviteit van high flow bekend. Zowel in de aanschaf van het high flow systeem als in de disposables zijn de kosten van het gebruik van de high flow aanzienlijk hoger dan bij het gebruik van een zuurstofbril. Hierbij kunnen de disposables gemiddeld een week per kind gebruikt worden. Met het gebruik van high flow therapie bij patiënten met bronchiolitis kunnen voordelen aanwezig zijn in het gebied van comfort. Mogelijk kan met high flow therapiefalen voorkomen worden waardoor behandeling met een andere intensievere ademhalingsondersteuning niet noodzakelijk wordt.
Aanvaardbaarheid voor de overige relevante stakeholders
Hoewel er vanuit de literatuur beperkte evidence is, is de werkgroep op basis van deze beperkte literatuur en de expert opinion van mening dat bij kinderen met bronchiolitis met zuurstofbehoefte boven 2 liter/minuut 100% O2 het starten van high flow kan worden overwogen.
De werkgroep kan zich echter voorstellen dat een kinderafdeling wacht met eventuele implementatie van high flow tot er betere evidence is over de effectiviteit en toegevoegde waarde.
Haalbaarheid en implementatie
De inzet van high flow therapie vereist de aanschaf van materialen specifiek voor deze vorm van ondersteuning. Naast de vaste apparatuur moeten er ook kosten voor speciale disposable materialen worden gemaakt per patiënt die aanzienlijk hoger liggen dan voor de gebruikelijke vormen van zuurstoftherapie. Daarnaast is scholing van het zorgpersoneel van groot belang. Tenslotte moet er een protocol komen dat de zorgverlener dient bij het uitvoeren van de high flow zorg en handelingen. De werkgroep beveelt aan een dergelijk protocol in afstemming met de lokale kinder-IC op te stellen. Wanneer klinieken besluiten om high flow te gaan gebruiken kan deze richtlijn als leidraad gelden, waarbij afstemming met de lokale kinder intensive care een voorwaarde is. Zoals bij elke nieuw te implementeren protocol verdient het de aanbeveling hiervoor enkele werknemers aan te wijzen die de implementatie binnen hun aandachtsgebied gaan uitvoeren. Het gaat bij de implementatie van deze richtlijn met name om de volgende vragen: welke patiënten starten met high flow, wanneer in het ziekteproces, hoe worden deze kinderen gemonitord en wanneer wordt overlegd met de kinder-intensive care. Al deze vragen kunnen van te voren in een lokaal protocol te worden vastgelegd in samenspraak met het medische en verpleegkundige team. Wat betreft de aanschaf van de systemen zal gekeken moeten worden voor welk systeem gekozen wordt. Hierbij is ook van belang te kijken naar het aantal beschikbare monitorplekken.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Hoewel het wetenschappelijke bewijs laag is, is de werkgroep van mening dat bij patiënten met een dreigende respiratoire insufficiëntie in geval van een bronchiolitis high flow een veilige ondersteuning kan zijn die therapiefalen lijkt te verminderen. Er zijn geen aanwijzingen dat het gebruik van high flow tot meer ernstige complicaties zoals een pneumothorax, pneumomediastinum of air-leak syndroom (definitie van voorgenoemde complicaties samen) leidt.
Kinderen met status astmaticus en pneumonie
Er is geen wetenschappelijk bewijs voor het gebruik van high flow bij patiënten met een status astmaticus, pneumonie of andere luchtweg- of longaandoeningen ten aanzien van therapiefalen.
Onderbouwing
Achtergrond
Sinds enkele jaren is er een grote toename van het gebruik van high flow zuurstoftherapie (verder: high flow) voor patiënten met toegenomen zuurstofbehoefte en/of ademarbeid. Het gebruik van de high flow is inmiddels niet meer alleen voorbehouden aan de intensive care (IC) maar wordt ook in toenemende mate gebruikt op de algemene kinderafdelingen en de spoedeisende hulp. In de praktijk is er behoefte aan kaders waarbinnen een veilig gebruik van de high flow kan worden gegarandeerd, gebaseerd op de beperkte huidige literatuur, in de ondersteuning van patiënten met respiratoire klachten en zuurstofbehoefte op de kinderafdeling.
Conclusies / Summary of Findings
Studies uitgevoerd op de spoedeisende hulp/algemene kinderafdeling
Cruciale uitkomsten
|
Redelijk GRADE |
Therapiefalen (dat wil zeggen: de noodzaak tot cross-over naar een andere ademhalingsondersteunende techniek en/of opname op de (P)ICU))
Behandeling met high flow leidt waarschijnlijk tot een lagere kans op therapiefalen vergeleken met standaard zuurstof middels een neusbril bij patiënten opgenomen met bronchiolitis op de spoedeisende hulp/kinderafdeling.
Bronnen: (Franklin, 2018; Kepreotes, 2018) |
|
Laag GRADE |
Opname op (P)ICU
Behandeling met high flow lijkt niet tot minder opnames op de (kinder)intensive care te leiden vergeleken met standaard zuurstof middels een neusbril bij patiënten opgenomen met bronchiolitis op de spoedeisende hulp/kinderafdeling.
Bronnen: (Franklin, 2018; Kepreotes, 2018) |
|
Zeer laag GRADE |
Opname op (P)ICU
Het is onduidelijk of high flow leidt tot minder opnames op de (P)ICU vergeleken met standaard zuurstof middels een neusbril bij patiënten opgenomen met astma exacerbaties op de spoedeisende hulp/kinderafdeling.
Bronnen: (Ballestero, 2018) |
|
Redelijk GRADE |
Mortaliteit
High flow leidt waarschijnlijk niet tot meer of minder sterfte vergeleken met standaard zuurstof middels een neusbril bij patiënten opgenomen met bronchiolitis op de spoedeisende hulp/kinderafdeling.
Bronnen: (Franklin, 2018; Kepreotes, 2018) |
|
Laag GRADE |
Mortaliteit
High flow leidt mogelijk niet tot meer of minder sterfte vergeleken met standaard zuurstof middels een neusbril bij patiënten opgenomen met astma exacerbaties op de spoedeisende hulp/kinderafdeling.
Bronnen: (Ballestero, 2018) |
|
Laag GRADE |
Ernstige complicaties
Er lijkt geen verschil te zijn in het optreden van ernstige complicaties ten gevolge van de behandeling met high flow of standaard zuurstof middels een neusbril bij patiënten opgenomen met bronchiolitis op de spoedeisende hulp/kinderafdeling.
Bronnen: (Franklin, 2018; Kepreotes, 2018) |
|
Zeer laag GRADE |
Ernstige complicaties
Het is onduidelijk welk effect high flow heeft op de prevalentie van ernstige complicaties (zoals pneumothorax, pneumomediastinum, air leak syndroom) bij patienten met astma exacerbaties op de spoedeisende hulp/kinderafdeling vergeleken met standaard zuurstof middels een neusbril.
Bronnen: (Ballestero, 2018) |
|
- GRADE |
Comfort
Het is onduidelijk welk effect high flow heeft op het comfort bij patiënten opgenomen op de spoedeisende hulp/kinderafdeling. |
Belangrijke uitkomsten
|
Laag GRADE |
Opnameduur
Behandeling met high flow lijkt gepaard te gaan met een even lange opnameduur als behandeling met low flow bij patiënten opgenomen met bronchiolitis op de spoedeisende hulp/kinderafdeling.
Bronnen: (Franklin, 2018; Kepreotes, 2018) |
|
Zeer laag GRADE |
Opnameduur
Het is onduidelijk welk effect high flow heeft op de opnameduur bij patiënten met astma exacerbaties op de spoedeisende hulp/kinderafdeling vergeleken met low flow.
Bronnen: (Ballestero, 2018) |
|
Laag GRADE |
Duur aan de beademing
De duur van de behandeling met high flow bij patiënten opgenomen met bronchiolitis op de spoedeisende hulp/kinderafdeling verschilt waarschijnlijk niet van de duur van de behandeling met low flow.
Bronnen: (Franklin, 2018; Kepreotes, 2018) |
|
- GRADE |
Minder ernstige complicaties
Het is onduidelijk welk effect high flow heeft op het vóórkomen van minder ernstige complicaties bij patiënten opgenomen op de spoedeisende hulp/kinderafdeling.
Bronnen: (Ballestero, 2018) |
|
- GRADE |
Ademarbeid en delay (vertraging in opschaling naar meer intensieve zorg)
Het is onduidelijk welk effect high flow heeft op ademarbeid en delay bij patiënten opgenomen op de spoedeisende hulp/kinderafdeling. |
Studies uitgevoerd op de (kinder-)intensive care
Cruciale uitkomsten
|
Laag GRADE |
Therapiefalen (bestaande uit cross-over naar een andere beademingstechniek, onveranderde of verslechterde klinische parameters of verhoging in de mWCAS of EDIN score).
Behandeling met high flow lijkt een hogere kans te geven op therapiefalen vergeleken met CPAP bij patiënten opgenomen met bronchiolitis op de (kinder-)intensive care.
Bronnen: (Sarkar, 2018; Milesi, 2017) |
|
Laag GRADE |
Therapiefalen (bestaande uit cross-over naar een andere beademingstechniek, onveranderde of verslechterde klinische parameters of verhoging in de mWCAS of EDIN score).
Behandeling met high flow lijkt een lagere kans te geven op therapiefalen vergeleken met een zuurstofmasker bij patiënten opgenomen met bronchiolitis op de (kinder-)intensive care.
Bronnen: (Ergul, 2018) |
|
Redelijk GRADE |
Mortaliteit
High flow leidt waarschijnlijk niet tot meer of minder sterfte vergeleken met low flow bij patiënten opgenomen met bronchiolitis op de (kinder-)intensive care.
Bronnen: (Sarkar, 2018; Milesi, 2017) |
|
Laag GRADE |
Mortaliteit
Het is onduidelijk welk effect high flow heeft op mortaliteit vergeleken met een zuurstofmasker bij patiënten opgenomen met bronchiolitis op de (kinder-)intensive care.
Bronnen: (Ergul, 2018) |
|
Laag GRADE |
(Dis)comfort
Er zijn aanwijzingen dat high flow leidt tot minder discomfort vergeleken met CPAP bij patiënten opgenomen met bronchiolitis op de (kinder)intensive care.
Bronnen: (Sarkar, 2018; Milesi, 2017) |
|
Laag GRADE |
Ernstige complicaties
Er lijken geen aanwijzingen te zijn dat behandeling met high flow leidt tot een toename van ernstige complicaties (zoals pneumothorax, pneumomediastinum, air leak syndroom) vergeleken met low-flow bij patiënten opgenomen met bronchiolitis op de (kinder)intensive care.
Bronnen: (Sarkar, 2018; Milesi, 2017) |
|
- GRADE |
Ademarbeid en delay
Het is onduidelijk welk effect high flow heeft op ademarbeid en delay van intensivering van zorg bij patiënten opgenomen op de (kinder-)intensive care. |
Belangrijke uitkomsten
|
GRADE |
Opnameduur
Er zijn aanwijzingen dat behandeling met high flow niet leidt tot een kortere of langere opnameduur bij patiënten met bronchiolitis opgenomen op de (kinder-)intensive care vergeleken met CPAP.
Bronnen: (Sakar, 2018) |
|
Laag GRADE |
Opnameduur
Er zijn aanwijzingen dat behandeling met high flow leidt tot een kortere opnameduur bij patiënten met bronchiolitis opgenomen op de (kinder-) intensive care vergeleken met een zuurstofmasker.
Bronnen: (Ergul, 2018) |
|
Laag GRADE |
Minder ernstige complicaties (onder andere huidlaesies, oogirritaties)
Er zijn aanwijzingen dat behandeling met high flow mogelijk leidt tot een lagere prevalentie van minder ernstige complicaties bij patiënten met bronchiolitis opgenomen op de (kinder-) intensive care vergeleken met CPAP
Bronnen: (Sarkar, 2018; Milesi, 2017) |
|
Zeer laag GRADE |
Beademingsduur
Het is onduidelijk of behandeling met high flow leidt tot een kortere behandelingsduur bij patiënten met bronchiolitis op de (kinder-) intensive care vergeleken met CPAP.
Bronnen: (Sarkar, 2018) |
|
Zeer laag GRADE |
Beademingsduur
Het is onduidelijk of behandeling met high flow leidt tot een kortere beademingsduur bij patiënten met bronchiolitis op de (kinder-) intensive care vergeleken met zuurstofmasker.
Bronnen: (Ergul, 2018) |
|
- GRADE |
Ademarbeid en delay (uitstel van opschaling naar meer intensieve zorg)
Het is onduidelijk welk effect high flow heeft op ademarbeid en delay bij patiënten opgenomen op de (kinder-) intensive care. |
Samenvatting literatuur
Beschrijving studies
De literatuuruitwerking is onderverdeeld in studies die zijn uitgevoerd op de algemene kinderafdeling/ spoedeisende hulp en in studies die zijn uitgevoerd op de (kinder-)IC.
Studies uitgevoerd op de algemene kinderafdeling/SEH
Franklin (2018) voerde een multicenter RCT uit op de spoedeisende hulp en de algemene kinderafdeling onder patiënten jonger dan 12 maanden met bronchiolitis die zuurstofbehoefte hadden. 739 patiënten werden gerandomiseerd voor de groep die high flow kreeg (2 l/kg/min, saturatie afkapwaarden 92 tot 98% in zes ziekenhuizen en 94% tot 98% in 11 ziekenhuizen) en 733 patiënten voor zuurstof via een neusbril (maximaal 2 l/min, onverwarmd). Therapiefalen werd vastgesteld aan de hand van vier parameters: persisterende verhoogde hartfrequentie en/of ademhalingsfrequentie, hypoxemie en een medische evaluatie naar aanleiding van het early warning systeem dat het desbetreffende ziekenhuis hanteerde. Dit early warning systeem incorporeerde ademhalingsfrequentie, ademarbeid (distress), zuurstofbehoefte en – saturatie, temperatuur, hartfrequentie, bloeddruk, capillaire refill-tijd en bewustzijn en moest bij achteruitgang en tenminste elke 8 uur worden afgenomen.
Kepreotes (2018) voerde een RCT uit op de spoedeisende hulp en de algemene kinderafdeling bij patiënten jonger dan 24 maanden met matige bronchiolitis (volgens de New South Wales richtlijn) en zuurstofbehoefte. 101 patiënten werden gerandomiseerd in de groep die high flow kreeg (1 l/kg/min) en 101 patiënten werden gerandomiseerd in de groep die standaard zuurstof (maximaal 2l/min, onverwarmd) middels een neusbril kreeg. Voor de klinische beoordeling werd gebruik gemaakt van standard paediatric observation charts (SPOCs) waarop ademhalingsfrequentie, hartfrequentie, zuurstofsaturatie, een respiratoire distress score en de beoordeling van de arts werden genoteerd. Bij een verandering waarbij de waarden afweken in de zogeheten “gele zone” was beoordeling binnen 30 minuten door een arts noodzakelijk, bij afwijkende waarden in de “rode zone” moest binnen 10 minuten een arts van de IC het kind beoordelen. Therapiefalen werd gedefinieerd als een achteruitgang waardoor de patiënt in de “rode zone” terechtkwam. In deze studie konden ook ex-prematuren met bronchopulmonale dysplasie met zuurstofbehoefte thuis geïncludeerd worden. Deze kinderen vallen buiten het bestek van deze richtlijn. Echter, gezien de lage prevalentie* van deze kinderen in beide behandelarmen schatte de werkgroep in dat dit geen grote gevolgen voor de uitkomsten van de studie zou hebben en werd de studie toch geïncludeerd.
*n=10 (5%) van de studiepopulatie had comorbiditeit, waaronder chronische longziekte, ventriculaire hypertrofie, pulmonaire stenose, chromosoom 5 deletie, laryngomalacie en neurologisch insult door een acuut levensbedreigende event.
Ballestero (2018) voerde een RCT uit op een pediatrische spoedeisende hulp bij patiënten in de leeftijd van één tot 14 jaar met matige tot ernstige astma exacerbaties. De diagnose astma was hierbij gedefinieerd als een eerder gestelde medische diagnose, twee eerdere episoden met Beta-2 mimetica reactieve wheeze of een eerste episode van wheeze bij een kind ouder dan twee jaar met een voorgeschiedenis van atopie. Dertig patiënten werden gerandomiseerd voor high flow en 32 patiënten werden gerandomiseerd voor standaard zuurstoftherapie. Afhankelijk van de mate van respiratoire nood kon de arts de flow aanpassen naar het voor de patiënt maximum toelaatbare, waarbij de flow van 2 l/kg/min bij kinderen onder de 10 kg en bij kinderen boven 10 kg op 2 l/kg/min + 0,5 liter/kg/min voor elke extra kilo niet overschreden werd. Standaard zuurstoftherapie betrof onverwarmde zuurstof middels een neusbril, Venturi-masker of een non-rebreathing masker, afhankelijk van ademarbeid, vitale parameters en de mate van zuurstofbehoefte.
Resultaten
Cruciale uitkomstmaten
Therapiefalen
In de studie van Franklin (2018) was er sprake van therapiefalen bij 12% in de high flow groep en 23% in de standaard zuurstoftherapiegroep (RR 0,52; 95%BI: 0,41 tot 0,66). Het protocol beschreef dat kinderen in de standaard zuurstoftherapiegroep bij therapiefalen konden overstappen naar high flow (cross-over). Dit gebeurde bij 65 van de 167 patiënten die in de standaard zuurstoftherapiegroep faalden (39%). Vier patiënten in de high flowgroep en acht patiënten in de standaardtherapiegroep moesten worden geïntubeerd (RR 1,99, 95%BI: 0,60 tot 6,65). Negen procent van de patiënten in de high flowgroep en 12% in de standaard zuurstoftherapiegroep werden opgenomen op de ICU (RR 0,75; 95%BI: 0,56 tot 1,02).
In de studie van Kepreotes (2018) was er sprake van therapiefalen bij 14% van de patiënten in de high flow groep en 33% van de patiënten in de standaard zuurstoftherapiegroep (RR 0,42; 95%BI: 0,24 tot 0,74). Het protocol beschreef dat bij therapiefalen de patiënten in de controlegroep konden overstappen naar high flow of ‘kritische’ high flow (2L/kg/min, op de IC). De patiënten uit de high flow therapiegroep konden tevens overstappen naar ‘kritische’ high flow (2L/kg, op de ICU), intermittent positive pressure ventilation (IPPV) (op de IC) of Continuous Positive Airway Pressure (CPAP). Van de 33 patiënten die faalden in de controlegroep kregen 32 een cross-over naar high flow. Voor twaalf van deze 32 patiënten was een opname op de IC nodig (zie figuur 2). Alle 14 patiënten die faalden onder high flow werden opgenomen op de IC. Eén patiënt kreeg CPAP middels een zogeheten bubble systeem.
In de studie van Ballestero (2018) werden nagenoeg evenveel patiënten uit beide behandelarmen (high flow versus standaard zuurstoftherapie (zowel neusbril als Venturi masker) opgenomen op de kinder-IC.
De resultaten uit Franklin (2018) en Kepreotes (2018) voor de uitkomstmaat therapiefalen zijn gepooled, zie figuur 1. De studie van Ballestero (2018) is uitgevoerd in een andere studiepopulatie, namelijk astma exacerbaties. Gezien de grote heterogeniteit werd deze studie niet meegenomen in de meta-analyse. Uit de meta-analyse blijkt dat high flow een significant beschermend effect heeft op de kans op therapiefalen, waarbij de kans op therapiefalen in de high flow groep twee maal kleiner was dan bij standaard zuurstof middels een neusbril.
De resultaten op de uitkomstmaat opname kinder-IC zijn weergegeven in figuur 2. Wegens de grote heterogeniteit is er voor gekozen om de resultaten niet te poolen.
Figuur 1 Therapiefalen, vergelijking high flow met standaard zuurstoftherapie/low flow bij patiënten opgenomen met bronchiolitis op de kinderafdeling/eerste hulp
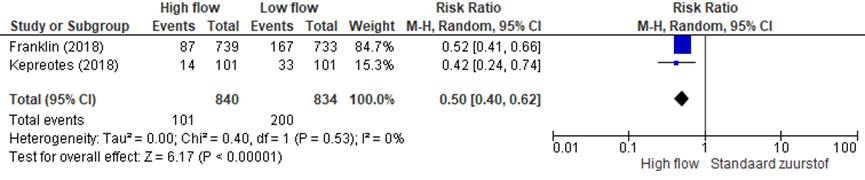
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Figuur 2 Opname op de (kinder)-IC, vergelijking high flow met andere beademings- ondersteuning bij patiënten opgenomen met bronchiolitis of astma exacerbaties op de kinderafdeling/eerste hulp
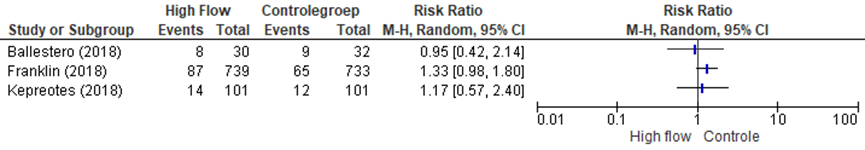
CI: betrouwbaarheidsinterval. Gezien de heterogenitieit van de studies zijn de resultaten niet gepoold
Mortaliteit
In geen van de geïncludeerde studies (Franklin, 2018; Kepreotes, 2018; Ballestero, 2018) is een patiënt overleden.
Ernstige complicaties (onder andere air leak syndrome)
Franklin (2018) rapporteerde dat in beide behandelarmen één patiënt een pneumothorax had gehad. De ‘Data Safety Monitoring Committee’ en de ethische commissie beoordeelden in beide gevallen dat dit niet door de interventie was veroorzaakt. De studie beschreef dat er geen gevallen waren geweest van een hartstilstand of een ademhalingsstilstand. De studie rapporteerde niet specifiek over het voorkomen van het air leak syndroom danwel pneumomediastinum. Kepreotes (2018) rapporteerde dat er geen “zuurstof-device gerelateerde complicaties” waren voorgevallen, zoals pneumothorax, druk-gerelateerde huidschade en bloedingen. In de studie van Ballestero (2018) werden de patiënten onder andere gemonitord voor air leaks, opgezette buik en infecties. Deze complicaties waren niet voorgekomen.
Comfort
Geen van de studies heeft deze uitkomstmaat gerapporteerd.
Belangrijke uitkomsten
Opnameduur
De totale ziekenhuisopnameduur in de studie van Franklin (2018) bedroeg 3,1 dagen (SD 2,43) in de high flow therapiegroep en 2,9 dagen (SD2,7) in de standaard zuurstoftherapiegroep, hetgeen niet significant van elkaar verschilde (gemiddeld verschil 0,18; 95% BI: -0,09 tot 0,44; p=0,19).
De studie rapporteerde ook de opnameduur op de ICU. Ook deze uitkomst verschilde niet tussen beide groepen (high flow: 2,6 dagen (SD 1,7); standaard zuurstoftherapie: 2,7 dagen (SD 2,3); gemiddeld verschil -0,09; 95%BI -0,74 tot 0,55; p=0,78). De studies van Kepreotes (2018) en Ballestero (2018) rapporteerden voor zowel de high flowgroep als de controlegroep een mediane opnameduur van twee dagen.
Beademingsduur
Franklin (2018) en Kepreotes (2018) rapporteerden beiden geen significant verschil in de duur van de beademing. In de studie van Franklin (2018) bedroeg de gemiddelde duur aan de beademing 1,8 dagen (SD 2,18) voor de high flow groep en 1,8 dagen (SD 2,1) voor de controlegroep (p=0,61). In de studie van Kepreotes (2018) bedroeg de gemiddelde duur aan de beademing 20,0 (range 17 tot 34) uur voor de high flow groep en 24,0 uur (range 18 tot 28) voor de controlegroep (p=0,61).
Minder ernstige complicaties (onder andere huidlaesies, oogirritaties)
De studie van Ballestero (2018) monitorde de prevalentie van nasale en aangezichtstraumata. Er werd gerapporteerd dat deze complicaties zich niet hadden voorgedaan. Franklin (2018) en Kepreotes (2018) hebben deze complicaties niet gemonitord.
Ademarbeid en delay
Ademarbeid, delay werden niet beschreven in de geïncludeerde artikelen.
Bewijskracht van de literatuur
De uitgangspositie voor de bewijskracht is bij RCT’s ‘hoog’.
Cruciale uitkomsten
De bewijskracht voor de uitkomstmaat therapiefalen bij patiënten met bronchiolitis is met één niveau verlaagd tot ‘redelijk’ gezien beperkingen in de onderzoeksopzet (risk of bias, gebrek aan blindering).
De bewijskracht voor de uitkomstmaat opname op de (P)ICU bij patiënten met bronchiolitis is met twee niveaus verlaagd tot ‘laag’ gezien beperkingen in de onderzoeksopzet (risk of bias, gebrek aan blindering) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat opname op de (P)ICU bij patiënten met astma exacerbaties is met drie niveaus verlaagd tot ‘zeer laag’ gezien beperkingen in de onderzoeksopzet (risk of bias, gebrek aan blindering) en het geringe aantal patiënten (imprecisie, twee graderingen aftrekken).
De bewijskracht voor de uitkomstmaat mortaliteit bij patiënten met bronchiolitis is met één niveau verlaagd tot ‘redelijk’ gezien geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat mortaliteit bij patiënten met astma exacerbaties is met twee niveau verlaagd tot ‘laag’ gezien geringe aantal patiënten (imprecisie, twee graderingen aftrekken).
De bewijskracht voor de uitkomstmaat ernstige complicaties bij patiënten met bronchiolitis is met twee niveaus tot ‘laag’ verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias, gebrek aan blindering) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat ernstige complicaties bij patiënten met astma exacerbaties is met drie niveaus verlaagd tot ‘zeer laag’ gezien beperkingen in de onderzoeksopzet (risk of bias, gebrek aan blindering) en het geringe aantal patiënten (imprecisie, twee niveaus).
De bewijskracht voor de uitkomstmaat comfort kon niet worden gegradeerd in verband met het gebrek aan data.
Belangrijke uitkomsten
De bewijskracht voor de uitkomstmaat opnameduur bij patiënten met bronchiolitis is met twee niveaus verlaagd tot ‘laag’ gezien beperkingen in de onderzoeksopzet (risk of bias, gebrek aan blindering) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat opnameduur bij patiënten met astma exacerbaties is met drie niveaus verlaagd tot ‘zeer laag’ gezien beperkingen in de onderzoeksopzet (risk of bias, gebrek aan blindering) en het geringe aantal patiënten (imprecisie, twee niveaus).
De bewijskracht voor de uitkomstmaat beademingsduur bij patiënten met bronchiolitis is met twee niveaus verlaagd tot ‘laag’ gezien beperkingen in de onderzoeksopzet (risk of bias, gebrek aan blindering) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat minder ernstige complicaties is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias, gebrek aan blindering) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaten delay en ademarbeid kon niet worden gegradeerd in verband met het gebrek aan data.
Studies uitgevoerd op de (kinder-)IC
Sarker (2018) voerde een RCT uit op de kinder-IC bij patiënten tussen de 28 dagen en de 12 maanden met ernstige bronchiolitis. Vijftien patiënten werden gerandomiseerd voor high flow en 16 patiënten werden gerandomiseerd voor nasale CPAP door middel van een neusmasker. High flow werd afgesteld op 2l/kg/min bij patiënten onder de 10 kg, bij patiënten boven 10 kg werd high flow afgesteld op 2 liter/kg/min + 0,5 liter/kg/min voor elke extra kilo en FiO2 van 0,4 bij aanvang van de therapie. CPAP werd in de meeste gevallen gestart op 4cm H2O en indien nodig verhoogd naar 8cm H2O. Therapiefalen werd gedefinieerd als een onveranderde of verhoogde hartfrequentie en/of ademhalingsfrequentie, een FiO2 >0,6 met PEEP bij CPAP of een FiO2>0,6 bij een maximale flow van de high flow om een saturatie > 94% te behouden en geen verbetering of verhoging in de ‘Respiratory Distress Assessment Instrument (RDAI)’ score.
Ergul (2018) voerde een RCT uit op de kinder-intensive care bij patiënten jonger dan 24 maanden met ernstige bronchiolitis. Dertig patiënten werden gerandomiseerd voor high flow en 30 patiënten werden gerandomiseerd voor zuurstoftherapie met een zuurstofmasker. High flow werd afgesteld tussen 1 l/kg/min met een maximum van 20L/min. Het zuurstofmasker werd afgesteld tussen 10 tot 15 l/min om de SpO2 > 94% te houden. Therapiefalen werd gedefinieerd als het volgens de behandelend arts voldoen aan tenminste twee van de drie volgende criteria: geen verandering of verhoging in de ademhalingsfrequentie ten opzichte van baseline; geen verandering of verhoging van de hartfrequentie ten opzichte van baseline; persisterende lage SpO2 (<92%) ondanks adequate zuurstofflow volgens de richtlijnen en FiO2 in de high flow behandelarm en adequate zuurstofflow van 15 liter/min in de zuurstofmasker behandelarm.
Milesi (2017) voerde een multicenter RCT uit op verschillende kinder-intensive cares bij patiënten tussen de één dag en zes maanden oud met bronchiolitis. In totaal werden 142 patiënten gerandomiseerd, 71 voor high flow en 71 voor nasale CPAP. High flow werd afgesteld op 2l/kg/min. Nasale CPAP werd gegeven op 7cm H2O. Therapiefalen werd gedefinieerd als het vóórkomen van tenminste één van de volgende criteria: 1 punt verhoging op de aangepaste Woods asthma score (mWCAS) vergeleken met de baselinewaarde, verhoging van de ademfrequentie met 10/min vergeleken met de baselinewaarde met een ademfrequentie van tenminste 60/min, 1 punt verhoging in de comfortscore gebruik makend van de EDIN-score vergeleken met de baselinewaarde, een EDIN- score van tenminste vier ondanks gebruik van het anti-histaminicum hydroxyzine (1mg/kg) of >2 apneus per uur waarvoor masker en ballon beademing nodig was ondanks een oplaaddosis cafeïne (20mg/kg) na de eerste apneu.
Resultaten
Cruciale uitkomstmaten
Therapiefalen en cross-over
In de studie van Sarkar (2018) faalde zuurstoftherapie éénmaal in beide behandelarmen. Beide patiënten werden geïntubeerd (figuur 3). Milesi (2017) hanteerde vier criteria voor therapiefalen (zie beschrijving studies). 50,7% van de patiënten in de high flow groep en 31,0% van de patiënten in de CPAP-groep voldeden aan tenminste één criterium voor therapiefalen. Het voornaamste criterium voor therapiefalen in de high flow groep was een stijging in mWCAS-score (58%). Bij de patiënten behandeld met CPAP was een stijging in EDIN-score voor neonatale pijn en discomfort het voornaamste criterium voor therapie falen (59%). Na het optreden van therapiefalen werden de patiënten in deze studie behandeld met zuurstoftherapie van de andere behandelarm. Cross-over van CPAP naar high flow was in 18 van de 22 (82%) gevallen succesvol en cross-over van high flow naar CPAP was in 26 van de 36 (72%) gevallen succesvol(zie figuur 3). Ergul (2018) rapporteerde 7 gevallen van therapiefalen, alle vonden plaats in de zuurstofmasker-groep (p=0,011).
De resultaten uit Sarkar (2018) en voor de uitkomstmaat therapiefalen zijn gepooled, zie figuur 3. De studie van Ergul (2018) vergeleek high flow met een andere controlegroep. Gezien de heterogeniteit werd deze studie niet meegenomen in de meta-analyse. Uit de meta-analyse blijkt dat behandeling met high flow een significant grotere kans geeft op therapiefalen, waarbij de kans op therapiefalen in de high flow groep 1,6 keer groter was dan bij standaard zuurstof middels CPAP.
Figuur 3 Therapiefalen, vergelijking high flow met CPAP bij patiënten opgenomen met bronchiolitis op de (P)ICU
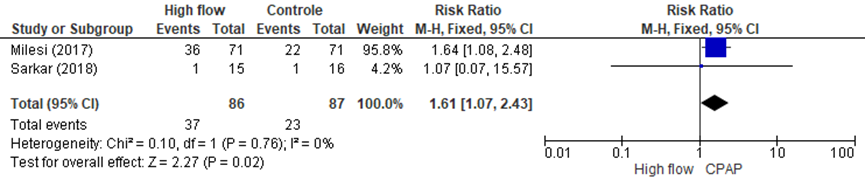
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Mortaliteit
In geen van de geïncludeerde studies (Sarkar, 2018; Milesi, 2017; Ergul, 2018) zijn patiënten overleden.
(Dis)comfort
De studie van Milesi (2017) gebruikte de EDIN schaal voor het meten van neonatale pijn en discomfort. De gemiddelde EDIN-score was 3 (SD 3) voor de high flow groep en 6 (SD 4) voor de CPAP-groep (p=0,02). Discomfort was de grootste oorzaak voor therapiefalen in de CPAP groep (59% in de CPAP groep tegenover 17% in de high flow groep). De studie van Sarkar (2018) rapporteerde de resultaten van de COMFORT-schaal op baseline en 2, 6, 12, 24, 36 en 48 uur na baseline (zie tabel 1). High flow had een gunstigere COMFORT-score vergeleken met CPAP (p<0,003, tabel 1).
Tabel 1 Gemiddelde door Sharkar (2018) gerapporteerde COMFORT score (SD) voor high flow en CPAP op baseline en 2, 6, 12, 24, 36 en 48 na baseline
|
|
Baseline |
2 uur |
6 uur |
12 uur |
24 uur |
36 uur |
48 uur |
|
High Flow |
6,9 (0,59) |
8,7 (0,45) |
9,4 (0,91) |
10,8(1,56) |
12,0 (0,0) |
12,3 (1,02) |
14,5 (0,51) |
|
CPAP |
6,2 (0,44) |
6,8 (0,61) |
8,2 (0,85) |
9,0 (0,51) |
9,8 (0,80) |
11,1 (0,80) |
12,2 (1,00) |
Ernstige complicaties (onder andere pneumothorax, air leak syndroom, pneumomediastinum en asystolie)
Sarkar (2018) rapporteerde dat er geen sprake was geweest van asystolie of pneumothorax. Milesi (2017) rapporteerde dat er geen gevallen waren geweest van het air leak syndroom.
Belangrijke uitkomsten
Opnameduur
De gemiddelde opnameduur op de kinder-IC in de studie van Sarkar (2018) bedroeg in zowel de high flow als de CPAP-groep 5 dagen (SD 1,6 en 1,8 respectievelijk, p=0,105). In de studie van Ergul (2018) bedroeg het mediane aantal dagen op de ICU drie in de high flow groep en vier in de zuurstofmaskergroep (p<0,001). Het totaal aantal dagen in het ziekenhuis was 4 (1e en 3e kwartiel: 3 tot 4) in de high flow groep en 5 (4 tot 6) in de zuurstofmaskergroep (p<0,001).
Minder ernstige complicaties (onder andere huidlaesies, oogirritaties)
De studie van Sarkar (2018) rapporteerde een niet-significant verschil in het voorkomen van huidlaesies bij CPAP vergeleken met high flow (p=0,16). Er werden ook geen significante verschillen gevonden tussen de behandelarmen voor de incidentie van oogirritaties. Wel rapporteerde Sarkar een niet-significant verschil in het voorkomen van ‘luchtlekkage’ met als gevolg verlies van druk rondom de interfaces van de CPAP of high flow bij CPAP vergeleken met high Flow (p=0,23). De studie van Milesi (2017) rapporteerde twee gevallen van huidlaesies in de high flowgroep en zes gevallen in de CPAP-groep, hetgeen niet significant van elkaar verschilde (p=0,27).
Beademingsduur
De gemiddelde duur van de beademing in de studie van Sarkar (2018) bedroeg 3,6 dagen (SD 0,63) in de high flow groep en 3,8 dagen (SD 0,80) in de CPAP groep, hetgeen niet significant van elkaar verschilde (p=0,33). Ergul (2018) rapporteerde een mediane beademingsduur van 56 uur voor de high flow groep tegenover 96 uur in de zuurstofmaskergroep (p<0,001).
Ademarbeid en delay
Ademarbeid en delay werden niet beschreven in de geïncludeerde artikelen.
Bewijskracht van de literatuur
De uitgangspositie voor de bewijskracht is bij RCT’s ‘hoog’.
Cruciale uitkomsten
De bewijskracht voor de uitkomstmaat therapiefalen bij high flow vergeleken met CPAP is met twee niveaus verlaagd tot ‘laag’ gezien beperkingen in de onderzoeksopzet (risk of bias, gebrek aan blindering) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat therapiefalen bij high flow vergeleken met zuurstofmasker is met twee niveaus verlaagd tot ‘laag’ gezien beperkingen in de onderzoeksopzet (risk of bias, gebrek aan blindering) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat mortaliteit bij high flow vergeleken met CPAP is met één niveau verlaagd tot ‘redelijk’ gezien het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat mortaliteit bij high flow vergeleken met het zuurstofmasker is met twee niveaus verlaagd tot ‘laag’ gezien het geringe aantal patiënten (imprecisie, twee graderingen aftrekken).
De bewijskracht voor de uitkomstmaat (dis)comfort bij high flow vergeleken met CPAP is met twee niveaus verlaagd tot ‘laag’ gezien beperkingen in de onderzoeksopzet (risk of bias, gebrek aan blindering) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat ernstige complicaties bij high flow vergeleken met CPAP is met twee niveaus verlaagd tot ‘laag’ gezien beperkingen in de onderzoeksopzet (risk of bias, gebrek aan blindering) en het geringe aantal patiënten (imprecisie).
Belangrijke uitkomstmaten
De bewijskracht voor de uitkomstmaat opnameduur bij high flow vergeleken met CPAP is met twee niveaus verlaagd tot ‘laag’ gezien beperkingen in de onderzoeksopzet (risk of bias, gebrek aan blindering) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat opnameduur bij high flow vergeleken met het zuurstofmasker is met twee niveaus verlaagd tot ‘laag’ gezien beperkingen in de onderzoeksopzet (risk of bias, gebrek aan blindering) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat minder ernstige complicaties bij high flow vergeleken met CPAP is met twee niveaus verlaagd tot ‘laag’ gezien beperkingen in de onderzoeksopzet (risk of bias, gebrek aan blindering) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat beademingsduur bij high flow vergeleken met CPAP is met twee niveaus verlaagd tot ‘laag’ gezien beperkingen in de onderzoeksopzet (risk of bias, gebrek aan blindering) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat beademingsduur bij high flow vergeleken met een zuurstofmasker is met drie niveaus verlaagd tot ‘zeer laag’ gezien beperkingen in de onderzoeksopzet (risk of bias, gebrek aan blindering) en het geringe aantal patiënten (imprecisie, twee graderingen aftrekken).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de effectiviteit van de high flow bij patiënten met dreigende respiratoire insufficiëntie als gevolg van bronchiolitis, pneumonie, status astmaticus of acuut respiratoir falen?
Hiervoor is de volgende PICO opgesteld:
P: kinderen (0 tot 18 jaar) met dreigende respiratoire insufficiëntie als gevolg van bronchiolitis, pneumonie, luchtweginfectie, preschool wheeze, astma, viral induced wheeze of peuterastma;
I: high flow;
C ademhalingsondersteuning via non-rebreathing masker/ neusbril/ zuurstofmasker/ supplemental oxygen;
O: therapiefalen, mortaliteit, comfort, complicaties, opnameduur, beademingsduur, ademarbeid en delay.
Relevante uitkomstmaten
De werkgroep achtte therapiefalen, mortaliteit, comfort en ernstige complicaties voor de besluitvorming cruciale uitkomstmaten; en opnameduur, beademingsduur, ademarbeid, minder ernstige complicaties en delay voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep hanteerde voor therapiefalen de in de studie gebruikte definities. Therapiefalen omvat in veel studies onder andere cross-over naar een andere beademingstechniek en opname op de kinder-IC. De werkgroep achtte deze losse uitkomstmaten ook relevant. Indien de studies deze uitkomsten apart rapporteerden werden deze ook apart beschreven in de literatuursamenvatting en het bewijsniveau apart gegradeerd.
De werkgroep definieerde delay als vertraging in noodzakelijke opschaling van zorg, bijvoorbeeld te laat overplaatsen naar een intensive care.
De werkgroep verstond onder ernstige complicaties air leak syndroom, pneumothorax en pneumomediastinum. Onder minder ernstige complicaties werd huidlesies en oogirritaties verstaan.
De uitkomstmaat comfort diende te zijn vastgesteld aan de hand van gevalideerde scorelijsten zoals de COMFORT-score.
De werkgroep hanteerde de door de internationale GRADE working group voorgestelde default grenzen gehanteerd voor klinische relevantie: een verschil in relatief risico van 25% bij dichotome uitkomstmaten. Voor continue uitkomstmaten werd een halve standaarddeviatie klinisch relevant geacht.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 08 augustus 2018 met relevante zoektermen gezocht naar studies die de effectiviteit van high flow vergeleken met zuurstoftoediening middels non-rebreathing masker, neusbril, low flow of een zuurstofmasker en zijn verschenen zijn na 2000. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 324 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- Studiedesign: RCT en systematische review.
- Afgebakende patiëntengroep (patiëntengroep met dezelfde indicatie voor high flow).
- Beschrijving van minimaal één van de bovengenoemde uitkomstmaten.
De resultaten van de studies dienden te zijn gebaseerd op een homogene patiëntenpopulatie, dat wil zeggen dat alle patiënten geïncludeerd in een studie dezelfde aandoening dienen te hebben. Omdat de pathofysiologie van de verschillende respiratoire aandoening verschilt en ook het falen van therapie bij de verschillende aandoeningen andere indicatoren kan hebben, kunnen de verschillende respiratoire aandoeningen onderling niet vergeleken worden.
Deze richtlijn is gericht op gebruik het gebruik van high flow op kinderafdeling en de spoedeisende hulp. De werkgroep achtte studies die uitgevoerd zijn op de kinder-IC wel relevant voor de beoordeling van de effectiviteit van high flow. Daarom zijn deze studies wel opgenomen in de literatuursamenvatting maar worden deze apart beschreven en wordt het bewijsniveau apart gegradeerd.
Op basis van titel en abstract werden in eerste instantie 22 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 16 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en zes studies definitief geselecteerd.
De belangrijkste studiekarakteristieken en resultaten van de geïncludeerde studies zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen (zie tabblad Verantwoording).
Referenties
- Ballestero, Y., De Pedro, J., Portillo, N., Martinez-Mugica, O., Arana-Arri, E., & Benito, J. (2018). Pilot clinical trial of high-flow oxygen therapy in children with asthma in the emergency service. The Journal of pediatrics, 194, 204-210.
- Ergul, A. B., Calıskan, E., Samsa, H., Gokcek, I., Kaya, A., Zararsiz, G. E., & Torun, Y. A. (2018). Using a high-flow nasal cannula provides superior results to OxyMask delivery in moderate to severe bronchiolitis: a randomized controlled study. European journal of pediatrics, 1-9.
- Franklin, D., Babl, F. E., Schlapbach, L. J., Oakley, E., Craig, S., Neutze, J., ... & Dalziel, S. R. (2018). A randomized trial of high-flow oxygen therapy in infants with bronchiolitis. New England Journal of Medicine, 378(12), 1121-1131.
- Kepreotes, E., Whitehead, B., Attia, J., Oldmeadow, C., Collison, A., Searles, A., ... & Mattes, J. (2017). High-flow warm humidified oxygen versus standard low-flow nasal cannula oxygen for moderate bronchiolitis (HFWHO RCT): an open, phase 4, randomised controlled trial. The Lancet, 389(10072), 930-939.
- Milési, C., Essouri, S., Pouyau, R., Liet, J. M., Afanetti, M., Portefaix, A., ... & Cambonie, G. (2017). High flow nasal cannula (HFNC) versus nasal continuous positive airway pressure (nCPAP) for the initial respiratory management of acute viral bronchiolitis in young infants: a multicenter randomized controlled trial (TRAMONTANE study). Intensive care medicine, 43(2), 209-216.
- Sarkar, M., Sinha, R., Roychowdhoury, S., Mukhopadhyay, S., Ghosh, P., Dutta, K., & Ghosh, S. (2018). Comparative study between noninvasive continuous positive airway pressure and hot humidified high-flow nasal cannulae as a mode of respiratory support in infants with acute bronchiolitis in pediatric intensive care unit of a Tertiary Care Hospital. Indian journal of critical care medicine: peer-reviewed, official publication of Indian Society of Critical Care Medicine, 22(2), 85.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Sarkar (2018) |
Type of study: RCT
Setting: PICU in tertiary-care hospital
Country: India
Source of funding: “Nil” |
Inclusion criteria: (i)Age 28 days to 12 months,i.e., infants excluding neonates (ii) diagnosis of severe bronchiolitis consistent with clinical features (history of cough, prolonged expiration, tachypnea, retraction of the chest wall or grunting, wheezing, rales or rhonchi; supporting chest x‑ray findings of hyperinflation); and (iii) fulfilling the criteria stating the need for nCPAP or High Flow, i.e., (peripheral capillary oxygen saturation (SpO2) <92% mmHg breathing room air) and/or Respiratory Distress Assessment Index (RDAI) ≥11.
Exclusion criteria: (i) emergency need for intubation; (ii) Glasgow Coma Scale <11; (iii) major acidosis (pH < 7.25); (iv) hypercapnia (partial pressure of carbon‑dioxide (PaCO2) >55 mmHg); (v) cough or gag reflex impairment; (vi) upper‑airway obstruction; (vii) facial/gastric surgery; (ix) hemodynamic instability; and (x) uncorrected cyanotic congenital heart disease or pulmonary vascular anomalies.
N total at baseline: Intervention/High Flow: 15 Control/CPAP:16
Important prognostic factors2: Age ± SD: (months) I: 4.06 (2.92) C: 2.81 (1.03)
Sex: I: 25% M C: 63% M
|
Describe intervention (treatment/procedure/test): High flow nasal canula (AIRVO™ 2, Fisher and Paykel Healthcare Limited, New Zealand), applied continuously through large‑bore binasal prongs, with a gas flow rate of 2 L/kg/min for the children less than equal to 10 kg and for children >10 kg 2 L/kg/min for the first 10 kg + 0.5 L/kg/min for each kg above that and FiO2 of 0.4 at initiation.(11) The fraction of oxygen in the gas flowing in the system was subsequently adjusted to maintain a SpO2 of 94% or more.
|
Describe control (treatment/procedure/test):
nCPAP through a nasal mask (SERVO‑i®, Maquet; Getinge Group, Sweden). CPAP was usually started at 4 cm H2O and increased as necessary up to a maximum of 8 cm H2O. Nasal prong or nasal mask (SERVO‑i®, Maquet; Getinge Group, Sweden) of appropriate size which was snugly fitted and produces minimum leak and maximum comfort was used as interface.
|
Length of follow-up: 48 hour
Loss-to-follow-up: Intervention: 0 Control: 0
Incomplete outcome data: Intervention: 0 Control: 0
|
Outcome measures and effect size (include 95%CI and p-value if available):
NIV failure/crash intubation (defined as If HR and/or RR remained unchanged/increased; required FiO2 >60% for nCPAP with PEEP >8; required FiO2 >60% for HHHFNC with maximum O2 flow rate to maintain SpO2 >94% and no improvement or increase in RDAI score.) 1 in both groups (p=0.29)
SpO2, RR, PaO2, PCO2, and RDAI Comparable between groups
HR HR improved more in the High Flow group compared to CPAP (p<0.001)
COMFORT score (tolerance of the interface) High flow was better tolerated compared to CPAP (p<0.003)
Nasal injury High flow: 4/15 CPAP=12/16 P=0.021
PICU length of stay (mean ± SD days) High Flow: 5 ± 1.6 days CPAP: 5 ± 1.788 days) p = 0.105
Air leak (presence of leaks around the interface that affected circuit pressurization <3 cm H2O despite repeated positioning) More frequent in CPAP group (non significant: p=0.23)
Skin sores More frequent in CPAP group (non significant: p=0.16)
cardiac arrest, pneumothorax, or safety system failures No events reported in both groups
gastric distension, eye irritation, and mortality No significant difference between groups (numbers not reported) |
|
|
Ergul, 2018 |
Type of study: RCT
Setting: Intensive care unit
Country: Turkey
Source of funding: No funding reported and “The authors declare that they have no conflicts of interest.” |
Inclusion criteria: Included patients were aged between 1 and 24 months and had been diagnosed with moderate or severe acute bronchiolitis.
Exclusion criteria: Any patients requiring immediate respiratory support (noninvasive or invasive mechanical ventilation, altered mental status, or apnea at presentation), those already admitted to the ICU due to respiratory failure, those with underlying chronic lung disease or cardiovascular disorders, those with obstructions of the upper respiratory tract, and those with cranial malformations were excluded.
N total at baseline: Intervention/High Flow: 30 Control/mask: 30
Important prognostic factors2: Age (months) ± SD: I: 11.12 (7.00–20.00) C: 10.07 (6.18–11.00)
Sex: I: 63.3% M C: 63.3% M
Groups comparable at baseline?
Yes, There were no significant differences in age, sex, weight, severity of bronchiolitis, baseline heart or respiration rate, SpO2, pCO2, pH, lactate level, white blood cell count, C-reactive protein, or procalcitonin level between the diffuser mask and HFNC groups. There were also no significant differences in the use of salbutamol or ipratropium nebulizer solution, intravenous
|
Describe intervention (treatment/procedure/test):
High Flow: Patients received oxygen therapy at a high flow rate from a Precision Flow nasal cannula (Vapotherm, Inc., Stevensonville, MD, USA)
|
Describe control (treatment/procedure/test): diffuser mask. oxygen therapy (10–15 L/min) from an OxyMask (Southmedic, Inc.)
|
Length of follow-up: 48 h
Loss-to-follow-up: No loss to follow-up
Incomplete outcome data: n.a.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Treatment failure, n (%) Diffuser mask: 7 (23.3) P=0.011
failure was increased use of oxygen (n = 4), followed by persistent tachycardia (n = 2) and persistent tachycardia (n = 1).
Length of ICU stay, days (1st/3rd quartiles) High Flow: 3 (2/3) P<0.001
Length of hospital stay, days (1st/3rd quartiles) High Flow: 4 (3/4) P<0.001
Time to weaning of oxygen, h ((1st/3rd quartiles) High Flow: 56 (42/72) P<0.001
Mechanical ventilation requirement 0 in both groups
Re-admission to ICU 0 in both groups
Respiratory rate 6 h was significantly greater in the HFNC group. There were no significant differences between baseline respiration rates, whereas the rates at 1, 6, 12, 24, and 48 h were significantly lower in the HFNC group
Heart rate The decreases (%) in heart rate compared to the baseline values were significantly greater in the HFNC group at 1, 6, 12, 24, and 48 h. There were no significant differences between baseline heart rates and those at 1 h, whereas the rates in the HFNC group were significantly lower at 6, 12, 24, and 48 h than in the diffuser mask group
SpO2 There were no significant differences in baseline, 24, and 48 h SpO2, whereas the values at 1, 6, and 12 h were significantly higher in the HFNC group than in the other groups
pCO2 No significant differences were observed in pCO2 or lactate values obtained at baseline, 1, 6, 12, 24, or 48 h |
|
|
Ballestero (2018) |
Type of study: RCT, pilot trial
Setting: Pediatric emergency department
Country: Spain
Source of funding: “Funded by an annual research grant from the Department of Health of the Basque government in 2011 (2011111118), the Ministry of Health for independent clinical trials in 2011 (EC11-327), and the Spanish Society of Pediatric Emergency Medicine in 2012. The authors declare no conflicts of interest.” |
Inclusion criteria:
Patients aged 1-14 years with asthma exacerbation who met at least 1 of the following criteria: moderate to severe respiratory failure, defined as a pulmonary score (PS) ≥6 or the need for a high level of oxygen support (SpO2 <94% with a face mask) despite initial treatment with nebulized salbutamol (<20 kg, 2.5 mg/dose; ≥20 kg, 5 mg/dose) and ipratropium (<20 kg, 250 _g/dose; ≥20 kg, 500 _g/dose) every 20 minutes during the first hour (at least 3 doses) and systemic corticosteroids (prednisone or methylprednisolone 2 mg/kg).
Exclusion criteria: Patients who required advanced airway management and those in whom informed consent was not obtained were excluded.
N total at baseline: Intervention/ high flow: 30 Control/conventional oxygen therapy: 32
Sex: I: 53% M C: 56% M
Age y, median (range) C:3.0 (2.0-6.0)
Groups comparable at baseline? Yes, all prognostic factors are similar
|
Describe intervention (treatment/procedure/test):
In the HFNC group, oxygen therapy was delivered by an MR850 humidifier and an RT330 junior breathing circuit kit (flow range, 2-25 L/min) for infants and young children,with OPT316 and OPT318 nasal cannulas, respectively, or an RT202 adult breathing circuit kit (flow range, 5-60 L/min) with an OPT842 nasal cannula for older children and adolescents (all fromFisher & Paykel Healthcare, Auckland, New Zealand).
|
Describe control (treatment/procedure/test):
Conventional oxygen delivery systems were used, ranging from nasal prongs to a Venturi mask or non-rebreather mask, depending on the patient’s level of distress and oxygen requirement. Nasal prongs: 13 Venturi mask: 5 Non-rebreather mask: 14
|
Length of follow-up: Until 72h after study visit
Loss-to-follow-up: I: n=1 Loss to follow up for 72h return call
Incomplete outcome data: 72h return call
|
Outcome measures and effect size (include 95%CI and p-value if available):
Change in asthma severity (decrease in PS by ≥2 points in the first 2 hours of treatment) I: n=16, 53% C: n=9, 28% p-value 0.01
Admission to PICU I: n=8, 26% C: n=9, 28% p>0.05
Within first 2 hours I: n=1 C: n=6 p-value 0.03
The other 7 patients (88%) in the HFNC group admitted to the PICU were transferred between 2 and 36 hours after starting therapy, 4 patients (57%) due to failed attempts to wean off HFNC therapy and 3 (43%) due to a lack of response to increased respiratory support after clinical worsening.
Length of stay(PICU/ward)
Need for additional therapies (i.e. inhales salbutamol, corticosteroids, intravenous magnesium sulfate and additional respiratory support) not significantly different between groups
|
|
|
Franklin (2018) |
Type of study: RCT
Setting: emergency departments and general pediatric wards
Country: Australia
Source of funding: Supported by a project grant (GNT1081736) from the National Health and Medical Research Council (NHMRC) and by the Queensland Emergency Medical Research Fund. Regional site funding was obtained for Ipswich Hospital from the Ipswich Hospital Foundation and for the Gold Coast University Hospital (GCUH) from the GCUH Foundation. |
Inclusion criteria: Infants younger than 12 months of age were eligible for inclusion on presentation to an emergency department or inpatient unit if they had clinical signs of bronchiolitis and a need for supplemental oxygen therapy to keep the oxygensaturation level in the range of 92 to 98% (or 94 to 98% at the 11 hospitals with higher saturation thresholds for intervention in hypoxemia, in alignment with their institutional practice).
Exclusion criteria: We excluded critically ill infants who had an immediate need for respiratory support and ICU admission; infants with cyanotic heart disease, basal skull fracture, upper airway obstruction, or craniofacial malformation; and infants who were receiving oxygen therapy at home.
N total at baseline: After exclusion of those declined consent Intervention/High Flow: 739 Control: 733
Important prognostic factors2: After exclusion of those declined consent Age mo, mean ± SD: I: 5.76 ± 3.54 C: 6.10 ± 3.44
Sex: I:61 % M C: 64% M
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
Infants in the high-flow group received heated and humidified high-flow oxygen at a rate of 2 liters per kilogram of body weight per minute, delivered by the Optiflow system with the use of an age-appropriate Optiflow Junior cannula and the Airvo 2 high-flow system (Fisher and Paykel Healthcare).
|
Describe control (treatment/procedure/test):
supplemental oxygen through a nasal cannula, up to a maximum of 2 liters per minute, to maintain an oxygen-saturation level in the range of 92 to 98% (or 94 to 98%, depending on institutional practice). |
Length of follow-up: Until end of hospital stay
Loss-to-follow-up: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: 166 (10% of 1638 patients that were randomized) were excluded owing to declined deferred consent or inability to obtain consent
167 of the 733 patients who were randomized to standard oxygen therapy crossed-over tot high flow |
Outcome measures and effect size (include 95%CI and p-value if available):
Treatment failure that resulted in escalation of care (see comment for definition) I: n=87 (12%) C: n=167 (23%) Risk difference: -11%, 95%CI: -15% to -7%, p-value < 0.001 The interval between enrollment and escalation of care did not differ significantly between the two groups
Escalation or care by those with and without an on-site ICU With I: 14% C: 30% Risk difference -6% 95%CI -11 to -1 Without I:7% C:28% Risk difference
Transfer to ICU I:12% C:9% Mean difference (95% CI) 1.37 (0.96 to 1.95)
Duration of hospital stay I: 3.12}2.43 C: 2.94±2.73 Mean difference (95% CI) 0.18 (−0.09 to 0.44)
Duration of oxygen therapy I: 1.81±2.18 C: 1.87±2.09
Intubation rate I:1% C:1% Mean difference (95% CI) 1.99 (0.60 to 6.65)
(Serious) adverse events Pneumothorax: I: n=1 C:n=1 Apneas I:n=3 C:n=3
|
137 (19%) in the intervention group and 128 (17%) in the control group were born prematurely.
Treatment failure was defined by four criteria by any amount since admission (by contrast, a decrease of >5 beats per minute or into the normal range indicated treatment success); 2 the respiratory rate remained unchanged or increased by any amount since admission (by contrast, a decrease of >5 breaths per minute or into the normal range indicated treatment success); 3 the oxygen requirement in the high-flow group exceeded an Fio2 of at least 0.4 to maintain an oxygen-saturation level of at least 92% (or ≥94%, depending on the institution) or the requirement for supplemental oxygen in the standard-therapy group exceeded 2 liters per minute to maintain an oxygen-saturation level of at least 92% (or ≥94%); and 4 the hospital internal early-warning tool triggered a medical review and escalation of care (see below). Clinicians were allowed to escalate therapy if they were concerned for other clinical reasons that were not captured in the four clinical criteria |
|
Kepreotes (2017) |
Type of study: RCT
Setting: emergency department and medical unit
Country: Australia
Source of funding: Hunter Children’s Research Foundation, John Hunter Hospital Charitable Trust, and the University of Newcastle Priority Research Centre GrowUpWell
“The funders of the study had no role in study design, data collection, data analysis, data interpretation, or writing of the report.” |
Inclusion criteria: Children aged less than 24 months presenting to the emergency department or admitted to the ward were eligible for inclusion if they had a clinical diagnosis of bronchiolitis that was assessed as being of moderate severity using the NSW Health clinical practice guideline15 and required supplemental oxygen. Infants with chronic neonatal lung disease on home oxygen could be included, but they were weaned to their home oxygen rate rather than to room air. Children with severe or life-threatening bronchiolitis were excluded because low-flow oxygen is not part of standard care for these patients.
Exclusion criteria:
N total at baseline: Intervention: 101 Control: 101
Important prognostic factors2: For example Age, mo medion (IQR): I: 6·0 (3·0–10·0) C: 5·0 (3·0–10·0)
Sex: I: 62% M C:74 % M
Groups comparable at baseline? No
|
Describe intervention (treatment/procedure/test):
HFWHO was delivered via age-appropriate Optiflow Junior nasal cannulae and the MR850 humidifier (Fisher and Paykel Healthcare; Auckland, New Zealand) using a maximum flow of 1 L/kg/min to a limit of 20 L/min using 1:1 air–oxygen ratio, resulting in a maximum FiO2 of 0·6. The Optiflow Junior nasal cannulae allowed all children in the experimental arm to start on a flow of 1 L/kg per min.
|
Describe control (treatment/procedure/test):
Standard therapy incorporated cold wall oxygen 100% via infant nasal cannulae at low-flow to a maximum of 2 L/min. |
Length of follow-up:
Loss-to-follow-up: 0
Incomplete outcome data: Intervention: N=1 censored c for the primary outcome after being transferred to another ICU because of bed shortages N=10 no follow-up until 30 days
Control: N =21 no follow-up until 30 days Therefore, modified ITT is only available for 170 patient
|
Outcome measures and effect size (include 95%CI and p-value if available):
proportion of treatment failure I: n=14 (14%) C: n=33 (33%) P=0.0016 Mean difference 95%CI 19% (8–30)
time to treatment failure At no point had 50% of the children in either group experienced treatment failure, making calculation of median time to treatment failure impossible. Therefore, 24 h event-free survival was calculated to summarise the proportion of children who survived 24 h without experiencing treatment failure. 90% (95% CI 80–100) of the HFWHO group remained free from treatment failure at 24 h compared with 60% (50–70) of the standard therapy group. The difference in survival distributions for time to treatment failure was statistically significant and favoured the HFWHO group (HR 0·3 (95% CI 0·2–0·6); p<0·0001).
proportion of crossover I: N=1 C: n=32 p-value <0.001
ICU transfer C:n=12 p=0.41 Heart rate (baseline-adjusted beats per minute) 4h I: −21·5 (−25·5 to −17·5) C: −16·8 (−21·2 to −12·4) p-value 0.40 24h I: −27·0 (−31·1 to −22·9) C:−23·0 (−27·1 to −19·0) p-value 0.59
Respiratory rate (baseline-adjusted beats per minute) 4h I: −9·1 (−11·6 to −6·5) C: −11·3 (−13·8 to −8·8) p-value =0.028 24h I: −12·9 (−15·7 to −10·0) C: −13·5 (−16·0 to −10·9) p-value 0.28
Comfort (modified ITT) C:3 (3-4) p-value 0.0170
Sleep score (modified ITT) I: 4 (3–4) C:3 (3-4) p-value 0.08
Sleep score (modified ITT) I: 4 (3–4) C:2 (2-4) p-value 0.0100
proportion of adverse events I: n=2 C: n=2
length of hospital stay, days median I:2·0 (1·0–3·0) C: 2·0 (1·0–3·0) p-value 0.99 |
This study included patients with chronic neonatal lung disease on home oxygen. This was not part of our pre-defined patient population. Data were not stratified. Since only few* patient were on home oxygen we decided to include this study in the
*Exact number not known. Number of patients with chronic neonatal lung disease is taken together with ventricular hypertrophy, pulmonary stenosis, chromosome 5 deletion, laryngomalacia, and neurological insult, in total 8 (8%) in the intervention group and 2 (2%) in the control group.
The need for supplemental oxygen was identified by an infant’s appearance, work of breathing, heart rate, respiratory rate, SpO2, and ability to feed.
18% of the study population had a gestational age < 37 age at birth
|
|
Milesi (2017) |
Type of study: RCT
Setting: PICUs
Country: France
Source of funding: All phases of this study were supported by Montpellier University Hospital (Grant: research contract 2012–2015). This study has also been supported by Fisher and Paykel Healthcare with the provision of 30 HFNC circuits. Fisher and Paykel was not involved in the study design and had no role in data management, data analysis and data interpretation, nor in the writing of the report and the decision to submit it for publication. |
Inclusion criteria: Patients aged from 1 day to 6 months and hospitalized in the PICU were eligible for inclusion if the following conditions were all met: (1) clinical diagnosis of bronchiolitis; (2) moderate to severe respiratory distress, defined by a modified Wood’s clinical asthma score (mWCAS) >3; (3) no underlying cardiac or neuromuscular disease and no pneumothorax on chest radiograph; (4) absence of indication for imminent intubation; and (5) authorization to perform the study signed by both parents.
Exclusion criteria:
N total at baseline: Intervention/High flow: 71 Control/CPAP: 71
Important prognostic factors2: For example Age days, mean (SD) I: 42 (39) C: 38 (32)
Sex: Not reported
|
Describe intervention (treatment/procedure/test):
HFNC device used was the Optiflow (Fisher and Paykel, Villebon France). Flow was delivered at 2 L/kg/min, with the device equipped with a pressure release valve set at 45 cmH2O.
|
Describe control (treatment/procedure/test):
support was randomly allocated as nCPAP or HFNC. Two different systems were used to generate nCPAP: the Infant Flow Ventilator (Electro Medical Equipment, Brighton, UK), and the FlexiTrunk infant interface (Fisher and Paykel, Villebon, France) connected to ventilator CPAP setups. Whatever the system, positive continuous pressure was set at +7 cmH2O (6). |
Length of follow-up: The protocol lasted a minimum of 24 h after the allocated treatment had begun. support. Patients switched from one group to the other were maintained on the second support for 24 h, and the data were again collected 1 h, 12 h, and 24 h following the crossover.
Loss-to-follow-up: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Treatment failure (for definition, see comment) C: n=36 (50.7%)
Non inferiority analysis: With a risk-difference of −19% (95% CI −35 to −3%), the prespecified noninferiority margin of −15% was included in the confidence limit, not allowing the conclusion of noninferiority (p = 0.707).
Superiority analysis: relative risk of success 1.63 (95% CI 1.02– 2.63) higher with nCPAP compared with HFNC
Time to treatment failure time to failure was comparable between groups (6.7 (5.7) vs 9.7 (8.8) h, p = 0.19). Sixty percent of failures (35/58) were observed during the first 6 h following treatment allocation
Proportion of intubations C: n=3 (4.2) p-value 0.72
Skin lesions C:n=6 p-value 0.27 All skin lesions were classified as NPUAP stage 1, including redness of the philtrum and the nasal bridge
PICU length of stay, days (SD) I: 6.2 (6) C: 7.5 (13) p-value 0.44
None of the patients had air leak syndrome or died. |
Failure was defined by the occurrence of one of the following criteria: (1) a 1-point increase in mWCAS compared with baseline; (2) RR rise >10 bpm compared with baseline, with RR >60 bpm; (3) a 1-point increase in the EDIN score compared with baseline, with EDIN >4 despite the use of hydroxyzine (1 mg/kg); and (4) more than two severe apnea episodes per hour (i.e., requiring bag and mask ventilation), despite a loading dose of caffeine (20 mg/kg) after the first apnea.
18% of the study patient wer born preterm |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Slain (2017) |
Narratief review |
|
Mikalsen (2016) |
Voldoet niet aan de PICO |
|
Mayfield (2016a) |
Studieprotocol |
|
Mayfield (2016b) |
Geen studies geïncludeerd in review |
|
Beggs (2014) |
Enkel Hilliard (2011) geïncludeerd; niet relevante controlegroep |
|
Kelly (2013) |
Geen vergelijking met andere beademingstechniek |
|
Sitthikarnkha (2018) |
Indicatie voor high flow niet gespecificeerd |
|
Ramnarayan (2018) |
Indicatie voor high flow niet gespecificeerd |
|
Vitali (2017) |
Indicatie voor high flow niet gespecificeerd |
|
Baudin (2017) |
Betreft cohortstudie |
|
Mardegon (2016) |
Narratief review |
|
Long (2016) |
Geen vergelijkende studie |
|
Hutchings (2015) |
Narratief review |
|
Franklin (2015) |
Studieprotocol |
|
Heikila (2018) |
Geen vergelijking met andere beademingstechniek |
|
Bueno Campagna (2013) |
Niet relevante controlegroep |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 15-07-2020
Beoordeeld op geldigheid : 26-06-2020
Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Vereniging voor Kindergeneeskunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Kindergeneeskunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbevelin |
|
Effectiviteit High flow |
NVK |
2020 |
2025 |
5 jaar |
NVK |
Nieuwe literatuur. |
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de zorg van kinderen met toegenomen zuurstofbehoefte en/of ademarbeid. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname en de werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn. De wetenschappelijke verenigingen van de spoedeisende hulpartsen en de ambulanceverpleegkundigen zijn ook gevraagd om te participeren in de werkgroep, maar dit bleek helaas niet mogelijk.
Werkgroep
- Dr. B. Kapitein, kinderarts-intensivist, werzaam in het Amsterdam Universitair Medisch Centrum te Amsterdam, NVK, voorzitter
- Dr. W. Balemans, kinderarts-pulmonoloog, werkzaam in het Antonius Ziekenhuis te Nieuwegein, NVK
- Drs. G. Brinkhorst, kinderarts-pulmonoloog, werkzaam bij Noordwest Ziekenhuisgroep Alkmaar-Den Helder, NVK
- Drs. R. Klein-Blommert, intensive care kinderverpleegkundige, werkzaam in het VU medisch Centrum te Amsterdam, V&VN
- Drs. I. Morsing, kinder-intensivist, werkzaam in het Utrecht Medisch Centrum te Utrecht, NVK
- E. Schmidt-Cnossen, MSc, senior projectmedewerker, werkzaam bij Stichting Kind en Ziekenhuis - tot april 2019
- J. Pingen, MSc, junior project- en beleidsmedewerker, werkzaam bij Stichting Kind en Ziekenhuis - vanaf mei 2019
- Dr. S. Terheggen-Lagro, kinderarts-pulmonoloog, werkzaam bij het Amsterdam Universitair Medisch Centrum te Amsterdam, NVK
Met ondersteuning van
- Dr. J. Buddeke, adviseur, Kennisintituut van de Federatie Medisch Specialisten
- Dr. E. Breejen, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Kapitein |
Kinderarts-intensivist, Amsterdam UMC, locatie AMC |
Human factor en crew resource management trainer (onbetaald) |
Geen |
Geen |
|
Balemans |
Kinderarts-pulmonoloog |
gastdocent TNO (astma bij kinderen voor jeugdartsen) Lid van MEC-U (medische ethische toetsingscommissie; samenwerking tussen het St. Antonius Ziekenhuis te Utrecht/Nieuwegein, het Catharina Ziekenhuis te Eindhoven, het Diakonessenhuis te Utrecht /Zeist /Doorn, het Maasstad Ziekenhuis te Rotterdam, het Meander Medisch Centrum te Amersfoort /Baarn en het OLVG te Amsterdam Visiteur voor de Registratiecommissie Geneeskundig Specialisten (RGS) -instellingsvisitaties |
Geen |
Geen |
|
Brinkhorst |
Kinderarts-pulmonoloog |
Lid Centraal Medisch Tuchtcollege (onkostenvergoeding) Instructeur SSHK (reiskostenvergoeding) |
Geen |
Geen |
|
Morsing |
Kinder-intensivist, UMC Utrecht |
Human factor en crew resource management trainer in healthcare |
Geen |
Geen |
|
Klein -Blommert |
Intensive care kinderverpleegkundige |
Docent aan de opleiding voor intensive care kinderen bij de Amstel Academie |
Geen |
Geen |
|
Schmidt – tot april 2019 |
Projectmanager - stichting kind en ziekenhuid 32 u p/w |
Psycholoog - laat ons ouders zijn (8/16 u p/w) Vrijwilliger ouderraad Sophia vrijwilliger VOC en vrijwilliger stichting Hiva |
Geen |
Geen |
|
Pingen – vanaf mei 2019 |
Junior project- en beleidsmedewerker |
Verzorgende niveau 3 |
Geen |
Geen |
|
Terheggen-Lagro |
Subafdelingshoofd kinderlongziekten, Amsterdam AMC, locatie AMC |
Betrokken bij ontwikkeling kwaliteitsstandaard CF (onbetaald) |
Geen |
Geen |
Inbreng patiëntenperspectief
Tijdens alle stappen van het ontwikkelproces is rekening gehouden met het patiëntperspectief. Een medewerker van stichting Kind en Ziekenhuis had zitting in de werkgroep. Tijdens de knelpuntenanalyse heeft stichting Kind en Ziekenhuis een knelpuntenanalyse uitgevoerd onder haar achterban. Tevens is de conceptrichtlijn voor commentaar aan stichting Kind en Ziekenhuis voorgelegd.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten van elke module. De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat er geen substantiële barrières konden worden geïdentificeerd die de implementatie van de aanbeveling zouden kunnen bemoeilijken.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de ervaren knelpunten rondom de zorg van high flow onder relevante partijen. Middels een schriftelijke knelpuntenanalyse is er input gevraagd op het conceptraamwerk aan de Nederlandse Vereniging voor Kindergeneeskunde, Verpleegkundige en Verzorgende Nederland, Nederlandse Vereniging voor Spoedeisende Hulp Artsen, Ambulancezorg, Nederlands Huisartsen Genootschap, stichting Kind en Ziekenhuis, Longfonds, Patientenfederatie, Inspectie voor de Gezondheidszorg en Jeugd, Nederlandse Federatie van Universitair Medische Centra, Nederlandse Vereniging van Ziekenhuizen, Samenwerkende Topklinische opleidingsZiekenhuizen, Zorginstituut Nederland, Zelfstandige Klinieken Nederland, Zorgverzekeraars Nederland, DBC-onderhoud, ZonMW en de Nederlandse Zorgautoriteit. Een beknopte samenvatting van de schriftelijke knelpuntenanalyse is opgenomen in de is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal, belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: Cochrane – voor gerandomiseerd gecontroleerd onderzoek en PROBAST – voor prognostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat er geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2000 – aug 2018
|
1 (high flow or high-flow or optiflow or hfnc or hfnct).ti. (1549) 2 exp Respiratory Tract Infections/ or exp Respiratory Insufficiency/ or exp BRONCHIOLITIS/ or exp PNEUMONIA/ or exp ASTHMA/ or ((respiratory adj3 support) or failure or insufficiency or infection or disease).ti,ab. or bronchiolitis.ti,ab. or pneumonia.ti,ab. or asthma*.ti,ab. or wheez*.ti,ab. (4343418) 3 neonates/ or premature infants/ or preterm*.ti,ab. or prematur*.ti,ab. or postmatur*.ti,ab. or perinat*.ti,ab. or postnat*.ti,ab. or neonat*.ti,ab. or newborn*.ti,ab. or new-born.ti,ab. or infant, newborn/ or infant/ or infant behavior/ or infan*.ti,ab. or toddler*.ti,ab. or baby*.ti,ab. or babies.ti,ab. or child behavior/ or child development/ or child psychiatry/ or orthopsychiatry/ or child psychology/ or child behavior disorders/ or pediatrics/ or paediat*.ti,ab. or pediat*.ti,ab. or child/ or child*.ti,ab. or kid.ti,ab. or kids.ti,ab. or puberty/ or puberty.ti,ab. or pubescen*.ti,ab. or prepubescen*.ti,ab. or prepuberty*.ti,ab. or teen*.ti,ab. or young*.ti,ab. or youth*.ti,ab. or minors*.ti,ab. or under ag*.ti,ab. or underag*.ti,ab. or juvenile*.ti,ab. or preadolesc*.ti,ab. or adolescent/ or adolescent behavior/ or adolescent development/ or adolescent psychiatry/ or adolescent psychology/ or adolesc*.ti,ab. or young adult/ or girl*.ti,ab. or boy*.ti,ab. or schools, nursery/ or nursery.ti,ab. or child day care centers/ or child care/ or early childhood education.ti,ab. or kindergarten*.ti,ab. or child, preschool/ or preschool*.ti,ab. or elementary education.ti,ab. or primary education.ti,ab. or K-12*.ti,ab. or K12.ti,ab. or secondary education.ti,ab. or junior high*.ti,ab. or highschool*.ti,ab. or college*.ti,ab. or tertiary education.ti,ab. or postsecondary education.ti,ab. or undergrad*.ti,ab. or education, graduate/ or universities/ or universit*.ti,ab. or students/ or student*.ti,ab. or schools/ or school*.ti,ab. or classroom*.ti,ab. (5166175) 4 1 and 2 and 3 (255) 5 limit 4 to english language (233) 6 limit 5 to yr="2000 -Current" (223)
= 223 |
324 |
|
Embase (Elsevier) |
('high flow nasal cannula'/exp/mj OR 'high flow nasal cannula oxygen therapy'/exp/mj OR 'high flow nasal cannula therapy'/exp/mj OR 'high flow oxygen therapy'/exp/mj OR 'high flow nasal oxygen therapy'/exp/mj OR 'high flow nasal cannula oxygen'/exp/mj OR 'high flow nasal oxygen'/exp/mj OR 'high flow':ti OR 'high-flow':ti OR optiflow:ti OR hfnc:ti OR hfnct:ti) AND (adolescen*:ab,ti OR 'adolescence'/exp OR 'adolescent coping orientation for problem experiences'/exp OR 'adolescent development'/exp OR 'adolescent disease'/exp OR 'adolescent health'/exp OR 'adolescent parent'/exp OR 'adolescent pregnancy'/exp OR 'adolescent smoking'/exp OR 'adolescent'/exp OR 'adolescent-family inventory of life events and changes'/exp OR babies:ab,ti OR baby:ab,ti OR 'birth weight'/exp OR boy:ab,ti OR boyhood:ab,ti OR boys:ab,ti OR 'brazelton neonatal behavioral assessment scale'/exp OR 'child abuse'/exp OR 'child advocacy'/exp OR 'child behavior checklist'/exp OR 'child behavior'/exp OR 'child care'/exp OR 'child death'/exp OR 'child health care'/exp OR 'child health'/exp OR 'child nutrition'/exp OR 'child parent relation'/exp OR 'child psychology'/exp OR 'child restraint system'/exp OR 'child safety'/exp OR 'child welfare'/exp OR child*:ab,ti OR 'child'/exp OR 'childhood disease'/exp OR 'childhood mortality'/exp OR 'childhood'/exp OR girl:ab,ti OR girlhood:ab,ti OR girls:ab,ti OR 'high risk infant'/exp OR infan*:ab,ti OR 'infant disease'/exp OR 'infant mortality'/exp OR 'infant nutrition'/exp OR 'infant welfare'/exp OR 'infanticide'/exp OR 'infantile diarrhea'/exp OR 'infantile hypotonia'/exp OR 'juvenile delinquency'/exp OR neonat*:ab,ti OR 'neonatal weight loss'/exp OR 'newborn disease'/exp OR 'newborn morbidity'/exp OR 'newborn period'/exp OR newborn*:ab,ti OR 'newborn'/exp OR nicu:ab,ti OR 'only child'/exp OR paediatr*:ab,ti OR pediatri*:de,ab,ti OR 'pediatric advanced life support'/exp OR 'pediatric anesthesia'/exp OR 'pediatric cardiology'/exp OR 'pediatric hospital'/exp OR 'pediatric intensive care nursing'/exp OR 'pediatric nurse practitioner'/exp OR 'pediatric nursing'/exp OR 'pediatric rehabilitation'/exp OR 'pediatric surgery'/exp OR 'newborn hypoxia'/exp OR 'pediatric ward'/exp OR 'pediatrics'/exp OR perinat*:ab,ti OR 'perinatal development'/exp OR 'perinatal period'/exp OR 'persistent hyperinsulinemic hypoglycemia of infancy'/exp OR picu:ab,ti OR postnat*:ab,ti OR 'postnatal care'/exp OR 'postnatal development'/exp OR 'postnatal growth'/exp OR postneonat*:ab,ti OR preschool*:ab,ti OR puberty:ab,ti OR 'runaway behavior'/exp OR 'school child':ab,ti OR schoolchild*:ab,ti OR 'severe myoclonic epilepsy in infancy'/exp OR suckling*:ab,ti OR teen:ab,ti OR teenager*:ab,ti OR teens:ab,ti OR toddler*:ab,ti OR 'transient hypogammaglobulinemia of infancy'/exp OR youth:ab,ti OR youths:ab,ti) AND ('respiratory tract disease'/exp OR 'respiratory failure'/exp OR 'bronchiolitis'/exp OR 'pneumonia'/exp OR 'asthma'/exp OR 'wheezing'/exp OR ((respiratory NEAR/3 (support OR failure OR insufficiency OR infection OR disease OR bronchiolitis)):ti,ab) OR pneumonia:ti,ab OR asthma*:ti,ab OR wheez*:ti,ab) AND (english)/lim AND (2000-2018)/py NOT 'conference abstract':it
= 270 |
