Laparoscopische versus laparotomische myomectomie bij vrouwen met myomen
Uitgangsvraag
Wat is de effectiviteit van een laparoscopische versus laparotomische myomectomie bij de behandeling van myomen bij vrouwen met hevig menstrueel bloedverlies?
Aanbeveling
Geef de voorkeur aan een laparoscopische myomectomie boven een laparotomische myomectomie indien dit technisch haalbaar is, met het oog op een kortere opnameduur.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is één systematische review en meta-analyse geïncludeerd van Chittawar (2014). De review rapporteerde de uitkomsten re-interventies (recidief myomen, re-interventie (herhaalde myomectomie, hysterectomie op een later moment) en de duur van de ziekenhuisopname. Er werden geen klinisch relevante verschillen gevonden in de terugkeer van myomen en het aantal re-interventies. Het bewijs werd beoordeeld als van zeer lage kwaliteit. De verblijfsduur in het ziekenhuis was bij alle studies minder lang bij een laparoscopische myomectomie. Het bewijs werd beoordeeld van lage kwaliteit. Hersteltijd (tijd tot terugkeer naar dagelijkse bezigheden of werk), patiënttevredenheid en kwaliteit van leven werden door de geïncludeerde trials niet gerapporteerd.
Omdat de rapportage van patiëntgerichte uitkomsten, zoals patiënttevredenheid en kwaliteit van leven, zeer beperkt was in de geïncludeerde RCT’s van de systematische review van Chittawar (2014), is besloten om twee prospectieve cohortstudies te beschrijven, die patiëntgerichte uitkomsten hebben gemeten, kort 6 tot 12 weken na de operatie (Laughin-Tomasso, 2020) en 6 tot 12 maanden na de operatie (Rodriguez-Triana, 2020). Deze studies konden niet worden meegenomen met de literatuuranalyse omdat de patiënten sterk verschilden op baseline niveau. De resultaten zijn echter wel beschreven in de overwegingen om toch een beeld te kunnen krijgen van het effect van de twee operatieve interventies op kwaliteit van leven en herstel na de operatie. De resultaten zullen met zorgvuldigheid moeten worden geïnterpreteerd.
In een prospectieve registratie studie (COMPARE-UF) van Laughin-Tomasso (2020) werden verschillende operatieve interventies, inclusief (robotisch ondersteunde) laparoscopische en laparotomische myomectomie met elkaar vergeleken bij vrouwen met symptomatische myomen op onder andere kwaliteit van leven, terugkeer naar werk en dagelijkse activiteiten en re-interventies. Hiervoor werden vragenlijsten, inclusief de gevalideerde EQ5D en USF-QOL, afgenomen op baseline niveau voor de operatie, en 6 tot 12 weken na de operatie.
In totaal werden 1206 vrouwen vergeleken met baseline en follow up uitkomsten: 519 met een (robot-geassisteerde) laparoscopische ingreep en 349 met een abdominale ingreep (338 vrouwen met een hysteroscopische ingreep zullen niet besproken worden).
Er werden geen grote verschillende gezien tijdens de follow up tussen de laparoscopische en laparotomische ingreep op domeinen van de UFS-QOL. Vrouwen waren op alle domeinen verbeterd ten opzichte van de baseline niveaus. Vrouwen na een abdominale ingreep meldden minder bloedingsklachten, maar de VAS-score was vergelijkbaar tussen groepen.
Re-interventies waren vergelijkbaar tussen groepen met 3.9% en 3.8% voor een laparoscopische en laparotomische ingreep. In conclusie lijken vrouwen met laparoscopische myomectomie iets sneller naar werk terug te keren, maar het verschil in hersteltijd naar dagelijkse activiteiten was klein.
De prospectieve cohortstudie van Rodriguez-Triana (2020) vergeleek vrouwen met symptomatische fibromen na een laparoscopische en abdominale myomectomie op kwaliteit van leven en ernst van de symptomen scores. De studie werd gedaan in een academisch centrum in California (VS) en gebruikte de UFS-QOL om de effecten van de myomen op kwaliteit van leven te beoordelen vooraf en 6 en 12 maanden na de operatie. De studie vergeleek de verschillen tussen baseline en follow up niveaus tussen de operatiewijzen per domein van de kwaliteit van leven-vragenlijst (QOL) en de symptom-severity-index (SS). 80 Vrouwen werden vergeleken tussen baseline en follow up, waarvan 28 laparoscopische myomectomie ondergingen en 52 abdominale myomectomie. Ondanks verschillen in baseline (grotere en meerdere myomen in laparotomie groep), hadden beide groepen 6 tot 12 maanden na de operatie een significante verbetering op alle domeinen van de QOL en SS. Gemiddelde SS-index, 6 tot 12 maanden na de operatie, was niet significant verschillend tijdens de 6 tot 12 maanden follow up, met 20 in de laparoscopische groep versus 13 in de abdominale groep. Ook QOL-scores verschilden niet significant van elkaar met respectievelijk 91 versus 88 in de laparoscopische versus abdominale groep. In beide groepen namen de symptomen dramatisch af op alle domeinen, ongeacht de ingreep.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Voor patiënten die een myomectomie ondergaan is er een voordeel voor de laparoscopische benadering wat betreft de opnameduur en de mate van invasiviteit. Aangezien er geen verschil lijkt te zijn in recidieven en re-interventie zou dit dan ook de voorkeur moeten hebben indien technisch haalbaar. Waarbij bij een laparoscopische myomectomie vaak gebruik gemaakt wordt van morcellatie (eventueel in een zak).
Een myomectomie wordt in principe alleen verricht bij patiënten die nog een kinderwens hebben en dus hun uterus willen behouden. Of intramurale of subsereuze myomen invloed hebben op de fertiliteit is niet duidelijk. Dit geldt wel voor de submuceuze myomen.
In de literatuur wordt mogelijk een iets grotere kans genoemd op een uterusruptuur bij een zwangerschap na een laparoscopische myomectomie dan na een laparotomische myomectomie. Hier zijn echter geen RCT’s over.
Uit prospectieve studies blijkt dat patiënten na een myomectomie in het algemeen een verbeterde kwaliteit van leven ervaren ongeacht het type myomectomie.
Kosten (middelenbeslag)
De kosten zullen waarschijnlijk hoger zijn voor een laparoscopische ingreep, echter de opnameduur in het ziekenhuis lijkt weer korter te zijn.
Aanvaardbaarheid, haalbaarheid en implementatie
De keuze voor een laparoscopische of laparotomische myomectomie is afhankelijk van de hoeveelheid, de locatie en de grootte van de myomen. Ook de expertise van het behandelend centrum speelt hierin mee; er kan verwezen worden naar een ander centrum.
Een voorbehandeling met GnRH-analogen kan nuttig zijn om het myoom of de myomen te verkleinen waardoor bijvoorbeeld een laparoscopische ingreep toch mogelijk kan zijn, of in geval van een laparotomische ingreep de incisie minder groot of anders (pfannenstiel versus mediane incisie) kan zijn.
Rationale van de aanbeveling
Voor patiënten met klachten van de uterus myomatosus en een wens tot behoud van uterus is een myomectomie een behandeloptie. Na een laparoscopische myomectomie lijkt er een kortere opnameduur en het herstel ook sneller te zijn, waarbij geen verschil is in recidieven of re-interventies.
Onderbouwing
Achtergrond
Voor vrouwen met een uterus myomatosus met klachten en nog een kinderwens is een myomectomie een behandeloptie, waarbij de uterus behouden blijft. Deze ingreep kan laparotomisch of laparoscopisch verricht worden. De keuze wordt gemaakt op basis van de grootte, hoeveelheid en locatie van de myomen, maar ook de voorkeur van de behandelaar en/of centrum speelt een rol. Hierdoor is er praktijkvariatie. Na een laparoscopische ingreep herstellen patiënten sneller. Mogelijk is er wel verschil in effect, recidief myomen en complicaties.
Conclusies / Summary of Findings
Re-interventie
De uitkomstmaat re-interventie is gerapporteerd als recidief myomen, opnieuw myomectomie en hysterectomie op een later tijdstip. De sub-uitkomstmaten werden apart beoordeeld op niveau van bewijskracht.
|
Laag GRADE |
Een laparoscopische myomectomie lijkt niet of nauwelijks te resulteren in een verschil recidief myomen vergeleken met een laparotomische myomectomie bij vrouwen met hevig menstrueel bloedverlies.
Bronnen: Chittawar, 2014 |
|
Zeer laag GRADE |
Het bewijs is erg onzeker over het verschil in herhaalde myomectomie na een laparoscopische versus laparotomische myomectomie als behandeling van myomen bij vrouwen met hevig menstrueel bloedverlies.
Bronnen: Chittawar, 2014 |
|
Zeer laag GRADE |
Het bewijs is erg onzeker over het verschil in hysterectomie op een later moment na een laparoscopische versus laparotomische myomectomie als behandeling van myomen bij vrouwen met hevig menstrueel bloedverlies.
Bronnen: Chittawar, 2014 |
Herstel
De uitkomstmaat hersteltijd tot terugkeer naar dagelijkse activiteiten en werk is niet gerapporteerd. Opnameduur in het ziekenhuis is wel gerapporteerd (zie ook beoordeling van de bewijskracht).
|
Laag GRADE |
Vrouwen verblijven na een laparoscopische myomectomie waarschijnlijk minder lang in het ziekenhuis dan na een laparotomische myomectomie.
Bronnen: Chittawar, 2014 |
|
Geen GRADE |
De uitkomstmaat amenorroe/reductie in menstrueel bloedverlies werd niet gerapporteerd. |
|
Geen GRADE |
De uitkomstmaat patiënttevredenheid werd niet gerapporteerd. |
Samenvatting literatuur
Beschrijving van de studies
De Cochrane systematische review en meta-analyse van Chittawar (2014) onderzocht de voor- en nadelen van een laparoscopische myomectomie versus laparotomische myomectomie (open procedure of via mini-laparotomie) bij vrouwen met myomen. De databases Cochrane Central Register of Controlled Trials (CENTRAL), the Menstrual Disorders and Subfertility Group (MDSG) Specialised Register of Controlled Trials, MEDLINE(R), Embase, PsycInfo and CINAHL werden doorzocht tot juli 2014. De auteurs includeerden alleen geblindeerde gerandomiseerde gecontroleerde studies (geblindeerde RCT's) die laparoscopische en laparotomische myomectomie vergeleken (open procedure of via mini-laparotomie). Hysteroscopie werd ook toegevoegd aan de vergelijking, maar verwijderd voor deze literatuuranalyse.
Chittawar (2014) includeerde in totaal negen RCT’s, waarvan één trial werd door de werkgroep van alle analysen is verwijderd omdat laparoscopisch geassisteerde-mini laparotomie werd gebruikt in de laparotomiegroep (Tan, 2008). De in totaal 8 geïncludeerde studies werden uitgevoerd in Italië (Alessandri, 2006; Cicinelli, 2009; Mais, 1995; Palomba, 2007; Rosetti, 2001; Seracchioli, 2010 en Sesti, 2008) en Australië (Holzer, 2006). ‘Laparoscopische myomectomie’ werd gedefinieerd als "de verwijdering van myomen via een diathermische incisie van de baarmoeder, vaak met behulp van morcellatie, met kleine incisies in de buikwand waardoor instrumenten onder laparoscopische controle worden ingebracht (Chittawar, 2014; Semm, 1979)". ‘Laparotomische myomectomie’ omvatte ‘open myomectomie’ en ‘mini-laparotomie’. Bij ‘open laparotomie wordt een grote (ongeveer 12 cm) dwarsincisie in de buik wordt gemaakt, de myomen worden verwijderd, hechtingen worden aangebracht en buiklagen worden gesloten (meestal minimaal de rectusschede en huidlagen)" (Chittawar, 2014). Bij mini-laparatomie is de incisie kleiner (circa 4 tot 6 cm) (Chittawar, 2014). Analyses werden uitgevoerd met supgroepen voor het type procedure.
Resultaten
In totaal 8 RCT’s uit de systematische review en meta-analyse van Chittawar (2014) werden geschikt gevonden voor inclusie (zie beschrijving van de studies). Waar mogelijk werden gepoolde analyses uitgevoerd. Alle analyses werden uitgevoerd met subgroepen voor het type laparotomische myomectomie dat werd gebruikt: open-laparotomie en mini-laparotomie.
1. Re-interventies
De review van Chittawar (2014) definieerde de uitkomst re-interventies als het terugkomen van de myomen (1.1), een herhaalde myomectomie (1.2) of een hysterectomie op een later moment (1.3).
1.1 Re-interventie - Recidief myomen
Vier studies (460 vrouwen) beschreven de uitkomst recidief myomen (Alessandri, 2006; Rosetti, 2001; Seracchioli, 2000; Sesti, 2008). Twee studies (Rosetti, 2001 en Seracchioli, 2000) werden meegenomen in de subgroep vergelijking ‘laparoscopische versus laparotomische myomectomie’ en twee studies (Alessandri, 2006 en Sesti, 2008) in de subgroep vergelijking ‘ laparoscopische myomectomie versus mini-laparotomie’.
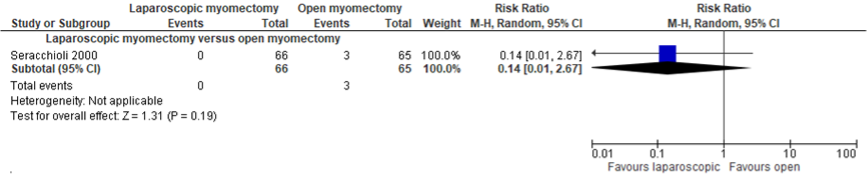
Figuur 7.1.7.1 Uitkomstmaat recidief myomen vergelijking laparoscopische myomectomie versus laparotomische myomectomie
Bron: Chittawar (2014). Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Recidief myomen werden beschreven in 30/231 (13%) vrouwen in de laparoscopische myomectomie groep versus 27/299 (9%) in de laparotomie groep (RR 1.10 (95%CI 0.69 tot 1.75)) (Figuur 7.1.7.1 Uitkomstmaat recidief myomen vergelijking laparoscopische myomectomie versus laparotomische myomectomie). Dit verschil was niet statistisch significant en klinisch relevant volgens de vooraf gestelde grenzen van klinische besluitvorming (ARR≥ 10%). In de subgroep laparoscopische myomectomie versus open myomectomie was het recidief 23/107 (21.5%) versus 21/105 (20%) respectievelijk (RR 1.08 (95%CI 0.64 tot 1.82)). In de subgroep laparoscopische myomectomie versus mini-laparotomie was een recidief van 7/124 (5.6%) versus 6/124 (4.8%) respectievelijk (RR 1.17 (95%CI 0.69 tot 1.75)). Het verschil binnen de subgroepen was ook niet statistisch significant en klinisch relevant.
1.2 Re-interventie - herhaalde myomectomie
De studie van Seracchioli (2000) onderzocht de uitkomst herhaalde myomectomie bij laparoscopische myomectomie versus een open myomectomie bij 131 vrouwen.
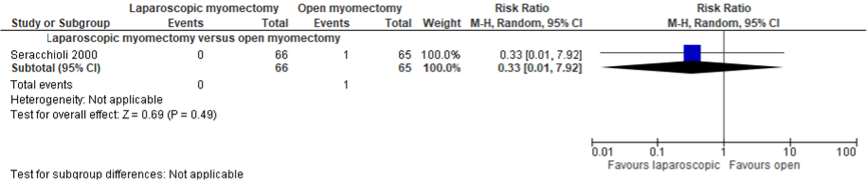
Figuur 7.1.7.2 Uitkomstmaat herhaalde myomectomie vergelijking laparoscopische myomectomie versus laparotomische myomectomie
Bron: Chittawar (2014). Z: p-waarde van het gepoolde effect; CI: betrouwbaarheidsinterval
Myomectomie werd geen enkele keer opnieuw uitgevoerd in de laparoscopische groep versus 3 keer in de laparotomie groep: 0/66 (0%) versus 3/65 (4.6%) (RR 0.14 (95% CI 0.01 tot 2.67)) (Figuur 7.1.7.2 Uitkomstmaat herhaalde myomectomie vergelijking laparoscopische myomectomie versus laparotomische myomectomie). Dit verschil was niet statistisch significant en klinisch relevant volgens de vooraf gestelde klinische criteria (RD≥ 10%).
1.3 Re-interventie - Hysterectomie op een later moment
De studie van Seracchioli (2000) onderzocht de uitkomst hysterectomie op een later moment bij laparoscopische myomectomie versus een open myomectomie bij 131 vrouwen.
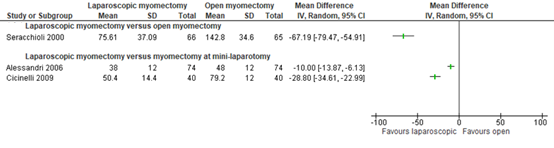
Figuur 7.1.7.3 Uitkomstmaat hysterectomie op een later moment vergelijking laparoscopische myomectomie versus laparotomische myomectomie
Bron: Chittawar (2014). Z: p-waarde van het gepoolde effect; CI: betrouwbaarheidsinterval
In de laparoscopiegroep werd geen hysterectomie uitgevoerd versus één hysterectomie bij een patiënt in de laparotomiegroep: (0/66 (0%) versus 1/65 (1.5%) (RR 0.33 (95% CI 0.01 tot 7.92)) (Figuur 7.1.7.3 Uitkomstmaat hysterectomie op een later moment vergelijking laparoscopische myomectomie versus laparotomische myomectomie). Dit verschil was niet statistisch significant en klinisch relevant volgens de vooraf gestelde klinische criteria (RD≥10%).
2. Herstel
Chittawar (2014) rapporteerde niet over de uitkomstmaat hersteltijd, gedefinieerd als tijd tot aan terugkeer naar werk of dagelijkse activiteiten. Deze review rapporteerde wel over de uitkomstmaat ‘opnameduur (uren)’. De review vond drie studies (359 vrouwen) die rapporteerden over de uitkomst opnameduur (Alessandri, 2006; Cicinelli, 2009 en Seracchioli, 2000). De resultaten werden niet gepoold vanwege de heterogeniteit tussen de studies.
Figuur 7.1.7.4 Uitkomstmaat opnameduur (uren) vergelijking laparoscopische myomectomie versus laparotomische myomectomie
Bron: Chittawar (2014). Z: p-waarde van het gepoolde effect; CI: betrouwbaarheidsinterval
De studie van Seracchioli (2000) vergeleek laparoscopische myomectomie versus open myomectomie bij 131 vrouwen. De studie vond een kortere opnameduur in de laparoscopiegroep met een gemiddeld verschil van 67 uur (Mean difference -67.10 (95%CI -79.47 tot -54.91)) (Figuur 7.1.7.4 Uitkomstmaat opnameduur (uren) vergelijking laparoscopische myomectomie versus laparotomische myomectomie). De twee studies van Alessandri (2006) and Cicinelli (2009) vergeleken laparoscopische myomectomie met een myomectomie via mini-laparotomie bij 148 en 80 vrouwen respectievelijk. De resultaten werden niet gepoold door de heterogeniteit tussen de studies. Beide studies vonden een korte opnameduur van 10 en 29 uur respectievelijke in het voordeel van de laparoscopiegroep (Alessandri, 2006: Mean difference -10.00 (95%CI -13.87 tot -6.13); Cicinelli, 2009: Mean difference -28.80 (95%CI -34.61 tot -22.99).
3. Amenorroea/reductie menstrueel bloedverlies (gevalideerde schaal)
De uitkomstmaat amenorroea/reductie menstrueel bloedverlies, gemeten met een gevalideerde schaal, werd niet gerapporteerd.
4. Patiënt tevredenheid (gevalideerde schaal)
De uitkomstmaat patiënt tevredenheid, gemeten met een gevalideerde schaal, werd niet gerapporteerd.
5. Kwaliteit van leven (gevalideerde schaal)
De uitkomstmaat kwaliteit van leven, gemeten met een gevalideerde schaal, werd niet gerapporteerd.
Bewijskracht van de literatuur
Gerandomiseerde gecontroleerde trials (RCT’s) starten op een hoog niveau van bewijskracht.
De uitkomstmaat re-interventie was gerapporteerd door Chittawar (2014) als recidief myomen, opnieuw myomectomie en hysterectomie op een later tijdstip. De sub-uitkomstmaten werden apart beoordeeld op niveau van bewijskracht.
De uitkomst recidief myomen werd afgewaardeerd naar een lage GRADE wegens imprecisie (het aantal gerapporteerde events was laag met 44 en 57 events respectievelijk en het betrouwbaarheidsinterval overschrijdt zowel de ondergrens als bovengrens voor klinische besluitvorming).
De uitkomstmaat herhaalde myomectomie werd afgewaardeerd naar een zeer lage GRADE wegens imprecisie (het aantal gerapporteerde events was zeer laag met 3 events en het betrouwbaarheidsinterval overschrijdt zowel de ondergrens als bovengrens voor klinische besluitvorming).
De uitkomstmaat hysterectomie op een later moment werd afgewaardeerd naar een zeer lage GRADE wegens imprecisie (het aantal gerapporteerde events was zeer laag met 1 event en het betrouwbaarheidsinterval overschrijdt zowel de ondergrens als bovengrens voor klinische besluitvorming).
Het niveau van bewijskracht voor de uitkomstmaat herstel was gerapporteerd door Chittawar (2014) als opnameduur in het ziekenhuis. De uitkomst waar de werkgroep eigenlijk in geïnteresseerd was, namelijk hersteltijd tot terugkeer naar dagelijkse bezigheden en naar werk, was niet gerapporteerd en daarom werd één niveau afgewaardeerd voor indirectheid. Hersteltijd was verder afgewaardeerd wegens heterogeniteit tussen studies, waardoor resultaten niet gepoold konden worden. Het niveau van bewijskracht kwam hiermee op een lage GRADE.
De uitkomstmaat amenorroe/reductie menstrueel bloedverlies werd niet gerapporteerd.
De uitkomstmaat patiënt tevredenheid werd niet gerapporteerd.
De uitkomstmaat kwaliteit van leven werd niet gerapporteerd.
Zoeken en selecteren
Er werd een systematische review van de literatuur uitgevoerd om de volgende vraag te beantwoorden:
Wat is de effectiviteit van een laparoscopische versus een laparotomische myomectomie voor de behandeling van myomen bij vrouwen met hevig menstrueel bloedverlies?
P: Vrouwen met hevig menstrueel bloedverlies en myomen.
I: Laparoscopische myomectomie.
C: Laparotomische myomectomie.
O: Re-interventies, hersteltijd, amenorroe/reductie in menstrueel bloedverlies (menstruatie scores, hoeveelheid bloedverlies), kwaliteit van leven, patiënt tevredenheid.
Relevante uitkomstmaten
De richtlijn werkgroep beschouwde de uitkomstmaat re-interventies als cruciaal en alle andere uitkomstmaten als belangrijk voor de besluitvorming.
De werkgroep definieerde de uitkomstmaten als volgt:
- re-interventies: chirurgische procedures die gedaan worden vanwege terugkeer van myoom gerelateerde klachten;
- hersteltijd: de tijd tussen chirurgisch ingrijpen en terugkeer naar werk en andere dagelijkse activiteiten;
- amenorroe: het uitblijven van de menstruatie voor langer dan 90 dagen (Fraser, 2011);
- reductie in menstrueel bloedverlies: gemeten met een gevalideerde schaal;
- kwaliteit van leven: gemeten met een gevalideerde schaal;
- patiënt tevredenheid: gemeten zijn met een gevalideerde schaal.
The werkgroep definieerde de klinische afkapwaardes als volgt:
- re-interventies: een 10% risico verschil (RV) of number needed to treat (NNT) van 10;
- hersteltijd: 1 week verschil in terugkeer naar werk of andere dagelijkse activiteiten;
- PBAC: een verschil van 50 punten op de PBAC schaal of een reductie van menstrueel bloedverlies van minstens 22% (Herman, 2017; Lukes, 2010);
- van de andere uitkomstmaten werden vooraf geen afkapwaardes benoemd.
Zoeken en selecteren (Methoden)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 18 februari 2021 met relevante zoektermen gezocht naar de effectiviteit van een laparoscopische versus een laparotomische myomectomie voor de behandeling van myomen bij vrouwen met hevig menstrueel bloedverlies. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 300 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: laparoscopische versus laparotomische myomectomie bij vrouwen met hevig menstrueel bloedverlies en myomen. De robot-geassisteerde myomectomie hebben wij geëxcludeerd, omdat dit maar een kleine groep is en maar in een aantal centra wordt uitgevoerd. Op basis van titel en abstract werden in eerste instantie 18 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 17 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en één Cochrane systematische review definitief geselecteerd.
De Cochrane systematische review en meta-analyse van Chittawar (2014) vergeleek ‘open myomectomie’ waaronder mini-laparotomie en open-procedure laparotomie met laparoscopische myomectomie. De later gepubliceerde reviews door Palomba (2015) en Chen (2015) vergeleken ook mini-laparotomie met laparoscopische myomectomie maar vonden geen RCT’s die niet door Chittawar in 2014 gevonden waren. Omdat de Cochrane systematische review en meta-analyse door Chittawar (2014) uitvoeriger was, is besloten om deze review te gebruiken voor de literatuuranalyse. De overige studies zijn de vinden in de tabel met de geëxcludeerde studies (zie tabblad Verantwoording).
Resultaten
Eén Cochrane systematisch review en meta-analyse (Chittawar, 2014) werd geïncludeerd voor de analyse van de literatuur. Belangrijke studiekarakteristieken en resultaten zijn samengevat in de evidencetabellen (zie tabblad Evidencetabellen). De beoordeling van de individuele studieopzet is opgenomen in de risk-of-biastabellen (zie tabblad Evidence tabellen).
Referenties
- Alessandri F, Lijoi D, Mistrangelo E, Ferrero S, Ragni N. Randomized study of laparoscopic versus minilaparotomic myomectomy for uterine myomas. J Minim Invasive Gynecol. 2006 Mar-Apr;13(2):92-7.
- Bhave Chittawar P, Franik S, Pouwer AW, Farquhar C. Minimally invasive surgical techniques versus open myomectomy for uterine fibroids. Cochrane Database of Systematic Reviews 2014, Issue 10.
- Chen R, Su Z, Yang L, Xin L, Yuan X, Wang Y. The effects and costs of laparoscopic versus abdominal myomectomy in patients with uterine fibroids: a systematic review and meta-analysis. BMC Surg. 2020 Mar 20;20(1):55.
- Cicinelli E, Tinelli R, Colafiglio G, Saliani N. Laparoscopy versus minilaparotomy in women with symptomatic uterine myomas: a prospective randomized study. J Minim Invasive Gynecol. 2009 Jul-Aug;16(4):422-6.
- Fraser, I. S., Critchley, H. O., Broder, M., & Munro, M. G. (2011, September). The FIGO recommendations on terminologies and definitions for normal and abnormal uterine bleeding. In Seminars in reproductive medicine (Vol. 29, No. 05, pp. 383-390). © Thieme Medical Publishers.
- Gupta JK, Daniels JP, Middleton LJ, et al.; on behalf of the ECLIPSE Collaborative Group. A randomised controlled trial of the clinical effectiveness and cost-effectiveness of the levonorgestrel-releasing intrauterine system in primary care against standard treatment for menorrhagia: the ECLIPSE trial. Southampton (UK): NIHR Journals Library; 2015 Oct. (Health Technology Assessment, No. 19.88.) Chapter 2, Outcome measures for the evaluation of treatment of heavy menstrual bleeding.
- Herman MC, Mak N, Geomini PM, Winkens B, Mol BW, Bongers MY; International Heavy Menstrual Bleeding IPD Meta-analysis Collaborative Group. Is the Pictorial Blood Loss Assessment Chart (PBAC) score associated with treatment outcome after endometrial ablation for heavy menstrual bleeding? A cohort study. BJOG. 2017 Jan;124(2):277-282.
- Holzer A, Jirecek ST, Illievich UM, Huber J, Wenzl RJ. Laparoscopic versus open myomectomy: a double-blind study to evaluate postoperative pain. Anesth Analg. 2006 May;102(5):1480-4.
- Janssen, C. A., Scholten, P. C., & Heintz, A. P. M. (1995). A simple visual assessment technique to discriminate between menorrhagia and normal menstrual blood loss. Obstetrics & Gynecology, 85(6), 977-982.
- Lethaby, A., Hussain, M., Rishworth, J. R., & Rees, M. C. (2015). Progesterone or progestogen‐releasing intrauterine systems for heavy menstrual bleeding. Cochrane Database of Systematic Reviews, (4). Lukes, A. S., Muse, K., Richter, H. E., Moore, K. A., & Patrick, D. L. (2010). Estimating a meaningful reduction in menstrual blood loss for women with heavy menstrual bleeding. Current medical research and opinion, 26(11), 2673-2678.
- Mais V, Ajossa S, Guerriero S, Mascia M, Solla E, Melis GB. Laparoscopic versus abdominal myomectomy: a prospective, randomized trial to evaluate benefits in early outcome. Am J Obstet Gynecol. 1996 Feb;174(2):654-8.
- Palomba S, Fornaciari E, Falbo A, La Sala GB. Safety and efficacy of the minilaparotomy for myomectomy: a systematic review and meta-analysis of randomized and non-randomized controlled trials. Reprod Biomed Online. 2015 May;30(5):462-81.
- Palomba S, Zupi E, Falbo A, Russo T, Marconi D, Tolino A, Manguso F, Mattei A, Zullo F. A multicenter randomized, controlled study comparing laparoscopic versus minilaparotomic myomectomy: reproductive outcomes. Fertil Steril. 2007 Oct;88(4):933-41.
- Rossetti A, Sizzi O, Soranna L, Cucinelli F, Mancuso S, Lanzone A. Long-term results of laparoscopic myomectomy: recurrence rate in comparison with abdominal myomectomy. Hum Reprod. 2001 Apr;16(4):770-4.
- Semm K. New methods of pelviscopy (gynaecologic laparoscopy) for myomectomy, ovariectomy, tubectomy and adnectomy. Endoscopy 1979;11:85-93.
- Seracchioli R, Rossi S, Govoni F, Rossi E, Venturoli S, Bulletti C, Flamigni C. Fertility and obstetric outcome after laparoscopic myomectomy of large myomata: a randomized comparison with abdominal myomectomy. Hum Reprod. 2000 Dec;15(12):2663-8.
- Sesti F, Capobianco F, Capozzolo T, Pietropolli A, Piccione E. Isobaric gasless laparoscopy versus minilaparotomy in uterine myomectomy: a randomized trial. Surg Endosc. 2008 Apr;22(4):917-23.
- Shen Q, Chen M, Wang Y, Zhou Q, Tao X, Zhang W, Zhu X. Effects of laparoscopic versus minilaparotomic myomectomy on uterine leiomyoma: a meta-analysis. J Minim Invasive Gynecol. 2015 Feb;22(2):177-84.
- Tan J, Sun Y, Dai H, Zhong B, Wang D. A randomized trial of laparoscopic versus laparoscopic-assisted minilaparotomy myomectomy for removal of large uterine myoma: short-term outcomes. J Minim Invasive Gynecol. 2008 Jul-Aug;15(4):402-9.
Evidence tabellen
Research question: What is the effectivity of laparoscopic versus laparotomic myomectomy in myomas in the treatment of menorrhagia?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) Laparoscopic myectomy |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Chittawar, 2014
|
SR and meta-analysis of RCTs
Literature search up to July, 2014
A: Alessandri, 2006 B: Cicinelli, 2009 C: Holzer, 2006 D: Mais, 1995 E: Palomba, 2007 F: Rossetti, 2001 G: Seracchioli, 2000 H: Sesti, 2008
Study design: RCT
Setting and Country: A: Department of Obstetrics and Gynecology, San Martino Hospital, University of Genoa, Italy B: Department of Obstetrics and Gynecology, University of Bari Medical School, Italy C: Department of Obstetrics and Gynecology, Medical University of Vienna, Austria D: Department of Obstetrics and Gynecology of the University of Cagliari, Italy E: Three university Departments of Obstetrics and Gynecology (Catanzaro, Rome and Florence), Italy F: One Department of obstetrics and Gynaecology at a University Hospital, Italy G: a reproductive medicine unit in Italy H: Section of Gynaecology, Department of Surgery, Tor Vergata Hospital University, Rome, Italy
Source of funding and conflicts of interest: A: not mentioned B: not mentioned in the trial report C: not mentioned in the trial report; on contact, study authors mentioned that no funding was obtained D: Quote: "The trial was approved by the university ethical committee, and written informed consent was obtained from each patient" E: not stated in the trial report F: not stated G: not stated H: “Research funds were financed by the Italian Ministry of University. There was no financial interest or any arrangement with the companies producing the instruments used in the study or with competitor companies. There also was no direct payment to the authors from any source for the purpose of financing the writing of the manuscript, nor was there any other financial connections, direct or indirect, or other situations that might raise the question of bias in the work”
|
Inclusion criteria SR: Premenopausal women with uterine fibroids diagnosed by clinical and ultrasound examination. Trials comparing open myomectomy versus myomectomy by laparoscopy or hysteroscopy. The term 'open myomectomy' encompasses laparotomy, mini-laparotomy and laparoscopically assisted mini-laparotomy.
Exclusion criteria SR: We have excluded fertility and pregnancy outcomes following surgical treatment of patients with fibroids, as this has already been addressed by another Cochrane review (Metwally 2012).
8 studies included*
Important patient characteristics at baseline:
N intervention/N control: A: 74/74 B: 40/40 C: 19/21 D: 20/20 E: 68/68 F: 40/41 G: 66/65 H: 50/50 I: 26/26
Number of myomas; fibroid size: A: 1-4; 3 <7cm B: <3; <7cm C: NR; 3-10cm D: 1-4; 3-6 cm E: <3; 3-10cm F: <7; >3cm G: >1; >5cm H: 1-5; 4-10cm I: 1-3; 5-10cm
Interventions: A: Laparoscopic myomectomy versus mini-laparotomy B: Laparoscopic myomectomy versus mini-laparotomy C: Laparoscopic myomectomy versus laparotomic myomectomy D: Laparoscopic myomectomy versus laparotomic myomectomy E: Laparoscopic myomectomy versus mini-laparotomy F: laparoscopic myomectomy versus laparotomic myomectomy G: Laparoscopic myomectomy versus laparotomic myomectomy H: (Gasless) laparoscopic myomectomy versus mini-laparotomy
|
Describe intervention:
A: Laparoscopic myomectomy: An open laparoscopy technique with a 10-mm umbilical port and one 5-mm and another 10-mm ancillary port on each side was used. A uterine manipulator was used, and an incision was made through the uterine wall and the pseudocapsule of the myoma. The myoma was fixed with a Manhes grasping forceps, the cleavage plane identified and the myoma enucleated. All uterine defects were closed with interrupted intracorporeal sutures, and the myoma was removed with an automatic morcellator. B: Laparoscopic myomectomy: Laparoscopy was done using Verres needle and 3 ports 5 mm at 3 cm below the umbilicus and 2 5-mm ancillary ports. A uterine manipulator was used, and a serosal incision was made without vasoconstriction using a monopolar needle. Manhes grasping forceps was used to obtain adequate traction on the myoma; the myoma was enucleated and the uterine wall sutured in two layers with extracorporeal sutures. The myoma was morcellated using an electromechanical morcellator. C: Laparoscopic myomectomy: done as described by Mais et al. D: Laparoscopic myomectomy: Using Verres needle for insufflation, a 10-mm primary port, 2 ancillary side ports on each side (the first 5 mm, the other 10 mm), an incision was made over the myoma pseudocapsule. The myoma was fixed with a myoma drill and enucleated. The myoma was removed by morcellation using a serrated edge macromorcellator. Uterine defects were closed with interrupted extracorporeal sutures, and the serosa was left open. E: Laparoscopic myomectomy: In the laparoscopic group, procedures were performed using a 10-mm scope with 2 or 3 ancillary ports. A longitudinal incision, using a unipolar hook scissor, was performed close to the midline. After cleavage plane identification, the leiomyoma was enucleated by means of adequate traction with a myoma drill or a strong grasper and countertraction maneuvers with Manhes forceps or scissors, or a hydrodissection technique. Myometrium was sutured in 1 or 2 layers, according to the depth of the uterine defect, with interrupted figure-8 sutures, using intracorporeal knots. Morcellation was done with a 12-mm Steiner automatic morcellator. F: "Myomectomies were performed with a standard technique using three suprapubic ports." Operating techniques were not further specified. G: Laparoscopy: A pneumoperitoneum was obtained with carbon dioxide insufflation, followed by a standard umbilical incision and introduction of the laparoscope. Two suprapubic access routes were inserted lateral, and a third was inserted in the midline. Uterine cannulation was used for optimal exposure of the myoma, and a methylene blue test was carried out. To incise the serosa of the myoma, a monopolar pointed knife was used. Dissection was done via traction on the myoma and countertraction on the uterus. Coagulation was performed with bipolar current before cutting. Afterwards, the uterine wall was sutured. The myomata were removed from the abdominal cavity with a manual laparoscopic morcellator, followed by washing of the pelvis with saline solution. H: Gasless laparoscopy: not further specified. |
Describe control:
A: Mini laparotomy myomectomy: A suprapubic transverse incision 4 to 6 cm in length was given, the fascia was opened crosswise and the abdominal muscle was opened longitudinally at the midline with a longitudinal peritoneal incision. A linear uterine incision was made at the most prominent portion of the myoma. After the myoma pseudo capsule was identified, enucleation was possible following the cleavage plane. Uterine defects were closed with interrupted sutures. B: Mini-laparotomy myomectomy: A 5-cm transverse suprapubic incision was made about 1 to 3 cm above the pubic symphysis. The fascia was opened longitudinally and the peritoneum vertically. The most prominent part of the uterine serosa overlying each myoma was cut with a monopolar knife. Enucleation was performed following the cleavage plane between the myoma and the pseudo capsule. Myoma beds were sutured with interrupted polyglactin 910 sutures C: Laparotomy myomectomy: done as described by Mais et al D: Laparotomy myomectomy: The mini-Pfannenstiel incision was used for laparotomy. No pharmacological vasoconstriction or mechanical vascular occlusion techniques were used before the uterine incision was made, usually anteriorly. Uterine defects were closed with interrupted sutures of Vicryl 1-0 polyglactin 910 (Ethicon SpA, Pratica di Mare, Rome). The serosa was approximated with Vicryl 4-0 E: Mini-laparotomic myomectomy: A 4- to 7-cm transverse incision was made for mini-laparotomy access. To avoid extension of the mini-laparotomies, 2 double sutures were made at the ends of the skin incisions. The anterior rectus fascia was incised vertically, and the muscular fibers were dissected. The parietal peritoneum was exposed and incised vertically. The hysterotomy was performed with a monopolar knife on the most prominent part of each tumour, and the myoma was enucleated; interrupted figure-8 sutures in 1 or 2 layers were used to repair the uterus. Progressive morcellement of the leiomyomas was performed with a cold knife scalpel if the tumour was larger than the skin incision. F: "Myomectomies were performed with a standard technique using three suprapubic ports." Operating techniques were not further specified.” G: Abdominal laparotomy: A low transverse abdominal incision was made, followed by a linear uterine incision as small as possible on the most prominent part of the leiomyoma. Different incisions were made, depending on the position of the myomata. Enucleation was done following the cleavage plain, the uterus was sutured in 1 or 2 planes according to depth and size of myomata. Afterwards, the endometrium was closed and sutured as well; this was followed by washing of the pelvis with a saline solution. H: Mini-laparotomy: not further specified. |
End-point of follow-up:
A: 6 months B: 6 months C: 4 weeks D: 6 months E: 3 months F: 40 months G: 5 years H: 3 years
For how many participants were no complete outcome data available? (intervention/control) A: no missing data B: no missing data C: no missing data D: no missing data E: no missing data F: no missing data G: no missing data H: no missing data
|
(1) Re-interventions Defined by Chittawar (2014) as (1.1) recurrence of fibroids, (1.2) repeat myectomy and (1.3) hysterectomy at a later time.
(1.1) Recurrence of fibroids Sub group Laparoscopic myomectomy versus open myomectomy Effect measure: RR (95% CI): F: 1.19 (0.55 to 2.56) G: 0.98 (0.48 to 2.03)
Sub group Laparoscopic myomectomy versus myomectomy at mini-laparotomy Effect measure: OR (95% CI): A: Not estimable (0 in both groups) H: 1.17 (0.42 to 3.23)
Pooled effect (RR, random effects model): 1.10 (0.69 to 1.75) favoring open (mini) myectomy Heterogeneity (I2): 0%
(1.2) Repeat myomectomy Laparoscopic myomectomy versus open myomectomy Effect measure: RR (95% CI): G: 0.14 (0.01 to 2.67)
Pooled effect (fixed effects model): 0.14 (0.01 to 2.67) favoring laparoscopic myomectomy Heterogeneity (I2): 0%
(1.3) Hysterectomy at a later time Laparoscopic myomectomy versus open myomectomy Effect measure: RR (95% CI): G: 0.32 (0.01 to 7.92)
Pooled effect (fixed effects model): 0.32 (0.01 to 7.92) favoring laparoscopic myomectomy Heterogeneity (I2): 0%
(2) Recovery time
‘Recovery time’, defined as time to return to work or daily activities, was not reported by Chittawar (2014), however ‘length of hospital stay (hours)’ was. The working group decided to include the outcome ‘length of hospital stay’.
Studies were not pooled because of extreme heterogeneity (I2=97%).
Laparoscopic myomectomy versus open myomectomy Effect measure: Mean difference (95% CI): G: -67.19 (-79.47 to -54.91)
Laparoscopic myomectomy versus myomectomy at mini-laparotomy Effect measure: Mean difference (95% CI): A: -10 (-13.87 to -6.13) B: -28.8 (-34.61 to -22.99) Studies were not pooled because of heterogeneity (3) Amenorroea/reduction blood loss (menstruation scores, amount of blood loss) (validated scale) Defined by Chittawar (2014) as improvement in menstrual symptoms such as heaviness of periods, or pressure symptoms (subjective information collected via surveys). One study including 148 participants reported on improvement in menstrual symptoms (Alessandri 2006). The study did not use a validated scale. The working group decided not to include the results.
(4) Patient satisfaction (validated scale) This outcome was not reported by Chittawar e.a. (2014)
(5) Quality of Life (validated scale) Defined by Chittawar (2014) as change in quality of life, measured on validated quality of life scales before and at different time points after surgery. No included studies reported this outcome.
|
Facultative: Chittawar (2014): Laparoscopic myomectomy is associated with less postoperative pain, lower incidence of postoperative febrile morbidity and a shorter hospital stay.
Further research is needed to address changes in menstrual symptoms, patient satisfaction and quality of life after open or laparoscopic myomectomy performed with well-validated instruments. Future trials should include longer follow-up to assess the need for repeat surgery (myomectomy or hysterectomy) among women undergoing myomectomy laparoscopically or by laparotomy.
GRADE assessment was not reported because all the reported outcomes were secondary outcomes of the review by Chittawar (2014).
The amount of included study populations was small, and the reported outcomes limited. Several studies did not clearly describe allocation concealment. Overall quality of evidence is ‘low’. Sensitivity analyses were not performed because of the small amount of included studies.
The overall heterogeneity was rather low. |
*One trial (Tan, 2008) was removed by the working group because it used laparoscopic assisted - mini laparotomy in the laparotomy arm.
Table of quality assessment
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Chittawar, 2014 |
Yes, appropriate research question and inclusion criteria |
Yes, in 6 databases and 4 trial registers |
Yes, extensive description |
Yes, extensive description |
NA |
Yes, Cochrane risk of bias tool and GRADE assessment |
Yes, selective inclusion criteria + sub groups based on procedure details |
No, because less than 10 studies were included no publication bias assessment was done |
Not reported |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Bansal, 2016 |
Narrative review, useful as background article |
|
Cezar, 2017 |
Narrative review, useful as background article |
|
Chen, 2020 |
It is not clearly described which surgical interventions and surgical routes were used in which studies. 5 of 12 RCTs were Chinese studies that we were not able to find. |
|
Claeys, 2014 |
Wrong outcome: uterine rupture after pregnancy after myectomy |
|
Fuduka, 2013 |
Wrong design: retrospective study |
|
Iavazzo, 2016 |
Wrong comparison: robotic assisted versus laparoscopic and/or open myomectomy |
|
Kotani, 2018 |
Wrong design: retrospective cohort study |
|
Laughlin-Tommaso, 2020 |
Wrong design: prospective cohort study, robotic assisted laparoscopy was included in the laparoscopy group. Baseline levels differed. |
|
Ming, 2020 |
Wrong design: cohort study combined with a meta analysis |
|
Orl, 2020 |
Wrong outcome: fertility outcomes |
|
Palomba, 2015 |
Wrong design: included also non-randomized trials and trials with unclear study design. Comparison: laparoscopic versus mini laparotomic myomectomy. |
|
Rakotomahenina, 2017 |
Narrative review, useful as background article |
|
Ranes 2016 |
Wrong design: retrospective chart review, wrong intervention: robot assisted laparoscopy versus abdominal myectomy |
|
Rodriguez-Triana, 2020 |
Wrong design: prospective cohort study. Baseline levels differed. |
|
Sandberg, 2018 |
Wrong comparison: not only traditional procedures, but all kind of new techniques. No Laparoscopic myectomy included. Wrong design: not only RCTs. |
|
Shen, 2015 |
Wrong design: included also non-randomized trials and trials with unclear study design. Comparison: laparoscopic versus minilaparotomic myomectomy. |
|
Wang, 2018 |
Wrong comparison: Robotic-assisted versus laparoscopic and abdominal myomectomy |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 30-06-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodules.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodules zijn in 2020 per module schrijvers en meelezers benoemd. Deze personen werden aangewezen als vertegenwoordigers door de relevante beroepsgroepen die betrokken zijn bij de in de module beschreven zorg (zie hiervoor de Samenstelling van de werkgroep). Alle schrijvers van modules vallend onder één richtlijn vormden samen een schrijfgroep. Alle meelezers van modules vallend onder één richtlijn vormden samen een clusterwerkgroep. In totaal resulteerde dit dus in zes werkgroep en zes clusterwerkgroepen.
Voorzitter project (technisch voorzitter)
Timmermans A. (Anne), gynaecoloog, AmsterdamUMC, NVOG
Werkgroep Hevig Menstrueel Bloedverlies
Janssen C.A.H. (Ineke), gynaecoloog, Groene Hart Ziekenhuis te Gouda, NVOG
Vree F.E.M. (Florentien), gynaecoloog, AmsterdamUMC, NVOG
Clusterwerkgroep Hevig Menstrueel Bloedverlies
Bosch M. (Marlies), patiëntvertegenwoordiger, Bekkenbodem4all
Braat M.N.G.J.A. (Manon), radioloog, UMCU te Utrecht, NVvR
Ondersteuning project
Abdollahi M. (Mohammadreza), adviseur Kennisinstituut van de Federatie van Medisch Specialisten
Labeur Y.J. (Yvonne), junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Olthuis-van Essen H. (Hanneke), adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Sussenbach A.E. (Annelotte), junior adviseur Kennisinstituut van de Federatie van Medisch Specialisten
Verhoeven M. (Maxime), adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Projectleiding
Augustus 2022- nu Mostovaya I.M. (Irina) (projectleider), senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
April 2020 tot augustus 2021: Bijlsma-Rutte A. (Anne), adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
September 2021 tot januari 2022: Venhorst K. (Kristie), adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Februari 2022 tot juni 2022: Göthlin M. (Mattias), adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoek financiering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Timmermans (technisch voorzitter van het project) |
Gynaecoloog, Amsterdam UMC (0.5 fte) |
Commissie kwaliteitsdocumenten NVOG (onbetaald); projectgroep Gynae Goes Green NVOG (onbetaald) |
Geen |
Geen actie |
|
Hevig menstrueel bloedverlies - werkgroep |
||||
|
Janssen |
Gynaecoloog |
Gynaecoloog, Groene Hart Ziekenhuis te Gouda |
Geen |
Geen actie |
|
Vree |
Gynaecoloog - chef de Clinique. |
NVOG Koploperproject cluster Benigne Gynaecologie |
Geen |
Geen actie |
|
Hevig menstrueel bloedverlies - clusterwerkgroep |
||||
|
Bosch |
Stichting Bekkenbodem4All. PR | Belangenbehartiging |
Fotograaf Bisdom Groningen-Leeuwarden. Deels betaald, deels vrijwilligerswerk |
Functie Belangenbehartiging Patiënten organisatie |
Geen |
|
Braat |
Radioloog, UMC Utrecht |
Auteur van een app over de stadiering en beeldvorming van gynaecologische tumoren, en een andere app over colorectale carcinomen (betaald; <200 euro per jaar) |
Studie om de waarde van HIFU van myomen in kaart te brengen (randomisatie 2:1 tussen HIFU en hysterectomie of embolisatie, mychoice.eu) is recent gestart door Isala. UMCU neemt tot op heden niet deel en ontvangt dus ook geen financiële vergoeding voor deze studie. Gezien HIFU slechts op 2 locaties, waaronder UMCU, wordt aangeboden kan dit tot naamsbekendheid leiden wanneer opgenomen in de richtlijn. |
Geen actie (als lid van de klankbordgroep is Braat geen lid van de schrijfgroep). Braat is geconsulteerd en de schrijfgroep kan dit advies meenemen of, onderbouwd, naast zich neerleggen). |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van Patiëntenfederatie Nederland en Stichting Bekkenbodem4All voor de schriftelijke knelpunteninventarisatie en voor deelname aan de clusterwerkgroepen. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is voor commentaar voorgelegd aan Patiëntenfederatie Nederland en Stichting Bekkenbodem4All en de eventueel aangeleverde commentaren worden bekeken en verwerkt.
Implementatie
|
Aanbeveling |
Tijdspad voor implementatie: 1 tot 3 jaar of > 3 jaar |
Verwacht effect op kosten |
Randvoorwaarden voor implementatie (binnen aangegeven tijdspad) |
Mogelijke barrières voor implementatie1 |
Te ondernemen acties voor implementatie2 |
Verantwoordelijken voor acties3 |
Overige opmerkingen |
|
1e |
1 tot 3 jaar |
In module beschreven |
Disseminatie van de richtlijn |
- |
Disseminatie van de richtlijn |
NVOG |
- |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld volgens de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg en de actualiteit van de aanbevelingen beschreven in de te reviseren modules. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG), de Nederlandse Vereniging van Maag-Darm-Leverartsen (NVMDL), Vereniging Klinische Genetica Nederland (VKGN), Inspectie Gezondheidszorg en Jeugd (IGJ), Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV), Nederlands Huisartsen Genootschap (NHG), Nederlandse Vereniging voor Bekkenfysiotherapie en Pré- en Postpartum Gezondheidszorg, Nederlandse Vereniging van Ziekenhuizen (NVZ), Patiëntenfederatie Nederland, Zorginstituut Nederland (ZiNL), Zelfstandige Klinieken Nederland (ZKN) en Zorgverzekeraars Nederland (ZN) via een schriftelijke knelpunteninventarisatie.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Ook definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Hultcrantz, 2017; Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nul effect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Volgens de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule wordt aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en akkoord.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. Erratum in: BMJ. 2008 May 24;336(7654).
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
