LNG-IUD versus endometriumablatie
Uitgangsvraag
Wat is de plaats van een levonorgestrelhoudend spiraal (LNG-IUD) vergeleken met endometriumablatie (EA) bij patiënten met hevig menstrueel bloedverlies zonder myomen/adenomyose?
Aanbeveling
Behandel vrouwen met hevig menstrueel bloedverlies zonder myomen of adenomyose (bij geschiktheid van het cavum uteri) en een toekomstige kinderwens met een levonorgestrelhoudend spiraal.
Bespreek bij vrouwen met hevig menstrueel bloedverlies zonder myomen of adenomyose en zonder kinderwens (bij geschiktheid van het cavum uteri) de volgende punten:
- De voor- en nadelen van een levonorgestrelhoudend spiraal en endometriumablatie.
- Dat na behandeling met een levonorgestrelhoudend spiraal wel een endometriumablatie mogelijk is, maar na een endometriumablatie mogelijk geen levonorgestrelhoudend spiraal kan worden geplaatst.
- Wijs de vrouw vooraf op de noodzaak van aanvullende anticonceptie na endometriumablatie behandeling en bespreek de diverse opties voor anticonceptie.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de effectiviteit van een levonorgestrelhoudend spiraal (LNG-IUD) vergeleken met endometriumablatie (EA) bij patiënten met hevig menstrueel bloedverlies (HMB) zonder myomen/adenomyose. In de update van de module zijn één systematische review en één RCT geïncludeerd die deze vergelijking hebben onderzocht. Voor de cruciale uitkomstmaat patiënttevredenheid werd op drie en zes maanden een klinisch relevante reductie in patiënttevredenheid gevonden ten nadele van de LNG-IUD groep. Op twaalf en 24 maanden werd er geen klinisch relevant verschil voor patiënttevredenheid gevonden tussen beide behandelingen. De bewijskracht voor deze uitkomstmaat op deze vier tijdspunten was laag. Voor patiënttevredenheid op vijf jaar is er veel onzekerheid en kan er geen duidelijke conclusie worden getrokken. De bewijskracht was zeer laag.
Voor de cruciale uitkomstmaat reductie van menstrueel bloedverlies is er onderscheid gemaakt tussen PBAC score en amenorroe. Voor alle tijdspunten waarop de PBAC score is gemeten en beide behandelingen werden vergeleken, is er grote onzekerheid en kan er geen duidelijke conclusie worden getrokken. De bewijskracht op alle tijdsmomenten is zeer laag. Voor amenorroe is gekeken naar de resultaten op twaalf en 24 maanden. Op twaalf maanden is er geen klinisch relevant verschil gevonden tussen beide behandelingen. De bewijskracht hiervoor was laag. Op 24 maanden werd er ook geen klinisch relevant verschil gevonden tussen beide groepen. De bewijskracht hiervoor was matig. De bewijskracht voor de cruciale uitkomstmaten samen genomen komt hiermee uit op zeer laag.
De belangrijke uitkomstmaten (kwaliteit van leven, chirurgische re-interventies en hersteltijd) kunnen ook geen richting geven voor de besluitvorming. Er zijn geen studies gevonden die hersteltijd hebben vergeleken tussen beide behandelingen.. Voor de andere twee uitkomstmaten was de bewijskracht zeer laag.
Een belangrijke beperking voor enkele uitkomsten in de systematische review van Rodriquez (2020) en de RCT van Beelen (2021a) is het ontbreken van de blindering, wat een mogelijk risico geeft op vertekening voor de subjectieve uitkomstmaten (patiënttevredenheid, PBAC score, en kwaliteit van leven). Daarnaast werd de lage bewijskracht veelal veroorzaakt door conflicterende resultaten welke van lage precisie waren en gemeten zijn in een te kleine patiëntengroep. Door de zeer lage bewijskracht zal de keuze voor de ene dan wel de andere behandeling dus afhangen van andere factoren.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Patiënten prefereren een niet–hormonale behandeling, zo weinig mogelijk bijwerkingen, geen noodzaak tot herhaling van een procedure en geen noodzaak tot aanvullende anticonceptie (van den Brink, 2018). Daar zitten zowel argumenten voor ablatie als voor LNG-IUD in. Patiënten vinden het belangrijk om goed gecounseld te worden over de mogelijke voor- en nadelen zodat samen een weloverwogen beslissing kan worden genomen. Het LNG-IUD bevat hormonen en moet na 6 jaar vervangen worden, maar heeft geen noodzaak tot aanvullende anticonceptie. De ablatie is niet-hormonaal, maar aanvullende anticonceptie is daarbij cruciaal. Wat de hormonen betreft is het echter wel zo dat de concentratie van levonorgestrel die in de circulatie terecht komt vele malen lager is dan van bijvoorbeeld de anticonceptiepil, zodat nog maar de vraag is of door patiënten als hormonaal aangemerkte klachten inderdaad hormonaal verklaard kunnen worden. Hier ligt ook een taak voor de arts om de patiënt hieromtrent uitleg te geven. Ten aanzien van het aantal re-interventies is het nog interessant te vermelden dat het niet uit lijkt te maken of de vrouw zelf de keuze heeft gemaakt voor de ene of de andere behandeling of dat zij gerandomiseerd is (Beelen, 2021b).
Kosten (middelenbeslag)
De behandeling met LNG-IUD kan in de 1e lijn of poliklinisch in de 2e lijn plaatsvinden. De endometriumablatie kan in ambulante setting plaatsvinden, poliklinisch of onder sedatie of narcose. Dit maakt de endometriumablatie een relatief duurdere behandeling ten opzichte van het LNG-IUD. Wanneer we het aantal hysterectomieën beschouwen die worden verricht in verband met falen van een van de methoden, lijkt daar geen verschil in kosten te ontstaan: Bhattacharya (2011) deed een meta-analyse naar hysterectomie na endometriumablatie of LNG-IUD spiraal. Na één jaar ondergingen evenveel vrouwen alsnog een hysterectomie (2,3% versus 6,7%); OR 0,36 (0,09 tot 1,48), p= 0,16. Deze analyse was echter gebaseerd op lage aantallen: twee van de 86 na endometriumablatie en zes van de 89 na LNG-IUD. De MIRA trial bevat ook een (Nederlandse) kosten-effectiviteitsanalyse (Van den Brink, 2021). De resultaten hiervan tonen aan dat de LNG-IUD een goedkopere optie is dan ablatie (2285 euro versus 3465 euro), alhoewel non-inferiority niet aangetoond kon worden. Het artikel concludeert dat de LNG-IUD een reversibele en minder invasieve behandeling is en kosteneffectief kan zijn, maar dat dit afhankelijk is van welk slagingspercentage vrouwen willen accepteren.
Aanvaardbaarheid, haalbaarheid en implementatie
Een voordeel van het LNG-IUD is dat het een reversibele methode is die de fertiliteit in de toekomst niet beïnvloedt, maar die wel uitstekende anticonceptie verzorgt gedurende het gebruik ervan. De reversibiliteit maakt ook dat LNG-IUD beter als eerste keus kan worden aangeboden. Endometriumablatie is irreversibel en na een ablatie is het veelal niet mogelijk om later alsnog een LNG-IUD in te brengen en ook cavumdiagnostiek is bemoeilijkt, terwijl na een LNG-IUD een endometriumablatie wel goed mogelijk is. Endometriumablatie zou wel als eerste keus kunnen worden aangeboden wanneer levonorgestrel absoluut gecontra-indiceerd is en er geen toekomstige kinderwens meer is, of wanneer het LNG-IUD eenvoudigweg niet gewenst wordt door de patiënt.
De noodzaak tot en keuze voor een aanvullende anticonceptiemethode bij endometriumablatie speelt ook een belangrijke rol in de beslissing. Wanneer voor endometriumablatie gekozen wordt, omdat hormonen gecontra-indiceerd of niet gewenst zijn, vallen er al veel betrouwbare anticonceptiemethoden af. Wanneer vervolgens gekozen wordt voor bijvoorbeeld sterilisatie als anticonceptiemethode werkt dit nog eens kostenverhogend. Wanneer daarbij de keuze valt op tubaligatie of tubectomie bij de vrouw, zou dit mogelijk ook nog de kans op het postablatie syndroom verhogen (pijnklachten door hematometra). Het is onduidelijk bij hoeveel vrouwen postablatiesyndroom optreedt. Het is wel bekend dat een jonge leeftijd, sterilisatie en dysmenorroe factoren zijn die geassocieerd zijn met het falen van endometriumablatie (Beelen, 2019). Daarnaast moet er rekening worden gehouden met de mogelijkheid tot het optreden van toekomstig postmenopauzaal bloedverlies na endometriumablatie. In de praktijk is gebleken dat cavumdiagnostiek bemoeilijkt kan zijn door adhesies, wat kan leiden tot (achteraf) onnodige uterusextirpaties.
Een nadeel van het LNG-IUD is onregelmatig, ongepland bloedverlies. Deze bijwerking wordt opvallend genoeg niet als heel belangrijk gescoord in het patiënten preferentie onderzoek van Van de Brink (2018), hoewel het soms wel een reden kan zijn om het LNG-IUD voortijdig te laten verwijderen. Verder is er een klein risico op het optreden van expulsie van een LNG-IUD (3-5%) of perforatie (0,1 tot 0,2%).
Tot slot geldt voor zowel het LNG-IUD als voor endometriumablatie, dat het cavum uteri geschikt moet zijn qua grootte en vorm, vast te stellen middels echoscopie of hysteroscopie, en dat er geen actuele kinderwens moet zijn.
Rationale/ balans tussen de argumenten voor en tegen de interventie
De eerste keus gaat naar een levonorgestrelhoudend spiraal, vanwege de reversibiliteit (endometriumablatie kan altijd nog), minder ingrijpende behandeling, het vervallen van de noodzaak tot aanvullende anticonceptie en waarschijnlijk minder kosten. Daarnaast kan de keuze van de aanvullende anticonceptie doorslaggevend zijn in de keuze tussen een levonorgestrelhoudend spiraal of endometriumablatie. Het is belangrijk dat de vrouw weet waarvoor ze kiest.
Onderbouwing
Achtergrond
Een levonorgestrelhoudend spiraal (levonorgestrel-releasing intrauterine device; LNG-IUD)(52 mg) en endometriumablatie (EA) zijn beide behandelingen voor hevig menstrueel bloedverlies (HMB). Wat betreft effectiviteit in het bereiken van een amenorroe, het reduceren van het bloedverlies, tevredenheid en de hoeveelheid re-interventies na 1 jaar lijken ze gelijkwaardig. Beide behandelingen hebben echter voor- en nadelen. Een ablatie is meer invasief en vrouwen met een (latente) kinderwens komen er niet voor in aanmerking, omdat er tijdens zwangerschap na een ablatie ernstige complicaties kunnen optreden. Tevens werkt een ablatie niet als contraceptie; een LNG-IUD wel. Recentelijk (in 2021) is de MIRA-trial, een ZonMW doelmatigheidsstudie, gepubliceerd. Dit Nederlandse onderzoek heeft aanleiding gegeven tot een herziening van de richtlijnmodule.
Conclusies / Summary of Findings
1. Patient satisfaction
Patient satisfaction at three, six, twelve and 24 months
|
Low GRADE
|
Three and six months Fewer patients with heavy menstrual bleeding without myomas/adenomyosis were satisfied at three and six months after receiving the levonorgestrel-releasing intrauterine device as compared to endometrial ablation.
Source: Beelen, 2021a.
Twelve and 24 months There might be little to no difference in patient satisfaction at twelve and 24 months when comparing the use of a levonorgestrel-releasing intrauterine device with endometrial ablation in patients with heavy menstrual bleeding without myomas/adenomyosis.
Source: Beelen, 2021a, Rodriquez, 2020. |
Patient satisfaction at five years
|
Very low GRADE
|
The evidence is very uncertain about the effect of a levonorgestrel-releasing intrauterine device on patient satisfaction at five years when compared with endometrial ablation in patients with heavy menstrual bleeding without myomas/adenomyosis.
Source: Rodriquez, 2020. |
2. Reduction in blood loss
2.1. PBAC score
|
Very low GRADE
|
The evidence is very uncertain about the effect of a levonorgestrel-releasing intrauterine device on PBAC score at three, six, twelve, 24, and 36 months when compared with endometrial ablation in patients with heavy menstrual bleeding without myomas/adenomyosis.
Source: Rodriquez, 2020; Beelen, 2021a. |
2.2 Amenorrhea
Amenorrhea at twelve months
|
Low GRADE
|
Use of a levonorgestrel-releasing intrauterine device may result in little to no difference in amenorrhea at twelve months when compared with endometrial ablation in patients with heavy menstrual bleeding without myomas/adenomyosis.
Source: Rodriquez, 2020. |
Amenorrhea at 24 months
|
Moderate GRADE
|
Use of a levonorgestrel-releasing intrauterine device probably results in little to no difference in amenorrhea at 24 months when compared with endometrial ablation in patients with heavy menstrual bleeding without myomas/adenomyosis.
Source: Beelen, 2021a. |
3. Quality of life
|
Very low GRADE
|
The evidence is very uncertain about the effect of a levonorgestrel-releasing intrauterine device on quality of life when compared with endometrial ablation in patients with heavy menstrual bleeding without myomas/adenomyosis.
Source: Rodriquez, 2020; Beelen, 2021a. |
4. Surgical reinterventions
|
Very low GRADE
|
The evidence is very uncertain about the effect of a levonorgestrel-releasing intrauterine device on surgical reinterventions at twelve, 24 and 36 months when compared with endometrial ablation in patients with heavy menstrual bleeding without myomas/adenomyosis.
Source: Rodriquez, 2020; Beelen, 2021a. |
5. Recovery time
|
No GRADE
|
No evidence was found regarding the effect of a levonorgestrel-releasing intrauterine device on recovery time when compared with endometrial ablation in patients with heavy menstrual bleeding without myomas/adenomyosis. |
Samenvatting literatuur
Description of studies
Rodriquez (2020) conducted a systematic review and meta-analysis to determine the effectiveness, acceptability, and safety of the LNG-IUD as compared to no treatment, placebo, or other medical or surgical therapy (for example endometrial ablation (EA)) for reducing heavy menstrual bleeding (HMB). The review systematically searched multiple databases (Cochrane Gynaecology and Fertility Specialised Register, CENTRAL, MEDLINE, Embase, PsycINFO and CINAHL) from inception to June 2019, as well as grey literature and unpublished trials in trial registers. A total of 25 RCTs were included, comprising 2,511 women of reproductive age with regular heavy periods measured either objectively or subjectively. Exclusion criteria were postmenopausal bleeding, irregular menses and intermenstrual bleeding at presentation, pathological causes of HMB, primary use of progesterone-releasing intrauterine system for any other reason than HMB, and conditions where the use of LNG-IUD is contraindicated. For the comparison relevant for our analysis, LNG-IUD versus EA, a total of eleven RCTs were included. Outcome measures included in this meta-analysis were menstrual bleeding, treatment satisfaction, quality of life, adverse events, treatment failure, requirement of surgery, and resource cost. The risk of bias for each included study was assessed by two independent reviewers using the Cochrane ‘Risk of bias’ tool.
Beelen (2021a) performed a multicenter RCT to compare the effectiveness of the LNG-IUD with EA in women with HMB. The RCT was performed between 2012 and 2016 in 26 hospitals and in a network of general practices in the Netherlands. Women were included in the study if they were 34 years or older and did not have a pregnancy wish or intracavitary pathology. A total of 645 women met the eligibility criteria, but 375 women were excluded because they declined to be randomized or participate. Finally, 270 women were included and randomly allocated to the LNG-IUD group (n=132) or EA group (n=138). Outcome measures were measured at different time points, with a maximum follow-up time of 24 months. The primary outcome was blood loss and the secondary outcomes were controlled bleeding, complications and reinterventions, amenorrhea, spotting, dysmenorrhea, presence of clots, duration of blood loss, satisfaction with treatment, quality of life, and sexual function. The mean age of women in the LNG-IUD group was 44.7 years (SD 4.6), versus 45.3 years (SD 4.9) in the EA group. Groups were largely comparable at baseline. There was a significant difference between the two groups at baseline for BMI, previous uterus surgery (myomectomy), the duration of HMB, and anticoagulants use (platelet aggregation inhibitors). There was no significant difference between the two groups for the other baseline characteristics.
Results
1. Patient satisfaction (critical)
Two studies reported the outcome measure patient satisfaction (Beelen, 2021a; Rodriquez, 2020). Beelen (2021a) measured patient satisfaction on a 5-point Likert scale at three, six, twelve, and 24 months (see Table 1), while Rodriquez (2020) described the proportion of women satisfied with the treatment at one, two, and five years of follow-up. The results of both studies are shown in Figure 1, whereby the categories in the 5-point Likert scale in Beelen (2021a) were dichotomized: ‘very satisfied’ and ‘satisfied’ were defined as ‘satisfied with the treatment’.
The risk ratio at three months was 0.54 (95% CI 0.42 to 0.69), in favour of EA. The risk ratio at 6 months was 0.69 (95% CI 0.57 to 0.82), also in favour of EA. Both RRs were considered to be clinically relevant.
The pooled risk ratio (RR) at twelve months was 0.92 (95% CI 0.85 to 1.00), in favour of EA. The pooled RR at 24 months was 0.89 (95% CI 0.82 to 0.97), also in favour of EA. Both RRs were not considered to be clinically relevant.
At five years of follow-up, de Souza (2010) (Rodriquez, 2020) reported 27 out of 27 (100%) satisfied women in the LNG-IUD group, versus 20 out of 25 (80%) satisfied women in the EA group. The RR was 1.25 (95%CI 1.01 to 1.53), in favour of LNG-IUD. This was a clinically relevant difference.
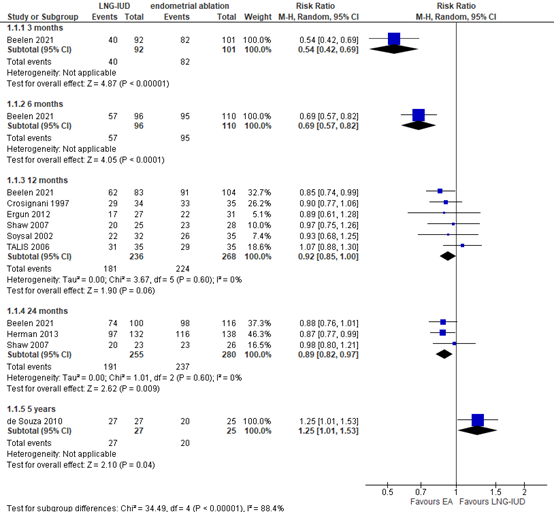
Figure 1. Proportion of women satisfied with the treatment; LNG-IUD versus EA. Note: one event is equal to a satisfied patient.
|
|
3 months |
6 months |
12 months |
24 months |
|
Very satisfied, n/total (%) |
LNG-IUD: 11/92 (12%) |
LNG-IUD: 22/96 (23%) |
LNG-IUD: 28/83 (34%) |
LNG-IUD: 46/100 (46%) |
|
Satisfied, n/total (%) |
LNG-IUD: 29/92 (32%) |
LNG-IUD: 35/96 (36%) |
LNG-IUD: 34/83 (41%) |
LNG-IUD: 28/100 (28%) |
|
Uncertain, n/total (%) |
LNG-IUD: 18/92 (20%) |
LNG-IUD: 20/96 (21%) |
LNG-IUD: 11/83 (13%) |
LNG-IUD: 20/100 (20%) |
|
Dissatisfied, n/total (%) |
LNG-IUD: 24/92 (26%) |
LNG-IUD: 13/96 (14%) |
LNG-IUD: 7/83 (8%) |
LNG-IUD: 4/100 (4%) |
|
Very dissatisfied, n/total (%) |
LNG-IUD: 10/92 (11%) |
LNG-IUD: 6/96 (6%) |
LNG-IUD: 3/83 (4%) |
LNG-IUD: 2/100 (2%) |
|
Dichotomized result (satisfied/other), n/total (%) |
LNG-IUD: 40/92 (44%) EA: 82/101 (81%) |
LNG-IUD: 57/96 (59%) EA: 95/110 (86%) |
LNG-IUD: 62/83 (76%) EA: 91/104 (88%) |
LNG-IUD: 74/100 (74%) EA: 98/116 (85%) |
Table 1. Patient satisfaction at different follow-up times as reported in Beelen (2021a). Note: the categories in the 5-point Likert scale were dichotomized. ‘Very satisfied’ and ‘satisfied’ were defined as ‘satisfied with the treatment’, and ‘uncertain’, ‘dissatisfied’ and ‘very dissatisfied’ were defined as ‘other’.
Level of evidence
Patient satisfaction at three, twelve and 24 months
The level of evidence regarding the outcome measure patient satisfaction at three, twelve and 24 months was based on a randomized study and therefore starts at high. The level of evidence was downgraded by two levels to low because of study limitations (no blinding of patients and physicians; risk of bias, -1), and the small number of included patients (imprecision, -1).
Patient satisfaction at six months
The level of evidence regarding the outcome measure patient satisfaction at six months was based on a randomized study and therefore starts at high. The level of evidence was downgraded by two levels to low because of study limitations (no blinding of patients and physicians; risk of bias, -1), and the confidence interval crossing the lower threshold for clinical relevance (imprecision, -1).
Patient satisfaction at five years
The level of evidence regarding the outcome measure patient satisfaction at five years was based on a randomized study and therefore starts at high. The level of evidence was downgraded by three levels to very low because of study limitations (no blinding of patients and physicians; risk of bias, -1), and the very small number of included patients (imprecision, -2).
2. Reduction in blood loss (critical)
2.1 PBAC score
Eight studies included in Rodriquez (2020) reported PBAC scores a six, twelve, 24 and 36 months. As PBAC scores were reported in different ways (mean versus median) and at different time points, data were not pooled. Beelen (2021a) reported PBAC scores at three, six, twelve and 24 months. All available results will be described per time point.
At three months follow-up, Beelen (2021a) reported the number of women with a PBAC score < 75. In the LNG-IUD group, 52 out of 87 women (60%) had a PBAC score < 75, versus 90 out of 108 (83%) in the EA group. The RR was 0.72 (95% CI 0.59 to 0.87). This was considered to be a clinically relevant difference.
At six months follow-up, Barrington (2003) (Rodriquez, 2020) reported a median PBAC score of 19 (range 0 to 100) in the LNG-IUD group (n=21), versus a median of 27 (range 0 to 424) in the EA group (n=23). Both median PBAC-scores were < 75. Yet, this study must be interpreted with caution, as the menstrual PBAC scores differed between groups before they received an intervention. Beelen (2021a) reported the number of women with a PBAC score < 75 at 6 months of follow-up. In the LNG-IUD group, 70 out of 100 women (70%) had a PBAC score < 75, versus 99 out of 113 (88%) in the EA group. The RR was 0.80 (95% CI 0.69 to 0.92). This was not considered to be a clinically relevant difference.
PBAC scores at twelve months were reported in Beelen (2021a) and in five studies in the SR of Rodriquez (2020). Table 2 gives an overview of the available results per study at 12 months of follow-up. All studies except Beelen (2021a) reported a mean or median PBAC score < 75 for both groups. Beelen (2021a) reported the percentage of women in both groups with a PBAC score < 75 and found a RR of 0.98 (95% CI 0.88 to 1.08), which was not considered to be a clinically relevant difference.
|
Reference |
Sample size (LNG-IUD/EA) |
LNG-IUD |
EA |
Effect measure (if reported) |
|
Beelen, 2021a |
104/124 |
90 women (87%) had a PBAC score < 75 |
110 women (89%) had a PBAC score < 75 |
RR 0.98 95% CI 0.88 to 1.08 |
|
Crosignani, 1997 |
30/30 |
Mean 38.8 SD 37.1 |
Mean 23.5 SD 32.6 |
Mean difference 15.30 95% CI -2.37 to 32.97 |
|
Ergun, 2012 |
18/24 |
Mean 70 SD not reported |
Mean 55 SD not reported |
Mean difference 15 95% CI cannot be calculated |
|
Malak, 2006 |
26/30 |
Mean 40.6 SD 28.5 |
Mean 42.2 SD 30.4 |
Mean difference -1.60 95% CI -17.04 to 13.84 |
|
Soysal, 2002 |
31/35 |
Mean 55 SD 11 |
Mean 21.8 SD 14 |
Mean difference 33.20 95% CI 27.16 to 39.24) |
|
Shaw, 2007 |
21/20 |
Median 26 Range 0 to 68 |
Median 62 Range 0 to 142 |
- |
Table 2. An overview of PBAC scores reported in different studies at 12 months of follow-up
At 24 months, TALIS (2006) (Rodriquez, 2020) reported a mean PBAC score of 20.6 (SD 28.8) in the LNG-IUD group (n=37), versus a mean of 75.4 (SD 91.1) in the EA group (n=31). The mean difference was -54.80 (95% CI -88.18 to -21.42).
Beelen (2021a) reported the number of women with a PBAC score < 75 at 24 months. In the LNG-IUD group, 100 out of 115 women (87%) had a PBAC score < 75, versus 124 out of 132 women (94%) in the EA group. The RR was 0.93 (95% CI 0.85 to 1.01). This was not considered to be a clinically relevant difference.
At 36 months follow-up, Kittelsen (1998) (Rodriquez, 2020) reported a median PBAC score of 7 (range 0 to 101) in the LNG-IUD group (n=19), versus a median score of 4 (range 0 to 182) in the EA group (n=22). Both median PBAC scores were < 75.
Level of evidence
PBAC score at three months
The level of evidence regarding the outcome measure PBAC score at three months was based on a randomized study and therefore starts at high. The level of evidence was downgraded by three levels from high to very low because of study limitations (no blinding of patients and physicians; risk of bias, -1), the confidence interval around the RR crossing the upper limit of clinical relevance and the small number of included patients (imprecision, -2).
PBAC score at six months
The level of evidence regarding the outcome measure PBAC score at six months was based on a randomized studies and therefore starts at high. The level of evidence was downgraded by three levels from high to very low because of study limitations (no blinding of patients and physicians and unequal baseline scores between the two groups; risk of bias, -1); conflicting results (inconsistency, -1), the wide confidence interval and ranges and the small number of included patients (imprecision, -1).
PBAC score at twelve and 24 months
The level of evidence regarding the outcome measure PBAC score at twelve and 24 months was based on a randomized studies and therefore starts at high. The level of evidence was downgraded by three levels from high to very low because of study limitations (no blinding of patients and physicians; risk of bias, -1); conflicting results (inconsistency, -1), and the small number of included patients (imprecision, -1).
PBAC score at 36 months
The level of evidence regarding the outcome measure PBAC score at 36 months was based on a randomized study and therefore starts at high. The level of evidence was downgraded by three levels from high to very low because of study limitations (no blinding of patients and physicians; risk of bias, -1); and the very small number of included patients (imprecision, -2).
2.2 Amenorrhea
Eight studies in Rodriquez (2020) reported the incidence of amenorrhea within twelve months. In the LNG-IUD group, 45 out of 210 women (21.4%) developed amenorrhea, versus 41 out of 221 (18.6%) women in the EA group. The pooled RR was 1.20 (95% CI 0.76 to 1.89; figure 2), in favour of LNG-IUD. This was not considered to be a clinically relevant difference.
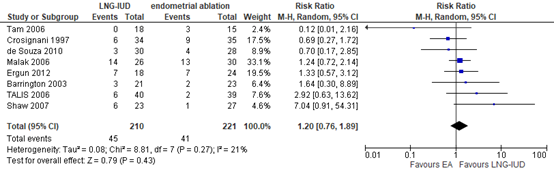
Figure 2. The incidence of amenorrhea at 12 months; LNG-IUD versus EA.
Beelen (2021a) reported amenorrhea at 24 months. In the LNG-IUD group, 67 out of 115 women (58%) developed amenorrhea, versus 89 out of 132 women (67%) in the EA group. The corresponding RR was 0.86 (95% CI 0.71 to 1.05), in favour of EA. This was not considered to be a clinically relevant difference.
Level of evidence
Amenorrhea at twelve months
The level of evidence regarding the outcome measure amenorrhea at twelve months was based on randomized studies and therefore starts at high. The level of evidence was downgraded by two levels from high to low because of conflicting results (inconsistency, -1), the wide confidence interval around the pooled RR and the small number of included patients (imprecision, -1).
Amenorrhea at 24 months
The level of evidence regarding the outcome measure amenorrhea at 24 months was based on a randomized study and therefore starts at high. The level of evidence was downgraded by one level from high to moderate because of the confidence interval around the pooled RR crossing the lower threshold for clinical relevance (imprecision, -1).
3. Quality of life (important)
Quality of life (QoL) was measured in Beelen (2021a) and in five trials that were included in Rodriquez (2020). Beelen (2021a) reported the SF-36 at twelve months follow-up. Four of the studies in Rodriquez (2020) (Tam, 2006; Crosignani, 1997; Soysal, 2002; TALIS, 2006) also used the SF-36 to measure QoL at twelve months follow-up. The fifth study (de Souza, 2010) used the Psychological General Well-Being Index (PGWBI) to measure QoL at five years follow-up.
Beelen (2021a) measured the QoL at twelve months with the SF-36 and reported mean differences for all domains on the SF-36. Almost all domains showed a difference at twelve months in favour of EA: physical health (mean difference (MD) -7.50, 95%CI -13.95 to -1.05), bodily pain (MD -8.40, 95%CI -16.08 to -0.72), vitality (MD -6.10, 95%CI 11.51 to -0.69), physical role limitation (MD -8.00, 95%CI -18.34 to 2.34), general health (MD -4.20, 95%CI -10,30 to 1.90), social functioning (MD -5.60, 95%CI -11.47 to 0.27), and mental health (MD -1.50, 95%CI -5.79 to 2.79). Only one domain – emotional role limitation – showed a MD of 4.30 (95%CI -3.49 to 12.09) in favour of LNG-IUD.
Tam (2006) (Rodriquez, 2020) also reported mean differences for all domains on the SF-36. Multiple domains showed a difference at twelve months in favour of EA: general health (MD -14.40, 95%CI -22.63 to -6.17), social functioning (MD -6.70, 95%CI -12.82 to -0.58), emotional role limitation (MD -10.10, 95%CI -17.03 to -3.17), and mental health (MD -11.20, 95%CI -17.08 to -5.32), physical functioning (MD -3.10, 95%CI -11.10 to 4.90), physical role limitation (MD -2.50, 95%CI -9.31 to 4.32), and vitality (MD -5.20, 95%CI -11.46 to 1.06). Only one domain – bodily pain – showed a MD of 0.40 (95%CI -6.43 to 7.23) in favour of LNG-IUD.
Crosignani (1997) and Soysal (2002) (Rodriquez, 2020) reported median SF-36 scores per domain at twelve months. In Crosignani (1997) (Rodriquez, 2020), median scores for all eight domains were equal to or higher in the LNG-IUD group as compared to the median scores in the EA group. The same was true for Soysal (2002) (Rodriquez, 2020), except for the domain general health perception.
TALIS (2006) (Rodriquez, 2020) reported the overall SF-36 score at twelve months. The MD was 2.60 (95%CI -5.98 to 11.18), in favour of LNG-IUD.
De Souza (2010) (Rodriquez, 2020) reported an improved physical well-being (RR 1.46; 95% CI 1.11 to 1.92) and emotional well-being (RR 1.59; 95% CI 1.09 to 2.30) at five years in participants having the LNG-IUD compared to EA.
Level of evidence
The level of evidence regarding the outcome measure quality of life was based on randomized studies and therefore starts at high. The level of evidence was downgraded by three levels from high to very low because of study limitations (no blinding of patients and physicians; risk of bias, -1); conflicting results (inconsistency, -1), and the small number of included patients (imprecision, -1).
4. Surgical reinterventions (important)
Beelen (2021a) reported the number of women with surgical reinterventions (endometrial ablation and/or hysterectomy) at 24 months. Rodriquez (2020) reported treatment failure, defined as the requirement for surgery for the treatment of HMB (ablation or hysterectomy) at twelve, 24 and 36 months for four studies in total. The results at twelve and 24 months were pooled and the results from Beelen (2021a) at 24 months were added to the forest plot (Figure 3). At twelve months, the pooled RR was 1.43 (95% CI 0.63 to 3.21), in favor of EA. At 24 months, the pooled RR was 1.40 (95% CI 0.46 to 4.31), also in favor of EA. Both RR’s at twelve and 24 months were clinically relevant.
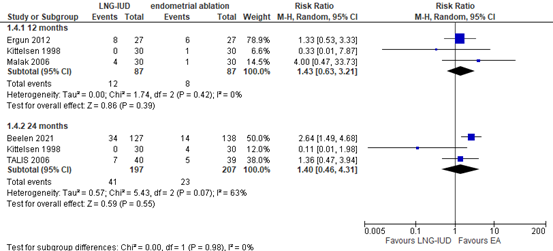
Figure 3. Surgical reinterventions at twelve and 24 months; LNG-IUD versus EA
At 36 months, Kittelsen (1998) (Rodriquez, 2020) reported that no women in the LNG-IUD (n=30) group required surgery, versus 4 women in the EA group (n=30). The risk difference was 13% (95% CI 0% to 27%).
Level of evidence
Surgical reinterventions at twelve and months
The level of evidence regarding the outcome measure surgical reinterventions at twelve and 24 months was based on randomized studies and therefore starts at high. The level of evidence was downgraded by three levels from high to very low because of conflicting results (inconsistency, -1), and the very wide confidence interval (imprecision, -2).
Surgical reinterventions at 36 months
The level of evidence regarding the outcome measure surgical reinterventions at 36 months
was based on a randomized study and therefore starts at high. The level of evidence was downgraded by three levels from high to very low because of the very small number of included patients and the very wide confidence interval (imprecision, -3).
5. Recovery time (important)
Not reported.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)favorable effects of the levonorgestrel-releasing intrauterine device (LNG-IUD) compared to endometrial ablation as a treatment in patients with heavy menstrual bleeding without myomas/adenomyosis?
P: patients with heavy menstrual bleeding (HMB) without myomas/adenomyosis
I: levonorgestrel-releasing intrauterine device
C: endometrial ablation
O: patient satisfaction, reduction in blood loss (amenorrhea and PBAC score), quality of life (using a validated scale), reinterventions, and recovery time.
Relevant outcome measures
The guideline development group considered patient satisfaction and reduction in blood loss as critical outcome measures for decision making; and quality of life, reinterventions, and recovery time as important outcome measures for decision making.
The working group defined the outcome measures as follows:
Patient satisfaction and quality of life need to be measured with a validated scale. Recovery time is the time from start of treatment to resumption of work/daily activities. Reduction of menstrual blood loss is measured by means of the PBAC (pictorial blood loss assessment chart) score (Janssen, 1995) and amenorrhea. Amenorrhea is the absence of uterine blood loss for longer than 90 days (Fraser, 2011).
For patient satisfaction, a difference of 20% was defined as a clinically (patient) important difference. For the PBAC score the working group decided that the intervention is successful if the mean or median post-treatment PBAC score was < 75. The median scores are preferred as PBAC has a skewed distribution. A difference between groups of 25% of women with a PBAC score < 75 was considered clinically relevant. For all other outcomes, the working group used 25% for dichotomous outcome measures and 0.5 SD for continuous outcome measures as a clinically (patient) important differences (Schüneman, 2013).
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched from 2012 until January 28, 2019, and updated with published literature from 2019 to December 31, 2021. The detailed search strategy of this updated search is depicted under the tab Methods. Studies were selected based on the following criteria: systematic reviews and RCTs that compared LNG-IUD to ablation in women with HMB without myomas/adenomyosis, and that reported at least one of the following outcome measures: patient satisfaction, amenorrhea/reduction in blood loss, quality of life (using a validated scale), re-interventions, and recovery time.
The systematic literature search up to 2019 resulted in 48 hits. Initially, 22 out of 48 studies were selected based on title and abstract screening. Two additional studies were added that were extracted from the reference lists in these articles. After reading the full text, 22 studies were excluded and two studies were included (Ghazizadeh, 2014; Lethaby, 2015)
The update search (2019-2021) resulted in 43 hits. Nine out of 43 studies were initially selected based on title and abstract screening. After reading the full text, seven studies were excluded (see the table with reasons for exclusion under the tab Methods), and two studies were included. No studies from the previous search were included (see exclusion tables).
Results
Two studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Beelen P, van den Brink MJ, Herman MC, Geomini PMAJ, Dekker JH, Duijnhoven RG, Mak N, van Meurs HS, Coppus SF, van der Steeg JW, Eising HP, Massop-Helmink DS, Klinkert ER, Nieboer TE, Timmermans A, van der Voet LF, Veersema S, Smeets NAC, Schutte JM, van Baal M, Bossuyt PM, Mol BWJ, Berger MY, Bongers MY. Levonorgestrel-releasing intrauterine system versus endometrial ablation for heavy menstrual bleeding. Am J Obstet Gynecol. 2021a Feb;224(2):187.e1-187.e10. doi: 10.1016/j.ajog.2020.08.016. Epub 2020 Aug 12. PMID: 32795428.
- Beelen P, van der Velde MGAM, Herman MC, Geomini PM, van den Brink MJ, Duijnhoven RG, Bongers MY. Treatment of women with heavy menstrual bleeding: Results of a prospective cohort study alongside a randomised controlled trial. Eur J Obstet Gynecol Reprod Biol. 2021b Feb;257:1-5. doi: 10.1016/j.ejogrb.2020.11.071. Epub 2020 Dec 1. PMID: 33309849.
- Beelen P, Reinders IMA, Scheepers WFW, Herman MC, Geomini PMAJ, van Kuijk SMJ, Bongers MY. Prognostic Factors for the Failure of Endometrial Ablation: A Systematic Review and Meta-analysis. Obstet Gynecol. 2019 Dec;134(6):1269-1281. doi: 10.1097/AOG.0000000000003556. PMID: 31764738.
- Bofill Rodriguez M, Lethaby A, Jordan V. Progestogen-releasing intrauterine systems for heavy menstrual bleeding. Cochrane Database Syst Rev. 2020 Jun 12;6(6):CD002126. doi: 10.1002/14651858.CD002126.pub4. PMID: 32529637; PMCID: PMC7388184.
- van den Brink MJ, Beelen P, Herman MC, Geomini PM, Dekker JH, Vermeulen KM, Bongers MY, Berger MY. The levonorgestrel intrauterine system versus endometrial ablation for heavy menstrual bleeding: a cost-effectiveness analysis. BJOG. 2021 Nov;128(12):2003-2011. doi: 10.1111/1471-0528.16836. Epub 2021 Jul 27. PMID: 34245652; PMCID: PMC8518490.
- van den Brink MJ, Beelen P, Herman MC, Claassen NJJ, Bongers MY, Geomini PM, van der Steeg JW, van den Wijngaard L, van Wely M. Women's preferences for the levonorgestrel intrauterine system versus endometrial ablation for heavy menstrual bleeding. Eur J Obstet Gynecol Reprod Biol. 2018 Sep;228:143-147. doi: 10.1016/j.ejogrb.2018.06.020. Epub 2018 Jun 12. PMID: 29945042.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Beelen, 2021a
MIRA-trial |
Type of study: RCT
Setting and country:
Funding and conflicts of interest: This trial was funded by the Netherlands Organization for Health Research and Development (ZonMw, grant number 171202001). The funder of the study had no role in the study design, collection, analysis, and interpretation of the data; in the writing of the manuscript; and in the decision to submit the article for publication. The authors had full access to all the data in the study and had final responsibility for the decision to submit for publication.
B.W.J.M. reports receiving grants from Guerbet and Merck; personal fees from Guerbet, Merck, and ObsEva; and other financial relationships with Guerbet (travel support to present at meetings), outside the submitted work. M.Y. Bongers reports other financial relationships with Gynesonics (device reduction in clinical trials), outside the submitted work. M.Y. Bongers is a member of the communication team of Bayer and the advisory board of Hologic. The remaining authors report no conflict of interest.
|
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention (LNG-IUS): 132 Control (EA): 138
Important prognostic factors2: Age, mean (SD) I: 44.7 (4.6) C: 45.3 (4.9)
BMI, mean (SD) I: 27.5 (5.4) C: 27.8 (5.8)
Vaginal deliveries, n (%) None I: 25 (20.0%) C: 23 (17.0%)
One I: 15 (12.0%) C: 26 (19.0%)
More than one I: 84 (68.0%) C: 87 (64.0%)
Cesarean delivery, n (%) I: 30 (23.0%) C: 23 (17.0%)
Previous uterus surgery, n (%) Myomectomy I: 7 (5.3) C: 11 (8.0)
Polypectomy I: 4 (3.0) C: 5 (3.6)
Duration of HMB in months, median (IQR) I: 12.0 (6.0-28.0) C: 12.0 (5.0-24.0)
Previous treatment, n (%) Tranexamic acid I: 19 (14.0) C: 20 (14.0)
NSAIDs I: 7 (5.3) C: 10 (7.2)
Oral contraceptives I: 33 (25.0) C: 32 (23.0)
Progestogens I: 17 (13.0) C: 14 (10.0)
LNG-IUS I: 3 (2.3) C: 5 (3.6)
GnRH agonist I: 1 (0.8) C: 0 (0.0)
NuvaRing I: 0 (0.0) C: 1 (0.7)
Anticoagulants, n (%) Platelet aggregation inhibitors I: 2 (1.5) C: 1 (0.7)
Vitamin K antagonists I: 3 (2.3) C: 1 (0.7)
Current hormonal medication, n (%) Oral contraceptives I: 19 (14.0) C: 17 (12.0)
Progestogens I: 4 (3.0) C: 5 (3.6)
Dysmenorrhea, n (%) Presence of dysmenorrhea I: 89 (73.0) , C: 87 (67.0)
Mild I: 22 (18.0) C: 14 (11.0)
Moderate I: 38 (31.0) C: 36 (28.0)
Severe I: 29 (24.0) C: 37 (28.0)
Duration of menstruation (days), median (IQR) I: 8.0 (6.0-10.5) C: 7.0 (6.0-10.0)
PBAC score, mean (SD) I: 616.3 (524.3) C: 630.0 (551.8)
Groups comparable at baseline? Yes, largely |
Describe intervention (treatment/procedure/test):
Levonorgestrel-releasing intrauterine system (LNG-IUS)
The device contains 52 mg levonorgestrel, releasing 20 ug/day. The device was inserted by a gynecologist, resident, or general practitioner skilled in inserting the LNG-IUS.
|
Describe control (treatment/procedure/test):
Endometrial ablation
The procedure was performed with a bipolar radiofrequency device: NovaSure system. The procedure was performed by a gynecologist or resident experienced in treatment with the NovaSure device. The procedure was performed in the office under local anesthetics or conscious sedation or in the operating room under general or spinal anesthesia depending on the local setting. |
Length of follow-up: 24 months
Loss-to-follow-up: I: 115 analysed ITT / 112 analysed PP C: 132 analysed ITT / 119 analysed PP
|
Outcome measures and effect size (include 95%CI and p-value if available):
1. Patient satisfaction Satisfaction at 3 months, n/total (%) Very satisfied I: 11/92 (12%) Satisfied I: 29/92 (32%) Uncertain I: 18/92 (20%) Dissatisfied Very dissatisfied
Satisfaction at 6 months, n/total (%) Very satisfied I: 22/96 (23%) Satisfied I: 35/96 (36%) Uncertain I: 20/96 (21%) Dissatisfied I: 13/96 (14%) Very dissatisfied I: 6/96 (6%)
Satisfaction at 12 months, n/total (%) Very satisfied: I: 28/83 (34%) C: 64/104 (62%) Satisfied: I: 34/83 (41%) C: 27/104 (26%) Uncertain: I: 11/83 (13%) C: 4/104 (3.8%) Dissatisfied: I: 7/83 (8.4%) C: 5/104 (4.8%) Very dissatisfied: I: 3/83 (3.6%) C: 4/104 (3.8%)
Satisfaction at 24 months, n/total (%) Very satisfied: I: 46/100 (46%) C: 73/116 (63%) Satisfied: I: 28/100 (28%) C: 25/116 (22%) Uncertain: I: 20/100 (20%) C: 7/116 (6%) Dissatisfied: I: 4/100 (4%) C: 7/116 (6%) Very dissatisfied: I: 2/100 (2%) C: 4/116 (3.4%)
2. Reduction in blood loss 2.1 PBAC score PBAC score < 75 at 3 months, n (%) I: 52/87 (60%) C: 90/108 (83%) RR: 0.72; 95% CI 0.59 to 0.87
PBAC score < 75 at 6 months, n (%) I: 70/100 (70%) C: 99/113 (88%) RR: 0.80; 95% CI 0.69 to 0.92
PBAC score < 75 at 12 months, n (%) I: 90 (87%) C: 110 (89%) RR: 0.98; 95% CI 0.88 to 1.08
PBAC score < 75 at 24 months, n (%) I: 100/115 (87%) C: 124/132 (94%) RR: 0.93; 95% CI 0.85 to 1.01
2.2 Amenorrhea Amenorrhea at 24 months, n (%) I: 67 (58%) C: 89 (67%) RR: 0.86; 95% CI 0.71 to 1.05
3. Quality of life QoL at 12 months measured with the SF-36 (different domains), mean (SD), n
Physical functioning I: 82.6 (24.6) n=83 C: 90.1 (19.2) n=104
Role limitation (physical) I: 75.9 (37.3) n=83 C: 83.9 (33.9) n=104
Bodily pain I: 74.8 (28) n=83 C: 83.2 (24.8) n=104
General health I: 68.6 (22.4) n=83 C: 72.8 (19.5) n=104
Vitality I: 60.8 (19.1) n=83 C: 66.9 (18.2) n=103
Social functioning I: 82.1 (20.9) n=83 C: 87.7 (19.6) n=104
Emotional role limitation I: 91.2 (23.3) n=83 C: 86.9 (31) n=104
Mental health I: 78.1 (15.3) n=83 C: 79.6 (14.3) n=104
4. Reinterventions LNG-IUD removal, n (%) I: 49 out of 127 (39%)
Number of women who received >1 reintervention at 24 months, n (%) I: 44 out of 127 (35%) C: 27 out of 138 (20%) RR: 1.77; 95% CI 1.17 to 2.68
Drug reintervention, n (%) I: 19 out of 127 (15%) C: 13 out of 138 (9.4%)
Surgical reintervention (24 months), n (%) I: 34 out of 127 (26.8%) C: 14 out of 138 (10.1%)
5. Recovery time Not reported. |
Author’s conclusion: This study showed that a strategy starting with the LNG-IUS and a strategy starting with EA lead to controlled bleeding in most women with comparable satisfaction, QoL, and sexual function scores. With both strategies, a large decrease in menstrual blood loss was found. Nevertheless, the mean score at 24 months was lower in the EA group, and we could not demonstrate noninferiority of the LNG-IUS strategy. Women who started with the LNG-IUS more frequently had further treatment, with a quarter of the women undergoing EA. |
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Rodriquez, 2020
|
SR and meta-analysis of RCTs
Literature search up to June, 2019
Comparison LNG-IUS vs EA
A: Barrington 2003 B: Crosignani, 1997 C: De Souza, 2010 D: Ergun, 2012 E: Malak, 2006 F: Shaw, 2007 G: Soysal, 2002 H: TALIS, 2006 I: Tam, 2006 J: Kittelsen 1998 K: Herman, 2013
Study design: RCT
Setting and Country: A: gynaecology clinic in district hospital, UK B: Italy C: Brazil D: Turkey E: Egypt F: UK G: university medical centre, Turkey H: hospital out patient clinic, NZ I: outpatient gynaecology clinic, Hong Kong J: gynaecology clinic, Norway K: Netherlands
Source of funding and conflicts of interest: non-commercial
|
Inclusion criteria SR: Women of reproductive years with regular heavy periods measured either objectively (by the alkaline haematin method), semi-objectively (by PBAC score) or subjectively (patient perception)
Exclusion criteria SR: Postmenopausal bleeding (more than one year from the last menstrual period); irregular menses (periods either less than 21 days or more than 35 days apart) and intermenstrual bleeding (bleeding between periods) at presentation; pathological causes of heavy menstrual bleeding; primary use of progesterone-releasing intrauterine system for any reason other than heavy menstrual bleeding for example contraception or relief of climacteric symptoms; conditions where the use of the LNG-IUS is contraindicated
25 studies included in total
Important patient characteristics at baseline: N, age A: 50 patients, age not reported B: 70 patients, 38-53 yrs C: 58 patients, >35 yrs D: 58 patients, >35 yrs E: 60 patients, 40-50 yrs F: 66 patients, 25-49 yrs G: 72 patients, >40 yrs (mean 44 yrs) H: 79 patients, 25-50 yrs (mean 41-43 yrs) I: 44 patients, >40 yrs (mean 44 and 45 yrs) J: 60 patients, 30-49 yrs K: 270 patients, >34 yrs
Groups comparable at baseline? |
A: Levonorgestrel-releasing intrauterine system (LNG IUS, Mirena) B: Levonorgestrel-releasing (20 ug/day) intrauterine contraceptive system inserted within seven days of menstruation C: Levonorgestrel-releasing IUS (Mirena), 12 months D: LNG-IUS inserted within first 15 days of menstrual cycle E: LNG IUS inserted following menstruation F: LNG IUS (Mirena) inserted in the uterine cavity just following menstruation G: LNG IUS inserted in the uterine cavity within first seven days of menstruation H: LNG IUS (Mirena) I: LNG IUS inserted following diagnostic hysteroscopy J: Levonorgestrel-releasing intrauterine system (LNG IUS) (Mirena) inserted within 7 days of the start of menstruation K: LNG-IUS (Mirena®)
|
A: Thermal balloon ablation after pre-operative endometrial thinning with gosarelin one month prior B: Endometrial resection in the early proliferative phase using a rollerball and a 90 degree loop. All the resections were performed by the same surgeon C: Thermal balloon ablation (Thermachoice) under general anaesthesia D: Rollerball endometrial ablation undertaken by obstetrics and gynaecology specialist E: Endometrial resection (ER) under general anaesthesia F: Thermal balloon ablation (Menotreat) - undertaken under general anaesthesia post menstruation without routine pretreatment G: Thermal balloon ablation with 2 months of pre-treatment with GnRH analogues to thin the endometrium H: Balloon ablation (Thermachoice I) I: Thermal balloon endometrial ablation (Thermachoice) performed 6 weeks after thinning with GnRH analogue or oral danazol J: Transcervical resection of the endometrium (TCRE) performed regardless of day of menstrual cycle K: Bipolar endometrial ablation (Novasure®) |
End-point of follow-up: A: 6 months B: 12 months C: 5 years D: 12 months E: 12 months F: 2 years G: 12 months H: 24 months I: Not reported J: 36 months K: 24 months
For how many participants were no complete outcome data available? (intervention/control) A: 4 (16%) / 2 (8%) B: 1 (1,4%) C: 3 (10%) / 3 (11%) D: 16 (27.6%) E: 4 (13%) / 0 F: 16 (24%) G: 6 (8.3%) H: 11 (13.9%) I: 11 (25%) J: 7 (12%) K: ?
|
1. Patient satisfaction Defined as proportion satisfied with treatment
12 months Effect measure: RR (95% CI): B: 0.90 (0.77 to 1.06) D: 0.89 (0.61 to 1.28) F: 0.97 (0.75 to 1.26) G: 0.93 (0.68 to 1.25) H: 1.07 (0.88 to 1.30)
24 months Effect measure: RR (95% CI): F: 0.98 (0.80 to 1.21) K: 0.87 (0.77 to 0.99)
5 years Effect measure: RR (95% CI): C: 1.25 (1.01 to 1.53)
2. Reduction in blood loss Defined as amenorrhea and PBAC score
2.1 PBAC score 6 months A: C: median 27 (range 0 to 424)
12 months B: I: mean 38.8 (SD 37.1) C: mean 23.5 (SD 32.6) D: I: mean 70 (SD not reported) C: mean 55 (SD not reported) E: I: mean 40.6 (SD 28.5) C: mean 42.2 (SD 30.4) F: I: median 26 (range 0 to 68) C: median 62 (range 0 to 142) G: I: mean 55 (SD 11) C: mean 21.8 (SD 14) RR 33.20 (95% CI 27.16 to 39.24)
24 months H: I: mean 20.6 (SD 28.8) C: mean 75.4 (SD 91.1)
36 months J: I: median 7 (range 0 to 101) C: median 4 (range 0 to 182)
2.2 Amenorrhea 12 months Effect measure: RR (95% CI): A: 1.64 (0.30 to 8.89) B: 0.69 (0.27 to 1.72) C: 0.70 (0.17 to 2.85) D: 1.33 (0.57 to 3.12) E: 1.24 (0.72 to 2.14) F: 7.04 (0.91 to 54.31) H: 2.92 (0.63 to 13.62) I: 0.12 (0.01 to 2.16)
3. Quality of life Measured differently per study I:
Physical functioning I: 40.5 (11) n=18 C: 43.6 (12.2) n=15
Role limitation (physical) I: 51.1 (10.8) n=18 C: 53.6 (9.2) n=15
Bodily pain I: 49.5 (10.7) n=18 C: 49.1 (9.3) n=15
General health I: 40.5 (8.5) n=18 C: 54.9 (14.3) n=15
Vitality I: 42 (7) n=18 C: 47.2 (10.6) n=15
Social functioning I: 43 (9.3) n=18 C: 49.7 (8.6) n=15
Emotional role limitation I: 46 (11.2) n=18 C: 56.1 (9.1) n=15
Mental health I: 38.3 (9.8) n=18 C: 49.5 (7.4) n=15
H: 36-Item Short Form Survey (SF-36) overall score, mean (SD), n I: 77.5 (20.1) n=40 C: 74.9 (18.8) n=39
B: 36-Item Short Form Survey (SF-36), median, IQR
Physical functioning: I: 85.0, IQR 62.8-95.0 C: 90.0, IQR 71.9-94.7
Social functioning: I: 75.0, IQR 50.0-87.5 C: 75.0, IQR 56.2-87.5
Physical role limitation: I: 100.0, IQR 50.0-100.0 C: 100.0, IQR 50.0-100.0
Emotional role limitation: I: 66.7, IQR 33.3-100.0 C: 100.0, IQR 66.7-100.0
Bodily pain: I: 41, IQR 41.0-84.0 C: 72.0, IQR 55.0-92.0
General health perception: I: 65.0, IQR 51.0-79.5 C: 72.5, IQR 64.5-77.0
Vitality: I: 55.0, IQR 47.5-65.0 C: 55.0, IQR 40.0-70.0
Mental health: I: 60.0, IQR 46.0-68.0 C: 64.0, IQR 46.7-68.0
G: 36-Item Short Form Survey (SF-36), median, IQR
Physical functioning: I: 72.5, IQR 53.7 to 91.2 C: 75, IQR 42.5 to 40
Social functioning: I: 50, IQR 3.7 to 96.8 C: 0, IQR 125 to 87.5
Physical role limitation: I: 25, IQR -25 to 75 C: 50, IQR -25 to 125
Emotional role limitation: I: 33.3, IQR -58.3 to 124.9 C: 33.3, IQR -33.3 to 99.9
Pain: I: 51, IQR 30 to 72 C: 51, IQR 20 to 82
General health perception: I: 52, IQR 25.5 to 78.5 C: 47, IQR 19.5 to 74.5
Vitality: I: 45, IQR 26.2 to 63.7 C: 45, IQR 10 to 80
Mental health: I: 52, IQR 25 to 79 C: 52, IQR 22 to 82
C: Quality of life at 5 years, proportion with improved wellbeing measured with Psychological General Well-Being Index (PGWBI), proportion/total
C: 17/25
Emotional I: 24/27 C: 14/25
4. Surgical reinterventions Defined as the requirement for surgery for the treatment of HMB (ablation or hysterectomy)
12 months Effect measure: RR (95% CI): D. 1.33 (0.53 to 3.33) E. 4.00 (0.47 to 33.73) J. 0.33 (0.01 to 7.87)
24 months Effect measure: RR (95% CI): H: 1.36 (0.47 to 3.94) J: 0.11 (0.01 to 1.98)
36 months Effect measure: RD (95% CI): J: I: 0 out of 30 C: 4 out of 40 RD 13% (95% CI 27% to 0%)
5. Recovery time Not reported. |
HMB = Heavy menstrual bleeding EA = Endometrial ablation PBAC = bleeding assessment chart score |
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Beelen, 2021a |
Definitely yes;
Reason: Consenting women were randomly allocated in a 1:1 ratio to 1 of 2 treatment arms. Randomization was performed in blocks, with a variable block size of 2 or 4, and was stratified for recruitment by the general practitioner or gynecologist. |
Definitely yes;
Reason: Women were allocated by research nurses at the local centers, using an internet-based randomization module. |
Definitely no
Reason: Patients and their treating physician were not blinded for the allocated treatment (not possible). |
Definitely yes
Reason: Small numbers of loss to follow-up: 5 in the intervention group (LNG-IUD), 0 in the control group (EA). |
Definitely yes
Reason: All relevant outcomes were reported and changes to the previously published study protocol were justified. |
Definitely yes
Reason: ITT analyses were performed.
The funder of the study had no role in the study design, collection, analysis, and interpretation of the data; in the writing of the manuscript; and in the decision to submit the article for publication. The authors had full access to all the data in the study and had final responsibility for the decision to submit for publication. |
HIGH for soft outcome measures
Reason: No blinding performed |
Table of quality assessment for systematic reviews of RCTs and observational studies
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Rodriquez, 20 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
Tables of excluded studies
Search 1 (2012-January 2019)
|
Author and year |
Reason for exclusion |
|
Blake, 2016 |
Double article |
|
Busfield, 2006 |
Included in Lethaby 2015 |
|
Duckitt K, 2012 |
Cochrane review Lethaby 2015 included, this study does not contain extra information. |
|
Ergun, 2012 |
Congress abstract |
|
Ganz, 2013 |
Does not fit the PICO |
|
Health Quality Ontario, 2016 |
Cochrane review Lethaby 2015 included, this study does not contain extra information. |
|
Herman, 2013 |
Protocol paper, does not contain data. |
|
Hoaglin, 2013 |
Cochrane review Lethaby 2015 included, this study does not contain extra information. |
|
Karimi-Zarchi, 2016 |
No RCT |
|
Kaunitz, 2012 |
Cochrane review Lethaby 2015 included, this study does not contain extra information. |
|
Louie, 2017 |
Does not fit the PICO |
|
Marjoribanks, 2016 |
Cochrane review Lethaby 2015 included, this study does not contain extra information. |
|
Matteson, 2012 |
Does not fit the PICO |
|
McCarthy, 2017 |
No RCT |
|
Pai, 2009 |
No RCT |
|
Rauramo, 2004 |
Included in Lethaby 2015 |
|
Roberts, 2011 |
Does not fit the PICO |
|
Silva-Filho, 2013 |
Included in Lethaby 2015 |
|
Singh, 2018 |
Guideline (no comparative study) |
|
Spencer, 2017 |
Does not fit the PICO |
|
van den Brink, 2018 |
Does not fit the PICO |
|
Yang, 2015 |
Cochrane review Lethaby 2015 included, this study does not contain extra information. |
Search 2 (2019-December 2021)
|
Author and year |
Reason for exclusion |
|
Bergeron, 2020 |
Probably fits the PICO, but will not be included as we chose to include the SR of Rodriguez 2020 (comparable reviews), as this SR is a Cochrane review of good quality and Bergeron 2020 does not clearly describe if patients were free of myomas. |
|
Beelen, 2021b |
Partly fits the PICO, but this study compares re-intervention rates between women included in an RCT versus an observational cohort. The RCT in question is the Mira trial (Beelen, 2021a), and is already included in the literature summary. The cohort study does not fit the defined study design. This study is, however, interesting to include in the considerations. |
|
Lethaby, 2015 |
This review was previously included in the module. However, there is an updated version of this review (Rodriquez, 2020) that is included for the update of this module. |
|
Ghazizadeh, 2014 |
Excluded because the study was initially included in the review of Rodriquez (2020), but they excluded it from the sub-analysis comparing LNG-IUD with EA. |
|
van den Brink, 2021 |
Does not fit PICO; wrong study design (cost-effectiveness analysis), but will be described in the considerations. |
|
McCarthy, 2017 |
Wrong study design (retrospective study, no RCT) |
|
van den Brink, 2018 |
Does not fit PICO: investigates preferences. Study will be described in the considerations. |
|
Oderkerk, 2021 |
Systematic review in which all types of studies were included - not solely RCTs |
|
Parra, 2020 |
Wrong language |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 09-01-2023
Geldigheid en onderhoud
Bij het opstellen van de module heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodule komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
|
Regiehouder(s)[1] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijnmodule[2] |
Frequentie van beoordeling op actualiteit[3] |
Wie houdt er toezicht op actualiteit[4] |
Relevante factoren voor wijzigingen in aanbeveling[5] |
|
NVOG |
2022 |
Eind 2027 |
Elke 5 jaar |
NVOG |
Ontwikkelingen in het vakgebied, nieuwe data. |
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
- Dr. C.A.H. Janssen, gynaecoloog Groene hart ziekenhuis, NVOG (inhoudelijk voorzitter)
- Drs. F.E.M. Vree, Gynaecoloog NWZ Alkmaar, NVOG
Met ondersteuning van
- Dr. R. Zwarts - van de Putte, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- F.M. Janssen, MSc, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. L. Niesink-Boerboom, literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Janssen |
Gynaecoloog Groene hart ziekenhuis |
Geen |
Geen |
Geen |
|
Vree |
Gynaecoloog NWZ Alkmaar (per 1 januari 2022) |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een patiëntvertegenwoordiger als werkgroeplid te betrekken bij de ontwikkeling van deze module. De conceptmodule wordt tevens voor commentaar voorgelegd aan de patiëntenvereniging.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze module is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit de inventarisatie van de knelpunten door de werkgroep bleek dat er een noodzaak was voor revisie van deze richtlijnmodule. Tijdens deze inventarisatie zijn er knelpunten aangedragen door relevante partijen via een schriftelijke enquête. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse is door de werkgroepleden en de adviseur een uitgangsvraag opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad ‘Zoekverantwoording’ voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration:
- Cochrane - voor gerandomiseerd gecontroleerd onderzoek;
- ACROBAT-NRS - voor observationeel onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz 2017).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de module is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Indicatorontwikkeling
Op verzoek van de NVOG werden er geen indicatoren ontwikkeld bij deze module vanwege het beperken van de registratielast van medisch specialisten.
Kennislacunes
Tijdens de ontwikkeling van deze module is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de bijlage Kennislacunes. Deze bijlage is te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodule werd aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve module werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.


