Palliatieve zorg bij hersenmetastasen
Uitgangsvraag
Wanneer en hoe moet palliatieve zorg worden ingezet bij patiënten met hersenmetastasen?
Aanbeveling
- Zet palliatieve zorg in vanaf de diagnose van de hersenmetastasen, tenzij een lange overleving en/of curatie aannemelijk is.
- Draag zorg voor:
- zorgvuldige afwegingen van de voors en tegens van ziektegerichte behandeling, zowel bij de start ervan als tijdens de behandeling;
- gezamenlijke besluitvorming van zorgverleners en patient
- adequate symptoombestrijding;
- aandacht voor klachten en problemen op psychisch, sociaal en/of spiritueel gebied;
- ‘advance care planning’;
- optimale zorg in de stervensfase.
- zorg voor de naasten (inclusief nazorg na het overlijden);
- Maak duidelijke afspraken over de taakverdeling en zorg voor goede afstemming en overdracht tussen alle betrokken zorgverleners.
- Zorg ervoor dat het de patiënt op ieder moment duidelijk is wie de centrale zorgverlener is en stem dit af met de betrokken zorgverleners.
- Raadpleeg bij moeilijk behandelbare symptomen en/of complexe problemen deskundigen, bijvoorbeeld een palliatief team, en/of verwijs naar gespecialiseerde zorgverleners.
Overwegingen
Voor de algemene aspecten van palliatieve zorg wordt verwezen naar de Algemene principes van palliatieve zorg (Integraal Kankercentrum, 2018-1) en het Kwaliteitskader palliatieve zorg in Nederland (Boddaert, 2017).
Er is weinig literatuur (Gofton, 2012; Habibi, 2018; Kaal, 2005; Oneschuk, 1998; Ostgathe, 2012; Taillibert, 2005) en er zijn geen richtlijnen over symptoomgerichte palliatieve zorg bij patiënten met hersenmetastasen.
In een retrospectief onderzoek bij 145 patiënten met hersenmetastasen, behandeld in een academisch centrum in de Verenigde Staten en verwezen naar het palliatieve team, werd het effect onderzocht van het tijdstip van consultatie op het zorggebruik en klinische uitkomsten (Habibi, 2018). Zesenveertig patiënten die binnen 8 weken na de diagnose werden verwezen naar het palliatieve team, werden vergeleken met een op leeftijd, geslacht en performance status gematchte groep van 46 patiënten, die later werden verwezen. Vroege consultatie was geassocieerd met minder opnames (p=0,004), vaker ontslag naar huis na opname (p=0,04), minder bezoek aan de Spoedeisende Hulp (p=0,006), minder PET-CT-scans (p=0,005), minder MRI’s (p=0,03) en minder stereotactische bestralingen (p<0,001). Er was geen verschil in overleving. Gezien het retrospectieve karakter van de studie kan (ondanks de matching van de groepen) de mogelijkheid van bias niet worden uitgesloten.
In het Kwaliteitskader Palliatieve Zorg in Nederland (Boddaert, 2017) wordt een negatief antwoord op de ‘surprise question’ (Zou u verbaasd zijn als de patiënt binnen een jaar is overleden?) als markering van de palliatieve fase gebruikt. Bij veel patiënten met hersenmetastasen (zeker als ze symptomatisch zijn) zal dit het geval zijn, omdat aannemelijk is dat ze binnen een jaar zullen overlijden, hetzij aan de hersenmetastasen, hetzij aan extracraniële ziekte.
Onderstaande aanbevelingen zijn gebaseerd op de Algemene principes van palliatieve zorg (Integraal Kankercentrum, 2018-1), het Kwaliteitskader palliatieve zorg in Nederland (Boddaert, 2017), de bovengenoemde literatuur en de mening van de werkgroep.
In het kader van het inzetten van palliatieve zorg bij patiënten met hersenmetastasen wordt aandacht besteed aan:
- zorgvuldige afwegingen van de voors en tegens van ziektegerichte behandeling, zowel bij de start ervan als tijdens de behandeling, waarbij niet te lang wordt doorbehandeld en de behandeling tijdig wordt gestaakt (zie ook: Stuurgroep Passende zorg in de laatste levensfase, 2015;
- adequate symptoombestrijding (zie verder en zie ook de richtlijnen palliatieve zorg (https://www.pallialine.nl/);
- behandeling van en aandacht voor klachten en problemen op psychisch, sociaal en/of spiritueel gebied;
- gezamenlijke besluitvorming van zorgverleners en patient;
- ‘advance care planning’ (Koninklijke Nederlandsche Maatschappij tot bevordering der Geneeskunde, 2012); daarbij kunnen aan de orde komen:
- wensen ten aanzien van behandeling van de ziekte en/of complicaties daarvan;
- of patiënt bij een complicatie opgenomen wil worden;
- wensen ten aanzien van reanimatie en/of beademing;
- opstellen van een schriftelijke wilsverklaring;
- aanwijzen van een wettelijk vertegenwoordiger;
- gewenste plaats van overlijden;
- beslissingen rond het levenseinde:
- bewust stoppen met eten en drinken om het levenseinde te bespoedigen;
- palliatieve sedatie;
- euthanasie;
- de arts kan in dat gesprek ook zijn mogelijkheden en zijn grenzen en beperkingen aangeven;
- zorg voor de naasten (inclusief nazorg na het overlijden);
- optimale zorg in de stervensfase (zie: Van Zuylen, 2010).
Voor iedere patiënt is een centrale zorgverlener (ook wel regiebehandelaar of case manager genoemd) beschikbaar (Boddaert, 2017). De centrale zorgverlener coördineert de zorg ten behoeve van de continuïteit. In samenspraak met de patiënt en diens naasten worden de taken van de centrale zorgverlener uitgevoerd door de hoofdbehandelaar, dan wel gedelegeerd aan een andere zorgverlener. Door veranderingen in situatie van de patiënt of de plaats waar deze behandeld en begeleid wordt, kan het noodzakelijk zijn van centrale zorgverlener te wisselen. De landelijke eerstelijns samenwerkingsafspraak palliatieve zorg kent de huisarts daarbij een belangrijke rol toe (Eizenga, 2006). In dit proces is een goede samenwerking en overdracht tussen zorgverleners essentieel.
Het is belangrijk om duidelijk af te spreken en af te stemmen wie welke taken voor zijn of haar rekening neemt. Bij patiënten met hersenmetastasen zal de medisch specialist die op dat moment hoofdbehandelaar is betrokken zijn bij de afwegingen van behandeling en (samen met de gespecialiseerd verpleegkundige of verpleegkundig specialist, indien betrokken) bij de symptoombestrijding tijdens de fase van behandeling. In de uitsluitend symptoomgerichte fase zal de huisarts meestal een centrale rol spelen bij de symptoombestrijding. Gesprekken over advance care planning kunnen gevoerd worden door de medisch specialist, de verpleegkundig specialist en/of de huisarts. Zorg in de stervensfase wordt geleverd door de zorgverleners op de locatie, waar de patiënt overlijdt (thuis, hospice, verpleeghuis of ziekenhuis).
Palliatieve zorg vergt expertise. In alle regio’s van Nederland zijn palliatieve teams (intra-, trans- of extramuraal) beschikbaar voor advies bij moeilijk behandelbare symptomen en/of complexe problemen (Integraal Kankercentrum, 2018-2). Consultatie is aangewezen bij moeilijk behandelbare symptomen en/of complexe problemen.
Onderbouwing
Achtergrond
Bij patiënten waarbij in opzet curatieve systemische therapie mogelijk is (bijvoorbeeld bij het testiscarcinoom) is curatie mogelijk in aanwezigheid van hersenmetastasen. De behandeling van andere patiënten met hersenmetastasen is palliatief in het overgrote gedeelte van de gevallen.
In de afgelopen decennia was de prognose van de meeste patiënten met hersenmetastasen slecht. In een retrospectief Zweeds onderzoek bij 15.517 patiënten met hersenmetastasen, die in de periode 1987 tot 2006 werden opgenomen in een ziekenhuis, bedroegen de mediane overleving en de 1-jaarsoverleving respectievelijk 2,7 maanden en 13% (Smedby, 2009). Er was geen verbetering in de loop van de tijd.
Bij een klein deel van de patiënten was lange termijn overleving mogelijk (Chao, 2006; Kotecha, 2002 en 2016; Lutterbach, 2002). Er werden vijfjaarsoverlevingen beschreven van 2,5% (Chao, 2006), 8,9% (Katechoa, 2002), 1,3% (Kotecha, 2016) en 1,8% (Lutterbach, 2002). Het betrof echter geselecteerde populaties.
In de afgelopen jaren is vermoedelijk enige vooruitgang geboekt. In een retrospectief cohortonderzoek werd de overleving van twee gematchte cohorten van 103 patiënten met hersenmetastasen (behandeld in meerdere instituten in de periode 1983 tot 1989 respectievelijk 2005 tot 2009) vergeleken (Nieder, 2011). De mediane overleving bedroeg 3,2 maanden in het eerste cohort en 3.9 maanden in het recente cohort. De 1-jaarsoverleving verbeterde van 15% (95% betrouwbaarheidsinterval 7 tot 25) naar 34% (95% betrouwbaarheidsinterval 25 tot 44%, p=0,03). In het cohort 2005 tot 2009 werden patiënten vaker behandeld met stereotactische radiotherapie, resectie en/of systemische therapie.
In een recent gepubliceerde studie uit de Verenigde Staten, waarbij SEER-data uit de periode 2010-2013 werden gebruikt over patiënten met hersenmetastasen ten tijde van de diagnose kanker (n=26.430), varieerde de mediane overleving voor de meeste tumortypes van 4 tot 6 maanden; bij het mammacarcinoom en het prostaatcarcinoom bedroeg de mediane overleving 10 respectievelijk 12 maanden (Cagney, 2017). De prognose van hersenmetastasen die in het beloop van de ziekte gevonden worden is vermoedelijk echter slechter.
Bij patiënten met hersenmetastasen van een melanoom is duidelijk vooruitgang geboekt, vermoedelijk vooral als gevolg van sterk verbeterde mogelijkheden voor systemische behandeling. In een recente retrospectieve studie bij 243 patiënten met hersenmetastasen van een melanoom, die werden behandeld met systemische therapie en/of radiotherapiebedroeg de mediane overleving vanaf het moment vande diagnose van de hersenmetastasen, vastgesteld in de periodes 2000 tot 2008, 2009 tot 2010 en vanaf 2011 respectievelijk 7, 5, 8, 5 en 22,7 maanden (Sloot, 2018). Het betrof wel een geselecteerde groep patiënten, gelet op het feit dat allen behandeld werden met systemische therapie en/of radiotherapie en 47% van de hersenmetastasen asymptomatisch was.
Of hersenmetastasen van een melanoom symptomatisch zijn of niet, is van grote invloed op de prognose. In een recente systematische review van 15 studies bij in totaal 1132 patiënten met hersenmetastasen, die behandeld werden met targeted therapy en/of immuuntherapie in combinatie met radiotherapie bedroegen de 1- en 2-jaarsjaars overleving bij asymptomatische versus symptomatische hersenmetastasen respectievelijk 70% versus 30% en 41% versus 0% (Rulli, 2019).
Palliatieve zorg wordt in het ‘Kwaliteitskader Palliatieve Zorg in Nederland’ gedefinieerd als ‘een benadering die de kwaliteit van leven verbetert van patiënten en hun naasten die te maken hebben met een levensbedreigende aandoening of kwetsbaarheid, door het voorkomen en verlichten van lijden door middel van vroegtijdige signalering en zorgvuldige beoordeling en behandeling van pijn en andere problemen van lichamelijke, psychosociale en spirituele aard’ (Boddaert, 2017).
Op basis van gerandomiseerd onderzoek bij patiënten met gevorderde stadia van kanker (Bakitas, 2009; Ferrell, 2014 en 2017; May, 2015; Temel 2010 en 2012, Zimmerman 2014) zijn er aanwijzingen dat vroegtijdig inzetten van palliatieve zorg kan leiden tot:
- beter besef van de prognose;
- verbetering van de stemming;
- verbetering van de kwaliteit van leven;
- minder vaak inzetten van chemotherapie kort voor het overlijden;
- tevredenheid over de zorg;
- verlaging van de kosten van de zorg;
- verlenging van de overleving.
- Bij palliatieve zorg wordt onderscheid gemaakt tussen (zie figuur 1) (Boddaert, 2017, Integraal Kankercentrum Nederland 2018-1):
- ziektegerichte palliatie;
- symptoomgerichte palliatie;
- palliatie in de stervensfase;
- nazorg.
Figuur 1
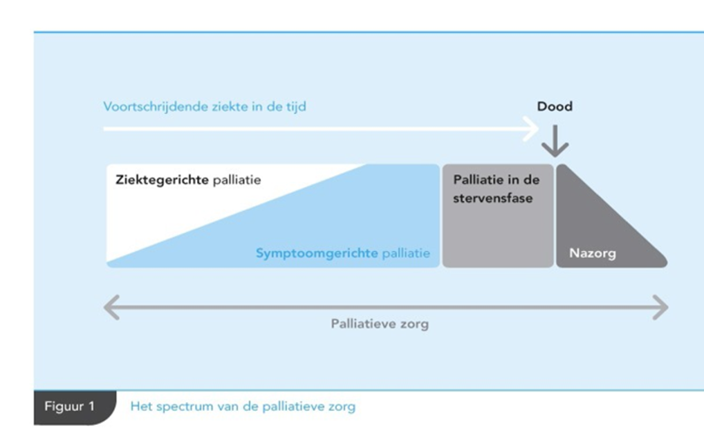
Bij patiënten met hersenmetastasen gaat het bij de ziektegerichte palliatie om radiotherapie, operatie en/of systemische therapie.
Ten aanzien van de prevalentie van symptomen ten gevolge van hersenmetastasen wordt verwezen naar de paragraaf over anamnese en lichamelijk onderzoek.
Zoeken en selecteren
Gezien de aard van de uitgangsvraag is voor deze uitgangsvraag geen systematische zoekactie uitgevoerd. Voor de overwegingen is literatuuronderzoek gedaan door de werkgroepleden.
Referenties
- Bakitas M, Lyons KD, Hegel MT, et al. Effects of a palliative care intervention on clinical outcomes in patients with advanced cancer: the Project ENABLE II randomized controlled trial. JAMA. 2009 19; 302: 741-9.
- Balan S, Brokaw FC, Seville J, Hull JG, Li Z, Tosteson TD, Byock IR, Ahles TA, Boddaert M, Douma J, Dijxhoorn F, Bijkerk M. Kwaliteitskader palliatieve zorg in Nederland. Integraal Kankercentrum Nederland, 2017.
- Cacho Díaz B, Spínola Maroño H, González Aguilar A, Arrieta O. Factors associated with long-term survival in central nervous system metastases. J Neuro-Oncol 2017; J Neurooncol. 2018 Jul 12. doi: 10.1007/s11060-018-2946-x. (Epub ahead of print).
- Cagney DN, Martin AM, Catalano PJ, Redig AJ, Lin NU, Lee EQ, Wen PY, Dunn IF, Bi WL, Weiss SE, Haas-Kogan DA, Alexander BM, Aizer AA. Incidence and prognosis of patients with brain metastases at diagnosis of systemic malignancy: a population-based study. Neuro Oncol 2017;19(11):1511-1521.
- Chao ST, Barnett GH, Liu SW, Reuther AM, Toms SA, Vogelbaum MA, Videtic GM, Suh JH. Five-year survivors of brain metastases: a single-institution report of 32 patients. Int J Radiat Oncol Biol Phys 2006; 66(3): 801-9.
- Eizenga WH, De Bont M, Vriezen JA, Jobse AP, Kruyt JE, Lampe IH, Leydens-Arendse CA, Van Meggelen ML, Van den Muijsenbergh METC. Landelijke eerstelijns samenwerkingsafspraak palliatieve zorg. Huisarts en Wetenschap 2006; 49: 308-312.
- Ferrell B, Sun V, Hurria A, et al. Interdisciplinary Palliative Care for Patients With Lung Cancer. J Pain Symptom Manage. 2015; 50(6): 758-67.
- Ferrell BR, Temel JS, Temin S, et al. Integration of Palliative Care Into Standard Oncology Care: American Society of Clinical Oncology Clinical Practice Guideline Update. J Clin Oncol. 2017; 35(1): 96-112
- Gofton TE, Graber J, Carver A. Identifying the palliative care needs of patients living with cerebral tumors and metastases: a retrospective analysis. J Neurooncol 2012; 108: 527–534.
- Habibi A, Wu SP, Gorovets D, et al. Early palliative care for patients with brain metastases decreases inpatient admissions and need for imaging studies. Am J Hospice Care 2018; 35: 1069-1075.
- Integraal Kankercentrum Nederland. Algemene principes van palliatieve zorg. www.pallialine.nl, 2018.
- Integraal Kankercentrum Nederland. Consultatieteams palliatieve zorg. https://www.iknl.nl/palliatieve-zorg/consultatie/consultatieteam, 2018-2.
- Kaal EC, Taphoorn MJ, Vecht CJ.. Symptomatic management and imaging of brain metastases. J Neurooncol. 2005; 75(1): 15-20.
- Kotecha R, Vogel S, Suh JH et al. A cure is possible: a study of 10-year survivors of brain metastases. J Neurooncol 2016: 129: 545–555.
- Lutterbach J, Bartelt S, Ostertag C. Long-term survival in patients with brain metastases. J Cancer Res Clin Oncol. 2002; 128(8): 417-25
- Lutterbach J, Bartelt S, Ostertag C. Long-term survival in patients with brain metastases. J Cancer Res Clin Oncol 2002; 128:417–425.
- May P, Garrido MM, Cassel JB, Kelley AS, Meier DE, Normand C, Smith TJ, Stefanis L, Morrison RS. Prospective Cohort Study of Hospital Palliative Care Teams for Inpatients With Advanced Cancer: Earlier Consultation Is Associated With Larger Cost-Saving Effect. J Clin Oncol 2015; 33(25): 2745-52.
- Nederlands Huisartsen Genootschap. NHG-standpunt Oncologische zorg in de huisartsenpraktijk, 2014.
- Koninklijke Nederlandsche Maatschappij tot Bevordering der Geneeskunde. Handreiking Tijdig spreken over het levenseinde. Utrecht: KNMG, 2012.
- Oneschuk D, Bruera E. Palliative management of brain metastases. Support Care Cancer 1998; 6: 365-372.
- Ostgathe C, Gaertner J, Kotterba, M, et al. Differential palliative care issues in patients with primary and secondary brain tumours. Supp Care Cancer 2010; 18(9): 1157-1163.
- Rullie E, Legramandi L, Salvati L, Mandala M. The impact of targeted therapies and immunotherapy in melanoma brain metastases: a systematic review and meta-analysis. Cancer 2019; 0: 1-14.
- Sloot S, Chen YA, Zhao X, et al. Improved survival of patients with melanoma brain metastases in the era of targeted BRAF and immune checkpoint therapy. Cancer 2018; 124: 297-305.
- Smedby KE, Brandt L, Backlund ML, Blomqvist P. Brain metastases admissions in Sweden between 1987 and 2006. Br J Cancer 2009; 101: 1919-1924.
- Stuurgroep Passende zorg in de laatste levensfase. Niet alles wat kan, hoeft. Utrecht, 2015.
- Taillibert S, Delattre JY. Palliative care in patients with brain metastases. Curr Opin Oncol 2005; 17: 588-592.
- Temel JS, Greer JA, Muzikansky A, Gallagher ER, Admane S, Jackson VA, Dahlin CM, Blinderman CD, Jacobsen J, Pirl WF, Billings JA, Lynch TJ. Early palliative care for patients with metastatic non-small-cell lung cancer.N Engl J Med 2010; 363: 733-42.
- Temel JS, Greer JA, Admane S, Gallagher ER, Admane S, Jackson VA, Lynch TJ, Lennis IT, Dahlin CM, Pirl WF. Longitudinal perceptions of prognosis and goals of therapy in patients with metastatic non-small-cell lung cancer: results of a randomized study of early palliative care. J Clin Oncol 2011; 29: 2319-2326.
- Zimmermann C, Swami N, Krzyzanowska M, et al. Early palliative care for patients with advanced cancer: a cluster-randomised controlled trial. Lancet. 2014;38 3(9930): 1721-30.
- Van Zuylen L, van Veluw H, van Esch J. Richtlijn Zorg in de stervensfase. www.pallialine.nl, 2010.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 02-09-2020
Beoordeeld op geldigheid : 01-06-2025
Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van een module komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Neurologie is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Palliatieve zorg |
NVN |
2020 |
2025 |
5 jaar |
LWNO |
- |
|
Behandeling met corticosteroïden |
NVN |
2020 |
2025 |
5 jaar |
LWNO |
- |
|
Behandeling met anti-epileptica |
NVN |
2020 |
2025 |
5 jaar |
LWNO |
- |
|
Behandeling van hoofdpijn |
NVN |
2020 |
2025 |
5 jaar |
LWNO |
- |
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financierder heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
De richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijk. De aanbevelingen zijn gebaseerd op een zo hoog mogelijke graad van wetenschappelijk bewijs en consensus binnen de werkgroepleden. De richtlijn biedt de gebruikers inzicht in het tot stand komen van de aanbevelingen. Uitgangspunt zijn de knelpunten die in de dagelijkse praktijk bij patiënten met hersenmetastasen worden gesignaleerd. De richtlijn kan worden gebruikt bij het geven van voorlichting aan patiënten en biedt aanknopingspunten voor lokale protocollen ter bevordering van de implementatie.
Doelgroep
Deze richtlijn is geschreven voor de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met hersenmetastasen. Hiertoe behoren:
Behandelaars: neurologen, neurochirurgen, radiotherapeuten, medisch oncologen, longartsen, (oncologie)verpleegkundigen, huisartsen, specialisten ouderengeneeskunde;
Ondersteunende specialisten: (neuro)radiologen en (neuro)pathologen
Gespecialiseerde psychosociale hulpverleners: maatschappelijk werkers, (neuro)psychologen, psychiaters. En anderen die bij de zorgverlening voor patienten met hersenmetastasen betrokken zijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is eind 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de zorg voor patienten met hersenmetastasen. De patienten zijn vertegenwoordigd via de Stichting Melanoom. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname en de werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- dr. J.M.M. (Anja) Gijtenbeek, neuroloog, Radboudumc, NVN, voorzitter
- dr. L.G.H. (Luc) Dewit, radiotherapeut-oncoloog, Antoni van Leeuwenhoek, NVRO
- Ir. K.J.A. (Koen) van Elst, patiëntvertegenwoordiger, voorzitter van Stichting Melanoom
- dr. R.H. (Roelien) Enting, neuroloog, UMC Groningen, NVN
- C.S. (Celine) Gathier MSc, neuroloog, Elisabeth-TweeSteden Ziekenhuis, NVN
- dr. A. (Alexander) de Graeff, internist-oncoloog en hospice-arts, UMC Utrecht en Hospice Demeter, NIV/NVMO
- J. (Joska) Heessels-Smetsers MSc, verpleegkundig specialist oncologie, Catharina Ziekenhuis, V&VN
- dr. L.E.L. (Lizza) Hendriks, longarts, Maastricht UMC+, NVALT
- J.J.M.G. (José) Jacobs-van Leur MSc, verpleegkundig specialist palliatieve zorg, gepensioneerd, V&VN
- dr. F.J. (Frank) Lagerwaard, radiotherapeut-oncoloog, Amsterdam UMC, locatie VU, NVRO
- dr. R.D.S. (Rishi) Nandoe Tewarie, neurochirurg, Haaglanden MC, NVvN
- prof. dr. M. (Marion) Smits, radioloog, Erasmus MC, NVvR
- dr. F.Y.F.L. (Filip) de Vos, internist-oncoloog, UMC Utrecht, NIV/NVMO
- dr. J.D. (Jaap) Zindler, radiotherapeut-oncoloog, Erasmus MC, NVRO
Met dank aan
- dr. J.V. van Thienen, internist-oncoloog, NIV/NVMO
Met ondersteuning van
- dr. J. Buddeke, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- dr. M. Pols, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- dr. L. Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Gijtenbeek |
Neuroloog Radboud UMC |
Voorzitter subcie Richtlijnen NVN (onbetaald) tot maart 2019 Voorzitter Landelijke werkgroep Neuro-oncologie (onbetaald) tot oktober 2019 Cielid adviescie Richtlijnen FMS, vergaderuren vergoed tot december 2018 |
Geen |
Geen |
|
Dewit |
Radiotherapeut-oncoloog Antoni van Leeuwenhoek ziekenhuis |
Geen |
Centrum behandelt ook met Gamma Knife |
Geen; er worden in de aanbevelingen geen merknamen van de apparatuur genoemd. |
|
Van Elst |
Voorzitter Stichting Melanoom (onbetaald) Vrijwilliger actief in de rol van voorzitter bij kankerpatienorganisatie (KPO) Stichting Consultant bij ASML N.V. Zowel deze organisatie zelf, als de branch waarin deze organisatie actief is, heeft als zodanig geen enkele connectie met de belangen en de praktijk van de omgeving waarin het te leveren advies op van toepassing is. |
In februari 2018 als 'Patient Advocate' (belangenbehartiger voor patiënten) een Patient Advisory Board van de firma Amgen in Zurich bijgewoond (betaald). |
Geen |
Geen |
|
Enting |
Neuroloog UMC Groningen |
Geen |
Geen |
Geen |
|
Gathier |
Neuroloog Elisabeth-TweeSteden Ziekenhuis |
Promovenda afdeling neurologie / intensive care UMC Utrecht (betaald) Bestuurslid Vereniging voor Arts Assistenten Neurologie (VAAN) tot december 2018 (onbetaald) Adviserend bestuurslid Nederlandse Vereniging van Neurologie (NVN) tot december 2018 (onbetaald) Docent bij de cursus 'Neurologic ALS’ van Expert College (betaald) |
Geen |
Geen |
|
de Graeff |
Internist-oncoloog UMC Utrecht |
Hospice-arts, Hospice Demeter, De Bilt |
Geen |
Geen |
|
Heessels-Smetsers |
verpleegkundig specialist oncologie Catharina ziekenhuis |
Lid verpleegkundig stafbestuur, adviseren/signaleren in verpleegkundige ontwikkelingen naar Raad van bestuur, 4 uur in loondienst Lid LWNO-V, deskundigheidsbevordering, kwaliteitszorg, netwerken op landelijk niveau (onbetaald) |
Geen |
Geen |
|
Hendriks |
Longarts Maastricht UMC+, |
PI van drie onderzoeken naar hersenmetastasen welke deels gesponsord worden door de farmaceutische industrie co-PI: studie die effect van PCI bij stadium III NSCLC bestudeert (Astrazeneca, studie in opstart) |
Adviesraad BMS (nivolumab), Boehringer Ingelheim (afatinib), vergoeding gaat naar instituut. Tijdens richtlijnontwikkeling zijn deze bijeenkomsten niet bijgewoond. Adviesraad Eli Lilly (ramucirumab), Roche (atezolizumab), geen betrekking op hersenmetastasen. Quadia : vergoeding webinars (niet specifiek gerelateerd aan hersenmetastasen) Mentorship programma met key opinion leaders, (Astrazeneca, niets met hersenmetastasen te maken)
|
De literatuurselectie voor de module ‘systemische therapie van hersenmetastasen van een longcarcinoom’ is door twee werkgroepleden uitgevoerd. Aanbevelingen voor deze module zijn tijdens de werkgroepvergadering door de gehele werkgroep geformuleerd. |
|
Jacobs-van Leur |
Verpleegkundig specialist palliatieve zorg (gepensioneerd) |
Bestuurslid VPTZ (vrijwilligers palliatieve terminale zorg) (onbetaald) |
Geen |
Geen |
|
Lagerwaard |
Radiotherapeut-oncoloog Amsterdam UMC, locatie VUmc |
Geen |
Geen |
Geen |
|
Nandoe Tewarie |
Neurochirurg Haaglanden MC |
Geen |
Geen |
Geen |
|
Smits |
Radioloog en professor Erasmus MC |
Secretaris van de sectie Neuroradiologie NVvR (onbetaald) Trial reviewer voor de EORTC-1410 trial (betaald, niet persoonlijk) Chair-elect van de Imaging Group EORTC (onbetaald) President-elect van de ESMRMB Honarary consultant University College London Hospital NHS Foundation Trust in London (betaald) |
Geen |
Geen |
|
de Vos |
Internist-oncoloog UMC Utrecht |
Lid Webredactieraad NVMO (onbetaald) Landelijke Werkgroep Neuro-oncologie (LWNO): bestuurslid Bestuurslid Dutch Brain Tumor Registry (onbetaald) Lid werkgroep kwalitetiscriteria LWNO, lid protocol comité zeldzame tumoren LWNO, werkgroeplid richtlijn gliomen (alle onbetaald) European Organization for Research and Treatment in Cancer (EORTC) - Brain Tumour Group - Member Quality Assurance EORTC BTG (onbetaald) |
Principal investigator van meerdere door de industrie gesponsorde studies. Echter, haast al deze studies hebben hersenmetastase als exclusiecriterium. Daarnaast zijn er geen studies die zich richten op patiënten met hersenmetastasen als doelgroep waaraan als principal of sub-investigator is meegewerkt. |
Geen |
|
Zindler |
Radiotherapeut-oncoloog Erasmus MC |
Principal investigator van een fase III multicenter studie waarbij totale schedelbestraling rechtstreeks vergeleken wordt met stereotactische radiochirurgie in patiënten met minimaal 4 en maximaal 10 hersenmetastasen. |
Onderzoek wordt gesponsord door Varian Medical Systems Varian heeft geen belang bij bepaalde uitkomst omdat beide behandelingen met dezelfde apparaten uitgevoerd worden |
Geen |
Inbreng patiëntenperspectief
Tijdens alle stappen van het ontwikkelproces is rekening gehouden met het patiëntperspectief. De voorzitter van Stichting Melanoom had zitting in de werkgroep. Tevens is de conceptrichtlijn voor commentaar aan Stichting Melanoom en Patientenfederatie Nederland voorgelegd. Bij de knelpunteninventarisatievergadering (invitational conference) was tevens een afgevaardigde namens hersenletsel.nl aanwezig.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de aanverwante producten bij elke module.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de ervaren knelpunten rondom de zorg van patienten met hersenmetastasen onder relevante partijen. Middels een knelpunteninventarisatievergadering is er input gevraagd op het conceptraamwerk aan de Nederlandse Vereniging voor Neurologie, Nederlandse Internisten Vereniging, Nederlandse Associatie Physician Assistants, Nederlands Huisartsen Genootschap, Verpleegkundige en Verzorgende Nederland, Integraal Kanker Centrum Nederland, Nederlandse Vereniging voor Neurochirurgie, Stichting Melanoom, Patientenfederatie Nederland, Nederlands Instituut Psychologen, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose, Nederlandse Vereniging voor Radiologie, Verenso, Hersenletsel.nl, Inspectie voor de Gezondheidszorg en Jeugd, Nederlandse Federatie van Universitair Medische Centra, Nederlandse Vereniging van Ziekenhuizen, Samenwerkende Topklinische opleidingsZiekenhuizen, Zorginstituut Nederland, Zelfstandige Klinieken Nederland, Zorgverzekeraars Nederland, en de Nederlandse Zorgautoriteit. Een beknopte samenvatting van de schriftelijke knelpuntenanalyse is opgenomen in de aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de vorige versie van de richtlijn en de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur conceptuitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal, belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de uitgangsvragen waarvoor een systematische literatuuranalyse was gepland, werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: Cochrane - voor gerandomiseerd gecontroleerd onderzoek en PROBAST - voor prognostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast de kwaliteit van het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Alle aanbevelingen zijn met de werkgroep vastgesteld.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is weergegeven in de aanverwante producten van deze richtlijn.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
