Beslissing tot behandeling met radiotherapie bij hersenmetastasen
Uitgangsvraag
Bij welke patiënten dient de behandeling beperkt te blijven tot best supportive care en dient afgezien te worden van radiotherapie (whole brain radiotherapie (WBRT) of stereotactische radiochirurgie (SRS))?
Aanbeveling
Wees terughoudend met bestraling in welke vorm dan ook bij patiënten met een KPS <70.
Heroverweeg de behandeling met bestraling indien de conditie van de patiënt verbetert.
Overweeg het gebruik van gevalideerde prognostische classificatiesystemen of nomogrammen indien er twijfel bestaat of SRS toegepast kan worden ondanks een matige conditie van patiënt.
Overwegingen
Prognostische classificatiesystemen
Er zijn geen valide predictieve modellen die een betrouwbare voorspelling mogelijk maken van het effect van behandeling van hersenmetastasen op de kwaliteit van leven. Bij de keuze van behandeling wordt daarom meestal uitgegaan van de prognose ten aanzien van de overleving. Om de prognose betrouwbaar te kunnen voorspellen zijn meerdere classificatiesystemen en nomogrammen ontwikkeld, echter allen met hun beperkingen. De recente ontwikkelingen op het gebied van de systemische therapie (targeted therapie, immuuntherapie) leiden tot langere overleving en noodzaken tot aanpassing van de prognostische modellen, met incorporeren van relevante moleculaire markers en biomarkers per tumorsoort. De uitbreiding van de systemische behandelopties beïnvloedt ook de indicatiestelling voor lokale behandeling van hersenmetastasen met chirurgie of (stereotactische) radiotherapie. Prognostische modellen zijn veelal gebaseerd op patiënten cohorten die behandeld zijn met systemische therapie die niet meer up-to-date is. Het vaststellen van de prognose voor een individuele patiënt blijft daardoor een uitdaging. In alle modellen heeft de KPS (of een andere performance score) een belangrijke plaats.
Recursive partitioning analysis (RPA)
De van oudsher meest gebruikte prognostische index is de recursive partitioning analysis (RPA) classificatie van de Radiation Therapy Oncology Group (RTOG). Deze classificatie is gebaseerd op 4 parameters: leeftijd, Karnofsky Performance Status (KPS), aan- of afwezigheid van extracraniële metastasen en de status van de primaire tumor (Tabel 1) en is gebaseerd op de data van RCT’s betreffende effectiviteit van WBRT. De RPA-classificatie houdt geen rekening met de primaire tumor. Op basis van deze data werd 20% van de patiënten ingedeeld in klasse 1, 65% in klasse 2 en 15% in klasse 3 (Gaspar, 1997; Gaspar, 2000, Nieder, 2000). Deze RPA classificatie is later wel gevalideerd voor patiënten behandeld met chirurgie (ondere andere Nieder, 2011) of SRS (onder andere Likhacheva 2012).
Tabel 1 RPA-classificatie
|
Klasse 1 |
Mediane overleving |
1-jaars overleving |
|
KPS ≥ 70, leeftijd < 65 jaar Geen extracraniële metastasen Primaire tumor onder controle |
7,1 maanden |
30% |
|
Klasse 2 |
|
|
|
Alle andere patiënten met KPS (Karnofsky Performance Status) ≥70 |
4,2 maanden |
15% |
|
Klasse 3 |
|
|
|
Alle patiënten met KPS < 70 |
2,3 maanden |
5% |
Omdat er geen studies met een onbehandelde controle-arm verricht zijn, is de waarde van de RPA-classificatie als predictieve factor (dat wil zeggen voorspellend voor het effect van behandeling) niet bekend.
Graded Prognostic Assessment (GPA/DS-GPA)
Een recentere score van de RTOG is de Graded Prognostic Assessment (GPA, Tabel 2), met vier in plaats van drie prognostische klassen (Nieder, 2008 2x; Nieder, 2009; Sperduto, 2008). In de GPA worden punten toegekend aan leeftijd, KPS, het aantal hersenmetastasen en de aanwezigheid van extracraniële metastasen. De status van de primaire tumor wordt niet meegenomen.
Tabel 2 Graded prognostic assessment (GPA)
|
|
Score |
||
|
0 |
0.5 |
1.0 |
|
|
Age |
> 60 |
50 to 59 |
< 50 |
|
KPS |
< 70 |
70 to 80 |
90 to 100 |
|
No. of CNS metastases |
> 3 |
2 to 3 |
1 |
|
Extracranial metastases |
Present |
- |
None |
Op basis van de GPA-score worden de patiënten in vier prognostische groepen verdeeld (Tabel 2). In het onderzoek van Sperduto was de verdeling als volgt: GPA score 0-1: 10%; GPA score 1,5-2,5: 16%; GPA score 3 61%; GPA score 3,5-4: 13%.
Ook met deze index bleef de vraag bestaan hoeveel en welke parameters een ideale index zou moeten bevatten en of het wel zinvol is verschillende tumortypen te analyseren met eenzelfde index (Nieder, 2009). Daarom is in aanvulling op de GPA de disease-specific (DS)-GPA ontwikkeld, op basis van retrospectieve data van patiënten die met WBRT behandeld zijn, al dan niet gecombineerd met SRS of chirurgie (Sperduto, 2010). In deze DS-GPA werd de oorspronkelijke GPA bevestigd voor SCLC en NSCLC, bleek voor melanoom en niercelcarcinoom alleen de KPS en aantal hersenmetastasen prognostisch significant, voor het mammacarcinoom alleen leeftijd, KPS en tumor subtype en voor gastro-intestinale tumoren alleen de KPS. Zie figuur 1 (Sperduto, 2012).
Figuur 1 DS-GPA-score en mediane overleving
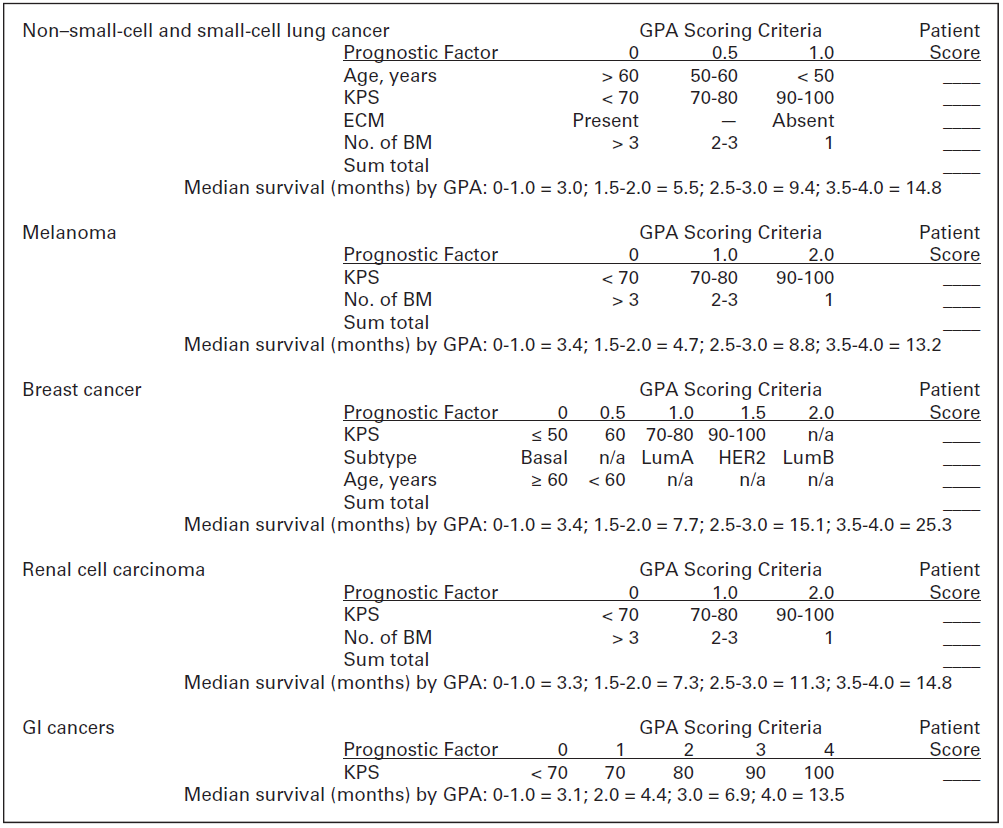
Overgenomen uit Sperduto (2012)
Recent zijn de DS-GPA’s geüpdatet en zijn moleculaire markers en biomarkers toegevoegd. Voor adenocarcinoom van de long bleken EGFR en ALK translocatie, naast de oorspronkelijke factoren (leeftijd, KPS, aantal hersenmetastasen, extracraniële metastasen) relevant. De mediane overleving na behandeling van de hersenmetastasen was gestegen van 7 maanden in het oude cohort behandeld tussen 1985 en 2005 (Sperduto, 2010), naar 12 maanden in het nieuwe cohort (2006 tot 2014). Patiënten met een Lung-molGPA score van 3,4 tot 4,0 hadden een mediane overleving van bijna 4 jaar (Sperduto, 2017). Vergeleken met een viertal andere prognostische modellen, waaronder de RPA en DS-GPA, voorspelde de Lung-molGPA de overleving het meest accuraat, terwijl de andere modellen een te korte overleving voorspelden (Rice, 2018).
In de Melanoma-molGPA is de BRAF status opgenomen, naast leeftijd, KPS, extracraniële metastasen en aantal hersenmetastasen, terwijl in de oorspronkelijke DS-GPA voor melanomen alleen KPS en aantal hersenmetastasen significant bleken. De mediane overleving was gestegen van 6,7 naar 9,8 maanden in de 2 verschillende perioden, met een overleving van 34,1 maanden in de hoogste Melanoma-molGPA groep (Sperduto,, 2017).
Voor de Renal GPA bleek bij de update uit 2018, naast de KPS en aantal hersenmetastasen uit de oorspronkelijke GPA, ook de extrarenale metastasen en het hemoglobine prognostisch significante factoren. De mediane overleving was 12 maanden, met een overleving van 35 maanden in de groep met de hoogste GPA score (Sperduto, 2017).
In een recente update van de DS-GPA voor gastro-intestinale tumoren werden naast de KPS, ook de drie andere factoren (leeftijd, aantal hersenmetastasen, extracraniële metastasen) significant bevonden. De mediane overleving was slechts 8 maanden, met 30% van de patiënten in de slechts prognostische groep. (Sperduto, 2019). De DS-GPA voor mammacarcinoom is sinds 2012 niet geüpdatet.
Op www.brainmetgpa.com zijn de individuele DS-GPA scores en daarbij horende geschatte overleving van patiënten met bovengenoemde hersenmetastasen eenvoudig te bepalen.
Naast de RPA, GPA en DS-GPA zijn vele andere prognostische modellen gepubliceerd, vooral gericht op het proberen te voorspellen van de prognose voor een individuele patiënt, met mediane overleving of ziektecontrole als eindpunt, en bedoeld als ondersteuning in behandelbeslissingen. Veelal worden hiervoor nomogrammen gebruikt. In de dagelijkse praktijk wordt de DS-GPA veelal gebruikt voor inschatting van de prognose per tumorsoort, en ter informatie aan patiënten. Continue monitoring van de prognostische modellen blijkt noodzakelijk vanwege de voortgaande geïndividualiseerde behandelingen, zowel van de primaire tumor als van de hersenmetastasen. Prognostische modellen die gebaseerd zijn op heterogene patiëntengroepen en op oudere databases zijn niet langer voor de klinische praktijk relevant.
In een review van recent gepubliceerde nomogrammen, vergeleken met RPA en DS-GPA, kwamen de nomogrammen voor voorspellen van overleving van mammacarcinoom van Ahn (2012) en van NSCLC van (Zindler, 2017) als beste naar voren, evenals een nomogram voor het voorspellen van recidief hersenmetastasen na radiochirurgie (Ayala-Piecock, 2017; Nieder, 2018). Voor het mammacarcinoom waren leeftijd, KPS, extracraniële ziekte controle, HER2 status, triple negativiteit en trastuzumab significante prognostische factoren (Ahn, 2012).
Vooral voor behandelbeslissingen voor patiënten die een slechte prognose hebben is een betrouwbaar prognostisch model van veel belang. Hiermee kan een voor patiënt zinloze behandeling worden voorkomen. Voor het voorspellen van vroeg overlijden (< 3 maanden) bij patiënten met hersenmetastasen van NSCLC bleken de leeftijd, geslacht, WHO performance status, aanwezigheid van extracraniële metastasen en grootste diameter van de hersenmetastase prognostisch significant. Het voorgesteld nomogram gaf een betere predictie van korte overleving dan de ongunstige groepen in onder andere de RPA en dsGPA en werd gevalideerd in externe cohorten (Zindler, 2017; Nieder, 2018). De nomogrammen zijn beschikbaar in de literatuurverwijzingen. Omdat in alle modellen de KPS een significante factor is, lijkt het aangewezen de KPS als uitgangspunt te nemen voor de beslissing om al dan niet met bestraling te behandelen. Gelet op de beperkte mediane overleving van patiënten met een KPS < 70 (overeenkomend met RPA klasse 3), het ontbreken van een aangetoonde overlevingswinst (geëxtrapoleerd naar andere primaire tumoren) en bijwerkingen zoals haaruitval of misselijkheid wordt geadviseerd geen WBRT te geven bij deze groep patiënten.
Er bestaat geen gerandomiseerd vergelijk tussen SRS en best supportive care voor patiënten met hersenmetastasen. Hoewel in de meeste publicaties over SRS voor (multipele) hersenmetastasen slechts een gering aantal patiënten met een KPS <70 (RPA 3) is geïncludeerd, lijkt de overleving vergelijkbaar laag als na WBRT. In een van de grootste gerapporteerde studies van Serizawa met 2445 patiënten behandeld met SRS waren 316 patiënten in RPA klasse 3 opgenomen met een mediane overleving van slechts 3,6 maanden (Serizawa, 2012). Vergelijkbare mediane overlevingsgetallen worden gevonden in kleinere series met SRS voor (multipele) hersenmetastasen (Likhacheva, 2012; Weltman, 2000). De genoemde bevindingen leiden tot het advies om ook terughoudend te zijn met SRS voor patiënten met KPS <70.
Bij twijfel of SRS toch geïndiceerd kan zijn bij een individuele patiënt, staan meer specifieke scoringssystemen ter beschikking. De Score Index for Radiosurgery in brain metastases (SIR) is een specifiek voor radiochirurgie ontwikkelde classificatie en includeert naast de gebruikelijke factoren leeftijd, KPS en status van de extracraniële ziekte ook het aantal hersenmetastasen en het volume van de grootste hersenmetastase (Weltman, 2000). De aard van de primaire tumor wordt niet meegenomen. Scores variëren van 0 (slechtste conditie) tot 10 punten (beste conditie). De mediane overleving van patiënten met een SIR 0-3 was 3,2 maanden, SIR 4-7 mediaan 8,6 maanden en de beste groep met een SIR 8-10 21,3 maanden (Serizawa 2012). Het eerder genoemde nomogram ter bepaling van de kans op vroeg (binnen 3 maanden) overlijden en lange-termijn (langer dan 12 maanden) kan een verdere inschatting van de prognose van individuele patiënten geven.
Figuur 2
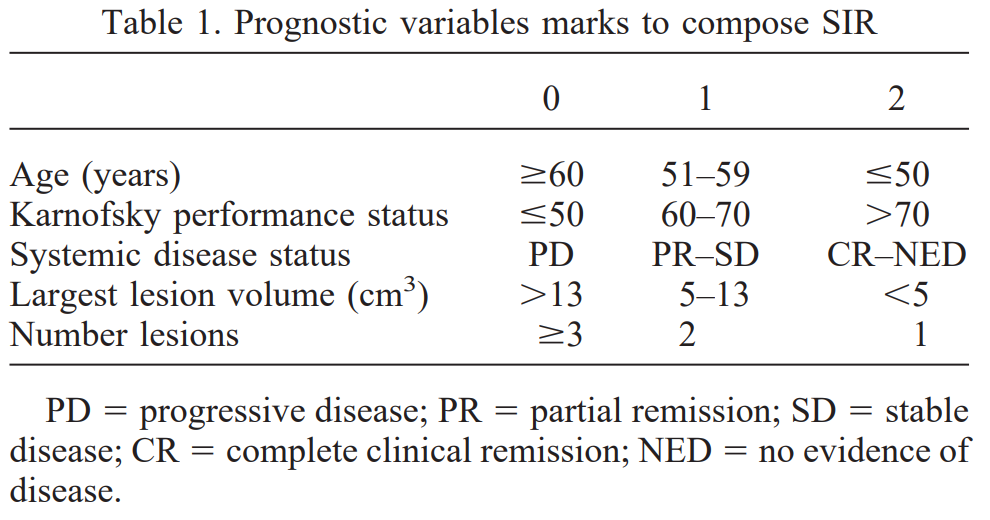
Overgenomen uit Weltman (2000)
Onderbouwing
Achtergrond
De keuze om al dan niet te behandelen met radiotherapie wordt onder andere bepaald door voor de tumorsoort specifieke prognostische factoren, de te verwachten effecten en bijwerkingen van de behandeling en de wens van de patiënt. De uitgangsvraag betreft het definiëren van de groep patiënten waarbij radiotherapie als eerste of enige behandeling (WBRT of SRS) op basis van bovengenoemde uitkomstmaten niet zinvol geacht wordt. De tekst uit de vorige richtlijn Hersenmetastasen ‘Beslissing tot behandeling’ is als basis genomen, aangepast en aangevuld. In recente jaren zijn in de literatuur een veelvoud aan classificatiesystemen en nomogrammen beschreven voor het beter vaststellen van de (geïndividualiseerde) prognose van patiënten met hersenmetastasen behandeld met WBRT en/of SRS zoals de GPA, DS-GPA en SIR. Deze worden kort beschreven in de overwegingen.
Conclusies / Summary of Findings
QALY en KPS
|
Laag GRADE |
Er zijn aanwijzingen dat er bij hersenmetastasen van niet-kleincellig longcarcinoom geen verschil is in QALYs en Karnofsky Performance Status tussen behandeling met whole brain radiotherapy + best supportive care en uitsluitend best supportive care.
Bronnen: (Mulvenna, 2016) |
Totale overleving
|
Redelijk GRADE |
Er zijn aanwijzingen dat er bij hersenmetastasen van niet-kleincellig longcarcinoom geen verschil is in overleving tussen behandeling met whole brain radiotherapy + best supportive care en uitsluitend best supportive care.
Bronnen: (Mulvenna, 2016) |
Samenvatting literatuur
In een gerandomiseerde, non-inferiority fase III studie van Mulvenna (2016) werden 538 patiënten met niet-kleincellig longcarcinoom en hersenmetastasen gerandomiseerd tussen twee behandelarmen. Ook patiënten met een KPS <70 konden worden geïncludeerd (40% van de totale studiepopualtie). Patiënten in behandelarm 1 (n=269) ontvingen best supportive care (BSC) en WBRT, die in behandelarm 2 (n=269) uitsluitend BSC. BSC bestond uit dexamethason, ondersteuning door een verpleegkundig specialist en onmiddellijke toegang tot gespecialiseerde artsen en palliatieve zorg teams. WBRT werd gegeven tot 20 Gy, in 5 fracties, bij voorkeur binnen vijf tot acht dagen. Serious adverse events werden klinisch of telefonisch beoordeeld en ingedeeld volgens de Common Terminology Criteria for Adverse Events version 3.0.
Resultaten
QALY - cruciale uitkomstmaat
Het gemiddeld aantal QALYs (sd) voor patiënten in de BSC + WBRT was 46,2 dagen (3,7) en voor patiënten in de BSC-groep 41,7 dagen (3,2), hetgeen niet significant van elkaar verschilde (verschil 4,7 dagen, 98% betrouwbaarheidsinterval (BI): -12,7 tot 3,3).
KPS – cruciale uitkomstmaat
De gemiddelde daling (SD) in KPS ten opzichte van baseline in week 4, 8 en 12 was 8,3 (13,9), 11,3 (13,0) en 18,0 (15,5), respectievelijk voor patiënten in de BSC + WBRT-groep en 8,5 (14,5), 13,4 (15,9) en 13,4 (13,7) voor patiënten in de BSC-groep. Op alle tijdsmomenten was er geen significant verschil (p=0,9272, p=0,2823 en p=0,0724, respectievelijk in week 4, 8 en 12).
Totale overleving - cruciale uitkomstmaat
Op het moment van analyseren (nog één patiënt van de 538 patiënten in leven in de studie, één patiënt lost-to-follow-up) was er geen verschil in totale overleving tussen de twee behandelarmen. De mediane totale overleving bedroeg 9,2 weken (95% BI: 7,2 tot 11,1) voor de WBRT + BSC-groep en 8,5 weken (95% BI: 7,1 tot 9,9) voor de BSC-groep (hazard ratio: 1,06, 95% BI: 0,90 tot 1,26).
Toxiciteit (serious adverse events)-cruciale uitkomstmaat
89 patiënten in de WBRT + BSC-groep (33%) en 82 patiënten in de BSC-groep (30%) kregen tenminste één serious adverse event, hetgeen niet significant van elkaar verschilde (p=0,579). Er werd wel een significant hogere frequentie van slaperigheid, haaruitval, misselijkheid en huidirritatie van de schedel gerapporteerd in de WBRT + BSC arm.
Overige uitkomstmaten
De uitkomstmaten tijd tot toename van neurologische klachten, neurocognitieve achteruitgang, progressie-vrije overleving, intracraniële respons zijn niet onderzocht.
Bewijskracht van de literatuur
Quality adjusted life years (QALY), (verandering in) Karnofsky Performance Scale (KPS)
totale overleving, toxiciteit - cruciale uitkomstmaten
De uitgangspositie van de bewijskracht bij een RCT is ‘hoog’, de bewijskracht voor alle cruciale uitkomstmaten komt uit op ‘laag’. De bewijskracht voor de uitkomstmaten is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (geen blindering, zie risk of bias tabel) en met één niveau verlaagd gezien het doorkruisen van de grens voor klinische relevantie (imprecisie).
Zoeken en selecteren
De NICE richtlijn ‘Brain tumours (primary) and brain metastases in adults’ is als uitgangspunt genomen. In deze richtlijn is een systematische search uitgevoerd tot september 2017.
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 19 juni 2018 met relevante zoektermen gezocht naar relevante artikelen gepubliceerd na september 2017. Er is gezocht naar studies die radiotherapie (WBRT of SRS) vergelijken met best supportive care. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 90 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: RCT’s, patiëntenpopulatie betreft patiënten met hersenmetastasen, interventie is WBRT of SRS, vergelijking is best supportive care.
Op basis van titel en abstract werden in eerste instantie drie studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden deze studies niet relevant geacht (zie exclusietabel). In de NICE richtlijn werd één relevante studie beschreven (Mulvenna, 2016). Deze is opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Relevante uitkomstmaten
De werkgroep achtte kwaliteit van leven, quality adjusted life years (QALY), tijd tot toename van neurologische klachten, neurocognitieve achteruitgang, Karnofsky Performance Status (KPS), totale overleving en toxiciteit voor de besluitvorming cruciale uitkomstmaten; en progressie-vrije overleving en intracraniële respons voor de besluitvorming belangrijke uitkomstmaten.
Kwaliteit van leven diende te zijn vastgesteld aan de hand van gevalideerde vragenlijsten. Toxiciteit werd gedefinieerd als tenminste graad 3, melding als ‘serious adverse event’ of reden voor het stopzetten van de behandeling. Neurologische/neurocognitieve klachten dienden te zijn vastgesteld aan de hand van gevalideerde vragenlijsten of deze klachten dienden specifiek door de patiënt te zijn gerapporteerd.
Een klinisch relevant verschil werd bij de uitkomstmaat QALY gedefinieerd als tenminste 30 dagen verschil tussen beide groepen. Een klinisch relevant verschil in KPS werd gedefinieerd als ten minste 20 punten verschil. Voor totale overleving en progressievrije-overleving werd een klinisch relevant verschil vastgesteld op 30 dagen of een hazard ratio van 0,7 of lager. Voor adverse events en toxiciteit lag de grens voor klinische relevantie op > 5% voor dodelijke adverse events en > 25% voor ernstige adverse events.
Voor de overige uitkomstmaten definieerde de werkgroep niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Referenties
- Ahn HK, Lee S, Park YH, Sohn JH. Prediction of outcomes for patients with brain parenchymal metastases form breast cancer (BC): a new BC-specifiec prognostic model and nomogram. Neuro-Oncol 2012;14: 1105-1113.
- Ayala-Peacoc DN, Attia A, Braunstein SE, Ahluwalia MS. Prediction of new brain metastases after radiosurgery; validation and analysis of performance of a multi-instutional nomogram. J. Neurooncol 2017: 135; 403-411.
- Ji S, Zhuang Y, Yin X,ZhQ et al. Survival time following resection of intracranial metastases form NSCLC-development and validation of a novel nomogram. BMC Cancer 2017: 17: 774.
- Lagerwaard FJ, Levendag PC, Nowak PJ, Eijkenboom WM, Hanssens PE, Schmitz PI. Identification of prognostic factors in brain metastases: a review of 1292 patients. Int J Radiat Oncol Biol Phys. 1999; 43:795-803.
- Lorenzi J, Devriendt D, Massager N, David Ph, et al. Radiosurgery for treatment of brain metastases; estimation of patient eligibility using three stratification systems. Int J Radiation Oncology Biol. Phys. 2004; 60: 218-224.
- Likhacheva A, Pinnix CC, Parikh N, Allen PK, Guha-Thakurta N, McAleer M, Sulman EP, Mahajan A, Shiu A, Luo D, Chiu M, Brown PD, Prabhu SS, Chang EL. Validation of Recursive Partitioning Analysis and Diagnosis-Specific Graded Prognostic Assessment in patients treated initially with radiosurgery alone. J Neurosurg. 2012 Dec;117 Suppl:38-44. doi: 10.3171/2012.3.GKS1289
- Mulvenna P, Nankivell M, Barton R, Faivre-Finn C, Wilson P, McColl E, Moore B, Brisbane I, Ardron D, Holt T, Morgan S, Lee C, Waite K, Bayman N, Pugh C, Sydes B, Stephens R, Parmar MK, Langley RE. Dexamethasone and supportive care with or without whole brain radiotherapy in treating patients with non-small cell lung cancer with brain metastases unsuitable for resection or stereotactic radiotherapy (QUARTZ): results from a phase 3, non-inferiority, randomised trial. Lancet. 2016 Oct 22;388(10055):2004-2014. doi: 10.1016/S0140-6736(16)30825-X. Epub 2016 Sep 4. PubMed PMID: 27604504; PubMed Central PMCID: PMC5082599.
- Nieder C, Astner ST, Andratschke NH, Marienhagen K. Postoperative treatment and prognosis of patients with resected single brain metastasis: how useful are established prognostic scores? Clin Neurol Neurosurg. 2011 Feb;113(2):98-103.
- Nieder C, Metha MP, Geinitz H, Grosu AL. Prognostic and predictive factors in patients with brain metastases from solid tumors; a review of published nomograms. Crit Rev Oncol/Hematology 2018: 126;13-18.
- Rice SR, Bentzen S, Hanna A, choi E. Prognostic models for patients with brain metastases after stereotactic radiosurgery with o.r without whole brain radiotherapy: a validation study. J Neuro-onc 2018; 140:341-349.
- Serizawa T, Higuchi Y, Nagano O, Hirai T, Ono J, Saeki N, Miyakawa A. Testing different brain metastasis grading systems in stereotactic radiosurgery: Radiation Therapy Oncology Group's RPA, SIR, BSBM, GPA, and modified RPA. J Neurosurg. 2012 Dec;117 Suppl:31-7.
- Sperduto PW, Kased N, Roberge D, Xu Z, et al. Summary report on the graded prognostic assessment; an accurate and facile diagnosis-specific tool to estimate survival for patients with brain metastasis. J Clin Oncol 2012 30:419-425.
- Sperduto PW, Jang TJ, Beal K, Pan H, et al. Estimating survival in patients with lung cancer and brain metastases: an update of the graded prognostic assessment of lung cancer using molecular markers. JAMA oncol 2017; 3:827-831.
- Sperduto PW, Jian W, Brown PD, Braunstein S. Estimating survival in melanoma patients with brain metastases; an update of the graded prognostic assessment for melanoma using molecular markers (Melanoma-molGPA). Int J Radiation Oncol Biol Phys 2017;4:812-816.
- Sperduto PW, Deegan BJ, Li J, Jethwa KR, et al. Estimating survival for renal cell carcinoma patients with brain metastases; an update of the renal graded prognostic assessment tool. Neuro-Oncology 2018: 20:1652-1660.
- Sperduto PW, Fang P, Li J, Breen W et al. Estimating survival in patients with gastrointestinal cancers and brain metastases: an update of graded prognostic assessment for gastrointestinal cancers (GI-GPA) Clin Transl Rad Oncol 2019: 18: 39-45.
- Weltman E, Salvajoli JV, Brandt RA, de Morais Hanriot R, et al. Radiosurgery for brain metastases: a score index for predicting prognosis. Int. J Radiation Onc Biol Phys 2000;46;1155-61.
- Zindler, J. D., Jochems, A., Lagerwaard, F. J., Beumer, R., Troost, E. G., Eekers, D. B., ... & Hurkmans, C. W. (2017). Individualized early death and long-term survival prediction after stereotactic radiosurgery for brain metastases of non-small cell lung cancer: Two externally validated nomograms. Radiotherapy and Oncology, 123(2), 189-194.
- Zindler, J. D., Rodrigues, G., Haasbeek, C. J., De Haan, P. F., Meijer, O. W., Slotman, B. J., & Lagerwaard, F. J. (2013). The clinical utility of prognostic scoring systems in patients with brain metastases treated with radiosurgery. Radiotherapy and Oncology, 106(3), 370-374.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Mulvenna, 2016 |
Type of study: RCT
Setting: Hospital
Country: Australia
Source of funding: Cancer Research UK, Medical Research Council Clinical Trials Unit at University College London, and the National Health and Medical Research Council in Australia. |
Inclusion criteria: Patients with histologically proven NSCLC and brain metastases (confirmed by CT or MRI), unsuitable for either surgery or stereotactic radiotherapy and uncertainty in the clinicians’ or patients’ minds about the potential benefit of WBRT
Exclusion criteria: previous radio therapy to the brain, or previous or current illness thought likely to interfere with protocol treatment.
N total at baseline: Intervention: 269 Control: 269
Important prognostic factors2:
Age Median, (IQR): I:66 (60-72) C: 67 (62-72)
Sex: I: 157 (58%) M C: 157 (58%) M
Groups comparable at baseline? Yes, Karnofsky Performance status, progressive brain metastases, NSCLC histology, extracranial metastases is equally divided |
WBRT + Optimal Supportive Care (OSP), including dexamethasone
Most patients had their dexamethasone dose decreased compared with the initial dose given at randomisation: during the fi rst 4 weeks 142 (61%) of 233 patients receiving OSC and 143 (58%) of 245 patients receiving WBRT plus OSC had their dose reduced (p=0·5771); during the fi rst 8 weeks 153 (66%) of 233 patients receiving OSC and 167 (68%) of 245 patients receiving WBRT plus OSC had their dose reduced (p-=0·6268). |
Optimal Supportive Care (OSP), including dexamethasone
|
Length of follow-up: Around 56 weeks
Loss-to-follow-up: 1 patient in the intervention group
Incomplete outcome data: 30 did not receive WBRT Of the 30 patients assigned to, but who did not receive WBRT, ten died before starting radiotherapy, 14 were considered too ill or their disease had progressed, fi ve refused treatment (one of these patients did later receive WBRT 6 months after randomisation), and one could not be contacted (loss to follow-up)
|
Quality of life, measured with the EQ-5D
The number of patients with maintained or improved quality of life compared with baseline was also similar between the groups at 4 weeks (81 (54%) of 149 patients receiving OSC plus WBRT versus 80 (57%) of 140 patients receiving OSC), 8 weeks (40 (44%) of 90 patients receiving OSC plus WBRT versus 40 (51%) of 78 patients receiving OSC), and 12 weeks (24 (44%) of 54 patients receiving OSC plus WBRT versus 21 (49%) of 43 patients receiving OSC).
Survival Overall Intervention versus Comparison HR 1.06, 95% CI 0.90–1.26, p=0.8084
Subgroups, significant or borderline significant associations
Aged <60 HR 1.48 (95% CI 1.01–2.16).
Aged, >70 HR 0.75, 95% CI 0.56-1.00)
KPS >70 HR 1.21, 95% CI: 0.97-1.50
≥5 brain metastases 1.37 (1.01–1.86)
Neurocognitive function Not reported
|
“Patients and investigators were not blinded to their treatment allocation because to do so would have required giving them sham WBRT, which we did not believe was justifi able on clinical or ethical grounds. In addition, travel to receive sham treatments could have influenced the patient’s quality of life, producing a biased assessment of quality of life and QALYs in those patients.” |
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Mulvenna, 2016 |
minimisation programme with a random element and stratification by centre, KPS, gender, status of brain metastases (newly diagnosed or progressive disease), and status of primary lung cancer (absent, controlled, or uncontrolled). |
Likely. Patients and investigators were not blinded to treatment allocation. |
Likely. Patients, investigators and care providers were not blinded to treatment allocation. |
Likely. Patients, investigators and care providers were not blinded to treatment allocation. |
Likely. Patients, investigators and care providers were not blinded to treatment allocation. |
Unlikely |
Unlikely (one patients lost to follow-up) |
Unlikely |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
DiRisio, 2017 |
Conference abstract |
|
Tsao, 2018 |
Systematische review; één artikel dat voldoet aan PICO, deze is reeds beschreven in de literatuursamenvatting |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 02-09-2020
Beoordeeld op geldigheid : 01-06-2025
Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van een module komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Neurologie is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Beslissing tot behandeling |
NVN |
2019 |
2024 |
Eens in vijf jaar |
NVN |
|
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financierder heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
De richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijk. De aanbevelingen zijn gebaseerd op een zo hoog mogelijke graad van wetenschappelijk bewijs en consensus binnen de werkgroepleden. De richtlijn biedt de gebruikers inzicht in het tot stand komen van de aanbevelingen. Uitgangspunt zijn de knelpunten die in de dagelijkse praktijk bij patiënten met hersenmetastasen worden gesignaleerd. De richtlijn kan worden gebruikt bij het geven van voorlichting aan patiënten en biedt aanknopingspunten voor lokale protocollen ter bevordering van de implementatie.
Doelgroep
Deze richtlijn is geschreven voor de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met hersenmetastasen. Hiertoe behoren:
Behandelaars: neurologen, neurochirurgen, radiotherapeuten, medisch oncologen, longartsen, (oncologie)verpleegkundigen, huisartsen, specialisten ouderengeneeskunde;
Ondersteunende specialisten: (neuro)radiologen en (neuro)pathologen
Gespecialiseerde psychosociale hulpverleners: maatschappelijk werkers, (neuro)psychologen, psychiaters. En anderen die bij de zorgverlening voor patienten met hersenmetastasen betrokken zijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is eind 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de zorg voor patienten met hersenmetastasen. De patienten zijn vertegenwoordigd via de Stichting Melanoom. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname en de werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- dr. J.M.M. (Anja) Gijtenbeek, neuroloog, Radboudumc, NVN, voorzitter
- dr. L.G.H. (Luc) Dewit, radiotherapeut-oncoloog, Antoni van Leeuwenhoek, NVRO
- Ir. K.J.A. (Koen) van Elst, patiëntvertegenwoordiger, voorzitter van Stichting Melanoom
- dr. R.H. (Roelien) Enting, neuroloog, UMC Groningen, NVN
- C.S. (Celine) Gathier MSc, neuroloog, Elisabeth-TweeSteden Ziekenhuis, NVN
- dr. A. (Alexander) de Graeff, internist-oncoloog en hospice-arts, UMC Utrecht en Hospice Demeter, NIV/NVMO
- J. (Joska) Heessels-Smetsers MSc, verpleegkundig specialist oncologie, Catharina Ziekenhuis, V&VN
- dr. L.E.L. (Lizza) Hendriks, longarts, Maastricht UMC+, NVALT
- J.J.M.G. (José) Jacobs-van Leur MSc, verpleegkundig specialist palliatieve zorg, gepensioneerd, V&VN
- dr. F.J. (Frank) Lagerwaard, radiotherapeut-oncoloog, Amsterdam UMC, locatie VU, NVRO
- dr. R.D.S. (Rishi) Nandoe Tewarie, neurochirurg, Haaglanden MC, NVvN
- prof. dr. M. (Marion) Smits, radioloog, Erasmus MC, NVvR
- dr. F.Y.F.L. (Filip) de Vos, internist-oncoloog, UMC Utrecht, NIV/NVMO
- dr. J.D. (Jaap) Zindler, radiotherapeut-oncoloog, Erasmus MC, NVRO
Met dank aan
- dr. J.V. van Thienen, internist-oncoloog, NIV/NVMO
Met ondersteuning van
- dr. J. Buddeke, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- dr. M. Pols, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- dr. L. Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Gijtenbeek |
Neuroloog Radboud UMC |
Voorzitter subcie Richtlijnen NVN (onbetaald) tot maart 2019 Voorzitter Landelijke werkgroep Neuro-oncologie (onbetaald) tot oktober 2019 Cielid adviescie Richtlijnen FMS, vergaderuren vergoed tot december 2018 |
Geen |
Geen |
|
Dewit |
Radiotherapeut-oncoloog Antoni van Leeuwenhoek ziekenhuis |
Geen |
Centrum behandelt ook met Gamma Knife |
Geen; er worden in de aanbevelingen geen merknamen van de apparatuur genoemd. |
|
Van Elst |
Voorzitter Stichting Melanoom (onbetaald) Vrijwilliger actief in de rol van voorzitter bij kankerpatienorganisatie (KPO) Stichting Consultant bij ASML N.V. Zowel deze organisatie zelf, als de branch waarin deze organisatie actief is, heeft als zodanig geen enkele connectie met de belangen en de praktijk van de omgeving waarin het te leveren advies op van toepassing is. |
In februari 2018 als 'Patient Advocate' (belangenbehartiger voor patiënten) een Patient Advisory Board van de firma Amgen in Zurich bijgewoond (betaald). |
Geen |
Geen |
|
Enting |
Neuroloog UMC Groningen |
Geen |
Geen |
Geen |
|
Gathier |
Neuroloog Elisabeth-TweeSteden Ziekenhuis |
Promovenda afdeling neurologie / intensive care UMC Utrecht (betaald) Bestuurslid Vereniging voor Arts Assistenten Neurologie (VAAN) tot december 2018 (onbetaald) Adviserend bestuurslid Nederlandse Vereniging van Neurologie (NVN) tot december 2018 (onbetaald) Docent bij de cursus 'Neurologic ALS’ van Expert College (betaald) |
Geen |
Geen |
|
de Graeff |
Internist-oncoloog UMC Utrecht |
Hospice-arts, Hospice Demeter, De Bilt |
Geen |
Geen |
|
Heessels-Smetsers |
verpleegkundig specialist oncologie Catharina ziekenhuis |
Lid verpleegkundig stafbestuur, adviseren/signaleren in verpleegkundige ontwikkelingen naar Raad van bestuur, 4 uur in loondienst Lid LWNO-V, deskundigheidsbevordering, kwaliteitszorg, netwerken op landelijk niveau (onbetaald) |
Geen |
Geen |
|
Hendriks |
Longarts Maastricht UMC+, |
PI van drie onderzoeken naar hersenmetastasen welke deels gesponsord worden door de farmaceutische industrie co-PI: studie die effect van PCI bij stadium III NSCLC bestudeert (Astrazeneca, studie in opstart) |
Adviesraad BMS (nivolumab), Boehringer Ingelheim (afatinib), vergoeding gaat naar instituut. Tijdens richtlijnontwikkeling zijn deze bijeenkomsten niet bijgewoond. Adviesraad Eli Lilly (ramucirumab), Roche (atezolizumab), geen betrekking op hersenmetastasen. Quadia : vergoeding webinars (niet specifiek gerelateerd aan hersenmetastasen) Mentorship programma met key opinion leaders, (Astrazeneca, niets met hersenmetastasen te maken)
|
De literatuurselectie voor de module ‘systemische therapie van hersenmetastasen van een longcarcinoom’ is door twee werkgroepleden uitgevoerd. Aanbevelingen voor deze module zijn tijdens de werkgroepvergadering door de gehele werkgroep geformuleerd. |
|
Jacobs-van Leur |
Verpleegkundig specialist palliatieve zorg (gepensioneerd) |
Bestuurslid VPTZ (vrijwilligers palliatieve terminale zorg) (onbetaald) |
Geen |
Geen |
|
Lagerwaard |
Radiotherapeut-oncoloog Amsterdam UMC, locatie VUmc |
Geen |
Geen |
Geen |
|
Nandoe Tewarie |
Neurochirurg Haaglanden MC |
Geen |
Geen |
Geen |
|
Smits |
Radioloog en professor Erasmus MC |
Secretaris van de sectie Neuroradiologie NVvR (onbetaald) Trial reviewer voor de EORTC-1410 trial (betaald, niet persoonlijk) Chair-elect van de Imaging Group EORTC (onbetaald) President-elect van de ESMRMB Honarary consultant University College London Hospital NHS Foundation Trust in London (betaald) |
Geen |
Geen |
|
de Vos |
Internist-oncoloog UMC Utrecht |
Lid Webredactieraad NVMO (onbetaald) Landelijke Werkgroep Neuro-oncologie (LWNO): bestuurslid Bestuurslid Dutch Brain Tumor Registry (onbetaald) Lid werkgroep kwalitetiscriteria LWNO, lid protocol comité zeldzame tumoren LWNO, werkgroeplid richtlijn gliomen (alle onbetaald) European Organization for Research and Treatment in Cancer (EORTC) - Brain Tumour Group - Member Quality Assurance EORTC BTG (onbetaald) |
Principal investigator van meerdere door de industrie gesponsorde studies. Echter, haast al deze studies hebben hersenmetastase als exclusiecriterium. Daarnaast zijn er geen studies die zich richten op patiënten met hersenmetastasen als doelgroep waaraan als principal of sub-investigator is meegewerkt. |
Geen |
|
Zindler |
Radiotherapeut-oncoloog Erasmus MC |
Principal investigator van een fase III multicenter studie waarbij totale schedelbestraling rechtstreeks vergeleken wordt met stereotactische radiochirurgie in patiënten met minimaal 4 en maximaal 10 hersenmetastasen. |
Onderzoek wordt gesponsord door Varian Medical Systems Varian heeft geen belang bij bepaalde uitkomst omdat beide behandelingen met dezelfde apparaten uitgevoerd worden |
Geen |
Inbreng patiëntenperspectief
Tijdens alle stappen van het ontwikkelproces is rekening gehouden met het patiëntperspectief. De voorzitter van Stichting Melanoom had zitting in de werkgroep. Tevens is de conceptrichtlijn voor commentaar aan Stichting Melanoom en Patientenfederatie Nederland voorgelegd. Bij de knelpunteninventarisatievergadering (invitational conference) was tevens een afgevaardigde namens hersenletsel.nl aanwezig.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de aanverwante producten bij elke module.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de ervaren knelpunten rondom de zorg van patienten met hersenmetastasen onder relevante partijen. Middels een knelpunteninventarisatievergadering is er input gevraagd op het conceptraamwerk aan de Nederlandse Vereniging voor Neurologie, Nederlandse Internisten Vereniging, Nederlandse Associatie Physician Assistants, Nederlands Huisartsen Genootschap, Verpleegkundige en Verzorgende Nederland, Integraal Kanker Centrum Nederland, Nederlandse Vereniging voor Neurochirurgie, Stichting Melanoom, Patientenfederatie Nederland, Nederlands Instituut Psychologen, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose, Nederlandse Vereniging voor Radiologie, Verenso, Hersenletsel.nl, Inspectie voor de Gezondheidszorg en Jeugd, Nederlandse Federatie van Universitair Medische Centra, Nederlandse Vereniging van Ziekenhuizen, Samenwerkende Topklinische opleidingsZiekenhuizen, Zorginstituut Nederland, Zelfstandige Klinieken Nederland, Zorgverzekeraars Nederland, en de Nederlandse Zorgautoriteit. Een beknopte samenvatting van de schriftelijke knelpuntenanalyse is opgenomen in de aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de vorige versie van de richtlijn en de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur conceptuitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal, belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de uitgangsvragen waarvoor een systematische literatuuranalyse was gepland, werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: Cochrane - voor gerandomiseerd gecontroleerd onderzoek en PROBAST - voor prognostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast de kwaliteit van het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Alle aanbevelingen zijn met de werkgroep vastgesteld.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is weergegeven in de aanverwante producten van deze richtlijn.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
