Antitrombotische therapie na herseninfarct
Uitgangsvraag
Wat is de beste antitrombotische therapie in het kader van secundaire preventie na TIA of herseninfarct bij patiënten met non-valvulair atriumfibrilleren?
Aanbeveling
Randvoorwaarden secundaire preventie met orale anticoagulantia
Voor secundaire preventie van herseninfarct bij niet-valvulair atriumfibrilleren kan gekozen worden voor één van de DOACs en als tweede keus een VKA.
Schrijf een trombocytenaggregatieremmer voor aan patiënten met een doorgemaakte TIA/herseninfarct en atriumfibrilleren, die een absolute contra-indicatie hebben voor een VKA of DOAC.
Overwegingen
In vooraf bepaalde subgroep-analyses is gekeken naar patiënten die reeds eerder een TIA of herseninfarct doormaakten (Diener, 2010; Diener, 2012; Easton, 2012; Hankey, 2012). De relatieve risicoreductie voor zowel herseninfarcten en systemische embolieën als het optreden van ernstige bloedingen verschilde niet tussen deelnemers met en zonder voorgeschiedenis van een herseninfarct of TIA en tussen patiënten jonger en ouder dan 75 jaar. Een uitzondering is het optreden van relatief meer gastro-intestinale bloedingen bij oudere patiënten (Eikelboom, 2011).
De belangrijkste onbekenden voor de effectiviteit en veiligheid voor het gebruik van DOACs in de dagelijkse praktijk (buiten de trials) zijn het effect van medicatiecompliance (zonder trombosediensten en trialorganisatie), verslechterende nierfunctie en het starten van interfererende comedicatie. Registraties van patiënten die DOACs gebruiken voor de indicatie AF geven vergelijkbare resultaten als binnen de trials (Larsen, 2013; Southworth, 2013; Tran, 2014). Het risico op gastro-intestinale bloedingen lijkt niet verhoogd bij gebruik van dabigatran of rivaroxaban ten opzichte van VKA-gebruikers voor de indicatie AF. Wel is bij patiënten ouder dan 75 jaar het risico van gastro-intestinale bloedingen zowel met DOACs als met VKA verhoogd (Abraham, 2015; Chang, 2015).
De European Society of Cardiology adviseert het gebruik van DOACs boven VKA voor patiënten met non-valvulair AF met een CHA2DS2-VASc score groter dan één mits gebruikt zoals in de bovenstaande RCTs (Camm, 2012). De door de beroepsgroepen opgestelde leidraad is terughoudender waarbij middelen meer gelijkwaardig worden beschouwd en er additionele restricties zijn (FMS, 2012). Daarnaast wordt gesteld dat bij patiënten die goed ingesteld zijn op een VKA er geen noodzaak is deze om te zetten in een DOAC.
De terughoudendheid ondanks de eenduidige positieve studieresultaten wordt met name veroorzaakt door de vraag in hoeverre behandeling binnen de RCTs overeenkomt met onze dagelijkse praktijk en als zodanig generaliseerbaar is. Beter gebruik van VKA, slechter gebruik van DOACs en gebruik bij andere patiënten dan in de RCT kunnen tot andere afwegingen leiden.
Indien warfarine voor >72,6% van de tijd binnen de therapeutische marge (INR 2 tot 3) was ingesteld was er geen superioriteit van dabigatran (2 dd 150 mg) meer ten opzichte van warfarine in het voorkomen van herseninfarcten (Wallentin, 2010). De deelnemende Nederlandse patiënten haalden dit gemiddeld genomen niet (70% binnen de marge). Het aantal intracraniële bloedingen onder dabigatran was nog steeds significant minder dan onder warfarine.
Inmiddels zijn er naast een meta-analyse ook nieuwe data bekend (Ruff, 2014). Gebruik van dabigatran in de dagelijkse praktijk werd door de FDA onderzocht en vergelijkbare veiligheid bevonden als in de trials (Southworth, 2013). Ook de langere termijn follow-up van patiënten die aan de dabigatranstudie meededen wijst in deze richting (Connolly, 2013). Er zijn ondertussen ook van de andere DOACS enkele grote fase-4-studies gerapporteerd met restultaten die vergelijkbaar zijn aan de besproken trials (Beyer-Westendorf, 2014; Camm, 2016; Graham, 2015; Korenstra, 2016; Lauffenburger, 2015; Seeger, 2015; Tamayo, 2015; Villines, 2015).
Bloedingscomplicaties treden met name op bij onjuist gebruik van DOACs en bij gebruik in combinatie met bloedplaatjesremmers, zoals dat overigens ook bij VKA het geval is (Hart, 2012; Pfeilschifter, 2013; Southworth, 2013). Aangezien trombosediensten de controles die gebruikelijk zijn voor VKAs niet (standaard) uitvoeren voor DOACs, valt het medicatiemanagement nu volledig onder de verantwoordelijkheid van voorschrijver en apotheker. Regionale transmurale afspraken over taken en verantwoordelijkheden in de keten antistolling zijn daarom voorwaarde voor veilig gebruik van DOACs (FMS, 2012; FMS, 2014).
Patiënten met een recent herseninfarct of TIA waarbij de novo AF wordt ontdekt hebben een indicatie voor een DOAC. Hierbij mag er, indien er geen voorgeschiedenis is van kleplijden, vanuit gegaan worden dat het om niet-valvulair atriumfibrilleren gaat en moet voor bevestiging daarvan patiënt naar de cardioloog verwezen worden. De keuze tussen VKAs en DOACs is een individuele afweging en moet met elke patiënt afzonderlijk worden gemaakt (tabel 1 en 2). Indien er geen contra-indicaties zijn voor VKA en DOAC is er op basis van de RCTs, meta-analyses en recente follow-up literatuur een voorkeur om een DOAC voor te schrijven.
Het is niet aannemelijk dat DOACs onveiliger zijn dan VKA in de eerste weken na een herseninfarct. Klinisch bewijs hiervoor ontbreekt echter nagenoeg. Advies is om DOACs te gebruiken conform VKA: dus na een groot herseninfarct starten na twee weken, voor lichtere herseninfarcten na vijf tot zeven dagen en voor een TIA direct (Hankey, 2013). Er is geen voorkeur voor een specifieke DOAC, wel voor de hogere ten opzichte van de lagere doseringen. Bij patiënten met een contra-indicatie voor VKA is apixaban effectiever dan ASA (Connolly, 2011). Dat de overige DOACs in dat geval een vergelijkbaar effect hebben is aannemelijk, maar niet aangetoond. Advies is om ook bij alle patiënten die reeds een VKA gebruiken een switch naar een DOAC te bespreken op basis van voor- en nadelen. Bij zowel VKA als DOAC is ketenzorg belangrijk voor de effectiviteit en veiligheid van de behandeling. De richtlijn van de Landelijke stuurgroep keten antistolling (LSKA; versie 2) geeft hier handvatten voor (FMS, 2012).
Tabel 1 Checklist voor starten en gebruik van DOACs na TIA of herseninfarct
|
Checklist |
|
|
Indicatie |
Non-valvulair Atrium Fibrilleren |
|
Leeftijd |
<18 jaar: niet vergoed; off-label gebruik 19 tot 80jaar: regulier gebruik >80 jaar: met name kwetsbare ouderen (VMS criteria); aangepaste (lagere) dosering. Deze aanwijzing voor doseringsaanpassing geldt uitsluitend voor dabigatran. Voor de Factor Xa remmers (rivaroxaban en edoxaban) behoeft de dosering niet op geleide van leeftijd te worden verminderd. Voor apixaban geldt dat de dosering aangepast moet worden indien ook sprake is van een laag lichaamsgewicht (≤60kg) of nierinsufficiëntie (serum creatinine ≥133 micromol/l). |
|
Vrouwen |
Over gebruik tijdens zwangerschap en lactatie is onvoldoende bekend en wordt afgeraden. Geen bekende interactie met orale anticonceptie |
|
Comorbiditeit (zie ook nierfunctiestoornis) |
Absolute contra-indicatie:
Relatieve contra-indicatie (overweeg lagere dosering):
|
|
Nierfunctiestoornis |
Alle DOACs worden deels nefrogeen geklaard (dabigatran voor 80% en de Xa remmers voor 20 tot 35%). Voor starten de creatinineklaring bepalen (en op recept noteren). Indien:
|
|
Comedicatie |
Relatieve contraindicaties (overleg met apotheker bij): De prodrug dabigatran etexilaat wordt volledig gemetaboliseerd door P-glycoproteine (P-GP) en de Xa-remmers apixaban en rivaroxaban (niet edoxaban) worden daarnaast ook via CYP3A4 en CYP2J2 gemetaboliseerd:
|
|
Switch |
Switch van VKA naar DOAC: stop VKA en start DOAC nadat INR<2 |
|
Organisatie |
Regionaal protocol over samenwerkingsafspraken (sluitende zorgketen), (contra-) indicatie, omgaan met bloedingen en chirurgische ingrepen |
|
Communicatie |
Voor- en nadelen en afwegingen bespreken met patiënt en communiceren naar overige betrokken professionals (huisarts, apotheek, overige specialisten) Bespreek potentiële bijwerkingen en omgaan met calamiteiten |
|
Therapietrouw |
|
|
Vergoeding |
Vul naast recept ook vergoedingsformulier in (inleveren bij apotheek) |
Tabel 2 voor en nadelen DOACs versus VKA
|
DOAC versus VKA |
|
|
Voordeel |
Nadeel |
|
|
[1] voor dabigatran is er een specifiek antidotum idaricizumab, voor de Xa-remmers wordt er een middel onderzocht (Andexanet alpha)
Onderbouwing
Achtergrond
Zowel chronisch als paroxysmaal atriumfibrilleren (AF) geeft gemiddeld een drie tot vijf maal verhoogd risico op een herseninfarct. Hiermee is AF verantwoordelijk voor 15 tot 25% van alle herseninfarcten (Marini, 2005). Klassieke orale anticoagulantia (vitamine-K-antagonisten (VKA) of coumarinederivaten) geven een risicoreductie van ongeveer tweederde en zijn daarmee de afgelopen decennia de eerste keuze preventieve medicatie na een TIA of herseninfarct bij AF geweest. Het nadeel van deze medicatie is de kans op ernstige bloedingen, interacties met diverse medicamenten en de noodzakelijke controles van de INR. Een nieuwe generatie antistollingsmedicijnen, de (niet-vitamine-K-afhankelijke) Directe Orale Anti-Coagulantia (DOACs), geven een nieuwe behandelmogelijkheid.
VKA zijn zeer effectief in het voorkomen van een herseninfarct bij patiënten met AF met een relatieve risicoreductie ten opzichte van placebo van 60 tot 70%, terwijl dit voor acetylsalicylzuur slechts 20 tot 25% is (Hart, 2007b; EAFT, 1993). Gebruik van VKA gaat gepaard met een jaarlijks risico op ernstige bloedingen van twee tot vijf procent, terwijl dit bij lage dosis acetylsalicylzuur gemiddeld minder dan één procent is, maar kan oplopen tot meer dan drie procent bij oudere patiënten (Baigent, 2009; Mant, 2007; Schulman, 2008). Het jaarlijkse risico op een intracraniële bloeding bij VKA-gebruik is gemiddeld een half tot één procent (Loewen, 2011). Een methode om een inschatting te maken is de HAS-BLED score (Hypertension=1, Abnormal renal/liver function=1-2, Stroke=1, Bleeding history or predisposition=1, Labile international normalized ratio=1, Elderly (>65 y)=1, Drugs (antiplatelet agents)/alcohol=1), waarbij een score hoger dan drie overeenkomt met een risico op een ernstige bloedingscomplicatie van meer dan vijf procent per jaar (Pisters, 2010).
Ondanks de superieure effectiviteit van VKA boven plaatjesremmers voor deze indicatie gebruikt slechts de helft van de patiënten met een indicatie deze middelen (Ogilvie, 2010; Willemsen, 2011). Mogelijk spelen noodzakelijke intensieve controles, interacties met medicatie en voeding en geschatte risico’s van kwetsbaarheid van oudere patiënten, welke niet in de risicoscores zijn meegenomen, daarin een rol.
Conclusies / Summary of Findings
Effectiviteit secundaire preventie herseninfarct bij nv-AF: VKA vs DOAC
|
Laag GRADE |
DOACs geven ten opzichte van VKA een vergelijkbare of betere preventie tegen herseninfarcten en systemische embolieën bij een geselecteerde groep patiënten met non-valvulair atriumfibrilleren. |
Veiligheid secundaire preventie herseninfarct bij nv-AF: VKA vs DOAC
|
Laag GRADE |
DOACs geven minder intracraniële bloedingen dan VKA bij een geselecteerde groep patiënten met non-valvulair atriumfibrilleren. |
Samenvatting literatuur
Met name de universeel forse afname van intracraniële bloedingen is opvallend. Er werd geen onderling vergelijkend onderzoek gedaan. De vier RCTs waren redelijk vergelijkbaar qua opzet, behoudens het open-label design van de studie naar dabigatran en de hoger risico populatie (gemiddelde CHADS2 = 3,5) in de studie naar rivaroxaban. In deze laatste studie hadden patiënten een hogere baseline CHADS2-score en was er een veel groter aandeel patiënten met een eerdere TIA of herseninfarct. Patiënten met een recent herseninfarct (varierend van minder dan zeven dagen tot meer dan zes maanden) of een eerdere hersenbloeding werden geëxcludeerd in de RCTs.
Een meta-analyse van de vier RCTs die patiënten met atriumfibrilleren includeerden (Connolly, 2009; Giugliano, 2013; Granger, 2011; Patel, 2011) toont een relatieve risicoreductie van DOACs ten opzichte van warfarine voor herseninfarcten of systemische embolie van 19% (RR 0,81; 95% BI 0,73 tot 0,91) (figuur 1), voor ernstige bloedingen van 14% (RR 0,86; 95% BI 0,73 tot 1,00) (figuur 2), voor intracraniële bloedingen van 52% (RR 0,48; 95% BI 0,39 tot 0,59) (figuur 3) en voor overlijden van 10% (RR 0,90; 95% BI 0,85 tot 0,95) (figuur 3) (Ruff, 2014). Er was een toegenomen risico op gastro-intestinale bloedingen van 25% (RR 1,25; 95% BI 1,01 tot 1,55) (figuur 3).
Figuur 1 Herseninfarct of hersenbloeding of andere systemische embolische events

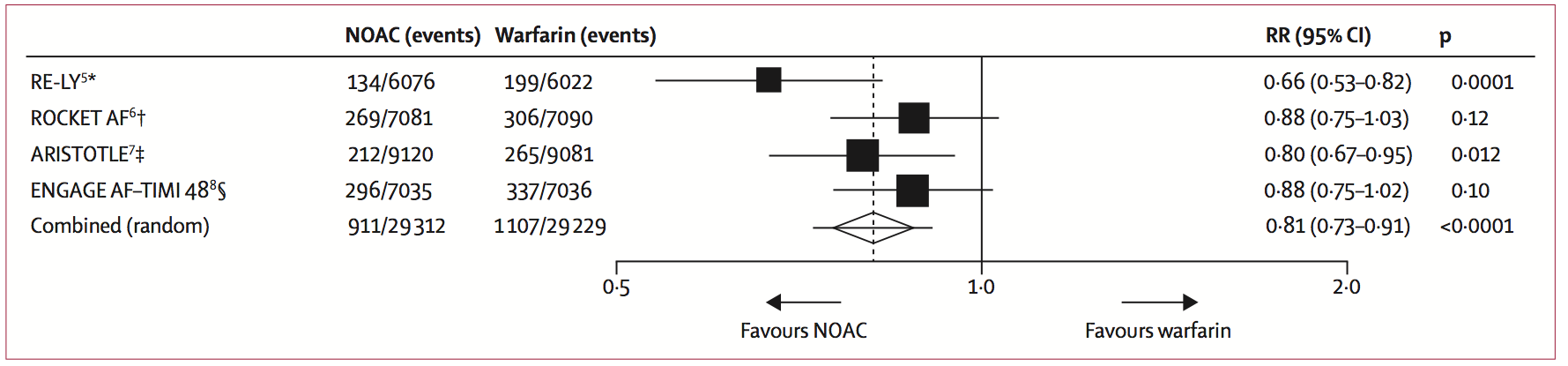
Data zijn n/N, tenzij anders aangegeven. Heterogeniteit: I²=47%; p=0,13. NOAC=DOAC (direct werkende orale anticoagulantia). RR=risk ratio. *Dabigatran 150 mg tweemaal daags. †Rivaroxaban 20 mg eenmaal daags. ‡Apixaban 5 mg tweemaal daags. §Edoxaban 60 mg eenmaal daags.
Figuur 2 Ernstige bloedingen

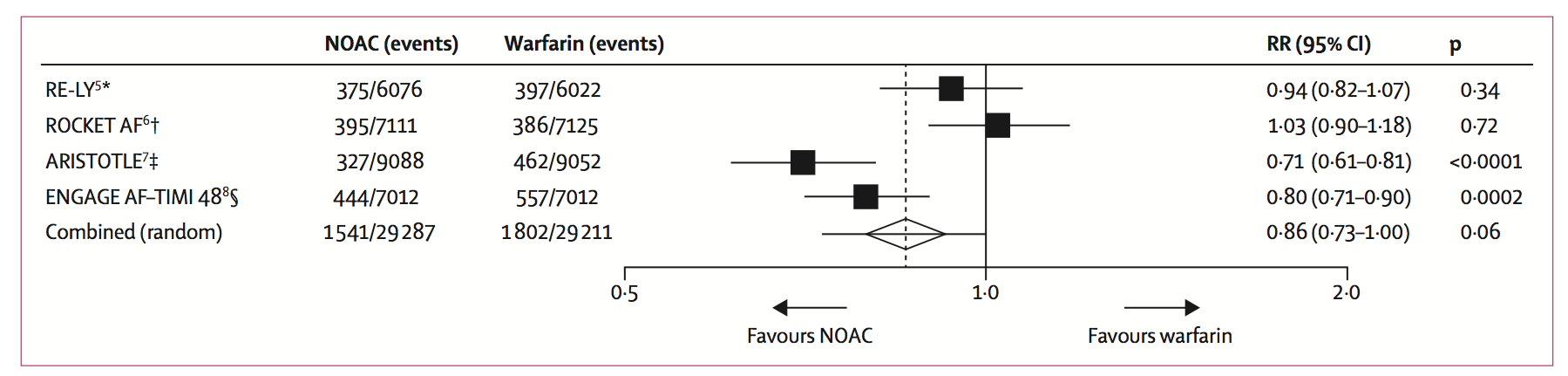
Data zijn n/N, tenzij anders aangegeven. Heterogeniteit: I2=83%; p=0·001. NOAC=DOAC (direct werkende orale anticoagulantia). RR=risk ratio. *Dabigatran 150 mg tweemaal daags. †Rivaroxaban 20 mg eenmaal daags. ‡Apixaban 5 mg tweemaal daags. §Edoxaban 60 mg eenmaal daags.
Figuur 3 Secundaire uitkomsten: bloedingen en ischemische events

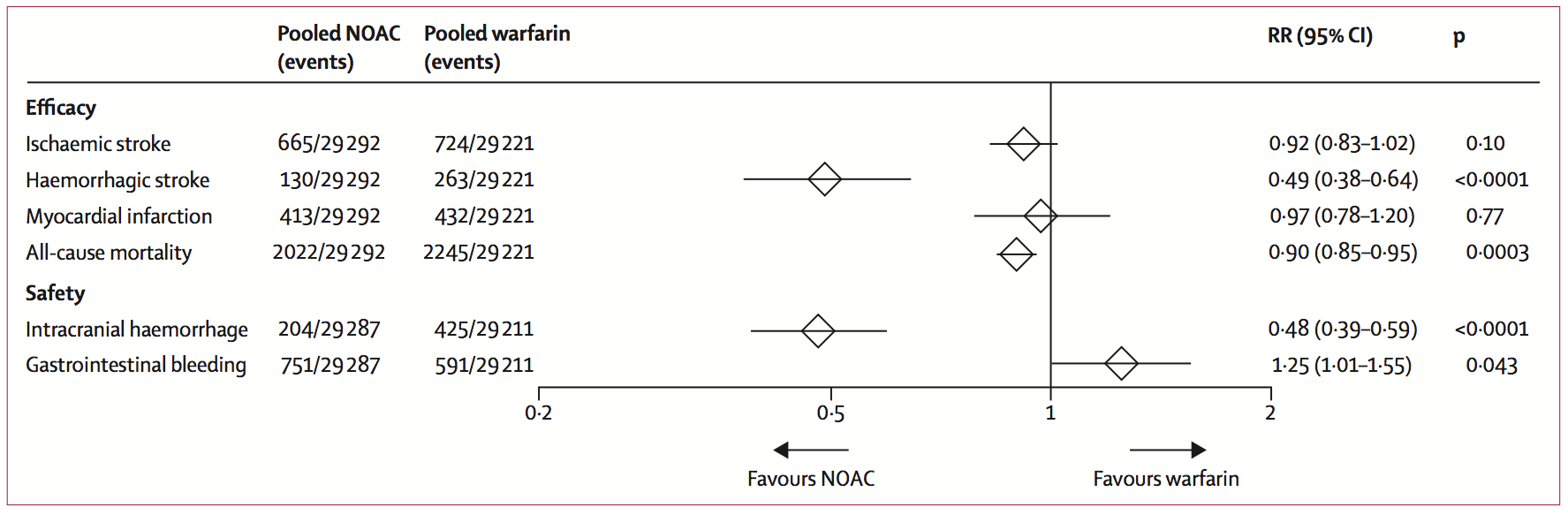
Data zijn n/N, tenzij anders aangegeven. Heterogeniteit herseninfarct: I2=32%, p=0,22; hersenbloeding: I2=34%, p=0,21; myocardinfarct I2=48%, p=0,13; mortaliteit I2=0%, p=0,81; intracraniële bloeding I2=32%, p=0,22; maag-darmbloedingen I2=74%, p=0,009. NOAC=DOAC (direct werkende orale anticoagulantia). RR=risk ratio.
Bewijskracht
Voor deze meta-analyse werd gebruik gemaakt van vier RCTs. De bewijskracht van RCTs is hoog, deze werd verlaagd vanwege onvolledige blindering in de RE-LY studie en sponsoring door de industrie.
Zoeken en selecteren
Relevante uitkomstmaten
De werkgroep achtte ernstige bloedingen, herseninfarcten en sterfte voor de besluitvorming kritieke uitkomstmaten.
Zoeken en methode
Voor de beantwoording van deze uitgangsvraag werd uitgegaan van een meta-analyse gepubliceerd in de Lancet (Ruff, 2014) die vier RCTs includeerde.
In de databases Medline (OVID) werd gezocht van 1 januari 2009 tot november 2013. Zoektermen waren atrial fibrillation, dabigatran, rivaroxaban, apixaban, edoxaban, oral factor Xa inhibitor, oral thrombin inhibitor, and warfarin. Daarnaast werd in Clinical Trials.gov gezocht naar lopende klinische studies. De analyses werden beperkt tot fase 3 gerandomiseerde studies die patiënten met atriumfibrilleren includeerden en die werden gerandomiseerd om DOACs te krijgen of warfarine waarbij de effectiviteit en veiligheid werd gerapporteerd.
Referenties
- Abraham NS, Singh S, Alexander GC, et al. Comparative risk of gastrointestinal bleeding with dabigatran, rivaroxaban, and warfarin: population based cohort study. BMJ. 2015;350:h1857.
- Baigent C, Blackwell L, Collins R, et al. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet. 2009;373(9678):1849-1860.
- Bauer, Kenneth A. Targeted anti-anticoagulants. N Engl J Med. 2015;373:569-71.
- Beyer-Westendorf J, Forster K, Pannach S, Ebertz F, Gelbricht V, Thieme C, et al. Rates, management, and outcome of rivaroxaban bleeding in daily care: Results from the dresden noac registry. Blood. 2014;124:955-962
- Camm AJ, Amarenco P, Haas S, Hess S, Kirchhof P, Kuhls S, et al. Xantus: A real-world, prospective, observational study of patients treated with rivaroxaban for stroke prevention in atrial fibrillation. Eur Heart J. 2016;37:1145-1153
- Camm AJ, Lip GY, De Caterina R, et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association. Eur Heart J. 2012;33(21):2719-2747.
- Chang HY, Zhou M, Tang W, et al. Risk of gastrointestinal bleeding associated with oral anticoagulants: population based retrospective cohort study. BMJ 2015;350:h1585.
- Connolly SJ, Eikelboom J, Joyner C, et al. Apixaban in patients with atrial fibrillation. N Engl J Med. 2011;364(9):806-817.
- Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361(12);1139-1151.
- Connolly SJ, Wallentin L, Ezekowitz MD, et al. The Long-Term Multicenter Observational Study of Dabigatran Treatment in Patients With Atrial Fibrillation (RELY-ABLE) Study. Circulation. 2013;128(3):237-243.
- Diener HC, Connolly SJ, Ezekowitz MD, et al. Dabigatran compared with warfarin in patients with atrial fibrillation and previous transient ischaemic attack or stroke: a subgroup analysis of the RE-LY trial. Lancet Neurol. 2010;9(12):1157-1163.
- Diener HC, Eikelboom J, Connolly SJ, et al. Apixaban versus aspirin in patients with atrial fibrillation and previous stroke or transient ischaemic attack: a predefined subgroup analysis from AVERROES, a randomised trial. Lancet Neurol. 2012;11(3):225-231.
- Diener HC, Foerch C, Riess H, et al. Treatment of acute ischaemic stroke with thrombolysis or thrombectomy in patients receiving anti-thrombotic treatment. Lancet Neurol. 2013;12(7):677-688.
- EAFT (European Atrial Fibrillation Trial) Study Group. Secondary prevention in non-rheumatic atrial fibrillation after transient ischaemic attack or minor stroke. Lancet. 1993;342(8882):1255-1262.
- Easton JD, Lopes RD, Bahit MC, et al. Apixaban compared with warfarin in patients with atrial fibrillation and previous stroke or transient ischaemic attack: a subgroup analysis of the ARISTOTLE trial. Lancet Neurol. 2012.
- Eikelboom JW, Wallentin L, Connolly SJ, et al. Risk of bleeding with 2 doses of dabigatran compared with warfarin in older and younger patients with atrial fibrillation: an analysis of the randomized evaluation of long-term anticoagulant therapy (RE-LY) trial. Circulation. 2011;123(21):2363-2372.
- Epple C, Steiner T. Acute stroke in patients on new direct oral anticoagulants: how to manage, how to treat? Expert Opin Pharmacother. 2014;15(14):1991-2001.
- Farmacotherapeutisch_kompas. http://www.medicijnkosten.nl. doi: 10.1053/j.seminhematol. 2013.
- FMS. Landelijke Standaard Ketenzorg Antistolling voor de eerste- en tweedelijnszorg, versie 2. http://www.knmp.nl/patientenzorg/samenwerking/landelijke-standaard-keten-antistolling-2-0-lska. 2014.
- FMS. Leidraad begeleide introductie nieuwe orale antistollingsmiddelen. http://www.knmp.nl/downloads/samenwerken-kennis-delen/ketenzorg/LeidraadNOAC.pdf. doi: 08010021 [pii]. 2012.
- Gage BF, Waterman AD, Shannon W, et al. Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation. JAMA. 2001;285(22):2864-2870.
- Giugliano RP, Ruff CT, Braunwald E, et al. Edoxaban versus Warfarin in Patients with Atrial Fibrillation. N Engl J Med. 2013;369(22):2093-2104.
- Graham DJ, Reichman ME, Wernecke M, Zhang R, Southworth MR, Levenson M, et al. Cardiovascular, bleeding, and mortality risks in elderly medicare patients treated with dabigatran or warfarin for nonvalvular atrial fibrillation. Circulation. 2015;131:157-164
- Granger CB, Alexander JH, McMurray JJ., et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2011;365(11):981-992.
- Hankey GJ, Patel MR, Stevens SR, et al. Rivaroxaban compared with warfarin in patients with atrial fibrillation and previous stroke or transient ischaemic attack: a subgroup analysis of ROCKET AF. Lancet Neurol. 2012;11(4):315-322.
- Hankey GJ. Unanswered questions and research priorities to optimise stroke prevention in atrial fibrillation with the new oral anticoagulants. Thromb Haemost. 2013;111(3).
- Hankey GJ. Unanswered questions and research priorities to optimise stroke prevention in atrial fibrillation with the new oral anticoagulants. Thromb Haemost. 2014;111(5):808-816.
- Hart RG, Diener HC, Yang S, et al. Intracranial hemorrhage in atrial fibrillation patients during anticoagulation with warfarin or dabigatran: the RE-LY trial. Stroke. 2012;43(6):1511-1517.
- Hart RG, Pearce LA, Aguilar MI. Adjusted-dose warfarin versus aspirin for preventing stroke in patients with atrial fibrillation. Ann Intern Med. 2007a;147(8):590-592.
- Hart RG, Pearce LA, Aguilar MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med. 2007b;146(12):857-867.
- Heeringa J, van der Kuip DA, Hofman A, et al. Prevalence, incidence and lifetime risk of atrial fibrillation: the Rotterdam2006;27(8):949-953.
- Jauch EC, Saver JL, Adams HP Jr, et al. Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2013;44(3):870-947.
- Kate M, Szkotak A, Witt A, et al. Proposed approach to thrombolysis in dabigatran-treated patients presenting with ischemic stroke. J Stroke Cerebrovasc Dis. 2014;23(6):1351-1355.
- Korenstra J, Wijtvliet EP, Veeger NJ, Geluk CA, Bartels GL, Posma JL, et al. Effectiveness and safety of dabigatran versus acenocoumarol in 'real-world' patients with atrial fibrillation. Europace. 2016;18:1319-1327.
- Larsen TB, Rasmussen LH, Skjoth F, et al. Efficacy and safety of dabigatran etexilate and warfarin in real-world patients with atrial fibrillation: a prospective nationwide cohort study. J Am Coll Cardiol. 2013;61(22):2264-2273.
- Lauffenburger JC, Farley JF, Gehi AK, Rhoney DH, Brookhart MA, Fang G. Effectiveness and safety of dabigatran and warfarin in real-world us patients with non-valvular atrial fibrillation: A retrospective cohort study. J Am Heart Assoc. 2015;4
- Lip GY, Halperin JL et al. Improving stroke risk stratification in atrial fibrillation. Am J Med. 2010;123(6):484-488.
- Loewen P, Dahri K. Risk of bleeding with oral anticoagulants: an updated systematic review and performance analysis of clinical prediction rules. Ann Hematol. 2011;90(10):1191-1200.
- Mant J, Hobbs FD, Fletcher K, et al. Warfarin versus aspirin for stroke prevention in an elderly community population with atrial fibrillation (the Birmingham Atrial Fibrillation Treatment of the Aged Study, BAFTA): a randomised controlled trial. Lancet. 2007;370(9586):493-503.
- Marini C, De Santis F, Sacco S, et al. Contribution of atrial fibrillation to incidence and outcome of ischemic stroke: results from a population-based study. Stroke, 2005;36(6):1115-1119.
- Matute MC, Masjuan J, Egido JA, et al. Safety and Outcomes following Thrombolytic Treatment in Stroke Patients Who Had Received Prior Treatment with Anticoagulants. Cerebrovascular Diseases. 2012;33(3):231-239.
- Miedema I, Luijckx GJ, De Keyser J, et al. Thrombolytic therapy for ischaemic stroke in patients using warfarin: a systematic review and meta-analysis. J Neurol Neurosurg Psychiatry. 2012;83(5):537-540.
- Ogilvie IM, Newton N, Welner SA, et al. Underuse of oral anticoagulants in atrial fibrillation: a systematic review. Am J Med. 2010;123(7):638-645.
- Opstelten W, Boode BS, Heeringa J, et al. Samenvatting van de standaard Atriumfibrilleren (eerste herziening) van het Nederlands Huisartsen Genootschap Ned Tijdschr Geneeskd. 2010;154:A1570.
- Patel MR, Mahaffey KW, Garg J, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med. 2011;365(10):883-891.
- Pfeilschifter W, Luger S, Brunkhorst R, et al. The gap between trial data and clinical practice -- an analysis of case reports on bleeding complications occurring under dabigatran and rivaroxaban anticoagulation. Cerebrovasc Dis. 2013;36(2):115-119.
- Pisters R, Lane DA, Nieuwlaat R, de Vos CB, Crijns HJ, Lip GY. A novel user-friendly score (has-bled) to assess 1-year risk of major bleeding in patients with atrial fibrillation: The euro heart survey. Chest. 2010;138:1093-1100.
- Ruff C, Giugliano R, Braunwald E, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet, Epub. 2014.
- Rybinnik I, Mullen MT, Messe S, et al. Treatment of acute stroke in patients on dabigatran: a survey of US stroke specialists. J Stroke Cerebrovasc Dis. 2013;22(8):1312-1316.
- Schulman S, Beyth RJ, Kearon C, et al. Hemorrhagic complications of anticoagulant and thrombolytic treatment: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest. 2008;133(6 Suppl):257S-298S.
- Seeger JD, Bykov K, Bartels DB, Huybrechts K, Zint K, Schneeweiss S. Safety and effectiveness of dabigatran and warfarin in routine care of patients with atrial fibrillation. Thromb Haemost. 2015;114:1277-1289
- Southworth MR, Reichman ME, Unger EF. Dabigatran and postmarketing reports of bleeding. N Engl J Med. 2013;368(14):1272-1274.
- Tamayo S, Frank Peacock W, Patel M, Sicignano N, Hopf KP, Fields LE, et al. Characterizing major bleeding in patients with nonvalvular atrial fibrillation: A pharmacovigilance study of 27 467 patients taking rivaroxaban. Clin Cardiol. 2015;38:63-68
- Tran TH, Nguyen C, Lam T, et al. Bleeding incidence and real-life prescribing practices with dabigatran use in an acute care setting. Consult Pharm. 2014;29(11):735-740.
- Villines TC, Schnee J, Fraeman K, Siu K, Reynolds MW, Collins J, et al. A comparison of the safety and effectiveness of dabigatran and warfarin in non-valvular atrial fibrillation patients in a large healthcare system. Thromb Haemost. 2015;114:1290-1298
- Wallentin L, Yusuf S, Ezekowitz MD, et al. Efficacy and safety of dabigatran compared with warfarin at different levels of international normalised ratio control for stroke prevention in atrial fibrillation: an analysis of the RE-LY trial. Lancet. 2010;376(9745):975-983.
- Willemsen RTA, Pisters R, Crijns HJGM, et al. Implementatie van antitrombotische behandeling bij atriumfibrilleren. Huisarts Wet. 2011;54(4):192-196.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question: Wat is de beste antitrombotische therapie in kader secundaire preventie na TIA of herseninfarct bij patiënten met non-valvulair AF?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Connolly, 2009 |
Type of study: RCT
Setting: multicenter
Country: 44 countries
Source of funding: Boehringer Ingelheim |
Inclusion criteria: documented atrial fibrillation &: History of previous stroke, TIA, or systemic embolism b. Ejection fraction less than 40% s c. Sympto-matic heart failure, Age at least 75 years e. Age > 65 years and one of: i. DM ii. Documented coronary artery disease iii. Hypertension
Exclusion criteria: heart valve disorder, severe disabling stroke within the previous 6 months, any stroke previous 14 days, conditions associated with increased risk of bleeding
N total at baseline: Dabigatran 110 mg: 6015 Dabigatran 150 mg: 6076 Warfarin: 6022
Important prognostic factors2: For example age ± SD: D 110: 71.4 +/- 8.6 D150: 71.5 +/- 8.8 W: 71.6 +/- 8.6
Sex: D 110: 64.3% M D 150: 63.2% M W: 63.3% M |
Describe intervention (treatment/procedure/test):
Dabigatran was administered, in a blinded fashion, in capsules containing either 110 mg or 150 mg of the drug, to be taken twice daily.
|
Describe control (treatment/procedure/test):
Warfarin was administered, in an unblended fashion, in tablets of 1, 3, or 5 mg and was adjusted locally to an international normalized ratio (INR) of 2.0 to 3.0, with the INR measured at least monthly. The time that the INR was within the therapeutic range was calculated with the use of the method of Rosendaal et al.,10 excluding INRs from the first week and after discontinuation of the study drug. These data were reported back to the participating centers with advice for optimal INR control. Concomitant use of aspirin (at a dose of <100 mg per day) or other antiplatelet agents was permitted. |
Length of follow-up: Median 2 yrs
Loss-to-follow-up: 20 Reasons unknown
Control: N (%) Reasons (describe)
Rates for discontinuation (1 year): D110: 14.5% D150: 15.5% W: 10.2% Reason unknown
Rates for discontinuation (2 years): D110: 20.7% D150: 21.2% W: 16.6%
|
Outcome measures and effect size (include 95%CI and p-value if available):
Stroke or systemic embolism occurred in 182 patients receiving 110 mg of dabigatran (1.53% per year), 134 patients receiving 150 mg of dabigatran (1.11% per year), and 199 patients receiving warfarin (1.69% per year) |
|
|
Giugliano, 2013 |
Type of study: RCT
Setting: multicenter
Country: 46 countries
Source of funding: Daiichi Sankyo Development |
Inclusion criteria: >21 yrs, atrial fibrillation documented by means of an electrical tracing within the 12 months preceding randomization, 2>= on CHADS2 risk assessment and anticoagulation therapy planned for duration of trial
Exclusion criteria: atrial fibrillation due to a reversible disorder, estimated creatinine clearance of less than 30 mL per minute, high risk of bleeding, dual antiplatelet therapy, mitral stenosis, other indications for anticoagulation therapy, acute coronary syndromes, coronary revascularization, or stroke within 30 days before randomization
N total at baseline: Warfarin: 7036 High-dose Edoxaban (HDE): 7035 Low-dose edoxaban (LDE): 7034
Important prognostic factors2: age (median): W: 72 {64-78] HDE: 72 [64-78] LDE: 72 [64-78]
Sex: W: 62.5 % M HDE: 62.1 % M LDE: 61.2 % M |
Describe intervention (treatment/procedure/test):
High-dose edoxaban 60 mg For patients in either group, dose was halved is any of the following characteristics were present at the time of randomization or during the study: estimated creatinine clearance of 30-50 mL/min, body weight of 60 kg or less, or the concomitant use of verapamil or quinidine (potent P-glycoprotein inhibitors). Protocol amendment, December 2010, mandated similar dose of concomitant use of dronedarone.
Low-dose edoxaban 30 mg
|
Describe control (treatment/procedure/test):
Warfarin
Each patient received two sets of study drugs: either active edoxaban and a placebo matching warfarin, or a placebo matching edoxaban and active warfarin. INR was measured at least monthly with the use of an encrypted point-of-care device. To maintain blinding, sham INR values were generated for patients who were randomly assigned to edoxaban |
Length of follow-up: Median exposure to treatment 907 days, median follow-up 1022 days (2,8 yrs)
Loss-to-follow-up: 1 lost, 244 withdrew consent to follow-up, 182 of these had no known primary-endpoint event and were not known to be dead.
Incomplete outcome data: Complete study without drug interruption W: 2421/7036= 34% HDE: 2621/7035=37% LDE: 2673/7034= 38%
Premature permanent discontinuation study drugs: W: 2417/7036= 34 % HDE: 2415 /7035= 34 % LDE: 2309 /7034= 33 %
|
Outcome measures and effect size (include 95%CI and p-value if available):
Primary stroke (ischemic or hemorrhagic) or systemic embolic event: 232 warfarin group (1,5%/year). HDE:182 (1,18%/year). LDE: 253 patients (1.61/year)
Principal safety endpoint was adjudicate major bleeding during treatment: W: 3.43%/year HDE: 2.75% LDE: 1.61%
|
|
|
Granger, 2011 |
Type of study: RCT
Setting: multicenter
Country:
Source of funding: Bristol-Myers Squibb and Pfizer |
Inclusion criteria: atrial fibrillation or flutter at enrolment or two or more episodes of atrial fibrillateion ot flutter as documented by ECG, at least two weeks apart in 12 months before enrolment. One of the following risk factors was required: >75Y, previous stroke, TIA, systemic embolism, symptomatic heart failure within previous 3 months or left ventricular ejection fraction <40%, hypertension requiring pharmacologic treatment
Exclusion criteria: atrial fibrillation due to a reversible cause, mitral stenosis, other conditions than AF requiring anticoagulation, stroke previous 7 daysm need for aspirin >165 mg/day or both aspirin and clopidogrel, renal insufficiency.
N total at baseline: Intervention: 9120 Control: 9081
Important prognostic factors2: Age (median)I: 70 [63-76] C: 70 [63-76]
Sex: I: 64.5% M C: 65.0% M |
Describe intervention (treatment/procedure/test):
Apixaban Apixaban or matching placebo was administered twice daily, with apixaban given in 5-mg doses; 2,5 mg doses were used in a subset of patients with two or more of the following criteria:>80 Y, <60 kg, serum creatinine 1,5 mg per decilitre or more. |
Describe control (treatment/procedure/test):
Dose-adjusted warfarin Warfarin (or matching placebo) was provided as 2 mg tablets and was adjusted to achieve INR of 2.0 to 3.0. INR was monitored using a patient encrypted, point-of-care INR device. An algorithm was provided to guide the adjustment of warfarin dose. |
Length of follow-up:
Loss-to-follow-up: I: 35 (0.4%) C: 34 (0.4%)
Incomplete outcome data: 380 (2.1%) I:92 (1.0)% C: 107 (1.2%) withdrawal of consent to follow-up
|
Outcome measures and effect size (include 95%CI and p-value if available):
Ischemic or hemorrhagic stroke or systemic embolism I: 212 (1.27%/year\0 C: 265 (1.6/year)
Major bleeding I: 327 (2.13%/year) C: 462 (3.09%/year)
Death from any cause I: 3.52%/year C; 3.94%/year |
|
|
Patel, 2011 |
Type of study: RCT
Setting: multicenter
Country: 45 countries
Source of funding: Johnson & Johnson Pharmaceutical Research and Development and Bayer HealthCare |
Inclusion criteria: nonvalvular atrial fibrillation, as documented on electrocardiography, who were at moderate-to-high risk for stroke. Elevated risk was indicated by a history of stroke, transient ischemic attack, or systemic embolism or at least two of the following risk factors: heart failure or a left ventricular ejection fraction of 35% or less, hypertension, an age of 75 years or more, or the presence of diabetes mellitus (i.e., a CHADS2 score of 2 or more, on a scale ranging from 1 to 6, with higher scores indicating a greater risk of stroke).
Exclusion criteria: see online content
N total at baseline: Intervention: 7131 Control: 7133
Important prognostic factors2: For example age median: I: 73 C: 73
Sex: I: 60.3 % M C:60.3 % M |
Describe intervention (treatment/procedure/test):
Fixeddose rivaroxaban (20 mg daily or 15 mg daily in patients with a creatinine clearance of 30 to 49 ml per minute)
Patients in each group also received a placebo tablet in order to maintain blinding.
|
Describe control (treatment/procedure/test):
adjusted-dose warfarin (target international normalized ratio [INR], 2.0 to 3.0).
Patients in each group also received a placebo tablet in order to maintain blinding.
|
Length of follow-up (median): 707 days
Loss-to-follow-up: 32 Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Because of violations in Good Clinical Practice guidelines at one site that made the data unreliable, 93 patients (50 in the rivaroxaban group and 43 in the warfarin group) were excluded from all efficacy analyses before unblinding. An additional issue with data quality was raised at another trial site, but this issue was resolved without the exclusion of the patients from the analysis |
Outcome measures and effect size (include 95%CI and p-value if available): In the intention-to-treat analysis, the primary end point occurred in 269 patients in the rivaroxaban group (2.1% per year) and in 306 patients in the warfarin group (2.4% per year) (hazard ratio, 0.88; 95% CI, 0.74 to 1.03; p<0.001 for noninferiority; p=0.12 for superiority). Major and nonmajor clinically relevant bleeding occurred in 1475 patients in the rivaroxaban group (14.9% per year) and in 1449 in the warfarin group (14.5% per year) (hazard ratio, 1.03; 95% CI, 0.96 to 1.11; p=0.44), with significant reductions in intracranial hemorrhage (0.5% vs. 0.7%, p=0.02) and fatal bleeding (0.2% vs. 0.5%, p=0.003) in the rivaroxaban group. |
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Risk of bias table for intervention studies (randomized controlled trials)
Research question: Wat is de beste antitrombotische therapie in kader secundaire preventie na TIA of herseninfarct bij patiënten met non-valvulair AF?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Connolly, 2009 |
randomly assigned to receive one of two doses of dabigatran, or to receive warfarin, by means of a central, interactive, automated telephone system. Dabigatran was administered, in a blinded fashion, in capsules containing either 110 mg or 150 mg of the drug, to be taken twice daily. Warfarin was administered, in an unblended fashion, in tablets of 1, 3, or 5 mg and was adjusted locally to an international normalized ratio (INR) of 2.0 to 3.0, with the INR measured at least monthly. |
unlikely |
Likely (not blinded for warfarin or apixaban use) |
likely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Giugliano. 2013 |
Randomization was performed with the use of 24-hour, interactive, computerized responde system. Patients who were already taking a vitamin K antagonist underwent randomization after the INR was 2.5 or less. Randomization was stratified according to the following characteristics: CHADS2 score of 2 or 3 versus a score of 4, 5 or 6 and status with respect to the need of a reduction in edoxaban dose. |
unlikely |
unlikely |
unclear |
unlikely |
unlikely |
unlikely |
unlikely |
|
Granger, 2011 |
See NEJM.org |
unlikely |
unlikely |
unclear |
unlikely |
unlikely |
unlikely |
unlikely |
|
Patel, 2011 |
Randomization was performed with the use of a central 24-hour, computerized, automated voice-response system. A point-of-care device was used to generate encrypted values that were sent to an independent study monitor, who provided sites with either real INR values (for patients in the warfarin group in order to adjust the dose) or sham values (for patients in the rivaroxaban group receiving placebo warfarin) during the course of the trial. Sham INR results were generated by means of a validated algorithm reflecting the distribution of values in warfarin-treated patients with characteristics similar to those in the study population. |
unlikely |
unlikely |
unlikely/likely |
unclear |
unlikely |
unlikely |
unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has soft (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 26-10-2017
Beoordeeld op geldigheid : 12-09-2024
De ontwikkelingen op het gebied van de acute opvang, secundaire preventie en revalidatie volgen elkaar in steeds sneller tempo op. Daarom werd in 2018 een kerngroep van neurologen, revalidatiearts en huisarts geïnstalleerd om snel op nieuwe ontwikkelingen te kunnen inspelen. In 2018 werden de modules over plaatjesaggregatieremmers en Directe Orale Anticoagulantia geupdate en nieuwe modules over tenecteplase en endovasculaire behandeling ontwikkeld. In 2019 wordt opnieuw geprioriteerd welke wijzigingen nodig zijn.
Deze kerngroep vergadert tenminste tweemaal per jaar om op basis van eigen inzichten en/of signalen uit het veld te beoordelen of hernieuwde aanvulling en/of revisie van (onderdelen van) de richtlijn gewenst is. Andere disciplines namen zitting in een klankbordgroep en worden betrokken afhankelijk van het onderwerp van de te reviseren module.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Op sommige plaatsen in deze richtlijn wordt verwezen naar de richtlijn Beroerte uit 2008. Het hoofdstuk Verantwoording uit deze richtlijn is op te vragen bij de Nederlandse Vereniging voor Neurologie.
In samenwerking met:
Koninklijk Nederlands Genootschap voor Fysiotherapie
Nederlands Huisartsen Genootschap
Nederlands Instituut van Psychologen
Nederlandse Vereniging voor Logopedie & Foniatrie
Nederlandse Vereniging voor Klinische Neurofysiologie
Nederlandse Vereniging voor Spoedeisende Hulp Artsen
Verenso Vereniging van Specialisten Ouderengeneeskunde
Verpleegkundigen & Verzorgenden Nederland (Neuro/stroke verpleegkundigen en Ambulancezorg)
Nederlandse Vereniging voor Ergotherapie
Doel en doelgroep
Doel
Het doel van deze op wetenschappelijk bewijs gebaseerde (evidence based) richtlijn is het bieden van een basis voor optimale zorg voor patiënten met een herseninfarct of hersenbloeding. Daarnaast draagt de richtlijn bij aan afstemming van de zorg tussen de verschillende zorgverleners en aan het terugdringen van ongewenste praktijkvariatie.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met een herseninfarct of hersenbloeding.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met TIA, herseninfarct of hersenbloeding. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende drie jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- prof. dr. D.W.J. Dippel (voorzitter), neuroloog, Erasmus MC Rotterdam, namens de Nederlandse Vereniging voor Neurologie (NVN)
- dr. H.B. van der Worp, neuroloog, UMC Utrecht, namens de NVN
- dr. J. Hofmeijer, neuroloog, Rijnstate ziekenhuis Arnhem, namens de NVN
- dr. R.M. van den Berg-Vos, neuroloog, OLVG West Amsterdam, namens de NVN
- dr. E.J. van Dijk, neuroloog, Radboudumc Nijmegen, namens de NVN
- M. Geurts, AIOS neurologie, UMC Utrecht, namens de NVN en de Vereniging Arts-Assistenten in opleiding tot Neuroloog (VAAN)
- prof. Dr. W. Mess, neuroloog/klinisch neurofysioloog, Maastricht UMC, namens de NVN
- dr. L.M.L. de Lau, neuroloog, Slotervaartziekenhuis Amsterdam, namens de NVN
- M. Kouwenhoven, revalidatiearts, De Hoogstraat Utrecht, namens de Nederlandse Vereniging van Revalidatiearsten (VRA)
- dr. B.J. Bouma, cardioloog, AMC Amsterdam, namens de Nederlandse Vereniging voor Cardiologie (NVvC)
- prof. dr. G.J. de Borst, vaatchirurg, UMC Utrecht, namens de Nederlandse Verenging voor Vaatchirurgie (NVvV)/Nederlandse Vereniging voor Heelkunde (NVvH)
- dr. J.A.H.R. Claassen, klinisch geriater, Radboudumc Nijmegen, namens de Nederlandse Vereniging voor Klinische Geriatrie (NVKG)
- dr. M. van Eijk, specialist ouderengeneeskunde, LUMC Leiden, namens Verenso Vereniging van Specialisten Ouderengeneeskunde
- dr. B.J.H. van den Born, internist, AMC Amsterdam, namens de Nederlandse Internisten Vereniging (NIV)/ Internistisch Vasculair Genootschap (IVG)
- dr. H.D. Boogaarts, neurochirurg, Radboudumc Nijmegen, namens de Nederlandse Vereniging voor Neurochirurgie (NVvN)
- dr. W. van Zwam, radioloog, Maastricht UMC, namens de Nederlandse Vereniging voor Radiologie (NVvR)
- I. Brummer, SEH-arts, Scheper ziekenhuis Emmen, namens de Nederlandse Vereniging van Spoedeisende Hulp Artsen (NVSHA)
- prof. dr. G. Kwakkel, hoogleraar neurorevalidatie, Vrije Universiteit Amsterdam, namens het Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF)
- A.F.E. Verburg, huisarts, namens het Nederlands Huisartsen Genootschap (NHG)
- K. Kanselaar, MANP, verpleegkundig specialist vasculaire neurologie Radboudumc Nijmegen, namens Verpleegkundigen & Verzorgenden Nederland (V&VN) afdeling Neuro & Revalidatie, werkgroep CVA
- G.J. Deddens, Verpleegkundig Specialist Acute Zorg, namens V&VN afdeling Ambulancezorg
- prof. dr. C.M. van Heugten, hoogleraar klinische neuropsychologie, Maastricht University, namens het Nederlands Instituut van Psychologen (NIP) sectie neuropsychologie.
- dr. S.K. Schiemanck, revalidatiearts, Leiden UMC, namens de VRA
- A. Harbers, klinisch linguist en logopediste, Klimmendaal, namens Nederlandse Vereniging voor Logopedie en Foniatrie (NVLF)
Met medewerking van
- dr. P.J. Nederkoorn, neuroloog, Academisch Medisch Centrum, Amsterdam
- dr. E. Steultjens, Hogeschool van Arnhem en Nijmegen, namens Ergotherapie Nederland
- E. van Gorp, namens de Patiëntenvereniging Hersenletsel.nl
- dr. R.H. Wimmers, namens de Hartstichting
- Ir. K. Idema, namens de Hart&Vaatgroep
Met ondersteuning van
- dr. M. Molag, adviseur, Kennisinstituut van Medisch Specialisten
- dr. I. Mostovaya, adviseur, Kennisinstituut van Medisch Specialisten
- dr. M. A. Pols, senior adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen door middel van reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten, een overzicht vindt u hieronder.
|
Werkgroeplid |
Functie |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
|
Berg-Vos |
Neuroloog |
Geen |
Geen |
Bestuurslid kennisnetwerk CVA |
Geen |
Geen |
Geen |
|
Boogaarts |
Neurochirurg |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Born |
Internist-vasculair geneeskundige |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Borst |
Vaatchirurg |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Bouma |
Cardioloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Brummer |
SEH-arts |
Geen |
Geen |
Lid richtlijnencommissie NVSHA |
Geen |
Geen |
Geen |
|
Claassen |
Klinisch geriater (0,6 fte) |
Geen |
Geen |
Geen |
Onderzoeksleider van 3 onderzoeksprojecten, (mede)gefinancierd door het onderzoeksfonds van Alzheimer Nederland (patiëntenvereniging), en 1 project gefinancierd door ISAO (Alzheimerfonds) |
Geen |
Mijn werkgever (Radboudumc) heeft financiele vergoedingen ontvangen van bedrijven (farmaceutische industrie) voor presentaties die ik op uitnodiging van die bedrijven heb gegeven, of voor symposia die ik voor die brdrijven heb (nede)georganiseerd. De vergoeding betrof steeds een vergoeding voor de gewerkte uren. |
|
Deddens |
Verpleegkundige Specialist Acute Zorg en Ambulanceverpleegkundige |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Dippel |
Neuroloog, hoogleraar acute behandeling neurovasculaire aandoeningen |
Geen |
Geen |
Niet van toepassing |
Het MR CLEAN onderzoek (www.mrclean-trial.org) wordt in geringe mate (10%) zonder voorwaarden gesteund door enkele medische industriën en importeurs. Deze staan vermeld op de website. Ik ben een van de hoofdonderzoekers van deze trial. |
Geen |
Geen |
|
Geurts |
AIOS neurologie |
Geen |
Geen |
Geen |
M. Geurts is studie-coordinator van de COOLing for Ischaemic Stroke Trial (COOLIST), dat wordt gefinancierd door de Nederlandse Hartstichting (2010B239). |
Geen |
Geen |
|
Harbers |
Logopediste & Klinisch Linguist |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Hofmeijer |
Neuroloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Kanselaar-Martens |
Verpleegkunde specialist Radboudumc |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Kwakkel |
Hoogleraar Neurorevalidatie |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Schiemanck |
Revalidatiearts Tot 31-12-2014: AMC ; Medisch Leidinggevende Neuroteam, AMC; Consulent Revalidatiegeneeskunde aan Zorgcentrum Berkenstede, Stichting Cordaan, Diemen, sinds 01-07-2006, Heden: subafdelingshoofd Leids Universitair Medisch Centrum |
Geen |
Geen |
Geen |
* Onderzoeksproject ism Radboudumc Efficacy of functional electrical stimulation of the peroneal nerve with the Actigait system on walking efficiency and patient satisfaction in stroke patients suffering from a drop foot, 2007-2014; studie is afgerond; financiering door Otto Bock Healthcare |
Geen |
Geen |
|
Spruit-Van Eijk |
Specialist Ouderengeneeskunde en UD PHEG |
Geen |
Geen |
Geen |
2007 - 2012 GRAMPS studie gefinancierd door 2 grote zorginstanties de Zorgboog en SVRZ, zorgt in Zeeland |
Geen |
Geen |
|
Van den Born |
internist |
Geen |
Geen |
Bestuurslid van de Nederlandse Hypertensievereniging |
Geen |
Geen |
Geen |
|
Van Dijk |
Neuroloog |
Geen |
Geen |
Bestuurslid Stafconvent Radboudumc: betaald |
Onderzoek naar effectiviteit en veiligheid DOACs in Nederland (gefinancierd door GGG-ZonMw / VWS): 110Keuro |
Geen |
Geen |
|
Van Heugten |
Psycholoog, hoogleraar Klinisch Neuropsychologie |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Verburg |
Wetenschappelijk medewerker en |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Zwam |
Radioloog |
Geen |
Geen |
Geen |
Stuurgroeplid MrClean studie |
Geen |
Geen |
Meelezers
|
Werkgroeplid |
Functie |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
|
Idema |
Beleidsadviseur (De Hart&Vaatgroep) |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Kouwenhoven |
Revalidatiearts |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Steultjens |
ass. Lector Neurorevalidatie |
Geen |
Geen |
lid raad van advies Ergotherapie Nederland |
Geen |
eigen onderneming gericht op bijscholing aan ergotherapeuten m.b.t. twee specifieke methoden van diagnostiek en interventie ook toepasbaar bij cliënten na bereorte. Scholing is niet gericht op toepassing multi-disciplinaire richtlijnen |
Geen |
|
Van Gorp-Clion |
Tot 1 juli 2014 Voorzitter, daarna bestuurslid |
Geen |
Doelgroep/ achterban van de patiëntenvereniging |
Belangen van CVA-patiënten bij de patiëntenorganisatie |
Geen |
Geen |
Geen |
|
Wielemaker |
Hoofd patiëntenzorg Hersenstichting Nederland |
Geen |
Geen |
Geen |
Geen deelname aan onderzoek. Ben zelf werkzaam bij een gezondheidsfonds, de Hersenstichting verleent wel subsidie aan wetenschappelijk onderzoek. |
Geen |
De Hersenstichting heeft een puur faciliterende rol als het gaat om ontwikkeling van bijvoorbeeld een zorgstandaard, zoals nu de zorgstandaard Traumatisch Hersenletsel. Zij heeft het zorgveld de opdracht gegeven een dergelijke zorgstandaard te ontwikkelen en stelt daarvoor de middelen ter beschikking. Meer informatie op www.zorgstandaardnah.nl |
|
Wimmers |
Teammanager Kennis & Trends, Hartstichting |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het raadplegen van afgevaardigden van de patiëntenvereniging hersenletsel.nl, de Hartstichting en de Hart&Vaatgroep. Deze partijen werden ook uitgenodigd om tijdens de invitational conference de door hen ervaren knelpunten aan te dragen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan deze partijen.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit (www.demedischspecialist.nl/richtlijnen). Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreetrust.org) dat een internationaal breed geaccepteerd instrument is en op Richtlijnen voor richtlijnen voor de beoordeling van de kwaliteit van richtlijnen (www.zorginstituutnederland.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Achmea en VGZ namens Zorgverzekeraars Nederland, het College voor Zorgverzekeringen (tegenwoordig Zorginstituut Nederland), de Inspectie voor de Gezondheidszorg, CVA Patiëntenvereniging Hersenletsel.nl, de Hart&Vaatgroep en de Hartstichting, via een invitational conference.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken, waarna de definitieve uitgangsvragen werden vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk en onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt inhoudt.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen, via de websites van enkele grote organisaties, zoals de American Heart Association en de European Stroke Organization. Tevens werd in de tijdschriften Stroke en Int J Stroke gezocht naar richtlijnen. Vervolgens werd op de website van de Cochrane Library gezocht naar systematische reviews. Tot slot werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases (NLM Pubmed, Google Scholar, Embase, Cochrane Library). De zoektermen werden geformuleerd aan de hand van een searchvraag. De searchvraag werd vertaald in een PICO (patient, intervention, control, outcome). Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepsleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in het hoofdstuk van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van vertrouwen in de literatuurconclusie (zie http://www.guidelinedevelopment.org/handbook/).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden.
Formuleren van de conclusies
Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusies, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt deze getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen door de werkgroep en beschreven in de literatuursamenvatting.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld binnen de clinical audit van de NVN om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de paragraaf Kennislacunes behorend bij elke module.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
