Behandeling na 4,5 uur of als het begintijdstip onbekend is bij acuut herseninfarct
Uitgangsvraag
Welke patiënten met een acuut herseninfarct hebben baat bij intraveneuze trombolyse met alteplase?
De uitgangsvraag omvat de volgende deelvragen:
- Wat is het effect van alteplase bij behandeling binnen 4,5 uur na ontstaan van de verschijnselen?
- Wat is het effect van alteplase bij behandeling later dan 4,5 uur na ontstaan van de verschijnselen of als het begintijdstip niet bekend is, bij patiënten geselecteerd met aanvullende beeldvorming?
In deze module wordt deelvraag 2 behandeld.
Aanbeveling
Behandel patiënten bij wie de behandeling pas na 4,5 uur kan worden gestart of met een onduidelijk begintijdstip van de klachten, maar “last seen well” meer dan 4,5 uur geleden (bijvoorbeeld omdat de verschijnselen pas bij ontwaken werden ontdekt) met intraveneuze alteplase op voorwaarde dat:
- behandeling binnen 12 uur na “last seen well” of begin van de verschijnselen kan worden gestart; en
- de veronderstelde infarctkern kleiner is dan 25 ml en de penumbra minstens zo groot is als de infarctkern, vastgesteld met MRI of CT perfusie, óf een DWI/FLAIR mismatch op MRI. Dit laatste criterium geldt ook voor patiënten met een lacunair syndroom zonder CT perfusie afwijkingen.
Dosering van alteplase en contra-indicaties zijn gelijk als bij behandeling binnen 4,5 uur.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Patiënten met een herseninfarct die worden behandeld met alteplase binnen het tijdvenster van 4,5 uur tot 9 uur na het begin van de verschijnselen, die voldoen aan de strenge gekwantificeerde selectiecriteria op het gebied van aanvullende beeldvorming (CT of MRI perfusie), hebben betere functionele uitkomsten dan patienten die geen alteplase krijgen. Patiënten met een herseninfarct bij wie het moment waarop ze voor het laatst goed gezien waren meer dan 4,5 uur geleden is en het aanvangstijd van de symptomen onbekend is, die voldoen aan de strenge gekwantificeerde selectiecriteria op het gebied van aanvullende beeldvorming (CT of MRI perfusie of MRI DWI/FLAIR mismatch), hebben betere functionele uitkomsten dan patiënten die niet zijn behandeld met alteplase. Deze verbeteringen waren klinisch relevant.
Behandeling met alteplase bij patienten met een onbekend aanvangstijdstip van de klachten is geassocieerd op met een hogere kans op overlijden binnen 3 maanden. Wanneer echter de uitkomst overlijden samen met een afhankelijke functionele uitkomst werd bekeken (mRS 3-6) dan was behandeling met alteplase geassocieerd met betere uitkomsten. Bij patienten met een bekend aanvangstijdstip (behandeling binnen 4,5 tot 9 uur) is de associatie met een hogere kans op overlijden niet significant. De bewijskracht hiervoor is laag. Net als in de groep patiënten die binnen 4,5 uur wordt behandeld, is een ernstige bijwerking van alteplase het optreden van een symptomatische intracraniële bloeding. Volgens de werkgroep weegt het gunstige effect van de behandeling sterk op tegen de nadelen. Dit komt ook tot uiting in de bewezen klinisch relevante gunstige effecten op de samengestelde uitkomst (vrijwel) volledig herstel en de uitkomst overlijden of afhankelijkheid.
Operationalisatie van de verschillende tijdsvensters
De studies die het effect van alteplase onderzochten bij patiënten in het late tijdsvenster met een bekend aanvangstijdstip hanteerden 9 uur sinds ontstaan van symptomen als bovengrens (Campbell 2019). De studies die zich richtten op patiënten met een ‘last seen well’ tijdstip van >4,5 uur maar onbekend aanvangstijdstip (‘wake-up strokes’) hanteerden geen bovengrens. In de studies die werden geïncludeerd in de meta-analyse van Thomalla (2020) was de mediane tijd tussen ‘last seen well’ en start van alteplase 10,6 uur. De p75 lag op 12,4 uur wat betekent dat 25% van de patiënten een tijd tussen ‘last seen well’ en start behandeling van meer dan 12 uur had. Een nog ongepubliceerde post-hoc analyse van de WAKE-UP trial liet echter zien dat het positieve effect van alteplase mogelijk niet geldt voor patiënten die >12 uur na ‘last seen well’ zijn behandeld. De effectschatting in deze subgroep was namelijk neutraal. Overigens was de test voor interactie niet significant. Alhoewel deze bevindingen dus voorzichtig moet worden geïnterpreteerd, lijkt het erop dat het positieve behandeleffect in de WAKE-UP trial vooral gedreven werd door patiënten behandeld <12 uur na ‘last seen well’.
Het is bekend dat het in het acute stadium vaak lastig is om het precieze aanvangstijdstip van de klachten vast te stellen of zelfs om te bepalen of het aanvangstijdstip bekend of onbekend is. Bovendien is het noodzakelijk om lokale en regionale afspraken te maken over binnen welk tijdsvenster na ‘last seen well’ patiënten met een mogelijke beroerte met de hoogste urgentie naar een ziekenhuis moeten worden vervoerd en spoedeisende diagnostiek dienen te ondergaan. Daarom adviseert de werkgroep als handvat voor de praktijk om 12 uur na het bekende aanvangstijdstip óf het moment van ‘last seen well’ als uniforme bovengrens te hanteren. Echter, o.b.v. bovengenoemde trialresultaten kan worden overwogen deze bovengrens niet in alle gevallen strikt te hanteren. In gevallen waarbij deze bovengrens van 12 uur wordt overschreden én er een acute MRI gemaakt kan worden waarop een MRI/FLAIR-mismatch wordt vastgesteld, kan alsnog worden overwogen de patiënt toch met alteplase te behandelen.
Rol van imaging
De studies die zich richtten op patienten met een bekend aanvangstijdstip (4,5 tot 9 uur) gebruikten CT of MRI perfusie voor de selectie van patiënten. De inclusiecriteria van de EXTEND-studie vermelden de vaak gebruikte ondergrens van 10 ml voor mismatch (het verschil in volume tussen infarct kern en het totale gebied met perfusieafwijking) en een bovengrens van 70 ml voor de (veronderstelde) infarctkern. De infarctkern werd gedefinieerd als een relatieve CBF <30% in vergelijking met normaal hersenweefsel, of het volume van de DWI afwijking op MRI. Echter, de karakteristieken van de daadwerkelijk geïncludeerde patiënten waren beduidend anders dan deze inclusiecriteria. De omvang van de veronderstelde infarctkern bedroeg in de meta-analyse van Campbell (2019) (waarin EXTEND de grootste trial was) namelijk mediaan 8 ml (IQR 0 tot 25ml) en het gebied met perfusieafwijking 64 ml (IQR 28 tot 117ml), wat duidt op een veel grotere “mismatch” en een veel kleinere infarctkern bij de geïncludeerde patiënten dan de inclusiecriteria suggereren. De werkgroep heeft de aanbevelingen voor de te hanteren grenzen van infarctkern en “mismatch” hierop gebaseerd, rekening houdend met de aanbevelingen en criteria voor aanvullende beeldvorming bij late trombectomie (zie module ‘endovasculaire trombectomie bij herseninfarct’).
De studies die zich richtten op patiënten met een tijstip van ‘last seen well’ van >4,5 uur geleden en een onbekend aanvangstijdstip gebruikten MRI DWI/FLAIR mismatch (WAKE-UP, THAWS), MRI perfusie-diffusie (ECASS4-EXTEND, EXTEND (12%)) of CT-perfusie (EXTEND (88%)). Op basis van de gepubliceerde resultaten lijken alle drie de modaliteiten equivalent. De werkgroep adviseert lokaal een keuze te maken voor een modaliteit waarvoor het praktisch haalbaar is om die 24/7 beschikbaar te hebben. De werkgroep merkt op dat bij patiënten met een klinisch lacunair syndroom bij wie een CT-perfusie wordt gemaakt die normaal blijkt alsnog een MRI kan worden overwogen, zodat bij een DWI/FLAIR mismatch alsnog kan worden behandeld.
Kosten (middelenbeslag)
Gezien de grootte van de effecten van behandeling (vergelijkbaar met IV trombolyse in het vroege tijdvenster) en de relatief geringe meerkosten ten opzichte van het zeer kosteneffectieve beleid bij patiënten die binnen 4,5 worden behandeld met trombolyse, is er geen reden voor zorg op dit gebied.
Aanvaardbaarheid, haalbaarheid en implementatie
- In de meeste centra zal CT/CTA/CT-perfusie als eerste keus worden verricht bij patiënten met laat of onbekend tijdstip van ontstaan. Dit heeft te maken met de ervaring die de meeste centra hebben met CT bij deze categorie patiënten en het de feit dat het maken van een acute MRI is in veel centra praktisch lastiger is te realiseren.
- Omdat nu bij geselecteerde patiënten in primaire stroke centra ook in het late tijdvenster met trombolytica kan worden behandeld, zal ook de CTP daar moeten gebeuren.
- Er zijn verschillende softwarepakketten, sommige platformafhankelijk, andere onafhankelijk. Er zijn voldoende aanwijzingen dat de meeste softwarepakketten voor de kleine “veronderstelde infarctkern” een goed overeenkomende volumeschatting geven.
- Ongeveer 2/3 van de patiënten in deze trials hadden een “large vessel occlusion,” en velen kunnen ook in aanmerking komen voor trombectomie. De CTP criteria voor trombectomie en trombolyse in het late tijdvenster komen nu overeen.
- Alhoewel door sommigen wordt gesuggereerd dat meting van het volume van de (veronderstelde) infarctkern en penumbra onnodig is, en een visuele inschatting van het volume voldoende is (“eyeballing”) adviseert de werkgroep daar tegen. Met name het risico van bloeding neemt toe met grootte van de infarctkern, en belangrijke reden om zo precies mogelijk te zijn in het vaststellen van de indicatie op grond van beeldvorming. Het gaat dus om computer gesteunde analyse aangevuld met visuele beoordeling, waarbij deze met elkaar in overeenstemming moeten zijn voor behandelbeslissingen.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
- De resultaten van de studies die behandeling met trombolytica in het late tijdvenster, dan wel bij ontwaken onderzochten, zijn geheel in lijn met soortgelijke resultaten bij patiënten die endovasculair werden behandeld. Ook de aanwijzingen voor toename van bloedingen en mortaliteit passen bij onze inzichten in het werkingsmechanisme van alteplase. Deze negatieve effecten vallen weg als naar relevante gecombineerde uitkomsten wordt gekeken.
- De aanbeveling is sterk. Het gaat om een behandeling die patiënten kan behoeden voor een verder leven met een ernstige handicap. Omdat de behandeling kan worden toegepast door neurologen in alle ziekenhuizen met een spoedeisende hulp, kunnen erg veel patiënten baat hebben en past een universele toepassing en implementatie in Nederland. Zie ook de module Organisatie van zorg, informatievoorziening en informatieoverdracht.
Onderbouwing
Achtergrond
Behandeling van herseninfarct patiënten met alteplase binnen 4,5 uur na het optreden van de verschijnselen is standaardbeleid in Nederland. Binnen dit vroege tijdvenster kan de indicatie worden gesteld op anamnese, neurologisch onderzoek en CT-hersenen zonder contrast.
Twintig tot 25% van de herseninfarcten ontstaan tijdens slaap. Als de patiënt langer dan viereneenhalf uur voordat kan worden behandeld voor het laatst wakker en zonder klachten is geweest, bestaat er een contra-indicatie voor trombolyse zie criteria uit deelvraag 1 (module 'Behandeling binnen 4,5 uur'). In enkele kleine observationele studies bleek trombolyse bij patiënten die de uitvalsverschijnselen voor het eerst bij het ontwaken uit slaap hadden ontdekt én die voldeden aan specifieke CT- of MRI-criteria niet gepaard te gaan met een grote kans op complicaties (Morelli, 2015; Barreto, 2016). Of de voordelen groter waren dan de nadelen bleef echter onzeker.
Aanleiding voor het toevoegen van dit extra deel aan de module waren enkele publicaties van gerandomiseerde klinische trials, die een gunstig effect beschrijven van alteplasebehandeling buiten dit tijdvenster bij herseninfarct-patiënten die zijn geselecteerd met behulp van meer geavanceerde beeldvormende technieken. Hierbij gaat het dus om patiënten die meer dan 4,5 uur geleden de eerste symptomen vertoonden, en om patiënten met een onbekend tijdstip van ontstaan van de klachten, waarbij in ieder geval niet zeker is dat de klachten korter dan 4,5 uur geleden zijn ontstaan (Thomalla, 2018; Ma, 2019; Campbell, 2019).
Conclusies / Summary of Findings
Onafhankelijk functioneren (mRS 0 tot 2); bekend aanvangstijdstip symptomen tussen 4,5 en 9 uur
|
Redelijk GRADE |
Bij patiënten met een herseninfarct met een bekend aanvangstijdstip van de symptomen dat ligt tussen de 4,5 en 9 uur vóór start van de reperfusiebehandeling en die zijn geselecteerd met behulp van geavanceerde beeldvorming (perfusie CT of MRI) vergroot behandeling met alteplase waarschijnlijk de kans op herstel tot onafhankelijk functioneren.
Bron: Campbell 2019 |
Onafhankelijk functioneren (mRS 0 tot 2); Onbekend aanvangsttijdstip
|
Redelijk GRADE |
Bij patiënten met een herseninfarct >4,5 uur na last seen well maar met een onbekend aanvangstijdstip van de symptomen die zijn geselecteerd met behulp van geavanceerde beeldvorming (perfusie CT of MRI of MRI DWI/FLAIR mismatch) vergroot behandeling met alteplase waarschijnlijk de kans op herstel tot onafhankelijk functioneren.
Bron: Thomalla 2020 |
(Vrijwel volledig) herstel (mRS 0 of 1); bekend aanvangstijdstip symptomen tussen 4,5 en 9 uur
|
Redelijk GRADE |
Bij patiënten met een herseninfarct met een bekend aanvangstijdstip van de symptomen dat ligt tussen de 4,5 en 9 uur vóór start van de reperfusiebehandeling en die zijn geselecteerd met behulp van geavanceerde beeldvorming (perfusie CT of MRI) vergroot behandeling met alteplase waarschijnlijk de kans op (vrijwel) volledig herstel.
Bron: Campbell 2019 |
(Vrijwel volledig) herstel (mRS 0 of 1); onbekend aanvangsttijdstip
|
Redelijk GRADE |
Bij patiënten met een herseninfarct >4,5 uur na last seen well maar met een onbekend aanvangstijdstip die zijn geselecteerd met behulp van geavanceerde beeldvorming (perfusie CT of MRI of MRI DWI/FLAIR mismatch) vergroot behandeling met alteplase waarschijnlijk de kans op (vrijwel) volledig herstel.
Bron: Thomalla 2020 |
Symptomatische (inclusief fatale) intracraniële bloedingen
|
Laag GRADE |
Bij patiënten met een herseninfarct en met een onbekend aanvangstijdstip (>4,5 uur na last seen well) die zijn geselecteerd met behulp van geavanceerde beeldvorming (perfusie CT of MRI of MRI DWI/FLAIR mismatch) vergroot behandeling met alteplase mogelijk de kans op symptomatische (inclusief fatale) intracraniële bloedingen.
Bronnen: Campbell 2019, Thomalla 2020 |
Overlijden tijdens follow-up; bekend aanvangstijdstip symptomen tussen 4,5 en 9 uur
|
Laag GRADE |
Bij patiënten met een herseninfarct met een bekend aanvangstijdstip van de symptomen dat ligt tussen de 4,5 en 9 uur vóór start van de reperfusiebehandeling en die zijn geselecteerd met behulp van geavanceerde beeldvorming (perfusie CT of MRI) is de kans op overlijden binnen 3 maanden mogelijk niet verhoogd bij patiënten die worden behandeld met alteplase in vergelijking met placebo.
Bron: Campbell 2019 |
Overlijden tijdens follow-up; onbekend aanvangstijdstip
|
Laag GRADE |
Bij patiënten met een herseninfarct met een onbekend aanvangstijdstip die zijn geselecteerd met behulp van geavanceerde beeldvorming (perfusie CT of MRI of MRI DWI/FLAIR mismatch) vergroot behandeling met alteplase mogelijk de kans op overlijden binnen 3 maanden.
Bron: Thomalla 2020 |
Samenvatting literatuur
Beschrijving studies
De werkgroep maakte onderscheid tussen patiënten met een bekend aanvangstijdstip waarbij behandeling mogelijk was tussen 4,5 tot 9 uur na ontstaan van de symptomen en patiënten met onbekend aanvangstijdstip van symptomen.
Behandeling tussen 4,5 en 9 uur na ontstaan symptomen (bekend aanvangstijdstip)
In 2019 verscheen een meta-analyse van gerandomiseerde trials (Campbell 2019), gericht op patiënten die meer dan 4,5 uur na het begin van de symptomen (bekend aanvangstijdstip) óf bij het ontwaken (onbekend aanvangstijdstip) waren geselecteerd met geavanceerde beeldvorming en vervolgens behandeld met alteplase of placebo. Campbell verrichte systematisch literatuuronderzoek in Pubmed naar RCT’s gepubliceerd tussen 1 januari 2006 en 1 maart 2019. De geavanceerde beeldvorming bestond uit CT-perfusie of perfusie-diffusie MRI. De primaire uitkomst was excellente functionele uitkomst (mRS score 0 tot 1 terugkeer naar alle gebruikelijke activiteiten) na 90 dagen. Het geschatte behandeleffect werd geadjusteerd voor de ernst van de neurologische uitval vóór de behandeling (NIHSS-score) en leeftijd. Secundaire uitkomsten waren functionele verbetering (≥ 1 punt reductie in mRS score (ordinale shift analyse)), met mRS categorieën 5 en 6 samengevoegd, na drie maanden en vroege neurologische verbetering (reductie van ≥ 8 punten op NIHSS of behalen NIHSS-score 0 tot 1) na 72 uur. Veiligheidsuitkomsten waren symptomatische intracraniële bloeding binnen 36 uur na behandeling, gecombineerd met neurologische achteruitgang van vier of meer NIHSS-punten of sterfte. In deze meta-analyse werden drie RCT’s geïncludeerd: EXTEND (Ma 2019) met 225 patiënten (vroegtijdig afgebroken wegens verlies van equipoise), ECASS4-EXTEND (Ringleb 2019) met 116 patiënten (vroegtijdig afgebroken wegens trage inclusie) en EPITHET (Davis 2008) met 101 patiënten behandeld 3,0 tot 6,0 uur na het aanvangstijdstip (waarvan 69 waren behandeld 4,5 tot 6,0 uur na het herseninfarct; alleen deze patiënten werden geïncludeerd in de meta-analyse). In totaal werden 414 patiënten in deze meta-analyse geïncludeerd. De resultaten werden gestratificeerd weergegeven voor verschillende subgroepen: (1) patienten behandeld tussen 4,5 en 6 uur na het bekende aanvangstijdstip, (2) patienten behandeld tussen 6,0 en 9,0 uur na het bekende aanvangstijdstip, en (3) patienten die wakker waren geworden met symptomen (onbekend aanvangstijdstip). De werkgroep heeft de resulaten van subgroepen (1) en (2) t.b.v. deze module gepooled.
Onbekend aanvangstijdstip
In 2020 verscheen een meta-analyse van gerandomiseerde trials (Thomalla 2020), gericht op patiënten met een onbekend aanvangstijdstip van de symptomen die waren geselecteerd met geavanceerde beeldvorming en behandeld met alteplase of placebo/standaardzorg. Thomalla verrichte systematisch literatuuronderzoek in Pubmed naar RCT’s gepubliceerd vanaf het begin tot en met 21 september 2020. Inclusiecriteria waren RCT’s die trombolyse met alteplase vergeleken met placebo of standaardzorg bij patiënten met een herseninfarct bij een onbekend aanvangsttijdstip van de symptomen. Geavanceerde beeldvorming bestond uit CT-perfusie, perfusie-diffusie MRI of de op MRI-gebaseerde “weefselklok” (DWI/FLAIR mismatch). Alleen studies met minstens 20 patiënten werden geïncludeerd. De primaire uitkomst was excellente functionele uitkomst (mRS score 0 tot 1, terugkeer naar alle gebruikelijke activiteiten) 90 dagen na het herseninfarct. Het geschatte behandeleffect werd geadjusteerd voor ernst van de aandoening vóór de behandeling (NIHSS-score) en leeftijd. Secundaire uitkomsten waren functionele verbetering op de gehele mRS schaal (≥ 1 punt reductie in mRS score (ordinale shift analyse)) op 90 dagen en herstel tot functionele onafhankelijkheid (mRS score 0 tot 2) op 90 dagen. Veiligheidsuitkomsten waren sterfte, ernstige afhankelijkheid of sterfte (mRS 4-6), symptomatische intracraniële bloeding volgens de Safe Implementation of Thrombolysis in Stroke Monitoring Study (SITS-MOST) en radiologisch gedefinieerde parenchymale bloeding type 2.
In deze meta-analyse werden vier RCT’s geïncludeerd: EXTEND (Ma 2019) met 225 patiënten (vroegtijdig afgebroken wegens verlies van equipoise), ECASS4-EXTEND (Ringleb 2019) met 116 patiënten (vroegtijdig afgebroken wegens trage inclusie), WAKE-UP (Thomalla 2019) met 503 patiënten (vroegtijdig afgebroken voor volledige inclusie wegens gebrek aan fondsen), en THAWS (Koga 2020) met 131 patiënten (vroegtijdig afgebroken wegens verlies van equipoise). Van EXTEND (n=146) en ECASS-4-EXTEND (n=63) werden alleen patienten geincludeerd van wie het aanvangstijdstip onbekend was. In totaal werden 843 individuele patiënten in deze meta-analyse geïncludeerd. De duur van “last seen well” tot start behandeling was mediaan 10,6 uur (IQR 8,6 tot 12,4 uur) in de alteplasegroep en 10,5 uur (IQR 8,4 tot 12,3 uur) in de controlegroep.
Resultaten
Behandeling tussen 4,5 en 9 uur na ontstaan symptomen (bekend aanvangstijdstip)
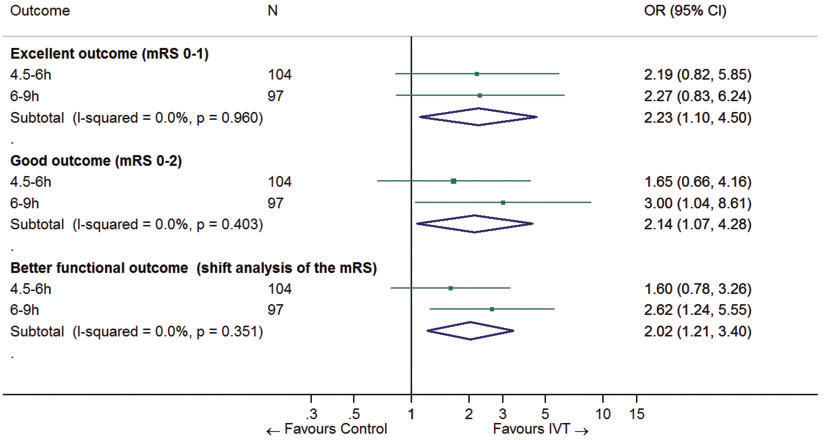
Figuur: Gepoolde geadjusteerde odds ratios voor excellente uitkomst (mRS 0-1), goede uitkomst (mRS 0-2) en een betere functionele uitkomst (gebaseerd op ordinale shift analyse) bij patiënten met een herseninfarct 4,5 tot 9 uur na ontstaan van de symptomen. Bron: Campbell (2019).
Cruciale uitkomstmaten
Onafhankelijk functioneren (mRS 0 tot 2)
De subgroepanalyse van patiënten met een bekend aanvangstijdstip (behandeling tussen 4,5 en 9 uur na ontstaan symptomen) in de meta-analyse van Campbell (2019) liet zien dat 27 van de 57 patiënten (47%) behandeld met alteplase en 20 van de 47 (43%) behandeld met placebo functioneel onafhankelijk waren (mRS 0 tot 2) na 3 maanden. Dit geeft een aOR van 2,14 (95% BI (1,07 tot 4,26)). Dit verschil in risico is klinisch relevant.
Belangrijke uitkomsten
Functionele uitkomst: (Vrijwel) volledig herstel (mRS 0 of 1)
De subgroepanalyse van patiënten met een bekend aanvangstijdstip (behandeling tussen 4,5 en 9 uur na ontstaan symptomen) in de meta-analyse van Campbell (2019) liet voor de uitkomst vrijwel volledig herstel (mRS 0 of 1) een geadjusteerde OR zien van 2,23 (95% BI 1,10 tot 4,50) ten faveure van alteplase in vergelijking met placebo. Dit verschil in risico is klinisch relevant.
Symptomatische intracraniële bloedingen
Over de uitkomst symptomatische intracraniële bloedingen in de subgroep patiënten met een bekend aanvangstijdstip die zijn behandeld tussen 4,5 en 9 uur na ontstaan symptomen werden in de meta-analyse van Campbell (2019) geen gegevens gerapporteerd. Het overall risico op symptomatische intracraniële bloedingen in de meta-analyse van Campbell (2019) was 5% (10/213) voor de patiënten behandeld met alteplase en <1% (1/201) voor de patiënten behandeld placebo (geadjusteerde OR 9,7 (95% BI 1,23-76,55). Hierin waren dus ook patiënten meegenomen die een onbekend aanvangstijdstip hadden.
Overlijden tijdens de follow-up
In de subgroep van patiënten met een bekend aanvangstijdstip (behandeling tussen 4,5 en 9 uur na ontstaan symptomen) overleden patiënten behandeld met alteplase vaker dan patiënten die placebo kregen (Campbell 2019). In de meta-analyse werden de volgende effectschattingen gerapporteerd:
4,5 tot 6 uur: aOR 1,49 (95% BI 0,48 tot 4,63) [N=107];
6 tot 9 uur: aOR 2,12 (95%BI 0,25 tot 17,58) [N=98].
Dit verschil in risico is klinisch relevant.
Onbekend aanvangstijdstip
Onafhankelijk functioneren (mRS 0 tot 2)
De meta-analyse van studies met patiënten met een onbekend aanvangstijdstip liet zien dat 273 van de 420 patiënten (65%) behandeld met alteplase en 239 van de 409 patienten (58%) in de controlegroep herstelden tot functionele onafhankelijkheid (mRS 0 tot 2 na 3 maanden; aOR 1,50 (95% BI 1,06 tot 2,12)) (Thomalla 2020). Dit verschil in risico is klinisch relevant.
(Vrijwel) volledig herstel (mRS 0 of 1)
Bij patiënten met een onbekend aanvangstijdstip werd een vrijwel volledig herstel gezien bij 199 van de 420 patiënten (47%) behandeld met alteplase en bij 160 van de 409 patiënten (39%) behandeld met controle (aOR 1,49 (95% BI (1,10 tot 2,03)) (Thomalla 2020). Dit verschil in risico is klinisch relevant.
Symptomatische intracraniële bloedingen
Bij patienten met een onbekend aanvangstijdstip werden 11 bloedingen gezien bij 429 patiënten (3%) behandeld met alteplase en 2 bij 414 patiënten (<1%) behandeld met controle (aOR 5,58 (95% BI 1,22 tot 25,5)) (Thomalla 2020). Dit verschil in risico is klinisch relevant.
Overlijden tijdens de follow-up
Van de patienten met een onbekend aanvangstijdstip overleden 27 van de 429 patiënten (6%) behandeld met alteplase versus 14 van de 414 (3%) behandeld met controle (aOR 2,06 (95% BI (1,03 tot 4,09)) (Thomalla 2020). Dit verschil in risico is klinisch relevant.
Bewijskracht van de literatuur
Onafhankelijk functioneren (mRS 0 of 2)
De bewijskracht voor de uitkomst onafhankelijk functioneren start hoog. Daarnaast werd met één niveau verlaagd naar redelijk wegens imprecisie (betrouwbaarheidsinterval overschrijdt de grens van klinische relevantie).
(Vrijwel) volledig herstel (mRS 0 of 1)
De bewijskracht voor de uitkomst functionele uitkomst: (vrijwel) volledig herstel start hoog. Deze werd met één niveau verlaagd naar redelijk wegens imprecisie (betrouwbaarheidsinterval overschrijdt de grens van klinische relevantie).
Symptomatische intracraniële bloeding
De bewijskracht voor symptomatische intracraniële bloedingen start hoog en werd met twee niveaus verlaagd naar laag wegens imprecisie (gering aantal events en een breed betrouwbaarheidsinterval dat de grens van klinische relevantie overschrijdt).
Overlijden tijdens follow-up
De bewijskracht voor de uitkomst overlijden tijdens follow-up start hoog en werd met twee niveaus verlaagd naar laag wegens imprecisie (gering aantal events en een breed betrouwbaarheidsinterval dat de grens van klinische relevantie overschrijdt).
Zoeken en selecteren
Om de uitgangsvraag (deelvraag 2) te kunnen beantwoorden is een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
P: patiënten met een acuut herseninfarct bij wie het in ieder geval niet zeker is dat de klachten korter dan 4,5 uur voor behandeling zijn ontstaan, met op aanvullende beeldvorming (MR DWI/FLAIR, of CT/MRI-perfusie) aanwijzingen voor nog reversibele focale ischemie;
I: standaardbehandeling met intraveneuze alteplase;
C: standaardbehandeling zonder alteplase;
O: functionele uitkomst: onafhankelijk functioneren, (vrijwel) volledig herstel; symptomatische (inclusief fatale) intracraniële bloedingen; overlijden tijdens follow-up.
Relevante uitkomstmaten
De werkgroep achtte ‘onafhankelijk functioneren’ cruciaal voor de besluitvorming. De werkgroep achtte de volgende uitkomstmaten belangrijk voor de besluitvorming: ’(vrijwel) volledig herstel, ‘symptomatische (inclusief fatale) intracraniële bloeding’ en ‘overlijden’.
- onafhankelijk functioneren: score op de mRS van 0 tot 2;
- (vrijwel) volledig herstel: score op de mRS van 0 of 1;
- symptomatische intracraniële bloeding: intracraniële bloeding die tot een (tijdelijke) toename van de neurologische verschijnselen leidt of tot overlijden (de precieze definities verschilden tussen de studies);
- overlijden binnen de studieperiode
Grenzen voor klinische relevantie
Gezien de ernst van de aandoening werd een OR van <0,8 of >1,25 beschouwd als klinisch relevant. Dit gold voor de uitkomsten ‘onafhankelijk functioneren’, ‘overleven zonder beperkingen’, ‘symptomatische intracraniële bloedingen’ en ‘overlijden’.
Zoeken en selecteren (Methode)
De conceptversie van deze tekst was gebaseerd op een gepubliceerde meta-analyse, met search tot en met maart 2019, gericht op bovenstaande PICO (Campbell 2019). Tijdens de commentaarronde verscheen echter een nieuwe meta-analyse met individuele patiëntendata met search t/m september 2020 (Thomalla 2020). In de definitieve versie van deze tekst werd de meta-analyse van Thomalla daarom toegevoegd. Er werd aanvullend naar systematic reviews en RCT’s gezocht vanaf de zoekdatum van die search (21 september 2020) t/m 12 april 2021 in de databases Embase.com en Ovid/Medline. Er werd gezocht op de elementen cva/stroke/herseninfarct EN alteplase. De zoekstrategie werd deels gebaseerd op eerdere reviews (Thomalla 2020, Campbell 2019 en Wardlaw 2014). De literatuurzoekactie leverde 332 unieke treffers op (zie zoekverantwoording).
Resultaten
In de meta-analyse van Campbell 2019 werden drie trials opgenomen: EXTEND (Ma 2019), ECASS4-EXTEND (Ringleb 2019) en EPITHET (Davis 2008). In de meta-analyse van Thomalla 2020 werden vier trials opgenomen: WAKE-UP (Thomalla 2018), EXTEND (Ma 2019), ECASS-4-EXTEND (Ringleb 2019) en THAWS (Koga 2020). De aanvullende literatuurzoekactie leverde geen aanvullende gepubliceerde trials op. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Amiri H, Bluhmki E, Bendszus M, et al. European Cooperative Acute Stroke Study-4: extending the time for thrombolysis in emergency neurological deficits ECASS-4: ExTEND. Int J Stroke 2016; 11: 260–67.
- Barow, E., et al., Functional Outcome of Intravenous Thrombolysis in Patients With Lacunar Infarcts in the WAKE-UP Trial. JAMA Neurol, 2019; 76: 641-649.
- Campbell BCV, Ma H, Ringleb PA, et al. EXTEND, ECASS-4, and EPITHET Investigators. Extending thrombolysis to 4·5-9 h and wake-up stroke using perfusion imaging: a systematic review and meta-analysis of individual patient data. Lancet. 2019 Jul 13;394(10193):139-147.
- Davis SM, Donnan GA, Parsons MW, et al. Effects of alteplase beyond 3 h after stroke in the Echoplanar Imaging Thrombolytic Evaluation Trial (EPITHET): a placebo-controlled randomised trial. Lancet Neurol 2008; 7: 299–309.
- Emberson J, Lees KR, Lyden P, et al. Effect of treatment delay, age, and stroke severity on the effects of intravenous thrombolysis with alteplase for acute ischaemic stroke: a meta-analysis of individual patient data from randomised trials. Lancet. 2014;384(9958):1929-35.
- Koga M, Yamamoto H, Inoue M, et al. Thrombolysis with alteplase at 0·6 mg/kg for stroke with unknown time of onset: a randomized controlled trial. Stroke 2020; 51: 1530–38
- Koopman MS, Berkhemer OA, Geuskens R, et al. Comparison of three commonly used ct perfusion software packages in patients with acute ischemic stroke. J Neurointerv Surg. 2019.
- Ma H, Parsons MW, Christensen S, et al. A multicentre, randomized, double blinded, placebo controlled phase 3 study to investigate EXtending the time for Thrombolysis in Emergency Neurological Deficits (EXTEND). Int J Stroke 2012; 7: 74–80.
- Ma H, Campbell BCV, Parsons MW, et al. Thrombolysis guided by perfusion imaging up to 9 hours after onset of stroke. N Engl J Med 2019; 380: 1795–803.
- Michel P, Ntaios G, Reichhart M, et al. Perfusion-CT guided intravenous thrombolysis in patients with unknown-onset stroke: A randomized, double-blind, placebo-controlled, pilot feasibility trial. Neuroradiology. 2012;54:579-588.
- Ringleb P, Bendszus M, Bluhmki E, et al. Extending the time window for intravenous thrombolysis in acute ischemic stroke using magnetic resonance imaging-based patient selection. Int J Stroke. 2019 Jul;14(5):483-490.
- Thomalla G, Simonsen CZ, Boutitie F, et al. MRI-Guided Thrombolysis for Stroke with Unknown Time of Onset. N Engl J Med. 2018 Aug 16;379(7):611-622.
- Thomalla G, Fiebach JB, Ostergaard L, et al. A multicenter, randomized, double-blind, placebo-controlled trial to test efficacy and safety of magnetic resonance imaging-based thrombolysis in wake-up stroke (wake-up). Int J Stroke. 2014;9:829-836.
- Wardlaw JM, Murray V, Berge E, et al. Thrombolysis for acute ischaemic stroke. Cochrane Database Syst Rev. 2014;(4).
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention |
Comparison / control |
Follow-up |
Outcome measures and effect size |
Comments |
|
Davis 2008 EPITHET |
Multicenter RCT
Setting: hospital
Country: Australia, New Zealand, Belgium, UK
Source of funding: academic grants from the Australian National Health and Medical Research Council (NHMRC), the National Stroke Foundation, and the Heart Foundation of Australia. Boehringer Ingelheim supplied matching alteplase and placebo, but was not involved in the study design, data management, or data analysis |
Inclusion criteria: acute hemispheric ischaemic stroke who presented 3–6 h after symptom onset, were 18 years of age or older, had a (NIHSS) of more than 4, premorbid score (mRS) of ≤2.
Exclusion criteria: acute haemorrhage (as judged by contrast CT), major early ischaemic change (defi ned as ischaemia of more than one-third of the territory of the middle cerebral artery);inability to undergo MRI, standard contraindications to alteplase; confounding neurological diseases such as dementia or life-threatening illness.
N=101 (I:52, C 49)
Age: I: 72 SD 13 C: 71 SD 13 Male sex: I: 60% C: 52% NIHSS I: 14 (4-26) C: 10 (5-25) Imaging with MR Perfusion |
Alteplase 0.9mg/kg |
No alteplase |
3 months |
mRS 0-1: I 15 (36% C 9 (21%) Delta: 15% (04to 34%)
Death: I: 13 (25%) C: 7 (14%)
Death or mRS 5: I: 18 (35%) C: 10 (20%)
sICH: I: 4 (7.7%) C: 0 (0%) |
MR perfusion mismatch was not an inclusion criterion but was assessed in all pts. |
|
Koga 2020 THAWS |
Multicenter randomized open label trial
Setting: hospital
Country: Japan
Source of funding: funded mainly by the Japan Agency for Medical Research and Development (AMED; 19ek0210091h0003 and 19lk0201094h0001, and the Ministry of Health, Labour, and Welfare, and partly by the Mihara Cerebrovascular Disorder Research Promotion Fund Many personal fees from pharmaceutical companies are reported under ‘disclosures’ in the publication; they all state that it is not related to the current work. |
Inclusion criteria: All patients met the clinical criteria for intravenous thrombolysis in Japan, other than a time last-known-well >4.5 hours. Patients could undergo randomization if MRI showed a negative FLAIR pattern (Figure I in the Data Supplement) with standard settings on FLAIR based on the imaging guidelines provided by the WAKE-UP group; design was similar to WAKE-UP.
Exclusion criteria: acute haemorrhage (as judged by contrast CT), major early ischaemic change (defi ned as ischaemia of more than one-third of the territory of the middle cerebral artery);inability to undergo MRI, standard contraindications to alteplase; confounding neurological diseases such as dementia or life-threatening illness.
N=131 (I:70, C 61)
Age: I: 73 SD 12 C: 76 SD 12 Male sex: I: 64% C: 51% NIHSS I: 7 (4-13) C: 7 (5-12) Imaging with MR Perfusion |
Alteplase 0.6mg/kg |
No alteplase; standard medical treatment |
3 months |
mRS 0-1: I 19 (% C 29 (%) RR 0.97 [95% CI 0.68 - 1.41])
Death: I: 2 (2.8%) C: 2 (3.3%)
Death or mRS 5: I: 9 (13%) C: 15 (26%)
sICH: I: 1 (1.4%) C: 0 (0%) |
MR perfusion mismatch was not an inclusion criterion but was assessed in all pts. |
|
Ma 2018 EXTEND |
Multicenter RCT
Setting: hospital
Country: Australia, New Zealand, Finland, Taiwan
Source of funding: Australian National Health and Medical Research Council and others |
Inclusion criteria: at least 18 years of age; had excellent functional status before enrollment (defined by a score of <2 on the modified Rankin scale, on which scores range from 0 (no neurologic deficit) to 6 (death)); had a stroke with a clinical severity score at presentation of 4 to 26 on the National Institutes of Health Stroke Scale (NIHSS), and had hypoperfused but salvageable regions of brain detected on automated perfusion imaging.
Exclusion criteria: Intracranial hemorrhage (ICH) identified by CT or MRI; rapidly improving symptoms; deemed eligible for Endovascular Clot Retrieval by the treating team; Pre-stroke mRS score of ≥ 2; contraindication to imaging with contrast agents; ischemic core >1/3 MCA territory qualitatively; participation in any investigational study in the previous 30 days; any terminal illness; any condition that could impose hazards to the patient if study therapy is initiated or affect the participation of the patient in the study; pregnancy
N=225 I: 113 C: 112 Age: I: 74 SD 12 C: 71 SD 13 Male sex: C: 59% NIHSS I: 12 (8-17) C: 10 (6-16.5) |
Alteplase 0.9mg/kg |
No alteplase |
3 months |
mRS 0-1: I: 40 25% C: 33 30% RR: 1.2 (0.8-1.8) Adjusted p=0.04
Death: I: 13 (11.5%) C: 10 (8.9%)
Death or mRS 5: I: 27 (23,9%) C: 24 (21,4%)
sICH: I: 7 (6.2%) C: 1 (0.9%) |
CT perfusion mismatch >1:1 was inclusion criterion |
|
Ringleb 2019 ECASS-4-EXTEND |
Multicenter RCT
Setting: hospital
Country: Germany, Australia, Spain, France, UK, Italy, Sweden,
Source of funding: University Hospital Heidelberg. The trial was supported with a restricted grant from Boehringer Ingelheim (Germany), the funder. The funder approved the study design. Besides the legally required co-collection of serious adverse events, the funder was not involved in data collection or data analysis. Two employees of the funder were members of the steering committee and thus involved in data interpretation and preparation of the publication. |
Inclusion criteria: patients presenting with AIS could be included if treatment could be started within 4.5–9 h after symptom onset. Patients who woke up with stroke symptoms could be included if the mean between time last seen well and symptom recognition was between these limits. NIHSS score had to be between 4 and 26, and the penumbral MRI had to demonstrate a perfusion volume (PWI) to infarct core (DWI) ratio of 1.2, and a perfusion lesion minimum volume of 20 ml
Exclusion criteria: standard IVT exclusion criteria, inability for MRI with infarct core >1/3 MCA territory qualitatively or >100 mL quantitatively
N randomized 120 N analyzed 116 I: 59 C:57 Age: I: 76 (65-83) C: 79 (67-84) Male sex: C: 31(53%) NIHSS: I: 10 IQR 9 C: 9 IQR 10 Time window: 0-9/Wake up |
Alteplase 0.9mg/kg |
No alteplase |
3 months
|
mRS 0-1: I: 21 (35%) C: 16 (28%) OR 1.35 (1.61 – 3.0)
Death: I: 7 (11.5%) C: 4 (6.8%)
Death or mRS 5: I: 10 (16.9%) C: 12 (21.0%)
sICH: I: 1 (0.9%)
C: 0 (0%) |
CT perfusion mismatch >1:1 was inclusion criterion |
|
Thomalla 2018 WAKE-UP |
Multicenter RCT
Setting: hospital
Country: Germany, Denmark, France, UK, Spain, the Netherlands, Belgium, Australia
Source of funding: European union seventh program |
Inclusion criteria: presented with clinical signs of acute stroke, were 18 to 80 years of age, and had been able to carry out usual activities in their daily life without support before the stroke. The patient either recognized stroke symptoms on awakening or could not report the timing of the onset of symptoms (e.g., as a result of aphasia or confusion). The time that had elapsed since the patient was last known to be well had to be more than 4.5 hours (with no upper limit).
Exclusion criteria: if MRI showed intracranial hemorrhage or lesions larger than one third of the territory of the middle cerebral artery; patients in whom thrombectomy was planned and those with severe stroke (a score of >25 NIHSS); generally recognized contraindications to treatment with alteplase
N=503 I: 254; C: 249 Age I: 65 SD 11 C: 65 SD12 Male sex I: 165 (65%) C: 160 (64%) NIHSS I: 6 (4-9) C: 6 (4-9) |
Alteplase 0.9mg/kg |
No alteplase |
3 months |
mRS 0-1: I: 131 (53%) C: 102 (42%) OR: 1.6 (95% CI:1.1 to 2.4)
Death: I: 10 (4.1%) C: 3 (1.2%)
Death or mRS 5: I: 6 C: 5
sICH: I: 5 (2.0%) C: 1 (0.4%) |
Imaging with MR DWI FLAIR mismatch was inclusion criterion
|
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Davis 2008 EPITHET |
Computer-generated |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Koga 2020 THAWS |
Computer-generated |
Unlikely |
Likely (open-label) |
Likely (open-label) |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Ma 2018 EXTEND |
Computer-generated |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Ringleb 2019 ECASS-4-EXTEND |
Computer-generated |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Thomalla 2018 WAKE-UP |
Web-based procedure with a permuted-block design according to trial center |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
NINDS Stroke rtPA; 1995 |
Geen late window patiënten/geen geavanceerde beeldvorming/ opgenomen in Emberson (2014) |
|
Hacke et al; 1995 |
Geen geavanceerde beeldvorming/ opgenomen in Emberson (2014) |
|
Hacke et al; 1998 |
Geen geavanceerde beeldvorming/ opgenomen in Emberson (2014) |
|
Clark et al; 1999 |
Geen geavanceerde beeldvorming/ opgenomen in Emberson (2014) |
|
Clark et al; 2000 |
Geen geavanceerde beeldvorming/ opgenomen in Emberson (2014) |
|
Hacke et al; 2005 |
Desmoteplase versus control |
|
Hacke et al; 2008 |
Geen geavanceerde beeldvorming/ opgenomen in Emberson (2014) |
|
Hacke et al; 2009 |
Desmoteplase versus control |
|
IST3 investigators; 2012 |
Geen geavanceerde beeldvorming/ opgenomen in Emberson (2014) |
|
Albers et al; 2015 |
Desmoteplase versus control |
|
Mori et al;2015 |
Desmoteplase versus control |
|
Von Kummer et al; 2016 |
Desmoteplase versus control |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 12-09-2024
Uiterlijk in 2022 bepaalt het bestuur van de Nederlandse Vereniging voor Neurologie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn of modules te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Neurologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Samenstelling werkgroep
Kerngroep
- Dr. B. (Bob) Roozenbeek, (voorzitter), neuroloog, Erasmus MC Rotterdam, namens de NVN
- Prof. dr. R.M. (Renske) van den Berg-Vos, neuroloog, OLVG Amsterdam, en Amsterdam UMC, locatie AMC, namens de NVN
- Prof. dr. J. (Jeannette) Hofmeijer, neuroloog, Rijnstate ziekenhuis Arnhem, namens de NVN
- Prof. dr. J.M.A. Visser-Meily, revalidatiearts, UMC Utrecht, namens de VRA
- A.F.E. (Arianne) Verburg, huisarts, namens het NHG
- Dr. H.B. (Bart) van der Worp, neuroloog, UMC Utrecht, namens de NVN
- Dr. S.M. (Yvonne) Zuurbier, neuroloog in opleiding, AMC Amsterdam, namens de NVN
- Prof. dr. W. (Wim) van Zwam, radioloog, Maastricht UMC, namens de NVvR
Met ondersteuning van
- Dr. M.L. Molag, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van den Berg-Vos |
Neuroloog |
geen |
"Voorzitter werkgroep CVA van het Transmuraal Platform Amsterdam (betaald dmv vacatiegelden) Lid focusgroep CVA ROAZ Noord-Holland (onbetaald) Vertrouwenspersoon voor A(N)IOS in OLVG (onbetaald) Bestuurslid Kennisnetwerk CVA Nederland (onbetaald) Lid SEH gebruikersoverleg in OLVG, locatie West (onbetaald) Lid Antistollings Commissie in het in het Zaans Medisch Centrum te Zaandam (onbetaald)" |
geen |
|
Dippel |
Neuroloog |
geen |
"Hoofdonderzoeker MR CLEAN trial ISRCTN10888758 en NTR1804 Hoofdonderzoeker MR CLEAN registry (https://www.mrclean-trial.org/) Hoofdonderzoeker MR CLEAN MED trial ISRCTN Research leider CONTRAST consortium (https://www.contrast-consortium.nl/) The MR CLEAN trial was deels gefinancierd door de Hartstichting, en middels financiele bijdragen zonder voorwaarden behoudens milestones, van AngioCare BV, Medtronic/Covidien/EV3®, MEDAC Gmbh/LAMEPRO, Penumbra Ine., Stryker®, and Top Medical/Concentric. Alle bijdragen werden betaald aan Erasmus MC. Het CONTRAST consortium wordt ondersteund door het Netherlands Cardiovascular Research lnitiative (CVON), een initiatief van de Hartstichting, en door de Nederlandse Hersenstichting. Erasmus MC ontving voor het CONTRAST consortium additionele financiele ondersteuning van Medtronic, en voor het uitvoeren van MR CLEAN NO-IV financiele ondersteuning van Stryker European Operations BIJVOORBEELD Alle bijdragen werden betaald aan Erasmus MC, zonder voorwaarden behoudens milestones. " |
geen |
|
Hofmeijer |
Neuroloog (0,6 fte) |
Hoogleraar Universiteit Twente (0,4 fte) |
geen |
geen |
|
Roozenbeek |
Neuroloog |
geen |
Lid van CONTRAST, coördineert onderzoeksprojecten op gebied van acute beroertezorg gefinancierd door Stichting BeterKeten, Stichting THEIA, Erasmus Universiteit en Erasmus MC |
Geen |
|
Verburg |
Huisarts en wetenschappelijk medewerker NHG |
Wetenschappelijk medewerker NHG |
geen |
Geen |
|
Visser-Meilij |
Revalidatiearts, hoogleraar en afdelingshoofd |
geen |
geen |
Geen |
|
Van der Worp |
Neuroloog |
Voorzitter European Stroke Organisation (ESO), onbetaald. Voorzitter schrijfcomissie ESO bij de richtlijn over “space-occupying infaction” |
Adviezen aan/consultancy voor Boehringer Ingelheim, producent van onder anderen alteplase en dabigatron. |
Uitsluiting besluitvorming alteplase en dabigatran |
|
Zuurbier |
AIOS neurologie |
geen |
Wetenschappelijk onderzoek gericht op centraal veneuze trombose (onbetaald) |
Geen |
|
Van Zwam |
Neuro-interventieradioloog |
geen |
Consultancy activiteiten voor Stryker en Cerenovus, lid CONTRAST, MRCLEAN LATE |
Geen invloed op richtlijnonderwerpen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door gebruik te maken van kwaliteitscriteria vanuit patiëntenperspectief voor CVA, ontwikkeld door Harteraad. Verder worden Harteraad, de Hartstichting en Hersenletsel.nl betrokken bij de module. Deze partijen zijn niet aanwezig bij vergaderingen, maar worden door middel van notulen van de vergadering door de kerngroep op de hoogte gehouden. Ook worden deze partijen betrokken bij relevante onderwerpen. De conceptmodules zijn tevens voor commentaar aan bovengenoemde verenigingen voorgelegd.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden in de bijlagen.
Werkwijze
AGREE
Deze module is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration:
- AMSTAR - voor systematische reviews;
- Cochrane - voor gerandomiseerd gecontroleerd onderzoek;
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de module is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Kennislacunes
Tijdens de ontwikkeling van deze module is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de bijlage Kennislacunes.
Commentaar- en autorisatiefase
De conceptmodule werd aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt)organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve module werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
