Behandeling binnen 4,5 uur bij acuut herseninfarct
Uitgangsvraag
Welke patiënten met een acuut herseninfarct hebben baat bij intraveneuze trombolyse met alteplase?
De uitgangsvraag omvat de volgende deelvragen:
- Wat is het effect van alteplase bij behandeling binnen 4,5 uur na ontstaan van de verschijnselen?
- Wat is het effect van alteplase bij behandeling later dan 4,5 uur na ontstaan van de verschijnselen of als het begintijdstip niet bekend is, bij patiënten geselecteerd met aanvullende beeldvorming?
In deze module wordt deelvraag 1 behandeld.
Aanbeveling
Behandel patiënten met een acuut herseninfarct zonder relevante contra-indicaties zo snel mogelijk met intraveneus alteplase, in ieder geval binnen 4,5 uur na het optreden van de verschijnselen.
Dosering intraveneus alteplase: 0,9 mg/kg lichaamsgewicht met een maximum van 90 mg, de eerste 10% toegediend als bolus, direct gevolgd door infusie van de overige 90% over één uur.
Indicatie voor intraveneuze trombolyse: acuut herseninfarct, waarbij de behandeling binnen 4,5 uur na het ontstaan van de verschijnselen kan worden gestart. In dit tijdsvenster is een CT-hersenen zonder contrast, voldoende voor selectie van patiënten voor behandeling.
Contra-indicatiesa
- intracraniële bloeding (inclusief hemorragische transformatie infarct) bij beeldvorming;
- matig/ernstig schedelhersenletsel in voorgaande twee maanden;
- herseninfarct in voorgaande twee maanden;
- intracraniële bloeding in voorgaande drie maanden;
- bloeding in maag-darmkanaal of urinewegen in voorgaande twee weken;
- grote chirurgische ingreep in voorgaande twee wekenb;
- bloeddruk systolisch ≥ 185 mmHg of diastolisch ≥ 110 mmHgc;
- actieve bloeding of traumatisch letsel (bijvoorbeeld fractuur);
- gebruik van vitamine K-antagonist en INR > 1,7;
- gebruik directe trombine- of factor Xa-remmer (direct oraal anticoagulantium; DOAC) - zie ook hieronder)d;
- gebruik LMW-heparine in therapeutische dosering, tenzij meer dan 4 uur geleden een subcutane gift en anti Xa-spiegels normaale;
- trombocyten < 100 x 109/L (was < 90 x 109/L;
- serum glucose < 2,7 mmol/L als mogelijke oorzaak van de verschijnselen, of serum glucose >22,0 mmol/L;
Opmerkingen bij contra-indicaties
- De contra-indicaties vormen een leidraad en zijn gebaseerd op de contra-indicaties in klinische trials van alteplase bij patiënten met een herseninfarct én op de mening van experts (Dirks, 2007). Zoals bij iedere behandeling dienen de potentiële voor- en nadelen van trombolyse tegen elkaar afgewogen te worden. Veel van de genoemde contra-indicaties zijn zeldzaam. In de praktijk is een grondige anamnese (ingrepen, trauma, bloedingsneiging, medicatieoverzicht) en vlot neurologisch onderzoek, bloeddrukmeting, bloedsuikerbepaling en NCCT van het hoofd voldoende;
- Indien een bloeding uit de operatiewond niet eenvoudig te voorkomen of te behandelen is;
- Indien gewenst verlagen met labetalol of nicardipine volgens schema bij behandeling van hypertensie. Er bestaat geen overtuigend bewijs dat het verlagen van de bloeddruk gecombineerd met trombolyse beter is dan het afzien van trombolyse. Onderzoek hiernaar is daarom gewenst. Een grote daling van de bloeddruk dient vermeden te worden;
- Voorbeelden: apixaban, rivaroxaban, edoxaban. De veiligheid van behandeling met alteplase bij het gebruik van deze middelen is onvoldoende bekend en de kans op het ontstaan van bloedingen is waarschijnlijk verhoogd. Bij twijfel over het gebruik van een DOAC kan een therapeutische spiegel worden uitgesloten. Voor handvatten voor de te gebruiken laboratoriumbepalingen en bijbehorende afkapwaarden per middel verwijst de werkgroep naar de richtlijn Antitrombotisch beleid, module Laboratoriumtesten bij antistollingsmiddelen.
Dabigatran vormt een uitzondering: behandeling met iv alteplase lijkt veilig als eerst geantagoneerd is met idarucizumb, een monoclonaal antilichaam dat zeer sterk bindt aan dabigatran en dit intactiveert. Na toediening van 5g IV kan na 5 minuten alteplase worden toegediend (Diener, 2016 en Kermer, 2017). - Een therapeutische spiegel van een LMWH kan worden uitgesloten dan wel aangetoond middels een anti-Xa-bepaling. Deze contra-indicatie geldt niet, indien er meer dan 4 uur geleden een subcutane gift van LWMH is toegediend en de anti-Xa-spiegels normaal zijn. Een anti-Xa spiegel onder de 0,1 U/mL is een veilige grens. De detectiegrens kan per laboratorium verschillen, stem dit daarom zo nodig af met het lokale laboratorium.
Geen contra-indicaties
- gebruik van een trombocytenaggregatieremmer;
- menstruatie;
- gebruik van laag-moleculair-gewicht heparine in profylactische dosering;
- dissectie extracraniële a. carotis of a. vertebralis;
- vroege ischemische veranderingen op non-contrast CT die niet suggereren dat het infarct ouder is dan viereneenhalf uur;
- ongeruptureerd intracranieel aneurysma of arterioveneuze/caverneuze malformatie;
- een acuut myocardinfarct: overleg zo nodig met de cardioloog over de voor- en nadelen van trombolyse;
- gebruik van dabigatran, indien gecoupeerd met idarucizumab.
Relatieve contra-indicatie
- Epileptisch insulta.
- Indien bij beeldvorming sprake is van een occlusie van een intracraniële arterie en/of van een territoriaal perfusiedefect, dan is het onwaarschijnlijk dat een parese als louter ‘postictaal’ geduid moet worden. Epilepsie is geen (absolute) contra-indicatie.
Overwegingen
Behandeling van een verhoogde bloeddruk vóór en in de eerste uren na trombolyse
Een bloeddruk hoger dan 185 mmHg systolisch of 110 mmHg diastolisch is een contra-indicatie voor behandeling met alteplase vanwege de toegenomen kans op intracraniële bloedingen Levy (1994) en Ahmed (2009). Ongeveer 20% van de patiënten die in aanmerking komen voor behandeling met alteplase heeft een dergelijke verhoogde bloeddruk (Dirks, 2015). Het is onbekend of het behandelen van de hypertensie gevolgd door trombolyse een voordeel heeft boven het afwachten of de bloeddruk spontaan daalt binnen het tijdvenster voor trombolyse. Actief verlagen van de bloeddruk voor intraveneuze trombolyse kan mogelijk ook schadelijk kan zijn omdat een plotselinge bloeddrukdaling, helemaal bij uitblijven van (snelle) rekanalisatie, zou kunnen leiden tot een verdere uitbreiding van de penumbra (Castillo, 2004). De werkgroep is van mening dat bij patiënten met een herseninfarct die behoudens een te hoge systolische of diastolische bloeddruk in aanmerking komen voor trombolyse een medicamenteuze verlaging van de bloeddruk overwogen kan worden, bijvoorbeeld volgens het onderstaande schema.
Ook tijdens en in de eerste 24 uur na behandeling met trombolyse dient de bloeddruk systolisch lager te zijn dan 185 mmHg en diastolisch lager dan 110 mmHg. In geval van een hogere bloeddruk kan volgens het onderstaande schema intraveneus labetalol gegeven worden. Indien dit onvoldoende effect heeft kan in overleg met een internist/vasculair geneeskundige de behandeling worden aangepast. Bij contra-indicaties voor labetalol infusie kan worden overgegaan op nicardipine.
|
Behandeling bloeddruk indien hoger dan 185 mmHg systolisch of 110 mmHg diastolisch
|
Bewaking en controles
Gedurende de behandeling met alteplase en de eerste 24 uur daarna:
- ademhalingsfrequentie, pols en O2-saturatie bloed: continue bewaking door telemetrie;
- bloeddruk, bewustzijn (Glasgow Coma Scale) en neurologische uitval;
- 0 tot 2 uur: iedere 15 minuten;
- 2 tot 6 uur: iedere 30 minuten;
- 6 tot 25 uur: ieder uur.
Vroege behandeling met acetylsalicylzuur
Het effect van intraveneuze toediening van 300 mg acetylsalicylzuur binnen 90 minuten na de start van alteplase is in een Nederlandse gerandomiseerde open trial met geblindeerde uitkomstmeting onder 642 patiënten met een herseninfarct vergeleken met dat van het starten van acetylsalicylzuur oraal na 24 uur. Na drie maanden was 54,0% van de patiënten in de vroege acetylsalicylzuur-groep in leven en onafhankelijk (mRS ≤ 2) en 57,2% van de patiënten in de groep die pas na 24 uur startte met acetylsalicylzuur (absolute verschil -3,2%; 95% BI (-10,8 tot 4,2); geadjusteerde OR 0,91 (95% BI (0,66 tot 1,26)); p=0,58). Symptomatische intracraniële bloedingen traden vaker op bij patiënten die vroeg werden behandeld met acetylsalicylzuur (absolute verschil 2,8%; 95% BI (0,2 tot 5,4); p=0,04) (Zinkstok, 2012). De werkgroep adviseert daarom in de eerste 24 uur na start van trombolyse niet te behandelen met een trombocyten-aggregatieremmer.
Behandeling van bloedingen na start alteplase
Als een klinisch relevante bloeding is opgetreden tijdens behandeling met alteplase, dan dient deze behandeling met alteplase direct gestaakt te worden. De optimale antifibrinolytische behandeling is onbekend omdat hiernaar geen adequaat onderzoek heeft plaatsgevonden. Overwogen kan worden om voorafgaand aan deze behandeling PTT, aPTT, INR en fibrinogeen en in ieder geval één en vier uur na de start hiervan fibrinogeen te bepalen. Hiermee krijgt men achteraf meer inzicht in de oorzaak van de bloeding en kan het fibrinogeen worden vervolgd. Het is van belang om een streefwaarde van 0.8 tot 1.0 g/l op 1 en 4 uur na het couperen aan te houden. Op indicatie kan met een hematoloog of (neuro)chirurg overlegd worden.
|
Antifibrinolytische behandeling bij een klinisch relevante bloeding tijdens of na behandeling met alteplase
|
Orolinguaal angio-oedeem
Bij 1 tot 5% van de patiënten treedt binnen uren na start van de alteplase oro-linguaal angio-oedeem op (Myslimi, 2016). De kans hierop is verhoogd bij het gebruik van een ACE-remmer. Meestal is het oedeem mild, maar in zeldzame gevallen ontstaat respiratoire insufficiëntie door een blokkade van de ademweg. Voor de behandeling kan het lokale allergie/anafylaxieprotocol gevolgd worden. De medicamenteuze behandeling bij mild tot matig ernstig oedeem kan bestaan uit clemastine 2 mg intraveneus gecombineerd met dexamethason 8 mg intraveneus en in geval van stridor of bronchospasme verneveling met salbutamol 1 mg). Indien sprake is van (dreigende) respiratoire en/of hemodynamische insufficiëntie bestaat de behandeling uit toediening van adrenaline 0,5 mg intramusculair, eventueel vernevelen met salbutamol 2,5-5 mg (zie NIV-richtlijn Anafylactische reactie) en dient de anesthesist met spoed bij de behandeling te worden betrokken.
Twijfelgevallen
Geringe of verbeterende uitval
Patiënten met een herseninfarct en aanvankelijk milde of snel verbeterende symptomen hebben toch een aanzienlijke kans op een slechte uitkomst (Smith, 2011). Zoals hierboven is beschreven blijkt uit een meta-analyse van de trombolysetrials dat ook patiënten met een NIHSS van 0 tot en met 4 op het moment van inclusie in de trial baat hadden bij behandeling met alteplase (Emberson, 2014). Het is echter niet bekend hoeveel van deze patiënten een score van 1 of 2 hadden (dus een zeer mild infarct), en patiënten met snel verbeterende symptomen werden van de meeste trials uitgesloten. De werkgroep adviseert om patiënten met een herseninfarct en een score ≥ 1 op de NIHSS te behandelen met intraveneus alteplase indien zij voldoen aan de overige criteria voor trombolyse.
Epileptisch insult
Een zeer klein deel van de herseninfarcten presenteert zich met een epileptisch insult op het moment van het ontstaan van de uitvalsverschijnselen. Zonder geavanceerde beeldvorming is het dan vaak in de eerste uren onduidelijk of sprake is van een postictale parese of uitval ten gevolge van een herseninfarct. Om deze reden werden patiënten die zich presenteerden met een epileptisch insult uitgesloten van de meeste trombolysetrials. Er is echter geen overtuigende reden om aan te nemen dat patiënten met een epileptisch insult bij het ontstaan van een herseninfarct minder voordeel zouden hebben van behandeling met trombolyse. Een epileptisch insult in de eerste uren na een herseninfarct is dan ook geen contra-indicatie voor trombolyse. De werkgroep adviseert om bij patiënten bij wie getwijfeld wordt tussen een postictale parese en uitval ten gevolge van een herseninfarct direct aanvullende beeldvorming te verrichten om het bestaan van een herseninfarct te evalueren. Deze beeldvorming kan bestaan uit een CT-angiografie en/of -perfusie of een MRI met DWI en/of MR-angiografie of -perfusie. Indien sprake is van een herseninfarct én de patiënt voldoet aan de overige criteria kan behandeld worden met alteplase.
Stroke mimics
Zelfs in centra met veel ervaring blijkt 1 tot 2% van de patiënten die behandeld zijn met alteplase wegens de verdenking op een herseninfarct achteraf geen herseninfarct te hebben. Er is dan sprake van een zogenaamde ‘stroke mimic’. In een grote multicenter studie bleek dat de kans op een intracraniële bloeding bij deze patiënten erg laag was: 1% (95% BI (0,0 tot 5,0%)) (Zinkstok, 2013). De werkgroep adviseert om bij patiënten bij wie getwijfeld wordt over de diagnose herseninfarct direct aanvullende beeldvorming te verrichten zoals beschreven onder ‘epileptisch insult.’ Indien een herseninfarct waarschijnlijk is én de patiënt voldoet aan de overige criteria kan behandeld worden met alteplase.
Eerdere intracraniële bloeding
Patiënten met een eerdere intracraniële of intracraniële bloeding werden uitgesloten van de meeste trombolysetrials. Dit gold niet voor IST-3, maar het is niet bekend of in die trial daadwerkelijk patiënten met een eerdere intracraniële bloeding geïncludeerd zijn. Ook zijn er geen observationele studies waarin voldoende patiënten met een eerdere intracraniële bloeding zijn geïncludeerd om betrouwbare uitspraken te kunnen doen over de veiligheid van trombolyse bij deze patiënten. Het is aannemelijk dat patiënten met een eerdere lobaire bloeding ten gevolge van bijvoorbeeld amyloïd-angiopathie een grotere kans hebben op het ontstaan van een symptomatische intracraniële bloeding na trombolyse, maar dit is minder duidelijk bij patiënten met een eerdere hypertensieve bloeding bij wie de bloeddruk daarna goed onder controle was, en bij patiënten met een eerder traumatisch subduraal hematoom. Het risico op een intracraniële bloeding lijkt niet relevant verhoogd bij patiënten met een eerdere bloeding uit een daarna behandelde intracraniële vaatafwijking zoals een aneurysma. De werkgroep adviseert daarom om bij patiënten met een herseninfarct die langer dan drie maanden geleden een intracraniële bloeding hebben gehad niet per definitie af te zien van trombolyse, maar de voor- en nadelen hiervan tegen elkaar af te wegen.
Cerebrale microbloedingen
Bij ongeveer een derde van de patiënten met een herseninfarct kunnen met MRI één of meerdere cerebrale microbloedingen worden aangetoond (Cordonnier, 2007). Het bestaan van microbloedingen (wel of niet als uiting van (probable) cerebrale amyloïdangiopathie) is mogelijk geassocieerd met een verhoogde kans op symptomatische intracraniële bloedingen als gevolg van trombolyse (Tsivgoulis, 2016; Charidimou, 2017). Uit de resultaten van een meta-analyse van 9 observationele studies van Tsivgoulis (2016) leek dit risico voornamelijk verhoogd te zijn bij patiënten met hoog aantal microbloedingen (>10). Patiënten zonder microbloedingen hadden 4,4% (95% BI: 3,5-5,4) kans op een symptomatische intracerebrale bloeding, patiënten met >1 microbloeding 6,5% (95% BI: 4,8-8,9) en patiënten met >10 microbloedingen 46,9% (95% CI: 22,8-72,5). Opgemerkt dient te worden dat het aantal patiënten met >10 bloedingen in deze meta-analyse zeer klein was (n=15, 0,8%). Het is onbekend of bij patiënten met microbloedingen het voordeel van trombolyse anders is dan bij patiënten zonder microbloedingen. De werkgroep is daarom van mening dat het bestaan van microbloedingen in het algemeen geen contra-indicatie voor behandeling met alteplase. De werkgroep adviseert bij iedere patiënt waarbij op een eerdere MRI microbloedingen zijn gedetecteerd bij de besluitvorming over de behandeling met alteplase de afweging te maken tussen het voor de individu verwachte absolute behandelingseffect van alteplase (ingeschat o.b.v. bijvoorbeeld de ernst van de uitval, wel of geen kandidaat voor trombectomie, etc.) en het ingeschatte risico op een symptomatische intracraniële bloeding.
Trauma capitis
Patiënten met een recent ernstig trauma capitis werden uitgesloten van deelname aan trombolysetrials. De definitie van recent varieerde van drie weken tot drie maanden. Op basis van internationale expert opinion is een periode van twee maanden vastgesteld (Dirks, 2007). De definitie van ernstig in de exclusiecriteria van trombolysetrials is helaas onduidelijk, en er bestaan geen betrouwbare gegevens over de risico’s van trombolyse bij patiënten met een recent licht schedelhersenletsel, bijvoorbeeld als gevolg van een val bij het ontstaan van de uitval. De werkgroep is van mening dat een geïsoleerd recent licht schedelhersenletsel geen contra-indicatie is voor behandeling met alteplase, tenzij bij CT-onderzoek van de hersenen aanwijzingen bestaan voor een intracraniële bloeding.
Onderbouwing
Achtergrond
Vroege intraveneuze behandeling met alteplase verbetert de kans op een goed herstel bij een geselecteerde groep patiënten met een acuut herseninfarct. Ten tijde van het schrijven van de Richtlijn Beroerte (2008) bestond nog onduidelijkheid over het nut van deze behandeling bij geringe of juist zeer ernstige uitvalsverschijnselen, bij patiënten ouder dan 80 jaar, en indien de behandeling niet binnen drie uur na het ontstaan van de verschijnselen kon worden gestart. In 2017 is een nieuwe versie van de Richtlijn Herseninfarct en hersenbloeding gepubliceerd, deze module (deelvraag 1) is in den beginne onveranderd in vergelijking met de versie van 2017 is, er zijn alleen enkele onvolkomenheden gecorrigeerd, de grote verandering betreft het late-window tijdsinterval, zie deelvraag 2 (module 'Behandeling na 4,5 uur of als het begintijdstip onbekend is)'. Nieuwe trials en meta-analyses hebben meer duidelijkheid verschaft. Ook bestaat nu relevante informatie over het nut en de gevaren van het starten met acetylsalicylzuur binnen enkele uren na de behandeling. Daarnaast bieden nieuwe observationele studies meer inzicht in het nut en de risico’s van behandeling met alteplase onder bijzondere omstandigheden.
Deze module beperkt zich tot trombolyse met alteplase, dat de voorkeur heeft boven tenecteplase. Voor aanbevelingen over tenecteplase zie de module ‘Intraveneuze behandeling met tenecteplase bij patiënten met een herseninfarct’.
Conclusies / Summary of Findings
|
Hoog GRADE |
Bij patiënten met een herseninfarct vermindert behandeling met intraveneuze alteplase de kans op afhankelijkheid en vergroot de behandeling de kans op een (vrijwel) volledig herstel, indien de behandeling wordt gestart binnen viereneenhalf uur na het ontstaan van de verschijnselen. De kans op een goed herstel neemt toe naarmate de behandeling eerder wordt gestart.
Bronnen: (Wardlaw, 2014; Emberson, 2014) |
|
Hoog GRADE |
Bij patiënten met een herseninfarct heeft behandeling met intraveneus alteplase geen effect op de kans op overlijden gedurende de eerste drie tot zes maanden indien de behandeling wordt gestart binnen viereneenhalf uur na het ontstaan van de verschijnselen.
Bronnen: (Wardlaw, 2014; Emberson, 2014) |
Samenvatting literatuur
De systematische literatuursearch leverde 12 relevante RCT’s op met in totaal 7012 patiënten. Deze trials zijn samengevat in een systematische Cochrane review en meta-analyse over de effecten van trombolyse bij een acuut herseninfarct (Wardlaw, 2014). Deze review dient als de basis voor deze module, naast een meta-analyse van gegevens van 6756 individuele patiënten met een acuut herseninfarct in acht RCT’s van trombolyse met alteplase (Emberson, 2014). Deze acht RCT’s zijn ook opgenomen in de Cochrane meta-analyse. Overigens worden in deze module de twee NINDS-trials als één beschouwd (NINDS, 1995).
De Cochrane meta-analyse betreft trials met een maximale duur tot start van de behandeling van zes uur na het ontstaan van de symptomen. Er wordt wel een onderscheid gemaakt tussen behandeling binnen 3 uur en behandeling tussen drie en zes uur. In de meta-analyse van individuele patiënten wordt de laatste periode bij viereneenhalf uur in tweeën gesplitst, hetgeen voor de klinische praktijk nuttige informatie oplevert. Helaas is in deze meta-analyse het primaire eindpunt ‘overleven zonder beperkingen’ (mRS 0 of 1) en worden de effecten van alteplase op het eindpunt ‘overlijden of afhankelijkheid’ niet gepresenteerd.
Het einde van de follow-up was in de verschillende trials drie of zes maanden. In deze module wordt daar geen onderscheid tussen gemaakt.
Dood of afhankelijkheid aan het einde van de follow-up
In tien trials met 6886 patiënten in de Cochrane meta-analyse verminderde behandeling met intraveneus alteplase gestart binnen zes uur na het ontstaan van de symptomen de kans op overlijden of afhankelijkheid aan het einde van de follow-up: OR 0,84 (95% BI (0,77 tot 0,93); p=0,0006), hetgeen vergelijkbaar is met 40 minder gevallen van overlijden of afhankelijkheid (95% BI 20 tot 65) per 1000 behandelde patiënten. Er was sprake van significante heterogeniteit van behandeleffecten tussen trials die alteplase gebruikten (I² = 63%, p=0,004).
Overlijden tijdens de follow-up
In 12 trials met in totaal 7012 patiënten in de Cochrane meta-analyse had behandeling met intraveneus alteplase binnen zes uur na het ontstaan van de symptomen geen effect op de kans op overlijden binnen drie tot zes maanden: OR 1,06 (95% BI (0,94 tot 1,20)). Wel leidde behandeling met alteplase tot een toename van de kans op overlijden in de eerste zeven tot tien dagen: OR 1,44 (95% BI (1,18 tot 1,7)6; p=0,0003), hetgeen vergelijkbaar is met 25 extra gevallen van overlijden (95% BI (11 tot 40)) in de eerste zeven tot tien dagen per 1000 behandelde patiënten. Er bestaat geen heterogeniteit tussen de trials (Wardlaw, 2014).
In de Cochrane meta-analyse ontstond bij 272 (7,7%) van de 3548 patiënten die binnen zes uur met alteplase waren behandeld in de eerste zeven tot tien dagen een symptomatische intracraniële bloeding, en bij 63 (1,8%) van de 3463 controles (OR 3,72; 95% BI (2,98 tot 4,64); p<0,00001), hetgeen vergelijkbaar is met 60 (95% BI (50 tot 70)) extra symptomatische intracraniële bloedingen per 1000 behandelde patiënten. Fatale intracraniële bloedingen traden in de eerste zeven tot tien dagen op bij 120 (3,6%) van 3359 patiënten die met alteplase waren behandeld en 21 (0,6%) van 3324 controles (OR 4,18; 95% BI (2,99 tot 5,84); p<0,00001), hetgeen vergelijkbaar is met 30 (95% BI (20 tot 40)) extra fatale intracraniële bloedingen per 1000 behandelde patiënten. Er bestond geen heterogeniteit tussen de trials (Wardlaw, 2014).
In de meta-analyse van gegevens van individuele patiënten ontstonden in de eerste zeven dagen symptomatische intracraniële bloedingen bij 231 (6,8%) van de 3391 patiënten die behandeld waren met alteplase en bij 44 (1,3%) van de 3365 controles (OR 5,55; 95% BI (4,01 tot 7,70); p<0,0001). Dit komt overeen met 55 extra symptomatische intracraniële bloedingen per 1000 behandelde patiënten. Fatale intracraniële bloedingen traden op bij 91 (2,7%) van de patiënten behandeld met alteplase en bij 13 (0,4%) van de controles (OR 7,14; 95% BI (3,98 tot 12,79); p<0,0001) (Emberson, 2014).
Effect van tijd tot behandeling
Het effect van alteplase op de kans op een (vrijwel) volledig herstel wordt sterk bepaald door de tijd tussen het ontstaan van de symptomen en het starten van de behandeling (p=0,016). Dit is te zien in de meta-analyse van gegevens van individuele patiënten die binnen 6 uur werden behandeld, na beeldvorming met alleen CT zonder contrast (om een bloeding uit te sluiten). Het tijdstip waarop de onderste grens van het 95% BI de lijn van geen effect passeert ligt in deze meta-analyse op 5,1 uur na het ontstaan van de symptomen (figuur 1) (Emberson, 2014). Deze berekende waarde biedt echter onvoldoende basis voor verandering van het wijzigen van het 4,5 uurs tijdscriterium voor behandeling zonder verdere beeldvorming. Er bestond in de trials geen statistisch significante relatie tussen de tijd tot de start van de behandeling en de kans op overlijden binnen drie tot zes maanden, maar een verband kan niet met voldoende zekerheid worden uitgesloten (figuur 1). De kans op het ontstaan van fatale intracraniële bloedingen was niet afhankelijk van het tijdstip van de start van de behandeling (Emberson, 2014) (figuur 1).
Figuur 1 Relatie tussen tijd tot behandeling en effect van alteplase (Emberson, 2014)
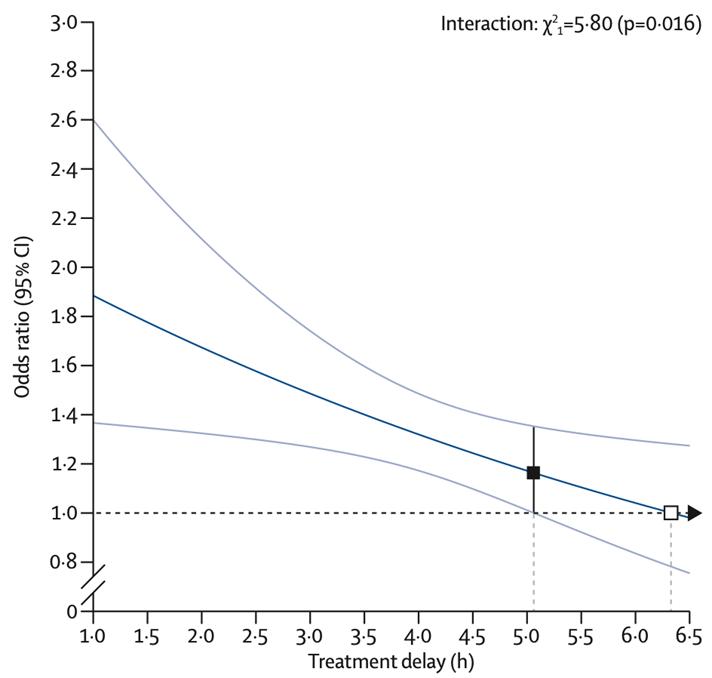
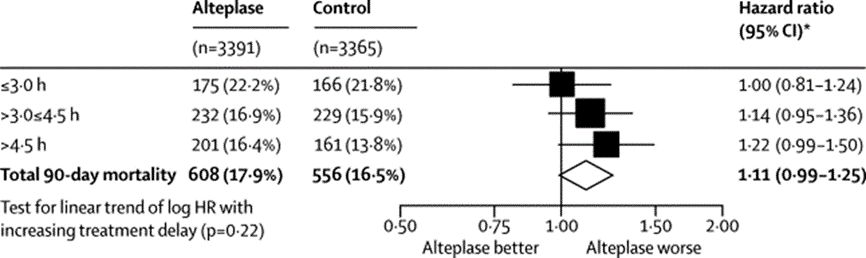
Figuur 2 Relatie tussen tijd van begin van de verschijnselen of “last seen well” tot behandeling met het effect van alteplase op sterfte binnen 90 dagen na behandeling (Emberson, 2014)
Start behandeling binnen drie uur
In zes trials met 1779 patiënten verminderde behandeling met intraveneus alteplase, gestart binnen drie uur na het ontstaan van de symptomen, de kans op overlijden of afhankelijkheid aan het einde van de follow-up: OR 0,65 (95% BI (0,54 tot 0,80); p<0,0001), hetgeen vergelijkbaar is met 90 minder gevallen van overlijden of afhankelijkheid (95% BI (46 tot 135)) per 1000 behandelde patiënten. Hierbij was geen sprake van heterogeniteit tussen de trials. In dit tijdsbestek had trombolyse geen effect op de kans op overlijden gedurende de follow-up: OR 0,91 (95% BI (0,73 tot 1,13)) ten gunste van alteplase (Wardlaw, 2014).
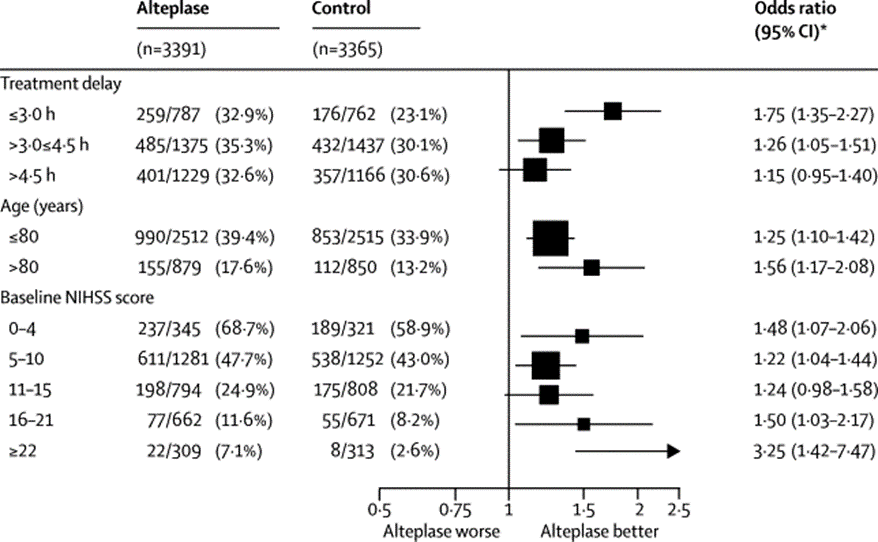
In de meta-analyse van gegevens van individuele patiënten leidde behandeling, binnen drie uur na het ontstaan van de symptomen, tot een grotere kans op een (vrijwel) volledig herstel: OR 1,75 (95% BI (1,35 tot 2,27); p<0,0001; figuur 4), hetgeen vergelijkbaar is met 98 extra patiënten met een (vrijwel) volledig herstel per 1000 behandelde patiënten (Emberson, 2014).
Figuur 3 Relatie tussen effect van de behandeling op herstel zonder afhankelijkheid enerzijds en tijd tot behandeling, leeftijd en ernst van de neurologische uitval anderzijds (Emberson, 2014)
Start behandeling tussen drie en viereneenhalf uur
In de meta-analyse van gegevens van individuele patiënten leidde behandeling, gestart tussen drie en viereneenhalf uur na het ontstaan van de symptomen, tot een grotere kans op een (vrijwel) volledig herstel: OR 1,26 (95% BI 1,05 tot 1,51; p=0,0132; figuur 3), hetgeen vergelijkbaar is met 52 extra patiënten met een (vrijwel) volledig herstel per 1000 behandelde patiënten (Emberson, 2014).
Start behandeling tussen viereneenhalf en zes uur
In de meta-analyse van gegevens van individuele patiënten leidde behandeling, gestart tussen viereneenhalf en zes uur na het ontstaan van de symptomen, niet tot een grotere kans op een (vrijwel) volledig herstel: OR 1,15 (95% BI (0,95 tot 1,40); p-waarde 0,15; figuur 3). Hierbij is wel opgemerkt dat bij het merendeel van deze patiënten geen aanvullende beeldvorming naast CT-hersenen zonder contrast was verricht.
Start behandeling tussen drie en zes uur
In zeven trials met 4971 patiënten had behandeling met alteplase, gestart tussen drie en zes uur na het ontstaan van de symptomen, geen effect op de kans op overleven zonder afhankelijkheid (OR 1,07 in het voordeel van alteplase; 95% BI (0,96 tot 1,20)).
Voor selectie van patiënten met een onduidelijk begintijdstip van de verschijnselen, of een begin langer dan 4,5 uur geleden op basis van geavanceerde beeldvorming, verwijzen we naar de bespreking van deelvraag 2.
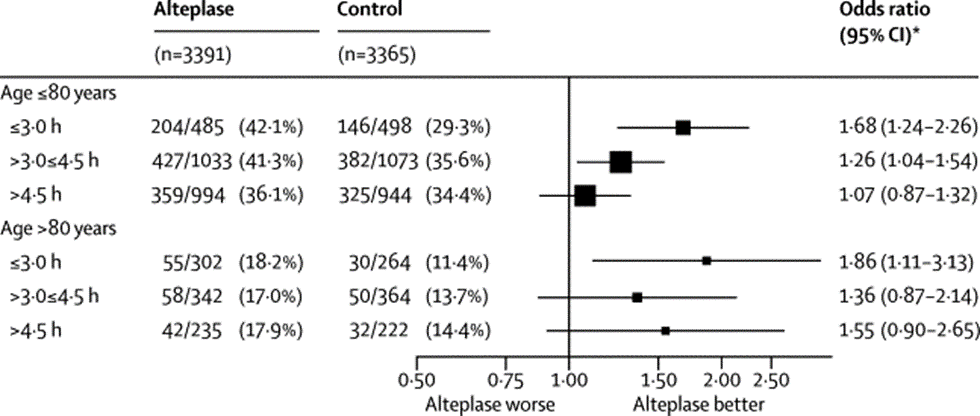
Effect van leeftijd
In de meta-analyse van gegevens van individuele patiënten had de leeftijd van de patiënt (ouder of jonger dan 80 jaar) geen invloed op het effect van behandeling met alteplase. Er is geen overtuigend bewijs dat leeftijd de tijd verkort waarbinnen behandeling met alteplase voordeel heeft (figuur 4). De toename van de kans op het ontstaan van fatale intracraniële bloedingen was niet afhankelijk van de leeftijd (figuur 4) (Emberson, 2014).
Figuur 4 Relatie tussen effect van de behandeling op herstel zonder afhankelijkheid enerzijds en de combinatie van leeftijd en tijd tot behandeling met alteplase anderzijds (Emberson, 2014)
Effect van ernst van het infarct
In de meta-analyse van gegevens van individuele patiënten werd geen overtuigend bewijs gevonden dat de ernst van de uitvalsverschijnselen, gemeten met de National Institutes of Health Stroke Sale (NIHSS), invloed heeft op het effect van behandeling met alteplase op de kans op een (vrijwel) volledig herstel (p=0,06). Er bestond met name geen bewijs dat alteplase minder effectief was voor patiënten met de minst ernstige of de meest ernstige uitval (figuur 3). Hierbij moet opgemerkt worden dat er waarschijnlijk onvoldoende informatie is voor patiënten met een NIHSS van 1 of 2 vóór de start van de behandeling: gegevens over deze groep zijn niet beschikbaar. De relatieve toename van de kans op het ontstaan van fatale intracraniële bloedingen was niet afhankelijk van de ernst van het infarct maar de absolute toename wel (Emberson, 2014).
Bewijskracht van de literatuur
De bewijskracht van een meta-analyse van RCT’s start hoog, er waren geen redenen om de bewijskracht te verlagen.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
P: patiënten met een acuut herseninfarct en de onderstaande karakteristieken a tot c;
I: behandeling met intraveneuze alteplase;
C: standaardbehandeling zonder alteplase;
O: functionele uitkomst, sterfte, intracraniële bloedingen.
Er wordt onderscheid gemaakt tussen patiënten met een herseninfarct op basis van de volgende karakteristieken:
a. start van de behandeling binnen drie uur of tussen drie en viereneenhalf uur;
b. leeftijd hoger dan wel lager dan 80 jaar;
c. ernst van de uitvalsverschijnselen: mild, matig ernstig tot ernstig, of zeer ernstig.
Relevante uitkomstmaten
De werkgroep achtte de volgende uitkomstmaten belangrijk voor de besluitvorming: ‘sterfte of afhankelijkheid’, ‘sterfte’, ’overleven zonder beperkingen’ - dat wil zeggen een score op de modified Rankin Scale (mRS) 0 of 1- en ‘symptomatische (inclusief fatale) intracraniële bloeding’.
Definities
- overlijden of afhankelijkheid: score op de mRS ≥ 3 (in de Cochrane review is bij trials waar geen mRS beschikbaar was gebruik gemaakt van de Barthel Index);
- (vrijwel) volledig herstel = overleven zonder beperkingen: score op de mRS van 0 of 1;
- symptomatische intracraniële bloeding: intracraniële bloeding die tot een (tijdelijke) toename van de neurologische verschijnselen leidt, of tot overlijden (de precieze definities verschilden overigens tussen de studies);
- Overlijden (binnen de studieperiode).
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase en Cochrane werd in 2014 met relevante zoektermen gezocht naar artikelen over trombolyse met alteplase. De zoekverantwoording is weergegeven in de bijlage. De literatuurzoekactie leverde 312 treffers op. Studies die voldeden aan de volgende selectiecriteria zijn opgenomen in de samenvatting van de literatuur: patiënten met een herseninfarct, RCT naar behandeling met intraveneus alteplase in vergelijking met standaardbehandeling zonder intraveneus alteplase en uitkomsten gerapporteerd als functioneel herstel en/of sterfte.
Referenties
- Ahmed N, Wahlgren N, Brainin M, et al. Relationship of Blood Pressure, Antihypertensive Therapy, and Outcome in Ischemic Stroke Treated With Intravenous Thrombolysis. Stroke 2009; 40:2442-2449.
- Barreto AD, Fanale CV, Alexandrov AV, et al. Prospective, open-label safety study of intravenous recombinant tissue plasminogen activator in wake-up stroke. Ann Neurol. 2016;80:211-218.
- Castillo J, Leira R, García MM, Serena J, Blanco M, Dávalos A. Blood pressure decrease during the acute phase of ischemic stroke is associated with brain injury and poor stroke outcome. Stroke. 2004;35:520–526.
- Charidimou A, Fox Z, Werring DJ. Do cerebral microbleeds increase the risk of intracerebral hemorrhage after thrombolysis for acute ischemic stroke? Int J Stroke. 2013;8:E1-2.
- Charidimou A, Turc G, Oppenheim C, Yan S, Scheitz JF, Erdur H, et al. Microbleeds, Cerebral Hemorrhage, and Functional Outcome After Stroke Thrombolysis. Stroke. 2017 Aug;48(8):2084-2090.
- Cordonnier C, Al-Shahi Salman R, Wardlaw J. Spontaneous brain microbleeds: Systematic review, subgroup analyses and standards for study design and reporting. Brain. 2007;130:1988-2003.
- Diener HC Bernstein R, Butcher K, et al. Thrombolysis and thrombectomy in patients treated with dabigatran with acute ischemic stroke: Expert opinion, Int J Stroke 2016; 12:9-12.
- Dirks M, Niessen LW, Koudstaal PJ, et al. Intravenous thrombolysis in acute ischaemic stroke: From trial exclusion criteria to clinical contraindications. An international delphi study. J.Neurol.Neurosurg.Psychiatry. 2007;78:685-689.
- Dirks M, Zonneveld TP, Dippel DW, Nederkoorn PJ, van de Beek D, van Oostenbrugge RJ, Kruyt ND. Elevated pretreatment blood pressure and IV thrombolysis in stroke. Neurology. 2015 Apr 7;84(14):1419-25.
- Emberson J, Lees KR, Lyden P, et al. Effect of treatment delay, age, and stroke severity on the effects of intravenous thrombolysis with alteplase for acute ischaemic stroke: a meta-analysis of individual patient data from randomised trials. Lancet. 2014;384(9958):1929-35.
- Kermer, P., C. C. Eschenfelder, H. C. Diener, et al. Antagonizing Dabigatran by Idarucizumab in Cases of Ischemic Stroke or Hemorrhage in Germany - a National Case Collection. Int J Stroke 2017;12:383-91.
- Levy DE, Brott TG, Haley EC Jr, Marler JR, Sheppard GL, Barsan W, Broderick JP. Factors related to intracranial hematoma formation inpatients receiving tissue-type plasminogen activator for acute ischemic stroke. Stroke.1994; 25:291-297
- Morelli N, Rota E, Immovilli P, et al. Computed tomography perfusion-based thrombolysis in wake-up stroke. Intern Emerg Med. 2015;10:977-984.
- Myslimi F, Caparros F, Dequatre-Ponchelle N, et al. Orolingual Angioedema During or After Thrombolysis for Cerebral Ischemia. Stroke. 2016;47(7):1825–1830.
- NINDS. Tissue plasminogen activator for acute ischemic stroke. The national institute of neurological disorders and stroke rt-pa stroke study group. N.Engl.J.Med. 1995;333:1581-1587.
- Smith EE, Fonarow GC, Reeves MJ, et al. Outcomes in mild or rapidly improving stroke not treated with intravenous recombinant tissue-type plasminogen activator: Findings from get with the guidelines-stroke. Stroke. 2011;42:3110-3115.
- Tsivgoulis G, Zand R, Katsanos AH, Turc G, Nolte CH, Jung S, Cordonnier C, Fiebach JB, Scheitz JF, Klinger-Gratz PP, Oppenheim C, Goyal N, Safouris A, Mattle HP, Alexandrov AW, Schellinger PD, Alexandrov AV. Risk of Symptomatic Intracerebral Hemorrhage After Intravenous Thrombolysis in Patients With Acute Ischemic Stroke and High Cerebral Microbleed Burden: A Meta-analysis. JAMA Neurol. 2016 Jun 1;73(6):675-83.
- Wardlaw JM, Murray V, Berge E, et al. Thrombolysis for acute ischaemic stroke. Cochrane Database Syst Rev. 2014;(4).
- Wardlaw JM, Murray V, Berge E, et al. Recombinant tissue plasminogen activator for acute ischaemic stroke: an updated systematic review and meta-analysis. Lancet. 2012;379(9834):2364-72. doi: 10.1016/S0140-6736(12)60738-7.
- Zinkstok SM, Engelter ST, Gensicke H, et al. Safety of thrombolysis in stroke mimics: Results from a multicenter cohort study. Stroke. 2013;44:1080-1084.
Evidence tabellen
Exclusietabel
|
H6.2 Trombolyse |
|
|
|
Referenties geselecteerde systematic review |
Selectie? |
Eventueel reden exclusie |
|
6) Bor-Seng-Shu E, Nogueira RC, Figueiredo EG, Evaristo EF, Conforto AB, Teixeira MJ. Sonothrombolysis for acute ischemic stroke: a systematic review of randomized controlled trials. (Review). Neurosurgical Focus 2012 Jan;32(1):E5. Ref ID: 69 |
nee |
Niet conform PICO
Sono-trombolyse |
|
(7) Charidimou A, Kakar P, Fox Z, Werring DJ. Cerebral microbleeds and the risk of intracerebral haemorrhage after thrombolysis for acute ischaemic stroke: systematic review and meta-analysis. (Review). Journal of Neurology, Neurosurgery & Psychiatry 2013 Mar;84(3):277-80. |
Nee |
Niet conform PICO
Bestudeert associatie microbloedingen en risico hersenbloeding |
|
(13) Desilles JP, Meseguer E, Labreuche J, Lapergue B, Sirimarco G, Gonzalez-Valcarcel J, et al. Diabetes mellitus, admission glucose, and outcomes after stroke thrombolysis: a registry and systematic review. (Review). Stroke 2013 Jul;44(7):1915-23. |
? |
Subgroep patiënten met diabetes |
|
(16) Echouffo-Tcheugui JB, Woodward M, Kengne AP. Predicting a post-thrombolysis intracerebral hemorrhage: a systematic review. (Review). Journal of Thrombosis & Haemostasis 2013 May;11(5):862-71. |
Nee |
Niet conform PICO
Bijwerkingen ICH: risico stratificatie model |
|
(40) Miedema I, Luijckx GJ, De KJ, Koch M, Uyttenboogaart M. Thrombolytic therapy for ischaemic stroke in patients using warfarin: a systematic review and meta-analysis. (Review). Journal of Neurology, Neurosurgery & Psychiatry 2012 May;83(5):537-40. |
? |
Subgroep patiënten die warfarine gebruiken |
|
(42) Collaborative Group, Sandercock P, Wardlaw JM, Lindley RI, Dennis M, Cohen G, et al. The benefits and harms of intravenous thrombolysis with recombinant tissue plasminogen activator within 6 h of acute ischaemic stroke (the third international stroke trial (IST-3)): a randomised controlled trial.(Erratum appears in Lancet. 2012 Aug 25;380(9843):730). Lancet 2012 Jun 23;379(9834):2352-63. |
Nee |
Niet conform PICO Trombolyse met rtPA |
|
(53) Ricci S, Dinia L, Del SM, Anzola P, Mazzoli T, Cenciarelli S, et al. Sonothrombolysis for acute ischaemic stroke. (Review)(Update of Cochrane Database Syst Rev. 2012;6:CD008348; PMID: 22696378). Cochrane Database of Systematic Reviews 2012;10:CD008348. |
Nee |
Niet conform PICO
Sono-trombolyse |
|
(68) Wardlaw JM, Murray V, Berge E, del ZG, Sandercock P, Lindley RL, et al. Recombinant tissue plasminogen activator for acute ischaemic stroke: an updated systematic review and meta-analysis. (Review). Lancet 2012 Jun 23;379(9834):2364-72. |
Nee |
Niet conform PICO
Trombolyse met rtPA |
|
(69) Wardlaw JM, Koumellis P, Liu M. Thrombolysis (different doses, routes of administration and agents) for acute ischaemic stroke. (Review)(Update of Cochrane Database Syst Rev. 2004;(4):CD000514; PMID: 15494998). Cochrane Database of Systematic Reviews 2013;5:CD000514. |
? |
Wel alteplase deel meenemen |
|
(70) Whiteley WN, Slot KB, Fernandes P, Sandercock P, Wardlaw J. Risk factors for intracranial hemorrhage in acute ischemic stroke patients treated with recombinant tissue plasminogen activator: a systematic review and meta-analysis of 55 studies. (Review). Stroke 2012 Nov;43(11):2904-9. |
Nee |
Niet conform PICO
Risicofactoren ICH |
|
(144) Michel P, Ntaios G, Reichhart M, Schindler C, Bogousslavsky J, Maeder P, et al. Perfusion-CT guided intravenous thrombolysis in patients with unknown-onset stroke: a randomized, double-blind, placebo-controlled, pilot feasibility trial. Neuroradiology 2012 Jun;54(6):579-88. |
Ja? |
Alteplase versus placebo
Subgroup patiënten met supratentorial stroke of unknown onset |
|
(163) Parsons M, Spratt N, Bivard A, Campbell B, Chung K, Miteff F, et al. A randomized trial of tenecteplase versus alteplase for acute ischemic stroke. New Engl J Med 2012 Mar 22;366(12):1099-107. |
nee |
Niet conform PICO Alteplase Tenecteplase: 2 doses |
|
(232) Zinkstok SM, Roos YB, ARTIS i. Early administration of aspirin in patients treated with alteplase for acute ischaemic stroke: a randomised controlled trial. Lancet 2012 Aug 25;380(9843):731-7. |
Nee |
Niet conform PICO
Acetylsalicylzuur+alteplase en alteplase |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-06-2021
Beoordeeld op geldigheid : 12-09-2024
Uiterlijk in 2022 bepaalt het bestuur van de Nederlandse Vereniging voor Neurologie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn of modules te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Neurologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Samenstelling werkgroep
Kerngroep
- Dr. B. (Bob) Roozenbeek, (voorzitter), neuroloog, Erasmus MC Rotterdam, namens de NVN
- Prof. dr. R.M. (Renske) van den Berg-Vos, neuroloog, OLVG Amsterdam, en Amsterdam UMC, locatie AMC, namens de NVN
- Prof. dr. J. (Jeannette) Hofmeijer, neuroloog, Rijnstate ziekenhuis Arnhem, namens de NVN
- Prof. dr. J.M.A. Visser-Meily, revalidatiearts, UMC Utrecht, namens de VRA
- A.F.E. (Arianne) Verburg, huisarts, namens het NHG
- Dr. H.B. (Bart) van der Worp, neuroloog, UMC Utrecht, namens de NVN
- Dr. S.M. (Yvonne) Zuurbier, neuroloog in opleiding, AMC Amsterdam, namens de NVN
- Prof. dr. W. (Wim) van Zwam, radioloog, Maastricht UMC, namens de NVvR
Met ondersteuning van
- Dr. M.L. Molag, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van den Berg-Vos |
Neuroloog |
geen |
"Voorzitter werkgroep CVA van het Transmuraal Platform Amsterdam (betaald dmv vacatiegelden) Lid focusgroep CVA ROAZ Noord-Holland (onbetaald) Vertrouwenspersoon voor A(N)IOS in OLVG (onbetaald) Bestuurslid Kennisnetwerk CVA Nederland (onbetaald) Lid SEH gebruikersoverleg in OLVG, locatie West (onbetaald) Lid Antistollings Commissie in het in het Zaans Medisch Centrum te Zaandam (onbetaald)" |
geen |
|
Dippel |
Neuroloog |
geen |
"Hoofdonderzoeker MR CLEAN trial ISRCTN10888758 en NTR1804 Hoofdonderzoeker MR CLEAN registry (https://www.mrclean-trial.org/) Hoofdonderzoeker MR CLEAN MED trial ISRCTN Research leider CONTRAST consortium (https://www.contrast-consortium.nl/) The MR CLEAN trial was deels gefinancierd door de Hartstichting, en middels financiele bijdragen zonder voorwaarden behoudens milestones, van AngioCare BV, Medtronic/Covidien/EV3®, MEDAC Gmbh/LAMEPRO, Penumbra Ine., Stryker®, and Top Medical/Concentric. Alle bijdragen werden betaald aan Erasmus MC. Het CONTRAST consortium wordt ondersteund door het Netherlands Cardiovascular Research lnitiative (CVON), een initiatief van de Hartstichting, en door de Nederlandse Hersenstichting. Erasmus MC ontving voor het CONTRAST consortium additionele financiele ondersteuning van Medtronic, en voor het uitvoeren van MR CLEAN NO-IV financiele ondersteuning van Stryker European Operations BIJVOORBEELD Alle bijdragen werden betaald aan Erasmus MC, zonder voorwaarden behoudens milestones. " |
geen |
|
Hofmeijer |
Neuroloog (0,6 fte) |
Hoogleraar Universiteit Twente (0,4 fte) |
geen |
geen |
|
Roozenbeek |
Neuroloog |
geen |
Lid van CONTRAST, coördineert onderzoeksprojecten op gebied van acute beroertezorg gefinancierd door Stichting BeterKeten, Stichting THEIA, Erasmus Universiteit en Erasmus MC |
Geen |
|
Verburg |
Huisarts en wetenschappelijk medewerker NHG |
Wetenschappelijk medewerker NHG |
geen |
Geen |
|
Visser-Meilij |
Revalidatiearts, hoogleraar en afdelingshoofd |
geen |
geen |
Geen |
|
Van der Worp |
Neuroloog |
Voorzitter European Stroke Organisation (ESO), onbetaald. Voorzitter schrijfcomissie ESO bij de richtlijn over “space-occupying infaction” |
Adviezen aan/consultancy voor Boehringer Ingelheim, producent van onder anderen alteplase en dabigatron. |
Uitsluiting besluitvorming alteplase en dabigatran |
|
Zuurbier |
AIOS neurologie |
geen |
Wetenschappelijk onderzoek gericht op centraal veneuze trombose (onbetaald) |
Geen |
|
Van Zwam |
Neuro-interventieradioloog |
geen |
Consultancy activiteiten voor Stryker en Cerenovus, lid CONTRAST, MRCLEAN LATE |
Geen invloed op richtlijnonderwerpen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door gebruik te maken van kwaliteitscriteria vanuit patiëntenperspectief voor CVA, ontwikkeld door Harteraad. Verder worden Harteraad, de Hartstichting en Hersenletsel.nl betrokken bij de module. Deze partijen zijn niet aanwezig bij vergaderingen, maar worden door middel van notulen van de vergadering door de kerngroep op de hoogte gehouden. Ook worden deze partijen betrokken bij relevante onderwerpen. De conceptmodules zijn tevens voor commentaar aan bovengenoemde verenigingen voorgelegd.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden in de bijlagen.
Werkwijze
AGREE
Deze module is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration:
- AMSTAR - voor systematische reviews;
- Cochrane - voor gerandomiseerd gecontroleerd onderzoek;
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de module is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Kennislacunes
Tijdens de ontwikkeling van deze module is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de bijlage Kennislacunes.
Commentaar- en autorisatiefase
De conceptmodule werd aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt)organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve module werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Database: Medline (OVID) 2012 - april, 2014
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) 2012-april 2014 Engels, Nederlands, Duits, Frans |
1 exp brain ischemia/ (narrower terms zijn: exp brain infarction/ or brain stem infarctions/ or lateral medullary syndrome/ or cerebral infarction/ or dementia, multi-infarct/ or infarction, anterior cerebral artery/ or infarction, middle cerebral artery/ or infarction, posterior cerebral artery/ or hypoxia-ischemia, brain/ or ischemic attack, transient/ or vertebrobasilar insufficiency/ or subclavian steal syndrome/) (81018) 2 exp intracranial embolism and thrombosis/ (18094) 3 ((infarct* or isch?emi*) adj3 (brain or cerebral or stroke)).ti,ab. (78673) 4 1 or 2 or 3 (130375) 5 limit 4 to (dutch or english or french or german) (114333) 7 limit 5 to yr=2012 -Current (15476) 15 (tPA or t-PA or rtPA or rt-PA or plasminogen or plasmin or alteplase or actilyse).tw. (56329) 16 Tissue Plasminogen Activator/ (15116) 17 Thrombolytic Therapy/ (18055) 18 15 or 16 or 17 (72068) 19 7 and 18 (1331) 20 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp Review Literature as Topic/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and review/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (204692) 21 19 and 20 (81) – 68 uniek 27 (randomized controlled trial/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or randomized controlled trial.pt. or random*.ti,ab. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (846024) 28 19 and 27 (210) 29 21 or 28 (249) 30 28 not 21 (168) – 155 uniek |
312 |
|
Embase (Elsevier) |
'brain infarction'/exp/mj OR 'brain ischemia'/exp/mj OR ((infarct* OR isch?emi*) NEAR/3 (brain OR cerebral OR stroke)):ab,ti AND (tpa:ab,ti OR 't pa':ab,ti OR rtpa:ab,ti OR 'rt pa':ab,ti OR plasminogen:ab,ti OR plasmin:ab,ti OR alteplase:ab,ti OR actilyse:ab,ti OR 'tissue plasminogen activator'/exp/mj OR 'fibrinolytic therapy'/exp/mj) AND ((dutch)/lim OR (english)/lim OR (french)/lim OR (german)/lim) AND (embase)/lim AND (2012-2014)/py
'meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp)) 41 SR, 12 uniek
AND ('randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp) 118 referenties, 46 uniek |
|
|
Cochrane (Wiley) |
((infarct* or isch?emi*) near/3 (brain or cerebral or stroke)):ti,ab,kw and (tpa or 't pa' or rtpa or 'rt pa' or plasminogen or plasmin or alteplase or actilyse) (Word variations have been searched) 55 referenties, 31 uniek |
