Intraveneuze behandeling met tenecteplase
Uitgangsvraag
Wat zijn de indicaties en contra-indicaties voor behandeling met iv tenecteplase bij patiënten met een herseninfarct?
Aanbeveling
Behandel patiënten met een acuut herseninfarct zonder relevante contra-indicaties zo snel mogelijk met intraveneus alteplase. Gebruik tenecteplase niet als standaard behandeling.
Overwegingen
Alteplase is een bewezen effectieve behandeling van het acute herseninfarct.(Wardlaw, 2014)
Meta-analyse van data van vijf gerandomiseerde klinische trials suggereert dat intraveneuze behandeling met tenecteplase even effectief is als intraveneuze behandeling met alteplase ter bevordering van het functionele herstel van patiënten met een herseninfarct. Tevens suggereren de data gelijke veiligheid. Er zijn geen studies verricht met een design gericht op non-inferioriteit en de optimale dosering is onduidelijk.
Een gunstig effect van tenecteplase werd vooral geobserveerd in patiënten met een indicatie voor intra arteriële trombectomie, dus patiënten met proximale occlusie van een grote intracraniële slagader (Campbell 2018). Opmerkelijkerwijs werd in deze trial het betere functionele herstel in de tenecteplasegroep niet voorafgegaan door een daling van de NIHSS score. In kleine trials met heterogene patiëntengroepen (Haley 2010; Huang 2015; Parsons 2012) en in 551 patiënten met een relatief klein herseninfarct (Logallo 2017) was het gunstige effect van tenecteplase minder groot. De bewijskracht voor tenecteplase is laag, waardoor de effecten mogelijk zullen veranderen als er nieuwe studies verschijnen.
Bij kan een anaphylactoide reactie optreden. Deze is geassocieerd met het gelijktijdig gebruik van ACE inhibitors. Het recidief risico noch de relatie met herhaalde toediening van alteplase is onduidelijk (De Los Rios La Rosa, 2017, Hill 2003). Alleen bij bekende anaphalactoide reacties en gecontinueerd gebruik van ace remmers is er mogelijk een herhalingsrisico . Of dezelfde reacties bij tenecteplase optreden is niet duidelijk. Ze zijn bij ons weten niet gerapporteerd. De beste maatregel om deze reactie te voorkomen zal daarom zijn het vervangen van de ACE remmer door een ander antihyerptensivum.
Gezien het ontbreken van bewijs voor non-inferioriteit ten opzichte van alteplase, de relatief kleine trials met diverse patiëntengroepen, de geringe heterogeniteit van uitkomsten en onduidelijkheid over de optimale dosering en praktische overwegingen is de werkgroep van mening dat alteplase een meer zekere en veiliger keuze is dan tenecteplase.
Onderbouwing
Achtergrond
Snelle intraveneuze behandeling met alteplase verbetert de kans op een goed herstel bij een geselecteerde groep patiënten met een acuut herseninfarct. Er zijn aanwijzingen dat tenecteplase effectiever is. Deze aanwijzingen zijn gebaseerd op de biologische eigenschappen en de architectuur van tenecteplase. Het middel is resistenter tegen PAI-1, bindt zich minder goed aan plasminogeen in afwezigheid van fibrine. Hierdoor verwacht men minder systemische effecten van intraveneuze toediening.
Conclusies / Summary of Findings
Functionele uitkomst
|
Laag GRADE |
Trombolyse met tenecteplase geeft eenzelfde verbetering van de functionele uitkomst als alteplase.
(Bronnen: Campbell 2018, Haley 2010, Huang 2015, Logallo 2017, Parsons 2012) |
Mortaliteit
|
Laag GRADE |
Trombolyse met tenecteplase heeft een zelfde effect op mortaliteit als alteplase.
(Bronnen: Campbell 2018, Haley 2010, Huang 2015, Logallo 2017, Parsons 2012) |
Symptomatische intracraniële bloeding
|
Laag GRADE |
Trombolyse met tenecteplase heeft een zelfde effect op het optreden van symptomatische intracraniële bloedingen als alteplase.
(Bronnen: Campbell 2018, Haley 2010, Huang 2015, Logallo 2017, Parsons 2012) |
Samenvatting literatuur
Beschrijving studies
Vijf RCTs zijn opgenomen in de literatuuranalyse. Hieronder volgt een korte beschrijving van deze studies.
Campbell 2018, vergeleek of intraveneuze trombolyse (0,25 mg/kg; max 25 mg) met tenecteplase non-inferieur was aan alteplase (0,9 mg/kg, max 90 mg) bij 202 patiënten binnen 4,5 uur na het begin van het herseninfarct bij patiënten met een indicatie voor EVT. Uitkomsten: reperfusie op een initieel katheter angiogram, score op de modified Rankin scale, mortaliteit en symptomatische hersenbloedingen.
Haley 2010, vergeleek trombolyse met intraveneus tenecteplase met intraveneus alteplase in een IIB/III trial binnen drie uur na het begin van het herseninfarct. In deze studie werd gezocht naar een optimale tenecteplase dosis (0,1; 0,25; en 0,4 mg/kg tenecteplase) en werd een vergelijking gemaakt met alteplase (0,9 mg/kg rtPA). Deze studie werd gestopt vanwege trage rekrutering na 112 patiënten. Gerapporteerde uitkomsten waren score op de modified Rrankin scale, mortaliteit en symptomatische hersenbloedingen.
Huang 2015, vergeleek trombolyse met tenecteplase versus alteplase binnen 4,5 uur na het begin van een supratentoriaal herseninfarct (ATTEST studie) in een populatie waar vooraf geen patiëntenselectie met beeldvorming was gedaan. In totaal werden 104 patiënten gerandomiseerd over tenecteplase 0,25 mg/kg (maximaal 25 mg) of alteplase 0,9 mg/kg (maximaal 90 mg). Gerapporteerde uitkomsten waren: het deel van de penumbra dat gered was, functionele uitkomst, symptomatische intracraniële bloedingen en mortaliteit.
Logallo 2017, vergeleek trombolyse met tenecteplase (0,4 mg/kg maximaal 40 mg) versus alteplase (0,9 mg/kg, maximaal 90 mg) binnen 4,5 uur na het begin van een herseninfarct. In totaal werden 549 patiënten gerandomiseerd in de tenecteplasegroep en 549 in de alteplasegroep. Gerapporteerde uitkomsten waren: functionele uitkomst, symptomatische intracraniële bloedingen en mortaliteit.
Parsons 2012, vergeleek trombolyses met tenecteplase (0,1 mg/kg lichaamsgewicht) met alteplase (0,9 mg/kg lichaamsgewicht) bij 75 patiënten binnen 6 uur na het ontstaan van een herseninfarct bij patiënten met een perfusiedefect minstens 20% groter dan de kern van het infarct op CT perfusiescan. Gerapporteerde uitkomsten waren reperfusie, functionele uitkomst, symptomatische intracraniële bloedingen en mortaliteit.
Resultaten
Figuur 1 Patiënten die een slecht functioneel herstel hadden (score op de modified Rankin scale ≥3) na trombolyse met tenecteplase danwel alteplase na een herseninfarct.
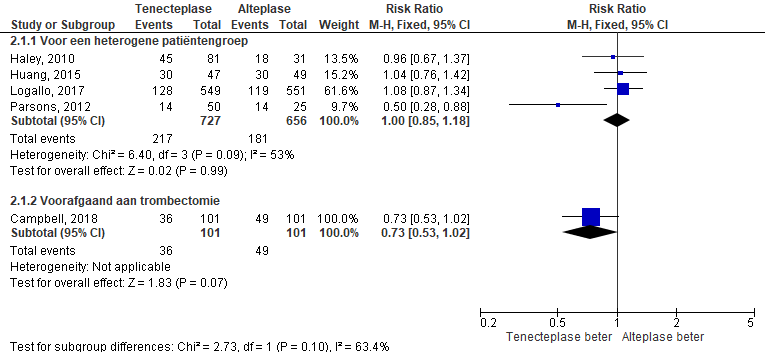
Bij patiënten die een slecht functioneel herstel hadden (score op de modified Rankin scale ≥3) werd trombolyse met tenecteplase vergeleken met alteplase (zie figuur 1). In de tenecteplasegroep hadden 253 van de 828 patiënten een slecht functioneel herstel en na standaard behandeling met alteplase 230 van de 757 patiënten. Voor een heterogene patiëntengroep is de risk ratio 1,00 (95% BI [0,85; 1,18]). Voor patiënten met een indicatie voor intraarteriële trombectomie is de risk ratio 0,73 (95% BI [0,53; 1,02]).
Figuur 2 Forest plot: Mortaliteit bij patiënten na trombolyse met tenecteplase danwel alteplase ter behandeling van een herseninfarct
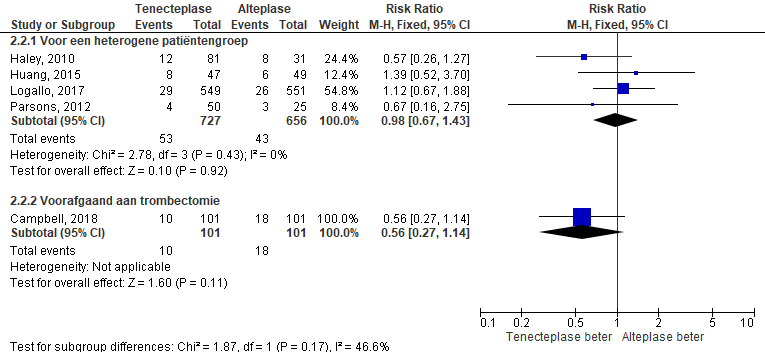
Mortaliteit na trombolyse met tenecteplase werd vergeleken met mortaliteit na alteplase (zie figuur 2). In de tenecteplasegroep overleden 63 van de 828 patiënten en na trombolyse met alteplase overleden 61 van de 757 patiënten. Voor een heterogene patiëntengroep is de risk ratio 0,98 (95% BI [0,67; 1,43]). Voor patiënten met een indicatie voor intra arteriële trombectomie is de risk ratio 0,56 (95% BI [0,27; 1,14]). Het verschil tussen de groepen is niet statistisch significant.
Figuur 3 Forest plot: Symptomatische intracraniële bloedingen bij patiënten die trombolyse met tenecteplase danwel alteplase kregen ter behandeling van een herseninfarct
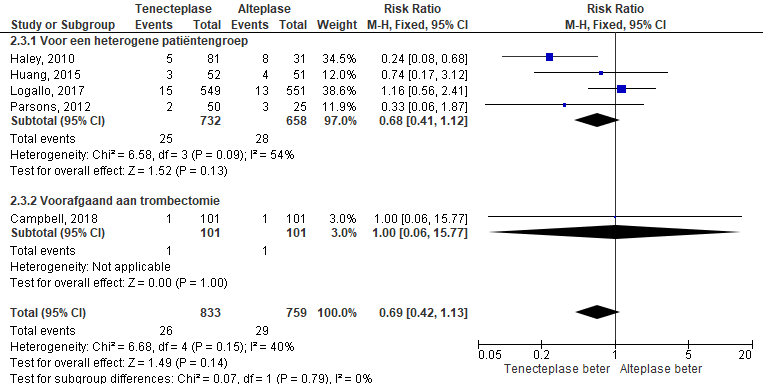
Het optreden van symptomatische intracraniële bloedingen na trombolyse met tenecteplase werd vergeleken met bloedingen bij trombolyse met alteplase (zie figuur 3). In de tenecteplasegroep traden 26 symptomatische hersenbloedingen op bij 833 patiënten en na alteplase behandeling traden 29 symptomatische hersenbloedingen op bij 759 patiënten. Voor een heterogene patiëntengroep is de risk ratio 0,68 (95% BI [0,41; 1,12]). Voor patiënten met een indicatie voor intra arteriële trombectomie is de risk ratio 1,0 (95% BI [0,06; 15,77]). Het verschil tussen de groepen is niet statistisch significant.
Bewijskracht van de literatuur
Functionele uitkomst
Dit werd bestudeerd in vijf RCTs. Er werd derhalve begonnen met een hoge bewijskracht. De bewijskracht werd verlaagd vanwege heterogene uitkomsten, mogelijk door een verschil in patiëntenselectie. Tevens werd verlaagd vanwege imprecisie: brede betrouwbaarheidsintervallen. De bewijskracht werd als ‘laag’ beoordeeld.
Mortaliteit
Dit werd bestudeerd in vijf RCTs. Er werd derhalve begonnen met een hoge bewijskracht. De bewijskracht werd verlaagd vanwege heterogene uitkomsten, mogelijk door een verschil in patiëntenselectie. Tevens werd verlaagd vanwege imprecisie: brede betrouwbaarheidsintervallen. De bewijskracht werd als ‘laag’ beoordeeld.
Symptomatische intracraniële bloeding
Dit werd bestudeerd in vijf RCTs. Er werd derhalve begonnen met een hoge bewijskracht. De bewijskracht werd verlaagd vanwege heterogene uitkomsten, mogelijk door een verschil in patiëntenselectie. Tevens werd verlaagd vanwege imprecisie: brede betrouwbaarheidsintervallen. De bewijskracht werd als ‘laag’ beoordeeld.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling(en):
P: patiënten met een acuut herseninfarct
I: behandeling met IV tenecteplase
C: behandeling met IV alteplase
O: functioneel herstel, mortaliteit, hersenbloedingen en reperfusie
Relevante uitkomstmaten
De werkgroep achtte mortaliteit en slecht functioneel herstel voor de besluitvorming kritieke uitkomstmaten, en hersenbloeding en reperfusie voor de besluitvorming belangrijke uitkomstmaten.
Definities:
Slecht functioneel herstel (overlijden of afhankelijkheid): score op de mRS ≥3 (in de Cochrane review is bij trials waar geen mRS beschikbaar was gebruik gemaakt van de Barthel Index);
symptomatische intracraniële bloeding: intracraniële bloeding die tot een (tijdelijke) toename van de neurologische verschijnselen leidt, bloeding in meer dan 30% van het geïnfarceerde gebied met een duidelijk ruimte-innemend effect of een bloeding op afstand van het infarct
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase, en Cochrane is met relevante zoektermen gezocht naar relevante literatuur over trombolyse met tenecteplase. De zoekverantwoording is weergegeven in de bijlage. De literatuurzoekactie leverde 161 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: patiënten met een herseninfarct, RCT naar behandeling met intraveneus tenecteplase in vergelijking met standaardbehandeling met alteplase en uitkomsten gerapporteerd als functioneel herstel en/of sterfte. Op basis van titel en abstract werden in eerste instantie 14 studies voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens negen studies geëxcludeerd (zie exclusietabel) en vijf studies definitief geselecteerd.
Vijf onderzoeken zijn opgenomen in de literatuuranalyse. De evidencetabellen hiervan en beoordeling van individuele studiekwaliteit kunt u in bijlage vinden.
Referenties
- Campbell BCV, Mitchell PJ, Churilov L, Yassi N, Kleinig TJ, Dowling RJ, et al. Tenecteplase versus Alteplase before Thrombectomy for Ischemic Stroke. N Engl J Med. 2018 Apr 26;378(17):1573-1582. PubMed PMID: 29694815.
- De Los Rios La Rosa F, Starosciak AK, Wolf B. Thrombolysis of a stroke patient with history of rtPA-associated angioedema. Neurol Clin Pract. 2017;7(6):541-543.
- Haley EC Jr, Thompson JL, Grotta JC, Lyden PD, Hemmen TG, Brown DL, et al. Tenecteplase in Stroke Investigators. Phase IIB/III trial of tenecteplase in acute ischemic stroke: results of a prematurely terminated randomized clinical trial. Stroke. 2010 Apr;41(4):707-11. PubMed PMID: 20185783.
- Hill MD, Lye T, Moss H, Barber PA, De Los Rios La Rosa F, Starosciak AK, Wolf B. Thrombolysis of a stroke patient with history of rtPA-associated angioedema. Neurol Clin Pract. 2017;7(6):541-543. Demchuk AM, Newcommon NJ, Green TL, Kenney C, Cole-Haskayne A, Buchan AM. Neurology. 2003 May 13;60(9):1525-7.
- Huang X, Cheripelli BK, Lloyd SM, Kalladka D, Moreton FC, Siddiqui A, Ford I, Muir KW. Alteplase versus tenecteplase for thrombolysis after ischaemic stroke (ATTEST): a phase 2, randomised, open-label, blinded endpoint study. Lancet Neurol. 2015 Apr;14(4):368-76. PubMed PMID: 25726502. Central PMCID: PMC2860601.
- Logallo N, Novotny V, Assmus J, Kvistad CE, Alteheld L, Rønning OM, et al. Tenecteplase versus alteplase for management of acute ischaemic stroke (NOR-TEST): a phase 3, randomised, open-label, blinded endpoint trial. Lancet Neurol. 2017 Oct;16(10):781-788. PubMed PMID: 28780236.
- Parsons M, Spratt N, Bivard A, Campbell B, Chung K, Miteff F, et al. A randomized trial of tenecteplase versus alteplase for acute ischemic stroke. N Engl J Med. 2012 Mar 22;366(12):1099-107. PubMed PMID: 22435369.
- Wardlaw JM, Murray V, Berge E, del Zoppo GJ. Thrombolysis for acute ischaemic stroke. Cochrane Database Syst Rev. 2014:CD000213
Evidence tabellen
Research question: Wat zijn de indicaties en contra-indicaties voor behandeling met iv tenecteplase trombolyse te worden gegeven aan patiënten met een herseninfarct?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
|
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Campbell, 2018 |
Type of study: RCT
Setting: hospital
Country: Australia
Source of funding: the National Health and Medical Research Council of Australia (1043242, 1035688, 1113352, 1111972), the Royal Australasian College of Physicians, the Royal Melbourne Hospital Foundation, the National Heart Foundation of Australia, and the Stroke Foundation of Australia, by infrastructure funding from the state government of Victoria, and by an unrestricted grant from Medtronic. |
Inclusion criteria: Patients were eligible if they could undergo intravenous thrombolysis within 4.5 hours after the onset of ischemic stroke and had cerebral vascular occlusion on CT angiography of the internal carotid artery, the first segment of the middle cerebral artery, the second segment of the middle cerebral artery, or the basilar artery and if treatment to retrieve the intraarterial clot could commence (arterial puncture) within 6 hours after stroke onset. No upper age limit; no restriction on clinical severity assessed NIHSS score
Exclusion criteria: severe preexisting disability, defined as a modified Rankin scale score of more than 3
N total at baseline: Intervention: 101 Control: 101
Important prognostic factors2: Age (mean ± SD) I: 70.4±15.1 C: 71.9±13.7
Sex: I: 57% M C: 51% M
Groups comparable at baseline? yes |
|
Describe intervention (treatment/procedure/test):
intravenous tenecteplase (at a dose of 0.25 mg per kilogram of body weight; maximum dose, 25 mg) |
Describe control (treatment/procedure/test):
alteplase (at a dose of 0.9 mg per kilogram; maximum dose, 90 mg). |
Length of follow-up: 90 days
Lost to follow-up: Not reported
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Ordinal score on the modified Rankin scale (range, 0 [no symptoms] to 6 [death]) at day 90: I: 2 C: 3
Functional independence (defined as a score on the modified Rankin scale of 0 to 2) at day 90. I: 65/101 = 64% C: 52/101 = 51%
Death within 90 days: 52 patients were death, there was no difference between I: 10/101 10% C: 18/101 18%
Occurrence of symptomatic intracranial hemorrhage within 36 hours, defined as an increase of at least 4 points in the NIHSS score that was associated with brain haemorrhage on imaging within 36 hours after symptom onset: I: 1/101= 1%) C: 1/101 = 1%)
|
|
|
Huang, 2015 |
Type of study: RCT
Setting: hospital
Country: Scotland
Source of funding: This study was funded by a grant (TSA 2010/04) from The Stroke Association. |
Inclusion criteria: clinically diagnosed supratentorial acute ischaemic stroke with measurable defi cit on the National Institutes of Health stroke scale (NIHSS),10 were within 4·5 h of symptom onset, were aged 18 years or older, were living independently pre-stroke, and were considered eligible for intravenous thrombolysis according to clinical guidelines.
Exclusion criteria: refl ected the current evidence regarding contraindications
N total at baseline: Intervention: 47 Control: 49
Important prognostic factors2: Age (SD) I: 71 (13) C: 71 (12)
Sex: I: 64% M C: 63% M
Groups comparable at baseline? yes |
|
Describe intervention (treatment/procedure/test):
Tenecteplase (0·25 mg per kg, to a maximum 25 mg as a single bolus)
|
Describe control (treatment/procedure/test):
Alteplase (0·9 mg per kg to a maximum 90 mg, with 10% of dose as initial bolus, followed by 90% in a 1 h infusion) or |
Length of follow-up: 3 months
Remarks: Eight patients ultimately had a diagnosis other than stroke and were excluded from the protocol-defined analysis.
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Ordinal score on the modified Rankin scale (range, 0 [no symptoms] to 6 [death]) at day 90: I: C:
Functional independence (defined as a score on the modified Rankin scale of 0 to 2) at day 90. I: 17/47 = 36% C: 19/49 =39%
Death within 90 days: 52 patients were death, there was no difference between I: 8/47 = 17% C: 6/49 = 12%
Occurrence of symptomatic intracranial hemorrhage within 36 hours, defined as an increase of at least 4 points in the NIHSS score that was associated with brain haemorrhage on imaging within 36 hours after symptom onset: I: 3/52 (6%) C: 4/51 (8%)
|
. |
|
Logallo, 2017 |
Type of study: RCT
Setting: hospital
Country: Norway
Source of funding: This study was funded by a grant from the Research Council of Norway. |
Inclusion criteria: eligible if they had clinically suspected acute ischaemic stroke with measurable deficits on the National Institutes of Health Stroke Scale (NIHSS), were admitted within 4·5 h of symptom onset or within 4·5 h of awakening with symptoms, were aged 18 years or older, were living independently pre-stroke, and were judged eligible for intravenous thrombolysis according to Norwegian clinical guidelines, which are similar to European guidelines. Patients who had symptoms on awakening or unknown onset were included in the study and treated off-label if mismatch between DW-MRI and FLAIR-MRI was detected. Patients eligible for intravenous thrombolysis as bridging therapy before endovascular treatment were included in the study. Inclusion of patients older than 80 years and patients with minor neurological deficits at presentation, previous history of stroke, and concomitant diabetes mellitus was allowed.
Exclusion criteria: See current evidence for contraindications
N total at baseline: Intervention: 549 Control: 551
Important prognostic factors2: Age (median) I: 70.8 ± 14.4 C: 71.2 ± 13.2
Sex: I:58 % M C: 62% M
Groups comparable at baseline? yes
|
|
Describe intervention (treatment/procedure/test):
Tenecteplase
tenecteplase (0·4 mg/kg to a maximum of 40 mg as a single bolus intravenously) |
Describe control (treatment/procedure/test):
Alteplase
Alteplase (0·9 mg/kg to a maximum of 90 mg, with 10% of the dose as initial bolus, followed by 90% in a 1 h intravenous infusion) |
Length of follow-up: 3 months
Lost to follow-up: 7 excluded (withdrawal of informed consent or reconsidered eligibility)
Incomplete outcome data:
Remarks |
Outcome measures and effect size (include 95%CI and p-value if available):
Ordinal score on the modified Rankin scale (range, 0 [no symptoms] to 6 [death]) at day 90: I: C:
Functional independence (defined as a score on the modified Rankin scale of 0 to 2) at day 90. I: (202+152+67=421)/549 = 77% C: (173+172+87=432)/551 = 78%
(Excellent functional outcome (defined as a score on the modified Rankin scale of 0 to 1) at day 90. I: 354/549 = 64% C: 345/551 = 63%)
Death within 90 days: 52 patients were death, there was no difference between I: 29/549.= 5% C: 26/551 = 5%
Occurrence of symptomatic intracranial hemorrhage within 36 hours, defined as an increase of at least 4 points in the NIHSS score that was associated with brain haemorrhage on imaging within 36 hours after symptom onset: I: 15/549 = 3%) C: 13/551 = 2%)
|
Median National Institutes of Health Stroke Scale score at baseline was 4 points (IQR 2-8). |
|
Haley, 2010 |
Type of study: RCT
Setting: hospital
Country: USA
Source of funding: grants from National Institute of Neurological Disordes and Stroke NIH |
Inclusion criteria: age 18 or over with serious neurological deficits believed to be on the basis of acute focal cerebral ischemia, and who were otherwise suitable for treatment with intravenous rt-PA within 3 hours of stroke onset using contemporary guidelines.
Exclusion criteria: Reasons for exclusion were reported
N total at baseline: Intervention: TNK in three doses 31 +31 + 19 = 81 Control: rt-PA = 31
Important prognostic factors2: Age (median) I: 68 C: 72
Sex: I: (12+16+13)/81 51% M C: 51 % M
Groups comparable at baseline? Patients randomized to rt-PA were older and had more severe stroke deficits at baseline than patients in the tenecteplase groups
|
|
Describe intervention (treatment/procedure/test):
TNK in three doses the dose-selection component of Phase IIB compared three tenecteplase doses: 0.1 mg/kg, 0.25 mg/kg, and 0.4 mg/kg. |
Describe control (treatment/procedure/test):
Rt PA |
Length of follow-up: 3 months
Incomplete follow-up: Four patients were either lost to follow up or voluntarily withdrew from the trial. Their 3 month Rankin categories were imputed using the last observation carried forward or the last recorded NIH Stroke Scale score using a pre-specified algorithm
|
Outcome measures and effect size (include 95%CI and p-value if available):
Ordinal score on the modified Rankin scale (range, 0 [no symptoms] to 6 [death]) at day 90: I: C:
Functional independence (defined as a score on the modified Rankin scale of 0 to 2) at day 90. I: (14+15+7=36)/(31+31+19=81)=44% C: 13/31 = 42 %
Death within 90 days: 52 patients were death, there was no difference between I: (2+7+3)/(31+31+19) 15% C: (8/31) 26%
Occurrence of symptomatic intracranial hemorrhage within 36 hours, defined as an increase of at least 4 points in the NIHSS score that was associated with brain haemorrhage on imaging within 36 hours after symptom onset: I: ((0+2+3)/(31+31+19)=6%) C: (1/31) 3%)
|
Three doses of tenecteplase compared
The trial was prematurely terminated for slow enrollment after only 112 patients had been randomized at 8 clinical centers between 2006 and 2008. The 0.4 mg/kg dose was discarded as inferior after only 73 patients were randomized, but the selection procedure was still unable to distinguish between 0.1 mg/kg and 0.25 mg/kg as a propitious dose at the time the trial was stopped |
|
Parsons, 2012 |
Type of study: RCT
Setting: hospital
Country: Australia
Source of funding: Supported by a grant from the Australian National Health and Medical Research Council. Dr. Parsons reports receiving advisory-board fees from Bayer Australia; Dr. Campbell, consultancy fees from Lundbeck, speaker payments from Boehringer Ingelheim Australia, and grant support from Cardiovascular Lipid Australia; Dr. Bladin, advisory-board fees from Bayer Australia; Dr. Donnan, consultancy fees from Boehringer Ingelheim Australia and Bayer Australia; Dr. Davis, consultancy fees from Orsan Technologies and Ever Pharma; and Dr. Levi, consultancy fees from Boehringer Ingelheim Australia. No other potential conflict of interest relevant to this article was reported. |
Inclusion criteria: first-ever hemispheric ischemic stroke who were 18 years of age or older, had a score greater than 4 on the National Institutes of Health Stroke Scale (NIHSS; a 42-point scale that quantifies neurologic deficits in 11 categories, with higher scores indicating more severe deficits), and a premorbid score of 2 or less on the modified Rankin scale (which ranges from 0 to 6, with 0 indicating no symptoms and 6 indicating death) (Table 1).
Exclusion criteria: Standard contra-indications to alteplase
N total at baseline: Intervention: 50 (25 each dose) Control: 25
Important prognostic factors2: Age (median) I 0.1: 72±6.9 I 0.25: 68±9.4 C: 70±8.4
Sex: I: 52% M C: 48% M
Groups comparable at baseline? the alteplase group included fewer persons who smoked (P = 0.01); this group also included fewer persons with diabetes (P = 0.01)
|
|
Describe intervention (treatment/procedure/test):
Tenecteplase (0.1 mg per kilogram, administered as a single bolus, with a maximum dose of 10 mg; or 0.25 mg per kilogram, administered as a single bolus, with a maximum dose of 25 mg).
|
Describe control (treatment/procedure/test):
Standard dose of alteplase (0.9 mg per kilogram, the first 10% administered as an initial bolus and the remainder over a 1-hour period, with a maximum dose of 90 mg) |
Length of follow-up:
Remarks:
Incomplete outcome data:
|
Outcome measures and effect size (include 95%CI and p-value if available):
Ordinal score on the modified Rankin scale (range, 0 [no symptoms] to 6 [death]) at day 90: I: C:
Functional independence (defined as a score on the modified Rankin scale of 0 to 2) at day 90. I: 36/50 = 72% C: 11/25 = 44%
Death within 90 days: 52 patients were death, there was no difference between I: 4/50 = 8% C: 3/25 = 12%
Occurrence of symptomatic intracranial hemorrhage within 36 hours, defined as an increase of at least 4 points in the NIHSS score that was associated with brain haemorrhage on imaging within 36 hours after symptom onset: I: 2/50 = 4% C: 3/25 = 12%
|
mean (±SD) NIHSS score for all patients in the trial was relatively high at 14.4±2.6 |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Risk of bias table for intervention studies (randomized controlled trials)
Research question:
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Campbell, 2018 |
Randomization was performed with the use of a centralized Web server, with stratification according to the site of the involved vessel (internal carotid artery, basilar artery, first segment of the middle cerebral artery, or second segment of the middle cerebral artery). |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Haley, 2010 |
Patients were randomized using a web-based randomization procedure, within sites to quadruplets – one of the three tenecteplase doses, or rt-PA – but only the triplet tenecteplase arms were involved in the selection procedure. (The rt-PA patients provided concurrent randomized controls for later comparisons of 3 month outcome with the selected tenecteplase dose.) |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Huang, 2015 |
A mixed minimisation and randomisation approach. Within each block of eight patients, two were allocated at random (one to alteplase, one to tenecteplase) and six were allocated using minimisation with respect to age (≤80 years and ≥81 years) and NIHSS score (1–9, 10–15, and 16–42). When the minimisation algorithm did not favour allocation to either group, the allocation was random. The order with which patients were allocated by randomisation or minimisation (and the random allocation to be used, if required) was defined by a prespecified sequence generated using the method of randomised permuted blocks. The allocation to treatment groups was obtained by telephone to an interactive voice response system (IVRS) developed at the Robertson Centre for Biostatistics, University of Glasgow. The computer program (and random seed) used to generate the minimisation and randomisation sequence was written by a statistician who was not involved with the final analysis, and was stored in a secure network location with access restricted to staff responsible for the development and maintenance of the study IVRS. Clinicians responsible for routine clinical care were aware of treatment assignment because drug administration schedules differ (alteplase requires to be administered as an infusion over 1 h). |
unlikely |
unlikely |
Unclear, not blinded |
unlikely |
unlikely |
unlikely |
unlikely |
|
Logallo, 2017 |
Patients meeting inclusion criteria were randomly assigned (1:1) to receive either tenecteplase or alteplase (0·9 mg/kg to a maximum of 90 mg, with 10% of the dose as initial bolus, followed by 90% in a 1 h intravenous infusion), via block randomisation (block size of four) stratified for site of inclusion but not for baseline characteristics. A biostatistician (JA) created the randomisation sequence using computer-generated random numbers. Envelopes were used to simplify and speed up logistics. To minimise predictability of content in future envelopes and ensure proper randomisation, centres were not informed about block size and envelopes were numbered from 1 to 150. Patients were not informed of treatment allocation. |
unlikely |
unlikely |
Unclear, not blinded |
unlikely |
unlikely |
unlikely |
unlikely |
|
Parsons, 2012 |
central block randomization was performed by the Centre for Clinical Epidemiology and Biostatistics, University of Newcastle, in blocks of 15 to allow the data and safety monitoring board to review blinded safety data after the recruitment of every 15 patients. Randomization was performed by means of a central telephone service. |
unlikely |
unlikely |
Unclear, not blinded |
unlikely |
unlikely |
unlikely |
unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Bivard, 2017 |
Gaat over target mismatch criteria, sluit niet aan op de PICO |
|
Campbell, 2018 |
Alleen studie design |
|
Huang, 2015 |
Uitkomsten fibrinolytic activity en protrombinetijd, dat komt niet overeen met PICO |
|
Huang, 2015 |
Dit is hetzelfde artikel als Huang, 2016 |
|
Huang, 2016 |
Analyse van patiëntdata van 3 RCTs, inmiddels zijn er 5 RCTs beschikbaar |
|
Rother, 2013 |
Breed beschrijvend artikel, sluit niet aan op PICO |
|
Thelengana, 2018 |
Systematische review van 4 RCTs, inmiddels zijn er 5 RCTs beschikbaar |
|
Tsivgoulis, 2014 |
Opzet van dit artikel is veel breder dan de PICO, ook allerlei andere strategieën worden vergeleken |
|
Wardlaw |
Artikel niet vindbaar, wellicht alleen een abstract |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 10-04-2019
Beoordeeld op geldigheid : 12-09-2024
De ontwikkelingen op het gebied van de acute opvang, secundaire preventie en revalidatie volgen elkaar in steeds sneller tempo op. Daarom werd in 2018 een kerngroep van neurologen, revalidatiearts en huisarts geïnstalleerd om snel op nieuwe ontwikkelingen te kunnen inspelen. In 2018 werden de modules over plaatjesaggregatieremmers en Directe Orale Anticoagulantia geupdate en nieuwe modules over tenecteplase en endovasculaire behandeling ontwikkeld. In 2019 wordt opnieuw geprioriteerd welke wijzigingen nodig zijn.
Deze kerngroep vergadert tenminste tweemaal per jaar om op basis van eigen inzichten en/of signalen uit het veld te beoordelen of hernieuwde aanvulling en/of revisie van (onderdelen van) de richtlijn gewenst is. Andere disciplines namen zitting in een klankbordgroep en worden betrokken afhankelijk van het onderwerp van de te reviseren module.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (Kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van deze op wetenschappelijk bewijs gebaseerde (evidence based) richtlijn is het bieden van een basis voor optimale zorg voor patiënten met een herseninfarct of hersenbloeding. Daarnaast draagt de richtlijn bij aan afstemming van de zorg tussen de verschillende zorgverleners en aan het terugdringen van ongewenste praktijkvariatie.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met een herseninfarct of hersenbloeding.
Samenstelling werkgroep
Kerngroep
- prof. dr. D.W.J. (Diederik) Dippel (voorzitter), neuroloog, Erasmus MC Rotterdam, namens de Nederlandse Vereniging voor Neurologie (NVN)
- dr. R.M. (Renske) van den Berg-Vos, neuroloog, OLVG West Amsterdam, namens de NVN
- dr. J. (Jeannette) Hofmeijer, neuroloog, Rijnstate ziekenhuis Arnhem, namens de NVN
- dr. J.M.A. Visser-Meilij, revalidatiearts, UMC Utrecht, namens de VRA
- A.F.E. (Arianne) Verburg, huisarts, namens het Nederlands Huisartsen Genootschap (NHG)
- dr. H.B. (Bart) van der Worp, neuroloog, UMC Utrecht, namens de NVN
- dr. S.M. (Yvonne) Zuurbier, neuroloog in opleiding, AMC Amsterdam, namens de NVN
- dr. W. (Wim) van Zwam, radioloog, Maastricht UMC, namens de Nederlandse Vereniging voor Radiologie (NVvR)
Met ondersteuning van:
- Dr. M.L. Molag, adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van den Berg-Vos |
Neuroloog |
geen |
"Voorzitter werkgroep CVA van het Transmuraal Platform Amsterdam (betaald dmv vacatiegelden) Lid focusgroep CVA ROAZ Noord-Holland (onbetaald) Vertrouwenspersoon voor A(N)IOS in OLVG (onbetaald) Bestuurslid Kennisnetwerk CVA Nederland (onbetaald) Lid SEH gebruikersoverleg in OLVG, locatie West (onbetaald) Lid Antistollings Commissie in het in het Zaans Medisch Centrum te Zaandam (onbetaald)" |
geen |
|
Dippel |
Neuroloog |
geen |
"Hoofdonderzoeker MR CLEAN trial ISRCTN10888758 en NTR1804 Hoofdonderzoeker MR CLEAN registry (www.mrclean-trial.org) Hoofdonderzoeker MR CLEAN MED trial ISRCTN Research leider CONTRAST consortium (www.contrast-consortium.nl) The MR CLEAN trial was deels gefinancierd door de Hartstichting, en middels financiele bijdragen zonder voorwaarden behoudens milestones, van AngioCare BV, Medtronic/Covidien/EV3®, MEDAC Gmbh/LAMEPRO, Penumbra Ine., Stryker®, and Top Medical/Concentric. Alle bijdragen werden betaald aan Erasmus MC. Het CONTRAST consortium wordt ondersteund door het Netherlands Cardiovascular Research lnitiative (CVON), een initiatief van de Hartstichting, en door de Nederlandse Hersenstichting. Erasmus MC ontving voor het CONTRAST consortium additionele financiele ondersteuning van Medtronic, en voor het uitvoeren van MR CLEAN NO-IV financiele ondersteuning van Stryker European Operations BIJVOORBEELD Alle bijdragen werden betaald aan Erasmus MC, zonder voorwaarden behoudens milestones. " |
geen |
|
Hofmeijer |
Neuroloog |
Hoofddocent universiteit twente |
geen |
geen |
|
Verburg |
Huisarts en wetenschappelijk medewerker NHG |
Wetenschappelijk medewerker NHG |
geen |
geen |
|
Visser-Meilij |
Revalidatiearts, hoogleraar en afdelingshoofd |
geen |
geen |
geen |
|
Van der Worp |
neuroloog |
|
Adviezen aan/consultancy voor Boehringer Ingelheim, producent van onder anderen alteplase en dabigatron. |
Uitsluiting besluitvorming alteplase en dabigatran |
|
Zuurbier |
AIOS neurologie |
geen |
Wetenschappelijk onderzoek gericht op centraal veneuze trombose (onbetaald) |
Geen |
|
Van Zwam |
Neuro-interventieradioloog |
geen |
Consultancy activiteiten voor stryker en Cerenovus, lid CONTRAST, MRCLEAN :ATE |
Geen invloed op richtlijnonderwerpen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door gebruik te maken van kwaliteitscriteria vanuit patiëntenperspectief voor CVA, ontwikkeld door Harteraad. Verder informeren Harteraad, Hartstichting en Hersenletsel door middel van notulen vergaderingen kerngroep en worden ze betrokken bij relevante onderwerpen.
De conceptmodules zijn tevens voor commentaar aan bovengenoemde verenigingen voorgelegd.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit (www.demedischspecialist.nl/richtlijnen). Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreetrust.org) dat een internationaal breed geaccepteerd instrument is en op Richtlijnen voor richtlijnen voor de beoordeling van de kwaliteit van richtlijnen (www.zorginstituutnederland.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Achmea en VGZ namens Zorgverzekeraars Nederland, het College voor Zorgverzekeringen (tegenwoordig Zorginstituut Nederland), de Inspectie voor de Gezondheidszorg, CVA Patiëntenvereniging Hersenletsel.nl, de Hart&Vaatgroep en de Hartstichting, via een invitational conference.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken, waarna de definitieve uitgangsvragen werden vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk en onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt inhoudt.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen, via de websites van enkele grote organisaties, zoals de American Heart Association en de European Stroke Organization. Tevens werd in de tijdschriften Stroke en Int J Stroke gezocht naar richtlijnen. Vervolgens werd op de website van de Cochrane Library gezocht naar systematische reviews. Tot slot werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases (NLM Pubmed, Google Scholar, Embase, Cochrane Library). De zoektermen werden geformuleerd aan de hand van een searchvraag. De searchvraag werd vertaald in een PICO (patient, intervention, control, outcome). Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepsleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in het hoofdstuk van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van vertrouwen in de literatuurconclusie (zie http://www.guidelinedevelopment.org/handbook/).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden.
Formuleren van de conclusies
Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusies, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt deze getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen door de werkgroep en beschreven in de literatuursamenvatting.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld binnen de clinical audit van de NVN om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de paragraaf Kennislacunes behorend bij elke module.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2000 – juli 2018
|
1 exp brain ischemia/ [narrower terms zijn: exp brain infarction/ or brain stem infarctions/ or lateral medullary syndrome/ or cerebral infarction/ or dementia, multi-infarct/ or infarction, anterior cerebral artery/ or infarction, middle cerebral artery/ or infarction, posterior cerebral artery/ or hypoxia-ischemia, brain/ or ischemic attack, transient/ or vertebrobasilar insufficiency/ or subclavian steal syndrome/] (97681) 2 exp "intracranial embolism and thrombosis"/ (20224) 3 ((infarct* or isch?emi*) adj3 (brain or cerebral or stroke)).ti,ab. (108832) 4 1 or 2 or 3 (166875) 5 limit 4 to english (141004) 6 limit 5 to yr="2000 -Current" (101733) 7 (tenecteplase or tnkase or 'tnk-tpa').ti,ab,kw. (469) 8 6 and 7 (94) 9 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (358450) 10 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1764983) 11 8 and 9 (3) 12 8 and 10 (51) 13 11 or 12 (51)
= 51 (51 uniek) |
161 |
|
Embase (Elsevier) |
((('brain infarction'/exp OR 'brain ischemia'/exp) OR ((infarct* OR isch?emi*) NEAR/3 (brain OR cerebral OR stroke)):ab,ti)
AND ('tenecteplase'/exp OR tenecteplase:ab,ti OR tnkase:ab,ti OR 'tnk-tpa':ab,ti))
AND [english]/lim AND [2000-2018]/py
Gebruikte filters:
Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it
= 143 (140 uniek)
|
