Endovasculaire trombectomie (EVT) bij herseninfarct
Uitgangsvraag
Vergroot endovasculaire trombectomie de kans op een goed herstel bij patiënten met een herseninfarct en een occlusie van één van de proximale intracraniële arteriën?
Aanbeveling
Patiënten met een herseninfarct dienen met spoed beeldvormend onderzoek van de hersenen (CT) en slagaderen van hoofd en hals (CTA) te ondergaan, om te kunnen beoordelen of zij in aanmerking komen voor endovasculaire trombectomie. Aanbevelingen voor de uitvoering van CT, CTA en CTP zijn te vinden in de appendix.
Dit betekent dat patiënten met een mogelijk herseninfarct met spoed (A2) dienen te worden vervoerd naar het dichtstbijzijnde ziekenhuis. Patiënten met een aangetoonde intracraniele occlusie dienen met grote spoed (A1) naar een interventie centrum te worden vervoerd.
Patiënten met een acuut herseninfarct door een occlusie van de distale a. carotis interna of de proximale a. cerebri media (M1 of M2) die met adequate beeldvorming is aaangetoond, dienen endovasculair te worden behandeld met een verwijderbare stent of andere state-of-the-art techniek, ongeacht de ernst van de neurologische uitval. Indien de patiënt ook in aanmerking komt voor intraveneuze trombolyse met alteplase dient dit eerst gestart te worden, maar het effect hiervan moet niet worden afgewacht. Als de patiënt binnen zes uur kan worden behandeld is geen verdere diagnostiek nodig.
Behandeling binnen 6 tot 24 uur is alleen geïndiceerd bij ernstige neurologische uitval (NIHSS ³ 10), een infarctkern kleiner dan 25 ml en een penumbra, zodanig dat het totale ischemische gebied 1,8 keer groter is dan de infarctkern alleen.
EVT van het herseninfarct ten gevolge van een occlusie van de a. basilaris is een optie waarvan de effectiviteit en veiligheid niet zijn aangetoond. Behandel daarom bij voorkeur in het kader van wetenschappelijk onderzoek.
Contra-indicatie voor EVT:
Intracraniële bloeding (inclusief hemorragische transformatie infarct) bij beeldvorming.
Relatieve contra-indicatie:
Infarct in het aangedane stroomgebied in de voorgaande zes weken.
Overwegingen
EVT van het herseninfarct is in de afgelopen vijf jaar ook in enkele andere trials onderzocht (Broderick 2013; Ciccone 2013; Kidwell 2013; Khoury 2017). In deze vier trials werd geen overtuigend voordeel van behandeling gevonden, hetgeen achteraf werd geweten aan het feit dat in drie van deze trials het grootste deel van de patiënten niet met de modernste technieken werd behandeld, én dat bij twee van de vier trials de occlusie van een proximale intracraniële arterie niet met niet-invasieve beeldvorming (CTA of MRA) was bevestigd. Deze ‘neutrale’ trials doen dus niets af aan de positieve resultaten van trials waarin moderne behandeltechnieken zijn gebruikt en die na 2013 zijn gepubliceerd.
De bovenstaande trials waren beperkt tot patiënten met een infarct in het stroomgebied van de a. carotis. Het is onzeker of de resultaten geëxtrapoleerd kunnen worden naar patiënten met een infarct ten gevolge van een occlusie van de a. basilaris. De werkgroep adviseert deze patiënten bij voorkeur te behandelen in het kader van een gerandomiseerde trial naar het effect van EVT. Zodra de resultaten van BEST en mogelijk spoedig ook BASICS zijn gepubliceerd, zal wederom een vernieuwde versie van deze sectie over EVT van het herseninfarct verschijnen.
Subgroepen
Observationele studies suggereren dat EVT minder effectief is indien sprake is van beperkte collaterale bloedvoorziening of uitgebreide ischemische afwijkingen op CT (Nambiar 2014; Puetz 2009). In een op individuele patiëntengegevens gebaseerde post-hoc meta-analyse van zeven gerandomiseerde trials gaf de collaterale status echter geen overtuigende effectmodificatie (Roman 2018). Wel was er ook in deze meta-analyse een trend naar een kleiner effect bij een slechte collaterale bloedvoorziening. Opgemerkt moet worden dat de kans op een goed herstel bij deze subgroep patiënten sowieso veel kleiner is, ongeacht de behandeling. Alle studies tot op heden zijn dus onvoldoende overtuigend om de behandelingskeuze door de mate van collaterale bloedvoorziening te laten bepalen.
Het is ook onzeker of EVT zinvol is bij patiënten met een occlusie van de a. carotis ten gevolge van een dissectie, maar er zijn aanwijzingen dat EVT bij deze patiënten technisch haalbaar en zinvol is (Berkhemer 2017; Hoving 2017). Ook zijn er aanwijzingen dat behandeling van patiënten die DOACs of VKA gebruiken, veilig en effectief is (Rozeman 2016; Kurowski 2017).
Meer informatie over de betreffende groepen patiënten zal vermoedelijk in de komende jaren beschikbaar komen. De werkgroep adviseert om deze factoren tot die tijd niet als absolute contra-indicatie voor EVT te beschouwen.
Patiënten met een recent ander herseninfarct in het stroomgebied van de afgesloten arterie werden van de meeste EVTstrials uitgesloten. De werkgroep adviseert echter dit niet in alle gevallen als absolute contra-indicatie te zien. Indien in de voorafgaande zes weken bijvoorbeeld een lacunair infarct is opgetreden en de patiënt zich nu presenteert met ernstige ischemie ten gevolge van een proximale occlusie zou EVT alsnog overwogen kunnen worden.
Antitromboticum
Bij alle patienten met een hersenifarct is het gewenst om snel te starten met een antitrbomboticum, meestal een plaatjesremmer. Dit geldt evenzeer voor patienten die EVT ondergingen. De enige uitzonderingn betreft patienten die zijn behandeld met IV alteplase, Het starten van antitrombotica in de eerste 24 uur na behandeling met alteplase waarschijnlijk gepaard gaat met een verhoogd risico op symptomatische bloedingen (Zinkstok 2012 Vanzelfsprekend dient de antitrombotische behandeling 24 uur na trombolyse te worden gestart.
Bloeddruk
Het is niet geheel zeker of een EVT bij een hogere bloeddruk ook van voordeel is, én of het verlagen van de bloeddruk om EVT mogelijk te maken een netto voordeel heeft. In een post-hoc analyse van MR CLEAN had de bloeddruk bij opname echter geen interactie met het behandeleffect, om welke reden een hoge bloeddruk vermoedelijk geen contra-indicatie is voor EVT (Mulder 2017). Zeker indien EVT voorafgegaan is door intraveneuze trombolyse met alteplase dient de bloeddruk de eerste 24 uur na behandeling onder 185/110 mm Hg gehouden te worden, volgens internationale consensus.
Tijdsinterval
Van drie gerandomiseerde trials naar het effect van EVT als die pas later dan zes uur na het veronderstelde begintijdstip kon worden ingezet, is er één na inclusie van 33 patiënten onderbroken en nog niet gepubliceerd (Turk A, POSITIVE trial, clinicaltrials.gov NCT 01778335). In de andere twee trials (DAWN en DEFUSE III) werden patiënten geïncludeerd volgens strenge criteria, die erop gericht waren diegenen te behandelen met een grote kans op herstel. Bij toepassen van deze criteria op een geselecteerde consecutieve serie patiënten met een herseninfarct, bleek dat slechts 2%-3% voldeed aan de inclusiecriteria van deze studies. De criteria betroffen de neurologische uitval bij randomisatie (score op de NIHSS), de grootte van de infarctkern en de omvang van het gebied met mogelijk reversibele ischemie (penumbra). Voor de beeldvormingscriteria is onderzoek met CT perfusie of MR diffusie/perfusie, softwarematige bewerking van de beelden, en uiteraard expertise bij de beoordeling vereist. Het profiel van de op deze criteria in beide studies geïncludeerde patiënten was echter nog gunstiger dan de inclusiecriteria suggereren. Daarom is het verstandig om niet de inclusiecriteria aan te houden als indicatie voor behandeling, maar af te gaan op het profiel van de patiënten die werkelijk in de studie zijn opgenomen. In de tabel staan de inclusie criteria van de trials en de p25 respectievelijk p75 van de overeenkomende klinische parameters, waarvan de werkgroep meent dat zij een goede afspiegeling vormen van de patiëntengroep die effect ondervond van de behandeling, en daarmee een goede indicatie oplevert. De werkgroep is op grond van deze gegevens van mening dat de criteria die leiden tot selectie van patiënten met een naar verwachting gunstig effect van trombectomie in het tijdvenster van 6-24 uur na begin van de verschijnselen de volgende zijn:
- behandeling kan pas worden gestart later dan zes uur maar binnen 24 uur na begin van de verschijnselen,
- NIHSS score voor behandeling van 10 of meer,
- Een infarct kern kleiner dan 25 ml, bepaald met behulp van CT perfusie of MRI
Een penumbra met een grootte van tenminste 80% van de grootte van de infarctkern.”
De infarctkern wordt gedefineerd als het gebied met minder dan 30% perfusie ten opzichte van normaal hersenweefsel (aan de contralaterale zijde), op CT perfusie. De penumbra wordt gedefineerd als het gebied met meer dan 30% perfusie, maar wel een tijd tot maximale perfusie (Tmax) van minimaal 6 seconden. (Lansberg 2012, Albers 2018)
Intraveneuze trombolyse vóór EVT
Het is onzeker of intraveneuze trombolyse met alteplase vóór EVT een extra voordeel voor patiënten biedt, of alleen maar het nadeel van een grotere kans op een symptomatische intracraniële bloeding. In de bovengenoemde gerandomiseerde trials van EVT versus geen EVT was er geen interactie tussen intraveneuze trombolyse en het behandeleffect van EVT. (Goyal 2016) Observationele studies geven echter uiteenlopende resultaten. (Mulder 2017; Coutinho 2017; Goyal 2016). Deze vraag wordt nu verder onderzocht in de Nederlandse gerandomiseerde trial MR CLEAN NoIV, en minstens drie andere gerandomiseerde studies. Tot die tijd adviseert de werkgroep om bij patiënten die voldoen aan de criteria voor intraveneuze trombolyse deze behandeling eerst te starten en daarna zonder de effecten van trombolyse af te wachten te starten met de EVT. De infusiepomp met alteplase hoeft niet voortijdig te worden gestopt in verband met de EVT.
Anesthesie
Observationele studies suggereren sterk dat bij patiënten die behandeld worden met EVT algehele anesthesie tijdens deze behandeling de kans op een goed herstel verkleint ten opzichte van ‘geen algehele anesthesie’(Campbell 2018). Kleine gerandomiseerde trials hebben echter aangetoond dat algehele anesthesie tijdens EVT niet tot slechtere uitkomsten leidt dan “conscious sedation” (Schonenberger 2016; Lowhagen 2017; Simonsen 2017). Wel zijn er aanwijzingen dat een strategie waarbij in het geheel geen sedatie, dus alleen lokale anesthesie, wordt toegepast leidt tot betere uitkomsten (van de Graaf, 2018). Er bestaan echter geen gerandomiseerde trials van algehele anesthesie versus lokale anesthesie tijdens EVT. De werkgroep kan nog geen advies geven over de methode van anesthesie tijdens EVT.
Onderbouwing
Achtergrond
Bij patiënten met een acuut herseninfarct op basis van een occlusie van een proximale intracraniële arterie wordt een endovasculaire trombectomie (EVT) al meer dan 20 jaar toegepast, maar tot eind 2014 bestond onzekerheid over het nut hiervan.
Conclusies
Functioneel herstel bij behandeling binnen zes uur
|
GRADE Hoog |
Bij patiënten met een herseninfarct door een occlusie van de distale a. carotis interna of de proximale a. cerebri media (M1 of M2) verkleint EVT met een verwijderbare stent de kans op afhankelijkheid ten opzichte van de ‘standaardbehandeling’, indien de EVT wordt gestart binnen zes uur na het ontstaan van de verschijnselen.
Bronnen (Berkhemer 2015, Bracard 2016, Campbell 2015, Goyal 2015, Jovin 2015, Muir 2017, Saver 2015). |
Functioneel herstel bij behandeling binnen 6 tot 16 uur
|
GRADE Hoog |
Bij patiënten met een herseninfarct door een occlusie van de distale a. Carotis interna of de proximale a. Cerebri media (M1 of M2) verkleint EVT met een verwijderbare stent de kans op afhankelijkheid ten opzichte van de ‘standaardbehandeling’, indien de EVT wordt gestart na zes, maar binnen 16 uur na het ontstaan van de verschijnselen, bij zeer sterk geselecteerde patiënten met ernstige neurologische uitval en met een bij perfusie beeldvorming aangetoonde kleine infarct kern en daarnaast klinisch dan wel bij beeldvorming aanwijzingen voor een “penumbra”.
Bronnen (Albers 2018, Nogueira 2018) |
Functioneel herstel bij behandeling binnen 16 tot 24 uur
|
GRADE Gemiddeld |
Bij patiënten met een herseninfarct door een occlusie van de distale a. Carotis interna of de proximale a. Cerebri media (M1 of M2) verkleint EVT met een verwijderbare stent de kans op afhankelijkheid ten opzichte van de ‘standaardbehandeling’, indien de EVT wordt gestart na zes, maar binnen 16 uur na het ontstaan van de verschijnselen, bij zeer sterk geselecteerde patiënten met ernstige neurologische uitval en met een bij perfusie beeldvorming aangetoonde kleine infarct kern en daarnaast klinisch dan wel bij beeldvorming aanwijzingen voor een “penumbra”.
Bronnen (Nogueira 2018) |
Mortaliteit
|
GRADE gemiddeld |
Er zijn onvoldoende aanwijzingen dat EVT de kans op overlijden binnen drie maanden bij patiënten met een herseninfarct door een occlusie van de distale a. carotis interna of de proximale a. cerebri media (M1 of M2) verlaagt.
Bronnen (Albers 2018, Berkhemer 2015, Bracard 2016, Broderick 2013, Campbell 2015, Goyal 2015, Jovin 2015, Mocco 2016, Muir 2017, Nogueira 2018, Saver 2015) |
Symptomatische intracraniële bloeding
|
GRADE Hoog |
Bij patiënten met een herseninfarct door een occlusie van de distale a. carotis interna of de proximale a. cerebri media (M1 of M2) heeft EVT met moderne technieken geen effect op het optreden van symptomatische intracraniële bloedingen.
Bronnen (Albers 2018, Berkhemer 2015, Bracard, 2016, Broderick 2013, Campbell 2015, Goyal 2015, Jovin 2015, Kidwel 2013, Mocco 2016, Muir 2017, Nogueira 2018, Ogawa 2007, Saver 2015) |
Samenvatting literatuur
Korte beschrijving van de geïncludeerde studies
De gevonden studies werden in een vijftal categorieën ingedeeld. De studies uit categorieën 1 en 2 gebruikten inmiddels obsolete behandel- en/of diagnostische methoden en worden hier niet besproken. De studies uit categorie drie tot vijf bespreken we hieronder. Studies die minder dan 10 patiënten hadden geïncludeerd zijn niet in de tabellen en figuren opgenomen, maar worden wel genoemd in de bespreking.
- EVT primair met trombolytica: hieronder vielen Proact I en II (Furlan 1999 en Del Zoppo 1998), MELT (Ogawa 2007), SYNTHESIS (Ciccone 2013).
- EVT met mechanische middelen, zonder altijd een CTA/MRA vooraf: IMS III (Broderick 2013), MR RESCUE (Kidwell 2013); EASI (Khoury 2017).
- Vroege EVT met stent retrievers early window (tot zes uur) met CTA of MRA vooraf: MR CLEAN (Berkhemer 2015); ESCAPE (Goyal 2015); SWIFT PRIME (Saver 2015); REVASCAT (Jovin 2015); EXTEND IA (Campbell 2015); THRACE (Bracard 2016); PISTE (Muir 2017), THRILL (Bendzus 2016).
- EVT met aspiratietechnieken met CTA of MRA vooraf: Therapy (Mocco 2016).
- Late EVT met CTA en CT perfusie of MR Diffusie / perfusie (6-16 of 24 uur): DAWN (Nogueira 2017); DEFUSE III (Albers 2018).
Slechts enkele patiënten met een occlusie van de a. basilaris waren in sommige van bovenstaande trials opgenomen. De Australian Urokinase trial, waarin patiënten met een basilaris-occlusie werden behandeld met het trombolyticum urokinase, was na acht patiënten tot een vroegtijdig einde gekomen (Macleod, 2005). Vier van de acht behandelde patiënten hadden een goede functionele uitkomst versus één van de zeven in de controlegroep. Grotere trials zijn nodig, omdat de anatomie en prognose aanzienlijk anders is dan bij patiënten met een infarct op basis van occlusie in de anterieure intracraniële circulatie. De BEST trial is gerapporteerd in oktober 2018 (World Stroke Conference), maar nog niet gepubliceerd, het protocol wel (Liu 2017). De trial is beëindigd nadat 131 patiënten, 38% van de beoogde 344 waren geïncludeerd, vanwege verlies van equipoise onder de onderzoekers. Ondertussen waren 14 van 65 patiënten in de controlegroep om die reden toch behandeld met EVT. De intention to treat analyse op de goede functionele uitkomst (mRS 0-2) toonde geen effect van de interventie (OR 1,3, p=0,48). Ook op de andere uitkomsten was de trial neutraal. Er is ook een vergelijking gemaakt tussen de werkelijk wel en niet behandelde patiënten (per protocol en as treated). In deze analyses was het effect klinisch en statistisch significant, maar vertekening kan hier een grote rol hebben gespeeld. Conclusies over de effectiviteit van EVT bij deze patiëntengroep kunnen daarom nog niet met voldoende zekerheid worden getrokken. De BASICS studie met een vergelijkbaar design is nog actief (Van der Hoeven 2013).
De MR CLEAN-trial (Berkhemer 2015) was een gerandomiseerde open klinische trial met geblindeerde uitkomstmeting bij 500 patiënten met een acuut herseninfarct ten gevolge van een met CTA bewezen occlusie van de distale a. carotis interna of de proximale a. cerebri media (M1 of M2) of de a. cerebri anterior (A1 of A2). Patiënten met een symptomatische occlusie van de a. vertebralis of a. basilaris werden van deelname uitgesloten. De laagste score op de NIHSS was drie en de mediaan 18. De minimale leeftijd voor inclusie was 18 jaar; er was geen bovenste leeftijdsgrens. De gemiddelde leeftijd van de geïncludeerde patiënten was 66 jaar. 89% van de patiënten was vóór inclusie behandeld met intraveneus alteplase. De EVT diende binnen zes uur na het ontstaan van het infarct te worden gestart. De wijze van EVT werd grotendeels overgelaten aan de interventionist. De primaire uitkomstmaat was de score op de modified Rankin Scale na drie maanden. Van de 500 patiënten werden er 233 (47%) gerandomiseerd voor EVT en 267 (53%) voor standaardbehandeling. Van de patiënten in de interventiegroep werden 196 (84%) daadwerkelijk endovasculair behandeld, evenals één patiënt in de controlegroep. Bij 190 van de 196 endovasculair behandelde patiënten werd een verwijderbare stent gebruikt, om welke reden de resultaten van MR CLEAN alleen op deze behandelingstechniek van toepassing zijn. Bij 24 patiënten (12%) werd naast de mechanische trombectomie ook intra-arterieel een trombolyticum toegediend.
De gegevens van MR CLEAN en vier andere gerandomiseerde trials waarin het effect van EVT met moderne hulpmiddelen (meestal verwijderbare stents) werd onderzocht (ESCAPE, REVASCAT, SWIFT PRIME, en EXTEND IA; Campbell 2015; Goyal 2015; Jovin 2015; Saver 2015) werden gezamenlijk geanalyseerd in een individual patient data meta-analyse (Goyal 2016). De andere trials beperkten zich net als de MR CLEAN tot patiënten met een herseninfarct door een occlusie van de distale a. carotis interna of de proximale a. cerebri anterior of a. cerebri media en in alle trials werd bij het grootste deel van de patiënten gebruik gemaakt van een verwijderbare stent. In de ESCAPE-trial konden patiënten worden geïncludeerd tot 12 uur na het ontstaan van de symptomen, maar werden patiënten met uitgebreide ischemische afwijkingen op de blanco CT (ASPECTS <6) en patiënten met een slechte collaterale circulatie op CTA van deelname uitgesloten. Ook in EXTEND IA, SWIFT PRIME en REVASCAT werden patiënten geëxcludeerd indien er op CT of MRI aanwijzingen waren voor irreversibele schade in een groot deel van het aangedane stroomgebied. In alle trials was bij het merendeel van de patiënten of bij alle patiënten gestart met intraveneus alteplase vóór de start van de EVT. Alle vier de trials werden voortijdig afgebroken na een interim-analyse naar aanleiding van de resultaten van de MR CLEAN-trial, en alle vier de trials bevestigden de positieve resultaten van MR CLEAN.
Na de bovengenoemde individuele patiënten meta-analyse van de vijf EVT trials zijn nog twee vergelijkbare gerandomiseerde trials gepubliceerd. THRACE (Bracard 2016) includeerde 414 patiënten met een herseninfarct door een occlusie van de distale a. carotis interna, de proximale a. cerebri media, of de distale a. basilaris. Van de laatste werden overigens maar vier patiënten geïncludeerd. Alle patiënten werden behandeld met intraveneuze trombolyse. EVT diende binnen vijf uur na het ontstaan van de symptomen gestart te worden. In PISTE werden 65 patiënten geïncludeerd met een herseninfarct door een occlusie van de distale a. carotis interna, de proximale a. cerebri media. Alle patiënten werden behandeld met intraveneuze trombolyse binnen 4,5 uur na het ontstaan van de symptomen. EVT diende binnen 90 minuten na het begin van de intraveneuze trombolyse gestart te worden (Muir 2017). In beide studies werden geen CT-perfusie of APECTS-criteria gebruikt. Wel werden in PISTE patiënten geëxcludeerd als er een duidelijke hypodensiteit bestond in meer dan één derde van het stroomgebied van de a. cerebri media. Beide trials werden voortijding afgebroken, één na een geplande interimanalyse en één vanwege het wegvallen van “equipoise” bij de onderzoekers. Tot slot zijn nog de resultaten van de THRILL studie gepubliceerd, maar deze studie werd na inclusie van vier patiënten al weer afgebroken (Bendszus 2016).
Twee recente gerandomiseerde klinische trials hebben zich gericht op patiënten met een herseninfarct door een occlusie van de distale a. carotis interna of het M1-segment van de a. cerebri media die tussen 6 en 16 (DEFUSE III) of 24 uur (DAWN). DAWN includeerde 206 patiënten op basis van een mismatch tussen de ernst van de neurologische uitval en de infarctgrootte op CT-perfusie of MRI. Bij ernstige neurologische uitval en een relatief klein infarctvolume, werd in deze trial verondersteld dat er sprake was van een grote penumbra. DEFUSE-III maakte gebruik van een mismatch tussen de grootte van het infarct en dat van de penumbra op CT-perfusie, waarbij het totale ischemische gebied tenminste 1,8 keer zo groot moest zijn als het infarct. Belangrijk is dat beide studies zich beperkten tot patiënten die vóór het herseninfarct geen beperkingen hadden (mRS 0 of 1) én vóór inclusie een score op de NIHSS hadden van tenminste 10 (DAWN) of 6 (DEFUSE III). In beide studies werd gebruik gemaakt van de RAPID® software om de grootte van de kern van het infarct en die van de penumbra te meten. De uiteindelijke mediaan (IQR) van de NIHSS was 17 (IQR: 13 – 21) in DAWN en 16 (IQR: 10 – 21) in DEFUSE III, en de mediane infarctkerngrootte respectievelijk 8 ml (IQR: 2-18) en 10 ml (IQR: 2-25), zie tabel 1. De patiënten hadden dus ernstige uitval bij een zeer kleine infarctkern. Patiënten werden gerandomiseerd tussen ‘EVT’ en ‘geen EVT.’ De EVT werd uitgevoerd met een stent retriever (DAWN) of elk gecertificeerd device (DEFUSE III). Beide studies zijn voortijdig beëindigd toen overtuigend was aangetoond was dat EVT ook na zes uur tot een grotere kans op een goed herstel leidde.
Tabel 1 Overzicht van inclusie criteria en patiënt-kenmerken in de trials van EVT in het late tijdvenster. Getallen zijn gemiddelden met standaardeviatie of mediaan met interkwartiel (p25-p75). Penumbra is gedefinieerd als het gebied met vertraagde perfusie, blijkend uit Tmax > 6sec, buiten het infarctkern gebied.
|
|
DAWN criteria |
DAWN Inclusie |
DEFUSE 3 criteria |
DEFUSE 3 Inclusie* |
|
Age |
- |
70 (14) |
<80 |
70 (50-80) |
|
NIHSS |
³10 |
17 (13-21) |
³6 |
16 (11-21) |
|
Infarct core (ml) Age >80 Age <80 Age <80 |
< 21
|
8 (2-18) |
<70 |
10 (2-25) |
|
Penumbra |
- |
- |
> 80% >15 ml |
115 (75-150 ml) |
|
Time window |
6 - 24 |
13 (10-16) |
6 - 16 |
11 (9-13) |
Functionele status
Figuur 1. Kans op een beter herstel (ordinale analyse van de mRS) na EVT versus geen EVT. ES=effectschatter, (common Odds Ratio).
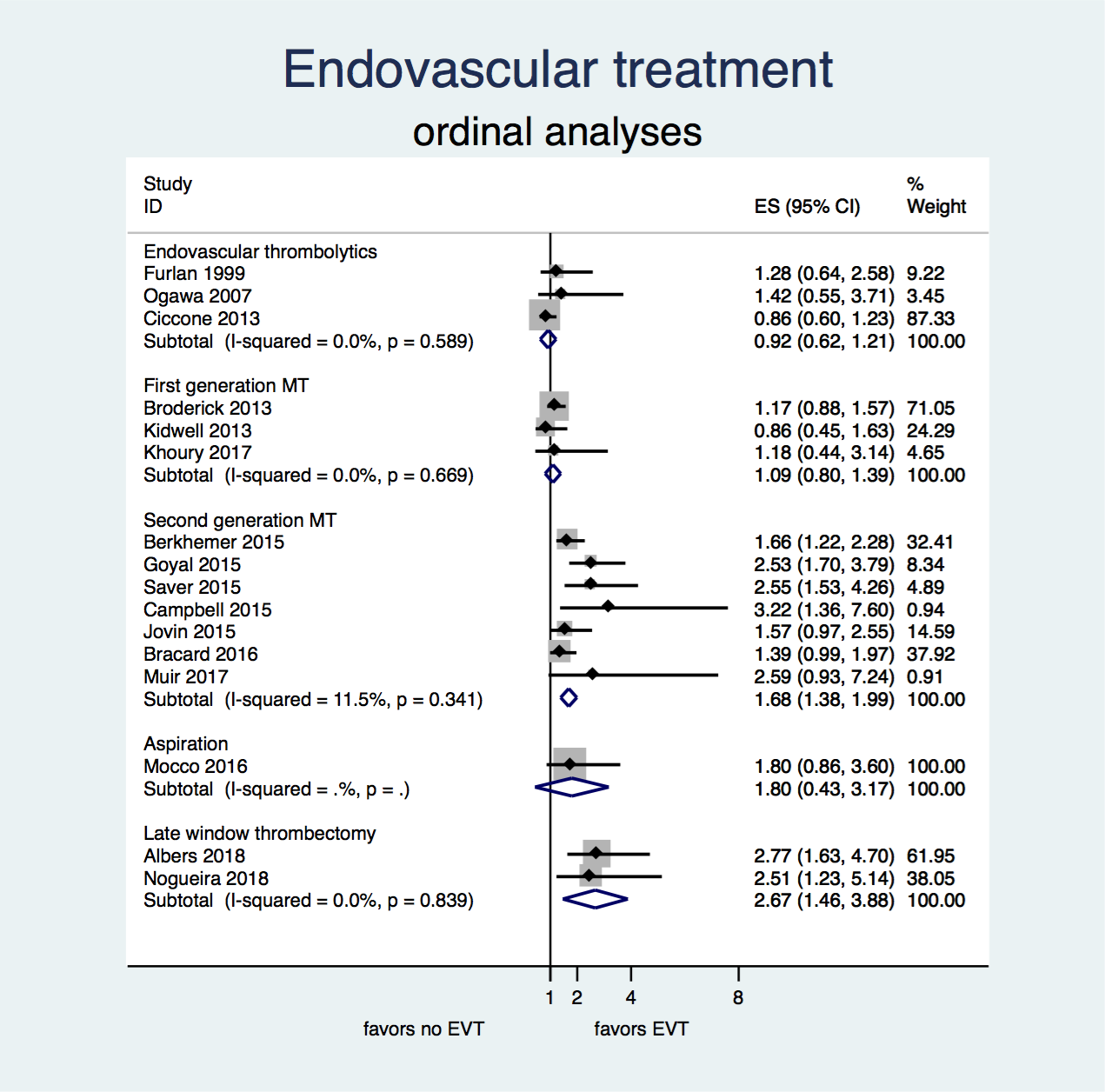
Zowel in de eerste zes uur na het ontstaan van het herseninfarct als in de periode tussen 6 en 24 uur vergroot EVT de kans op herstel bij (zeer) sterk geselecteerde patiënten met een herseninfarct door een occlusie van de distale a. carotis interna of proximale a. cerebri media.
Figuur 2. Kans op een goed herstel (mRS 0 – 2) na EVT versus geen EVT.
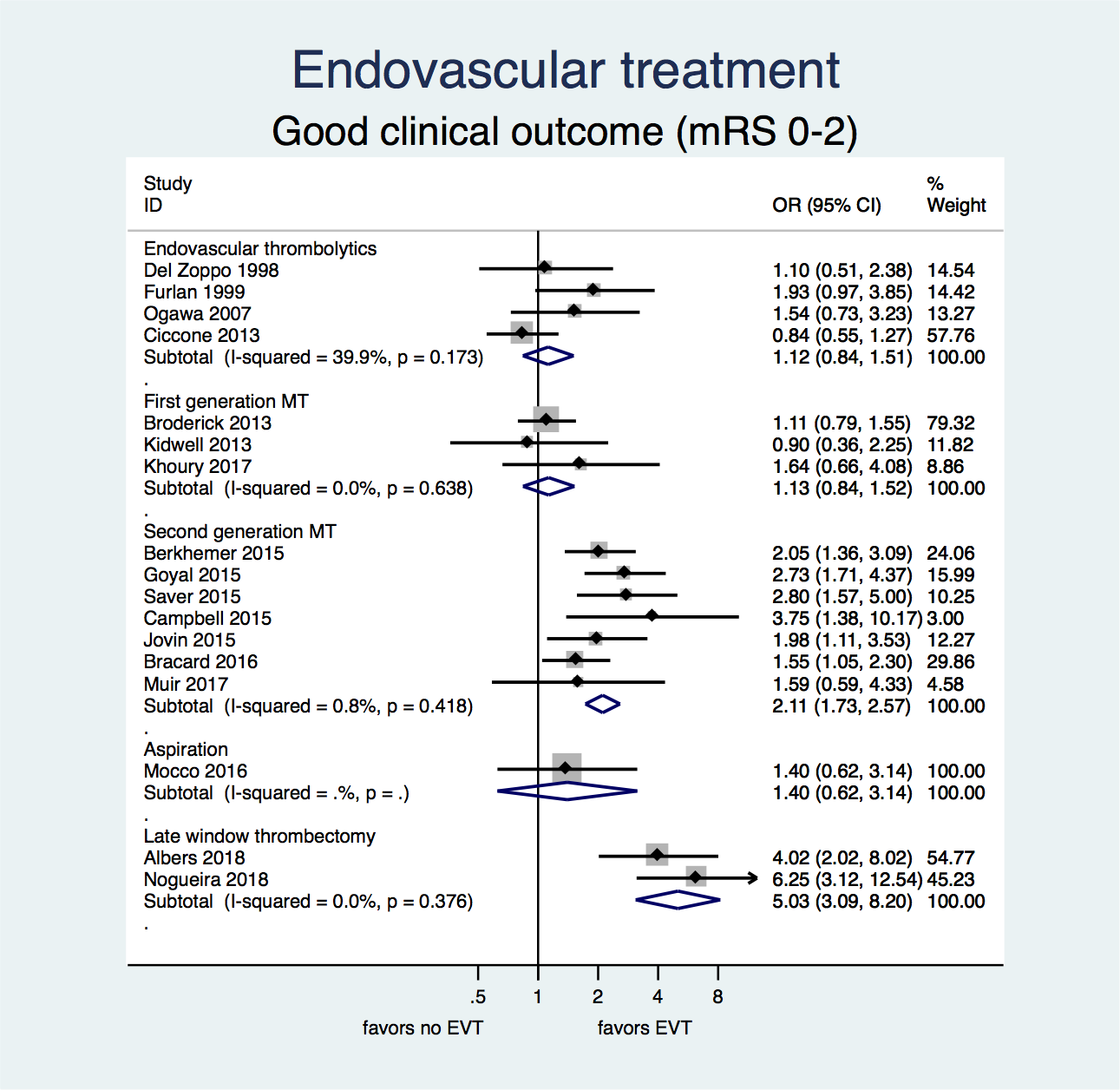
Zowel in de eerste zes uur na het ontstaan van het herseninfarct als in de periode tussen 6 en 24 uur vergroot EVT met hedendaagse technieken de kans op een goed herstel bij (zeer) sterk geselecteerde patiënten met een herseninfarct door een occlusie van de distale a. carotis interna of proximale a. cerebri media of anterior. Bij het gebruik van oudere technieken (trials tot en met 2013) zijn er onvoldoende aanwijzingen dat EVT tot een grotere kans op een goed herstel leidt.
Figuur 3. Kans op overlijden binnen drie maanden na het herseninfarct na EVT versus geen EVT.

Er is op grond van bovenstaand gegevens geen bewijs dat EVT de kans op overlijden binnen drie maanden na een herseninfarct verkleint, In de MR CLEAN trial was een reductie van overlijden binnen twee jaar na inclusie gezien (Van den Berg 2017), maar in de enige andere trial met een langere follow up (één jaar), REVASCAT, was dit niet het geval (Davalos 2017).
Figuur 4. Kans op een symptomatische intracraniële bloeding na EVT versus geen EVT.
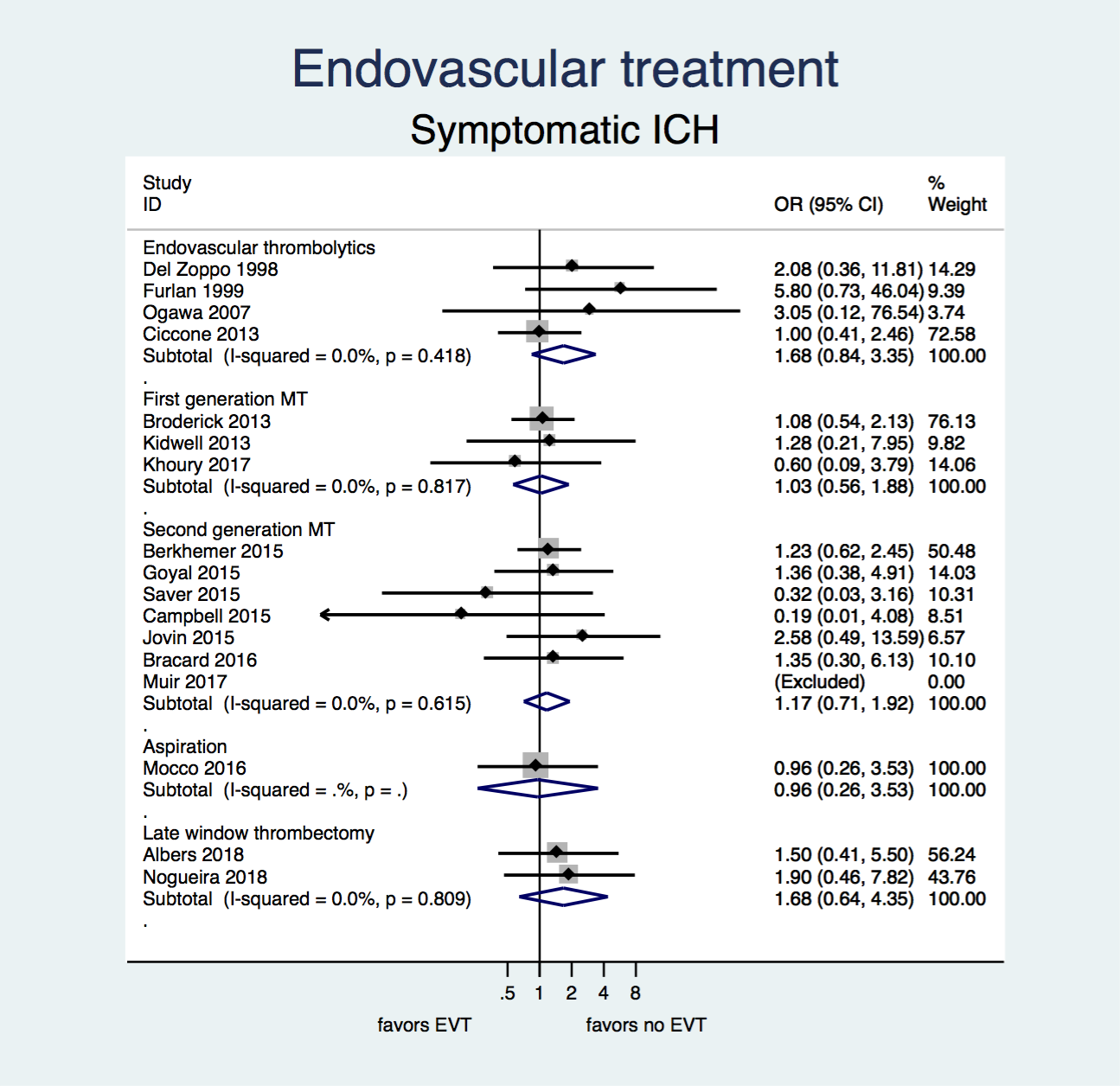
Er zijn geen aanwijzingen dat EVT de kans op een symptomatische intracraniële bloeding na een herseninfarct beïnvloedt.
Bewijskracht
Functioneel herstel
GRADE analyse: De waardering start hoog, het gaat om grote multicenter gerandomiseerde trials van goede kwaliteit. Alle in de meta-analyse opgenomen recente trials waren te voren geregistreerd, hadden gepubliceerde protocollen en hadden een PROBE-design. Er zijn geen argumenten om de waardering te verlagen. Voor 16-14 uur werd de bewijskracht verlaagd naar gemiddeld omdat dit slechts op één trial gebaseerd was.
Mortaliteit
GRADE analyse: De waardering start hoog, het gaat om grote multicenter gerandomiseerde trials van goede kwaliteit. Alle recente trials waren te voren geregistreerd, hadden gepubliceerde protocollen en hadden een PROBE-design. Echter de resultaten zijn heterogeen en de betrouwbaarheidsintervallen breed, daarom werd de bewijskracht verlaagd naar gemiddeld.
Symptomatische intracraniële bloeding
GRADE analyse: De waardering start hoog, het gaat om grote multicenter gerandomiseerde trials van goede kwaliteit. Alle trials waren te voren geregistreerd, hadden gepubliceerde protocollen en hadden een PROBE-design. Er zijn geen argumenten om de waardering te verlagen.
Zoeken en selecteren
Vraagstelling
De uitgangsvraag of patiënten met een acuut herseninfarct op basis van een occlusie van één van de proximale intracraniële arteriën baat hebben bij een EVT werd vertaald naar de volgende PICO:
P: patiënten met een acuut herseninfarct op basis van een occlusie van één van de proximale intracraniële arteriën;
I: EVT met state-of-the-art technieken;
C: standaard behandeling zonder endovasculaire interventie;
O: functionele uitkomst, sterfte, intracraniële bloedingen.
Belangrijke deelvragen zijn vervolgens welke (combinaties van) patiënt-kenmerken zodanig van invloed zijn op de effectiviteit van de EVT, dat deze niet meer zinvol is. Hierbij moet allereerst worden gedacht aan de (tijdsbepaalde) irreversibiliteit van de ischemische schade, en aan patiënt-kenmerken die geassocieerd zijn met een slecht herstel en complicaties na behandeling. In de overwegingen wordt hierop ingegaan.
Zoeken en selecteren (methode)
Om de uitgangsvraag te kunnen beantwoorden is de literatuur systematisch geanalyseerd. Hiertoe hebben we bestaande systematische reviews en meta-analyses gebruikt, en geactualiseerd met nieuwe RCTs. Deze zijn gezocht in de databases van ISRCTN, Clinicaltrials.gov en de Cochrane collaboration. De literatuurzoekactie leverde 260 treffers op. Alleen trials die de strategie “EVT” met de strategie ‘geen EVT’ tegen een achtergrond van gebruikelijke zorg met elkaar vergeleken werden geïncludeerd. Belangrijk uitgangspunten hierbij waren de “individual patient data” meta-analyse van Goyal 2016 en een eerdere meta-analyse (Badhiwala 2015 JAMA), omdat deze vollledig en van voldoende methodologische kwaliteit waren. Uiteindelijk werden 17 trials geïncludeerd in de literatuuranalyse.
Extra aandacht is gegeven aan de gegevens van de MR CLEAN-trial aangezien de MR CLEAN-trial in Nederland is uitgevoerd met brede inclusiecriteria. De resultaten zijn toepasbaar op de Nederlandse situatie.
Relevante uitkomstmaten
De werkgroep achtte ‘sterfte of afhankelijkheid’ en mortaliteit voor de besluitvorming kritieke uitkomstmaten en ’symptomatische intracraniële bloedingen’ ook een voor de besluitvorming belangrijke uitkomstmaat. De standaard om een behandeleffect op een ordinale uitkomstschaal zoals de modified Rankin scale (mRS), uit te drukken is de common odds ratio. Deze kan worden gezien als een gemiddeld effect over alle dichotomiseringen die mogelijk zijn.
Definities
- sterfte of afhankelijkheid: score op de mRS ≥ drie op drie maanden;
- symptomatische intracraniële bloeding: intracraniële bloeding die geassocieerd is met een toename van score op de NIHSS van vier of meer punten (hiervoor is geen exacte tijdsdefinitie, maar de waarnemingen betreffen de periode van ziekenhuisopname)
- Sterfte: overlijden binnen drie maanden.
Referenties
- Albers GW, Marks MP, Kemp S, Christensen S, Tsai JP, Ortega-Gutierrez S, et al. Thrombectomy for Stroke at 6 to 16 Hours with Selection by Perfusion Imaging. N Engl J Med. 2018 Feb 22;378(8):708-718. PubMed PMID: 29364767.
- Badhiwala JH, Nassiri F, Alhazzani W, et al. Endovascular Thrombectomy for Acute Ischemic Stroke: A Meta-analysis. JAMA. 2015;314:1832-1843.
- Bendszus, M., Thomalla, G., Hacke, W., Knauth, M., Gerloff, C., Bonekamp, S., . . . investigators, T. (2016). Early termination of THRILL, a prospective study of mechanical thrombectomy in patients with acute ischemic stroke ineligible for i.v. thrombolysis. Clinical Neuroradiology, 26(4), 499-500.
- Berkhemer OA, Fransen PS, Beumer D, et al. A randomized trial of intraarterial treatment for acute ischemic stroke. N Engl J Med. 2015;372(1):11-20.
- Berkhemer, Olvert A., et al. Collateral status on baseline computed tomographic angiography and intra-arterial treatment effect in patients with proximal anterior circulation stroke. Stroke 47.3 (2016): 768-776.
- Berkhemer OA, Borst J, Kappelhof M, Yoo AJ, van den Berg LA, Fransen PSS, et al. Extracranial carotid disease and effect of intra-arterial treatment in patients with proximal anterior circulation stroke in mr clean. Ann Intern Med. 2017;166:867-875
- Bracard S, Ducrocq X, Mas JL, Soudant M, Oppenheim C, Moulin T, Guillemin F; THRACE investigators. Mechanical thrombectomy after intravenous alteplase versus alteplase alone after stroke (THRACE): a randomised controlled trial. Lancet Neurol. 2016 Oct;15(11):1138-47. Epub 2016 Aug 23. PubMed PMID: 27567239.
- Broderick JP, Palesch YY, Demchuk AM, et al. Endovascular therapy after intravenous t-PA versus t-PA alone for stroke. N Engl J Med. 2013;368(10):893-903.
- Campbell BC, Mitchell PJ, Kleinig TJ, Dewey HM, Churilov L, Yassi N, et al. Endovascular therapy for ischemic stroke with perfusion-imaging selection. N Engl J Med. 2015;372:1009-1018
- Campbell BCV, Majoie C, Albers GW, Menon BK, Yassi N, Sharma G, et al. Penumbral imaging and functional outcome in patients with anterior circulation ischaemic stroke treated with endovascular thrombectomy versus medical therapy: A meta-analysis of individual patient-level data. Lancet neurology. 2018 (Epub ahead of print)
- Ciccone A, Valvassori L, Nichelatti M, et al. Endovascular treatment for acute ischemic stroke. N Engl J Med. 2013;368(10):904-913.
- Coutinho, J. M., Liebeskind, D. S., Slater, L. A., Nogueira, R. G., Clark, W., Davalos, A., . . . Pereira, V. M. (2017). Combined Intravenous Thrombolysis and Thrombectomy vs Thrombectomy Alone for Acute Ischemic Stroke: A Pooled Analysis of the SWIFT and STAR Studies. JAMA Neurol, 74(3), 268-274.
- Davalos A, Cobo E, Molina CA, Chamorro A, de Miquel MA, Roman LS, et al. Safety and efficacy of thrombectomy in acute ischaemic stroke (revascat): 1-year follow-up of a randomised open-label trial. Lancet Neurol. 2017;16:369-376
- Del Zoppo GJ, Higashida RT, Furlan AJ, Pessin MS, Rowley HA, Gent M. PROACT: a phase II randomized trial of recombinant pro-urokinase by direct arterial delivery in acute middle cerebral artery stroke. PROACT Investigators. Prolyse in Acute Cerebral Thromboembolism. Stroke. 1998 Jan;29(1):4-11. PubMed PMID: 9445320.
- Fransen, Puck SS, et al. Time to reperfusion and treatment effect for acute ischemic stroke: A randomized clinical trial. JAMA neurology. 2016;73(2):190-196.
- Furlan A, Higashida R, Wechsler L, Gent M, Rowley H, Kase C et al. Intra-arterial prourokinase for acute ischemic stroke. The PROACT II study: a randomized controlled trial. Prolyse in Acute Cerebral Thromboembolism. JAMA. 1999 Dec 1;282(21):2003-11. PubMed PMID: 10591382.
- Goyal M, Demchuk AM, Menon BK, et al. Randomized Assessment of Rapid Endovascular Treatment of Ischemic Stroke. N Engl J Med. 2015.
- Goyal, Mayank, et al. Endovascular thrombectomy after large-vessel ischaemic stroke: a meta-analysis of individual patient data from five randomised trials. The Lancet. 2016;387(10029):1723-1731.
- Hoving JW, Marquering HA, Majoie C. Endovascular treatment in patients with carotid artery dissection and intracranial occlusion: A systematic review. Neuroradiology. 2017;59:641-647
- Jovin, Tudor G., et al. Thrombectomy within 8 hours after symptom onset in ischemic stroke. New England Journal of Medicine. 2015;372(24):2296-2306.
- Khoury, N. N., Darsaut, T. E., Ghostine, J., Deschaintre, Y., Daneault, N., Durocher, A., . . . collaborators, E. t. (2017). Endovascular thrombectomy and medical therapy versus medical therapy alone in acute stroke: A randomized care trial. J Neuroradiol, 44(3), 198-202.
- Kidwell CS, Jahan R, Gornbein J, et al. A trial of imaging selection and endovascular treatment for ischemic stroke. N Engl J Med. 2013;368(10):914-923.
- Kurowski D, Jonczak K, Shah Q, Yaghi S, Marshall RS, Ahmad H, et al. Safety of endovascular intervention for stroke on therapeutic anticoagulation: Multicenter cohort study and meta-analysis. J Stroke Cerebrovasc Dis. 2017;26:1104-1109
- Lansberg MG, Straka M, Kemp S, Mlynash M, Wechsler LR, Jovin TG, Wilder MJ, Lutsep HL, Czartoski TJ, Bernstein RA, Chang CW, Warach S, Fazekas F, Inoue M, Tipirneni A, Hamilton SA, Zaharchuk G, Marks MP, Bammer R, Albers GW; DEFUSE 2 study investigators. MRI profile and response to endovascular reperfusion after stroke (DEFUSE 2): a prospective cohort study. Lancet Neurol. 2012 Oct;11(10):860-7.
- Liu, X., Xu, G., Liu, Y., Zhu, W., Ma, M., Xiong, Y., . . . Investigators, B. T. (2017). Acute basilar artery occlusion: Endovascular Interventions versus Standard Medical Treatment (BEST) Trial-Design and protocol for a randomized, controlled, multicenter study. Int J Stroke, 12(7), 779-785.
- Lowhagen Henden P, Rentzos A, Karlsson JE, Rosengren L, Leiram B, Sundeman H, et al. General anesthesia versus conscious sedation for endovascular treatment of acute ischemic stroke: The ANSTROKE trial (anesthesia during stroke). Stroke. 2017;48:1601-1607
- Macleod, M. R., Davis, S. M., Mitchell, P. J., Gerraty, R. P., Fitt, G., Hankey, G. J., . . . Donnan, G. A. (2005). Results of a multicentre, randomised controlled trial of intra-arterial urokinase in the treatment of acute posterior circulation ischaemic stroke. Cerebrovasc Dis, 20(1), 12-17
- Mocco J, Zaidat OO, von Kummer R, Yoo AJ, Gupta R, Lopes D, et al. Aspiration Thrombectomy After Intravenous Alteplase Versus Intravenous Alteplase Alone. Stroke. 2016 Sep;47(9):2331-8. doi: 10.1161/STROKEAHA.116.013372. PubMed PMID: 27486173.
- Muir KW, Ford GA, Messow CM, Ford I, Murray A, Clifton A et al. Endovascular therapy for acute ischaemic stroke: the Pragmatic Ischaemic Stroke Thrombectomy Evaluation (PISTE) randomised, controlled trial. J Neurol Neurosurg Psychiatry. 2017 Jan;88(1):38-44. PubMed PMID: 2775680.
- Mulder MJJL, Ergezen S, Lingsma HF, Berkhemer OA, Fransen PSS, Beumer D, et al. Baseline blood pressure effect on the benefit and safety of intra-arterial treatment in mr clean (multicenter randomized clinical trial of endovascular treatment of acute ischemic stroke in the netherlands). Stroke. 2017;48:1869-1876
- Nambiar V, Sohn SI, Almekhlafi MA, et al. CTA collateral status and response to recanalization in patients with acute ischemic stroke. AJNR Am J Neuroradiol. 2014;35(5):884-890.
- Nogueira RG, Jadhav AP, Haussen DC, Bonafe A, Budzik RF, Bhuva P et al. Thrombectomy 6 to 24 Hours after Stroke with a Mismatch between Deficit and Infarct. N Engl J Med. 2018 Jan 4;378(1):11-21. PubMed PMID: 29129157.
- Ogawa A, Mori E, Minematsu K, Taki W, Takahashi A, Nemoto S, Miyamoto S, Sasaki M, Inoue T; MELT Japan Study Group. Randomized trial of intraarterial infusion of urokinase within 6 hours of middle cerebral artery stroke: the middle cerebral artery embolism local fibrinolytic intervention trial (MELT) Japan. Stroke. 2007 Oct;38(10):2633-9. PubMed PMID: 17702958.
- Puetz V, Dzialowski I, Hill MD, et al. The Alberta Stroke Program Early CT Score in clinical practice: what have we learned? Int J Stroke. 2009;4(5):354-364.
- Roman LS, Menon BK, Blasco J, Hernandez-Perez M, Davalos A, Majoie C, et al. Imaging features and safety and efficacy of endovascular stroke treatment: A meta-analysis of individual patient-level data. Lancet neurology. 2018;17:895-904
- Rozeman AD, Wermer MJ, Lycklama a Nijeholt GJ, Dippel DW, Schonewille WJ, Boiten J, et al. Safety of intra-arterial treatment in acute ischaemic stroke patients on oral anticoagulants. A cohort study and systematic review. European journal of neurology : the official journal of the European Federation of Neurological Societies. 2016;23(2):290-6.
- Saver, Jeffrey L., et al. Stent-retriever thrombectomy after intravenous t-PA vs. t-PA alone in stroke. New England Journal of Medicine. 2015;372(24):2285-2295.
- Schonenberger S, Uhlmann L, Hacke W, Schieber S, Mundiyanapurath S, Purrucker JC, et al. Effect of conscious sedation vs general anesthesia on early neurological improvement among patients with ischemic stroke undergoing endovascular thrombectomy: A randomized clinical trial. JAMA. 2016;316:1986-1996
- Simonsen CZ, Yoo AJ, Sorensen LH, Juul N, Johnsen SP, Andersen G, et al. Effect of general anesthesia and conscious sedation during endovascular therapy on infarct growth and clinical outcomes in acute ischemic stroke: A randomized clinical trial. JAMA Neurol. 2018;75:470-477
- Van de Graaf RA, Samuels N, Mulder M, Eralp I, van Es A, Dippel DWJ, et al. Conscious sedation or local anesthesia during endovascular treatment for acute ischemic stroke. Neurology. 2018;91:e19-e25
- Van den Berg LA, Dijkgraaf MG, Berkhemer OA, Fransen PS, Beumer D, Lingsma HF, et al. Two-year outcome after endovascular treatment for acute ischemic stroke. N Engl J Med. 2017;376:1341-1349
- van der Hoeven EJ, Schonewille WJ, Vos JA, Algra A, Audebert HJ, Berge E, et al. The basilar artery international cooperation study (basics): Study protocol for a randomised controlled trial. Trials. 2013;14:200
- Zinkstok, S. M., & Roos, Y. B. (2012). Early administration of aspirin in patients treated with alteplase for acute ischaemic stroke: a randomised controlled trial. The Lancet, 380(9843), 731-737.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question:
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Albers, 2018
DEFUSE III |
Type of study: multicentre, randomized, open-label trial
Setting: hospital
Country: USA
Source of funding: NIH through StrokeNet |
Inclusion criteria: Patients could undergo initiation of endovascular therapy between 6 and 16 hours after the time that they had last been known to be well, including if they had awakened from sleep with symptoms of a stroke; had an initial infarct volume (ischemic core) of less than 70 ml, a ratio of volume of ischemic tissue to initial infarct volume of 1.8 or more, and an absolute volume of potentially reversible ischemia (penumbra) of 15 ml or more; occlusion of the cervical or intracranial internal carotid artery or the proximal middle cerebral artery on (CTA) or (MRA).
Exclusion criteria:
N total at baseline: Intervention: 92 Control: 90
Important prognostic factors2: For example age ± SD: I: C:
Sex: I: % M C: % M
Groups comparable at baseline?
|
Describe intervention (treatment/procedure/test):
Endovasculair treatment after 6 to 16 hours |
Describe control (treatment/procedure/test):
Standard medical therapy |
Length of follow-up: 3 months
Loss-to-follow-up: 3 patients were lost to follow-up at day 90
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Ordinal score on the modified Rankin scale (range, 0 [no symptoms] to 6 [death]) at day 90: unadjusted common odds ratio, 2.77; 95% confidence interval [CI], 1.63 to 4.70; P<0.001). The odds ratio after adjustment for stratification factors was 3.36 (95% CI, 1.96 to 5.77; P<0.001).
Functional independence (defined as a score on the modified Rankin scale of 0 to 2) at day 90. I: 41/92 = 45% C: 15/90 = 17%
Death within 90 days: I: 13/92 = 14% C: 21/90 = 26%
Occurrence of symptomatic intracranial hemorrhage within 36 hours, defined as an increase of at least 4 points in the NIHSS score that was associated with brain haemorrhage on imaging within 36 hours after symptom onset: I: 7% C: 4%
|
Study was terminated early for efficacy |
|
Berkhemer, 2015
MR CLEAN |
Type of study: RCT
Setting: hospital
Country: The Netherlands
Source of funding: Supported by the Dutch Heart Foundation and by unrestricted grants from AngioCare Covidien/ev3, Medac/Lamepro, and Penumbra. |
Inclusion criteria: Initiation of intraarterial treatment had to be possible within 6 hours after stroke onset. An occlusion of the distal intracranial carotid artery, middle cerebral artery (M1 or M2), or anterior cerebral artery (A1 or A2), established with computed tomographic (CT) angiography (CTA), magnetic resonance angiography (MRA), or digital-subtraction angiography (DSA), and a score of 2 or higher on the National Institutes of Health Stroke Scale (NIHSS; range, 0 to 42, with higher scores indicating more severe neurologic deficits). Inclusion of patients with an additional extracranial internal- carotid-artery occlusion or dissection was left to the judgment of the treating physician.
Exclusion criteria:
N total at baseline: Intervention: 233 Control: 267
Important prognostic factors2: Age (median) I: 65.8 C: 65.7
Sex: I: 57.9% M C: 58.8% M
Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test):
Intraarterial treatment consisted of arterial catheterization with a microcatheter to the level of occlusion and delivery of a thrombolytic agent, mechanical thrombectomy, or both. The method of intraarterial treatment was left to the discretion of the local interventionist.
The use of alteplase or urokinase for intraarterial thrombolysis was allowed in this trial, with a maximum dose of 90 mg of alteplase or 1,200,000 IU of urokinase. The dose was restricted to 30 mg of alteplase or 400,000 IU of urokinase if intravenous alteplase was given. Mechanical treatment could involve thrombus retraction, aspiration, wire disruption, or use of a retrievable stent.
|
Describe control (treatment/procedure/test):
Usual care (which could include intravenous administration of alteplase) |
Length of follow-up: 90 days
Remarks: Intraarterial treatment was never initiated in 17 patients (7.3%) assigned to the
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Ordinal score on the modified Rankin scale (range, 0 [no symptoms] to 6 [death]) at day 90: I: 3 (2 to 5) C: 4 (3 to 5)
Functional independence (defined as a score on the modified Rankin scale of 0 to 2) at day 90. I: 76/233 (32.6%) C: 51/267 (19.1%)
Death within 90 days: 52 patients were death, there was no difference between I: 44/233 = 19% C: 49/267 = 18%
Occurrence of symptomatic intracranial hemorrhage within 36 hours, defined as an increase of at least 4 points in the NIHSS score that was associated with brain haemorrhage on imaging within 36 hours after symptom onset: I: 18 (7.7%) C: 17 (6.4%)
|
Actual intraarterial therapy (with or without mechanical thrombectomy) was performed in 196 of the 233 patients in the intervention group (84.1%). In 88 patients (37.8%), general anesthesia was used. A simultaneous second revascularization procedure (acute cervical carotid stenting) was performed in 30 patients (12.9%). Mechanical treatment was performed in 195 of the 233 patients (83.7%). Retrievable stents were used in 190 patients (81.5%), and other devices were used in 5 patients (2.1%) (Table S2 in the Supplementary Appendix). Additional intraarterial thrombolytic agents were given to 24 patients (10.3%). |
|
Bracard, 2016
Thrace |
Type of study: RCT
Setting: hospital
Country: USA
Source of funding: funded by the French Ministry for Health as part of its 2009 STIC programme for the support of costly innovations (grant number 2009 A00753-54) |
Inclusion criteria: acute ischaemic stroke were eligible for inclusion if they were aged 18–80 years; had a US National Institutes of Health Stroke Scale (NIHSS) score of 10–25; had an occlusion of the intracranial internal carotid artery, the M1 segment of the middle cerebral artery, or the superior third of the basilar artery confirmed by CT or magnetic resonance angiography; could be administered intra venous thrombo lysis within 4 h of symptom onset; and if thrombectomy could be initiated within 5 h of symptom onset.
Exclusion criteria: Patients who had cervical internal carotid artery occlusion and subocclusive stenosis
N total at baseline: Intervention: 208 Control: 204
Important prognostic factors2: For example age ± SD: I: 66 (54–74) C: 68 (54–75)
Sex: I: 57% M C: 50% M
Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test):
Intravenous thrombolysis and mechanical thrombectomy (IVTMT group)
All patients received intravenous thrombolysis as per standard care—ie, 0·9 mg/kg of alteplase (maximum 90 mg), with an initial bolus of 10% of the total dose, and then infusion of the remaining dose over 60 min, irrespective of group assignment. Initially, patients allocated to the IVTMT group were to be clinically assessed after the completion of intravenous thrombolysis but before angiography. |
Describe control (treatment/procedure/test):
intravenous thrombolysis alone (IVT group).
All patients received intravenous thrombolysis as per standard care—ie, 0·9 mg/kg of alteplase (maximum 90 mg), with an initial bolus of 10% of the total dose, and then infusion of the remaining dose over 60 min, irrespective of group assignment |
Length of follow-up:3 months
Loss-to-follow-up: Intervention: N (%) 2 Reasons (describe)
Control: N (%) 2 Reasons (describe)
Incomplete outcome data: Intervention: 2 N (%) Reasons (describe)
Control: N (%) 4 Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Functional independence (defined as a score of 0, 1, or 2 on the modified Rankin scale) at day 90. I: 106/200 =53% C: 85/202 = 42%
Death within 90 days: I: 24/202 = 12% C: 27/206 = 13%
Occurrence of symptomatic intracranial hemorrhage (defined according to European Cooperative Acute Stroke Study III criteria as the presence of extravascular blood in the cranium that was associated with an increase in the NIHSS score of ≥4 points or death and was judged to be the predominant cause of neurologic deterioration) within 24 hours after randomization: I: 4/185 = 2% C: 3/192 = 2%
|
|
|
Broderick, 2013
IMS III |
Type of study: RCT
Setting: hospital
Country: USA
Source of funding: grants from the National Institutes of Health and the National Institute of Neurological Disorders and Stroke (UC U01NS052220, MUSC U01NS054630, and U01NS077304) and by Genentech, EKOS, Concentric Medical, Cordis Neurovascular, and Boehringer Ingelheim. |
Inclusion criteria: receipt of intravenous t-PA within 3 hours after symptom onset and a moderate-to-severe neurologic deficit (defined as an NIHSS score ≥10 or, after approval of amendment 3, a score of 8 to 9 with CT angiographic evidence of an occlusion of the first segment of the middle cerebral artery [M1], internal carotid artery, or basilar artery at institutions where CT angiographic imaging at baseline was the standard of care for patients with acute stroke).
Exclusion criteria:
N total at baseline: Intervention: 434 Control: 222
Important prognostic factors2: age (median): I: 69 C: 68
Sex: I: 50% M C: 55% M
Groups comparable at baseline? Yes, except for history of coronary artery disease |
Describe intervention (treatment/procedure/test):
All participants began receiving a standard dose of intravenous t-PA (0.9 mg per kilogram), with 10% as a bolus and the remainder infused over a 1-hour period (maximum dose, 90 mg). Throughout the trial, randomization was required within 40 minutes after the initiation of the infusion.
Participants randomly assigned to the endovascular-therapy group underwent angiography as soon as possible, either at the hospital that initiated treatment with intravenous t-PA or at another participating hospital. Participants who had no angiographic evidence of a treatable occlusion received no additional treatment, and those with a treatable vascular occlusion received endovascular intervention with an approach chosen by the site neurointerventionalist.
|
Describe control (treatment/procedure/test):
All participants began receiving a standard dose of intravenous t-PA (0.9 mg per kilogram), with 10% as a bolus and the remainder infused over a 1-hour period (maximum dose, 90 mg). Throughout the trial, randomization was required within 40 minutes after the initiation of the infusion. The patients randomly assigned to the intravenous t-PA group received the remainder of the standard dose.
|
Length of follow-up: 3 months
Remarks: An unfavorable imputation was applied for 27 participants (14 participants for whom the primary outcome was assessed outside the specified 30-day window and 13 for whom the primary outcome was not assessed).
Loss-to-follow-up: Not reported
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Functional independence (defined as a score on the modified Rankin scale of 0 to 2) at day 90. I: 177/434 = 40.8% C: 86/222 = 38.7% absolute adjusted difference, 1.5 percentage points; 95% confidence interval [CI], −6.1 to 9.1, with adjustment for NIHSS strata)
Death within 90 days: I: 83 (19%) C: 48 (21.6%)
Occurrence of symptomatic intracranial hemorrhage within 36 hours, defined as an increase of at least 4 points in the NIHSS score that was associated with brain haemorrhage on imaging within 36 hours after symptom onset: I: 27 (6.2%) C: 13 (5.9%)
|
stopped early because of futility |
|
Campbell, 2015 Extend IA |
Type of study: RCT
Setting: hospital
Country: Australia
Source of funding: Supported by grants from the Australian National Health and Medical Research Council of Australia (1043242 and 1035688), Royal Australasian College of Physicians, Royal Melbourne Hospital Foundation, the National Heart Foundation of Australia, and the National Stroke Foundation of Australia; and by infrastructure funding from the state government of Victoria. The Solitaire FR device and trial infrastructure were provided under an unrestricted grant from Covidien. |
Inclusion criteria: could receive intravenous alteplase within 4.5 hours after the onset of anterior circulation ischemic stroke and had occlusion of the internal carotid artery or of the first or second segment of the middle cerebral artery, as seen on CT angiography. In addition, CT perfusion imaging, which was processed with the use of fully automated software (RAPID, noncommercial research version, Stanford University), was used to identify potentially salvageable brain tissue. Brain tissue at risk for infarction (“ischemic penumbra”) was distinguished from minimally hypoperfused tissue if the time to maximum (Tmax) delay was more than 6 seconds. Irreversibly injured brain (“ischemic core”) was diagnosed if the relative cerebral blood flow was less than 30% of that in normal tissue.
Exclusion criteria: Endovascular therapy had to be initiated (groin puncture) within 6 hours after stroke onset and completed within 8 hours after onset. There were no restrictions on age or clinical severity, as assessed according to the score on the National Institutes of Health Stroke Scale (NIHSS), which ranges from 0 (normal) to 42 (death). However, patients were required to have functional independence before the stroke episode, which was defined as a score of less than 2 on the modified Rankin Scale, which ranges from 0 (normal) to 6 (death).
N total at baseline: Intervention: 35 Control: 35
Important prognostic factors2: For example age ± SD: I: 68.6±12.3 C: 70.2±11.8
Sex: I: 49% M C: 49% M
Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test):
alteplase at a dose of 0.9 mg per kilogram as standard care plus endovascular therapy (endovasculartherapy group)
|
Describe control (treatment/procedure/test):
alteplase at a dose of 0.9 mg per kilogram as standard care; no further therapy (alteplase-only group)
|
Length of follow-up: 3 months
Loss-to-follow-up: Not reported
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Ordinal score on the modified Rankin scale (range, 0 [no symptoms] to 6 [death]) at day 90 (median): I: 1 (0 to 3) C: 3 (1 to 5) (generalized odds ratio, 2.0; 95% confidence interval [CI], 1.2 to 3.8; P = 0.006
Functional independence (defined as a score on the modified Rankin scale of 0 to 2) at day 90. I: 25/35 (71%) C: 14/35 (40%)
Death within 90 days: I: 3/35 (9%) C: 7/35 (20%)
Occurrence of symptomatic intracranial hemorrhage within 36 hours, defined as an increase of at least 4 points in the NIHSS score that was associated with brain haemorrhage on imaging within 36 hours after symptom onset: I: 0% C: 2 (6%)
|
The trial stopped early because of efficacy.
|
|
Ciccone, 2013
Synthesis |
Type of study: RCT
Setting: hospital
Country: Italy
Source of funding: Supported by a grant from the Italian Medicines Agency (AIFA) (FARM6LN3KS). The trial received t-PA from Boehringer Ingelheim Italia, which was paid by the AIFA for use in the experimental group and by the individual participating hospitals for use in the control group. The catheters and devices used in the study were those present in the participating interventional radiologists’ apparatus and were refunded by Niguarda Ca’ Granda Hospital (Milan) with the AIFA funding. |
Inclusion criteria: Patients with acute stroke and an age of 18 to 80 years, in whom intracranial hemorrhage had been ruled out, were eligible if there was a clearly defined time of stroke onset that allowed for immediate initiation of intravenous t-PA therapy (defined as within 4.5 hours after symptom onset) or for the administration of endovascular treatment as soon as possible (within 6 hours after symptom onset).
Exclusion criteria:
N total at baseline: Intervention: 181 Control: 191
Important prognostic factors2: For example age ± SD: I: 66±11 C: 67±11
Sex: I: 59% M C: 57% M
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
Patients who were assigned to this treatment group did not receive intravenous t-PA while awaiting endovascular treatment. Angiography was targeted to acquire data essential for guiding endovascular therapy. Anticoagulant therapy was recommended with an initial bolus dose of 5000 IU of intravenous heparin, followed by an infusion of 500 IU per hour until the conclusion of the angiography. Once the diagnostic information had been acquired, the interventionist could consider pharmacologic or mechanical thrombolysis or both. For pharmacologic thrombosis, a microcatheter was to be positioned close to (or within or beyond) the thrombus with the use of a microguide; the full t-PA dose infused did not exceed 0.9 mg per kilogram of body weight (maximum, 90 mg for patients with a body weight of ≥100 kg) and was to be delivered within 1 hour. If complete recanalization was achieved before the maximum dose was reached, the t-PA infusion was stopped. The option of mechanical thrombolysis was left to each interventionist’s discretion. Mechanical thrombosis could involve the use of a micro-guidewire to facilitate disintegration of the thrombus, systems to capture and extract the thrombus, or more complex systems to crush and aspirate it. |
Describe control (treatment/procedure/test):
Standard treatment that also included systemic thrombolytic treatment is indicated was to be started immediately after randomization, within 4.5 hours after symptom onset. Intravenous t-PA was administered at a dose of 0.9 mg per kilogram (maximum, 90 mg), with 10% given as an initial bolus and the remaining 90% as a constant infusion over a period of 60 minutes. |
Length of follow-up: 90 days
Loss-to-follow-up: None
Incomplete outcome data: Intervention: 15 did not receive the treatment (6 because of clinical improvement, 3 because of a lack of evidence of occlusion, 3 because of dissection, 1 because of an unknown bleeding diathesis, 1 because of a groin hematoma, and 1 because of the delayed availability of the interventionist). Three procedures had to be interrupted, owing to equipment breakdown (in one procedure) and intraprocedural complications (in two procedures).
|
Outcome measures and effect size (include 95%CI and p-value if available):
Ordinal score on the modified Rankin scale (range, 0 [no symptoms] to 6 [death]) at day 90: Not reported
Functional independence (defined as a score on the modified Rankin scale of 0 to 2) at day 90. I: (22+33+21=) 76/181 = 42% C: (28+35+21=) 84/181 = 46%
Death within 90 days: I: 26/181 = 14% C: 18/181 = 9,9%
Occurrence of symptomatic intracranial hemorrhage within 36 hours, defined as an increase of at least 4 points in the NIHSS score that was associated with brain haemorrhage on imaging within 36 hours after symptom onset: I:10/181 6% C: 10/181 6%
|
|
|
Del Zoppo, 1998
ProAct I |
Type of study: RCT
Setting: hospital
Country: USA
Source of funding Abbott Laboratories (Abbott Park, Ill) |
Inclusion criteria: patients (1) have a new onset of focal neurological signs in the MCA distribution allowing randomization and initiation of treatment within 6 hours of the onset of symptoms; (2) have a minimum NIHSS14 score of 4, except for isolated aphasia or isolated hemianopsia; and (3) be 18 to 85 years old. Clinical exclusion criteria included an NIHSS score .30, coma, minor stroke symptoms, or a history of stroke within the previous 6 weeks; suspected lacunar stroke; seizure at stroke onset; clinical presentation suggestive of subarachnoid hemorrhage (even if the initial CT scan was normal); evidence or history of intracranial haemorrhage at any time or an intracranial neoplasm; uncompensated hypertension (blood pressure .180/100 mm Hg); presumed septic embolus or endocarditis; surgery or trauma (within 30 days); head trauma (within 90 days); active or recent hemorrhage within 14 days; known hereditary or acquired hemorrhagic diathesis; or oral anticoagulation with an international normalized ratio .1.5.
Exclusion criteria: evidence of hemorrhage of any degree, significant mass effect with midline shift, or the presence of an intracranial tumor (except a small meningioma). Patients with early changes of ischemia on CT were included.
N total at baseline: Intervention: 26 Control: 14
Important prognostic factors2: For example age ± SD: I: 66.5 ± 11.0 C: 69.6 ± 11.1
Sex: I: 54% M C: 36% M
Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test):
underwent diagnostic cerebral angiography of the symptomatic carotid artery territory. Angiographic inclusion criteria were complete occlusion (TIMI grade 0)15 or contrast penetration with minimal perfusion (TIMI grade 1) of either the horizontal M1 segment or the M2 division of the MCA. Patients not meeting the angiographic inclusion criteria were followed for neurological deterioration and/or serious adverse events for 24 hours or until alternative treatment was initiated, whichever came first. If an M1 or M2 occlusion was documented, the patient was allocated by the Central Randomization Center to receive either 6 mg rpro-UK or saline placebo at a 30-mL/h controlled infusion rate (tier I)
|
Describe control (treatment/procedure/test):
Matching placebo consisting of saline |
Length of follow-up: 3 months
Loss-to-follow-up: no
Incomplete outcome data: no
|
Outcome measures and effect size (include 95%CI and p-value if available):
Ordinal score on modified Rankin scale 0-2: Not reported
Functional independence (defined as a score of 0, 1, or 2 on the modified Rankin scale) at day 90. Not reported, only 0-1
Death within 90 days: I: 7/26 C: 6/14 Absolute difference:
Occurrence of symptomatic intracranial hemorrhage (defined according to European Cooperative Acute Stroke Study III criteria as the presence of extravascular blood in the cranium that was associated with an increase in the NIHSS score of ≥4 points or death and was judged to be the predominant cause of neurologic deterioration) within 24 hours after randomization: I:0 % C: 0%
|
|
|
Furlan, 1999
Pro Act II |
Type of study: RCT
Setting: hospital
Country: USA
Source of funding: funded by Abott laboratories |
Inclusion criteria: new focal neurological signs in the MCA distribution allowing initiation of treatment within 6 hours of onset of symptoms; a minimum NIHSS score of 4, except for isolated aphasia or hemianopia; and age 18-85 y.
Exclusion criteria: see publication
N total at baseline: Intervention: 121 Control: 59
Important prognostic factors2: age ± SD: I: 64 ± 14 C: 64 ± 14
Sex: I: 58% M C: 61% M
Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test):
Intra-arterial recombinant pro Urokinase plus heparin
|
Describe control (treatment/procedure/test):
heparin |
Length of follow-up: 90 days
Remarks: Intervention: 13 did not receive pro UroK: No M1 or M2 occlusion, 3 not within 6h of onset, 2 technical difficulties and 4 other reason
Control: 5 received pro uro K: pharmacy error 2; patient/family insistence
Incomplete outcome data: Intervention: 10 N (%) Reasons (describe)
Control: 8 N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Ordinal score on modified Rankin scale: I:. 5.5±3.8 C: 3.4±3.1
Functional independence (defined as a score of 0, 1, or 2 on the modified Rankin scale) at day 90. I: 49/121 = 40% C: 15/59 = 25%
Death within 90 days: I: 25/121 = 25 % C: 27/59 = 27% Absolute difference:
Occurrence of symptomatic intracranial hemorrhage (defined according to European Cooperative Acute Stroke Study III criteria as the presence of extravascular blood in the cranium that was associated with an increase in the NIHSS score of ≥4 points or death and was judged to be the predominant cause of neurologic deterioration) within 24 hours after randomization: I: 38/108 = 35% C: 7/54 = 13%
|
|
|
Goyal, 2015
ESCAPE |
Type of study: RCT
Setting: hospital
Country: At 22 centers in Canada (11 centers), the United States (6), South Korea (3), Ireland (1), and the United Kingdom (1)
Source of funding: Supported by Covidien through an unrestricted grant to the University of Calgary. Also supported by the University of Calgary (Hotchkiss Brain Institute, the Department of Clinical Neurosciences and Calgary Stroke Program, and the Department of Radiology), Alberta Innovates–Health Solutions, the Heart and Stroke Foundation of Canada, and Alberta Health Services. |
Inclusion criteria: adults (no upper-age limit) with a disabling ischemic stroke who had been functioning independently in the community (score on the Barthel Index [range, 0 to 100, with higher scores indicating a greater ability to complete activities of daily living] ≥90) before the stroke. Enrollment could occur up to 12 hours after the onset of stroke symptoms. Noncontrast CT and CTA (preferably multiphase) were performed to identify participants with a small infarct core, an occluded proximal artery in the anterior circulation, and moderate-to-good collateral circulation. Multiphase CTA is less vulnerable to patient motion than CT perfusion, requires no additional contrast, and allows for quick determination of collateral status. The use of magnetic resonance imaging for patient selection was discouraged.
Exclusion criteria:
N total at baseline: Intervention: 165 Control: 150
Important prognostic factors2: Age (median): I: 71 C: 70
Sex: I: 48% M C: 47% M
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
Before and during screening, participants were treated with intravenous alteplase when clinically appropriate as part of standard care (
rapid endovascular treatment. A cerebral angiogram was obtained. The neurointerventionist used available thrombectomy devices to achieve reperfusion. The use of retrievable stents was recommended. During thrombus retrieval, suction through a balloon guide catheter in the relevant internal carotid artery was also recommended.
|
Describe control (treatment/procedure/test):
Before and during screening, participants were treated with intravenous alteplase when clinically appropriate as part of standard care (
The control group received the current standard of care as described in the Canadian or local guidelines for the management of acute stroke. |
Length of follow-up: 90 days
Crossover: One participant in the control group crossed over to receive endovascular treatment. In the intervention group, 14 participants did not receive any interventional therapy. Four participants (1.3%) were lost to follow-up; missing data on outcomes in these participants were not imputed.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Ordinal score on the modified Rankin scale (range, 0 [no symptoms] to 6 [death]) at day 90 (median): I: 2 C: 4
Functional independence (defined as a score on the modified Rankin scale of 0 to 2) at day 90. I: 87/164 (53%) C: 43/147 (29%) (rate ratio, 1.8; 95% CI, 1.4 to 2.4; P<0.001)
Death within 90 days: I: 17/164 (10%) C: 28/147 (19%) (rate ratio, 0.5; 95% CI, 0.3 to 1.0; P = 0.04)
Occurrence of symptomatic intracranial hemorrhage: I: 6 (3.6%) C: 4 (2.7%) (rate ratio, 1.4; 95% CI, 0.4 to 4.7; P = 0.75) |
|
|
Jovin, 2015
Revascat |
Type of study: RCT
Setting: hospital
Country: Spain
Source of funding: Supported by Fundació Ictus Malaltia Vascular through an unrestricted grant from Covidien, by a grant from the Spanish Ministry of Health cofinanced by Fondo Europeo de Desarrollo Regional (Instituto de Salud Carlos III, Red Temática de Investigación Cooperativa Invictus, RD 12/0014/008), and a grant from the Generalitat de Catalunya (SGR 464/2014). |
Inclusion criteria: Eligible patients were between the ages of 18 and 80 years, had an occlusion in the proximal anterior circulation that could be treated within 8 hours after symptom onset, had a prestroke functional ability of 1 or less on the modified Rankin scale (ranging from 0 [no symptoms] to 6 [death]), and had a baseline score of at least 6 points on the National Institutes of Health Stroke Scale (NIHSS), which ranges from 0 to 42, with higher values indicating more severe deficit.
Exclusion criteria: evidence of a large ischemic core, as indicated by an Alberta Stroke Program Early Computed Tomography Score (ASPECTS) of less than 7 on computed tomography (CT) without the use of contrast material or a score of less than 6 on diffusion-weighted magnetic resonance imaging
N total at baseline: Intervention: 103 Control: 103
Important prognostic factors2: age ± SD: I: 65.7±11.3 C: 67.2±9.5
Sex: I: 53% M C: 52% M
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
medical therapy (including intravenous alteplase when eligible) and endovascular treatment with the Solitaire stent retriever (thrombectomy group)
|
Describe control (treatment/procedure/test):
medical therapy alone (control group).
|
Length of follow-up: 3 months
Loss-to-follow-up: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Ordinal score on the modified Rankin scale (range, 0 [no symptoms] to 6 [death]) at day 90: Not reported
Functional independence (defined as a score on the modified Rankin scale of 0 to 2) at day 90. I: 45/103 (43.7%) C: 29/103 (28.2%)
Death within 90 days: I: 19/103 = 18.4% C: 116/103 = 5.5%
Occurrence of symptomatic intracranial hemorrhage: I: 5/103 = 4.9% C: 2/103 = 1.9%
|
REVASCAT |
|
Kidwel, 2013
MR RESCUE |
Type of study: RCT
Setting: hospital
Country: USA
Source of funding: Supported by a grant (P50 NS044378) from NINDS. Concentric Medical provided study catheters and devices from the initiation of the study until August 2007; thereafter, costs for all study catheters and devices were covered by study funds or third-party payers. |
Inclusion criteria: patients between the ages of 18 and 85 years, with National Institutes of Health Stroke Scale (NIHSS) scores of 6 to 29 (on a scale ranging from 0 to 42, with higher scores indicating more severe neurologic deficits) who had a large-vessel, anterior-circulation ischemic stroke were randomly assigned within 8 hours after the onset of symptoms to undergo either mechanical embolectomy Patients who were treated with intravenous t-PA without successful recanalization were eligible if magnetic resonance angiography or CT angiography after the treatment showed a persistent target occlusion.
Exclusion criteria:
N total at baseline: Intervention: 70 Control: 57
Important prognostic factors2: age ± SD: Penumbral I: 66.4±13.2 C: 65.8±16.9 Nonpenumbral I: 61.6±12.0 C: 69.4±15.9
Sex: 57% M
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
Patients in the embolectomy group could be treated with any combination of FDA-cleared embolectomy devices, including the Merci Retriever (since trial initiation in 2004) and the Penumbra System (since 2009). The intraarterial administration of t-PA at a dose of as much as 14 mg was allowed as rescue therapy within 6 hours after symptom onset.
|
Describe control (treatment/procedure/test):
The intraarterial administration of t-PA at a dose of as much as 14 mg was allowed as rescue therapy within 6 hours after symptom onset.
|
Length of follow-up: 90 days
Loss-to-follow-up: Intervention: 11 (%) Reasons (describe): excluded from per-protocol analysis (6), no target lesion on vessel imaging (5), failed perfusion imaging (1)
Control: 6 (%) Reasons (describe): excluded from per-protocol analysis (3), no target lesion on vessel imaging (2), failed perfusion imaging (1)
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Ordinal score on the modified Rankin scale (range, 0 [no symptoms] to 6 [death]) at day 90: I: 3.9 C: 3.9
Functional independence (defined as a score on the modified Rankin scale of 0 to 2) at day 90. I: 12/38 = 32% C: 11/36 = 31%
Death within 90 days: I: 12/64 = 19% C: 13/54 = 24%
Occurrence of symptomatic intracranial hemorrhage within 36 hours, defined as an increase of at least 4 points in the NIHSS score that was associated with brain haemorrhage on imaging within 36 hours after symptom onset: I: 3 9% C: 2 6%
|
Randomization was stratified according to whether the patient had a favourable penumbral pattern (substantial salvageable tissue and small infarct core) or a nonpenumbral pattern (large core or small or absent penumbra) |
|
Mocco, 2016
Therapy |
Type of study: RCT
Setting: hospital
Country: USA and Germany
Source of funding: Penumbra, Inc |
Inclusion criteria: Eligible patients (18–85 years old) with intracranial internal carotid artery (ICA) or middle cerebral artery occlusion on CT angiography and an National Institute of Health Stroke Scale (NIHSS) score of ≥8 were treated with intravenous-alteplase based on standard eligibility criteria. Enrollment required a nonenhanced thin-section (≤2.5 mm) CT scan demonstrating ≥8 mm clot length. Investigators were trained on clot length identification methodology17 and each site submitted examples before study initiation.
Exclusion criteria: >1 of 3 of the affected middle cerebral artery territory with established infarction, cervical ICA stenosis/occlusion requiring treatment before thrombectomy, and prestroke disability (modified Rankin Scale [mRS] score >1).
N total at baseline: Intervention: 55 Control: 53
Important prognostic factors2: For example age ± SD: I: C:
Sex: I: % M C: % M
Groups comparable at baseline?
|
Describe intervention (treatment/procedure/test):
aspiration thrombectomy after intravenous-alteplase administration compared with intravenousalteplase alone in patients with large vessel ischemic stroke because of ≥8 mm thrombus
|
Describe control (treatment/procedure/test):
intravenousalteplase alone |
Length of follow-up: 3 months
Loss-to-follow-up: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Functional independence (defined as a score of 0, 1, or 2 on the modified Rankin scale) at day 90. I: 19/50 = 38% C: 14/46 = 30%
Death within 90 days: I:6/55 = 12% C: 12/53 = 23.9% Absolute difference:
Occurrence of symptomatic intracranial hemorrhage (defined according to European Cooperative Acute Stroke Study III criteria as the presence of extravascular blood in the cranium that was associated with an increase in the NIHSS score of ≥4 points or death and was judged to be the predominant cause of neurologic deterioration) within 24 hours after randomization: I: 5/55= 9.3% C: 5 /53=9.7%
|
|
|
Muir, 2017
Piste |
Type of study: RCT
Setting: hospital
Country: UK
Source of funding: the Stroke Association (TSA 2011/2006) from 2012 to 2015 and the National Institute of Health Research (NIHR) Health Technology Assessment programme (HTA 14.08.47) from 2015 to 2016, and received unrestricted grants from Codman and Covidien (Medtronic). |
Inclusion criteria: patients ≥18 years were eligible if presenting with acute supratentorial ischaemic stroke and eligible for IVT started within 4.5 hours of symptom onset. If non-invasive angiographic imaging with CT angiography (CTA) or magnetic resonance angiography showed occlusion of the intracranial ICA, M1 segment of the MCA or a single M2 MCA branch, patients were eligible for randomisation.
Exclusion criteria: contraindications to IVT, life expectancy limited to <90 days, with chronic extracranial ICA occlusion or with extensive early hypodensity on non-contrast CT brain involving more than one-third of the MCA territory
N total at baseline: Intervention: 32 Control: 33
Important prognostic factors2: For example age ± SD: I: 67±17 C: 64±16
Sex: I: 39% M C: 50% M
Groups comparable at baseline? Those randomised to receive MT were older, more often female, had more severe strokes, higher prevalence of some vascular risk factors (diabetes, atrial fibrillation) and a higher proportion had prestroke impairment on estimated mRS; a higher proportion had good collateral score and favourable ASPECT score.
|
Describe intervention (treatment/procedure/test):
Inravenous trombolysis and mechanical trombecomy
|
Describe control (treatment/procedure/test):
Intravenous trombolysis alone |
Length of follow-up: 3 months
Loss-to-follow-up: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Functional independence (defined as a score of 0, 1, or 2 on the modified Rankin scale) at day 90. I: 16/32 = 51% C: 13/33 = 40%
Death within 90 days: I: 7/32 =22% C: 4/33 -= 12% Absolute difference:
Occurrence of symptomatic intracranial hemorrhage (defined according to European Cooperative Acute Stroke Study III criteria as the presence of extravascular blood in the cranium that was associated with an increase in the NIHSS score of ≥4 points or death and was judged to be the predominant cause of neurologic deterioration) within 24 hours after randomization: I: 0% C: 0%
|
|
|
Nogueira, 2018
DAWN |
Type of study: RCT
Setting: hospital
Country: USA
Source of funding: Stryker Neurovascular, which provided funding and the thrombectomy devices for the trial and performed regulatory monitoring at each site and central database maintenance. The first drafts of the manuscript were written by the first and last authors, with input from all the authors and with no writing assistance from the sponsor. The authors had unrestricted access to the data. The data analysis was performed by a data-management staff from Stryker Neurovascular, with oversight from independent statisticians. All the authors vouch for the completeness and accuracy of the reported data and the fidelity of the trial to the protocol. |
Inclusion criteria: evidence of occlusion of the intracranial internal carotid artery, the first segment of the middle cerebral artery, or both on computed tomographic (CT) angiography or magnetic resonance angiography. In addition, patients had to have a mismatch between the severity of the clinical deficit and the infarct volume, see publication for detaisl; >18 years of age, interval between the time that the patient was last known to be well and randomization of 6 to 24 hours, a prestroke score of 0 or 1 on the modified Rankin scale, no evidence of intracranial hemorrhage on CT or MRI, and no evidence of an infarct involving more than one third of the territory of the middle cerebral artery on CT or MRI at baseline
Exclusion criteria:
N total at baseline: Intervention: 107 Control: 99
Important prognostic factors2: For example age ± SD: I: 69.4±14.1 C: 70.7±13.2
Sex: I: 39 % M C: 52% M
Groups comparable at baseline? Yes, except for a history of atrial fibrillation (P = 0.01), treatment with intravenous alteplase (P = 0.04), and the onset of stroke on awakening (P = 0.03). |
Describe intervention (treatment/procedure/test):
thrombectomy plus standard medical care
|
Describe control (treatment/procedure/test):
standard medical care alone (the control group) |
Length of follow-up: 90 days
Loss-to-follow-up: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Score on utility weighted modified Rankin scale (To determine the utility-weighted score, the score on the modified Rankin scale is weighted according to average values calculated from patient-centered and clinician-centered studies. The following weights are assigned to scores 0 through 6 on the modified Rankin scale: 10.0, 9.1, 7.6, 6.5, 3.3, 0, and 0, respectively. The utility-weighted modified Rankin scale ranges from 0 (death) to 10 (no symptoms or disability)) at day 90: I:. 5.5±3.8 C: 3.4±3.1
Functional independence (defined as a score of 0, 1, or 2 on the modified Rankin scale) at day 90. I: 52/107 = 49% C: 13/99 = 13%
Death within 90 days: I: 19% C: 18% Absolute difference: 1 (-10 to 11)
Occurrence of symptomatic intracranial hemorrhage (defined according to European Cooperative Acute Stroke Study III criteria as the presence of extravascular blood in the cranium that was associated with an increase in the NIHSS score of ≥4 points or death and was judged to be the predominant cause of neurologic deterioration) within 24 hours after randomization: I: 6% C: 3% Absolute difference: 3 (-3 to 8)
|
|
|
Ogawa, 2007
MELT |
Type of study: RCT
Setting: hospital
Country: USA
Source of funding: Grants-in-Aid from the Ministry of Health, Labor and Welfare of Japan (H14-Shinkin-007 and H16-Shinkin-004) |
Inclusion criteria: new onset of focal neurological signs in the MCA distribution allowing randomization and initiation of fibrinolysis within 6 hours from the onset of symptoms; minimum National Institutes of Health Stroke Scale (NIHSS) score of 5, except for immediate improvement before initiation of treatment; no or only subtle early ischemic signs in the insular cortex, frontal and temporal opercula, or lenticular nuclei on initial CT allowing initiation of treatment within 2 hours of CT; and age 20 to 75 years old.
Exclusion criteria: coma; NIHSS score >22; seizure at stroke onset; premorbid disability of mRS score of >2; presumed fat embolus or endocarditis; and complication of other diagnostic angiography. Patients with high risk of hemorrhagic complication were also excluded
N total at baseline: Intervention: 57 Control: 57
Important prognostic factors2: age ± SD: I: 66.9_9.3 C: 67.3 8.5
Sex: I: 65% M C: 65% M
Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test):
Intravenous infusion of heparin (5000 IU) was administered before introducing the sheath. An infusion microcatheter with a single end hole was passed through the clot and positioned on the distal side of the thrombus. Local infusion into the clot or M1 segment was permitted if the microcatheter could not be passed through the clot. More proximal regional infusion was prohibited. Mechanical disruption of clots was permitted only with a guidewire. No other mechanical clot removal techniques were allowed. Repeat CT was required at a maximum interval of 2 hours. Only patients with no or subtle early ischemic signs on the second CT scan could be accepted for the next step. Intraarterial infusion of UK (120 000 IU over 5 minutes) was performed and repeated until the total dose reached 600 000 IU, 2 hours had passed after starting infusion, or complete recanalization was achieved. The dose of UK was determined based on previous uncontrolled studies of intraarterial infusion of UK for stroke and consensus among the investigators.
|
Describe control (treatment/procedure/test):
No specific treatments were indicated for the control group. Osmotic diuretics were used in patients manifesting high intracranial pressure. Intravenous infusion of fibrinolytic agents was prohibited in both UK and control groups. Any approved medical or rehabilitation treatment was allowed in all patients except for antithrombotic therapies, including heparin, warfarin, aspirin, and ticropidin, for 24 hours after fibrinolysis in the UK group. |
Length of follow-up: 90 days
Loss-to-follow-up: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Ordinal score on modified Rankin scale: I:. 5.5±3.8 C: 3.4±3.1
Functional independence (defined as a score of 0, 1, or 2 on the modified Rankin scale) at day 90. I: 28/57 = 49% C: 22/57 = 39%
Death within 90 days: I: 3/57 5% C: 2/57 = 4%
Occurrence of symptomatic intracranial hemorrhage (defined according to European Cooperative Acute Stroke Study III criteria as the presence of extravascular blood in the cranium that was associated with an increase in the NIHSS score of ≥4 points or death and was judged to be the predominant cause of neurologic deterioration) within 24 hours after randomization: I:1/57 = 2 % C: 0/57 = 0%
|
|
|
Saver, 2015
Swift Prime |
Type of study: RCT
Setting: hospital
Country: USA
Source of funding: Supported by Covidien. |
Inclusion criteria: acute ischemic stroke with moderate-to-severe neurologic deficits; had imaging-confirmed occlusion of the intracranial internal carotid artery, the first segment of the middle cerebral artery, or both; met the imaging eligibility requirements; were receiving or had received intravenous t-PA; and were able to undergo initiation of endovascular treatment within 6 hours after the time that they were last known to be well before the onset of acute stroke symptoms. Qualifying imaging had to be performed at a study hospital; imaging was repeated for patients who were transferred from outside hospitals.
Exclusion criteria:
N total at baseline: Intervention: 98 Control: 98
Important prognostic factors2: age ± SD: I: 65.0±12.5 C: 66.3±11.3
Sex: I: 55% M C: 47% M
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
endovascular thrombectomy with the use of a stent retriever within 6 hours after symptom onset (intervention group).
In the intervention group, neurovascular thrombectomy was performed with the use of the Solitaire FR (Flow Restoration) or Solitaire 2 device. Concomitant stenting of the cervical internal carotid artery was not permitted, although angioplasty could be performed to permit intracranial access.
|
Describe control (treatment/procedure/test):
intravenous t-PA to continue with t-PA alone (control group) |
Length of follow-up: 90 days
Loss-to-follow-up: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Ordinal score on the modified Rankin scale (range, 0 [no symptoms] to 6 [death]) at day 90 (median): I: 2 C: 3
Functional independence (defined as a score on the modified Rankin scale of 0 to 2) at day 90. I: 59/98 (60%) C: 33/93 (35%)
Death within 90 days: I: 9/98 = 9% C: 12/97 = 12%
Occurrence of symptomatic intracranial hemorrhage within 27 hours, defined as an increase of at least 4 points in the NIHSS score that was associated with brain haemorrhage on imaging within 36 hours after symptom onset: I: 0% C: 3%
|
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Risk of Bias table
Research question:
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Albers, 2018
DEFUSE III |
with the use of a Web-based dynamic randomization system (Table S1 in the Supplementary Appendix). Randomization was stratified according to age, core infarct volume, time from symptom onset to enrollment, baseline score on the National Institutes of Health Stroke Scale (NIHSS; range, 0 to 42, with higher scores indicating a greater deficit), and trial site |
unlikely |
unclear, blinding was not possible |
unclear, blinding was not possible |
unlikely |
unlikely |
unlikely |
unlikely |
|
Berkhemer, 2015
MR CLEAN |
The randomization procedure was Web-based, with the use of permuted blocks. We stratified randomization according to medical center, use of intravenous alteplase (yes or no), planned treatment method (mechanical or other), and stroke severity (NIHSS score of ≤14 or >14). |
Unlikely |
unclear, blinding was not possible |
unclear, blinding was not possible |
unlikely |
unlikely |
unlikely |
unlikely |
|
Bracard, 2016
THRACE |
Randomisation was done at the coordination centre by a computer analyst who was masked to the investigation centres and to the patients. Randomisation was done with a computer-generated sequence and was stratified by centre, and sequential minimisation with a factor of 85% was used to avoid imbalance in treatment. Participants were enrolled by local investigators and assigned to the trial group according to the random number. |
unlikely |
unclear, blinding was not possible |
unclear, blinding was not possible |
unclear |
unlikely |
unlikely |
unlikely |
|
Broderick, 2013
IMS III |
Participants were randomly assigned in a 2:1 ratio to endovascular therapy or intravenous t-PA alone with the use of an Internet-based, computerized algorithm of minimization and the biased-coin method, which accounted for two factors: clinical center and baseline NIHSS strata (scores of 8 to 19 vs. ≥20) |
unlikely |
unclear, blinding was not possible |
unclear, blinding was not possible |
unlikely |
unlikely |
unlikely |
unlikely |
|
Campbell, 2015
Extend IA |
Patients were randomly assigned in a 1:1 ratio to receive either alteplase plus endovascular therapy (endovasculartherapy group) or no further therapy (alteplase-only group) by means of a centralized website and stratified according to the site of arterial occlusion: the internal carotid artery or the first or second segment of the middle cerebral artery. |
unlikely |
unclear, blinding was not possible |
unclear, blinding was not possible |
unlikely |
unlikely |
unlikely |
unlikely |
|
Ciccone, 2013
Synthesis |
The study protocol provided for centralized, simple randomization online. A single randomization list was prepared with the use of a hardware system, available at www.random.org. All patients underwent randomization within 4.5 hours after symptom onset. |
Unlikely |
unclear, blinding was not possible |
unclear, blinding was not possible |
unlikely |
unlikely |
unlikely |
unlikely |
|
Del Zoppo, 1998
ProActI |
Allocated by central randomisation center, no further details provided |
unclear |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
Unlikely |
|
Furlan, 1999
ProAct II |
A blinded randomization code was assigned via telephone independent of the sponsor by Paragon Biomedical Inc, Irvine, Calif. A computer-generated master randomization schedule using block size ranging from 3 to 12 was used. The schedule was not stratified by clinical centre to preclude knowledge of the distribution of future treatment assignments at a given center. |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Goyal, 2015
ESCAPE |
Randomization was performed with the use of a real-time, dynamic, Internet-based, randomized minimization procedure (minimal sufficient balance method) to achieve distribution balance with regard to age, sex, baseline National Institutes of Health Stroke Scale (NIHSS) score, site of arterial occlusion, baseline Alberta Stroke Program Early Computed Tomography Score, and status with respect to intravenous alteplase treatment. |
unlikely |
unclear, blinding was not possible |
unclear, blinding was not possible |
unlikely |
unlikely |
unlikely |
unlikely |
|
Jovin, 2015
Revascat |
A real-time computerized randomization procedure that was tratified according to age, baseline NHISS score, therapeutic window, occlusion site, and participating center. |
unlikely |
unclear, blinding was not possible |
unclear, blinding was not possible |
unlikely |
unlikely |
unlikely |
unlikely |
|
Kidwel, 2013
MR RESCUE |
Baseline multimodal imaging was automatically processed on a dedicated site computer, generating a 4-digit code that assigned patients to treatment on the basis of separate permuted-block sequences for favorable penumbral and nonpenumbral patterns. |
unlikely |
unclear, blinding was not possible |
unclear, blinding was not possible |
unlikely |
unlikely |
unlikely |
unlikely |
|
Mocco, 2016
Therapy |
Randomization was performed through a centralized interactive voice response system, stratified according to enrolling center |
unlikely |
unclear, blinding was not possible |
unclear, blinding was not possible |
unlikely |
unlikely |
unlikely |
unlikely |
|
Muir, 2017
Piste |
Allocation used a minimisation algorithm, including age group, stroke severity on the National Institutes of Health Stroke Scale (NIHSS) and symptom onset-to-treatment time. Randomisation was conducted using an interactive voice-response system managed by the Robertson Centre for Biostatistics, University of Glasgow. |
unlikely |
unclear, blinding was not possible |
unclear, blinding was not possible |
unlikely |
unlikely |
unlikely |
Unlikely |
|
Nogueira, 2018
DAWN |
a central, Web-based procedure, with block minimization processes to balance the two treatment groups, and was stratified according to mismatch criteria (Group A, Group B, or Group C), the interval between the time that the patient was last known to be well and randomization (6 to 12 hours or >12 to 24 hours), and the occlusion site (intracranial internal carotid artery or the first segment of the middle cerebral artery). |
Unlikely |
unclear, blinding was not possible |
unclear, blinding was not possible |
unlikely |
unlikely |
unlikely |
unlikely |
|
Ogawa, 2007
MELT |
Included patients were allocated to the Central Randomization Center through the Internet and randomized to receive either intraarterial UK infusion (UK group) or conventional treatment (control group). |
unlikely |
unclear, blinding was not possible |
unclear, blinding was not possible |
unlikely |
unlikely |
unlikely |
unlikely |
|
Saver, 2015
Swift Prime |
Patients were randomly assigned in a 1:1 ratio to one of two treatment groups: intravenous t-PA plus stent retriever (intervention group) or intravenous t-PA alone (control group). Using a minimization algorithm, we balanced the numbers of patients in the two treatment groups with respect to four factors: investigational site, baseline severity according to the National Institutes of Health Stroke Scale (NIHSS) score (≤17 vs. >17, on a scale of 0 to 42, with higher scores indicating greater severity), age (<70 years vs. ≥70 years), and occlusion location (middle cerebral artery vs. internal carotid artery). |
unlikely |
unclear, blinding was not possible |
unclear, blinding was not possible |
unlikely |
unlikely |
unlikely |
unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-05-2019
Laatst geautoriseerd : 10-05-2019
Geplande herbeoordeling : 01-01-2020
De ontwikkelingen op het gebied van de acute opvang, secundaire preventie en revalidatie volgen elkaar in steeds sneller tempo op. Daarom werd in 2018 een kerngroep van neurologen, revalidatiearts en huisarts geïnstalleerd om snel op nieuwe ontwikkelingen te kunnen inspelen. In 2018 werden de modules over plaatjesaggregatieremmers en Directe Orale Anticoagulantia geupdate en nieuwe modules over tenecteplase en endovasculaire behandeling ontwikkeld. In 2019 wordt opnieuw geprioriteerd welke wijzigingen nodig zijn.
Deze kerngroep vergadert tenminste tweemaal per jaar om op basis van eigen inzichten en/of signalen uit het veld te beoordelen of hernieuwde aanvulling en/of revisie van (onderdelen van) de richtlijn gewenst is. Andere disciplines namen zitting in een klankbordgroep en worden betrokken afhankelijk van het onderwerp van de te reviseren module.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (Kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van deze op wetenschappelijk bewijs gebaseerde (evidence based) richtlijn is het bieden van een basis voor optimale zorg voor patiënten met een herseninfarct of hersenbloeding. Daarnaast draagt de richtlijn bij aan afstemming van de zorg tussen de verschillende zorgverleners en aan het terugdringen van ongewenste praktijkvariatie.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met een herseninfarct of hersenbloeding.
Samenstelling werkgroep
Kerngroep
- prof. dr. D.W.J. (Diederik) Dippel (voorzitter), neuroloog, Erasmus MC Rotterdam, namens de Nederlandse Vereniging voor Neurologie (NVN)
- dr. R.M. (Renske) van den Berg-Vos, neuroloog, OLVG West Amsterdam, namens de NVN
- dr. J. (Jeannette) Hofmeijer, neuroloog, Rijnstate ziekenhuis Arnhem, namens de NVN
- dr. J.M.A. Visser-Meilij, revalidatiearts, UMC Utrecht, namens de VRA
- A.F.E. (Arianne) Verburg, huisarts, namens het Nederlands Huisartsen Genootschap (NHG)
- dr. H.B. (Bart) van der Worp, neuroloog, UMC Utrecht, namens de NVN
- dr. S.M. (Yvonne) Zuurbier, neuroloog in opleiding, AMC Amsterdam, namens de NVN
- dr. W. (Wim) van Zwam, radioloog, Maastricht UMC, namens de Nederlandse Vereniging voor Radiologie (NVvR)
Met ondersteuning van:
- Dr. M.L. Molag, adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van den Berg-Vos |
Neuroloog |
geen |
"Voorzitter werkgroep CVA van het Transmuraal Platform Amsterdam (betaald dmv vacatiegelden) Lid focusgroep CVA ROAZ Noord-Holland (onbetaald) Vertrouwenspersoon voor A(N)IOS in OLVG (onbetaald) Bestuurslid Kennisnetwerk CVA Nederland (onbetaald) Lid SEH gebruikersoverleg in OLVG, locatie West (onbetaald) Lid Antistollings Commissie in het in het Zaans Medisch Centrum te Zaandam (onbetaald)" |
geen |
|
Dippel |
Neuroloog |
geen |
"Hoofdonderzoeker MR CLEAN trial ISRCTN10888758 en NTR1804 Hoofdonderzoeker MR CLEAN registry (www.mrclean-trial.org) Hoofdonderzoeker MR CLEAN MED trial ISRCTN Research leider CONTRAST consortium (www.contrast-consortium.nl) The MR CLEAN trial was deels gefinancierd door de Hartstichting, en middels financiele bijdragen zonder voorwaarden behoudens milestones, van AngioCare BV, Medtronic/Covidien/EV3®, MEDAC Gmbh/LAMEPRO, Penumbra Ine., Stryker®, and Top Medical/Concentric. Alle bijdragen werden betaald aan Erasmus MC. Het CONTRAST consortium wordt ondersteund door het Netherlands Cardiovascular Research lnitiative (CVON), een initiatief van de Hartstichting, en door de Nederlandse Hersenstichting. Erasmus MC ontving voor het CONTRAST consortium additionele financiele ondersteuning van Medtronic, en voor het uitvoeren van MR CLEAN NO-IV financiele ondersteuning van Stryker European Operations BIJVOORBEELD Alle bijdragen werden betaald aan Erasmus MC, zonder voorwaarden behoudens milestones. " |
geen |
|
Hofmeijer |
Neuroloog |
Hoofddocent universiteit twente |
geen |
geen |
|
Verburg |
Huisarts en wetenschappelijk medewerker NHG |
Wetenschappelijk medewerker NHG |
geen |
geen |
|
Visser-Meilij |
Revalidatiearts, hoogleraar en afdelingshoofd |
geen |
geen |
geen |
|
Van der Worp |
neuroloog |
|
Adviezen aan/consultancy voor Boehringer Ingelheim, producent van onder anderen alteplase en dabigatron. |
Uitsluiting besluitvorming alteplase en dabigatran |
|
Zuurbier |
AIOS neurologie |
geen |
Wetenschappelijk onderzoek gericht op centraal veneuze trombose (onbetaald) |
Geen |
|
Van Zwam |
Neuro-interventieradioloog |
geen |
Consultancy activiteiten voor stryker en Cerenovus, lid CONTRAST, MRCLEAN :ATE |
Geen invloed op richtlijnonderwerpen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door gebruik te maken van kwaliteitscriteria vanuit patiëntenperspectief voor CVA, ontwikkeld door Harteraad. Verder informeren Harteraad, Hartstichting en Hersenletsel door middel van notulen vergaderingen kerngroep en worden ze betrokken bij relevante onderwerpen.
De conceptmodules zijn tevens voor commentaar aan bovengenoemde verenigingen voorgelegd.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit (www.demedischspecialist.nl/richtlijnen). Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreetrust.org) dat een internationaal breed geaccepteerd instrument is en op Richtlijnen voor richtlijnen voor de beoordeling van de kwaliteit van richtlijnen (www.zorginstituutnederland.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Achmea en VGZ namens Zorgverzekeraars Nederland, het College voor Zorgverzekeringen (tegenwoordig Zorginstituut Nederland), de Inspectie voor de Gezondheidszorg, CVA Patiëntenvereniging Hersenletsel.nl, de Hart&Vaatgroep en de Hartstichting, via een invitational conference.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken, waarna de definitieve uitgangsvragen werden vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk en onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt inhoudt.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen, via de websites van enkele grote organisaties, zoals de American Heart Association en de European Stroke Organization. Tevens werd in de tijdschriften Stroke en Int J Stroke gezocht naar richtlijnen. Vervolgens werd op de website van de Cochrane Library gezocht naar systematische reviews. Tot slot werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases (NLM Pubmed, Google Scholar, Embase, Cochrane Library). De zoektermen werden geformuleerd aan de hand van een searchvraag. De searchvraag werd vertaald in een PICO (patient, intervention, control, outcome). Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepsleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in het hoofdstuk van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van vertrouwen in de literatuurconclusie (zie http://www.guidelinedevelopment.org/handbook/).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden.
Formuleren van de conclusies
Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusies, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt deze getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen door de werkgroep en beschreven in de literatuursamenvatting.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld binnen de clinical audit van de NVN om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de paragraaf Kennislacunes behorend bij elke module.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
