Endovasculaire trombectomie basilaris
Uitgangsvraag
Wat is de plaats van endovasculaire trombectomie (EVT) na een acuut herseninfarct op basis van een occlusie van de arteria basilaris?
Aanbeveling
Behandel patiënten met een basilaristrombose bij wie behandeling binnen 12 uur na begin van de verschijnselen kan worden gestart met EVT bij ernstige neurologische uitval (NIHSS ≥ 10).
Overweeg EVT bij patiënten met een basilaristrombose bij wie behandeling binnen 12 uur na begin van de verschijnselen kan worden gestart bij NIHSS < 10
Overweeg EVT bij patiënten met een basilaristrombose bij wie behandeling tussen 12 en 24 uur na begin van de verschijnselen kan worden gestart, met name bij ernstige neurologische uitval (NIHSS ≥ 10).
Pas geen EVT toe bij uitgebreide vroege ischemische afwijkingen (PC ASPECT score< 6) op een blanco CT cerebrum in het stroomgebied van de arteria basilaris.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Endovasculaire trombectomie (EVT) binnen 24 uur na ontstaan van de verschijnselen lijkt een gunstig en klinisch relevant effect te hebben op functionele uitkomst en mortaliteit in vergelijking met standaard behandeling bij patiënten met een herseninfarct op basis van een basilaris occlusie. Het risico op een symptomatische intracraniële bloeding lijkt echter groter met endovasculaire behandeling dan met standaard behandeling. De bewijskracht voor de gevonden effecten is matig tot laag vanwege risico op bias, die veroorzaakt wordt door een hoge incidentie van cross-over en brede betrouwbaarheidsintervallen.
Verreweg de meeste patiënten in de geïncludeerde trials hadden ernstige neurologische uitval bij inclusie (NIHSS ≥ 10). In de BASICS trial was er statistisch significatie interactie tussen de ernst van de uitval en het effect van de behandeling, met een groter effect bij ernstige uitval. De mate van bewijs voor effect van EVT is dus het grootst voor patiënten met ernstige uitval. Bovendien is er bij ernstige uitval meer baat van de behandeling te verwachten.
De meeste patiënten werden geïncludeerd binnen twaalf uur na het geschatte moment van ontstaan van de basilarisocclusie, dus de mate van bewijs is hoger bij behandeling binnen twaalf uur dan bij latere behandeling. Het geschatte moment van basilarisocclusie kan worden voorafgegaan door vertigo of milde uitvalsverschijnselen. In dat geval wordt gerekend vanaf het geschatte moment van basilarisocclusie. Patiënten met uitgebreide vroege tekenen van ischemie op een blanco CT cerebrum werden geëxcludeerd in de BASICS trial en de BAOCHE en ATTENTION trials excludeerden patienten met een PC-ASPECT score <6 en <8, respectievelijk. De mate van bewijs voor EVT bij uitgebreide vroege tekenen van ischemie is laag.
De twee positieve trials (ATTENTION en BOACHE) werden beide in China uitgevoerd. In deze trials was het percentage patiënten dat behandeld werd met EVT veel lager dan in de Nederlandse praktijk. Extrapolatie van de resultaten van deze trials naar de Nederlandse praktijk vergt dus zorgvuldige afweging. De enige Nederlandse trial (BASICS) liet op het niveau van de gehele groep geen statistisch significant behandeleffect zien. Er was wel een statistisch significant voordeel voor patiënten met ernstige neurologische uitval bij inclusie (NIHSS ≥ 10).
Hoewel de etiologie van het herseninfarct in de posterieure circulatie en de anatomie van de vaten anders zijn dan in de voorste circulatie, kunnen de duidelijke effecten van endovasculaire behandeling bij een herseninfarct op basis van een proximale intracraniële arteriële occlusie in de voorste circulatie niet worden genegeerd. Dit geldt temeer, omdat de voorste circulatie studies groter waren, met minder risico op bias.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Vermindering van de kans op blijvende neurologische uitval is het belangrijkste doel van EVT voor de patiënt. Gezien het ongunstige natuurlijk beloop van een basilaris occlusie, met een grote kans op blijvende ernstige neurologische uitval (de controle groep in de RCTs), is een behandeling met een relatief kleine kans van slagen en enig risico op complicaties waarschijnlijk toch gerechtvaardigd. In gesprek met de patiënt of diens partner/familie moeten de voordelen en mogelijke risico’s van de behandeling worden afgewogen tegen afwachtend beleid. Dat geldt vooral bij patiënten met minder ernstige neurologische uitval (NIHSS ≤ 10), omdat de kans op voordeel voor deze patiënten kleiner is met nog wel een aanwezig risico op complicaties van de EVT. Daarbij moet meegenomen worden dat overlijden (mRS 6) vaak als minder desastreus ervaren wordt dan een mRS 5 als lange termijn uitkomst.
Kosten (middelenbeslag)
In het algemeen hebben kosteneffectiviteitsanalyses van behandelingen voor patiënten met een acuut herseninfarct aangetoond dat een kleine verbetering in functioneel herstel al leidt tot een belangrijke reductie van zorg gerelateerde kosten: bij een gering effect is de behandeling al kosteneffectief (van den Berg, 2022).
Aanvaardbaarheid, haalbaarheid en implementatie
Sinds de implementatie van EVT voor proximale occlusies in de voorste hersencirculatie zijn de Nederlandse EVT centra en acute CVA netwerken in principe goed toegerust voor de behandeling. Patienten met een basilaris occlusie zijn echter vaker comateus, waardoor vaker intubatie en sedatie nodig zullen zijn. Ook zal vaker IC opname nodig zijn. Met name centra die EVT zonder sedatie toepassen zullen afspraken moeten maken met de afdelingen anesthesie en intensive care.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Er is laag tot matig bewijs dat patiënten met een herseninfarct op basis van een basilaris occlusie voordeel hebben van EVT, toegepast binnen 24 uur na ontstaan van de verschijnselen. Het voordeel van EVT geldt vooral voor patiënten met ernstige neurologische uitval (NIHSS ≥10).
Onderbouwing
Achtergrond
Een acute endovasculaire behandeling bij patiënten met een herseninfarct op basis van een proximale intracraniële arteriële occlusie van de voorste circulatie is veilig en effectief. Er is onduidelijkheid over de veiligheid en effectiviteit van endovasculaire behandeling bij patiënten met een herseninfarct op basis van een intracraniële occlusie van de arteria basilaris.
Conclusies / Summary of Findings
1. Functional outcome (critical)
|
Low GRADE |
Endovascular treatment may result in more patients with a good clinical outcome (mRS 0-2) than standard medical treatment in patients with an acute ischemic stroke based on basilar artery occlusion, in particular in patients with a severe neurological deficit.
Sources: Liu, 2020; Langezaal, 2021; Jovin, 2022; Tao, 2022 |
2. Mortality (critical)
|
Moderate GRADE |
Endovascular treatment likely reduces mortality compared to standard medical treatment in patients with acute ischemic stroke based on basilar artery occlusion.
Sources: Liu, 2020; Langezaal, 2021; Jovin, 2022; Tao, 2022 |
3. Intracranial haemorrhage (important)
|
Moderate GRADE |
Endovascular treatment likely increases the rate of intracranial haemorrhages when compared with standard medical treatment in patients with an acute ischemic stroke based on basilar artery occlusion.
Sources: Liu, 2020; Langezaal, 2021; Jovin, 2022; Tao, 2022 |
Samenvatting literatuur
Description of studies
Jovin (2022) describes an open-label, randomized controlled trial (BAOCHE), including 217 patients that had an occlusion of the basilar artery or intracranial segments of both vertebral arteries that could be treated within 6 to 24 hours after symptom onset. Patients were randomly assigned to undergo medical thrombectomy plus standard medical care (n=110, mean age 64.2 ± 9.6, 73% men) or to receive standard medical care alone (n=107, mean age 63.7± 9.8, 74% men). Four patients in the control group crossed over to receive endovascular treatment, and 1 in the thrombectomy group crossed over to receive medical care only. One patient in the control group withdrew consent and was excluded from the analysis. Missing primary-outcome data were imputed for 3 patients. This trial was terminated early after a planned interim analysis that included the first 212 enrolled patients who had completed 90 days of follow-up, as a between-group difference in the primary outcome at 90 days (modified Rankin scale score of 0 to 3) was observed with a P-value of less than 0.001. This crossed the prespecified stopping boundary for trial termination (P<0.012) and therefore enrollment was stopped. Outcomes assessed for this study were: patients’ functional outcome (by the mRS scale), mortality and intracranial haemorrhage incidence (symptomatic). All outcome measures were assessed after 90 days of follow-up.
Langezaal (2021) describes a randomised controlled trial (BASICS), including 300 patients with stroke caused by basilar artery occlusion within six hours after the estimated time of onset of stroke. Patients were randomly allocated to receive endovascular treatment (n=154; mean age 66.8y ± 13.1; 64.9% men) or standard medical care (n=146; mean age 67.2 ± 11.9; 65.8% men). After randomisation, three of the 154 patients in the endovascular treatment group and seven of the 146 patients in the standard medical care group did not receive the allocated intervention. Intravenous thrombolysis was administered in 79% of the patients in the endovascular treatment group and in 80% of the patients in the medical care group. The effects were evaluated on patients’ functional outcome (by the mRS scale), mortality and intracranial haemorrhage incidence (symptomatic). All outcome measures were assessed after 90 days of follow-up. 29.2% of the eligible patients were treated outside the trial, from which 79% received endovascular therapy. Furthermore, 5% of the medical treatment group crossed over to the endovascular group, which were factors that have introduced bias in the enrolled population.
Liu (2020) describes an open-label, randomised controlled trial (BEST), including 113 patients with an acute ischemic stroke consistent with acute occlusion of the basilar artery. Patients were randomly allocated to receive endovascular treatment in combination with standard medical therapy, following the American Heart Association/American Stroke Association guidelines (n=66; median age 62y [50 to 74 yrs]; 73% men) or standard medical therapy alone (n=65; median age 68y [57 to 74 yrs]; 80% men). After randomisation, three patients in the endovascular treatment group and 14 patients in the standard medical therapy group did not receive allocated intervention because of not suitable for treatment, family did not accept treatment or death. All patients received their allocated intervention within 4.5 hours after stroke onset (defined as the time the patient was last seen well). The effects were evaluated on patients’ functional outcome (by the mRS scale), mortality and intracranial haemorrhage incidence (symptomatic). All outcome measures were assessed after 90 days of follow-up. The study was terminated early because of the high crossover rates and progressive drop in the valid per-center recruitment, leading to only 38% of the planned power.
Tao (2022) describes a randomized controlled trial (ATTENTION), including 340 patients with basilar artery occlusion within 12 hours after the estimated time of basilar artery occlusion. Patients were assigned in a 2:1 ratio to receive endovascular thrombectomy (n=226, mean age 66.0 ± 11.1, 66% male ) or best medical care (n=114, mean age 67.3 ± 10.2). Intravenous thrombolysis was used in 31% of the patients in the thrombectomy group and in 34% of those in the control group. Outcomes assessed were functional status (by the MRS scale) at 90 days, quality of life, symptomatic intracranial haemorrhage at 24 to 72 hours, 90-day mortality, and procedural complications.
Individual study characteristics are shown in Table 1.
|
Table 1: Characteristics of included studies |
||||||
|
Author |
Patients |
Intervention |
Comparison |
Follow-up |
||
|
Type |
Characteristics |
Type |
Characteristics |
|||
|
Jovin, 2022 |
Patients aged 18-80 years with basilar-artery stroke that could be treated within 6-24 hours after symptom onset with a pre-stroke mRS score ≤1 and NIHSS score ≥10. |
Thrombectomy performed with the Solitaire device plus standard medical care |
n = 110 Mean age (SD): 64.2 (9.6) years Male (%): 73% Median NIHSS score (IQR): 20 (15-29)
Medical history Atrial fibrillation: 13% Diabetes mellitus: 27% Hypertension: 82%
Median (IQR) time from stroke onset to randomization: 664 (512-861) minutes |
Standard medical care alone |
n = 107 Mean age (SD): 63.7 (9.8) years Male (%): 74% Median NIHSS score (IQR): 19 (12-30)
Medical history Atrial fibrillation: 12% Diabetes mellitus: 27% Hypertension: 75%
Median (IQR) time from stroke onset to randomization: 662 (492-838) minutes |
12 months |
|
Langezaal, 2021 |
Patients with basilar-artery stroke that could be treated within 6 hours and NIHSS score ≥0. |
Endovascular thrombectomy |
n = 154 Mean age (SD): 66.8 (13.1) years Male (%): 64.9%
Medical history Posterior circulation stroke: 7.1% Hypertension: 60.4% Diabetes mellitus: 22.2% Atrial fibrillation: 28.6%
Median (IQR) time from stroke onset to randomization: NR |
Medical care consisting of conventional care according to local protocols and national guidelines |
n = 146 Mean age (SD): 67.2 (11.9) years Male (%): 65.8%
Medical history Posterior circulation stroke: 4.8% Hypertension: 56.6% Diabetes mellitus: 21.2% Atrial fibrillation: 15.1%
Median (IQR) time from stroke onset to randomization: NR |
90 days |
|
Liu, 2020 |
Patients aged ≥18 years with an acute ischemic stroke due to occlusion of the basilar artery who could be randomized within 8 hours and had a pre-stroke mRS score ≤2. |
Endovascular thrombectomy with stent retriever or thrombo-aspiration devices plus standard medical therapy |
n = 66 Median age (IQR): 62 (50-74) years Male (%): 73% Median (IQR) NIHSS score: 32 (18-38)
Medical history Coronary heart disease: 15% Atrial fibrillation: 27% Hypertension: 68% Hyperlipidemia: 5% Diabetes: 15% Ischemic stroke or TIA: 21%
Median (IQR) time from stroke onset to randomization: 246 (139-360) minutes |
Standard medical therapy alone |
n = 65 Median age (IQR): 68 (57-74) years Male (%): 80% Median (IQR) NIHSS score: 26 (13-37)
Medical history Coronary heart disease: 12% Atrial fibrillation: 15% Hypertension: 65% Hyperlipidemia: 8% Diabetes: 17% Ischemic stroke or TIA: 31%
Median (IQR) time from stroke onset to randomization: 278 (191-387) minutes |
90 days |
|
Tao, 2022 |
Patients aged ≥18 years with moderate-to-severe acute ischemic stroke (NIHSS ≥10) consistent with basilar-artery occlusion. |
Endovascular thrombectomy plus best medical care |
n = 226 Mean age (SD): 66.0 (11.1) years Male (%): 66% Median (IQR) NIHSS score: 24 (15-35)
Medical history: NR
Median (IQR) time from stroke onset to randomization: 5.1 (3.6-7.2) hours |
Best medical care alone |
n = 114 Mean age (SD): 67.3 (10.2) years Male (%): 72% Median (IQR) NIHSS score: 24 (14-35)
Medical history: NR
Median (IQR) time from stroke onset to randomization: 4.9 (3.5-7.0 hours) |
90 days |
Abbreviations: IQR = interquartile range; mRS = modified rankin scale; NIHSS = national institutes of health stroke scale; NR = not reported; SD = standard deviation; TIA = transient ischemic attack.
Results
1. Functional outcome
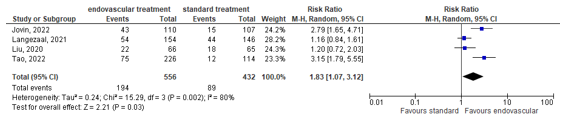
Liu (2020), Langezaal (2021), Jovin (2022) and Tao (2022) assessed functional outcome by the mRS (range 0-6; lower score means better outcome) at 90 days (n=988). All studies reported on the number of patients who scored mRS 0-2, indicating good clinical outcome. The proportion of patients with a good clinical outcome was 34.9% for endovascular treatment versus 20.6% for standard treatment. This resulted in a risk ratio (RR) of 1.83 (95% CI 1.07 to 3.12), indicating a clinically relevant difference in favor of endovascular treatment (Figure 1) that overlapped with the border of clinical relevance.
Figure 1: Forest plot showing proportions of patients with good functional outcome at 90 days for endovascular treatment versus standard medical therapy.
2. Mortality
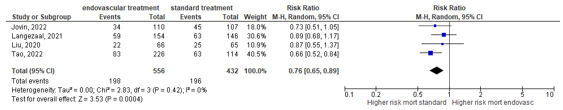
Liu (2020), Langezaal (2021), Jovin (2022) and Tao (2022) assessed mortality at day 90. Patients in the endovascular treatment group had a lower mortality at 90 days (35.6%) than patients in the standard treatment group (45.4%). This resulted in a risk ratio (RR) of 0.77 (95% CI 0.65 to 0.89), indicating a clinically relevant difference in favor of endovascular treatment (Figure 2).
Figure 2: Forest plot showing mortality at 90 days for endovascular treatment versus standard medical therapy.
3. Intracranial haemorrhage
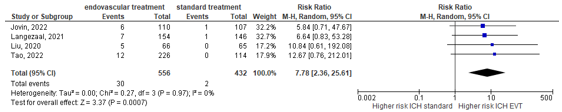
Liu (2020), Langezaal (2021), Jovin (2022) and Tao (2022) assessed intracranial haemorrhage as the number of patients with symptomatic haemorrhage (according to SITS-MOST criteria). Patients in the endovascular treatment group had a higher rate of symptomatic intracranial hemorrhage (5.4%) than patients with standard treatment (0.5%). This resulted in a risk ratio (RR) of 7.78 (95% CI 2.36 to 25.61), indicating a clinically relevant difference in favor of standard treatment (Figure 3).
Figure 3: Forest plot showing proportions of patients with symptomatic intracranial hemorrhage for endovascular treatment versus standard medical therapy.
Level of evidence of the literature
The level of evidence for all outcome measures started at high because they were based on randomized controlled trials.
1. Functional outcome
The evidence was downgraded by two levels due to study limitations (crossover of around 5% and one study that terminated early) (risk of bias, -1) and crossing the borders of clinical relevance (imprecision, -1). The overall level is low.
2. Mortality
The evidence was downgraded with one level due to study limitations (crossover of around 5% and one study that terminated early) (risk of bias, -1). The overall level is moderate.
3. Intracranial hemorrhage
The evidence was downgraded with one level due to study limitations (crossover of around 5% and one study that terminated early) (risk of bias, -1). The overall level is moderate.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the effects of EVT in patients with an acute ischemic stroke due to an occlusion of the basilar artery on functional outcome, mortality and intracranial haemorrhage.
P: Patients with acute basilar artery occlusion;
I: Standard care with EVT with state-of-the-art techniques;
C: Standard care without EVT;
O: Functional outcome, mortality, intracranial haemorrhage.
Relevant outcome measures
The working group considered functional outcome and mortality as critical outcome measures for decision making, and intracranial haemorrhage as important outcome measure for decision making.
The working group defined the outcome measures as follows:
- Functional outcome: the percentage of patients with a good clinical outcome (0-2) or excellent clinical outcome (0-1) on the modified Rankin Scale (mRS; range 0-6; lower score means better outcome).
- Mortality: the percentage of patients who died within three months.
- Intracranial haemorrhage: the percentage of patients with symptomatic intracranial haemorrhage.
For each outcome measure, the working group defined a ‘minimal clinically important difference’:
- Functional outcome: a relative risk reduction or an increase of 10% of more (RR <0.9, RR >1.10) on a good/excellent clinical outcome (mRS 0-2);
- Mortality: a relative risk reduction or an increase of 10% of more (RR <0.9, RR >1.10);
- Intracranial haemorrhage: a relative risk reduction or an increase of 10% of more (RR <0.9, RR >1.10)
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2010 until the 27th of March 2023 for systematic reviews and RCTs on endovascular trombectomy in patients with an acute ischemic stroke due to an occlusion of the basilar artery. The detailed search strategy is depicted under the tab Methods. The searches yielded 535 hits, including 127 systematic reviews and 408 randomised controlled trials.
Studies were selected based on the following criteria:
- Systematic review of RCTs, or RCTs;
- Patients with an acute basilar artery occlusion treated within 24 hours after onset of symptoms of basilar occlusion;
- Patients received endovascular thrombectomy as an intervention;
- The control group received standard care without endovascular thrombectomy;
- At least one of the outcomes measures was reported.
Five systematic reviews were selected based on title and abstract screening. After reading the full text, four RCTs and one systematic review were included (Yu, 2023) that described these four RCTs.
Results
The systematic literature search resulted in 4 RCTs (Jovin, 2022; Liu, 2020; Langezaal, 2021; Tao, 2022) and one systematic review that described these 4 RCTs for the outcomes of interest (Yu, 2023). It included RCTs comparing EVT with standard care in patients with basilar artery occlusion; evaluating both efficacy outcomes and safety outcomes at 90 days; and that had sample size > 50 patients. Animal studies, retrospective studies, and cohort studies were excluded. Important study characteristics and results are summarised in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Jovin, T. G., Li, C., Wu, L., Wu, C., Chen, J., Jiang, C., Shi, Z., Gao, Z., Song, C., Chen, W., Peng, Y., Yao, C., Wei, M., Li, T., Wei, L., Xiao, G., Yang, H., Ren, M., Duan, J., Liu, X., BAOCHE Investigators (2022). Trial of Thrombectomy 6 to 24 Hours after Stroke Due to Basilar-Artery Occlusion. The New England journal of medicine, 387(15), 1373-1384. https://doi.org/10.1056/NEJMoa2207576
- Langezaal LCM, van der Hoeven EJRJ, MontAlverne FJA, Calvalho, JJF, Lima FO, Dippel DWJ, van der Lugt A, Lo RTH, Boiten J, Lycklama à Nijeholt GJL, Staals, J, van Zwam WH et al. the BASICS Study Group. Endovascular Therapy for Stroke Due to Basilar-Artery Occlusion. N Engl J Med. 2021 May; 384:1910-1920. DOI: 10.1056/NEJMoa2030297
- Liu, X., Dai, Q., Ye, R., Zi, W., Liu, Y., Wang, H., Zhu, W., Ma, M., Yin, Q., Li, M., Fan, X., Sun, W., Han, Y., Lv, Q., Liu, R., Yang, D., Shi, Z., Zheng, D., Deng, X., Wan, Y., BEST Trial Investigators (2020). Endovascular treatment versus standard medical treatment for vertebrobasilar artery occlusion (BEST): an open-label, randomised controlled trial. The Lancet. Neurology, 19(2), 115-122. https://doi.org/10.1016/S1474-4422(19)30395-3
- Tao C, Nogueira RG, Zhu Y, Sun J, Han H, Yuan G, Wen C, Zhou P, Chen W, Zeng G, Li Y, Ma Z, Yu C, Su J, Zhou Z, Chen Z, Liao G, Sun Y, Ren Y, Zhang H, Chen J, Yue X, Xiao G, Wang L, Liu R, Liu W, Liu Y, Wang L, Zhang C, Liu T, Song J, Li R, Xu P, Yin Y, Wang G, Baxter B, Qureshi AI, Liu X, Hu W; ATTENTION Investigators. Trial of Endovascular Treatment of Acute Basilar-Artery Occlusion. N Engl J Med. 2022 Oct 13;387(15):1361-1372. doi: 10.1056/NEJMoa2206317. PMID: 36239644.
- van den Berg LA, Berkhemer OA, Fransen PSS, Beumer D, Lingsma H, Majoie CBM, Dippel DWJ, van der Lugt A, van Oostenbrugge RJ, van Zwam WH, Roos YB, Dijkgraaf MGW; MR CLEAN Investigators†. Economic Evaluation of Endovascular Treatment for Acute Ischemic Stroke. Stroke. 2022 Mar;53(3):968-975. doi: 10.1161/STROKEAHA.121.034599. Epub 2021 Oct 14. PMID: 34645287.
- Yu, Y., Lou, Y., Cui, R., Miao, Z., Lou, X., & Ma, N. (2023). Endovascular treatment versus standard medical treatment for basilar artery occlusion: a meta-analysis of randomized controlled trials. Journal of neurosurgery, 1-9. Advance online publication. https://doi.org/10.3171/2022.12.JNS222490
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison/control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Jovin, 2022 (BAOCHE trial) |
Type of study: Setting and country: Funding and conflicts of interest: |
Inclusion criteria: Exclusion criteria: magnetic resonance imaging (MRI)8; and the presence on CT, CTA source images, or MRI of a large infarct in the brain stem, defined as a Pons-Midbrain Index of more than 2 points (range, 0 to 8, with higher values indicating more infarct burden; 1 point is attributed to infarction of <50% and 2 points to infarction of ≥50% on one side of the pons or midbrain). N total at baseline: Important prognostic factors2: age ± SD Sex: Groups comparable at baseline?
|
Patients received thrombectomy plus standard medical care (thrombectomy group) |
Patients received standard medical care alone (control group). |
Length of follow-up: Loss-to-follow-up: Intervention: 1 (0.9%) Reasons: withdrawal of consent Incomplete outcome data: Reasons: missing primary outcome data. |
Functional outcome Effect measure: Risk ratio (RR): 2.79 [1.65 – 1.71] in favor of endovascular therapy. Mortality Effect measure: RR [95% CI]: 1.36 [0.95 - 1.94] in favor of endovascular therapy. Intracranial haemorrhage Effect measure: RR [95% CI]: 0.19 [0.02 - 1.57] in favor of the control group. |
Author’s conclusion
|
|
Langezaal, 2021 (BASICS trial) |
Type of study: Setting and country: Funding and conflicts of interest: |
Inclusion criteria:
Exclusion criteria: N total at baseline: Important prognostic factors2: age ± SD Sex: Groups comparable at baseline?
|
The methods and devices used for endovascular thrombectomy were determined by the local interventional operator. Angioplasty or stenting of the vertebral artery in patients assigned to endovascular therapy was allowed if stenosis hampered access to the basilar artery, and stenting of the basilar artery was allowed if there was residual stenosis after thrombectomy. |
Medical care, which consisted of conventional care according to local protocols and national guidelines as determined by the site investigators, could include intravenous thrombolysis. |
Length of follow-up: Loss-to-follow-up: Intervention: 0 Incomplete outcome data: Reasons: crossover to other treatment. |
Functional outcome Effect measure: Risk ratio (RR): 1.15 [0.84 - 1.61] in favor of endovascular therapy. Mortality Effect measure: RR [95% CI]: 1.09 [0.90 - 1.31] in favor of endovascular therapy. Intracranial haemorrhage Effect measure: RR [95% CI]: 0.96 [0.93 - 1.00] in favor of the control group. |
Author’s conclusion: Risk of bias |
|
Liu, 2020 (BEST) |
Type of study: Setting and country: Funding and conflicts of interest: XinfL reports personal fees from Medtronic and speaker fees from Medtronic, Abbott, and Johnson & Johnson, outside the submitted work. RGN reports personal fees from and collaboration in trials with Stryker Neurovascular, Medtronic, Cerenovus/Neuravi, and Phenox; collaboration in trials from penumbra; and personal fees from Anaconda, Genentech, Biogen, Prolong Pharmaceuticals, Brainomix, Viz-AI, Corindus Vascular Robotics, Vesalio, and Ceretrieve, outside the submitted work. SD reports grants from the National Health and Medical Research Council of Australia and speaker fees from Abbott, Boehringer Ingelheim, and Medtronic, outside the submitted work; and was on the advisory board of Abbott, Boehringer Ingelheim, and Medtronic. All other authors declare no competing interests. This trial was funded by an unrestricted grant from the Jiangsu Provincial Special Program of Medical Science (BL2013025). |
Inclusion criteria: were also included in the trial. Other inclusion criteria were age 18 years or older, a prestroke score of 0–2 on the modified Rankin scale (mRS; range 0–6, with a score of 0 indicating no disability and higher scores indicating more severe disability), and no evidence of intracranial haemorrhage, significant cerebellar mass effect, acute hydrocephalus, or extensive bilateral brainstem ischaemia on CT or MRI Exclusion criteria: N total at baseline: Important prognostic factors2:
Sex: Stroke diagnosis: Groups comparable at baseline?
|
In the intervention group, endovascular preparation was initiated simultaneously with or soon after intravenous alteplase administration was started. The endovascular procedure consisted of mechanical thrombectomy with stent retriever (the preferred method) or thrombo-aspiration devices. Patients in both groups were admitted to stroke units or intensive care units and received standard medical therapy, which followed the American Heart Association/American Stroke Association guidelines. |
The control group received standard medical therapy which followed the American Heart Association/American Stroke Association guidelines |
Length of follow-up: Loss-to-follow-up: Intervention: 0 Incomplete outcome data: Control: 14 (21.5%) |
Functional outcome. Effect measure: Risk ratio (RR) [95% CI]: 1.20 [ 0.72 - 2.03] favoring endovascular therapy. Mortality Effect measure: RR [95% CI]: 1.08 [0.84 - 1.40] favoring endovascular therapy. Intracranial haemorrhage Effect measure: RR [95% CI]: 0.92 [0.86 to 1.00] in favor of the control group. |
Author’s conclusion: Risk of bias
|
|
Tao, 2022 (ATTENTION) |
Type of study: Setting and country: Funding and conflicts of interest: |
Inclusion criteria: Exclusion criteria: N total at baseline: Important prognostic factors2: age ± SD Sex: Groups comparable at baseline?
|
The strategies that were used for endovascular treatment included stent retrievers, thromboaspiration, balloon angioplasty, stent deployment, intraarterial thrombolysis (with alteplase or urokinase), or combinations of these approaches that were left to the discretion of the treating team. |
The standard care for acute basilar-artery occlusion in China is that patients arriving at a hospital within 4.5 hours after stroke onset receive intravenous thrombolysis. |
Length of follow-up: Loss-to-follow-up: Intervention: 2 (0.9%) Reasons: withdrawal of consent Incomplete outcome data: |
Functional outcome Effect measure: Risk ratio (RR): 1.64 [1.09 – 2.48] in favor of endovascular therapy. Mortality Effect measure: RR [95% CI]: 1.50 [1.19 - 1.91] in favor of endovascular therapy. Intracranial haemorrhage Effect measure: RR [95% CI]: 0.08 [0.04 – 0.44] in favor of the control group. |
Author’s conclusion
|
Risk-of-bias tabellen
|
Study reference (first author, publication year) |
Was the allocation sequence adequately generated? Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed? Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented? Were patients blinded? Were healthcare providers blinded? Were data collectors blinded? Were outcome assessors blinded? Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent? Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting? Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias? Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure LOW Some concerns HIGH
|
|
Jovin, 2022 (BAOCHE trial) |
Definitely yes; Reason: Patients were randomly assigned in a 1:1 ratio to undergo thrombectomy plus receive standard medical care (thrombectomy group) or to receive standard medical care alone (control group). Randomization was performed by means of a central, Web-based procedure, with the use of a minimization process to balance the two treatment groups and with stratification according to age (≤70 years or >70 years), the time from symptom onset to randomization (6 to 12 hours or >12 to 24 hours), and baseline NIHSS score (6 to 20 or >20). |
No information; Reason: No information was provided about allocation concealment. |
Probably no; Reason: Only information was provided about blinding of outcome evaluation (which was made sure). Considering that blinding to treatment type was quite difficult to achieve, there was definitely performance bias due to difficulty of blinding to treatment type for patients, healthcare providers and data analysts. |
Definitely yes; Reason: There were few losses to follow-up (1.4%). |
Definitely no; Reason: Protocol changes were made during the trial, most notably to the primary outcome, on the basis of data from other trials that were unavailable at the time of the protocol design. |
Probably no; Reason: Since the population that was enrolled is representative of the Han Chinese population, the generalizability of our trial results to other populations is limited. |
Moderate |
|
Langezaal, 2021 (BASICS trial) |
Definitely yes; Reason: Patients were randomly assigned in a 1:1 ratio to receive endovascular therapy or standard medical care. Randomization was conducted with the use of a central, Web-based procedure with permuted blocks (size 2) and was stratified according to center, use of intravenous thrombolysis, and NIHSS score (<20 or ≥20). |
No information; Reason: No information was provided about the concealment of allocation. |
Probably no; Reason: The assessment of endpoints was blinded. Considering that blinding to treatment type was quite difficult to achieve, there was definitely performance bias due to difficulty of blinding to treatment type for patients, healthcare providers and data analysts. |
Definitely yes; Reason: There were few losses to follow-up (<1%). |
Definitely yes; Reason: All the authors vouch for the accuracy and completeness of the presented data, for adherence of the trial to the protocol, and for the accurate reporting of adverse events. The trial was monitored by an independent data and safety monitoring board. |
Definitely no; Reason: The enrolled population derived from inside and outside the trial, crossing over of patients occurred in 5% in the medical treatment group, there was an inbalance of patients with atrial fibrillation in the two groups. |
Moderate |
|
Liu, 2020 (BEST trial) |
Definitely yes; Reason: The randomisation sequence was computer generated (SAS Statistical Package, version 9.3) and stratified by participating centres. |
Definitely yes; Reason: Allocation concealment was done by a statistician who did not directly participate in trial recruitment and enrolment. Allocation concealment was implemented by use of sealed envelopes., centralised, webbased randomisation system. |
Probably no; Reason: The assessment of endpoints was blinded. Considering that blinding to treatment type was quite difficult to achieve, there was definitely performance bias due to difficulty of blinding to treatment type for patients, healthcare providers and data analysts. |
Definitely yes; Reason: There was no lost to follow-up. |
Definitely yes; Reason: The safety endpoints were adjudicated by an independent clinical-events committee. The trial was terminated early due to reaching clinically predefined endpoints. |
Definitely no; Reason: A third of the qualifying patients declined trial participation and high crossover rates might have induced confounding of the results. |
Moderate |
|
Tao, 2022 (ATTENTION trial) |
Definitely yes; Reason: Patients were randomly assigned in a 2:1 ratio to undergo endovascular thrombectomy and receive best medical care (thrombectomy group) or to receive best medical care alone (control group). Randomization was performed as soon as possible after the occlusion of the basilar artery had been confirmed on imaging at trial hospitals and written informed consent for trial participation had been obtained. |
Definitely no; Reason: Owing to the nature of the intervention, treatment assignments were not concealed from patients or the treating team. |
Probably no; Reason: Only outcome assessors were blinded. Considering that blinding to treatment type was quite difficult to achieve, there was definitely performance bias due to difficulty of blinding to treatment type for patients, healthcare providers. |
Definitely yes; Reason: No patients were lost to follow-up or had data missing for main baseline covariates and primary outcome. |
Definitely yes; Reason: The authors vouch for the accuracy and completeness of the presented data, for the fidelity of the trial to the protocol, and for the accurate reporting of adverse events. |
Definitely no; Reason: Chinese patients have a high prevalence of intracranial large-artery atherosclerosis, and our results may not be generalizable to Western countries. |
Moderate |
Table of excluded studies
|
Author |
Reason for exclusion |
|
Chiang, 2021 |
Wrong population (no basilar artery occlusion) |
|
Shu, 2019 |
Wrong design (systematic review of observational studies) |
|
Barral, 2018 |
Wrong population (no basilar artery occlusion) |
|
Li, 2020 |
Wrong design (systematic review of observational studies) |
|
Abdalkader, 2023 |
Risk of bias assessment is not specified per domain |
|
Adusumilli, 2022 |
Description of excluded studies is missing at individual level, and study is less recent compared to Yu (2023) |
|
Katsanos, 2019 |
Not clear which studies included patients with posterior/basilar artery occlusion and which anterior artery occlusion |
|
Malik, 2022 |
Description including relevant characteristics of included studies are missing, and study is less recent compared to Yu (2023) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 28-05-2024
Beoordeeld op geldigheid : 12-09-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financierder heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een doorstart gemaakt met de multidisciplinaire werkgroep, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met een herseninfarct of hersenbloeding.
Werkgroep
- dr. B. (Bob) Roozenbeek (voorzitter), neuroloog, Erasmus MC Rotterdam, namens de Nederlandse Vereniging voor Neurologie (NVN)
- prof. dr. J. (Jeannette) Hofmeijer, neuroloog, Rijnstate ziekenhuis Arnhem, namens de NVN
- dr. M.H. (Heleen) den Hertog, neuroloog, Isala Zwolle, namens de NVN
- dr. S.M. (Yvonne) Zuurbier, neuroloog in het Universitair Ziekenhuis Antwerpen (UZA), namens de NVN
- dr. M. (Maarten) Uyttenboogaart, neuroloog, UMC Groningen, namens de NVN
- J.C. (Jeroen) de Jonge, neuroloog in het OLVG, Amsterdam, namens de NVN
- prof. dr. J.M.A. (Anne) Visser-Meily, revalidatiearts, UMC Utrecht, namens de VRA
- prof. dr. C.G.M. (Carel) Meskers, revalidatiearts, Amsterdam UMC, namens de VRA
- A.F.E. (Arianne) Verburg, huisarts, namens het Nederlands Huisartsen Genootschap (NHG)
- prof. dr. W. (Wim) van Zwam, radioloog, Maastricht UMC, namens de Nederlandse Vereniging voor Radiologie (NVvR)
- prof. dr. G. (Gert) Kwakkel, hoogleraar neurorevalidatie, Amsterdam UMC, namens het Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF)
Met ondersteuning van
- Dr. M.L. Molag, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. F. Ham, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. L.C. van Wijngaarden, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Roozenbeek |
Neuroloog, Erasmus MC, Rotterdam |
Geen |
Lid van CONTRAST, coördineert onderzoeksprojecten op gebied van acute beroertezorg gefinancierd door Stichting BeterKeten, Stichting THEIA, Erasmus Universiteit en Erasmus MC |
Geen |
|
Hofmeijer |
Neuroloog, Rijnstate, Arnhem (0,7 fte) Universitair hoofddocent, Universiteit Twente (0,4 fte) |
Geen |
Geen |
Geen |
|
den Hertog |
Neuroloog met aandachtsgebied neurovasculaire aandoeningen en acute neurologie, Isala Medisch hoofd innovatie en wetenschap, Isala Lid medical board speerpunt acute zorg, Isala |
Voorzitter Nederlandse neurovasculaire werkgroep Lid werkgroep digitale cardiovasculaire zorg DCVA, werkgroep onderzoekspijler DCVA, expertisegroep cluster CVRM, werkgroep elearning acute neurologie Deelname aan de SKMS-projectaanvraag Samen beslissen NVvR |
Projectleider ATTEST, betrokkenheid (geen projectleider) bij onderzoek gefinanceerd door Bayer, grant from Thrombolytic Science International en Portola Pharmaceuticals |
Geen |
|
Zuurbier |
Arts assistent in opleiding tot neuroloog, AMC, afdeling neurologie |
Geen |
Geen |
Geen |
|
Uyttenboogaart |
Neuroloog, Neuro-interventionalist, UMCG |
Geen |
Hartstichting TKI Health-Holland - Financiering 2 PhD studenten CONTRAST WORKPACKAGE 8 - WP leider. P.I. van (aanstaande) CASES trial. |
Geen |
|
de Jonge |
AIOS neurologie, UMC Utrecht PhD-student, afdeling neurologie en neurochirurgie, UMC Utrecht, Universiteit Utrecht |
Geen |
Betrokkenheid PRECIOUS |
Geen |
|
Visser-Meily |
Revalidatiearts, hoogleraar en afdelingshoofd van de afdeling Revalidatie, fysiotherapiewetenschap en sport in UMCU (0.8 fte) Hoofd van het Kenniscentrum Revalidatiegeneeskunde Utrecht (samenwerking tussen De Hoogstraat Revalidatie en UMC Utrecht) (0.2 fte) |
Geen |
Geen |
Geen |
|
Meskers |
Revalidatiearts, hoogleraar revalidatiegeneeskunde ihb neuromechanica |
Directeur research programma Ageing & Vitality Movement Sciences Management team Amsterdam Movement Sciences Editor tijdschrift Experimental Gerontology |
Projectleider AMS – Sarcopenia mobility. Betrokkenheid bij ArmCoach4Stroke, EMPOWER-GR en APROOF |
Geen |
|
Verburg |
Huisarts (0.4 fte) |
Senior wetenschappelijk medewerker NHG |
Geen |
Geen |
|
Van Zwam |
Neuro-interventieradioloog, Maastricht University Medical Center |
Geen |
Consultancy activiteiten voor Stryker en Cerenovus, lid CONTRAST, P.I. MRCLEAN LATE |
Geen |
|
Kwakkel |
Hoogleraaar Neurorevalidatie |
Europees Editor NeuroRehabilitation and Neural Repair
|
Handling editor Stroke (AHA) Coordinator Stroke Unit Cursus NPI Cursusleider mCIMT bij NPI Cursusleider Neurorebvalidatie-CVA bij NPI
|
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door gebruik te maken van kwaliteitscriteria vanuit patiëntenperspectief voor CVA, ontwikkeld door Harteraad. Verder informeren wij Harteraad, Hartstichting en Hersenletsel door middel van notulen van de vergaderingen met de kerngroep en worden ze betrokken bij relevante onderwerpen. De conceptmodules zijn tevens voor commentaar aan bovengenoemde verenigingen voorgelegd.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten na een herseninfarct of hersenbloeding. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptmodule werd aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve module werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Zoekverantwoording
Algemene informatie
|
Richtlijn: Herseninfarct en hersenbloeding |
|
|
Uitgangsvraag: Wat is de plaats van endovasculaire trombectomie (EVT) na een acuut herseninfarct in de posterieure circulatie (basilaris)? |
|
|
Database(s): Embase, Medline |
Datum: 27-03-2023 |
|
Periode: >2010 |
Talen: Engels, Nederlands |
|
Literatuurspecialist: Linda Niesink |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting en opmerkingen:
→ Voor deze vraag is gezocht op de elementen acute hersenbloeding/herseninfarct (in de posterieure circulatie) (in het blauw) en endovasculaire trombectomie (EVT) (in het groen).
→ De genoemde sleutelartikelen van Langezaal (2021), Liu (2020), Tao (2022) en Jovin (2022) worden gevonden met de zoekopdracht.
à Resultaten staan in Rayyan.
|
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase (via embase.com) en Medline (via OVID) is op 27-03-2023 met relevante zoektermen gezocht vanaf 2010 naar systematische reviews en RCT’s over endovasculaire trombectomie (EVT) bij patiënten met een acuut herseninfarct op basis van een occlusie in de posterieure circulatie. De literatuurzoekactie leverde 535 unieke treffers op. |
|
Zoekopbrengst
|
|
Embase |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
118 |
111 |
127 |
|
RCTs |
331 |
237 |
408 |
|
Totaal |
449 |
348 |
535 |
Zoekverantwoording
|
Database |
Zoektermen |
|||||||||||||||||||||||||||
|
Embase
|
|
|||||||||||||||||||||||||||
|
Medline (OVID)
|
1 ((basilar or vertebral or vertebrobasilar or posterior) adj4 (occlusion* or thrombosis)).ti,ab,kf. or 'brain stem infarct*'.ti,ab,kf. or 'brainstem infarct*'.ti,ab,kf. or 'posterior circulation'.ti,ab,kf. (8261) 2 exp Thrombectomy/ or (endovascular adj3 (therap* or treatment*)).ti,ab,kf. or thrombectom*.ti,ab,kf. or ('periprocedural medication*' or 'intravenous alteplase').ti,ab,kf. (40592) 3 1 and 2 (1521) 4 limit 3 to yr="2010 -Current" (1303) 5 (meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) (627698) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (2368830) 7 4 and 5 (111) - SRs 8 (4 and 6) not 7 (237) - RCTs 9 7 or 8 (348)
|