Chirurgische decompressie herseninfarct
Uitgangsvraag
Doet chirurgische decompressie bij ruimte-innemende, supratentoriële herseninfarcten de kans op een slecht functioneel herstel en overlijden afnemen?
Aanbeveling
Overweeg chirurgische decompressie bij patiënten met klinische en radiologische tekenen van een ruimte-innemend herseninfarct binnen 48 uur na ontstaan van het infarct. Bespreek bij patiënten van 60 jaar of jonger dat de kans op overleven met een milde tot matig ernstige handicap toeneemt, maar ook de kans op overleven met een ernstige handicap. Bespreek bij patiënten ouder dan 60 jaar de zeer grote kans op overleven met een ernstige handicap.
Wees terughoudend met chirurgische decompressie bij patiënten met klinische en radiologische tekenen van een ruimte-innemend herseninfarct na 48 uur na ontstaan van het infarct.
Maak voor wat betreft de indicatie voor chirurgische decompressie geen onderscheid tussen patiënten met en zonder afasie.
Overwegingen
Chirurgische decompressie wordt in het algemeen erkend als effectieve behandeling voor patiënten met een ruimte-innemend herseninfarct. Er is echter aanhoudende controverse over het nut van de behandeling door meningsverschil over de definitie van een goede uitkomst (Hofmeijer, 2014).
Effecten op QoL en depressie zijn onderzocht in twee trials (Vahedi, 2007; Hofmeijer, 2009; Geurts, 2013). Verreweg de meeste patiënten hebben een voldoende kwaliteit van leven en bij slechts een minderheid bestaan tekenen van depressie.
Massaal ruimte-innemend oedeem treedt bij slechts 1 tot 5% van de patiënten met een supratentorieel herseninfarct op (Hofmeijer, 2003a). Er zijn geen betrouwbare vroege voorspellers en het is onduidelijk welke patiënten moeten worden verwezen naar een neurochirurgisch centrum en wanneer verwijzing het best kan plaatsvinden (Hofmeijer, 2008). De meest betrouwbare geïdentificeerde voorspeller binnen 6 uur is infarctvolume van >82ml op DWI (Thomalla, 2010), maar MRI en DWI worden in Nederland in de acute fase van een herseninfarct nauwelijks toegepast.
Op basis van data uit HAMLET werd berekend dat kosten na chirurgische decompressie veel hoger zijn dan na conservatieve behandeling (gemiddelde toename van kosten €127.000 per gewonnen QALY in de eerste drie jaar) (Hofmeijer, 2013). Langdurige opnames in revalidatiecentra en verpleeghuizen zijn de belangrijkste kostendragers.
Als gekozen wordt voor chirurgische decompressie zijn snelle operatie en een ruime hemicraniëctomie en duraplastiek (>12cm) belangrijk.
Effect van andere behandelingen (osmotherapie, sedatie, corticosteroïden, koeling) is niet goed onderzocht en onzeker (Hofmeijer 2003a). De werkgroep kan over deze behandelingen geen aanbevelingen doen. Er bestaat indirect bewijs dat hyperventilatie schadelijk is (Hofmeijer 2003a) en de werkgroep ontraadt deze behandeling.
Onderbouwing
Achtergrond
Grote infarcten in het stroomgebied van de arteria cerebri media (ACM) gaan gepaard met oedeemvorming, die in ernstige gevallen kan leiden tot cerebrale inklemming. Patiënten met klinische verschijnselen van een groot ruimte-innemend herseninfarct hebben hierdoor een slechte prognose: in een prospectief onderzoek was de mortaliteit 78%, ondanks maximale conservatieve therapie (Hacke, 1996). Overlevenden zijn meestal ernstig gehandicapt. In de jaren ‘90 suggereerden enkele grote observationele onderzoeken dat chirurgische decompressie, bestaande uit een hemicraniëctomie en een duraplastiek, leidt tot een sterke afname van de kans op overlijden (Rieke, 1995; Schwab, 1998; Gupta, 2004). Of deze ingreep ook de kans op een goed functioneel herstel deed toenemen bleef echter lang onzeker. Vanaf 2001 zijn meerdere gerandomiseerde klinische trials verricht om het effect van chirurgische decompressie op functioneel herstel te bepalen.
Conclusies / Summary of Findings
|
Hoog GRADE |
Bij patiënten van 60 jaar of jonger met klinische en radiologische tekenen van een ruimte-innemend herseninfarct, die binnen 48 uur kunnen worden geopereerd, leidt chirurgische decompressie tot afname van sterfte. |
|
Matig GRADE |
Bij patiënten van 60 jaar of jonger met klinische en radiologische tekenen van een ruimte-innemend herseninfarct, die binnen 48 uur kunnen worden geopereerd, leidt chirurgische decompressie tot afname van de kans op een zeer slechte uitkomst (mRS 5 of 6) en afname van de kans op een slechte tot zeer slechte uitkomst (mRS 4, 5 of 6). |
|
Laag GRADE |
Er is in deze groep geen verschil in effect van chirurgische decompressie tussen patiënten met en zonder afasie. |
|
Matig GRADE |
Bij patiënten van 60 jaar of jonger met klinische en radiologische tekenen van een ruimte-innemend herseninfarct, die na 48 uur worden geopereerd, is het effect van chirurgische decompressie onzeker. |
|
Hoog GRADE |
Bij patiënten ouder dan 60 jaar met klinische en radiologische tekenen van een ruimte-innemend herseninfarct die binnen 48 uur kunnen worden geopereerd leidt chirurgische decompressie tot afname van sterfte. |
|
Matig GRADE |
Bij patiënten ouder dan 60 jaar met klinische en radiologische tekenen van een ruimte-innemend herseninfarct die binnen 48 uur kunnen worden geopereerd leidt chirurgische decompressie tot afname van de kans op een zeer slechte uitkomst (mRS 5 of 6). Het effect op de kans op een slechte uitkomst (mRS 4, 5 of 6) is onzeker. |
Samenvatting literatuur
In de afgelopen jaren zijn zeven gerandomiseerde klinische trials gepubliceerd waarin is onderzocht of chirurgische decompressie bij patiënten met een ruimte-innemend infarct in het stroomgebied van de ACM het herstel bevordert. De resultaten van de Filipijnse HeMMI-trial en de Turkse DEMITUR-trial zijn nog niet bekend.
De Amerikaanse Hemicraniectomy And Durotomy for deterioration From Infarction-Relating Swelling Trial (Frank, 2014) is in 2004 na de inclusie van 25 patiënten gestaakt. De belangrijkste inclusiecriteria waren leeftijd van 18 tot 75 jaar, een infarct in het stroomgebied van de ACM met op CT tekenen van infarcering van het volledige stroomgebied en ernstige focale uitval (NIHSS score ≥18). Patiënten die voldeden aan deze criteria werden 96 uur gevolgd. Als binnen 96 uur een bewustzijnsdaling en midline shift ontstonden werd gerandomiseerd tussen chirurgische decompressie en voortzetten van medicamenteuze behandeling zonder chirurgische decompressie. De primaire uitkomstmaat was overlijden na 21 dagen. De mediane leeftijd was 56 jaar. Aan vijftien patiënten werd door randomisatie operatieve behandeling toegewezen, waarvan veertien werden geopereerd. Er was afname van de kans op overlijden voor patiënten die werden gerandomiseerd voor operatieve behandeling (21% vs. 40%, verschil 19%, 95% BI -13 tot 50). Er werden geen data met betrekking tot functioneel herstel gerapporteerd.
De Franse Decompressive Craniectomy in Malignant Middle Cerebral Artery Infarction (DECIMAL) trial (Vahedi, 2007) werd in 2006 na inclusie van 38 van de 60 gewenste patiënten gestaakt vanwege een tegenvallende inclusiesnelheid en een geplande analyse van samengevoegde data uit de DECIMAL-, DESTINY- en HAMLET-trials. De belangrijkste inclusiecriteria waren leeftijd tussen 18 en 55 jaar, een infarct in het stroomgebied van de ACM met zowel ischemische afwijkingen in minimaal 50% van het stroomgebied van de ACM op CT als een lesievolume op diffusie-gewogen MRI van meer dan 145 ml, ernstige focale uitval en een tenminste licht gedaald bewustzijn (gedefinieerd als een score ≥1 op onderdeel 1a van de NIH Stroke Scale). De maximale tijd tussen het ontstaan van het infarct en inclusie was 24 uur. Chirurgische decompressie diende binnen zes uur na inclusie te worden verricht. De primaire uitkomstmaat was functioneel herstel na zes maanden, gemeten met de modified Rankin Scale (mRS). Een score van vier of meer werd beschouwd als een slecht herstel. De mediane leeftijd van de geïncludeerde patiënten was 43 jaar. Aan twintig patiënten werd door randomisatie operatieve behandeling toegewezen. Er waren geen cross-overs. Na chirurgische decompressie was er een kleinere kans op een slechte uitkomst, maar zonder statistische significantie in de primaire analyse (75% vs. 94%; p=0,18), en een kleinere kans op overlijden (25% vs. 78%; p<0,0001).
De Duitse Decompressive Surgery for the Treatment of Malignant Infarction of the Middle Cerebral Artery (DESTINY) trial (Jüttler, 2007) werd in 2006 na inclusie van 32 van de verwachte 68 patiënten gestaakt vanwege een hogere mortaliteit in de conservatief behandelde dan in de chirurgisch behandelde groep. De belangrijkste inclusiecriteria waren leeftijd tussen 18 en 60 jaar, een infarct in het stroomgebied van de ACM met ischemische afwijkingen in minimaal tweederde van het stroomgebied van de ACM op CT, ernstige focale uitval en een tenminste licht gedaald bewustzijn (gedefinieerd als een score ≥1 op onderdeel 1a van de NIH Stroke Scale). De maximale tijd tussen het ontstaan van het infarct en inclusie was 36 uur. Chirurgische decompressie diende binnen zes uur na inclusie te worden verricht. De primaire uitkomstmaat was dezelfde als in DECIMAL. De mediane leeftijd van de geïncludeerde patiënten was 45 jaar. Aan zeventien patiënten werd door randomisatie operatieve behandeling toegewezen. Deze patiënten werden allen geopereerd. Tevens werd één patiënt uit de controlegroep geopereerd. Er was een kleinere kans op een slechte uitkomst voor patiënten die werden gerandomiseerd voor operatieve behandeling bij analyse van de verdeling van uitkomsten over de mRS (p=0,04). Er was een kleinere kans op een slecht herstel (mRS 4 tot 6), maar zonder statistische significantie (53% vs. 73%; p=0,23), en een kleinere kans op overlijden (12% vs. 53%; p<0,02).
De Nederlandse Hemicraniectomy After Middle cerebral artery infarction with Life-threatening Edema Trial (HAMLET) (Hofmeijer, 2009) werd in 2007 na inclusie van 64 van de beoogde 128 patiënten na een interim-analyse vanwege futiliteit gestaakt. De belangrijkste inclusiecriteria waren leeftijd tussen 18 en 60 jaar, een infarct in het stroomgebied van de ACM met ischemische afwijkingen in minimaal tweederde van het stroomgebied van de ACM op CT, ernstige focale uitval en een tenminste licht gedaald bewustzijn (gedefinieerd als een score ≤13 op de Glasgow Coma Scale of een oog + motor-score ≤9 bij afasie). De maximale tijd tussen het ontstaan van het infarct en inclusie was 96 uur. Chirurgische decompressie diende binnen drie uur na inclusie te worden verricht. De primaire uitkomstmaat was functioneel herstel na 12 maanden, gemeten met de mRS. Een score van vier of meer werd beschouwd als een slecht herstel. De mediane leeftijd van de geïncludeerde patiënten was 48 jaar. Aan tweeëndertig patiënten werd door randomisatie operatieve behandeling toegewezen. Er waren geen cross-overs. Chirurgische decompressie had geen effect op de kans op een slechte uitkomst (mRS 4-6, 75% vs. 75%, ARR 0%, 95%BI -21 tot 21), maar was geassocieerd met een afname van sterfte (22% vs. 59%, ARR 38%, 95%BI 15 tot 60).
Een Chinese trial (Zhao, 2012) werd gestaakt na inclusie van 47 patiënten op grond van een interimanalyse die statistisch significant voordeel toonde ten aanzien van de primaire uitkomstmaat. De belangrijkste inclusiecriteria waren leeftijd van 18 tot en met 80 jaar, mogelijkheid van inclusie en start van de behandeling binnen 48 uur na ontstaan van het infarct, bewustzijnsdaling tot een oog- en motor score van ≤9 op de GCS en tekenen van infarcering in minimaal tweederde van het stroomgebied van de ACM met massawerking. De primaire uitkomstmaat was functioneel herstel na zes maanden, gemeten met de mRS. Een score groter dan vier werd beschouwd als een slecht herstel. De mediane leeftijd van de geïncludeerde patiënten was 64 jaar. Aan vierentwintig patiënten werd door randomisatie operatieve behandeling toegewezen. Er waren geen cross-overs. Er was een statistisch significante afname van de kans op een slecht herstel (33% vs. 83%, p= 0,001) of overlijden (13% vs. 71%, p= 0,001) na chirurgische decompressie. Deze resultaten waren in essentie gelijk in de subgroep van patiënten van 80 jaar en ouder.
In de Duitse DESTINY-2-trial (Jüttler, 2014) werden 112 patiënten van 61 jaar of ouder geïncludeerd. De overige inclusiecriteria en de uitkomstmaten waren gelijk aan die van de eerste DESTINY-trial. De maximale tijd tussen het ontstaan van het infarct en inclusie was 48 uur. De mediane leeftijd van de geïncludeerd patiënten was 70 jaar. Negenenveertig patiënten werden geopereerd. Er was een statistisch significante afname van de kans op een slecht herstel (62% vs. 82%, OR 2,9, 95%BI 1,1 tot 7,5) of overlijden (33% vs. 70%, p= 0,001) na chirurgische decompressie.
Van een gerandomiseerde trial uit Letland (Slezins, 2012) werden resultaten van een interimanalyse van de eerste 28 geïncludeerde patiënten gepubliceerd. Het is onduidelijk of de trial nadien is gestaakt. De belangrijkste inclusiecriteria waren leeftijd 18 jaar of ouder, een infarct in het stroomgebied van de ACM met ischemische afwijkingen in minimaal de helft van het stroomgebied van de ACM op CT of MRI, of infarct volume van meer dan 145 cm3, NIHSS score >15 en mogelijkheid van starten met de operatie binnen 48 uur na het herseninfarct. De primaire uitkomstmaat was functioneel herstel na een jaar gemeten met de mRS. Een score groter dan vier werd beschouwd als een slecht herstel. De gemiddelde leeftijd van de patiënten was 62 jaar. Elf patiënten werden geopereerd. Het aantal door randomisatie toegewezen operaties en het aantal cross-overs zijn onduidelijk. De kans op een slecht herstel was kleiner (54% vs. 92%) en sterfte was lager (54% vs. 92%) in de geopereerde groep. Er werd echter geen statistische significantie bereikt.
Zes trials werden opgenomen in een meta-analyse (Frank, 2014; Vahedi, 2007; Jüttler, 2007; Hofmeijer, 2009; Zhao, 2012; Jüttler, 2014). Van de trials HEMMI, DEMITUR en Slezins 2012 waren niet onvoldoende gegevens beschikbaar. De follow-up duur van alle geïncludeerde onderzoeken was één jaar, met uitzondering van zes maanden in (Frank, 2014). Er werd een meta-analyse gedaan in drie subgroepen:
- De eerste subgroep betrof patiënten van 18 tot en met 60 jaar met klinische en radiologische tekenen van een ruimte-innemend supratentorieel herseninfarct binnen 48 uur na het infarct.
- De tweede subgroep betrof patiënten van 18 tot en met 60 jaar met klinische en radiologische tekenen van een ruimte-innemend supratentorieel herseninfarct na 48 uur na het infarct.
- De derde subgroep betrof patiënten ouder dan 60 met klinische en radiologische tekenen van een ruimte-innemend supratentorieel herseninfarct binnen 48 uur na het infarct.
Subgroep 1: patiënten van 18 tot en met 60 jaar met klinische en radiologische tekenen van een ruimte-innemend supratentorieel herseninfarct binnen 48 uur na het infarct.
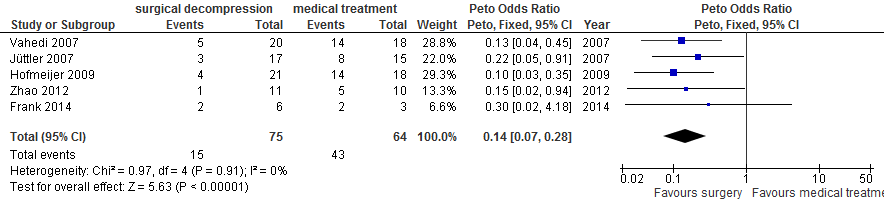
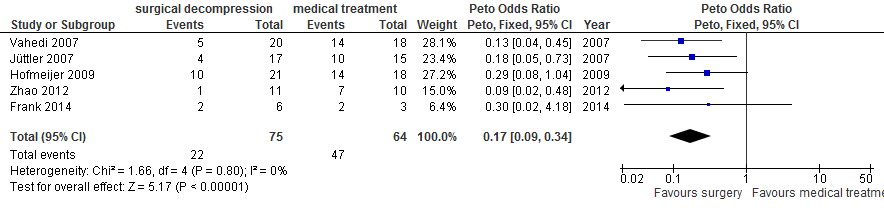
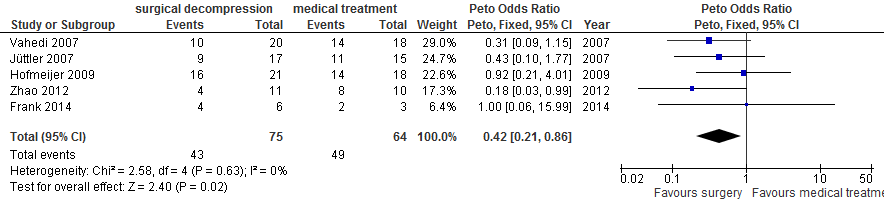
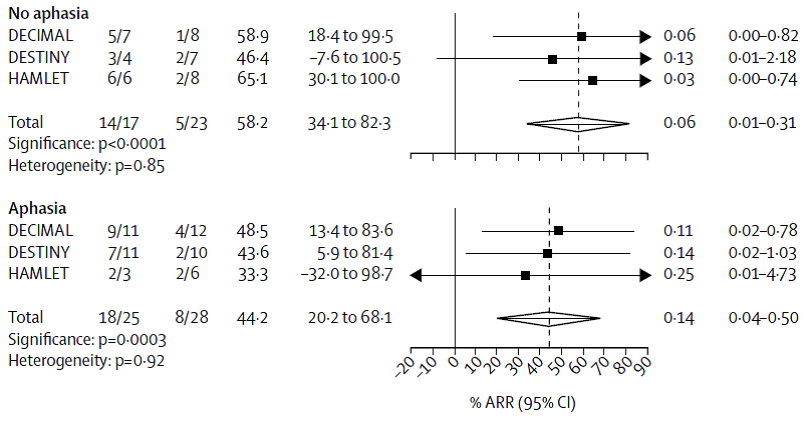
Na chirurgische decompressie was er afname van de kans op overlijden (20% vs. 76%; OR 0,14; 95%BI 0,07 tot 0,28; Figuur 1), afname van de kans op overlijden of ernstige handicap (mRS 5 of 6: 29% vs. 73%; OR 0,17; 95%BI 0,09 tot 0,34; Figuur 2) en afname van de kans op overlijden, een ernstige of een matig ernstige handicap (mRS 4, 5 of 6: 57% vs. 77%; OR 0,42; 95%BI 0,21 tot 0,86; Figuur 3). In de HAMLET-groep waren de resultaten na drie jaar in essentie gelijk (Geurts, 2013). Voor wat betreft de kans op overlijden of ernstige handicap (mRS 5 of 6) was het effect gelijk in de subgroepen van patienten met en zonder afasie in een analyse van gepoolde data van DECIMAL, DESTINY en HAMLET (Figuur 3; Vahedi, 2007).
Figuur 1 Meta-analyse van kans op overlijden voor patiënten van 18 tot en met 60 jaar en operatie binnen 48 uur

Figuur 2 Meta-analyse van kans op overlijden of ernstige handicap (mRS 5 of 6) voor patiënten van 18 tot en met 60 jaar en operatie binnen 48 uur

Figuur 3 Meta-analyse van kans op overlijden, ernstige handicap of matig ernstige handicap (mRS 4, 5 of 6) voor patiënten van 18 tot en met 60 jaar en operatie binnen 48 uur

Figuur 4 Meta-analyse van kans op overlijden of ernstige handicap (mRS 5 of 6) in subgroepen van patiënten met en zonder afasie van 18 tot en met 60 jaar en operatie binnen 48 uur
Subgroep 2: patiënten van 18 tot en met 60 jaar met klinische en radiologische tekenen van een ruimte-innemend supratentorieel herseninfarct na 48 na het infarct.
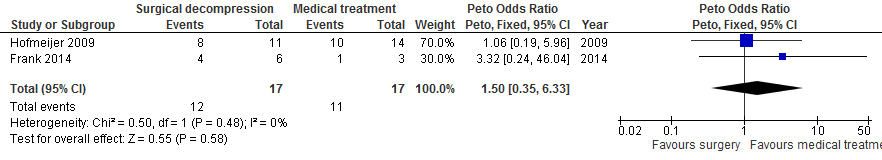
Na chirurgische decompressie was er geen statistisch significante verandering van de kans op overlijden (29% vs. 35%; OR 0,76; 95%BI 0,18 tot 3,16; Figuur 5), de kans op overlijden of ernstige handicap (mRS 5 of 6: 29% vs. 35%; OR 0,76; 95%BI 0,18 tot 3,16; Figuur 6) of de kans op overlijden, ernstige handicap of matig ernstige handicap (mRS 4, 5 of 6: 71% vs. 65%; OR 1,50; 95%BI 0,35 tot 6,33; Figuur 7).
Figuur 5 Meta-analyse van kans op overlijden voor patiënten van 18 tot en met 60 jaar en operatie na 48 uur

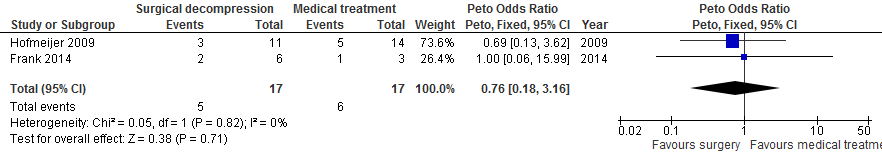
Figuur 6 Meta-analyse van kans op overlijden of ernstige handicap (mRS 5 of 6) voor patiënten van 18 tot en met 60 jaar en operatie na 48 uur

Figuur 7 Meta-analyse van kans op overlijden, ernstige handicap of matig ernstige handicap (mRS 4, 5 of 6) voor patiënten van 18 tot en met 60 jaar en operatie na 48 uur

Subgroep 3: patiënten van ouder dan 60 met klinische en radiologische tekenen van een ruimte-innemend supratentorieel herseninfarct binnen 48 uur na het infarct.
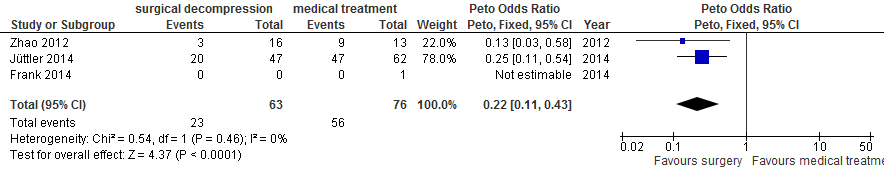
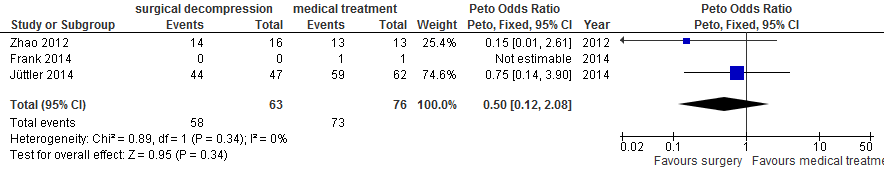
Na chirurgische decompressie was er afname van de kans op overlijden (37% vs. 74%; OR 0,22; 95%BI 0,11 tot 0,43; Figuur 8) en afname van de kans op overlijden of ernstige handicap (mRS 5 of 6: 54% vs. 86%; OR 0,21; 95%BI 0,10 tot 0,44; Figuur 9). Er was geen statistisch significante afname van de kans op overlijden, ernstige handicap of matig ernstige handicap (mRS 4, 5 of 6; 92% vs. 96%; OR 0,50; 95%BI 0,12 tot 2,08; Figuur 10).
Figuur 8 Meta-analyse van kans op overlijden voor patiënten ouder dan 60 jaar en operatie binnen 48 uur

Figuur 9 Meta-analyse van kans op overlijden of ernstige handicap (mRS 5 of 6) voor patiënten ouder dan 60 jaar en operatie binnen 48 uur.

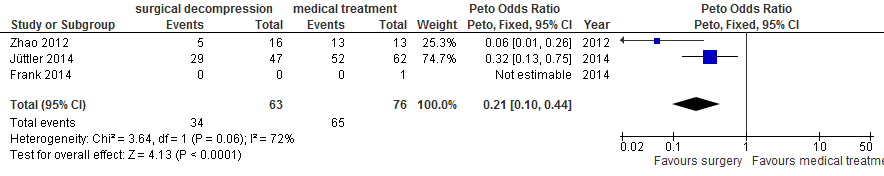
Figuur 10 Meta-analyse van kans op overlijden, ernstige handicap of matig ernstige handicap (mRS 4, 5 of 6) voor patiënten ouder dan 60 jaar en operatie binnen 48 uur

Bewijskracht van de literatuur
Uitkomstmaten: functioneel herstel en sterfte
De bewijskracht van een systematische review van gerandomiseerd onderzoek start hoog. Het niveau van bewijs werd voor de uitkomstmaat functioneel herstel verlaagd op grond van ongeblindeerde uitkomstmetingen in alle behalve één trial (kans op bias).
Zoeken en selecteren
Deze vraag werd vertaald in de volgend PICOs:
P patiënten met een ruimte-innemend herseninfarct (een groot, supratentorieel herseninfarct met klinische (bewustzijnsdaling) en radiologische (verplaatsing van hersenweefsel) tekenen van massawerking;
I chirurgische decompressie;
C geen chirurgische decompressie;
O mortaliteit, functioneel herstel.
In de databases Medline (OVID), Embase en Cochrane is met relevante zoektermen gezocht naar artikelen over chirurgische decompressie bij patiënten met een ruimte-innemend herseninfarct. De zoekverantwoording is weergegeven in de bijlage. Studies die voldeden aan de volgende selectiecriteria zijn opgenomen in de samenvatting van de literatuur: patiënten met een ruimte-innemend herseninfarct in het stroomgebied van de ACM, RCT naar chirurgische decompressie vs conservatieve behandeling en uitkomsten gerapporteerd als functioneel herstel en/of sterfte.
Referenties
- Frank JI, Schumm LP, Wroblewski K, et al. Hemicraniectomy and durotomy upon deterioration from infarction related swelling trial. Stroke. 2014;45:781-87.
- Geurts M, Van der Worp HB, Kappelle J, et al. Surgical decompression for space-occupying cerebral infarction: outcomes at three years in the randomized HAMLET trial. Stroke. 2013;44:2506-8.
- Gupta R, Connolly ES, Mayer S, et al. Hemicraniectomy for massive middle cerebral artery territory infarction: a systematic review. Stroke. 2004;35:539-43.
- Hacke W, Schwab S, Horn M, et al. 'Malignant' middle cerebral artery infarction. Clinical course and prognostic signs. Arch Neurol. 1996;53:309-15.
- Hofmeijer J, Algra A, Kappelle LJ, et al. Predictors of Life-Threatening Brain Edema in Middle Cerebral Artery Infarction. Cerebrovasc Dis. 2008;25:176-184.
- Hofmeijer J, Kappelle LJ, Algra A, et al. Surgical decompression for space-occupying cerebral infarction (the Hemicraniectomy After MCA infarction with Life-threatening Edema Trial (HAMLET): a muliticentre, open, randomized trial. Lancet Neurol. 2009;8:326-33.
- Hofmeijer J, van der Worp HB, Amelink GJ, et al. Chirurgische decompressie bij het ruimte-innemende herseninfarct. Aanmelding voor een gerandomiseerde trial. Ned Tijdschr Geneeskd. 2003a;147:2594-2596.
- Hofmeijer J, van der Worp HB, Kappelle LJ, et al. Cost-effectiveness of surgical decompression for space-occupying hemispheric infarction. Stroke. 2013;44:2923-5.
- Hofmeijer J, Van der Worp HB, Kappelle LJ. Treatment of space-occupying hemispheric infarction. Crit Care Med. 2003b;31:617-25.
- Hofmeijer J. Evidence based medical knowledge: the neglected role of expert opinion. J Eval Clin Pract 2014;20:803-8.
- Jüttler E, Schwab S, Schmiedek P, et al. Decompressive Surgery for the Treatment of Malignant Infarction of the Middle Cerebral Artery (DESTINY): a randomized, controlled trial. Stroke. 2007;38:2518-25.
- Juttler E. Unterberg A, Woitzik J, et al. Hemicraniectomy in older patients with extensive middle cerebral artery stroke. New Engl J Med. 2014;370:1091-100.
- Rieke K, Schwab S, Krieger D, et al. Decompressive surgery in space-occupying hemispheric infarction: Results of an open, prospective trial. Crit Care Med. 1995;23:1576-87.
- Schwab S, Steiner T, Aschoff A, et al. Early hemicraniectomy in patients with complete middle cerebral artery infarction. Stroke. 1998;29:1888-93.
- Slezins J, Keris V, Bricis R, et al. Preliminary results of randomized controlled study on decompressive craniectomy in treatment of malignant middle cerebral artery stroke. Medicina (Kaunas). 2012;48:521-4.
- Thomalla G, Hartmann F, Juettler E, et al. Prediction of malignant middle cerebral artery infarction by MRI within 6 hours of symptom onset: a prospective multicenter observational study. Ann Neurol. 2010;68:435-45.
- Vahedi K, Hofmeijer J, Juettler E, et al. on behalf of the DECIMAL, DESTINY, and HAMLET investigators. Early decompressive surgery in malignant infarction of the middle cerebral artery: a pooled analysis of three randomised controlled trials. Lancet Neurol. 2007;6:215-22.
- Vahedi K, Vicaut E, Mateo J, et al. Sequential-design, multicenter, randomized, controlled trial of early decompressive craniectomy in malignant middle cerebral artery infarction (DECIMAL Trial). Stroke. 2007;38:2506-17.
- Zhao J, Su YY, Zhang Y, et al. Decompressive hemicraniectomy in malignant middle cerebral artery infarct: a randomized controlled trial enrolling patients up to 80 years old. Neurocrit care. 2012;17:161-71.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 26-10-2017
Beoordeeld op geldigheid : 12-09-2024
De ontwikkelingen op het gebied van de acute opvang, secundaire preventie en revalidatie volgen elkaar in steeds sneller tempo op. Daarom werd in 2018 een kerngroep van neurologen, revalidatiearts en huisarts geïnstalleerd om snel op nieuwe ontwikkelingen te kunnen inspelen. In 2018 werden de modules over plaatjesaggregatieremmers en Directe Orale Anticoagulantia geupdate en nieuwe modules over tenecteplase en endovasculaire behandeling ontwikkeld. In 2019 wordt opnieuw geprioriteerd welke wijzigingen nodig zijn.
Deze kerngroep vergadert tenminste tweemaal per jaar om op basis van eigen inzichten en/of signalen uit het veld te beoordelen of hernieuwde aanvulling en/of revisie van (onderdelen van) de richtlijn gewenst is. Andere disciplines namen zitting in een klankbordgroep en worden betrokken afhankelijk van het onderwerp van de te reviseren module.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Op sommige plaatsen in deze richtlijn wordt verwezen naar de richtlijn Beroerte uit 2008. Het hoofdstuk Verantwoording uit deze richtlijn is op te vragen bij de Nederlandse Vereniging voor Neurologie.
In samenwerking met:
Koninklijk Nederlands Genootschap voor Fysiotherapie
Nederlands Huisartsen Genootschap
Nederlands Instituut van Psychologen
Nederlandse Vereniging voor Logopedie & Foniatrie
Nederlandse Vereniging voor Klinische Neurofysiologie
Nederlandse Vereniging voor Spoedeisende Hulp Artsen
Verenso Vereniging van Specialisten Ouderengeneeskunde
Verpleegkundigen & Verzorgenden Nederland (Neuro/stroke verpleegkundigen en Ambulancezorg)
Nederlandse Vereniging voor Ergotherapie
Doel en doelgroep
Doel
Het doel van deze op wetenschappelijk bewijs gebaseerde (evidence based) richtlijn is het bieden van een basis voor optimale zorg voor patiënten met een herseninfarct of hersenbloeding. Daarnaast draagt de richtlijn bij aan afstemming van de zorg tussen de verschillende zorgverleners en aan het terugdringen van ongewenste praktijkvariatie.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met een herseninfarct of hersenbloeding.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met TIA, herseninfarct of hersenbloeding. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende drie jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- prof. dr. D.W.J. Dippel (voorzitter), neuroloog, Erasmus MC Rotterdam, namens de Nederlandse Vereniging voor Neurologie (NVN)
- dr. H.B. van der Worp, neuroloog, UMC Utrecht, namens de NVN
- dr. J. Hofmeijer, neuroloog, Rijnstate ziekenhuis Arnhem, namens de NVN
- dr. R.M. van den Berg-Vos, neuroloog, OLVG West Amsterdam, namens de NVN
- dr. E.J. van Dijk, neuroloog, Radboudumc Nijmegen, namens de NVN
- M. Geurts, AIOS neurologie, UMC Utrecht, namens de NVN en de Vereniging Arts-Assistenten in opleiding tot Neuroloog (VAAN)
- prof. Dr. W. Mess, neuroloog/klinisch neurofysioloog, Maastricht UMC, namens de NVN
- dr. L.M.L. de Lau, neuroloog, Slotervaartziekenhuis Amsterdam, namens de NVN
- M. Kouwenhoven, revalidatiearts, De Hoogstraat Utrecht, namens de Nederlandse Vereniging van Revalidatiearsten (VRA)
- dr. B.J. Bouma, cardioloog, AMC Amsterdam, namens de Nederlandse Vereniging voor Cardiologie (NVvC)
- prof. dr. G.J. de Borst, vaatchirurg, UMC Utrecht, namens de Nederlandse Verenging voor Vaatchirurgie (NVvV)/Nederlandse Vereniging voor Heelkunde (NVvH)
- dr. J.A.H.R. Claassen, klinisch geriater, Radboudumc Nijmegen, namens de Nederlandse Vereniging voor Klinische Geriatrie (NVKG)
- dr. M. van Eijk, specialist ouderengeneeskunde, LUMC Leiden, namens Verenso Vereniging van Specialisten Ouderengeneeskunde
- dr. B.J.H. van den Born, internist, AMC Amsterdam, namens de Nederlandse Internisten Vereniging (NIV)/ Internistisch Vasculair Genootschap (IVG)
- dr. H.D. Boogaarts, neurochirurg, Radboudumc Nijmegen, namens de Nederlandse Vereniging voor Neurochirurgie (NVvN)
- dr. W. van Zwam, radioloog, Maastricht UMC, namens de Nederlandse Vereniging voor Radiologie (NVvR)
- I. Brummer, SEH-arts, Scheper ziekenhuis Emmen, namens de Nederlandse Vereniging van Spoedeisende Hulp Artsen (NVSHA)
- prof. dr. G. Kwakkel, hoogleraar neurorevalidatie, Vrije Universiteit Amsterdam, namens het Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF)
- A.F.E. Verburg, huisarts, namens het Nederlands Huisartsen Genootschap (NHG)
- K. Kanselaar, MANP, verpleegkundig specialist vasculaire neurologie Radboudumc Nijmegen, namens Verpleegkundigen & Verzorgenden Nederland (V&VN) afdeling Neuro & Revalidatie, werkgroep CVA
- G.J. Deddens, Verpleegkundig Specialist Acute Zorg, namens V&VN afdeling Ambulancezorg
- prof. dr. C.M. van Heugten, hoogleraar klinische neuropsychologie, Maastricht University, namens het Nederlands Instituut van Psychologen (NIP) sectie neuropsychologie.
- dr. S.K. Schiemanck, revalidatiearts, Leiden UMC, namens de VRA
- A. Harbers, klinisch linguist en logopediste, Klimmendaal, namens Nederlandse Vereniging voor Logopedie en Foniatrie (NVLF)
Met medewerking van
- dr. P.J. Nederkoorn, neuroloog, Academisch Medisch Centrum, Amsterdam
- dr. E. Steultjens, Hogeschool van Arnhem en Nijmegen, namens Ergotherapie Nederland
- E. van Gorp, namens de Patiëntenvereniging Hersenletsel.nl
- dr. R.H. Wimmers, namens de Hartstichting
- Ir. K. Idema, namens de Hart&Vaatgroep
Met ondersteuning van
- dr. M. Molag, adviseur, Kennisinstituut van Medisch Specialisten
- dr. I. Mostovaya, adviseur, Kennisinstituut van Medisch Specialisten
- dr. M. A. Pols, senior adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen door middel van reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten, een overzicht vindt u hieronder.
|
Werkgroeplid |
Functie |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
|
Berg-Vos |
Neuroloog |
Geen |
Geen |
Bestuurslid kennisnetwerk CVA |
Geen |
Geen |
Geen |
|
Boogaarts |
Neurochirurg |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Born |
Internist-vasculair geneeskundige |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Borst |
Vaatchirurg |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Bouma |
Cardioloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Brummer |
SEH-arts |
Geen |
Geen |
Lid richtlijnencommissie NVSHA |
Geen |
Geen |
Geen |
|
Claassen |
Klinisch geriater (0,6 fte) |
Geen |
Geen |
Geen |
Onderzoeksleider van 3 onderzoeksprojecten, (mede)gefinancierd door het onderzoeksfonds van Alzheimer Nederland (patiëntenvereniging), en 1 project gefinancierd door ISAO (Alzheimerfonds) |
Geen |
Mijn werkgever (Radboudumc) heeft financiele vergoedingen ontvangen van bedrijven (farmaceutische industrie) voor presentaties die ik op uitnodiging van die bedrijven heb gegeven, of voor symposia die ik voor die brdrijven heb (nede)georganiseerd. De vergoeding betrof steeds een vergoeding voor de gewerkte uren. |
|
Deddens |
Verpleegkundige Specialist Acute Zorg en Ambulanceverpleegkundige |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Dippel |
Neuroloog, hoogleraar acute behandeling neurovasculaire aandoeningen |
Geen |
Geen |
Niet van toepassing |
Het MR CLEAN onderzoek (www.mrclean-trial.org) wordt in geringe mate (10%) zonder voorwaarden gesteund door enkele medische industriën en importeurs. Deze staan vermeld op de website. Ik ben een van de hoofdonderzoekers van deze trial. |
Geen |
Geen |
|
Geurts |
AIOS neurologie |
Geen |
Geen |
Geen |
M. Geurts is studie-coordinator van de COOLing for Ischaemic Stroke Trial (COOLIST), dat wordt gefinancierd door de Nederlandse Hartstichting (2010B239). |
Geen |
Geen |
|
Harbers |
Logopediste & Klinisch Linguist |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Hofmeijer |
Neuroloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Kanselaar-Martens |
Verpleegkunde specialist Radboudumc |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Kwakkel |
Hoogleraar Neurorevalidatie |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Schiemanck |
Revalidatiearts Tot 31-12-2014: AMC ; Medisch Leidinggevende Neuroteam, AMC; Consulent Revalidatiegeneeskunde aan Zorgcentrum Berkenstede, Stichting Cordaan, Diemen, sinds 01-07-2006, Heden: subafdelingshoofd Leids Universitair Medisch Centrum |
Geen |
Geen |
Geen |
* Onderzoeksproject ism Radboudumc Efficacy of functional electrical stimulation of the peroneal nerve with the Actigait system on walking efficiency and patient satisfaction in stroke patients suffering from a drop foot, 2007-2014; studie is afgerond; financiering door Otto Bock Healthcare |
Geen |
Geen |
|
Spruit-Van Eijk |
Specialist Ouderengeneeskunde en UD PHEG |
Geen |
Geen |
Geen |
2007 - 2012 GRAMPS studie gefinancierd door 2 grote zorginstanties de Zorgboog en SVRZ, zorgt in Zeeland |
Geen |
Geen |
|
Van den Born |
internist |
Geen |
Geen |
Bestuurslid van de Nederlandse Hypertensievereniging |
Geen |
Geen |
Geen |
|
Van Dijk |
Neuroloog |
Geen |
Geen |
Bestuurslid Stafconvent Radboudumc: betaald |
Onderzoek naar effectiviteit en veiligheid DOACs in Nederland (gefinancierd door GGG-ZonMw / VWS): 110Keuro |
Geen |
Geen |
|
Van Heugten |
Psycholoog, hoogleraar Klinisch Neuropsychologie |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Verburg |
Wetenschappelijk medewerker en |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Zwam |
Radioloog |
Geen |
Geen |
Geen |
Stuurgroeplid MrClean studie |
Geen |
Geen |
Meelezers
|
Werkgroeplid |
Functie |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
|
Idema |
Beleidsadviseur (De Hart&Vaatgroep) |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Kouwenhoven |
Revalidatiearts |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Steultjens |
ass. Lector Neurorevalidatie |
Geen |
Geen |
lid raad van advies Ergotherapie Nederland |
Geen |
eigen onderneming gericht op bijscholing aan ergotherapeuten m.b.t. twee specifieke methoden van diagnostiek en interventie ook toepasbaar bij cliënten na bereorte. Scholing is niet gericht op toepassing multi-disciplinaire richtlijnen |
Geen |
|
Van Gorp-Clion |
Tot 1 juli 2014 Voorzitter, daarna bestuurslid |
Geen |
Doelgroep/ achterban van de patiëntenvereniging |
Belangen van CVA-patiënten bij de patiëntenorganisatie |
Geen |
Geen |
Geen |
|
Wielemaker |
Hoofd patiëntenzorg Hersenstichting Nederland |
Geen |
Geen |
Geen |
Geen deelname aan onderzoek. Ben zelf werkzaam bij een gezondheidsfonds, de Hersenstichting verleent wel subsidie aan wetenschappelijk onderzoek. |
Geen |
De Hersenstichting heeft een puur faciliterende rol als het gaat om ontwikkeling van bijvoorbeeld een zorgstandaard, zoals nu de zorgstandaard Traumatisch Hersenletsel. Zij heeft het zorgveld de opdracht gegeven een dergelijke zorgstandaard te ontwikkelen en stelt daarvoor de middelen ter beschikking. Meer informatie op www.zorgstandaardnah.nl |
|
Wimmers |
Teammanager Kennis & Trends, Hartstichting |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het raadplegen van afgevaardigden van de patiëntenvereniging hersenletsel.nl, de Hartstichting en de Hart&Vaatgroep. Deze partijen werden ook uitgenodigd om tijdens de invitational conference de door hen ervaren knelpunten aan te dragen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan deze partijen.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit (www.demedischspecialist.nl/richtlijnen). Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreetrust.org) dat een internationaal breed geaccepteerd instrument is en op Richtlijnen voor richtlijnen voor de beoordeling van de kwaliteit van richtlijnen (www.zorginstituutnederland.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Achmea en VGZ namens Zorgverzekeraars Nederland, het College voor Zorgverzekeringen (tegenwoordig Zorginstituut Nederland), de Inspectie voor de Gezondheidszorg, CVA Patiëntenvereniging Hersenletsel.nl, de Hart&Vaatgroep en de Hartstichting, via een invitational conference.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken, waarna de definitieve uitgangsvragen werden vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk en onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt inhoudt.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen, via de websites van enkele grote organisaties, zoals de American Heart Association en de European Stroke Organization. Tevens werd in de tijdschriften Stroke en Int J Stroke gezocht naar richtlijnen. Vervolgens werd op de website van de Cochrane Library gezocht naar systematische reviews. Tot slot werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases (NLM Pubmed, Google Scholar, Embase, Cochrane Library). De zoektermen werden geformuleerd aan de hand van een searchvraag. De searchvraag werd vertaald in een PICO (patient, intervention, control, outcome). Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepsleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in het hoofdstuk van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van vertrouwen in de literatuurconclusie (zie http://www.guidelinedevelopment.org/handbook/).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden.
Formuleren van de conclusies
Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusies, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt deze getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen door de werkgroep en beschreven in de literatuursamenvatting.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld binnen de clinical audit van de NVN om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de paragraaf Kennislacunes behorend bij elke module.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
MCA Guidelines
Surgical decompression
MEDLINE (Ovid) January 2008 to February 2014
|
1. brain ischemia/ or exp brain infarction/ or hypoxia-ischemia, brain/ or carotid artery diseases/ or carotid artery thrombosis/ or carotid artery, internal, dissection/ or intracranial arterial diseases/ or cerebral arterial diseases/ or infarction, anterior cerebral artery/ or infarction, middle cerebral artery/ or infarction, posterior cerebral artery/ or exp intracranial embolism and thrombosis/ or exp stroke/ or vertebral artery dissection/ or brain edema/ 2. (isch?emi$ adj6 (stroke$ or apoplex$ or cerebral vasc$ or cerebrovasc$ or cva)).tw. 3. ((brain or cerebr$ or cerebell$ or vertebrobasil$ or hemispher$ or intracran$ or intracerebral or infratentorial or supratentorial or middle cerebral artery or MCA$ or anterior circulation or posterior circulation or basilar artery or vertebral artery or space-occupying) adj5 (isch?emi$ or infarct$ or thrombo$ or emboli$ or occlus$ or hypoxi$ or oedema or odema or edema or swell$ or swollen or herniation)).tw. 4. ((cerebell$ or vertebrobasil$ or hemispher$ or intracran$ or intracerebral or infratentorial or supratentorial or middle cerebr$ or MCA$ or anterior circulation or posterior circulation or basilar artery or vertebral artery or space-occupying) adj5 stroke$).tw. 5. 1 or 2 or 3 or 4 6. decompression, surgical/ or decompressive craniectomy/ 7. (decompress$ or craniectom$ or hemicraniect$ or hemi-craniect$).tw. 8. 6 or 7 9. Randomized Controlled Trials as Topic/ 10. random allocation/ 11. Controlled Clinical Trials as Topic/ 12. control groups/ 13. clinical trials as topic/ or clinical trials, phase i as topic/ or clinical trials, phase ii as topic/ or clinical trials, phase iii as topic/ or clinical trials, phase iv as topic/ 14. (randomized controlled trial or controlled clinical trial).pt. 15. (clinical trial or clinical trial phase i or clinical trial phase ii or clinical trial phase iii or clinical trial phase iv).pt. 16. (random$ or RCT or RCTs).tw. 17. (controlled adj5 (trial$ or stud$)).tw. 18. (clinical$ adj5 trial$).tw. 19. trial.ti. 20. ((control or treatment or experiment$ or intervention or surgical) adj5 (group$ or subject$ or patient$)).tw. 21. (quasi-random$ or quasi random$ or pseudo-random$ or pseudo random$).tw. 22. controls.tw. 23. Meta-Analysis as Topic/ or Meta-Analysis/ 24. (meta analy$ or metaanaly$).tw. 25. (systematic adj (review$1 or overview$1)).tw. 26. exp Review Literature as Topic/ 27. (cochrane or medline or pubmed or embase or cinahl or science citation index).ab. 28. (reference list$ or bibliograph$ or hand-search$ or relevant journals or manual search$).ab. 29. (selection criteria or data extraction).ab. and Review/ 30. or/9-29 31. 5 and 8 and 30 32. comment/ or letter/ or editorial/ 33. exp animals/ not humans.sh. 34. (neonat$ or newborn$ or new born or pediatric or paediatric or birth or infant or infants or perinatal or peri-natal or baby or babies or child or children).ti. 35. decompression sickness/ or decompression sickness.tw. 36. 32 or 33 or 34 or 35 37. 31 not 36 |
|
|
Cochrane Library search strategy 2014 issue 1 |
Cochrane Database of Systematic Reviews (CDSR) Cochrane Central Register of Controlled Trials (CENTRAL) Database of Reviews of Effects (DARE) #1 [mh ^brain ischemia] or [mh brain infarction] or [mh ^hypoxia-ischemia, brain] or [mh ^carotid artery diseases] or [mh ^carotid artery thrombosis] or [mh ^carotid artery, internal, dissection] or [mh ^intracranial arterial diseases] or [mh ^cerebral arterial diseases] or [mh ^infarction, anterior cerebral artery] or [mh ^infarction, middle cerebral artery] or [mh ^infarction, posterior cerebral artery] or [mh intracranial embolism and thrombosis] or [mh stroke] or [mh ^vertebral artery dissection] or [mh ^brain edema] #2 isch*mi* near/6 (stroke* or apoplex* or cerebral next vasc* or cerebrovasc* or cva):ti,ab #3 (brain or cerebr* or cerebell* or vertebrobasil* or hemispher* or intracran* or intracerebral or infratentorial or supratentorial or middle cerebral artery or MCA* or anterior circulation or posterior circulation or basilar artery or vertebral artery or space-occupying) near/5 (isch*mi* or infarct* or thrombo* or emboli* or occlus* or hypoxi* or oedema or odema or edema or swell* or swollen or herniation):ti,ab #4 ((cerebell* or vertebrobasil* or hemispher* or intracran* or intracerebral or infratentorial or supratentorial or middle next cerebr* or MCA* or anterior circulation or posterior circulation or basilar artery or vertebral artery or space-occupying) near/5 stroke):ti,ab #5 #1 or #2 or #3 or #4 #6 [mh ^decompression, surgical] or [mh ^decompressive craniectomy] #7 (decompress* or craniectom* or hemicraniect* or hemi-craniect*):ti,ab #8 #6 or #7 #9 #5 and #8 |
|
|
EMBASE (Ovid) search strategy Jan 2008 to February 2014 |
1. stroke/ or brain infarction/ or brain stem infarction/ or cerebellum infarction/ or exp brain ischemia/ or carotid artery disease/ or exp carotid artery obstruction/ or cerebral artery disease/ or exp cerebrovascular accident/ or exp occlusive cerebrovascular disease/ or stroke patient/ or brain edema/ 2. (isch?emi$ adj6 (stroke$ or apoplex$ or cerebral vasc$ or cerebrovasc$ or cva)).tw. 3. ((brain or cerebr$ or cerebell$ or vertebrobasil$ or hemispher$ or intracran$ or intracerebral or infratentorial or supratentorial or middle cerebral artery or MCA$ or anterior circulation or posterior circulation or basilar artery or vertebral artery or space-occupying) adj5 (isch?emi$ or infarct$ or thrombo$ or emboli$ or occlus$ or hypoxi$ or oedema or odema or edema or swell$ or swollen or herniation)).tw. 4. ((cerebell$ or vertebrobasil$ or hemispher$ or intracran$ or intracerebral or infratentorial or supratentorial or middle cerebr$ or MCA$ or anterior circulation or posterior circulation or basilar artery or vertebral artery or space-occupying) adj5 stroke$).tw. 5. 1 or 2 or 3 or 4 6. decompression surgery/ or brain decompression/ or decompressive craniectomy/ or craniectomy/ 7. (decompress$ or craniectom$ or hemicraniect$ or hemi-craniect$).tw. 8. 6 or 7 9. randomized controlled trial/ or randomized controlled trial (topic)/ 10. Randomization/ 11. Controlled Study/ 12. control group/ 13. clinical trial/ or phase 1 clinical trial/ or phase 2 clinical trial/ or phase 3 clinical trial/ or phase 4 clinical trial/ or controlled clinical trial/ 14. (random$ or RCT or RCTs).tw. 15. (controlled adj5 (trial$ or stud$)).tw. 16. (clinical$ adj5 trial$).tw. 17. trial.ti. 18. ((control or treatment or experiment$ or intervention or surgical) adj5 (group$ or subject$ or patient$)).tw. 19. (quasi-random$ or quasi random$ or pseudo-random$ or pseudo random$).tw. 20. controls.tw. 21. meta analysis/ or meta analysis (topic)/ or systematic review/ or systematic review (topic)/ 22. (meta analy$ or metaanaly$).tw. 23. (systematic adj (review$1 or overview$1)).tw. 24. (cochrane or medline or pubmed or embase or cinahl or science citation index).ab. 25. (reference list$ or bibliograph$ or hand-search$ or relevant journals or manual search).ab. 26. (selection criteria or data extraction).ab. 27. review.pt. or literature/ or review/ 28. 26 and 27 29. 9 or 10 or 11 or 12 or 13 or 14 or 15 or 16 or 17 or 18 or 19 or 20 or 21 or 22 or 23 or 24 or 25 or 28 30. 5 and 8 and 29 31. (letter or editorial).pt. 32. (exp animals/ or exp invertebrate/ or animal experiment/ or animal model/ or animal tissue/ or animal cell/ or nonhuman/) not (human/ or normal human/ or human cell/) 33. (neonat$ or newborn$ or new born or pediatric or paediatric or birth or infant or infants or perinatal or peri-natal or baby or babies or child or children).ti. 34. decompression sickness/ or decompression sickness.tw. 35. 31 or 32 or 33 or 34 36. 30 not 35 |
|
Database: Medline (OVID) 2008 – feb, 2014
Aantal hits: ??
