Cardiale emboliebron herseninfarct
Uitgangsvraag
Hoe dient een cardiale emboliebron als oorzaak van een TIA of herseninfarct te worden gediagnosticeerd?
Aanbeveling
Registreer bij patiënten die een TIA of herseninfarct hebben doorgemaakt en waarbij de oorzaak van de TIA of het herseninfarct onbekend is (een zogenaamde ‘cryptogenic stroke’) het hartritme gedurende tenminste 72 uur met behulp van cardiale monitoring, Holter-ECG of een ‘(external of internal) loop recorder’. Echter, langduriger monitoring moet overwogen worden om stil atriumfibrilleren op te sporen.
Ontwikkel samen met de cardiologen, al dan niet in onderzoeksverband, geprotocolleerde afspraken betreffende indicatie, duur en type van de registratie en de volgorde van cardiale monitoring-modaliteiten.
Maak een transthoracaal echocardiogram bij patiënten die een TIA of herseninfarct hebben doorgemaakt en waarbij de oorzaak van de TIA of het herseninfarct onbekend is.
Overwegingen
A. Sterk geassocieerde cardiale emboliebron
1 Atriumfibrilleren
De internationaal gehanteerde minimale duur van atriumfibrilleren waarop de diagnose gesteld kan worden is 30 seconden. Door de toegenomen mogelijkheden tot langdurige registratie is duidelijk geworden dat patiënten na een TIA of herseninfarct soms episodes met zeer kortdurend atriumfibrilleren (gedurende seconden) laten zien. Er zijn momenteel geen data bekend die richting geven hoe om te gaan met deze korte episodes van atriumfibrilleren en hoe lang een episode met atriumfibrilleren minimaal moet zijn om een verhoogd risico is op recidief herseninfarct of systemische embolieën te geven en een switch naar therapie met orale anticoagulantia te rechtvaardigen. Voor de literatuuranalyse werd uitgegaan van de diagnose atriumfibrilleren bij detectie hiervan gedurende tenminste 30 seconden.
In de verschillende studies lijken zowel een selectie van patiënten en een registratie met automatische analyse van de geregistreerde ritmes de opbrengst duidelijk te vergroten. De omschrijving van de wijze waarop in de verschillende studies patiënten geselecteerd werden verschilde, maar bij de meeste hield selectie in dat het ging om patiënten met een cryptogenic stroke. In de meeste studies was in de geselecteerde patiëntengroepen met aanvullend onderzoek uitgesloten dat het om een lacunair infarct bij small vessel disease ging, was er geen stenose van 50% of meer op basis van atherosclerose van de extracraniële of intracraniële circulatie gevonden, was er bij een cardiale echo geen verhoogd risico op een cardiale emboliebron anders dan AF gevonden (bijvoorbeeld intracardiale thrombus of mitralisklepstenose of klepvegetaties of recent myocardinfarct of <30% ejectiefractie van het hart of aanwijzingen voor endocarditis) en waren er geen aanwijzingen voor zeldzame oorzaken als dissectie, vasospasme, drugsgebruik.
De geselecteerde groep patiënten die in de meeste studies dan ook overbleef wordt volgens de ‘modified’ TOAST-criteria als ‘with a likely atherothrombotic cause’ ingedeeld (Bousser, 2009). Deze patiënten hebben vaak wel degelijk atherosclerose en meerdere vasculaire risicofactoren waardoor het risico op atriumfibrilleren relatief hoger is, maar de atherosclerose is over het algemeen zogenaamd niet occlusief, met plaques die <50% stenose veroorzaken en gelokaliseerd kunnen zijn in de aortaboog of cervicale of cerebrale arterieën. In deze context lijkt de vrij recent gelanceerde term ‘embolic strokes of undetermined source’ (Hart, 2014) wellicht zelfs beter de lading te dekken voor de patiëntengroep waar uitgebreide monitoring geïndiceerd lijkt dan cryptogenic stroke of stroke with likely atherothrombotic cause. Slechts een beperkt aantal prospectieve cohortstudies naar de opbrengst van transthoracale echocardiografie rapporteren bevindingen waarbij duidelijk is aangegeven hoe de patiënten zijn geselecteerd. Een emboliebron (open foramen ovale of aortaboog atherosclerotische plaque als meest frequente bevinding) werd bij 29% gevonden. Slechts bij 2,5% van de patiënten leidde de bevinding tot verandering in beleid (i.e. start van orale anticoagulantia) (Wilson, 2016).
Of patiënten bij wie zeer kortdurende episodes van paroxysmaal AF worden gedetecteerd door ELR’s of ILR’s een even groot risico op thrombo-embolieën hebben als patiënten bij wie die diagnose op de conventionele manier gesteld is, laat staan of in die situaties een switch naar vitamine K-antagonisten of directe orale anticoagulantia tot werkelijke risicoreductie leidt, is onbekend en dient verder onderzocht te worden. Er zijn een aantal studies verschenen bij patiënten met implanteerbare pacemakers of defibrillatoren - die in het algemeen een hoog risico op thrombo-embolisme hebben - waarin het vangen van zogenaamde episodes van atriale hoge ritme-activiteit gedurende minuten tijdens een follow-up van maanden gepaard ging met een hoger risico op een herseninfarct of overlijden als gevolg van een herseninfarct. Verder verschijnt in 2018 de NAVIGATE ESUS-studie die de DOAC rivaroxaban met acetylsalicylzuur vergelijkt in de secundaire preventie van systemische en hersen-embolieën bij patiënten met een ‘embolic stroke of undetermined source’.
Een kosten-effectiviteitsanalyse, waarbij uitgegaan is van een opbrengst van AF bij ‘outpatient monitoring’ van 5,9% (95% BI 3,6% tot 9,3%) heeft aangetoond dat registratie gedurende zeven dagen met een ELR 44 nieuwe gevallen van atriumfibrilleren zou opsporen per 1000 onderzochte patiënten. Dit zou resulteren in een winst van 34 ‘quality-adjusted life-years (QALY)’ bij een totaalbedrag aan kosten van $440.000,-. De kosten-effectiviteitsratio van een dergelijke registratie zou dan $13.000,- zijn per gewonnen QALY, hetgeen onder de in Nederland gehanteerde grens van €20.000,- per QALY ligt (Kamel, 2010). Er zijn geen kosten-effectiviteitsanalyses gepubliceerd naar het gebruik van ILRs voor detectie van atriumfibrilleren.
Een aantal studies heeft aangetoond dat de detectiekans van AF vergroot kan worden door resultaten verkregen uit telemetrie of door middel van loop recorders automatisch te analyseren (Kallmunzer, 2012). Dit is door ze op te slaan of uit te printen, later te evalueren en gebruik te maken van zogenaamde structurele algoritmes waarin onder andere naar wisselingen in hartfrequentie, periodes met bradycardie en tachycardie, ventriculaire arythmie en onregelmatigheden in RR-intervallen gekeken wordt. Of een dergelijke registratie in de dagelijkse praktijk vanuit een afdeling neurologie (op de stroke unit bij telemetrie en met ELR’s in de poliklinische setting) gerealiseerd kan worden – waar in het algemeen geen verpleegkundigen werken met vergelijkbare kennis als op een coronary care unit en waar een cardioloog ook niet altijd laagdrempelig beschikbaar is – is momenteel niet duidelijk.
In de (poli)klinische praktijk zal er gekozen worden voor een opeenvolging van modaliteiten voor cardiale monitoring, waarbij er voor een meer invasieve methode gekozen zal worden wanneer de verdenking op AF hoger is. Hierdoor is het nog lang niet duidelijk welke methode voor welke patiënt op welk moment het beste is of nog beter welke volgorde van modaliteiten het beste is.
Ook is op basis van de gepubliceerde studies lastig uit te maken wat nu de meest optimale registratieduur is, waarbij registratie, bijvoorbeeld met ELR’s, ook in de praktijk haalbaar en betaalbaar moet zijn. Hiervoor zijn aanvullende studies naar de opbrengst van registratie met ELR’s met verschillende registratietijd nodig, maar vooral ook kosten-effectiviteitsstudies. Op pragmatische gronden adviseert de werkgroep dan ook vooralsnog te streven naar een registratie van tenminste 72 uur. Echter, langduriger monitoring moet overwogen worden om stil atriumfibrilleren op te sporen.
Over de belasting voor de patiënt die ritmeregistratie met een ELR of ILR zou moeten ondergaan is weinig bekend. Men kan er echter wel van uit gaan dat enkele dagen een uitwendig kastje en elektroden dragen en erna uitlezen van de gegevens minder belastend en veel goedkoper is dan het plaatsen van een ILR, het controleren en uitlezen van de gegevens en vervolgens weer verwijderen van de ILR. En dit staat dan nog los van de mogelijk invaliderende en kostbare gevolgen bij complicaties van ILR-gebruik. Echter, het is met een ILR wel mogelijk om veel langer te registreren dan met een ELR (maanden versus dagen of weken). Het is mogelijk dat in toekomstige studies bij langdurig met ILR’s registreren een nog grotere opbrengst van atriumfibrilleren gevonden wordt.
Tenslotte moet aangemerkt worden dat de geselecteerde studies heterogeen waren en onderhevig aan verschillende vormen van bias. Naast verschillende vormen van selectie en registratie en verschillende definities van AF waren ook baselinekarakteristieken vaak onvoldoende gerapporteerd om secundaire analyses te kunnen doen. Dit maakt de generaliseerbaarheid van de resultaten minder.
De bewijskracht voor een RCT start hoog. De bewijskracht voor de uitkomstmaat incidentie atriumfibrilleren is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (er was geen sprake van blindering van arts en behandelaar ten aanzien van de interventie) en wegens heterogeniteit (de minimumleeftijdsgrens verschilde per studie net als de follow-up duur en de meetmethode; bias ten gevolge van indirectheid).
2 Intracardiale trombus
Een intracardiale trombus is een belangrijke bevinding bij patiënten met een herseninfarct. De prevalentie van een intracardiale trombus is sterk afhankelijk van risicofactoren als leeftijd, myocardinfarct, systolische dysfunctie en uitgebreidheid van het infarct en varieert tussen de 7 en 13%. Deze diagnose impliceert een verandering van therapie van plaatjesaggregatieremming naar orale anticoagulantia. Naast medische voorgeschiedenis, anamnese en ECG is transthoracale echocardiografie (TTE) de modaliteit van keuze om dit op te sporen.
A. Linkerventrikelafwijkingen zoals verminderde systolische functie, aneurysmata en cardiomyopathieën zoals de non-compacte cardiomyopathie worden gemakkelijk opgespoord met TTE. Met behulp van contrastmiddelen is de opbrengst nog verder te verhogen. MRI heeft overigens een nog hogere sensitiviteit.
B. Trombus in het hartoor van de linker boezem is een diagnose die vrijwel alleen met TEE kan worden opgespoord. Echter, dit komt vrijwel alleen voor bij patiënten met boezemfibrilleren.
3 Cardiale massa’s
TTE is de modaliteit van keuze om intracardiale tumoren op te sporen door de hoge spatiële en temporele resolutie. Het myxoom is de meest frequente tumor en is meestal in de linker boezem gelegen. Andere tumoren zijn het fibro-elastoom, dat meestal aan een hartklep verbonden is, en metastasen. De behandeling is vrijwel altijd chirurgisch. De diagnose is vrijwel altijd met TTE te stellen. De prevalentie is lager dan 1%. Indien een cardiale massa met TTE niet kan worden uitgesloten is verdere beeldvorming aangewezen.
4 Reumatisch kleplijden (mitralisklepstenose)
Acuut reuma is een immunologische reactie op een infectie met een β-hemolytische streptokok die op latere leeftijd in ongeveer 30% van de gevallen leidt tot hartklepbeschadiging, meestal een mitralisklepstenose. Hoewel de incidentie van acuut reuma in Nederland vrijwel nihil is komt mitralisklepstenose door de toegenomen migratie regelmatig voor. Bij patiënten met een TIA of herseninfarct en een mitralisklepstenose wordt algemeen aanbevolen deze te behandelen met orale anticoagulantia. De diagnose is met TTE te stellen. Veel patiënten met een mitralisklepstenose hebben ook boezemfibrilleren.
5 Atherosclerose van de aorta ascendens en de aortaboog
Atherosclerose van de aorta ascendens en de aortaboog neemt toe met de leeftijd en is geassocieerd met traditionele vasculaire risicofactoren. Het is geassocieerd met coronairlijden en het geeft een verhoogde kans op een TIA of herseninfarct of perifere embolieën. Er wordt vaak een tweedeling gemaakt in atherosclerose en complexe atheromen (mobiele of ulcererende plaques of plaques groter dan 4 mm). De diagnose kan niet altijd worden gesteld met TTE (beperkte window), maar vaak wel met TEE. De beste onderzoeksmodaliteiten zijn MRI en CT omdat hiermee de hele aorta in beeld kan worden gebracht. De prevalentie van complexe atherosclerotische plaques loopt sterk uiteen variërend van 1 tot 40% en is afhankelijk van patiëntkenmerken. De behandeling van complexe atheroma bij patiënten lijkt niet anders dan bij de kleinere plaques. De ARCH-trial waarbij acenocoumarol vergeleken werd met carbasalaatcalcium in combinatie met clopidogrel gaf een niet statistisch significant verschil in event rate van 11,3% en 7,6% respectievelijk. De bloedingsrisico’s kunnen de voordelen van de behandeling met orale anticoagulantia van mobiele trombi in de aorta ascendens en boog gemakkelijk overstijgen.
6 Endocarditis
Endocarditis is vrijwel altijd een bacteriële infectie van meestal de links gelegen hartkleppen met een klinisch beeld variërend van chronisch (endocarditis lenta) met koorts, malaise en nachtzweten tot vrij acuut. De diagnose wordt gesteld aan de hand van de Dukes-criteria waarbij echocardiografie (TTE en TEE) een cruciale rol speelt. De behandeling is primair met antibiotica, maar bij complicaties moet de patiënt geopereerd worden aan zijn hartklep. Marantische endocarditis is een niet-bacteriële ontsteking van de hartklep, die gezien kan worden bij aandoeningen als SLE. Deze dient onder meer behandeld te worden met orale anticoagulantia. Het initiële onderzoek van keuze is TTE. Echter, bij een negatieve TTE en een hoge klinische verdenking op endocarditis is een TEE aangewezen. De prevalentie is lager dan één procent.
7 Mechanische klepprothesen
Bij patiënten met een kunstklep en een TIA of herseninfarct moet de verdenking op een trombo-embolische oorzaak hoog zijn. Het risico daarop is groter a) bij een ouder type kunstklep, b) indien de INR niet goed ingesteld was in de weken voor de TIA of het herseninfarct, c) als de behandeling met orale anticoagulantia recent onderbroken was, d) als de klep in mitraliskleppositie zit, e) als er tevens sprake is van cardiale morbiditeit die reeds geassocieerd is met een trombo-embolie zoals een verminderde LV functie en boezemfibrilleren en f) bij zwangerschap. TTE zal bij een obstructieve trombus een verhoogde gradiënt vaststellen en een verlaagd openingsoppervlak. Bij een niet-obstructieve trombus is meestal een TEE aangewezen voor het stellen van de diagnose. Er zal dan gezien worden dat een leaflet minder beweegt, er is een trombus te zien, er zijn abnormale lekkage-jets (door de kunstklep) ontstaan. Eventueel kunnen fluorscopie (röntgendoorlichting) en een CT-scan bijdragend zijn in de diagnose. De behandeling bestaat uit heparine, toevoegen van plaatjesaggregatieremmers of chirurgie. Een andere belangrijke complicatie bij mechanische klepprothesen is de zogenaamde kunstklep-endocarditis. Hierbij past een klinisch beeld van koorts en positieve bloedkweken. Echocardiografie (zowel de TTE als de TEE) speelt hier een sleutelrol. De behandeling is zoals bij punt 6 vermeld.
8 Atriumseptumdefect
Patiënten met een atriumseptumdefect hebben meestal een links-rechts shunt. Bij drukverhogende momenten maar ook soms zonder uitlokkende factor kan er een kortdurende rechts-links shunt ontstaan. Door de afwezigheid van een deel van het atriumseptum kan hierdoor een veneuze trombo-embolie naar de linkerboezem komen die een TIA of herseninfarct kan veroorzaken. De ESC-richtlijnen voor volwassenen met aangeboren hartafwijkingen adviseren dan ook elk atriumseptumdefect bij patiënten met een TIA of herseninfarct te sluiten met een device (IIa). De diagnose wordt gesteld met TTE met gebruik van contrast. Een TEE bevestigt de diagnose waarbij er dan een defect zit meestal in de fossa ovalis. De prevalentie is kleiner dan 1%.
B. Mogelijke of onzekere cardiale emboliebron
Het betreft mitralisklep-prolaps, mitralisklep-annulus-calcificaties, aortaklepsclerose en -stenose, atriumseptum-aneurysma en patent formamen ovale (PFO). Deze aandoeningen hebben een zwakke associatie met het optreden van een vaak als cryptogeen omschreven TIA of herseninfarct. De meeste diagnoses zijn bij een acceptabel echovenster met TTE gemakkelijk te diagnosticeren. Een TEE heeft meerwaarde voor de anatomie van het intra-atriale septum-aneurysma en het PFO. Van deze aandoeningen is de betekenis onzeker en er is in het algemeen bij een eerste TIA of herseninfarct geen bewijs dat een wijziging van de standaardbehandeling zinnig is.
Patent foramen ovale
Het patent foramen ovale (PFO) is lange tijd als belangrijke oorzaak van een TIA of herseninfarct gezien. Het komt voor bij 25 tot 30% van de bevolking met een hogere prevalentie bij patiënten met een cryptogene stroke. Het is een spleetvormige opening ter plaatse van de fossa ovalis. De diagnose is vrij gemakkelijk te stellen met TTE door geagiteerd fysiologisch zout te injecteren in een armvene en vervolgens vast te stellen of de echogene bubbels het atriale septum passeren. In uitzonderlijke gevallen is een TEE noodzakelijk. Recent zijn er drie grote RCT’s geweest waarbij patiënten met een herseninfarct en een PFO gerandomiseerd werden naar sluiting middels een zogenaamd ‘closure device’ of medicamenteuze therapie. Bij de intention-to-treat analyse kwam er geen voordeel uit van de sluiting middels een device. Een recent ontwikkeld concept is om een schatting te maken van de bijdrage van een PFO in een cryptogene TIA of herseninfarct met behulp van de RoPe-score waarin een optelsom van leeftijd, vasculaire risicofactoren en embolisch event wordt gemaakt en daarmee wordt ingeschat hoe groot de kans is dat een recidief TIA of herseninfarct een atherosclerotische oorzaak heeft dan wel gerelateerd zou zijn aan het PFO. Aan de hand hiervan kan een schatting gemaakt worden van de kans dat het PFO een rol heeft gespeeld. Bewijs dat sluiten van het PFO bij patiënten met een hoge RoPe-score (grote bijdrage van het PFO) effectief is in de preventie van een recidief herseninfarct is er echter (nog) niet (Elmariah, 2014).
Verdere beeldvorming
Een TEE is een semi-invasief onderzoek dat het hart bestudeert vanaf de oesofagus. Het heeft een zeer hoge resolutie. Het is dus zeer geschikt om cardiale emboliebronnen op te sporen. Bij een trombus in het hartoor is het TEE veruit superieur boven TTE. Echter, een trombus hierin komt vrijwel alleen voor bij patiënten met boezemfibrilleren of een mitralisklepstenose of kunstkleppen die daarom reeds een indicatie voor orale anticoagulantia hebben. Met TEE kunnen ook eenvoudige en complexe (>4 mm) atheromen in de aorta ascendens en de aortaboog worden opgespoord. Echter, de huidige MRI- en CT-scanners hebben een hogere sensitiviteit en specificiteit, en omdat TEE ook niet de gehele ascenderende aorta kan onderzoeken lijkt de indicatie hiervoor geleidelijk te vervallen. Omdat er geen voordeel is aangetoond van een behandeling met orale anticoagulantia boven de standaardbehandeling bij complexe atheromen is de meerwaarde om dit te onderzoeken beperkt (Pepi, 2010).
Bij patiënten met een TIA of herseninfarct zonder duidelijke oorzaak is echocardiografie aangewezen, omdat er verscheidene bevindingen zijn die maken dat de behandeling daarmee verandert. Transthoracale echocardiografie is in het overgrote deel van de gevallen voldoende.
Onderbouwing
Achtergrond
Een embolie van cardiale oorsprong is de oorzaak van ongeveer 15 tot 30% van TIA’s en herseninfarcten. De diagnose van een cardiale oorsprong van de embolie is vaak onzeker. Hier wordt vaak naar gezocht als er geen aanwijzingen zijn voor een (atherosclerotische) stenose in de halsslagaders. Voor de in frequentie belangrijkste cardiale emboliebron, atriumfibrilleren (AF), geldt dat deze vaak samen voorkomt met atherosclerotisch vaatlijden. Beide aandoeningen nemen in frequentie toe met de leeftijd. Er is momenteel een grote ontwikkeling gaande om patiënten met (paroxysmaal) AF te diagnostiseren.
Er zijn verschillende cardiale aandoeningen geassocieerd met een herseninfarct door een cardiale embolie. Veel van die aandoeningen zijn reeds bekend (hartfalen, atriumfibrilleren, een mechanische hartklep), worden bij presentatie gediagnosticeerd (atriumfibrilleren) of hebben vaak een typisch klinisch beloop (bijvoorbeeld endocarditis).
Er wordt in het algemeen een onderscheid gemaakt in de mate waarin cardiale afwijkingen geassocieerd zijn met een TIA of herseninfarct. Voor deze aandoeningen is er een specifiek behandelingsvoorschrift, zoals orale anticoagulantia (atriumfibrilleren, klepprothesen), hartoperatie (tumoren), enzovoorts. Daarnaast bestaan er een aantal afwijkingen die een mogelijke of onzekere cardiale emboliebron vormen.
Conclusies / Summary of Findings
|
Laag GRADE |
Huidige internationale richtlijnen bevelen aan om bij patiënten na een herseninfarct tenminste een 12-afleidingen electrocardiografie (ECG) en tenminste 24-uur cardiale monitoring te verrichten voor detectie van hartritmestoornissen en in het bijzonder atriumfibrilleren (AF).
Bronnen (Sanna, 2014; Higgins, 2014; Gladstone, 2013) |
|
Laag GRADE |
Er is onderzoek gedaan naar de detectie van AF in een geselecteerde patiëntenpopulatie. Dit betreft patiënten die een cryptogene TIA of herseninfarct doormaakten waarbij de volgende definitie is gebruikt: patiënten bij wie met aanvullend onderzoek uitgesloten is dat het om een lacunair infarct ging, geen >50% stenose op basis van atherosclerose van de extracraniële of intracraniële circulatie is gevonden, bij een cardiale echo geen verhoogd risico op een cardiale emboliebron anders dan AF is gevonden (bijvoorbeeld intracardiale trombus of mitralisklepstenose of klepvegetaties of recent myocardinfarct of <30% ejectiefractie van het hart of aanwijzingen voor endocarditis) en waren er geen aanwijzingen voor zeldzame oorzaken als dissectie, vasospasme, drugsgebruik.
Bronnen (Sanna, 2014; Higgins, 2014; Gladstone, 2013) |
|
Laag GRADE |
Bij patiënten met een cryptogene TIA of herseninfarct verhoogt ritmeregistratie naar (paroxysmaal) atriumfibrilleren gedurende minimaal zeven dagen met behulp van cardiale monitoring, Holter-ECG of een zgn external of internal loop recorder de detectiegraad van AF. Bewijs voor betere uitkomsten tengevolge van een wijziging in beleid naar aanleiding van het detecteren van AF met deze methoden ontbreekt echter (nog).
Bronnen (Sanna, 2014; Higgins, 2014; Gladstone, 2013) |
|
Laag GRADE |
Hierbij lijkt de opbrengst groter te zijn naarmate de lengte van de registratieperiode groter is, en er automatische analyse van de geregistreerde ritmes plaatsvindt. Het is nog niet duidelijk welke registratieduur voor welke patiënt het meest geschikt is,
Bronnen (Sanna, 2014; Higgins, 2014; Gladstone, 2013) |
|
Laag GRADE |
Het is tevens nog niet duidelijk welke methode van detectie, namelijk met behulp van external loop recorders of implanteerbare devices ofwel implantable loop recorders het meest geschikt is.
Bronnen (Sanna, 2014; Higgins, 2014; Gladstone, 2013) |
|
Laag GRADE |
Ook is nog niet duidelijk welke volgorde van cardiale monitoring-modaliteiten het meest geschikt is om tegen zo laag mogelijke kosten zo veel mogelijk patiënten met paroxysmaal AF te vangen.
Bronnen (Sanna, 2014; Higgins, 2014; Gladstone, 2013) |
|
Laag GRADE |
Bij het zoeken naar de etiologie van een TIA of herseninfarct wordt frequent een cardiale oorzaak gevonden. Op basis van de klinische voorgeschiedenis en met onderzoek naar ritmestoornissen zullen de meeste cardiale oorzaken al gevonden worden. Er zijn echter een aantal cardiale afwijkingen met een sterke associatie met een cardiale emboliebron waarbij de diagnose gesteld kan worden met transthoracale echografie. Voor sommige oorzaken zal dit consequenties hebben voor de behandeling. In verreweg de meerderheid van de gevallen zal een transthoracaal echogram (TTE) volstaan. |
Samenvatting literatuur
Beschrijving studies
Literatuurstudie vanaf het jaar 2007 leverde één review-artikel (Kishore, 2014) en drie gerandomiseerde onderzoeken (Sanna, 2014; Higgins, 2013; Gladstone, 2014) en 13 prospectieve cohortstudies op. De studies waren heterogeen met betrekking tot de patiëntenpopulatie. In de studies verschilden zowel in methoden en duur van registratie van het hartritme (electrocardiografie (ECG), Holter, ‘external loop recorders’ (ELR), ‘implantable loop recorder’ (ILR)) als in methoden van selectie van patiënten, zoals verschillende minimumleeftijd en het wel of niet (en op verschillende wijze) uitgesloten hebben van andere oorzaken voor de TIA of het herseninfarct. Ook de minimaal vereiste duur van het atriumfibrilleren om deze diagnose te stellen, verschilde.
Resultaten
In de recente meta-analyse (Kishore, 2014) werden 32 studies geïncludeerd, dit betrof voornamelijk cohortonderzoeken. De omschrijving van hoe selectie plaatsvond in de zogenaamde geselecteerde patiëntengroepen ging niet veel verder dan dat het ging om patiënten met een zogenaamde ‘cryptogenic stroke’. De detectiegraad bij een registratieduur van 24 uur tot maximaal zeven dagen in ongeselecteerde patiënten was in deze review 6,2% (95% BI 4,4% tot 8,3) en in een geselecteerde patiëntengroep bij een registratieduur van 24 uur tot maximaal 30 dagen en hiernaast registratie met ILR’s 13,4% (95% BI 9,0% tot 18,4%). Nieuwere, prospectieve studies, die drie tot zeven dagen klinische cardiale monitoring of Holter ECG-registratie hebben toegepast, toonden een detectiegraad variërend tussen 4 en 21% (Manina, 2014; Grond, 2013; Suissa, 2013; Rizos, 2012; Suissa, 2014). Deze nieuwere prospectieve studies laten ook een meerwaarde van langduriger registreren met ELR’s zien met een opbrengst van 13 tot 21% met 7 dagen en 11 tot 16% met 30 dagen registreren (Flint, 2012; Kallmunzer, 2012; Lazzaro, 2012; Rizos, 2010; Gaillard, 2010; Lazzaro, 2012).
De review van Kishore includeerde studies gepubliceerd t/m 1 januari 2013. Sindsdien zijn drie RCTs verschenen: de EMBRACE-studie, een gerandomiseerd onderzoek uitgevoerd door Higgins et al. en de CRYSTAL AF-studie (Sanna, 2014; Higgins, 2013; Gladstone, 2014).
De EMBRACE-studie randomiseerde 571 patiënten van 55 jaar of ouder na een cryptogeen herseninfarct of TIA in de voorgaande zes maanden. Dit gebeurde gemiddeld 75 dagen na het event (Gladstone, 2014). Hierbij was het van belang dat de etiologie in kaart gebracht was. In de interventiegroep kreeg men een ambulatory ECG met een event-triggered loop recorder die 30 dagen registreerde. De controlegroep onderging naast de standaard workup van ECG en 24-uurs Holter-monitoring nog een extra 24-uurs Holter-monitoring. De belangrijkste uitkomstmaat was atriumfibrilleren (AF) gedurende minstens 30 seconden. De follow-up duur was 90 dagen. In de interventiegroep werd bij 16% (45/280) van de patiënten atriumfibrilleren gedetecteerd binnen 90 dagen, vergeleken met bij 3% (9/277) in de controlegroep. Dit betrof een verschil van 12,9% (95% BI 8,0 tot 17,6; p<0,001).
De CRYSTAL AF-studie randomiseerde 441 patiënten van 40 jaar of ouder na een cryptogeen herseninfarct of TIA in de voorafgaande 90 dagen (Sanna, 2014). Dit gebeurde gemiddeld 38 dagen na het event. In de interventiegroep kreeg men lange-termijn monitoring met een insertable cardiac monitor. In de controlegroep kregen patiënten ECG en/of Holter-monitoring naar invulling van de lokale onderzoeker maar precieze gegevens (type, duur) hierover worden in het artikel niet vermeld. De belangrijkste uitkomstmaat was AF gedurende minstens 30 seconden. Het primaire eindpunt van deze studie lag op zes maanden. In de interventiegroep werd bij 8,6% (19/221) van de patiënten atriumfibrilleren gedetecteerd vergeleken met bij 1,4% (3/220) in de controlegroep. De bijbehorende hazard ratio was 6,4 (95% BI 1,9 tot 21,7; p<0,001). De resultaten na 12 maanden follow-up zijn ook beschreven. In de interventiegroep werd bij 13% (29/221) van de patiënten atriumfibrilleren gedetecteerd vergeleken met 2% (4/220) in de controlegroep. De bijbehorende hazard ratio was 7,3 (95% BI 2,6 tot 20,8; p<0,001). In deze studie was in het nog maar resterende 1/8 deel van de patiënten die drie jaar waren gevolgd de detectiegraad 30%.
De RCT van Higgins randomiseerde 100 patiënten van 50 jaar en ouder binnen zeven dagen na een herseninfarct (Higgins, 2013). Dit betrof een pilot van 100 patiënten in een trial die uiteindelijk 5.000 patiënten zal includeren. Patiënten in de interventiegroep kregen het standaard onderzoek en daarnaast werd gedurende zeven dagen gemeten met zogenaamde noninvasive cardiac-event monitoring met een device, in de controlegroep werd uitsluitend het standaard onderzoek uitgevoerd betreffende een ECG bij opname, 24-uurs Holter-monitoring en nog een ECG. De belangrijkste uitkomstmaat was AF gedurende minimaal 20 seconden (de lengte van de strip van het device na triggering), primair na 14 dagen follow-up, maar er werden tevens gegevens verzameld na 90 dagen follow-up. In de interventiegroep werd na 14 dagen bij 18% (8/50) van de patiënten atriumfibrilleren met een minimale duur van 20 seconden gedetecteerd vergeleken met bij 2% (1/50) in de controlegroep. Het bijbehorende gemiddelde verschil betrof 16% (95% BI 4,7% tot 27,3%; p<0,05). Na 90 dagen was de detectiegraad van atriumfibrilleren met een minimale duur van 20 seconden 22% (22/100) in de interventiegroep versus 8% (8/100) in de controlegroep. Het bijbehorende gemiddelde verschil bedroeg 14% (95% BI 0,0% tot 27,7%; p=0,09).
De gepoolde resultaten van deze drie gerandomiseerde studies zijn te zien in figuur 1.
Figuur 1

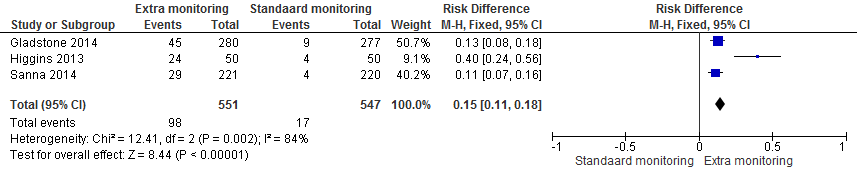
De follow up van zowel de EMBRACE-studie als de studie van Higgins was 90 dagen. In de CRYSTAL-AF studie was het primaire eindpunt het detectiepercentage na 6 maanden en één van de secundaire eindpunten dat na 12 maanden. Voor bovenstaande analyse werd een ‘random effects’ model gekozen vanwege heterogeniteit tussen de studies mbt methode en duur van registratie van het hartritme en verschillen in de selectie van patiënten zoals vereiste minimumleeftijd.
Het gepoolde risicoverschil bedroeg 15% (95% BI 11 tot 18%), dat wil zeggen dat de detectiekans bij extra monitoring 15% hoger is. Vooralsnog zijn er geen overtuigende aanwijzingen dat de dure methode van de ILR de opbrengst veel verder verhoogt dan het zeven tot 30 dagen registreren met een ELR.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de vraagstelling: wat is het effect van extra ritmebewaking met ECG, Holter, external loop recorders (ELR) of implantable loop recorders (ILR)) versus standaard ritmebewaking bij patiënten die een herseninfarct hebben doorgemaakt op de detectie van (paroxysmaal) atriumfibrilleren?
Bij deze uitgangsvraag is het van belang dat in de meeste onderzochte studies patiënten werden geïncludeerd met een cryptogenic stroke. De term cryptogenic stroke is als volgt gedefinieerd: er was met aanvullend onderzoek uitgesloten dat het om een lacunair infarct bij small vessel disease ging, er was geen stenose van 50% of meer op basis van atherosclerose van de extracraniële of intracraniële circulatie gevonden, er was bij een cardiale echo geen verhoogd risico op een cardiale emboliebron anders dan AF gevonden (bijvoorbeeld intracardiale thrombus of mitralisklepstenose of klepvegetaties of recent myocardinfarct of <30% ejectiefractie van het hart of aanwijzingen voor endocarditis) en er waren geen aanwijzingen voor andere oorzaken als dissectie, vasospasme, drugsgebruik.
PICO:
P patiënten met herseninfarct;
I extra ritmebewaking met ECG, Holter, ‘external loop recorders’ (ELR), implantable loop recorder’ (ILR);
C standaard ritmebewaking;
O (paroxysmaal) atriumfibrilleren.
In de databases Medline (OVID), Embase and Cochrane is met relevante zoektermen gezocht naar: stroke, cerebral infarction, TIA, electrocardiography, Holter, ECG, loop recorder. De zoekverantwoording is weergegeven in de bijlage. De literatuurzoekactie leverde 2087 treffers op vanaf 2007. In eerste instantie werden 21 fulltext onderzoeken opgevraagd en geanalyseerd, uiteindelijk werden hiervan 17 geselecteerd.
Referenties
- Bousser MG, Amarenco P, Chamorro A, et al. Rationale and design of a randomized, double-blind, parallel-group study of terutroban 30 mg/day versus aspirin 100 mg/day in stroke patients: the prevention of cerebrovascular and cardiovascular events of ischemic origin with terutroban in patients with a history of ischemic stroke or transient ischemic attack (PERFORM) study. Cerebrovasc.Dis. 2009;27(5):509-518.
- Elmariah S, Furlan AJ, Reisman M, et al. Predictors of recurrent events in patients with cryptogenic stroke and patent foramen ovale within the CLOSURE I (Evaluation of the STARFlex Septal Closure System in Patients With a Stroke and/or Transient Ischemic Attack Due to Presumed Paradoxical Embolism Through a Patent Foramen Ovale) trial. JACC Cardiovasc Interv. 2014;7(8):913-20.
- Flint AC, Banki NM, Ren X, et al. Detection of paroxysmal atrial fibrillation by 30-day event monitoring in cryptogenic ischemic stroke: the Stroke and Monitoring for PAF in Real Time (SMART) Registry. Stroke. 2012;43(10):2788-2790.
- Gaillard N, Deltour S, Vilotijevic B, et al. Detection of paroxysmal atrial fibrillation with transtelephonic EKG in TIA or stroke patients. Neurology. 2010;74(21):1666-1670.
- Gladstone DJ, Spring M, Dorian P, et al. Atrial fibrillation in patients with cryptogenic stroke. N.Engl.J.Med. 2014;370(26):2467-2477.
- Grond M, Jauss M, Hamann G, et al. Improved detection of silent atrial fibrillation using 72-hour Holter ECG in patients with ischemic stroke: a prospective multicenter cohort study. Stroke. 2013;44(12):3357-3364.
- Hart RG, Diener HC, Coutts SB, et al. Embolic strokes of undetermined source: the case for a new clinical construct. Lancet Neurol. 2014;13(4):429-438.
- Higgins P, MacFarlane PW, Dawson J, et al. Noninvasive cardiac event monitoring to detect atrial fibrillation after ischemic stroke: a randomized, controlled trial. Stroke. 2013;44(9):2525-2531.
- Kallmunzer B, Breuer L, Hering C, et al. A structured reading algorithm improves telemetric detection of atrial fibrillation after acute ischemic stroke. Stroke. 2012;43(4):994-999.
- Kamel H, Hegde M, Johnson DR, et al. Cost-effectiveness of outpatient cardiac monitoring to detect atrial fibrillation after ischemic stroke. Stroke. 2010;41(7):1514-1520.
- Kishore A, Vail A, Majid A, et al. Detection of atrial fibrillation after ischemic stroke or transient ischemic attack: a systematic review and meta-analysis. Stroke. 2014;45(2):520-526.
- Lazzaro MA, Krishnan K, Prabhakaran S. Detection of atrial fibrillation with concurrent holter monitoring and continuous cardiac telemetry following ischemic stroke and transient ischemic attack. J.Stroke Cerebrovasc. Dis. 2012;21(2):89-93.
- Manina G, Agnelli G, Becattini C, et al. 96 hours ECG monitoring for patients with ischemic cryptogenic stroke or transient ischaemic attack. Intern.Emerg.Med. 2014;9(1):65-67.
- Rizos T, Guntner J, Jenetzky E, et al. Continuous stroke unit electrocardiographic monitoring versus 24-hour Holter electrocardiography for detection of paroxysmal atrial fibrillation after stroke. Stroke. 2012;43(10):2689-2694.
- Rizos T, Rasch C, Jenetzky E, et al. Detection of paroxysmal atrial fibrillation in acute stroke patients. Cerebrovasc.Dis. 2010;30(4):410-417.
- Sanna T, Diener HC, Passman RS, et al. Cryptogenic stroke and underlying atrial fibrillation. N.Engl.J.Med. 2014;370(26):2478-2486.
- Suissa L, Lachaud S, Mahagne MH. Continuous ECG monitoring for tracking down atrial fibrillation after stroke: Holter or automated analysis strategy? Eur.Neurol. 2014;72(1-2):7-12.
- Suissa L, Lachaud S, Mahagne MH. Optimal timing and duration of continuous electrocardiographic monitoring for detecting atrial fibrillation in stroke patients. J.Stroke Cerebrovasc.Dis. 2013;22(7):991-995.
- Wilson C, Tai W, Desai J. Diagnostic Yield of Echocardiography in Transient Ischemic Attack. J Stroke and Cerebrovascular Diseases. 2016;25(5):1135-1140.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 26-10-2017
Beoordeeld op geldigheid : 12-09-2024
De ontwikkelingen op het gebied van de acute opvang, secundaire preventie en revalidatie volgen elkaar in steeds sneller tempo op. Daarom werd in 2018 een kerngroep van neurologen, revalidatiearts en huisarts geïnstalleerd om snel op nieuwe ontwikkelingen te kunnen inspelen. In 2018 werden de modules over plaatjesaggregatieremmers en Directe Orale Anticoagulantia geupdate en nieuwe modules over tenecteplase en endovasculaire behandeling ontwikkeld. In 2019 wordt opnieuw geprioriteerd welke wijzigingen nodig zijn.
Deze kerngroep vergadert tenminste tweemaal per jaar om op basis van eigen inzichten en/of signalen uit het veld te beoordelen of hernieuwde aanvulling en/of revisie van (onderdelen van) de richtlijn gewenst is. Andere disciplines namen zitting in een klankbordgroep en worden betrokken afhankelijk van het onderwerp van de te reviseren module.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Op sommige plaatsen in deze richtlijn wordt verwezen naar de richtlijn Beroerte uit 2008. Het hoofdstuk Verantwoording uit deze richtlijn is op te vragen bij de Nederlandse Vereniging voor Neurologie.
In samenwerking met:
Koninklijk Nederlands Genootschap voor Fysiotherapie
Nederlands Huisartsen Genootschap
Nederlands Instituut van Psychologen
Nederlandse Vereniging voor Logopedie & Foniatrie
Nederlandse Vereniging voor Klinische Neurofysiologie
Nederlandse Vereniging voor Spoedeisende Hulp Artsen
Verenso Vereniging van Specialisten Ouderengeneeskunde
Verpleegkundigen & Verzorgenden Nederland (Neuro/stroke verpleegkundigen en Ambulancezorg)
Nederlandse Vereniging voor Ergotherapie
Doel en doelgroep
Doel
Het doel van deze op wetenschappelijk bewijs gebaseerde (evidence based) richtlijn is het bieden van een basis voor optimale zorg voor patiënten met een herseninfarct of hersenbloeding. Daarnaast draagt de richtlijn bij aan afstemming van de zorg tussen de verschillende zorgverleners en aan het terugdringen van ongewenste praktijkvariatie.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met een herseninfarct of hersenbloeding.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met TIA, herseninfarct of hersenbloeding. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende drie jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- prof. dr. D.W.J. Dippel (voorzitter), neuroloog, Erasmus MC Rotterdam, namens de Nederlandse Vereniging voor Neurologie (NVN)
- dr. H.B. van der Worp, neuroloog, UMC Utrecht, namens de NVN
- dr. J. Hofmeijer, neuroloog, Rijnstate ziekenhuis Arnhem, namens de NVN
- dr. R.M. van den Berg-Vos, neuroloog, OLVG West Amsterdam, namens de NVN
- dr. E.J. van Dijk, neuroloog, Radboudumc Nijmegen, namens de NVN
- M. Geurts, AIOS neurologie, UMC Utrecht, namens de NVN en de Vereniging Arts-Assistenten in opleiding tot Neuroloog (VAAN)
- prof. Dr. W. Mess, neuroloog/klinisch neurofysioloog, Maastricht UMC, namens de NVN
- dr. L.M.L. de Lau, neuroloog, Slotervaartziekenhuis Amsterdam, namens de NVN
- M. Kouwenhoven, revalidatiearts, De Hoogstraat Utrecht, namens de Nederlandse Vereniging van Revalidatiearsten (VRA)
- dr. B.J. Bouma, cardioloog, AMC Amsterdam, namens de Nederlandse Vereniging voor Cardiologie (NVvC)
- prof. dr. G.J. de Borst, vaatchirurg, UMC Utrecht, namens de Nederlandse Verenging voor Vaatchirurgie (NVvV)/Nederlandse Vereniging voor Heelkunde (NVvH)
- dr. J.A.H.R. Claassen, klinisch geriater, Radboudumc Nijmegen, namens de Nederlandse Vereniging voor Klinische Geriatrie (NVKG)
- dr. M. van Eijk, specialist ouderengeneeskunde, LUMC Leiden, namens Verenso Vereniging van Specialisten Ouderengeneeskunde
- dr. B.J.H. van den Born, internist, AMC Amsterdam, namens de Nederlandse Internisten Vereniging (NIV)/ Internistisch Vasculair Genootschap (IVG)
- dr. H.D. Boogaarts, neurochirurg, Radboudumc Nijmegen, namens de Nederlandse Vereniging voor Neurochirurgie (NVvN)
- dr. W. van Zwam, radioloog, Maastricht UMC, namens de Nederlandse Vereniging voor Radiologie (NVvR)
- I. Brummer, SEH-arts, Scheper ziekenhuis Emmen, namens de Nederlandse Vereniging van Spoedeisende Hulp Artsen (NVSHA)
- prof. dr. G. Kwakkel, hoogleraar neurorevalidatie, Vrije Universiteit Amsterdam, namens het Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF)
- A.F.E. Verburg, huisarts, namens het Nederlands Huisartsen Genootschap (NHG)
- K. Kanselaar, MANP, verpleegkundig specialist vasculaire neurologie Radboudumc Nijmegen, namens Verpleegkundigen & Verzorgenden Nederland (V&VN) afdeling Neuro & Revalidatie, werkgroep CVA
- G.J. Deddens, Verpleegkundig Specialist Acute Zorg, namens V&VN afdeling Ambulancezorg
- prof. dr. C.M. van Heugten, hoogleraar klinische neuropsychologie, Maastricht University, namens het Nederlands Instituut van Psychologen (NIP) sectie neuropsychologie.
- dr. S.K. Schiemanck, revalidatiearts, Leiden UMC, namens de VRA
- A. Harbers, klinisch linguist en logopediste, Klimmendaal, namens Nederlandse Vereniging voor Logopedie en Foniatrie (NVLF)
Met medewerking van
- dr. P.J. Nederkoorn, neuroloog, Academisch Medisch Centrum, Amsterdam
- dr. E. Steultjens, Hogeschool van Arnhem en Nijmegen, namens Ergotherapie Nederland
- E. van Gorp, namens de Patiëntenvereniging Hersenletsel.nl
- dr. R.H. Wimmers, namens de Hartstichting
- Ir. K. Idema, namens de Hart&Vaatgroep
Met ondersteuning van
- dr. M. Molag, adviseur, Kennisinstituut van Medisch Specialisten
- dr. I. Mostovaya, adviseur, Kennisinstituut van Medisch Specialisten
- dr. M. A. Pols, senior adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen door middel van reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten, een overzicht vindt u hieronder.
|
Werkgroeplid |
Functie |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
|
Berg-Vos |
Neuroloog |
Geen |
Geen |
Bestuurslid kennisnetwerk CVA |
Geen |
Geen |
Geen |
|
Boogaarts |
Neurochirurg |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Born |
Internist-vasculair geneeskundige |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Borst |
Vaatchirurg |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Bouma |
Cardioloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Brummer |
SEH-arts |
Geen |
Geen |
Lid richtlijnencommissie NVSHA |
Geen |
Geen |
Geen |
|
Claassen |
Klinisch geriater (0,6 fte) |
Geen |
Geen |
Geen |
Onderzoeksleider van 3 onderzoeksprojecten, (mede)gefinancierd door het onderzoeksfonds van Alzheimer Nederland (patiëntenvereniging), en 1 project gefinancierd door ISAO (Alzheimerfonds) |
Geen |
Mijn werkgever (Radboudumc) heeft financiele vergoedingen ontvangen van bedrijven (farmaceutische industrie) voor presentaties die ik op uitnodiging van die bedrijven heb gegeven, of voor symposia die ik voor die brdrijven heb (nede)georganiseerd. De vergoeding betrof steeds een vergoeding voor de gewerkte uren. |
|
Deddens |
Verpleegkundige Specialist Acute Zorg en Ambulanceverpleegkundige |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Dippel |
Neuroloog, hoogleraar acute behandeling neurovasculaire aandoeningen |
Geen |
Geen |
Niet van toepassing |
Het MR CLEAN onderzoek (www.mrclean-trial.org) wordt in geringe mate (10%) zonder voorwaarden gesteund door enkele medische industriën en importeurs. Deze staan vermeld op de website. Ik ben een van de hoofdonderzoekers van deze trial. |
Geen |
Geen |
|
Geurts |
AIOS neurologie |
Geen |
Geen |
Geen |
M. Geurts is studie-coordinator van de COOLing for Ischaemic Stroke Trial (COOLIST), dat wordt gefinancierd door de Nederlandse Hartstichting (2010B239). |
Geen |
Geen |
|
Harbers |
Logopediste & Klinisch Linguist |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Hofmeijer |
Neuroloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Kanselaar-Martens |
Verpleegkunde specialist Radboudumc |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Kwakkel |
Hoogleraar Neurorevalidatie |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Schiemanck |
Revalidatiearts Tot 31-12-2014: AMC ; Medisch Leidinggevende Neuroteam, AMC; Consulent Revalidatiegeneeskunde aan Zorgcentrum Berkenstede, Stichting Cordaan, Diemen, sinds 01-07-2006, Heden: subafdelingshoofd Leids Universitair Medisch Centrum |
Geen |
Geen |
Geen |
* Onderzoeksproject ism Radboudumc Efficacy of functional electrical stimulation of the peroneal nerve with the Actigait system on walking efficiency and patient satisfaction in stroke patients suffering from a drop foot, 2007-2014; studie is afgerond; financiering door Otto Bock Healthcare |
Geen |
Geen |
|
Spruit-Van Eijk |
Specialist Ouderengeneeskunde en UD PHEG |
Geen |
Geen |
Geen |
2007 - 2012 GRAMPS studie gefinancierd door 2 grote zorginstanties de Zorgboog en SVRZ, zorgt in Zeeland |
Geen |
Geen |
|
Van den Born |
internist |
Geen |
Geen |
Bestuurslid van de Nederlandse Hypertensievereniging |
Geen |
Geen |
Geen |
|
Van Dijk |
Neuroloog |
Geen |
Geen |
Bestuurslid Stafconvent Radboudumc: betaald |
Onderzoek naar effectiviteit en veiligheid DOACs in Nederland (gefinancierd door GGG-ZonMw / VWS): 110Keuro |
Geen |
Geen |
|
Van Heugten |
Psycholoog, hoogleraar Klinisch Neuropsychologie |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Verburg |
Wetenschappelijk medewerker en |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Zwam |
Radioloog |
Geen |
Geen |
Geen |
Stuurgroeplid MrClean studie |
Geen |
Geen |
Meelezers
|
Werkgroeplid |
Functie |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
|
Idema |
Beleidsadviseur (De Hart&Vaatgroep) |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Kouwenhoven |
Revalidatiearts |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Steultjens |
ass. Lector Neurorevalidatie |
Geen |
Geen |
lid raad van advies Ergotherapie Nederland |
Geen |
eigen onderneming gericht op bijscholing aan ergotherapeuten m.b.t. twee specifieke methoden van diagnostiek en interventie ook toepasbaar bij cliënten na bereorte. Scholing is niet gericht op toepassing multi-disciplinaire richtlijnen |
Geen |
|
Van Gorp-Clion |
Tot 1 juli 2014 Voorzitter, daarna bestuurslid |
Geen |
Doelgroep/ achterban van de patiëntenvereniging |
Belangen van CVA-patiënten bij de patiëntenorganisatie |
Geen |
Geen |
Geen |
|
Wielemaker |
Hoofd patiëntenzorg Hersenstichting Nederland |
Geen |
Geen |
Geen |
Geen deelname aan onderzoek. Ben zelf werkzaam bij een gezondheidsfonds, de Hersenstichting verleent wel subsidie aan wetenschappelijk onderzoek. |
Geen |
De Hersenstichting heeft een puur faciliterende rol als het gaat om ontwikkeling van bijvoorbeeld een zorgstandaard, zoals nu de zorgstandaard Traumatisch Hersenletsel. Zij heeft het zorgveld de opdracht gegeven een dergelijke zorgstandaard te ontwikkelen en stelt daarvoor de middelen ter beschikking. Meer informatie op www.zorgstandaardnah.nl |
|
Wimmers |
Teammanager Kennis & Trends, Hartstichting |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het raadplegen van afgevaardigden van de patiëntenvereniging hersenletsel.nl, de Hartstichting en de Hart&Vaatgroep. Deze partijen werden ook uitgenodigd om tijdens de invitational conference de door hen ervaren knelpunten aan te dragen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan deze partijen.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit (www.demedischspecialist.nl/richtlijnen). Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreetrust.org) dat een internationaal breed geaccepteerd instrument is en op Richtlijnen voor richtlijnen voor de beoordeling van de kwaliteit van richtlijnen (www.zorginstituutnederland.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Achmea en VGZ namens Zorgverzekeraars Nederland, het College voor Zorgverzekeringen (tegenwoordig Zorginstituut Nederland), de Inspectie voor de Gezondheidszorg, CVA Patiëntenvereniging Hersenletsel.nl, de Hart&Vaatgroep en de Hartstichting, via een invitational conference.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken, waarna de definitieve uitgangsvragen werden vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk en onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt inhoudt.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen, via de websites van enkele grote organisaties, zoals de American Heart Association en de European Stroke Organization. Tevens werd in de tijdschriften Stroke en Int J Stroke gezocht naar richtlijnen. Vervolgens werd op de website van de Cochrane Library gezocht naar systematische reviews. Tot slot werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases (NLM Pubmed, Google Scholar, Embase, Cochrane Library). De zoektermen werden geformuleerd aan de hand van een searchvraag. De searchvraag werd vertaald in een PICO (patient, intervention, control, outcome). Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepsleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in het hoofdstuk van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van vertrouwen in de literatuurconclusie (zie http://www.guidelinedevelopment.org/handbook/).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden.
Formuleren van de conclusies
Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusies, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt deze getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen door de werkgroep en beschreven in de literatuursamenvatting.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld binnen de clinical audit van de NVN om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de paragraaf Kennislacunes behorend bij elke module.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Zoekverantwoording
1a
P patienten met herseninfarct
I echocardiografie, transthoracale echogr (TTE), contrast echogr, transoesofageale echogr (TEE)
C geen echocardiografie
O risico op cardiale emboliebron
PubMed, 16-04-2014
|
Search |
Query |
Items found |
|
((((cardiogenic[tiab] OR cardioembolic[tiab] OR cardiac origin*[tiab] OR cardiac emboli*[tiab] OR cardiac source*[tiab] OR embolic source*[tiab])) OR (Risk[Mesh] OR Risk Assessment[Mesh] OR Risk Factors[Mesh] OR Predictive Value of Tests[Mesh] OR Sensitivity and Specificity[Mesh]))) AND (((Echocardiography[Mesh] OR echocardiogra*[tiab] OR Transesophageal Echo*[tiab] OR transthoracic echo*[tiab] OR transesophageal ultraso*[tiab] OR transthoracic ultraso*[tiab] OR transoesophageal echo*[tiab] OR transoesophageal ultraso*[tiab] OR contrast echo*[tiab])) AND (Stroke[Mesh] OR Ischemic Attack, Transient[Mesh] OR tia[tiab] OR tias[tiab] OR transient ischemic attack*[tiab] OR transient ischaemic attack*[tiab] OR stroke*[tiab] OR cerebrovascular accident*[tiab] OR brain vascular accident*[tiab] OR cva[tiab] OR cvas[tiab] OR ((brain[tiab] OR cerebral[tiab] OR cerebrovascular[tiab]) AND infarct*[tiab]))) |
||
|
((((Stroke[Mesh] OR Ischemic Attack, Transient[Mesh] OR tia[tiab] OR tias[tiab] OR transient ischemic attack*[tiab] OR transient ischaemic attack*[tiab] OR stroke*[tiab] OR cerebrovascular accident*[tiab] OR brain vascular accident*[tiab] OR cva[tiab] OR cvas[tiab] OR ((brain[tiab] OR cerebral[tiab] OR cerebrovascular[tiab]) AND infarct*[tiab]))) AND (Echocardiography[Mesh] OR echocardiogra*[tiab] OR Transesophageal Echo*[tiab] OR transthoracic echo*[tiab] OR transesophageal ultraso*[tiab] OR transthoracic ultraso*[tiab] OR transoesophageal echo*[tiab] OR transoesophageal ultraso*[tiab] OR contrast echo*[tiab]))) AND (cardiogenic[tiab] OR cardioembolic[tiab] OR cardiac origin*[tiab] OR cardiac emboli*[tiab] OR cardiac source*[tiab] OR embolic source*[tiab]) |
||
|
cardiogenic[tiab] OR cardioembolic[tiab] OR cardiac origin*[tiab] OR cardiac emboli*[tiab] OR cardiac source*[tiab] OR embolic source*[tiab] |
||
|
((((Stroke[Mesh] OR Ischemic Attack, Transient[Mesh] OR tia[tiab] OR tias[tiab] OR transient ischemic attack*[tiab] OR transient ischaemic attack*[tiab] OR stroke*[tiab] OR cerebrovascular accident*[tiab] OR brain vascular accident*[tiab] OR cva[tiab] OR cvas[tiab] OR ((brain[tiab] OR cerebral[tiab] OR cerebrovascular[tiab]) AND infarct*[tiab]))) AND (Echocardiography[Mesh] OR echocardiogra*[tiab] OR Transesophageal Echo*[tiab] OR transthoracic echo*[tiab] OR transesophageal ultraso*[tiab] OR transthoracic ultraso*[tiab] OR transoesophageal echo*[tiab] OR transoesophageal ultraso*[tiab] OR contrast echo*[tiab]))) AND (Risk[Mesh] OR Risk Assessment[Mesh] OR Risk Factors[Mesh] OR Predictive Value of Tests[Mesh] OR Sensitivity and Specificity[Mesh]) |
||
|
Risk[Mesh] OR Risk Assessment[Mesh] OR Risk Factors[Mesh] OR Predictive Value of Tests[Mesh] OR Sensitivity and Specificity[Mesh] |
||
|
((Stroke[Mesh] OR Ischemic Attack, Transient[Mesh] OR tia[tiab] OR tias[tiab] OR transient ischemic attack*[tiab] OR transient ischaemic attack*[tiab] OR stroke*[tiab] OR cerebrovascular accident*[tiab] OR brain vascular accident*[tiab] OR cva[tiab] OR cvas[tiab] OR ((brain[tiab] OR cerebral[tiab] OR cerebrovascular[tiab]) AND infarct*[tiab]))) AND (Echocardiography[Mesh] OR echocardiogra*[tiab] OR Transesophageal Echo*[tiab] OR transthoracic echo*[tiab] OR transesophageal ultraso*[tiab] OR transthoracic ultraso*[tiab] OR transoesophageal echo*[tiab] OR transoesophageal ultraso*[tiab] OR contrast echo*[tiab]) |
||
|
Echocardiography[Mesh] OR echocardiogra*[tiab] OR Transesophageal Echo*[tiab] OR transthoracic echo*[tiab] OR transesophageal ultraso*[tiab] OR transthoracic ultraso*[tiab] OR transoesophageal echo*[tiab] OR transoesophageal ultraso*[tiab] OR contrast echo*[tiab] |
||
|
Stroke[Mesh] OR Ischemic Attack, Transient[Mesh] OR tia[tiab] OR tias[tiab] OR transient ischemic attack*[tiab] OR transient ischaemic attack*[tiab] OR stroke*[tiab] OR cerebrovascular accident*[tiab] OR brain vascular accident*[tiab] OR cva[tiab] OR cvas[tiab] OR ((brain[tiab] OR cerebral[tiab] OR cerebrovascular[tiab]) AND infarct*[tiab]) |
#96 Echocardiografie:
Echocardiography[Mesh] OR echocardiogra*[tiab] OR Transesophageal Echo*[tiab] OR transthoracic echo*[tiab] OR transesophageal ultraso*[tiab] OR transthoracic ultraso*[tiab] OR transoesophageal echo*[tiab] OR transoesophageal ultraso*[tiab] OR contrast echo*[tiab]
#100 Cardiale emboliebron:
cardiogenic[tiab] OR cardioembolic[tiab] OR cardiac origin*[tiab] OR cardiac emboli*[tiab] OR cardiac source*[tiab] OR embolic source*[tiab]
#98 Risico op:
Risk[Mesh] OR Risk Assessment[Mesh] OR Risk Factors[Mesh] OR Predictive Value of Tests[Mesh] OR Sensitivity and Specificity[Mesh]
PubMed, 17-04-2014
|
Search |
Query |
Items found |
|
(((((Epidemiologic Studies[Mesh:NoExp] OR Case-Control Studies[Mesh] OR Cohort Studies[Mesh] OR Cross-Sectional Studies[Mesh] OR case-control[tiab] OR cohort stud*[tiab] OR cohort analy*[tiab] OR follow up stud*[tiab] OR observational stud*[tiab] OR longitudinal[tiab] OR cross sectional[tiab] OR retrospective[tiab])) OR (randomized controlled trial[pt] OR controlled clinical trial[pt] OR randomized[tiab] OR placebo[tiab] OR clinical trials as topic[mesh:noexp] OR randomly[tiab] OR trial[ti])) OR systematic[sb])) AND (((Stroke[Mesh] OR Ischemic Attack, Transient[Mesh] OR tia[tiab] OR tias[tiab] OR transient ischemic attack*[tiab] OR transient ischaemic attack*[tiab] OR stroke*[tiab] OR cerebrovascular accident*[tiab] OR brain vascular accident*[tiab] OR cva[tiab] OR cvas[tiab] OR ((brain[tiab] OR cerebral[tiab] OR cerebrovascular[tiab]) AND infarct*[tiab]))) AND (Echocardiography[Mesh] OR echocardiogra*[tiab] OR Transesophageal Echo*[tiab] OR transthoracic echo*[tiab] OR transesophageal ultraso*[tiab] OR transthoracic ultraso*[tiab] OR transoesophageal echo*[tiab] OR transoesophageal ultraso*[tiab] OR contrast echo*[tiab])) |
||
|
((Stroke[Mesh] OR Ischemic Attack, Transient[Mesh] OR tia[tiab] OR tias[tiab] OR transient ischemic attack*[tiab] OR transient ischaemic attack*[tiab] OR stroke*[tiab] OR cerebrovascular accident*[tiab] OR brain vascular accident*[tiab] OR cva[tiab] OR cvas[tiab] OR ((brain[tiab] OR cerebral[tiab] OR cerebrovascular[tiab]) AND infarct*[tiab]))) AND (Echocardiography[Mesh] OR echocardiogra*[tiab] OR Transesophageal Echo*[tiab] OR transthoracic echo*[tiab] OR transesophageal ultraso*[tiab] OR transthoracic ultraso*[tiab] OR transoesophageal echo*[tiab] OR transoesophageal ultraso*[tiab] OR contrast echo*[tiab]) |
||
|
(((Epidemiologic Studies[Mesh:NoExp] OR Case-Control Studies[Mesh] OR Cohort Studies[Mesh] OR Cross-Sectional Studies[Mesh] OR case-control[tiab] OR cohort stud*[tiab] OR cohort analy*[tiab] OR follow up stud*[tiab] OR observational stud*[tiab] OR longitudinal[tiab] OR cross sectional[tiab] OR retrospective[tiab])) OR (randomized controlled trial[pt] OR controlled clinical trial[pt] OR randomized[tiab] OR placebo[tiab] OR clinical trials as topic[mesh:noexp] OR randomly[tiab] OR trial[ti])) OR systematic[sb] |
||
|
systematic[sb] Sort by: Relevance |
||
|
randomized controlled trial[pt] OR controlled clinical trial[pt] OR randomized[tiab] OR placebo[tiab] OR clinical trials as topic[mesh:noexp] OR randomly[tiab] OR trial[ti] Sort by: Relevance |
||
|
Epidemiologic Studies[Mesh:NoExp] OR Case-Control Studies[Mesh] OR Cohort Studies[Mesh] OR Cross-Sectional Studies[Mesh] OR case-control[tiab] OR cohort stud*[tiab] OR cohort analy*[tiab] OR follow up stud*[tiab] OR observational stud*[tiab] OR longitudinal[tiab] OR cross sectional[tiab] OR retrospective[tiab] Sort by: Relevance |
#15
Herseninfarct + echocardiografie + (observationeel of RCT of systematic review)
#13
Observationele studies of RCT’s of systematic reviews
1b
P patienten met herseninfarct
I ritmebewaking (ECG, Holter, Reveal)
C geen ritmebewaking
O (paroxysmal) atrial fibrillation
|
Search |
Query |
Items found |
|
Search ((Stroke[Mesh] OR Ischemic Attack, Transient[Mesh] OR tia[tiab] OR tias[tiab] OR transient ischemic attack*[tiab] OR transient ischaemic attack*[tiab] OR stroke*[tiab] OR cerebrovascular accident*[tiab] OR brain vascular accident*[tiab] OR cva[tiab] OR cvas[tiab] OR ((brain[tiab] OR cerebral[tiab] OR cerebrovascular[tiab]) AND infarct*[tiab]))) AND (((Electrocardiography[Mesh] OR electrocardiogra*[tiab] OR ECG*[tiab] OR EKG*[tiab])) OR (loop record*[tiab] OR Holter[tiab] OR body surface potential map*[tiab] OR vectorcardiogra*[tiab] OR polarcardiogra*[tiab] OR body surface map*[tiab] OR event record* OR aCEM[tiab])) |
||
|
Search ((Electrocardiography[Mesh] OR electrocardiogra*[tiab] OR ECG*[tiab] OR EKG*[tiab])) OR (loop record*[tiab] OR Holter[tiab] OR body surface potential map*[tiab] OR vectorcardiogra*[tiab] OR polarcardiogra*[tiab] OR body surface map*[tiab] OR event record* OR aCEM[tiab]) |
||
|
Search loop record*[tiab] OR Holter[tiab] OR body surface potential map*[tiab] OR vectorcardiogra*[tiab] OR polarcardiogra*[tiab] OR body surface map*[tiab] OR event record* OR aCEM[tiab] zowel bij syst reviews als controlled studies geen zinvolle opbrengst, ook bij #98 en algemene stroke niet veel |
||
|
Search Electrocardiography[Mesh] OR electrocardiogra*[tiab] OR ECG*[tiab] OR EKG*[tiab] |
||
|
Search Stroke[Mesh] OR Ischemic Attack, Transient[Mesh] OR tia[tiab] OR tias[tiab] OR transient ischemic attack*[tiab] OR transient ischaemic attack*[tiab] OR stroke*[tiab] OR cerebrovascular accident*[tiab] OR brain vascular accident*[tiab] OR cva[tiab] OR cvas[tiab] OR brain[tiab] OR cerebral[tiab] OR cerebrovascular[tiab]) AND infarct*[tiab]) |
#99 Ritmebewaking:
((Electrocardiography[Mesh] OR electrocardiogra*[tiab] OR ECG*[tiab] OR EKG*[tiab])) OR (loop record*[tiab] OR Holter[tiab] OR body surface potential map*[tiab] OR vectorcardiogra*[tiab] OR polarcardiogra*[tiab] OR body surface map*[tiab] OR event record* OR aCEM[tiab])
Continuous ECG monitoring: zit al in ECG (afkorting of voluit)
External loop recording: zit al in loop record*
CEM niet gebruiken want te veel ruis, is o.a. een soort cement en een bepaalde cel
[tiab] = term staat in title of abstract
* = trunceren, alle woorden die met bv. infarct beginnen worden gevonden, infarct* levert oa op: infarct, infarcts, infarction, infarctions enz.
PubMed, 17-04-2014
|
Search |
Query |
Items found |
|
((((Stroke[Mesh] OR Ischemic Attack, Transient[Mesh] OR tia[tiab] OR tias[tiab] OR transient ischemic attack*[tiab] OR transient ischaemic attack*[tiab] OR stroke*[tiab] OR cerebrovascular accident*[tiab] OR brain vascular accident*[tiab] OR cva[tiab] OR cvas[tiab] OR ((brain[tiab] OR cerebral[tiab] OR cerebrovascular[tiab]) AND infarct*[tiab]))) AND (((Electrocardiography[Mesh] OR electrocardiogra*[tiab] OR ECG*[tiab] OR EKG*[tiab])) OR (loop record*[tiab] OR Holter[tiab] OR body surface potential map*[tiab] OR vectorcardiogra*[tiab] OR polarcardiogra*[tiab] OR body surface map*[tiab] OR event record* OR aCEM[tiab])))) AND ((((Epidemiologic Studies[Mesh:NoExp] OR Case-Control Studies[Mesh] OR Cohort Studies[Mesh] OR Cross-Sectional Studies[Mesh] OR case-control[tiab] OR cohort stud*[tiab] OR cohort analy*[tiab] OR follow up stud*[tiab] OR observational stud*[tiab] OR longitudinal[tiab] OR cross sectional[tiab] OR retrospective[tiab])) OR (randomized controlled trial[pt] OR controlled clinical trial[pt] OR randomized[tiab] OR placebo[tiab] OR clinical trials as topic[mesh:noexp] OR randomly[tiab] OR trial[ti])) OR systematic[sb]) |
||
|
(((Epidemiologic Studies[Mesh:NoExp] OR Case-Control Studies[Mesh] OR Cohort Studies[Mesh] OR Cross-Sectional Studies[Mesh] OR case-control[tiab] OR cohort stud*[tiab] OR cohort analy*[tiab] OR follow up stud*[tiab] OR observational stud*[tiab] OR longitudinal[tiab] OR cross sectional[tiab] OR retrospective[tiab])) OR (randomized controlled trial[pt] OR controlled clinical trial[pt] OR randomized[tiab] OR placebo[tiab] OR clinical trials as topic[mesh:noexp] OR randomly[tiab] OR trial[ti])) OR systematic[sb] |
||
|
((((Stroke[Mesh] OR Ischemic Attack, Transient[Mesh] OR tia[tiab] OR tias[tiab] OR transient ischemic attack*[tiab] OR transient ischaemic attack*[tiab] OR stroke*[tiab] OR cerebrovascular accident*[tiab] OR brain vascular accident*[tiab] OR cva[tiab] OR cvas[tiab] OR ((brain[tiab] OR cerebral[tiab] OR cerebrovascular[tiab]) AND infarct*[tiab]))) AND (((Electrocardiography[Mesh] OR electrocardiogra*[tiab] OR ECG*[tiab] OR EKG*[tiab])) OR (loop record*[tiab] OR Holter[tiab] OR body surface potential map*[tiab] OR vectorcardiogra*[tiab] OR polarcardiogra*[tiab] OR body surface map*[tiab] OR event record* OR aCEM[tiab])))) AND (Risk[Mesh] OR Risk Assessment[Mesh] OR Risk Factors[Mesh] OR Predictive Value of Tests[Mesh] OR Sensitivity and Specificity[Mesh]) Deze search met controlled trials en reviews levered niet veel op |
||
|
Risk[Mesh] OR Risk Assessment[Mesh] OR Risk Factors[Mesh] OR Predictive Value of Tests[Mesh] OR Sensitivity and Specificity[Mesh] |
||
|
((((Stroke[Mesh] OR Ischemic Attack, Transient[Mesh] OR tia[tiab] OR tias[tiab] OR transient ischemic attack*[tiab] OR transient ischaemic attack*[tiab] OR stroke*[tiab] OR cerebrovascular accident*[tiab] OR brain vascular accident*[tiab] OR cva[tiab] OR cvas[tiab] OR ((brain[tiab] OR cerebral[tiab] OR cerebrovascular[tiab]) AND infarct*[tiab]))) AND (((Electrocardiography[Mesh] OR electrocardiogra*[tiab] OR ECG*[tiab] OR EKG*[tiab])) OR (loop record*[tiab] OR Holter[tiab] OR body surface potential map*[tiab] OR vectorcardiogra*[tiab] OR polarcardiogra*[tiab] OR body surface map*[tiab] OR event record* OR aCEM[tiab])))) AND (cardiogenic[tiab] OR cardioembolic[tiab] OR cardiac origin*[tiab] OR cardiac emboli*[tiab] OR cardiac source*[tiab] OR embolic source*[tiab]) Bruikbaar tot pagina 9 vanaf 2000 en pagina 8 (ref 1 t/m 127) vanaf 2007 |
||
|
cardiogenic[tiab] OR cardioembolic[tiab] OR cardiac origin*[tiab] OR cardiac emboli*[tiab] OR cardiac source*[tiab] OR embolic source*[tiab] |
||
|
((Stroke[Mesh] OR Ischemic Attack, Transient[Mesh] OR tia[tiab] OR tias[tiab] OR transient ischemic attack*[tiab] OR transient ischaemic attack*[tiab] OR stroke*[tiab] OR cerebrovascular accident*[tiab] OR brain vascular accident*[tiab] OR cva[tiab] OR cvas[tiab] OR ((brain[tiab] OR cerebral[tiab] OR cerebrovascular[tiab]) AND infarct*[tiab]))) AND (((Electrocardiography[Mesh] OR electrocardiogra*[tiab] OR ECG*[tiab] OR EKG*[tiab])) OR (loop record*[tiab] OR Holter[tiab] OR body surface potential map*[tiab] OR vectorcardiogra*[tiab] OR polarcardiogra*[tiab] OR body surface map*[tiab] OR event record* OR aCEM[tiab])) deze gedaan vanaf 2007 = ref 1960 van de 5512) |
5445 juni 5512 |
#12 – 286 artikelen
Herseninfarct + ECG + cardiale emboliebron
#14 – 1427 artikelen
Herseninfarct + ECG + risico
#16 – 2208 artikelen
Herseninfarct + ECG + (observationeel of RCT of systematic review)
Zoekverantwoording PICO 1b
((((Stroke[Mesh] OR Ischemic Attack, Transient[Mesh] OR tia[tiab] OR tias[tiab] OR transient ischemic attack*[tiab] OR transient ischaemic attack*[tiab] OR stroke*[tiab] OR cerebrovascular accident*[tiab] OR brain vascular accident*[tiab] OR cva[tiab] OR cvas[tiab] OR ((brain[tiab] OR cerebral[tiab] OR cerebrovascular[tiab]) AND infarct*[tiab]))) AND (((Electrocardiography[Mesh] OR electrocardiogra*[tiab] OR ECG*[tiab] OR EKG*[tiab])) OR (loop record*[tiab] OR Holter[tiab] OR body surface potential map*[tiab] OR vectorcardiogra*[tiab] OR polarcardiogra*[tiab] OR body surface map*[tiab] OR event record* OR aCEM[tiab])))) AND (cardiogenic[tiab] OR cardioembolic[tiab] OR cardiac origin*[tiab] OR cardiac emboli*[tiab] OR cardiac source*[tiab] OR embolic source*[tiab])
en
((Stroke[Mesh] OR Ischemic Attack, Transient[Mesh] OR tia[tiab] OR tias[tiab] OR transient ischemic attack*[tiab] OR transient ischaemic attack*[tiab] OR stroke*[tiab] OR cerebrovascular accident*[tiab] OR brain vascular accident*[tiab] OR cva[tiab] OR cvas[tiab] OR ((brain[tiab] OR cerebral[tiab] OR cerebrovascular[tiab]) AND infarct*[tiab]))) AND (((Electrocardiography[Mesh] OR electrocardiogra*[tiab] OR ECG*[tiab] OR EKG*[tiab])) OR (loop record*[tiab] OR Holter[tiab] OR body surface potential map*[tiab] OR vectorcardiogra*[tiab] OR polarcardiogra*[tiab] OR body surface map*[tiab] OR event record* OR aCEM[tiab]))

