Stenten van een carotisstenose (CAS)
Uitgangsvraag
Wat is de plaats van stenten van een carotisstenose (carotid artery stenting: CAS)?
Aanbeveling
Symptomatische patiënten
Behandel symptomatische patiënten bij voorkeur met carotisendarteriëctomie. Overweeg alleen behandeling met een stent als er sprake is van ernstige comorbiditeit zoals een ‘hostile neck’ of als de patiënt jonger is dan 70 jaar.
Asymptomatische patiënten
Pas bij asymptomatische patiënten buiten trialverband geen stenting van de arteria carotis toe.
Overwegingen
Extrapoleerbaarheid van de resultaten:
- Voor leeftijd gecorrigeerde uitkomsten. In zes RCTs waren individuele patiëntendata beschikbaar en konden de resultaten per leeftijdsgroep worden geanalyseerd. Bij patiënten jonger dan 70 jaar (N=1.994) was de OR voor sterfte of herseninfarct of hersenbloeding na 30 dagen 1,16 (95% BI 0,80 tot 1,67). Voor patiënten van 70 jaar of ouder (N=1.928) was de OR 2,20 (95% BI 1,47 tot 3,29). Bij patiënten van 70 jaar of ouder was de kans op proceduregerelateerde sterfte of herseninfarct of hersenbloeding in de endovasculair behandelde groep dus significant hoger.
- Aan geslacht gerelateerde uitkomsten. In zeven RCTs werden de resultaten voor mannen en vrouwen separaat geanalyseerd. De kans op sterfte of herseninfarct of hersenbloeding was niet significant verschillend voor mannen en vrouwen.
- Letsel van de halszenuw. Bij stentplaatsing is het risico op perifeer zenuwletsel lager dan bij CEA. Hoewel het 30-dagenrisico op perifeer zenuwletsel na CEA rond de 5% ligt is deze uitval doorgans van tijdelijke aard en is het risico op permanent zenuwletsel ten gevolge van CEA zeer laag. Om deze reden is het halszenuwletsel geen onderdeel van een samengesteld eindpunt binnen RCTs (De Borst, 2014).
- Hoog-risico-criteria. Voor de zogenaamde klassieke hoog-risico-kenmerken (status na radiotherapie, restenose na eerdere CEA, contralaterale stenose) zoals opgenomen in de inclusiecriteria van de Sapphire-trial is nooit aangetoond dat CAS veiliger is dan CEA. CAS kan worden overwogen bij deze patiënten maar er zal in een multidisciplinair team op basis van individuele patiëntkenmerken moeten worden bepaald of behandeling geïndiceerd is en welke behandeling de meeste winst oplevert. Het is zeker niet zo dat stentplaatsing bij patiënten met een restenose na eerdere carotisdesobstructie of cervicale radiotherapie per definitie een lager risico heeft op een procedureel herseninfarct of hersenbloeding in vergelijking met CEA (Fokkema, 2012 en 2014). Daarnaast zijn enkele duidelijke anatomische kenmerken gedefinieerd die het risico op herseninfarct of hersenbloeding ten gevolge van stentplaatsing aanzienlijk verhogen: type 3 aortaboog; ernstige tortuositeit van de proximale en distale arteria carotis, en ernstige calcificaties en trombus ter plaatse van de carotisplaque. Deze anatomische criteria worden op dit moment al gehanteerd binnen de lopende RCTs tussen CEA en CAS om patiënten te excluderen voor randomisatie en stentplaatsing (ACST-2; SPACE-2; CREST 2).
- Tijdsduur. De tijdsduur tussen symptomatische presentatie en behandeling is relevant voor de totale benefit van revascularisatie. De aanbeveling is om zo snel mogelijk (bij voorkeur binnen twee weken) te behandelen. De gemiddelde vertraging tussen event en interventie in de RCTs lag echter rond de drie maanden, met slechts 15% van de patiënten die hun ingreep binnen twee weken ondergingen. De gegevens uit de beschreven RCTs zijn daardoor niet goed extrapoleerbaar naar de praktijkvoering anno 2014.
- Procedurele uitkomst bepaalt de techniek. Het verschil in herseninfarct- of hersenbloedingvrije overleving tussen CEA en CAS wordt bepaald door de procedurele uitkomst (tot 30 dagen). Als de procedure veiliger kan worden gemaakt, dan is de verwachting dat stentplaatsing gelijkwaardig kan worden aan CEA. De langetermijnuitkomsten van de voltooide RCTs bevestigen dit.
- Surrogaat eindpunt: wittestofafwijkingen. Buiten de klinische eindpunten werd in een substudie van de ICSS-trial aangetoond dat CAS gepaard gaat met een significant hoger risico op het krijgen van nieuwe cerebrale wittestofafwijkingen in vergelijking met CEA. De klinische betekenis hiervan dient verder geanalyseerd te worden (Bonati, 2010). Eenzelfde substudie wordt op dit moment uitgevoerd binnen de ACST-2 trial.
Onderbouwing
Achtergrond
Stenten van de arteria carotis (carotisangioplastiek met stentplaatsing; CAS) is een alternatief voor chirurgische behandeling van een carotisstenose door middel van carotisendarteriëctomie (CEA). Het voordeel van CAS ten opzichte van CEA is dat de behandeling minder invasief is en halsexploratie vermeden wordt.
CAS kan voordelen hebben bij patiënten met ernstige cardiopulmonale comorbiditeit of als CEA technisch niet haalbaar wordt geacht, bijvoorbeeld als in het verleden aan de hals is geopereerd of in het halsgebied met radiotherapie is behandeld, een zogenaamde ‘hostile neck’. De exacte definitie van deze zogenaamde hoog-risico-patiënt dient echter nog nader vastgesteld te worden. Deze module biedt een overzicht van de beschikbare literatuur ten aanzien van de veiligheid en de langetermijneffectiviteit van carotisangioplastiek met en zonder stentplaatsing in de arteria carotis.
Conclusies / Summary of Findings
A) Symptomatische patiënten
Sterfte of herseninfarct of hersenbloeding
|
Matig GRADE |
De behandeling van symptomatische patiënten met carotisstenose door middel van een endovasculaire behandeling geeft een significant hoger risico op een herseninfarct of hersenbloeding binnen 30 dagen in vergelijking met carotisendarteriëctomie. Er zijn geen aanwijzingen voor een verschil in effect op lange termijn.
Bronnen (Bonati, 2012) |
B) Asymptomatische patiënten
|
Laag GRADE |
Er kon zowel binnen dertig dagen als op langere termijn geen verschil in uitkomst worden aangetoond tussen endovasculaire behandeling en stentplaatsing of chirurgie bij asymptomatische patiënten met betrekking tot het risico op mortaliteit of herseninfarct of hersenbloeding.
Bronnen(Bonati, 2012) |
Samenvatting literatuur
Een Cochrane systematische review van 16 RCT’s werd geselecteerd (Bonati, 2012). In deze systematische review werd endovasculaire behandeling vergeleken met CEA (N=7572). Endovasculaire behandeling betreft het plaatsen van een stent en/of transluminale ballondilatatie. De systematische review beschrijft de uitkomsten op korte termijn, in de eerste 30 dagen na randomisatie of behandeling, en de uitkomsten op lange termijn, van randomisatie (behandeling) tot einde follow-up (jaren). In de analyse werd onderscheid gemaakt tussen symptomatische patiënten (met een recente TIA of herseninfarct in het stroomgebied van de betreffende halsslagader) en asymptomatische patiënten. De resultaten worden derhalve gepresenteerd volgens de indeling naar klinische presentatie en follow-up duur:
a) symptomatische patiënten; sterfte of herseninfarct of hersenbloeding binnen 30 dagen;
b) symptomatische patiënten; sterfte of herseninfarct of hersenbloeding binnen 30 dagen of ipsilaterale herseninfarct of hersenbloeding tot het einde van de follow-up;
c) asymptomatische patiënten; sterfte of herseninfarct of hersenbloeding binnen 30 dagen;
d) asymptomatische patiënten; sterfte of herseninfarct of hersenbloeding binnen 30 dagen of ipsilaterale herseninfarct of hersenbloeding tot het einde van de follow-up.
A) Symptomatische patiënten, kortetermijnresultaten
In vergelijking met CEA is endovasculaire behandeling geassocieerd met een hoger risico op een procedureel herseninfarct of procedurele hersenbloeding en op sterfte gerelateerd aan herseninfarct of hersenbloeding. Dit verschil wordt vooral veroorzaakt door het vaker optreden van een niet-invaliderend(e) herseninfarct of hersenbloeding in de endovasculair behandelde groep, en met name bij oudere patiënten (Mas, 2006; The SPACE collaborative group, 2006; Intertnational Carotid Stenting Study Invenstigators, 2010; Brott, 2010; Carotid Stenting Trialists’ Collaboration, 2010). De uitkomst sterfte of herseninfarct of hersenbloeding in de eerste 30 dagen na randomisatie werd geanalyseerd in 11 RCTS betreffende 5.778 patiënten. In de endovasculaire groep was de kans op dit eindpunt 8,1% (237/2.897) en in de CEA groep 5,0% (144/2882). De OR was 1,72 (95% BI 1,29 tot 2,31) (zie figuur 1). Voor de uitkomstmaat ernstig(e) /invaliderend(e) herseninfarct of hersenbloeding en sterfte was er geen significant verschil tussen de twee groepen (OR 1,28; 95% BI 0,93 tot 1,77).
Figuur 1 Symptomatische patiënten; 30 dagen uitkomsten herseninfarct of hersenbloeding en mortaliteit 
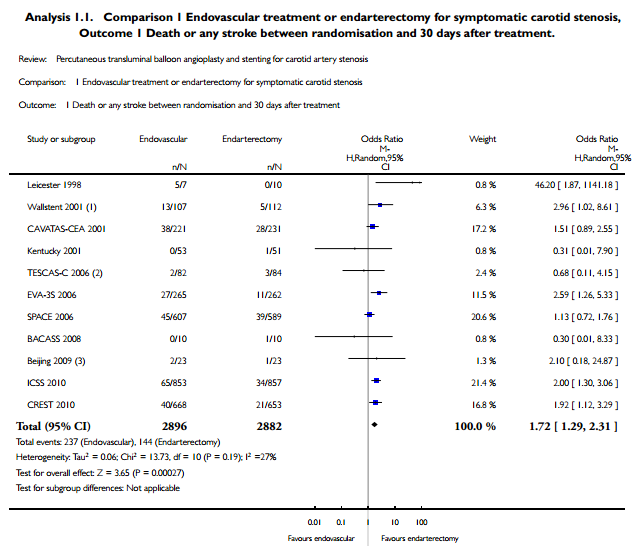
Uitkomsten gecorrigeerd voor leeftijd
In zes RCTs waren individuele patiëntengegevens beschikbaar en konden de resultaten per leeftijdsgroep worden geanalyseerd. Bij patiënten jonger dan 70 jaar (N=1.994) was de kans op sterfte of herseninfarct of hersenbloeding na 30 dagen 6,6% (66/1006) in de endovasculaire groep, en 5,8% (57/988) in de CEA-groep. De OR was 1,16 (95% BI 0,80 tot 1,67).
Voor patiënten van 70 jaar of ouder (N=1.928) was dit 11,9% (114/957) in de endovasculaire groep en 5,8% (56/971) in de CEA-groep. De OR was 2,20 (95% BI 1,47 tot 3,29). Bij patiënten van 70 jaar of ouder was de kans op proceduregerelateerde sterfte of herseninfarct of hersenbloeding in de endovasculair behandelde groep dus significant hoger.
Uitkomsten gerelateerd aan geslacht
In zeven RCTs werden de individuele patiëntdata voor mannen en vrouwen separaat geanalyseerd. Voor 3.657 mannelijke patiënten was de kans op sterfte of herseninfarct of hersenbloeding 8,4% (154/1827) in de endovasculaire groep en 4,9% (90/1830) in de CEA-groep. De OR was 1,86 (95% BI 1,19 tot 2,91). Voor 1.586 vrouwelijke patiënten was de kans op sterfte of herseninfarct of hersenbloeding 8,2% (66/804) in de endovasculaire groep en 5,5% (43/782) in de CEA-groep. De OR was 1,53 (95% BI 1,02 tot 2,29). De kans op sterfte of herseninfarct of hersenbloeding was niet significant verschillend voor mannen en vrouwen.
Myocardinfact
De kans op een myocardinfarct na 30 dagen werd beschreven in acht RCTs betreffende 5.359 patiënten. In de endovasculaire groep was de kans op een myocardinfarct 0,4% (11/2690) en in de CEA-groep 1,0% (27/2669). De OR was 0,44 (95% BI 0,23 tot 0,87).
De gecombineerde uitkomst: myocardinfarct met any stroke en mortaliteit was echter nog steeds in het nadeel van de endovasculaire groep (OR 1,44; 95% BI 1,15 tot 1,80).
Mortaliteit binnen 30 dagen
De kans op mortaliteit binnen 30 dagen werd beschreven in 11 RCTS betreffende 6.927 patiënten. In de endovasculaire groep was de mortaliteit 1,1% (37/3426) en in de CEA groep 0,6% (24/3501). De OR was 1,59 (95% BI 0,94 tot 2,70).
B) symptomatische patiënten; sterfte of herseninfarct of hersenbloeding (<30 dagen) of ipsilaterale herseninfarct of hersenbloeding tot het einde van de follow-up
De gecombineerde uitkomst kwam significant vaker voor bij patiënten die gerandomiseerd waren naar endovasculaire behandeling dan bij degenen die endarteriëctomie toegewezen hadden gekregen (OR 1,39; 95% BI 1,10 tot 1,75; p= 0,005; I² = 0%) (zie figuur 2). Deze uitkomst werd geanalyseerd in acht RCTs betreffende 3.753 patiënten. In de endovasculaire groep was de kans op dit eindpunt 8,1 % (237/2.897) en in de CEA-groep 5,0% (144/2882).
Binnen de 2012 Cochrane meta-analyse (Bonati, 2012) werd in twee RCTs (CAVATAS en EVA-3S) het risico op een herseninfarct of hersenbloeding na vier jaar geanalyseerd, betreffende 965 patiënten. In de endovasculaire groep was de kans op een herseninfarct of hersenbloeding 10,1% (45/447) en in de CEA groep 6,6% (32/488). De OR was 1,42 (95% BI 0,71 tot 2,86) (zie figuur 2).
Als onderscheid wordt gemaakt tussen studies met alleen ballonangioplastiek en studies met stenting is er geen verschil in grootte en richting van het effect. Dit gold voor alle uitkomstmaten. Studies die angioplastiek en stenting met elkaar vergelijken zijn niet verricht.
Alle RCTs met inclusie van symptomatische patiënten hebben inmiddels hun vooraf gedefinieerde en vastgelegde middellange-termijnuitkomsten gerapporteerd. In de eerste jaren na interventie zijn beide procedures even effectief in het voorkomen van recidief ipsilaterale herseninfarct of hersenbloeding (Brott, 2010; Gurm, 2008; Eckstein, 2008; Mas, 2008), maar na deze termijn zijn er geen data beschikbaar voor de langere termijn na de procedure.
In de Carotid And Vertebral Artery Transluminal Angioplasty Study (CAVATAS) (N=504; 90% symptomatisch) was de achtjaars-incidentie en hazard ratio (HR) voor ipsilateraal non-perioperatief herseninfarct of hersenbloeding 11,3% na endovasculaire interventie versus 8,6% (HR 1,22; 95% BI 0,59 tot 2,54) na CEA en voor alle non-perioperatieve herseninfarct of hersenbloeding 21,1% versus 15,4% (HR 1,66; 95% BI 0,99 tot 2,8) (Ederle, 2009). Deze trial was echter underpowered met daarbij passende zeer brede betrouwbaarheidsintervallen. Daarnaast kreeg slechts 23% van de patiënten in de endovasculaire arm een stent; het overige deel kreeg alleen een PTA.
Figuur 2 Symptomatische patiënten; sterfte of herseninfarct of hersenbloeding (<30 dagen) of ipsilaterale herseninfarct of hersenbloeding tot het einde van de follow-up.
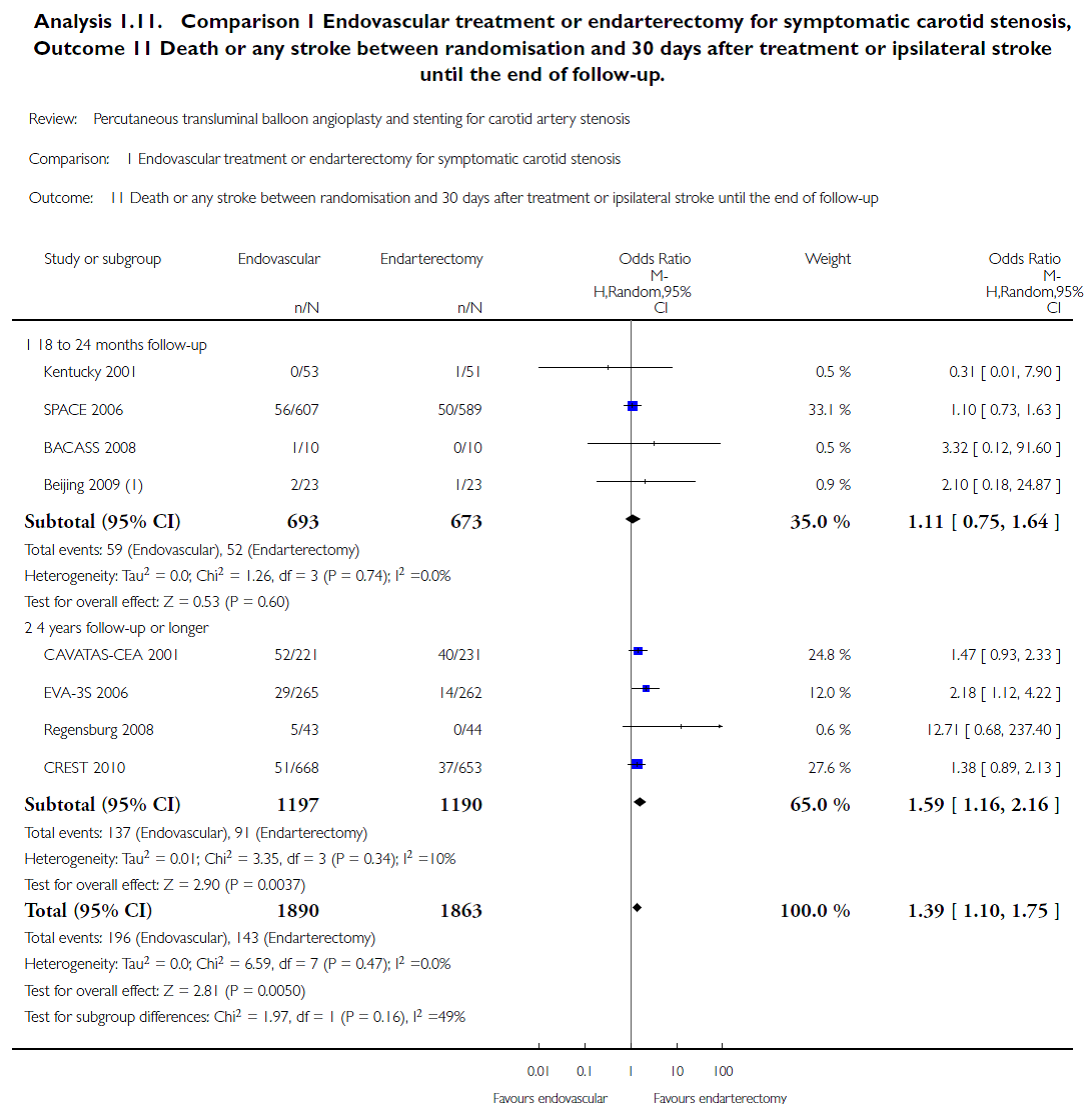
In de Stent-protected Angioplasty versus Carotid Endarterectomy in symptomatic patients trial (SPACE-trial) werd binnen zowel de intention to treat als de per protocol analyses geen significant verschil in Kaplan Meier schatting gerapporteerd voor een ipsilateraal ischemisch herseninfarct of hersenbloeding of periprocedureel herseninfarct of hersenbloeding en sterfte (9,4% vs. 7,7%; HR 1,23; 95% BI 0,82 to 1,83) twee jaar na interventie (Eckstein, 2008). De SPACE-trial werd echter voortijdig gestaakt en had niet genoeg power om verschillen in langere-termijnuitkomsten te detecteren.
In de Endarterectomy versus Stenting in Patients with Symptomatic Severe Carotid Stenosis trial (EVA3S-trial) trad, na een mediane follow up van 7,1 jaar (IQR 5,1 tot 8,8 jaar; maximum 12,4 jaar), het primaire eindpunt (samengesteld ipsilateraal herseninfarct of hersenbloeding na randomisatie of procedureel herseninfarct of hersenbloeding en sterfte) op in 30 patiënten in de CAS-groep en in 18 patiënten in de CEA-groep (Mas, 2014). De cumulatieve incidentie was 11,5% (8,2 tot 15,9) versus 7,6% (4,9 tot 11,8; HR 1,70; 95% BI 0,95 tot 3,06) na tien jaar follow-up. Er werd daarmee geen significant verschil gezien tussen de behandelgroepen met betrekking tot ipsilateraal herseninfarct of hersenbloeding na dertig dagen, ernstige restenose (>70%) of occlusie, overlijden, of myocardinfarct.
In de ICSS-trial werd bij analyse van events na 30 dagen geen verschil gezien in de uitkomsten fataal of invaliderend herseninfarct of hersenbloeding na CAS of CEA (vijfjaarsrisico 3,4% vs. 4,3%; HR 0,93; 95% BI 0,53 tot 1,60). Er was ook geen verschil in ipsilateraal herseninfarct of hersenbloeding (4,7% vs. 3,4%; HR 1,29; 95% BI 0,74 tot 2,24). Herseninfarct of hersenbloeding van willekeurige ernst en stroomgebied trad vaker op na CAS (8,9% vs. 5,8%; HR 1,53; 95% BI 1,02 tot 2,31), met name ten gevolge van een niet-invaliderend herseninfarct of hersenbloeding in het stroomgebied van de contralaterale carotis of arteria vertebralis (International Carotid Stenting Study Investigators, 2010).
CAS is mogelijk geassocieerd met een hoger risico op restenose dan CEA. Een meta-analyse van voorgaande RCTs toonde geen significante toename van restenose na primair stenten ten opzichte van endarteriëctomie (Bonati, 2012). Echter, de betrouwbaarheidsintervallen waren zeer breed, en er werden verschillende duplex ultrasound criteria gebruikt voor het vaststellen van de ernst van restenose.
De SPACE-trial toonde een evident hoger cumulatief restenosepercentage in de CAS-groep na twee jaar (10,7%) in vergelijking met de CEA-groep (4,6%) (Eckstein, 2008). Daartegenover staat dat geen significant verschil in ernstige restenose tussen CAS en CEA werd gezien binnen de EVA-3S-trial na drie jaar (3,3% vs. 2,8%), noch in de CREST-trial na twee jaar (6,0% vs. 6,3%) (Lal, 2012). Ook de ICSS-trial toonde geen significant verschil in langetermijnkans op ernstige restenose (≥70%) of occlusie: 72 patiënten in de CAS-groep (vijfjaarsrisico 10,8%) en in 62 patiënten in de endarteriëctomiegroep (vijfjaarsrisico 8,6%; HR 1,25; 95% BI 0,89 tot 1,75) (International Carotid Stenting Study Investigators, 2010).
Concluderend levert het optreden van restenose na beide behandelingen een beperking van de duurzaamheid van de revascularisatie met betrekking tot doorgankelijkheid van de arteria carotis, maar er lijkt geen sprake van een significant verschil tussen beide behandelingen op langere termijn. Daarnaast heeft het optreden van restenose >50% beperkte klinische impact omdat het meestal een asymptomatisch beloop heeft en slechts zelden tot een recidief herseninfarct leidt.
C. Asymptomatische patiënten; <30 dagen (Bonati, 2012).
De veiligheid van stentplaatsing bij een asymptomatische patiënt met een hooggradige stenose is onderwerp van studie in drie trials die op dit moment nog patiënten includeren: de Asymptomatic Carotid Surgery Trial 2 (ACST-2); de Stent-Protected Angioplasty versus Carotid Endarterectomy 2 (SPACE-2) en de Carotid Revascularization Endarterectomy versus Stenting Trial 2 (CREST-2).
De beschikbare data over stenten bij asymptomatische patiënten komt voornamelijk uit de CREST-trial en uit de eerste publicatie uit de ACST-2 trial. In de asymptomatische subgroep (1181 patiënten) binnen CREST-1 was het risico op herseninfarct of hersenbloeding en overlijden 2,5% ± 0,6% voor CAS en 1,4% ± 0,5% voor CEA (hazard ratio 1,88; 95% BI 0,79 tot 4,42) (Silver, 2011).
ACST-2 is de grootste tweearmige trial (CAS versus CEA) die wordt uitgevoerd en waarvan recent de baseline-karakteristieken en geblindeerde gecombineerde 30 dagen interimresultaten voor 986 patiënten (geïncludeerd tot september 2012) zijn gerapporteerd (ACST-2 Collaborative Group, 2013). Bij 691 patiënten met tenminste één maand follow-up en rapportage van de Rankin score trad het gecombineerde eindpunt, bestaande uit ernstig(e) herseninfarct of hersenbloeding, fataal myocardinfarct of overlijden, op bij 1% van de patiënten.
In de hier gebruikte Cochrane review zijn ook 1318 asymptomatische patiënten uit drie trials (CAVATAS, 2009) vergeleken (herseninfarct of hersenbloeding en sterfte in eerste 30 dagen). Er was geen statistisch significant verschil tussen endovasculaire behandeling en chirurgie (OR 1,71; 95% BI 0,78 tot 3,76; p=0,18). Deze puntschatting was vergelijkbaar met de Odds Ratio bij symptomatische patiënten (OR 1,72; 95% BI 1,29 tot 2,31). Bij het vaststellen van de optimale techniek voor behandeling van een asymptomatische patiënt met een hooggradige carotisstenose dient men zich te realiseren dat de winst van interventie boven de best beschikbare medicatie in het voorkomen van herseninfarct of hersenbloeding zeer gering is. In de ACST-1-trial werd alleen voor mannen jonger dan 75 jaar een voordeel van CEA boven medicatie gezien bij een periprocedureel risico op sterfte of herseninfarct of hersenbloeding van 3%. Dit maakt dat de meeste patiënten met een asymptomatische carotisstenose mogelijk geen baat hebben enige vorm van revascularisatie. Bij asymptomatische patiënten is er buiten trialverband op dit moment dan ook geen indicatie voor stenting van de arteria carotis (noch voor carotisendarteriëctomie).
Figuur 3
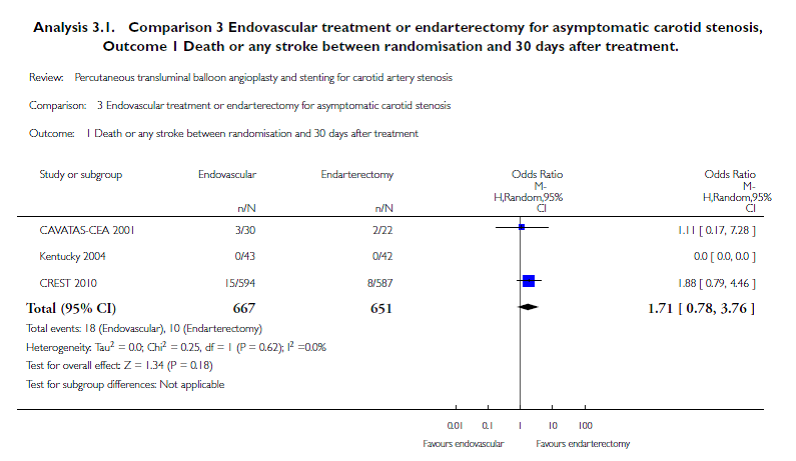
D. Asymptomatische patiënten; sterfte of herseninfarct of hersenbloeding (<30 dagen) of ipsilateraal herseninfarct of hersenbloeding tot het einde van de follow-up (Bonati, 2012)
In de Stenting and Angioplasty with Protection in Patients at high risk for Endarterectomy (Sapphire) trial werd geen significant verschil gezien in langetermijnuitkomsten tussen patiënten die CAS ondergingen en diegenen die CEA kregen. Binnen deze studie was 71% van de patiënten asymptomatisch. Sapphire evalueerde CAS met een protectie-device ten opzichte van CEA in 334 patiënten met een theoretisch verhoogd risico op complicaties ten gevolge van CEA. Tussen 31 en 1080 dagen (drie jaar) was de incidentie van ipsilateraal herseninfarct of hersenbloeding 10,0% (12 van 117 patiënten) in de CAS-groep en 9,3% (11 van 120 patiënten) in de CEA-groep. Gezien de comorbiditeit kunnen de uitkomsten van deze trial niet eenvoudig geëxtrapoleerd worden naar de interpretatie van behandeling van asymptomatische patiënten op de langere termijn.
De Cochrane review, met dezelfde drie trials als onder C. (1318 patiënten), liet geen statistisch significant verschil zien in gecombineerde uitkomst herseninfarct of hersenbloeding en sterfte in eerste 30 dagen met ipsilaterale herseninfarct of hersenbloeding tussen 30 dagen en einde follow up (OR 1,75; 95% BI 0,92 tot 3,33).
Figuur 4
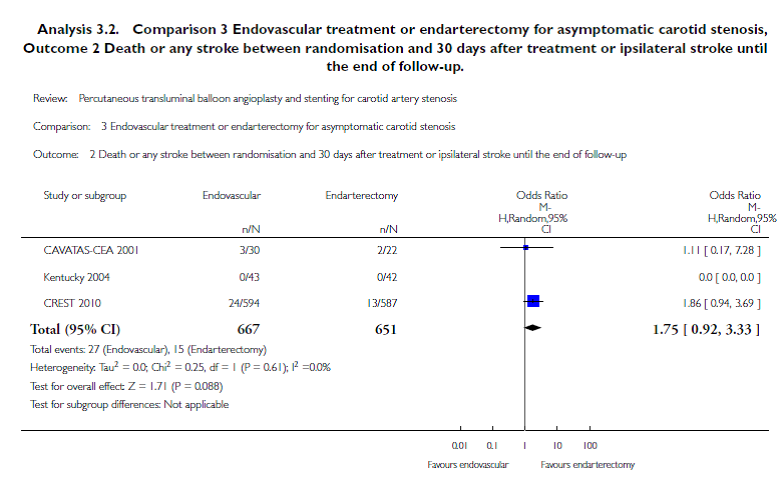
Bewijskracht van de literatuur
Symptomatische patiënten: sterfte of herseninfarct of hersenbloeding tussen randomisatie en einde follow-up
De conclusie is gebaseerd op acht RCTs, deze hebben een hoge bewijskracht in de GRADE-methodologie. Bij twee studies is er sprake van beperkingen in de studieopzet, de methode van randomisatie is niet duidelijk (Kentucky, 2001 en TESCAC-C, 2006). Er is sprake van indirectheid, doordat twee RCTs (Beijing, 2009 en TESCAC-C, 2006) ook asymptomatische patiënten includeerden, voor deze twee factoren dient de bewijskracht te worden verlaagd met één punt. De bewijskracht van deze conclusie is daarom matig.
Asymptomatische patiënten
De conclusie is gebaseerd op vier RCTs, RCTs hebben een hoge bewijskracht in de GRADE-methodologie. De RCTs van CAVATAS en CREST waren van goede kwaliteit. Er is sprake van beperkingen in de studieopzet bij de Kentucky-trial, er is geen informatie over randomisatie, allocation concealment en de patiëntenaantallen tijdens de follow-up zijn niet beschreven.
Er is sprake van indirectheid, doordat de SAPPHIRE-RCT ook symptomatische patiënten includeerde en omdat deze trial patiënten includeerde die een groter risico op complicaties liepen dan de gemiddelde patiënt, voor deze beide aspecten dient te worden verlaagd.
In de hier gebruikte Cochrane review zijn ook de asymptomatische patiënten uit drie trials (CAVATAS, CREST en Kentucky 2009) vergeleken (herseninfarct of hersenbloeding en sterfte in eerste 30 dagen), waarbij geen statistisch significant verschil werd gevonden (OR 1,71; 95% BI 0,78 tot 3,76; p=0,18). Deze puntschatting was vergelijkbaar met de Odds Ratio bij symptomatische patiënten (OR 1,72; 95% BI 1,29 tot 2,31). Het totale aantal events is klein (<3%). De totale bewijskracht voor deze uitkomst wordt daarom als laag beoordeeld.
Zoeken en selecteren
In de databases Medline (OVID), Embase and Cochrane is met relevante zoektermen gezocht naar endarteriëctomie, carotisstenose, stents, mortaliteit, herseninfarct, hersenbloeding en myocardinfarct. De zoekverantwoording is weergegeven in de bijlage. De literatuurzoekactie leverde 636 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: (systematische review van) vergelijkend onderzoek; betreffende vergelijking stentplaatsing versus carotisendarteriëctomie. Minimaal één van de volgende uitkomstmaten werd beschreven: 1) herseninfarct, 2) hersenbloeding, 3) myocardinfarct en 4) mortaliteit. In totaal werden 20 studies opgevraagd en uiteindelijk werd één Cochrane review geselecteerd.
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende vraagstelling: Wat is het effect van CAS op het voorkomen van herseninfarct en hersenbloeding, myocardinfarct en mortaliteit, in vergelijking met CEA bij patiënten met (a)symptomatische carotisstenose; en samenstellingen van deze drie uitkomstmaten, op de lange termijn, en binnen dertig dagen. Is er effectmodificatie door klinische kenmerken als leeftijd en geslacht en comorbiditeit?
Relevante uitkomstmaten
De werkgroep achtte herseninfarct en hersenbloeding, myocardinfarct en mortaliteit voor de besluitvorming kritieke uitkomstmaten.
Referenties
- Bonati LH, Lyrer P, Ederle J, et al. Percutaneous transluminal balloon angioplasty and stenting for carotid artery stenosis. Cochrane Database Syst Rev. 2012;9.
- Mas JL, Chatellier G, Beyssen B, et al. EVA-3S Investigators. Endarterectomy versus stenting in patients with symptomatic severe carotid stenosis. N Eng J Med. 2006;355:1660-1671.
- The SPACE Collaborative group. 30 day results from the SPACE trial of stent protected angioplasty versus carotid endarterectomy in symptomatic patients: a randomized non-inferiority trial. Lancet. 2006;368:1239-1247.
- International Carotid Stenting Study Investigators. Carotid artery stenting compared with endarterectomy in patients with symptomatic carotid stenosis (ICSS): an interim analysis of a randomized controlled trial. Lancet. 2010;375:985-997.
- Brott TG, Hobson RW II, Howard G, et al. CREST Investigators. Stenting versus endarterectomy for treatment of carotid artery stenosis. N Eng J Med. 2010;363:11-23.
- Carotid Stenting Trialists Collaboration. Short term outcome after stenting versus endarterectomy for symptomatic carotid stenosis: a preplanned meta-analysis of individual patient data. Lancet. 2010;376:1062-1073.
- Calvet D, Mas JL, Algra A, et al. Carotid Stenting Trialists Collaboration. Carotid stenting: is there an operator effect? A pooled analysis from the carotid stenting trialistscollaboration. Stroke. 2014;45:527-532.
- Brott TG, Hobson RW II, Howard G, et al. CREST Investigators. Stenting versus endarterectomy for treatment of carotid artery stenosis. N Eng J Med. 2010;363:11-23.
- Gurm HS, Yadav JS, Fayad P, et al. Long-term results of carotid stenting versus endarteerctomy in high risk patients. N Eng J Med. 2008;358:1572-9.
- Eckstein HH, Ringleb P, Allenberg JR, et al. Results of the Stent-Protected angioplasty versus Carotid Endarterectomy (SPACE) study to treat symptomatic stenoses at 2 years: a multinational, prospective, randomized trial. Lancet Neurol. 2008;7:893-902.
- Mas JL, trinquart L, Leys d, et al. Endarterectomy versus Angioplasty in patients with symptomatic severe carotid stenosis (EVA-3S) trial: results up to 4 years from a randmised, multicentre trial. Lancet Neurol. 2008;7:885-892.
- Ederle J, Bonati LH, Dobson J, et al. Endovascular treatment with angioplasty or stenting versus endarterectomy in patients with carotid artery stenosis in the Carotid And Vertebral Artery Transluminal Angioplasty Study (CAVATAS): long term follow-up of a randomized trial. Lancet Neurol. 2009;8(10):898-907.
- Mas J-L, Arquizan C, Calvet D, et al. Long-term follow-up study of endarterectomy versus angioplasty in patients with symptomatic severe carotid stenosis trial. Stroke. 2014;45:2750-2756.
- Lal BK, Beach KW, Roubin GS, et al. Restenosis after carotid artery stenting and endarterectomy: a secondary analysis of CREST. Lancet neurology. 2012;11:755-763.
- Silver FL, Mackey A, Clark WM, et al. Safety of Stenting and Endarterectomy by Symptomatic Status in the Carotid Revascularization Endarterectomy Versus Stenting Trial (CREST). Stroke. 2011;42:675-680.
- ACST-2 Collaborative Group, Halliday A, Bulbulia R, et al. Status update and interim results from the asymptomatic carotid surgery trial-2 (ACST-2). Eur J Vasc Endovasc Surg. 2013;46(5):510-8.
- De Borst GJ. Cranial nerve palsy should not be included within a primary composite endpoint in carotid surgery trials. Eur J Vasc Endovasc Surg. 2014;47(6):583-4.
- Fokkema M, Vrijenhoek JE, Den Ruijter HM, et al. Stenting versus Endarterectomy for restenosis following prior ipsilateral carotid endarteerctomy : an individual patient data meta-analysis. Ann Surg. 2014; Epub ahead of print.
- Fokkema M, den Hartog AG, Bots ML, et al. Stenting versus surgery in patients with carotid stenosis after previous cervical radiation therapy: systematic review and meta-analysis. Stroke. 2012;43(3):793-801.
- Bonati LH, Jongen LM, Haller S, et al. New ischaemic brain lesions on MRI after stenting for symptomatic carotid stenosis: a substudy of the International Carotid Stenting study (ICSS). Lancet Neurol. 2010;9(4):353-62.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 26-10-2017
Beoordeeld op geldigheid : 12-09-2024
De ontwikkelingen op het gebied van de acute opvang, secundaire preventie en revalidatie volgen elkaar in steeds sneller tempo op. Daarom werd in 2018 een kerngroep van neurologen, revalidatiearts en huisarts geïnstalleerd om snel op nieuwe ontwikkelingen te kunnen inspelen. In 2018 werden de modules over plaatjesaggregatieremmers en Directe Orale Anticoagulantia geupdate en nieuwe modules over tenecteplase en endovasculaire behandeling ontwikkeld. In 2019 wordt opnieuw geprioriteerd welke wijzigingen nodig zijn.
Deze kerngroep vergadert tenminste tweemaal per jaar om op basis van eigen inzichten en/of signalen uit het veld te beoordelen of hernieuwde aanvulling en/of revisie van (onderdelen van) de richtlijn gewenst is. Andere disciplines namen zitting in een klankbordgroep en worden betrokken afhankelijk van het onderwerp van de te reviseren module.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Op sommige plaatsen in deze richtlijn wordt verwezen naar de richtlijn Beroerte uit 2008. Het hoofdstuk Verantwoording uit deze richtlijn is op te vragen bij de Nederlandse Vereniging voor Neurologie.
In samenwerking met:
Koninklijk Nederlands Genootschap voor Fysiotherapie
Nederlands Huisartsen Genootschap
Nederlands Instituut van Psychologen
Nederlandse Vereniging voor Logopedie & Foniatrie
Nederlandse Vereniging voor Klinische Neurofysiologie
Nederlandse Vereniging voor Spoedeisende Hulp Artsen
Verenso Vereniging van Specialisten Ouderengeneeskunde
Verpleegkundigen & Verzorgenden Nederland (Neuro/stroke verpleegkundigen en Ambulancezorg)
Nederlandse Vereniging voor Ergotherapie
Doel en doelgroep
Doel
Het doel van deze op wetenschappelijk bewijs gebaseerde (evidence based) richtlijn is het bieden van een basis voor optimale zorg voor patiënten met een herseninfarct of hersenbloeding. Daarnaast draagt de richtlijn bij aan afstemming van de zorg tussen de verschillende zorgverleners en aan het terugdringen van ongewenste praktijkvariatie.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met een herseninfarct of hersenbloeding.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met TIA, herseninfarct of hersenbloeding. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende drie jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- prof. dr. D.W.J. Dippel (voorzitter), neuroloog, Erasmus MC Rotterdam, namens de Nederlandse Vereniging voor Neurologie (NVN)
- dr. H.B. van der Worp, neuroloog, UMC Utrecht, namens de NVN
- dr. J. Hofmeijer, neuroloog, Rijnstate ziekenhuis Arnhem, namens de NVN
- dr. R.M. van den Berg-Vos, neuroloog, OLVG West Amsterdam, namens de NVN
- dr. E.J. van Dijk, neuroloog, Radboudumc Nijmegen, namens de NVN
- M. Geurts, AIOS neurologie, UMC Utrecht, namens de NVN en de Vereniging Arts-Assistenten in opleiding tot Neuroloog (VAAN)
- prof. Dr. W. Mess, neuroloog/klinisch neurofysioloog, Maastricht UMC, namens de NVN
- dr. L.M.L. de Lau, neuroloog, Slotervaartziekenhuis Amsterdam, namens de NVN
- M. Kouwenhoven, revalidatiearts, De Hoogstraat Utrecht, namens de Nederlandse Vereniging van Revalidatiearsten (VRA)
- dr. B.J. Bouma, cardioloog, AMC Amsterdam, namens de Nederlandse Vereniging voor Cardiologie (NVvC)
- prof. dr. G.J. de Borst, vaatchirurg, UMC Utrecht, namens de Nederlandse Verenging voor Vaatchirurgie (NVvV)/Nederlandse Vereniging voor Heelkunde (NVvH)
- dr. J.A.H.R. Claassen, klinisch geriater, Radboudumc Nijmegen, namens de Nederlandse Vereniging voor Klinische Geriatrie (NVKG)
- dr. M. van Eijk, specialist ouderengeneeskunde, LUMC Leiden, namens Verenso Vereniging van Specialisten Ouderengeneeskunde
- dr. B.J.H. van den Born, internist, AMC Amsterdam, namens de Nederlandse Internisten Vereniging (NIV)/ Internistisch Vasculair Genootschap (IVG)
- dr. H.D. Boogaarts, neurochirurg, Radboudumc Nijmegen, namens de Nederlandse Vereniging voor Neurochirurgie (NVvN)
- dr. W. van Zwam, radioloog, Maastricht UMC, namens de Nederlandse Vereniging voor Radiologie (NVvR)
- I. Brummer, SEH-arts, Scheper ziekenhuis Emmen, namens de Nederlandse Vereniging van Spoedeisende Hulp Artsen (NVSHA)
- prof. dr. G. Kwakkel, hoogleraar neurorevalidatie, Vrije Universiteit Amsterdam, namens het Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF)
- A.F.E. Verburg, huisarts, namens het Nederlands Huisartsen Genootschap (NHG)
- K. Kanselaar, MANP, verpleegkundig specialist vasculaire neurologie Radboudumc Nijmegen, namens Verpleegkundigen & Verzorgenden Nederland (V&VN) afdeling Neuro & Revalidatie, werkgroep CVA
- G.J. Deddens, Verpleegkundig Specialist Acute Zorg, namens V&VN afdeling Ambulancezorg
- prof. dr. C.M. van Heugten, hoogleraar klinische neuropsychologie, Maastricht University, namens het Nederlands Instituut van Psychologen (NIP) sectie neuropsychologie.
- dr. S.K. Schiemanck, revalidatiearts, Leiden UMC, namens de VRA
- A. Harbers, klinisch linguist en logopediste, Klimmendaal, namens Nederlandse Vereniging voor Logopedie en Foniatrie (NVLF)
Met medewerking van
- dr. P.J. Nederkoorn, neuroloog, Academisch Medisch Centrum, Amsterdam
- dr. E. Steultjens, Hogeschool van Arnhem en Nijmegen, namens Ergotherapie Nederland
- E. van Gorp, namens de Patiëntenvereniging Hersenletsel.nl
- dr. R.H. Wimmers, namens de Hartstichting
- Ir. K. Idema, namens de Hart&Vaatgroep
Met ondersteuning van
- dr. M. Molag, adviseur, Kennisinstituut van Medisch Specialisten
- dr. I. Mostovaya, adviseur, Kennisinstituut van Medisch Specialisten
- dr. M. A. Pols, senior adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen door middel van reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten, een overzicht vindt u hieronder.
|
Werkgroeplid |
Functie |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
|
Berg-Vos |
Neuroloog |
Geen |
Geen |
Bestuurslid kennisnetwerk CVA |
Geen |
Geen |
Geen |
|
Boogaarts |
Neurochirurg |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Born |
Internist-vasculair geneeskundige |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Borst |
Vaatchirurg |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Bouma |
Cardioloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Brummer |
SEH-arts |
Geen |
Geen |
Lid richtlijnencommissie NVSHA |
Geen |
Geen |
Geen |
|
Claassen |
Klinisch geriater (0,6 fte) |
Geen |
Geen |
Geen |
Onderzoeksleider van 3 onderzoeksprojecten, (mede)gefinancierd door het onderzoeksfonds van Alzheimer Nederland (patiëntenvereniging), en 1 project gefinancierd door ISAO (Alzheimerfonds) |
Geen |
Mijn werkgever (Radboudumc) heeft financiele vergoedingen ontvangen van bedrijven (farmaceutische industrie) voor presentaties die ik op uitnodiging van die bedrijven heb gegeven, of voor symposia die ik voor die brdrijven heb (nede)georganiseerd. De vergoeding betrof steeds een vergoeding voor de gewerkte uren. |
|
Deddens |
Verpleegkundige Specialist Acute Zorg en Ambulanceverpleegkundige |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Dippel |
Neuroloog, hoogleraar acute behandeling neurovasculaire aandoeningen |
Geen |
Geen |
Niet van toepassing |
Het MR CLEAN onderzoek (www.mrclean-trial.org) wordt in geringe mate (10%) zonder voorwaarden gesteund door enkele medische industriën en importeurs. Deze staan vermeld op de website. Ik ben een van de hoofdonderzoekers van deze trial. |
Geen |
Geen |
|
Geurts |
AIOS neurologie |
Geen |
Geen |
Geen |
M. Geurts is studie-coordinator van de COOLing for Ischaemic Stroke Trial (COOLIST), dat wordt gefinancierd door de Nederlandse Hartstichting (2010B239). |
Geen |
Geen |
|
Harbers |
Logopediste & Klinisch Linguist |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Hofmeijer |
Neuroloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Kanselaar-Martens |
Verpleegkunde specialist Radboudumc |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Kwakkel |
Hoogleraar Neurorevalidatie |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Schiemanck |
Revalidatiearts Tot 31-12-2014: AMC ; Medisch Leidinggevende Neuroteam, AMC; Consulent Revalidatiegeneeskunde aan Zorgcentrum Berkenstede, Stichting Cordaan, Diemen, sinds 01-07-2006, Heden: subafdelingshoofd Leids Universitair Medisch Centrum |
Geen |
Geen |
Geen |
* Onderzoeksproject ism Radboudumc Efficacy of functional electrical stimulation of the peroneal nerve with the Actigait system on walking efficiency and patient satisfaction in stroke patients suffering from a drop foot, 2007-2014; studie is afgerond; financiering door Otto Bock Healthcare |
Geen |
Geen |
|
Spruit-Van Eijk |
Specialist Ouderengeneeskunde en UD PHEG |
Geen |
Geen |
Geen |
2007 - 2012 GRAMPS studie gefinancierd door 2 grote zorginstanties de Zorgboog en SVRZ, zorgt in Zeeland |
Geen |
Geen |
|
Van den Born |
internist |
Geen |
Geen |
Bestuurslid van de Nederlandse Hypertensievereniging |
Geen |
Geen |
Geen |
|
Van Dijk |
Neuroloog |
Geen |
Geen |
Bestuurslid Stafconvent Radboudumc: betaald |
Onderzoek naar effectiviteit en veiligheid DOACs in Nederland (gefinancierd door GGG-ZonMw / VWS): 110Keuro |
Geen |
Geen |
|
Van Heugten |
Psycholoog, hoogleraar Klinisch Neuropsychologie |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Verburg |
Wetenschappelijk medewerker en |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Zwam |
Radioloog |
Geen |
Geen |
Geen |
Stuurgroeplid MrClean studie |
Geen |
Geen |
Meelezers
|
Werkgroeplid |
Functie |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
|
Idema |
Beleidsadviseur (De Hart&Vaatgroep) |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Kouwenhoven |
Revalidatiearts |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Steultjens |
ass. Lector Neurorevalidatie |
Geen |
Geen |
lid raad van advies Ergotherapie Nederland |
Geen |
eigen onderneming gericht op bijscholing aan ergotherapeuten m.b.t. twee specifieke methoden van diagnostiek en interventie ook toepasbaar bij cliënten na bereorte. Scholing is niet gericht op toepassing multi-disciplinaire richtlijnen |
Geen |
|
Van Gorp-Clion |
Tot 1 juli 2014 Voorzitter, daarna bestuurslid |
Geen |
Doelgroep/ achterban van de patiëntenvereniging |
Belangen van CVA-patiënten bij de patiëntenorganisatie |
Geen |
Geen |
Geen |
|
Wielemaker |
Hoofd patiëntenzorg Hersenstichting Nederland |
Geen |
Geen |
Geen |
Geen deelname aan onderzoek. Ben zelf werkzaam bij een gezondheidsfonds, de Hersenstichting verleent wel subsidie aan wetenschappelijk onderzoek. |
Geen |
De Hersenstichting heeft een puur faciliterende rol als het gaat om ontwikkeling van bijvoorbeeld een zorgstandaard, zoals nu de zorgstandaard Traumatisch Hersenletsel. Zij heeft het zorgveld de opdracht gegeven een dergelijke zorgstandaard te ontwikkelen en stelt daarvoor de middelen ter beschikking. Meer informatie op www.zorgstandaardnah.nl |
|
Wimmers |
Teammanager Kennis & Trends, Hartstichting |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het raadplegen van afgevaardigden van de patiëntenvereniging hersenletsel.nl, de Hartstichting en de Hart&Vaatgroep. Deze partijen werden ook uitgenodigd om tijdens de invitational conference de door hen ervaren knelpunten aan te dragen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan deze partijen.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit (www.demedischspecialist.nl/richtlijnen). Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreetrust.org) dat een internationaal breed geaccepteerd instrument is en op Richtlijnen voor richtlijnen voor de beoordeling van de kwaliteit van richtlijnen (www.zorginstituutnederland.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Achmea en VGZ namens Zorgverzekeraars Nederland, het College voor Zorgverzekeringen (tegenwoordig Zorginstituut Nederland), de Inspectie voor de Gezondheidszorg, CVA Patiëntenvereniging Hersenletsel.nl, de Hart&Vaatgroep en de Hartstichting, via een invitational conference.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken, waarna de definitieve uitgangsvragen werden vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk en onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt inhoudt.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen, via de websites van enkele grote organisaties, zoals de American Heart Association en de European Stroke Organization. Tevens werd in de tijdschriften Stroke en Int J Stroke gezocht naar richtlijnen. Vervolgens werd op de website van de Cochrane Library gezocht naar systematische reviews. Tot slot werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases (NLM Pubmed, Google Scholar, Embase, Cochrane Library). De zoektermen werden geformuleerd aan de hand van een searchvraag. De searchvraag werd vertaald in een PICO (patient, intervention, control, outcome). Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepsleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in het hoofdstuk van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van vertrouwen in de literatuurconclusie (zie http://www.guidelinedevelopment.org/handbook/).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden.
Formuleren van de conclusies
Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusies, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt deze getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen door de werkgroep en beschreven in de literatuursamenvatting.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld binnen de clinical audit van de NVN om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de paragraaf Kennislacunes behorend bij elke module.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.

