Bloeddrukverlaging bij hersenbloeding
Uitgangsvraag
Moet een verhoogde bloeddruk bij patiënten met een hersenbloeding in de acute fase medicamenteus worden verlaagd? Zo ja: hoe en wanneer?
Aanbeveling
Streef bij patiënten met een spontane intracerebrale bloeding en een systolische bloeddruk van 150 mmHg of hoger, die binnen zes uur na ontstaan van de symptomen kunnen worden behandeld, naar een systolische bloeddruk van 140 mmHg, te bereiken binnen één uur. Gebruik hiervoor in de acute fase zo nodig intraveneuze kortwerkende medicatie (labetalol of nicardipine). Start na 24 uur medicatie per os en bouw intraveneuze medicatie af. Kies bij voorkeur voor medicatie per os die ook beoogd wordt op de langere termijn ter secundaire preventie (bijvoorbeeld diureticum en/of ACE-remmer, zie de CVRM-richtlijn 2013).
Streef bij patiënten met een spontane intracerebrale bloeding en een systolische bloeddruk hoger dan 180 mmHg, die niet binnen zes uur na ontstaan van de symptomen kunnen worden behandeld, naar een geleidelijke daling van de systolische bloeddruk in enkele uren, naar een streefwaarde van 140 mmHg. Start na 24 uur medicatie per os en bouw intraveneuze medicatie af. Kies bij voorkeur voor medicatie die ook beoogd wordt op de langere termijn ter secundaire preventie (bijvoorbeeld diureticum en/of ACE-remmer, zie de CVRM richtlijn 2013).
Intraveneuze behandeling met labetalol of nicardipine kan worden uitgevoerd op de stroke unit. Invasieve arteriële bloeddrukmeting is hierbij niet obligaat, als frequente bloeddrukmeting gewaarborgd is.
Overwegingen
De behandeling met bloedstollingsbeïnvloedende medicamenten wil de werkgroep hier kort noemen en verder verwijzen naar hoofstuk 9 (beleid bij bloedingen en ingrepen) van de richtlijn Antitrombotisch beleid (2016). In de acute fase van een ICH is er een absolute indicatie voor staken van anticoagulantia. Bij vitamine-K-antagonisten is couperen met 4-factorenconcentraat en vitamine K geïndiceerd. Bij een dabigatran-gerelateerde bloeding is er een indicatie voor idaricuzimab (Pollack, 2015). Daarmee wordt het anticoagulerende effect gecoupeerd, maar effecten op de uitkomsten zijn onduidelijk. Voor verdere specificering van beleid rondom bloedstollingsbeïnvloedende medicamenten verwijzen we naar de richtlijn Antitrombotisch beleid, Module Strategie in geval van bloeding of ingrepen (2016). Transfusie van trombocyten bij patiënten met een ICH en gebruik van plaatjesremmers leidt tot slechtere uitkomsten (Baharoglu, 2016).
Deze paragraaf gaat verder in op de behandeling van hoge bloeddruk bij patiënten met een acute intracrebrale bloeding.
Het verschil in uitkomst ten gunste van de intensief behandelde patiëntengroep in INTERACT 2 was klein (absolute risicoreductie voor overlijden of slecht herstel 3,6% na drie maanden). In de primaire (klassieke dichotome) analyse was dit verschil niet statistisch significant. In een ongeadjusteerde secundaire (ordinale) analyse werd wel statistische significantie bereikt. De ordinale analyse was toegevoegd aan het analyseplan en het studieprotocol voordat de dataverzameling was voltooid en zonder inzicht in (voorlopige) resultaten. De richting van het behandelingseffect was gelijk in alle vooraf gedefinieerde subgroepen, waaronder subgroepen op basis van leeftijd (jonger dan 65 jaar vs. 65 jaar en ouder) en plaats van de bloeding (diepe lokalisatie vs. andere lokalisatie) (Anderson, 2013). Er is dus geen bewijs dat het effect anders is op hogere leeftijd.
Het gebrek aan statistische significantie in de primaire analyse is mogelijk gerelateerd aan effectdilutie door het relatief kleine verschil in bloeddruk tussen de behandelgroepen. Dit bloeddrukcontrast was kleiner dan beoogd, omdat de gemiddelde bloeddruk in de controlegroep relatief laag was (164 mmHg na één uur en 153 mmHg na zes uur). Eerdere observationele onderzoeken lieten een hoog risico zien op een slechte uitkomst bij een systolische bloeddruk hoger dan 210 mmHg (Okumura, 2005; Vemmos, 2004; Zhang, 2008), een hoog risico op overlijden bij een systolische bloeddruk hoger dan 180 mmHg (Okumura, 2005) en een toename van de kans op een slechte uitkomst bij een oplopende systolische bloeddruk (Zhang, 2008). De relatief lage bloeddruk in de standaard behandelde patiënten in INTERACT II is gerelateerd aan het hoge percentage (43%) van de patiënten, dat tóch intraveneus werd behandeld met bloeddrukverlagers. Omdat in veel Nederlandse centra tot op heden een bloeddruk tot 220/120 mmHg geaccepteerd wordt, is het de vraag of deze resultaten direct toepasbaar zijn op de Nederlandse situatie.
Theoretisch kan bloeddrukverlaging gevaarlijk zijn, omdat die kan leiden tot afname van de cerebrale perfusiedruk en tot cerebrale ischemie, met name bij pre-existente hypertensie. In INTERACT II bestond echter geen verschil tussen de behandelingsgroepen in het optreden van sterfte of andere complicaties. Na statistische correctie voor pre-existente hypertensie bleef in INTERACT het behandelingseffect behouden, zonder toegenomen risico op complicaties bij pre-existente hypertensie. De afwezigheid van toegenomen sterfte bij intensieve behandeling van een verhoogde bloeddruk is consistent met eerdere onderzoeken (Antihypertensive Treatment of Acute Cerebral Hemorrhage (ATACH) investigators, 2010; Potter, 2009; Sandset, 2011). In INTERACT II was de gemiddelde systolische bloeddruk in de interventiegroep 150 mmHg. De streefwaarde van 140 mmHg werd gehaald bij 462 patiënten (33%). Ernstige hypotensie (gedefinieerd als hypotensie met klinische consequenties (veelal achteruitgang van de nierfunctie) waarvoor behandeling met intraveneuze vulling of vasopressieve medicatie nodig was) werd bij 0,5% van de patiënten gezien, even vaak in de interventiegroep als in de controlegroep. In ATACH-2 werd vaker nierinsufficiëntie gezien bij intensief behandelde patiënten, maar er was geen verschil tussen de behandelingsgroepen ten aanzien van neurologische complicaties. De systolische bloeddruk kan daarom in de acute fase waarschijnlijk veilig worden verlaagd naar een streefwaarde van 140 mmHg systolisch.
In INTERACT II was de mediane tijd tussen ontstaan van de bloeding en start van de bloeddrukverlagende behandeling 4,0 uur (IQR 2,9-5,1) (Anderson, 2013). In alle voorgaande onderzoeken, met een neutrale uitkomst, was dit tijdsinterval langer. In de SCAST-trial, naar het effect van bloeddrukverlaging bij patiënten met een herseninfarct of -bloeding met de angiotensine-II-receptorantagonist candesartan, werd in de subgroep van patiënten met een hersenbloeding pas gestart met de behandeling na gemiddeld 18 uur. In deze subgroep van patiënten met een hersenbloeding was behandeling met candesartan geassocieerd met een gelijke kans op overlijden of een recidief herseninfarct, maar met een slechter functioneel herstel na zes maanden (Jusufovic, 2014). Daarentegen werd in de subgroep van patiënten die snel werd behandeld (<6 uur na ontstaan van de symptomen) voordeel van de behandeling gevonden, met een statistisch significant, lineair verband tussen snelheid van de behandeling en functioneel herstel (Jusufovic, 2014). In deze vroeg (<6 uur) behandelde groep zaten echter patiënten met een hersenbloeding en patiënten met een herseninfarct en er werd geen onderscheid gemaakt tussen effecten bij hersenbloedingen en -infarcten. Snelle initiatie van bloeddrukverlaging is waarschijnlijk belangrijk. De resultaten van INTERACT 2 kunnen waarschijnlijk niet worden geëxtrapoleerd naar patiënten die pas na zes uur na ontstaan van de bloeding kunnen worden behandeld.
Een groot deel van de in INTERACT II geïncludeerde patiënten was afkomstig uit China. Hoewel de subgroepanalyse eenzelfde risicoreductie voor Chinese en niet-Chinese patiënten toonde, is het onbekend of de effecten van bloeddrukverlaging bij de Chinese en niet-Chinese populatie gelijk zijn. De behandeling van hypertensie in de controlegroep van de trial was intensiever dan de huidige standaardbehandeling in Nederland. Bovendien bestond intraveneuze behandeling vaak uit de alfablokker urapidil, een middel dat in Nederland weinig wordt gebruikt. Om deze redenen verdient extrapolatie van de resultaten naar de Nederlandse populatie enige voorzichtigheid.
Het veronderstelde mechanisme van het gunstige effect van bloeddrukverlaging (beperking van hematoomgrootte) kon in INTERACT II, in tegenstelling tot in INTERACT I, niet worden aangetoond.
De werkgroep is van mening dat in de INTERACT- en ATACH-trials effectverdunning waarschijnlijk een belangrijke rol heeft gespeeld in het reduceren van het het voordeel van intensieve bloeddrukverlaging bij patiënten met een hersenbloeding. Immers, ook in de controlegroepen werd een lage systolische bloeddruk bereikt. De werkgroep acht het aannemelijk dat het voordeel van intensieve bloeddrukverlaging groter was geweest, als de controlegroep was behandeld volgens de huidige klinische praktijk in Nederland, waarbij systolische bloeddrukken van boven 200 mmHg eerder regel dan uitzondering zijn. Op basis van de data uit INTERACT kan de werkgroep concluderen dat intensieve bloeddrukdaling naar een streefwaarde van 140 mmHg of lager een gunstig effect heeft. Hierbij vindt de werkgroep de effectschatting op grond van de geprespecificeerde ordinale analyse in INTERACT van doorslaggevende waarde. De resultaten en het bereikte behandelcontrast in de ATTACH-2-studie vindt de werkgroep niet van toepassing op de Nederlandse situatie. Voorts vindt de werkgroep dat voldoende is aangetoond dat bloeddrukverlaging in de acute fase van een hersenbloeding veilig is.
Om die redenen beveelt de werkgroep aan bij patiënten met een hersenbloeding te streven naar een systolische bloeddruk van 140 mmHg, in eerste instantie met intraveneuze medicatie. Tevens is de werkgroep van mening dat alle patiënten met een acute hersenbloeding bij voorkeur worden opgenomen op een stroke unit, ook als een patiënt behandeld wordt met intraveneuze bloeddrukverlagende medicatie.
Onderbouwing
Achtergrond
Patiënten met een acute hersenbloeding hebben vaak een hoge tot zeer hoge bloeddruk. Het is onduidelijk of het nuttig of juist schadelijk is om een verhoogde bloeddruk in de acute fase te verlagen.
Conclusies / Summary of Findings
|
Matig GRADE |
Er is matig bewijs dat bij patiënten met een spontane intracerebrale bloeding een snelle verlaging van de systolische bloeddruk naar een streefwaarde van <140 mmHg een vergelijkbare kans geeft op een goed functioneel herstel als behandeling met een streefwaarde van <180 mmHg, indien deze behandeling wordt gestart binnen zes uur na het ontstaan van de bloeding.
Bronnen (Anderson, 2008 en 2013) |
|
Laag GRADE |
Er zijn geen aanwijzingen dat snelle verlaging van de systolische bloeddruk naar een streefwaarde van <140 mmHg, binnen zes uur na het ontstaan van een spontane intracerebrale bloeding, leidt tot toegenomen sterfte of nadelige neurologische uitkomsten.
Bronnen (Anderson, 2008 en 2013) |
Samenvatting literatuur
In INTERACT 1 en 2 (Anderson, 2008 en 2013) werden respectievelijk 404 en 2839 patiënten van 18 jaar of ouder geïncludeerd (totaal 3243 patiënten) met een spontane intracerebrale bloeding en een systolische bloeddruk tussen 150 en 220 mmHg (zie evidencetabel in de bijlage). De gemiddelde leeftijd van de patiënten was 63 jaar en ruim de helft was 65 jaar of ouder. Patiënten werden geïncludeerd binnen zes uur na de bloeding. In de interventiegroep was het doel de systolische bloeddruk te verlagen tot een streefwaarde van minder dan 140 mmHg binnen één uur na inclusie. In de controlegroep was de streefwaarde voor de systolische bloeddruk lager dan 180 mmHg. De keuze voor te gebruiken medicamenten was aan de behandelende arts. Er kon worden behandeld met intraveneuze medicatie of medicatie per os. De behandeling werd gedurende zeven dagen toegepast. De follow-up duur was 90 dagen. In INTERACT II werd een verlaging van de gemiddelde bloeddruk van 14 mmHg in de interventiegroep (150 mmHg) ten opzichte van de controlegroep (164 mmHg) bereikt. Na 6 uur was de gemiddelde bloeddruk verder gedaald naar 139 en 153 mmHg, respectievelijk.
In de ATACH-2 trial werden 1000 patiënten met een intracerebrale bloeding gerandomiseerd naar behandeling gericht op een streefwaarde voor de systolische bloeddruk tussen 110 en 139 mmHg of tussen 140 en 189 mmHg (Qureshi, 2016). Nicardipine werd daartoe intraveneus toegediend binnen 4,5 uur na ontstaan van de symptomen. In ATACH-2 werd binnen twee uur in de controlegroep een gemiddelde systolische bloeddruk van 141 mmHg bereikt en in de interventiegroep een gemiddelde systolische bloeddruk van 129 mmHg. De systolische bloeddruk bij randomisatie was 201 mmHg.
Functioneel herstel
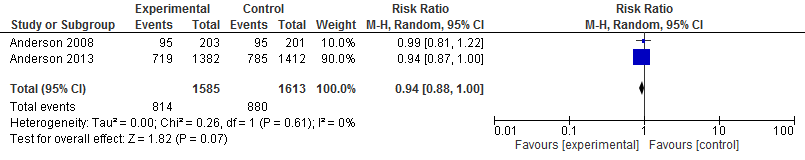
Functioneel herstel werd gemeten met behulp van de modified Rankin scale (mRS) op drie maanden na inclusie in de studie. Deze schaal kent 6 categorieën, waarbij 0 betekent dat er geen neurologische uitval is, en 5 staat voor ernstige functionele beperkingen. Om pragmatische redenen werd categorie 6 (overlijden) toegevoegd. In de INTERACT-onderzoeken werd in de primaire analyse de score op de mRS geanalyseerd als dichotome variabele, waarbij een score van 0 tot 3 werd gedefinieerd als een goede uitkomst en een score van 4 tot 6 als een slechte uitkomst. In de interventiegroep had 51% van de patiënten (814/1585) een slechte uitkomst, vergeleken met 55% (880/1613) in de controlegroep (RR 0,94; 95% BI 0,88 tot 1,00; p=0,07; Figuur 1). Met een vooraf bepaalde secundaire analyse werd de verdeling van uitkomsten over de categorieën van de mRS in INTERACT 2 ordinaal geanalyseerd. Daarmee toonde de ongeadjusteerde common OR een significante verschuiving van gemiddeld richting goed herstel (cOR: 0,87; 95% BI 0,77 tot 1,00; p=0.04). In de ATACH-2 trial werd de score op de mRS geanalyseerd als dichotome variabele, waarbij een score van 0 tot 3 werd gedefinieerd als een goede uitkomst en een score van 4 tot 6 als een slechte uitkomst. De trial werd na 1000 inclusies op basis van een geplande interimanalyse gestaakt vanwege futiliteit. In de interventiegroep had 39% van de patiënten (186/481) een slechte uitkomst, vergeleken met 38% (181/480) in controlegroep (RR 1,04; 95% BI 0,85 tot 1,27).
Figuur 1 Gepoolde data betreffende invaliditeit en sterfte gemeten met de modified Rankin scale (4 tot 6) na drie maanden

Mortaliteit
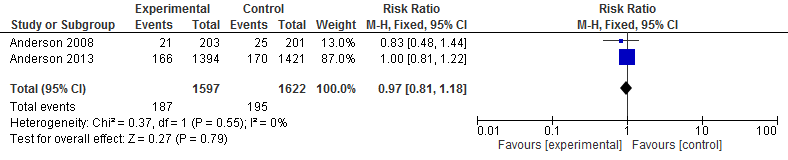
INTERACT I en II: In de interventiegroep overleed 12% van de patiënten (187/1597), vergeleken met 12% (195/1622) in de controlegroep (RR 0,97; 95% BI 0,81 tot 1,18; p=0,79; figuur 2). ATACH-2: In de interventiegroep overleed 6,6% van de patiënten (33/500), vergeleken met 6,8% (34/500) in de controlegroep (RR 0,97; 95% BI 0,60 tot 1,57; p=0,90.
Figuur 2 Gepoolde data betreffende mortaliteit binnen drie maanden

Bewijskracht van de literatuur
Uitkomstmaten: functioneel herstel
De bewijskracht van een systematische review van gerandomiseerd onderzoek start hoog. Een verschil van 2% in absolute risicoreductie werd klinisch relevant gevonden. Omdat het 95% betrouwbaarheidsinterval de effectschatting van klinische relevantie overschrijdt wordt de betrouwbaarheid van de conclusie met 1 punt gedowngrade wegens imprecisie en wordt de bewijskracht van de INTERACT-trials als matig gewaardeerd.
Uitkomstmaten: mortaliteit
De bewijskracht van een systematische review van gerandomiseerd onderzoek start hoog. Wegens imprecisie (omdat het 95% betrouwbaarheidsinterval de effectschatting van klinische relevantie overschrijdt aan beide kanten van de 1) wordt de conclusie met twee punten gedowngrade.
Zoeken en selecteren
De uitgangsvraag is of een verhoogde bloeddruk bij patiënten met een hersenbloeding in de acute fase medicamenteus moet worden verlaagd. Deze vraag werd vertaald in de volgende PICO:
P patiënten met een acute hersenbloeding en hoge bloeddruk (>140mm Hg systolisch);
I acute medicamenteuze verlaging van de bloeddruk;
C standaardbehandeling;
O functioneel herstel en mortaliteit.
Voor beantwoording van de uitgangsvraag zijn de volgende uitkomstmaten van belang geacht: functioneel herstel, sterfte. Een absolute risicoreductie van 2% in sterfte/afhankelijkheid werd al klinisch relevant geacht voor deze relatief eenvoudige behandeling.
In de databases Medline (OVID), Embase en Cochrane is met relevante zoektermen gezocht naar de acute behandeling van hoge bloeddruk na een hersenbloeding. De zoekverantwoording is weergegeven in bijlage. De literatuurzoekactie leverde 270 treffers op. Onderzoeken die voldeden aan de volgende selectiecriteria zijn opgenomen in de samenvatting van de literatuur: betrof patiënten met een parenchymateuze hersenbloeding, waarbij verhoogde bloeddruk acuut (binnen 24 uur) verlaagd werd in vergelijking met standaardbehandeling, en waarbij de uitkomsten gerapporteerd werden als sterfte of functioneel herstel. Twee multicenter RCTs (INTERACT 1 en 2 (Anderson, 2008 en 2013) zijn opgenomen in de literatuuranalyse. Daarnaast wordt we de ATACH-2 studie besproken (Qureshi, 2016).
Referenties
- Anderson CS, Heeley E, Huang Y, et al. Rapid blood-pressure lowering in patients with acute intracerebral hemorrhage. N. Engl. J. Med. 2013;368:23552365.
- Anderson CS, Huang Y, Wang JG, et al. Intensive blood pressure reduction in acute cerebral haemorrhage trial (INTERACT): a randomised pilot trial. Lancet Neurol. 2008;7:391399.
- Antihypertensive Treatment of Acute Cerebral Hemorrhage (ATACH) investigators. Antihypertensive treatment of acute cerebral hemorrhage. Crit. Care Med. 2010;38:637648.
- Baharoglu MI, Cordonnier C, Salman RA-S, et al. Platelet transfusion versus standard care after acute stroke due to spontaneous cerebral haemorrhage associated with antiplatelet therapy (PATCH): a randomised, open-label, phase 3 trial. The Lancet. 2016;387(10038):2605-13.
- Jusufovic M, Sandset EC, Bath PMW, et al. Blood pressure-lowering treatment with candesartan in patients with acute hemorrhagic stroke. Stroke J. Cereb. Circ. 2014;45:34403442.
- Okumura K, Ohya Y, Maehara A, et al. Effects of blood pressure levels on case fatality after acute stroke. J. Hypertens. 2005;23:12171223.
- Pollack CV, Jr., Reilly PA, Eikelboom J, et al. Idarucizumab for Dabigatran Reversal. N Engl J Med. 2015;373(6):511-20.
- Potter JF, Robinson TG, Ford GA, et al. Controlling hypertension and hypotension immediately post-stroke (CHHIPS): a randomised, placebo-controlled, double-blind pilot trial. Lancet Neurol. 2009;8:4856.
- Qureshi AI, Palesch YY, Barsan WG, et al. Intensive Blood-Pressure Lowering in Patients with Acute Cerebral Hemorrhage. N Engl J Med. 2016;375:1033-43.
- Sandset EC, Bath PMW, Boysen G, et al. The angiotensin-receptor blocker candesartan for treatment of acute stroke (SCAST): a randomised, placebo-controlled, double-blind trial. Lancet. 2011;377:741750.
- Vemmos KN, Tsivgoulis G, Spengos K, et al. U-shaped relationship between mortality and admission blood pressure in patients with acute stroke. J. Intern. Med. 2004;255:257265.
- Zhang Y, Reilly KH, Tong W, et al. Blood pressure and clinical outcome among patients with acute stroke in Inner Mongolia, China. J. Hypertens. 2008;26:14461452.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
Research question: Moet een verhoogde bloeddruk bij patiënten met een hersenbloeding in de acute fase medicamenteus worden verlaagd? Zo ja: hoe en wanneer?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Anderson, 2013 |
Type of study: RCT
Setting: 144 hospitals, in 21 countries
Country: not specified how many patients from each country
Source of funding: Funded by the National Health and Medical Research Council of Australia; INTERACT2 ClinicalTrials.gov number, NCT00716079
|
Inclusion criteria: spontaneous intracerebral haemorrhage (ICH) within 6 hours of onset and a blood pressure between 150 and 220 mm Hg.
Exclusion criteria: a structural cerebral cause for the intracerebral haemorrhage, if they were in a deep coma defined as a score of 3 to 5 on the Glasgow Coma Scale (GCS), in which scores range from 3 to 15, with lower scores indicating reduced levels of consciousness), if they had a massive hematoma with a poor prognosis, or if early surgery to evacuate the hematoma was planned.
N total at baseline: Intervention: 1399 Control: 1430
Important prognostic factors2: For example age ± SD: I: age 63 +/- 13 C: age 64 +/- 13
Sex: I: 64 % M C: 62 % M
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test): Intensive blood pressure lowering treatment (target systolic level <140 mm Hg) within 1 hour after randomization and maintaining this level for the next seven days
|
Describe control (treatment/procedure/test): Guideline-recommended blood pressure lowering treatment if BP was higher than 180 mm Hg (<180 mm Hg)
|
Length of follow-up: 90 days
Loss-to-follow-up (disability): Intervention: 21 N (1%) Reasons (describe) zie supplementary appendix
Control: 24 N (2%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Disability (Rankin scale >3) at 90 days defined as a modified Rankin Scale (mRS) score of 3 to 6 (death) Intervention: 719/1382 (52%) Control: 785/1412 (56%) (0,87; 95% CI, 0,77 to 1,00, p=0,04)
Mortality at 90 days: Intervention: 166/1394 Control: 170/1421 (12%)
|
|
|
Anderson, 2008 (Interact) |
Type of study: RCT
Setting:
Countries: China, South Korea and Australia
Source of funding: a program grant (358395) from the National Health and Medical Research Council (NHMRC) of Australia. |
Inclusion criteria: Eligible patients were aged 18 years with CT-confirmed spontaneous ICH and elevated systolic BP (2 measurements of 150 mm Hg and 220 mm Hg recorded 2 minutes apart) with the capacity to start randomly assigned BP-lowering treatment within 6 hours of ICH in a suitably monitored environment. Written informed consent was obtained from each participant or their surrogate.
Exclusion criteria: a clear indication for, or contraindication to, intensive BP lowering; ICH secondary to a structural cerebral abnormality or the use of a thrombolytic agent; recent ischemic stroke; deep coma; significant prestroke disability or medical illness; and early planned neurosurgical intervention
N total at baseline: Intervention: 151 Control: 145
Important prognostic factors2: Age ± SD: I: 63 ± 11 C: 62 ± 13
Sex: I: 58 % M C:70 % M
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
Goal was to achieve a systolic BP of 140 mm Hg within 1 hour of radnomization and subsequently to maintain this level for the next 7 days.
|
Describe control (treatment/procedure/test):
Treatment was recommended to achieve a target systolic BP of 180 mm Hg. |
Length of follow-up: 72 H
Loss-to-follow-up: Intervention: N=14 (%) Reasons (did not have CT in DICOM format)
Control: N=12 (10%) Reasons (did not have CT in DICOM format)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Disability (Rankin scale >3) at 90 days defined as a modified Rankin Scale (mRS) score of 3 to 6 (death) Intervention: 95/203 (48%) Control: 95/201 (49%)
Mortality at 90 days: Intervention: 21/203 Control: 25/201 (13%)
|
Same patients as Interact 2? |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Risk of bias table for intervention studies (randomized controlled trials)
Research question: Moet een verhoogde bloeddruk bij patiënten met een hersenbloeding in de acute fase medicamenteus worden verlaagd? Zo ja: hoe en wanneer?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Anderson, 2013 and Delcourt 2010 |
Computer randomised by internet access to a 24-h password protected website operated from The George Institute for International Health in Sydney, Australia. In China, investigators have the option of using a customised 24-h digital Interactive Voice Response System that connects to the website to allow patients to be randomised at sites where rapid access to the internet may not be possible. |
unlikely |
unclear |
Likely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Anderson, 2008 |
Computer randomised by internet access to a 24-h password protected website operated from The George Institute for International Health in Sydney, Australia. In China, investigators have the option of using a customised 24-h digital Interactive Voice Response System that connects to the website to allow patients to be randomised at sites where rapid access to the internet may not be possible. |
unlikely |
unclear |
Likely (not possible) |
unlikely |
unlikely |
unlikely |
unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has soft (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel exclusie
|
H5.1 Bloeddruk |
|
|
Referenties geselecteerde systematic review |
Evt. reden exclusie |
|
(11) Thanvi BR, Sprigg N, Munshi SK. Advances in spontaneous intracerebral haemorrhage. [Review]. International Journal of Clinical Practice 2012 Jun;66(6):556-64. |
Geen systematische search |
|
(18) Warburton E, Alawneh JA, Clatworthy PL, Morris RS. Stroke management. Clinical Evidence 2011;2011,2011. |
Opmerking: searches t/m 2010, belangrijke trials ontbreken |
|
(21) Steiner T, Bosel J. Options to restrict hematoma expansion after spontaneous intracerebral hemorrhage. [Review] [62 refs]. Stroke 2010 Feb;41(2):402-9. |
Beperkt zich niet tot hoge bloeddruk, ook neurochirurgie |
|
(22) Reddy P, Yeh YC. Use of injectable nicardipine for neurovascular indications. [Review] [29 refs]. Pharmacotherapy:The Journal of Human Pharmacology & Drug Therapy 2009 Apr;29(4):398-409. |
Andere patiëntengroep: acute traumatic brain injury of Subarachnoid hematoma |
|
(26) Qureshi AI. Acute hypertensive response in patients with stroke pathophysiology and management. Circulation 2008;118(2):176-87. |
Zoekstrategie en selectiecriteria onduidelijk |
|
(27) Alqadri SL, Qureshi AI. Management of acute hypertensive response in patients with intracerebral hemorrhage. Curr Atheroscler Rep 2012 Aug;14(4):322-7. |
Beschrijvend artikel, geen systematic review, geen RCT |
|
Referenties geselecteerde systematic review |
Evt. reden exclusie |
|
Referenties geselecteerde RCTs |
|
|
(1) Chen G, Arima H, Wu G, Heeley E, Delcourt C, Zhang P, et al. Subarachnoid extension of intracerebral hemorrhage and 90-day outcomes in INTERACT2. Stroke 2014 Jan;45(1):258-60. |
Onderwerp effect hematoma expansion op outcome, niet conform PICO |
|
(2) Kate MP, Hansen MB, Mouridsen K, Ostergaard L, Choi V, Gould BE, et al. Blood pressure reduction does not reduce perihematoma oxygenation: a CT perfusion study. Journal of Cerebral Blood Flow & Metabolism 2014 Jan;34(1):81-6. |
Uitkomstmaat perihematoma oxygenation, voldoet niet aan PICO |
|
(8) Butcher KS, Jeerakathil T, Hill M, Demchuk AM, Dowlatshahi D, Coutts SB, et al. The Intracerebral Hemorrhage Acutely Decreasing Arterial Pressure Trial. Stroke 2013 Mar;44(3):620-6. |
Uitkomstmaat cerebral blood flow, niet PICO |
|
(13) Graffagnino C, Bergese S, Love J, Schneider D, Lazaridis C, Lapointe M, et al. Clevidipine rapidly and safely reduces blood pressure in acute intracerebral hemorrhage: The accelerate trial. Cerebrovasc Dis 2013;36(3):173-80. |
Geen controlegroep, uitkomst verlaging BP, niet conform PICO |
|
(19) Sakamoto Y, Koga M, Yamagami H, Okuda S, Okada Y, Kimura K, et al. Systolic blood pressure after intravenous antihypertensive treatment and clinical outcomes in hyperacute intracerebral hemorrhage: the stroke acute management with urgent risk-factor assessment and improvement-intracerebral hemorrhage study. Stroke 2013 Jul;44(7):1846-51. |
Geen controlegroep, uitkomst verlaging BP, niet conform PICO |
|
(27) Alqadri SL, Qureshi AI. Management of acute hypertensive response in patients with intracerebral hemorrhage. Curr Atheroscler Rep 2012 Aug;14(4):322-7. |
Beschrijvend artikel, geen RCT, geen systematic review |
|
(28) Arima H, Huang Y, Wang JG, Heeley E, Delcourt C, Parsons M, et al. Earlier blood pressure-lowering and greater attenuation of hematoma growth in acute intracerebral hemorrhage: INTERACT pilot phase. Stroke 2012 Aug;43(8):2236-8. |
Deze studie geeft rationale voor keuze bloeddrukverlaging in interact 2, maar laat niet zien wat effect is van bloeddruk verlaging op hematoomvolume. Uitgangspunt is namelijk de bereikte bloeddrukverlaging en niet de interventie die de patiënt onderging. |
|
(32) Delcourt C, Huang Y, Arima H, Chalmers J, Davis SM, Heeley EL, et al. Hematoma growth and outcomes in intracerebral hemorrhage: the INTERACT1 study. Neurology 2012 Jul 24;79(4):314-9. |
Niet conform PICO, maar associatie hematoma growth en functional outcome (Interact) |
|
(39) Hwang SK, Kim JS, Kim JH, Hong CK, Yang KH. Antihypertensive treatment of acute intracerebral hemorrhage by intravenous nicardipine hydrochloride: prospective multi-center study. Journal of Korean Medical Science 2012 Sep;27(9):1085-90. |
Nicardipine hydrochloride, vraagstelling effectiviteit bloeddruk verlaging |
|
(40) Koga M, Toyoda K, Yamagami H, Okuda S, Okada Y, Kimura K, et al. Systolic blood pressure lowering to 160 mm Hg or less using nicardipine in acute intracerebral hemorrhage: a prospective, multicenter, observational study (the Stroke Acute Management with Urgent Risk-factor Assessment and Improvement-Intracerebral Hemorrhage study). J Hypertens 2012 Dec;30(12):2357-64. |
Nicardipine, vraagstelling effectiviteit bloeddruk verlaging |
|
(71) Sansing LH, Messe SR, Cucchiara BL, Lyden PD, Kasner SE. Anti-adrenergic medications and edema development after intracerebral hemorrhage. Neurocrit Care 2011 Jun;14(3):395-400. |
Secundaire retrospectieve analyse in CHANT trial |
|
Tanahashi N, Nakagawara J, Okada Y, Minematsu K, Challenge-Stroke Study Group. Candesartan cilexetil in the management of blood pressure for acute and recurrent stroke in Japan: the Challenge-Stroke study. Exp Rev Cardiovasc Ther 2011 Sep;9(9):1115-26. |
Geen RCT |
|
(82) Anderson CS, Huang Y, Arima H, Heeley E, Skulina C, Parsons MW, et al. Effects of early intensive blood pressure-lowering treatment on the growth of hematoma and perihematomal edema in acute intracerebral hemorrhage: the Intensive Blood Pressure Reduction in Acute Cerebral Haemorrhage Trial (INTERACT). Stroke 2010 Feb;41(2):307-12. |
Interact uitkomstmaat hematoma growth, geen invaliditeit of sterfte beschreven |
|
(83) Antihypertensive Treatment of Acute Cerebral Hemorrhage (ATACH) investigators. Antihypertensive treatment of acute cerebral hemorrhage. Crit Care Med 2010 Feb;38(2):637-48. |
Niet gerandomiseerd, ATACH N=60 Van te voren veel patiënten geexcludeerd door trauma of te lage BP, |
|
(84) Arima H, Anderson CS, Wang JG, Huang Y, Heeley E, Neal B, et al. Lower treatment blood pressure is associated with greatest reduction in hematoma growth after acute intracerebral hemorrhage. Hypertension 2010 Nov;56(5):852-8. |
Uitkomstmaat: hematoma growth |
|
(94) Qureshi AI, Palesch YY, Martin R, Novitzke J, Cruz-Flores S, Ehtisham A, et al. Effect of systolic blood pressure reduction on hematoma expansion, perihematomal edema, and 3-month outcome among patients with intracerebral hemorrhage: results from the antihypertensive treatment of acute cerebral hemorrhage study. Arch Neurol 2010 May;67(5):570-6. |
ATACH post hoc analyse, 3 mnd uitkomst |
|
(112) Potter J, Mistri A, Brodie F, Chernova J, Wilson E, Jagger C, et al. Controlling Hypertension and Hypotension Immediately Post Stroke (CHHIPS) - A randomised controlled trial. Health Technol Assess 2009;13(9):iii-53. |
Artikel in health technology assessment, dat aandacht besteedt aan kosten |
|
(113) Potter JF, Robinson TG, Ford GA, Mistri A, James M, Chernova J, et al. Controlling hypertension and hypotension immediately post-stroke (CHHIPS): a randomised, placebo-controlled, double-blind pilot trial. Lancet Neurology 2009 Jan;8(1):48-56. |
Geen onderscheid tussen hersenbloeding en herseninfarct |
|
(115) Suri MF, Vazquez G, Ezzeddine MA, Qureshi AI. A multicenter comparison of outcomes associated with intravenous nitroprusside and nicardipine treatment among patients with intracerebral hemorrhage. Neurocrit Care 2009;11(1):50-5. |
Retrospectief cohortonderzoek, geen RCT |
|
(132) Itabashi R, Toyoda K, Yasaka M, Kuwashiro T, Nakagaki H, Miyashita F, et al. The impact of hyperacute blood pressure lowering on the early clinical outcome following intracerebral hemorrhage. J Hypertens 2008 Oct;26(10):2016-21. |
Geen RCT |
|
(135) Koch S, Romano JG, Forteza AM, Otero CM, Rabinstein AA. Rapid blood pressure reduction in acute intracerebral hemorrhage: feasibility and safety. Neurocrit Care 2008;8(3):316-21. |
Andere doelstelling: Test bloeddruk verlaging
|
|
(137) Liu-Deryke X, Janisse J, Coplin WM, Parker D, Jr., Norris G, Rhoney DH. A comparison of nicardipine and labetalol for acute hypertension management following stroke. Neurocrit Care 2008;9(2):167-76. |
Geen RCT, maar retrospectief onderzoek, niet gerandomiseerd |
|
(160) Qureshi AI. Antihypertensive Treatment of Acute Cerebral Hemorrhage (ATACH): rationale and design. Neurocrit Care 2007;6(1):56-66. |
Geen RCT, maar beschrijving desgin ATACH |
|
Diverse designs |
|
|
(10) Kalita J, Misra UK, Kumar B. Is beta-blocker (atenolol) a preferred antihypertensive in acute intracerebral hemorrhage? Neurol Sci 2013;34(7):1099-104. |
Geen RCT, maar behandeling volgens ‘discretion of treating doctor’ |
|
(16) Ortega-Gutierrez S, Thomas J, Reccius A, Agarwal S, Lantigua H, Li M, et al. Effectiveness and safety of nicardipine and labetalol infusion for blood pressure management in patients with intracerebral and subarachnoid hemorrhage. Neurocrit Care 2013 Feb;18(1):13-9. |
Geen RCT, maar retrospective chart review |
|
(32) Honner SK, Singh A, Cheung PT, Alter HJ, Dutaret CG, Patel AK, et al. Emergency department control of blood pressure in intracerebral hemorrhage. J Emerg Med 2011 Oct;41(4):355-61. |
Geen RCT, maar observatief onderzoek verlaging bloeddruk in emergency department |
|
(39) Fujii M, Nakagawa K, Tomita H, Tone O, Tamaki M, Takada Y, et al. Efficacy of the American Heart Association/American Stroke Association guidelines for ultra-early, intentional antihypertensive therapy in intracerebral hemorrhage. J Clin Neurosci 2010 Sep;17(9):1136-9. |
Retrospectief status onderzoek |
|
(42) Nishikawa T, Ueba T, Kajiwara M, Iwata R, Miyamatsu N, Yamashita K. Preventive effect of aggressive blood pressure lowering on hematoma enlargement in patients with ultra-acute intracerebral hemorrhage. Neurol Med -Chir 2010;50(11):966-71. |
Retrospectief status onderzoek |
|
(43) Ohwaki K, Yano E, Nagashima H, Hirata M, Nakagomi T, Tamura A. Blood pressure management in acute intracerebral haemorrhage: low blood pressure and early neurological deterioration. Br J Neurosurg 2010 Aug;24(4):410-4. |
Retrospectief bloeddruk bij opname geevalueerd |
|
(55) Marti-Fabregas J, Martinez-Ramirez S, Martinez-Corral M, Diaz-Manera J, Querol L, Suarez-Calvet M, et al. Blood pressure is not associated with haematoma enlargement in acute intracerebral haemorrhage. Eur J Neurol 2008 Oct;15(10):1085-90. |
Geen RCT, maar observatief onderzoek |
|
(59) Suri MF, Suarez JI, Rodrigue TC, Zaidat OO, Vazquez G, Wensel A, et al. Effect of treatment of elevated blood pressure on neurological deterioration in patients with acute intracerebral hemorrhage. Neurocrit Care 2008;9(2):177-82. |
Geen RCT, retrospectief bloeddruk bestudeerd |
|
(64) Barton CW, Hemphill JC, III. Cumulative dose of hypertension predicts outcome in intracranial hemorrhage better than American Heart Association guidelines. Acad Emerg Med 2007 Aug;14(8):695-701. |
Onderwerp meetmethode bloeddruk, voldoet niet aan PICO |
|
(73) Sorimachi T, Fujii Y, Morita K, Tanaka R. Predictors of hematoma enlargement in patients with intracerebral hemorrhage treated with rapid administration of antifibrinolytic agents and strict blood pressure control. J Neurosurg 2007 Feb;106(2):250-4. |
Onderwerp: voorspelling hematoma vergroting, voldoet niet aan PICO |
|
Referenties aanvullende search |
|
|
(2) Sandset EC. Trials on blood pressure lowering in acute ischaemic stroke. Eur J Neurol 2012;19:16. |
Geen onderscheid herseninfarct en hersenbloeding |
|
(4) Sandset EC, Bath PM, Boysen G, Jatuzis D, Korv J, Luders S, et al. The angiotensin-receptor blocker candesartan for treatment of acute stroke (SCAST): a randomised, placebo-controlled, double-blind trial. Lancet 2011 Feb 26;377(9767):741-50. |
Geen onderscheid herseninfarct en hersenbloeding |
|
(6) Geeganage C, Bath PM. Interventions for deliberately altering blood pressure in acute stroke. [Review] [92 refs][Update of Cochrane Database Syst Rev. 2001;(3):CD000039; PMID: 11686949]. Cochrane Database Syst Rev 2008;(4 |
Geen onderscheid herseninfarct en hersenbloeding |
|
(5) Anderson CS, Heeley E, Huang Y, Wang J, Stapf C, Delcourt C, et al. Rapid blood-pressure lowering in patients with acute intracerebral hemorrhage. New England Journal of Medicine 2013 Jun 20;368(25):2355-65 |
Al gevonden in 1e search |
|
(10) Liu-DeRyke X, Levy PD, Parker D, Jr., Coplin W, Rhoney DH. A prospective evaluation of labetalol versus nicardipine for blood pressure management in patients with acute stroke. Neurocrit Care 2013 Aug;19(1):41-7. |
Nicardipine, vraagstelling effectiviteit bloeddruk verlaging |
|
(14) Sandset EC, Murray GD, Bath PM, Kjeldsen SE, Berge E, Scandinavian Candesartan Acute Stroke Trial (SCAST) Study Group. Relation between change in blood pressure in acute stroke and risk of early adverse events and poor outcome. Stroke 2012 Aug;43(8):2108-14. |
Geen onderscheid hersenbloeding en herseninfarct |
|
(24) Geeganage CM, Bath PM. Relationship between therapeutic changes in blood pressure and outcomes in acute stroke: a metaregression. [Review] [38 refs]. Hypertension 2009 Oct;54(4):775-81 |
Geen onderscheid hersenbloeding en herseninfarct |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 26-10-2017
Beoordeeld op geldigheid : 12-09-2024
De ontwikkelingen op het gebied van de acute opvang, secundaire preventie en revalidatie volgen elkaar in steeds sneller tempo op. Daarom werd in 2018 een kerngroep van neurologen, revalidatiearts en huisarts geïnstalleerd om snel op nieuwe ontwikkelingen te kunnen inspelen. In 2018 werden de modules over plaatjesaggregatieremmers en Directe Orale Anticoagulantia geupdate en nieuwe modules over tenecteplase en endovasculaire behandeling ontwikkeld. In 2019 wordt opnieuw geprioriteerd welke wijzigingen nodig zijn.
Deze kerngroep vergadert tenminste tweemaal per jaar om op basis van eigen inzichten en/of signalen uit het veld te beoordelen of hernieuwde aanvulling en/of revisie van (onderdelen van) de richtlijn gewenst is. Andere disciplines namen zitting in een klankbordgroep en worden betrokken afhankelijk van het onderwerp van de te reviseren module.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Op sommige plaatsen in deze richtlijn wordt verwezen naar de richtlijn Beroerte uit 2008. Het hoofdstuk Verantwoording uit deze richtlijn is op te vragen bij de Nederlandse Vereniging voor Neurologie.
In samenwerking met:
Koninklijk Nederlands Genootschap voor Fysiotherapie
Nederlands Huisartsen Genootschap
Nederlands Instituut van Psychologen
Nederlandse Vereniging voor Logopedie & Foniatrie
Nederlandse Vereniging voor Klinische Neurofysiologie
Nederlandse Vereniging voor Spoedeisende Hulp Artsen
Verenso Vereniging van Specialisten Ouderengeneeskunde
Verpleegkundigen & Verzorgenden Nederland (Neuro/stroke verpleegkundigen en Ambulancezorg)
Nederlandse Vereniging voor Ergotherapie
Doel en doelgroep
Doel
Het doel van deze op wetenschappelijk bewijs gebaseerde (evidence based) richtlijn is het bieden van een basis voor optimale zorg voor patiënten met een herseninfarct of hersenbloeding. Daarnaast draagt de richtlijn bij aan afstemming van de zorg tussen de verschillende zorgverleners en aan het terugdringen van ongewenste praktijkvariatie.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met een herseninfarct of hersenbloeding.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met TIA, herseninfarct of hersenbloeding. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende drie jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- prof. dr. D.W.J. Dippel (voorzitter), neuroloog, Erasmus MC Rotterdam, namens de Nederlandse Vereniging voor Neurologie (NVN)
- dr. H.B. van der Worp, neuroloog, UMC Utrecht, namens de NVN
- dr. J. Hofmeijer, neuroloog, Rijnstate ziekenhuis Arnhem, namens de NVN
- dr. R.M. van den Berg-Vos, neuroloog, OLVG West Amsterdam, namens de NVN
- dr. E.J. van Dijk, neuroloog, Radboudumc Nijmegen, namens de NVN
- M. Geurts, AIOS neurologie, UMC Utrecht, namens de NVN en de Vereniging Arts-Assistenten in opleiding tot Neuroloog (VAAN)
- prof. Dr. W. Mess, neuroloog/klinisch neurofysioloog, Maastricht UMC, namens de NVN
- dr. L.M.L. de Lau, neuroloog, Slotervaartziekenhuis Amsterdam, namens de NVN
- M. Kouwenhoven, revalidatiearts, De Hoogstraat Utrecht, namens de Nederlandse Vereniging van Revalidatiearsten (VRA)
- dr. B.J. Bouma, cardioloog, AMC Amsterdam, namens de Nederlandse Vereniging voor Cardiologie (NVvC)
- prof. dr. G.J. de Borst, vaatchirurg, UMC Utrecht, namens de Nederlandse Verenging voor Vaatchirurgie (NVvV)/Nederlandse Vereniging voor Heelkunde (NVvH)
- dr. J.A.H.R. Claassen, klinisch geriater, Radboudumc Nijmegen, namens de Nederlandse Vereniging voor Klinische Geriatrie (NVKG)
- dr. M. van Eijk, specialist ouderengeneeskunde, LUMC Leiden, namens Verenso Vereniging van Specialisten Ouderengeneeskunde
- dr. B.J.H. van den Born, internist, AMC Amsterdam, namens de Nederlandse Internisten Vereniging (NIV)/ Internistisch Vasculair Genootschap (IVG)
- dr. H.D. Boogaarts, neurochirurg, Radboudumc Nijmegen, namens de Nederlandse Vereniging voor Neurochirurgie (NVvN)
- dr. W. van Zwam, radioloog, Maastricht UMC, namens de Nederlandse Vereniging voor Radiologie (NVvR)
- I. Brummer, SEH-arts, Scheper ziekenhuis Emmen, namens de Nederlandse Vereniging van Spoedeisende Hulp Artsen (NVSHA)
- prof. dr. G. Kwakkel, hoogleraar neurorevalidatie, Vrije Universiteit Amsterdam, namens het Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF)
- A.F.E. Verburg, huisarts, namens het Nederlands Huisartsen Genootschap (NHG)
- K. Kanselaar, MANP, verpleegkundig specialist vasculaire neurologie Radboudumc Nijmegen, namens Verpleegkundigen & Verzorgenden Nederland (V&VN) afdeling Neuro & Revalidatie, werkgroep CVA
- G.J. Deddens, Verpleegkundig Specialist Acute Zorg, namens V&VN afdeling Ambulancezorg
- prof. dr. C.M. van Heugten, hoogleraar klinische neuropsychologie, Maastricht University, namens het Nederlands Instituut van Psychologen (NIP) sectie neuropsychologie.
- dr. S.K. Schiemanck, revalidatiearts, Leiden UMC, namens de VRA
- A. Harbers, klinisch linguist en logopediste, Klimmendaal, namens Nederlandse Vereniging voor Logopedie en Foniatrie (NVLF)
Met medewerking van
- dr. P.J. Nederkoorn, neuroloog, Academisch Medisch Centrum, Amsterdam
- dr. E. Steultjens, Hogeschool van Arnhem en Nijmegen, namens Ergotherapie Nederland
- E. van Gorp, namens de Patiëntenvereniging Hersenletsel.nl
- dr. R.H. Wimmers, namens de Hartstichting
- Ir. K. Idema, namens de Hart&Vaatgroep
Met ondersteuning van
- dr. M. Molag, adviseur, Kennisinstituut van Medisch Specialisten
- dr. I. Mostovaya, adviseur, Kennisinstituut van Medisch Specialisten
- dr. M. A. Pols, senior adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen door middel van reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten, een overzicht vindt u hieronder.
|
Werkgroeplid |
Functie |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
|
Berg-Vos |
Neuroloog |
Geen |
Geen |
Bestuurslid kennisnetwerk CVA |
Geen |
Geen |
Geen |
|
Boogaarts |
Neurochirurg |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Born |
Internist-vasculair geneeskundige |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Borst |
Vaatchirurg |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Bouma |
Cardioloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Brummer |
SEH-arts |
Geen |
Geen |
Lid richtlijnencommissie NVSHA |
Geen |
Geen |
Geen |
|
Claassen |
Klinisch geriater (0,6 fte) |
Geen |
Geen |
Geen |
Onderzoeksleider van 3 onderzoeksprojecten, (mede)gefinancierd door het onderzoeksfonds van Alzheimer Nederland (patiëntenvereniging), en 1 project gefinancierd door ISAO (Alzheimerfonds) |
Geen |
Mijn werkgever (Radboudumc) heeft financiele vergoedingen ontvangen van bedrijven (farmaceutische industrie) voor presentaties die ik op uitnodiging van die bedrijven heb gegeven, of voor symposia die ik voor die brdrijven heb (nede)georganiseerd. De vergoeding betrof steeds een vergoeding voor de gewerkte uren. |
|
Deddens |
Verpleegkundige Specialist Acute Zorg en Ambulanceverpleegkundige |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Dippel |
Neuroloog, hoogleraar acute behandeling neurovasculaire aandoeningen |
Geen |
Geen |
Niet van toepassing |
Het MR CLEAN onderzoek (www.mrclean-trial.org) wordt in geringe mate (10%) zonder voorwaarden gesteund door enkele medische industriën en importeurs. Deze staan vermeld op de website. Ik ben een van de hoofdonderzoekers van deze trial. |
Geen |
Geen |
|
Geurts |
AIOS neurologie |
Geen |
Geen |
Geen |
M. Geurts is studie-coordinator van de COOLing for Ischaemic Stroke Trial (COOLIST), dat wordt gefinancierd door de Nederlandse Hartstichting (2010B239). |
Geen |
Geen |
|
Harbers |
Logopediste & Klinisch Linguist |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Hofmeijer |
Neuroloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Kanselaar-Martens |
Verpleegkunde specialist Radboudumc |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Kwakkel |
Hoogleraar Neurorevalidatie |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Schiemanck |
Revalidatiearts Tot 31-12-2014: AMC ; Medisch Leidinggevende Neuroteam, AMC; Consulent Revalidatiegeneeskunde aan Zorgcentrum Berkenstede, Stichting Cordaan, Diemen, sinds 01-07-2006, Heden: subafdelingshoofd Leids Universitair Medisch Centrum |
Geen |
Geen |
Geen |
* Onderzoeksproject ism Radboudumc Efficacy of functional electrical stimulation of the peroneal nerve with the Actigait system on walking efficiency and patient satisfaction in stroke patients suffering from a drop foot, 2007-2014; studie is afgerond; financiering door Otto Bock Healthcare |
Geen |
Geen |
|
Spruit-Van Eijk |
Specialist Ouderengeneeskunde en UD PHEG |
Geen |
Geen |
Geen |
2007 - 2012 GRAMPS studie gefinancierd door 2 grote zorginstanties de Zorgboog en SVRZ, zorgt in Zeeland |
Geen |
Geen |
|
Van den Born |
internist |
Geen |
Geen |
Bestuurslid van de Nederlandse Hypertensievereniging |
Geen |
Geen |
Geen |
|
Van Dijk |
Neuroloog |
Geen |
Geen |
Bestuurslid Stafconvent Radboudumc: betaald |
Onderzoek naar effectiviteit en veiligheid DOACs in Nederland (gefinancierd door GGG-ZonMw / VWS): 110Keuro |
Geen |
Geen |
|
Van Heugten |
Psycholoog, hoogleraar Klinisch Neuropsychologie |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Verburg |
Wetenschappelijk medewerker en |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Zwam |
Radioloog |
Geen |
Geen |
Geen |
Stuurgroeplid MrClean studie |
Geen |
Geen |
Meelezers
|
Werkgroeplid |
Functie |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
|
Idema |
Beleidsadviseur (De Hart&Vaatgroep) |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Kouwenhoven |
Revalidatiearts |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Steultjens |
ass. Lector Neurorevalidatie |
Geen |
Geen |
lid raad van advies Ergotherapie Nederland |
Geen |
eigen onderneming gericht op bijscholing aan ergotherapeuten m.b.t. twee specifieke methoden van diagnostiek en interventie ook toepasbaar bij cliënten na bereorte. Scholing is niet gericht op toepassing multi-disciplinaire richtlijnen |
Geen |
|
Van Gorp-Clion |
Tot 1 juli 2014 Voorzitter, daarna bestuurslid |
Geen |
Doelgroep/ achterban van de patiëntenvereniging |
Belangen van CVA-patiënten bij de patiëntenorganisatie |
Geen |
Geen |
Geen |
|
Wielemaker |
Hoofd patiëntenzorg Hersenstichting Nederland |
Geen |
Geen |
Geen |
Geen deelname aan onderzoek. Ben zelf werkzaam bij een gezondheidsfonds, de Hersenstichting verleent wel subsidie aan wetenschappelijk onderzoek. |
Geen |
De Hersenstichting heeft een puur faciliterende rol als het gaat om ontwikkeling van bijvoorbeeld een zorgstandaard, zoals nu de zorgstandaard Traumatisch Hersenletsel. Zij heeft het zorgveld de opdracht gegeven een dergelijke zorgstandaard te ontwikkelen en stelt daarvoor de middelen ter beschikking. Meer informatie op www.zorgstandaardnah.nl |
|
Wimmers |
Teammanager Kennis & Trends, Hartstichting |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het raadplegen van afgevaardigden van de patiëntenvereniging hersenletsel.nl, de Hartstichting en de Hart&Vaatgroep. Deze partijen werden ook uitgenodigd om tijdens de invitational conference de door hen ervaren knelpunten aan te dragen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan deze partijen.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit (www.demedischspecialist.nl/richtlijnen). Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreetrust.org) dat een internationaal breed geaccepteerd instrument is en op Richtlijnen voor richtlijnen voor de beoordeling van de kwaliteit van richtlijnen (www.zorginstituutnederland.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Achmea en VGZ namens Zorgverzekeraars Nederland, het College voor Zorgverzekeringen (tegenwoordig Zorginstituut Nederland), de Inspectie voor de Gezondheidszorg, CVA Patiëntenvereniging Hersenletsel.nl, de Hart&Vaatgroep en de Hartstichting, via een invitational conference.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken, waarna de definitieve uitgangsvragen werden vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk en onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt inhoudt.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen, via de websites van enkele grote organisaties, zoals de American Heart Association en de European Stroke Organization. Tevens werd in de tijdschriften Stroke en Int J Stroke gezocht naar richtlijnen. Vervolgens werd op de website van de Cochrane Library gezocht naar systematische reviews. Tot slot werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases (NLM Pubmed, Google Scholar, Embase, Cochrane Library). De zoektermen werden geformuleerd aan de hand van een searchvraag. De searchvraag werd vertaald in een PICO (patient, intervention, control, outcome). Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepsleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in het hoofdstuk van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van vertrouwen in de literatuurconclusie (zie http://www.guidelinedevelopment.org/handbook/).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden.
Formuleren van de conclusies
Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusies, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt deze getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen door de werkgroep en beschreven in de literatuursamenvatting.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld binnen de clinical audit van de NVN om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de paragraaf Kennislacunes behorend bij elke module.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2007-mei 2014 Engels |
1 exp cerebral hemorrhage/ [narrower terms: exp basal ganglia hemorrhage/ or putaminal hemorrhage/] (27380) 2 ((cerebral or cerebrum or intracerebral or brain or intracranial or stroke) adj3 h?emorrhag*).ti,ab. (26689) 3 1 or 2 (43545) 4 limit 3 to (dutch or english or german) (35204) 5 limit 4 to yr=2007 -Current (12151) 10 exp Diuretics/ or Diuretics.ti,ab. (79369) 11 exp Antihypertensive Agents/ or antihypertensive agent*.ti,ab. (227434) 12 Hypertension/dt [Drug Therapy] (54614) 13 exp Adrenergic beta-Antagonists/ or beta-antagonists.ti,ab. (76996) 14 exp Calcium Channel Blockers/ or (calcium adj2 (antagonist* or blocker*)).ti,ab. (79912) 15 ((Hypertension or blood-pressure) adj5 (therapy or lowering)).ti,ab. (15508) 16 10 or 11 or 12 or 13 or 14 or 15 (370277) 17 5 and 16 (368) 18 limit 17 to english language (362) 19 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp Review Literature as Topic/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and review/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (207625) 20 18 and 19 (26) – 20 uniek 21 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1360133) 22 18 and 21 (128) – 22 not 20=110, 106 uniek 23 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective.tw. or prospective.tw. or Cross sectional.tw. or Cross-sectional studies/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (1979596) 24 18 and 23 (115) 24 not (20 or 22) = 68 25 20 or 22 or 24 (204) |
332 |
|
Embase (Elsevier) |
'brain hemorrhage'/exp/mj OR ((cerebral OR cerebrum OR intracerebral OR brain OR intracranial OR stroke) NEAR/3 hemorrhag*):ab,ti OR ((cerebral OR cerebrum OR intracerebral OR brain OR intracranial OR stroke) NEAR/3 haemorrhag*):ab,ti AND ('diuretic agent'/exp/mj OR 'antihypertensive agent'/exp/mj OR 'beta adrenergic receptor blocking agent'/exp/mj OR 'calcium channel blocking agent'/exp/mj OR 'hypertension'/exp/mj/dm_dt OR diuretic*:ab,ti OR (antihypertensive NEAR/2 agent*):ab,ti OR ((calcium OR beta) NEAR/2 (antagonist* OR blocker*)):ab,ti OR ((hypertension OR 'blood pressure') NEAR/5 (therapy OR lowering)):ab,ti) AND [english]/lim AND [embase]/lim AND [2007-2014]/py
('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) 28 referenties (SR) – 18 uniek
OR ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it) 153 referenties (RCT), 93 uniek
'major clinical study'/exp) 44 referenties (MCS) , 31 uniek |
