Acute neurochirurgie bij hersenbloeding
Uitgangsvraag
Wat zijn de indicaties en contra-indicaties voor acute neurochirurgische behandeling van patiënten met een hersenbloeding?
Aanbeveling
Supratentorieel
Wees zeer terughoudend met het opereren van patiënten met een spontaan intracerebraal hematoom.
Overweeg een operatie bij patiënten met progressieve neurologische achteruitgang met een oppervlakkig gelegen hematoom.
Infratentorieel
Overweeg evacuatie van een infratentorieel hematoom bij progressieve neurologische achteruitgang of bij initiële slechte neurologische toestand.
De werkgroep beveelt aan om patiënten met een intracerebraal hematoom te observeren op een bewaakte afdeling (neuro medium care dan wel stroke unit).
Overwegingen
Bovenstaande conclusie betreft relatief stabiele patiënten. De effecten van chirurgische decompressie of hematoomevacuatie bij patiënten met progressieve achteruitgang zijn niet onderzocht. De werkgroep is van mening dat chirurgische interventie, met nieuwe (minimaal invasieve) technieken verder onderzoek verdient. De werkgroep acht het plausibel dat patiënten met progressieve neurologische achteruitgang en een oppervlakkig gelegen hematoom in sommige gevallen baat kunnen hebben bij een ingreep.
Er zijn geen gerandomiseerde klinische trials of grote observationele onderzoeken naar effecten van chirurgische decompressie of hematoom evacuatie bij het infratentoriële hematoom. Op basis van expert opinion veronderstelt de werkgroep dat hierbij in geval van progressieve klinische achteruitgang chirurgische interventie overwogen moet worden.
Onderbouwing
Achtergrond
Een intracerebraal hematoom is een plots ontstane, ruimte-innemende, uit bloed bestaand laesie in het hersenweefsel. De verschijnselen kunnen zowel focale neurologische uitval als tekenen van verhoogde intracraniële druk betreffen. Het is om deze reden dat sommigen menen dat neurochirurgische behandeling van het hematoom effectief zou kunnen zijn bij het voorkómen van sterfte en ernstige handicap.
Conclusies / Summary of Findings
|
Laag GRADE |
Functionele status
Er zijn onvoldoende aanwijzingen dat chirurgische decompressie of hematoomevacuatie leidt tot een grotere kans op een goed functioneel herstel dan een in aanzet conservatieve behandeling.
Bronnen (Mendelow, 2013; Mendelow, 2005; Hattori, 2004, Morgenstern, 1998) |
Samenvatting literatuur
In de discussie van de STICH-2-trial (Mendelow, 2013) wordt een meta-analyse gepresenteerd van tot dan gepubliceerde RCTs. Deze meta-analyse includeerde RCTs van variabele kwaliteit, daarom werden deze door de werkgroep herbeoordeeld (zie tabel Quality assessment in de bijlage). Hierbij werd vooral gekeken naar de methode van randomisatie, allocation concealment en onafhankelijkheid (blindering) van de outcome assessor. Indien de studie op twee of meer van deze drie aspecten niet voldeed, werd de studie geëxcludeerd. De studies van goede kwaliteit worden hieronder beschreven. De resulterende evidencetabellen kunt u in de bijlage vinden.
Eén multicenter RCT (Mendelow, 2013) onderzocht 601 patiënten met diagnose spontane intracerebrale lobaire bloeding zonder intraventriculaire uitbreiding. In deze RCT werd hematoomevacuatie binnen 12 uur na randomisatie vergeleken met een initieel conservatieve behandeling. Randomisatie vond plaats binnen 48 uur na de ictus. Latere chirurgische evacuatie was toegestaan als dit medisch noodzakelijk werd geacht. De follow-up duur was 6 maanden. De resultaten zijn alle volgens de intention to treat methode geanalyseerd, waarbij moet worden vermeld dat van de initieel conservatief behandelde groep (292) uiteindelijk 62 patiënten alsnog geopereerd zijn. In de neurochirurgisch behandelde groep was de sterfte na zes maanden 18% en in de conservatief behandelde groep 24%. Een gunstige functionele uitkomst werd gezien bij 41% in de neurochirurgisch behandelde groep en 38% in de conservatief behandelde groep (absoluut risicoverschil 3,7%; 95% BI -4,3 tot 11,6; p=0,34).
Een eerdere RCT (Mendelow, 2005) onderzocht 1033 patiënten met CT-bewijs van een spontane supratentoriële intracerebrale bloeding die binnen 72 uur gezien werden en bij wie de verantwoordelijke neurochirurg onzeker was over de voordelen van één van beide behandelingen, en die een hematoom >=2 cm hadden en een Glasgow Coma Score >5. In deze RCT werd hematoomevacuatie binnen 24 uur vergeleken met initieel conservatieve behandeling. Latere chirurgische evacuatie was toegestaan als dit medisch noodzakelijk werd geacht. De follow-up duur was 6 maanden. In de neurochirurgisch behandelde groep was de sterfte na 6 maanden 36% en in de conservatief behandelde groep 37%. Een gunstige functionele uitkomst werd gezien bij 26% in de neurochirurgisch behandelde groep en 24% in de conservatief behandelde groep (absoluut risicoverschil 2,3%; 95% BI -3,2 tot 7,7; p=0,41).
Een derde RCT (Hattori, 2004) bestudeerde 242 patiënten die hun ogen openden in respons op zwakke of sterke stimuli. Patiënten die er beter of slechter aan toe waren werden geëxcludeerd van deze studie. Stereotactische evacuatie van het hematoom werd vergeleken met standaard behandeling. De follow-up duur was niet duidelijk. In de neurochirurgisch behandelde groep was de sterfte 15,7% en in de conservatief behandelde groep 35,3%. Een gunstige functionele uitkomst werd gezien bij 50% in de neurochirurgisch behandelde groep en 32% in de conservatief behandelde groep.
Een vierde artikel (Morgenstern, 1998) beschreef een cohort en een RCT die 35 patiënten includeerde met een ICH >9 ml gediagnosticeerd met een CT van het hoofd binnen drie uur na de screening en met een Glasgow Coma Scale van 5 tot 15. Open craniotomie en hematoomevacuatie werd vergeleken met standaard behandeling. De follow-up was zes maanden. In de neurochirurgisch behandelde groep was de sterfte 17% en in de standaard behandelde groep 24%. Een slechte functionele uitkomst werd gezien bij 50% van de patiënten in de chirurgisch behandelde groep en 69% in de standaard behandelde groep.
Mortaliteit
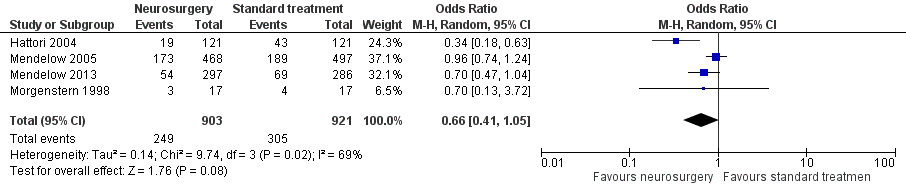
Figuur 1 laat zien dat de gewogen Odds Ratio voor mortaliteit voor de vier geïncludeerde studies 0,66 is (95% BI 0,41 tot 1,05).
Figuur 1 Neurochirurgie versus standaard behandeling uitkomst mortaliteit

Functionele status
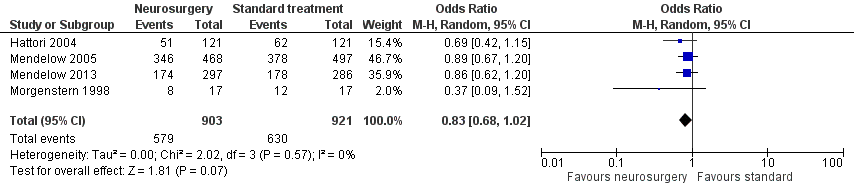
Figuur 2 laat zien dat de gewogen Odds Ratio voor een afhankelijke functionele status in de vier geïncludeerde studies 0,83 is (95% BI 0,68 tot 1,02).
Figuur 2 Neurochirurgie versus standard behandeling uitkomst functionele status afhankelijk
Bewijskracht uitkomstmaten mortaliteit functionele status
De bewijskracht van een RCT start hoog. Er werden twee punten afgetrokken vanwege inconsistentie, mogelijk berustend op een verschil in de patiëntenpopulaties, en één punt wegens heterogeniteit door het grote aantal operaties dat in de controlegroep werd uitgevoerd en de verschillende chirurgische methoden die werden gebruikt.
Ten aanzien van minimaal invasieve chirurgische modaliteit is er alleen de studie van Hattori die het effect van stereotactische evacuatie van het hematoom onderzocht heeft. Hoewel de studie van Mendolow (2005) een stereotactische of endoscopische subgroep kent, heeft deze niet voor type chirurgie gestratificeerd. De recente resultaten van een fase II studie naar het effect van minimaal invasieve chirurgie zijn hoopgevend, maar de fase III studies moeten worden afgewacht (Hanley 2016).
Zoeken en selecteren
Wetenschappelijke vraagstelling
Bij welke patiënten met een acute intracerebrale supra- of infratentoriële bloeding kan neurochirurgische ontlasting van het hematoom overwogen worden?
Relevante uitkomstmaten
De werkgroep achtte functioneel herstel en sterfte voor de besluitvorming kritieke uitkomstmaten.
Zoeken en Methode
In de databases Medline (OVID), Embase and Cochrane is met relevante zoektermen gezocht naar studies die hematoom evacuatie vergeleken met een niet-chirurgisch behandelde controlegroep. De zoekverantwoording is weergegeven in bijlage. De literatuurzoekactie leverde 182 treffers op. Hiervan werden in eerste instantie een Cochrane review geselecteerd (Prasad, 2008) en een RCT (Mendelow, 2013). Omdat Mendelow in de discussie een update presenteert van de meta-analyse van Prasad, is de analyse van Mendelow (2013) als uitgangspunt genomen.
Referenties
- Hanley DF, Thompson RE, Muschelli J, et al. Safety and efficacy of minimally invasive surgery plus alteplase in intracerebral haemorrhage evacuation (MISTIE): A randomised, controlled, open-label, phase 2 trial. Lancet Neurol. 2016;15:1228-1237
- Hattori N, Katayama Y, Maya Y, et al. Impact of stereotactic hematoma evacuation on activities of daily living during the chronic period following spontaneous putaminal hemorrhage: a randomized study. J Neurosurg. 2004;101(3):417-20. PubMed PMID: 15352598.
- Mendelow AD, Gregson BA, Rowan EN, et al. Early surgery versus initial conservative treatment in patients with spontaneous supratentorial lobar intracerebral haematomas (STICH II): a randomised trial. Lancet. 2013;382(9890):397-408. PubMed PMID: 23726393
- Mendelow AD, Gregson BA, Fernandes HM, et al. Early surgery versus initial conservative treatment in patients with spontaneous supratentorial intracerebral haematomas in the International Surgical Trial in Intracerebral Haemorrhage (STICH): a randomised trial. Lancet. 2005;365(9457):387-97. PubMed PMID: 15680453.
- Morgenstern LB, Frankowski RF, Shedden P, et al. Surgical treatment for intracerebral hemorrhage (STICH): a single-center, randomized clinical trial. Neurology. 1998;51(5):1359-63. PubMed PMID: 9818860.
- Prasad K, Mendelow AD, Gregson B. Surgery for primary supratentorial intracerebral haemorrhage. The Cochrane database of systematic reviews. 2008:CD000200.
Evidence tabellen
Risk of bias table for intervention studies (randomized controlled trials)
Research question: Wat zijn de indicaties en contra-indicaties voor acute neurochirurgische behandeling van patiënten met een hersenbloeding? (uitgaande van meta-analyse Mendelow 2013)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Auer, 1989 |
No information on randomisation method provided |
Likely |
Likely |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely |
|
Batjer, 1990 |
Randomization was facilitated by one of us (J.S.R.) by producing a series of sealed envelopes, each containing one of the proposed treatment modalities. |
Unlikely |
Likely |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely |
|
Chen, 1992 |
No information randomisation method, in Chinese |
Likely |
Likely |
Likely |
Likely |
Unclear |
Unclear |
Unclear |
|
Chen, 2001 |
No information randomisation method, in Chinese |
|
|
|
|
|
|
|
|
Hattori, 2004 |
Randomization was accomplished using sealed, opaque envelopes with equal treatment allocation probabilities. |
Unlikely |
Likely |
Likely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Hosseini, 2003 |
No information randomisation method |
Likely |
Unclear |
Unclear |
Unclear |
Unclear |
Unclear |
Unlikely |
|
Juvela, 1989 |
No information on randomisation method provided |
Likely |
Likely |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely |
|
McKissock, 1961 |
No information on randomisation method |
Likely |
Unclear |
Unclear |
Unclear |
Unclear |
Unclear |
Unclear |
|
Mendelow, 2005 |
A 24-hour telephone randomisation service provided by the Clinical Trial Service Unit (CTSU) at the University of Oxford was used. |
Unlikely |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Mendelow, 2013 |
Automatic telephone and internet-based randomisation service |
Unlikely |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
Morgenstern, 1998 |
41 patiënts were in a prospective nonrandomized study and 34 patiënts were randomized. Randomization occurred using sealed, opaque envelopes with equal treatment allocation probabilities. |
Unclear |
Likely |
Likely |
Likely |
Unlikely |
Unclear |
Likely |
|
Pantazis, 2006 |
No information on randomisation method |
Likely |
Likely |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely |
|
Teernstra, 2001 |
An independent external agency handled inclusion and randomisation. Eight separate treatment random allocation lists were used on the basis of prestratification on GCS (<9>10).In each list, block sizes of two and four in random order were used. |
Unlikely |
Likely |
Likely |
Likely |
Unlikely |
Unclear |
Unlikely |
|
Wang, 2009: minimally invasive craniopuncture therapy: is dat het type operatie dat we hier onderzoeken? |
The Center for Quality Control (CQC) at the National Office for CVD prevention and Control in Beijing set up two groups of random numbers before the study recruited patiënts. When a patiënt met inclusion criteria, CQC was telephoned and a random number was obtained. Each number was only allocated once. |
Unlikely |
Likely |
Likely |
Likely |
Unlikely |
Unlikely |
Unclear |
|
Zuccarello, 1999 |
A list of random sequential assignment of patiënts to medical or surgical treatment was generated by the study statistician. Each patiënt assignment was placed in an individual sequential opaque envelope that was opened by the nurse investigator after she was contacted by the physician investigator. |
Unlikely |
Likely |
Likely |
Likely |
Unlikely |
Unclear |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patiënts and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patiënt nor the care provider (attending physician) knows which patiënt is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patiënt assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has soft (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patiënts lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patiënts lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question: Wat zijn de indicaties en contra-indicaties voor acute neurochirurgische behandeling van patiënten met een hersenbloeding?
|
Study reference |
Study characteristics |
patiënt characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Mendelow, 2013 |
Type of study: RCT
Setting: multicenter trial in 129 neurosurgical units
Country: 39 countries
Source of funding: UK Medical Research Council |
Inclusion criteria: patiënts with spontaneous lobar intracerebrale haemorrhage on CT scan (<= 1 cm from the cortical surface of the brain) with a volume of between 10 mL and 100 mL, within 48H of ictus, a best Glasgow Coma Score of 5 or 6, best eye score of 2 or more (ie conscious at randomisation)
Exclusion criteria: haemhorrhage due to an aneurysm or angiographically proven arteriovenous malformation; secondary to tumour or trauma; involved the basal ganglia, thalamic, cerebellar or brainstem regions, or if there was any intraventricular blood. patiënts were ineligible if they had any severe pre-existing physical or mental disabilities or comorbidities that could interfere with the assessment of the outcome.
N total at baseline: Intervention: 305 Control: 292
Important prognostic factors2: Age ± SD: I: 63.9 ± 13.0 C: 63.9 ± 13.7
Sex: I: 57 % M C:57 % M
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
Early sugery, undertaking evacuation of the haematoma within 12 hours.
|
Describe control (treatment/procedure/test):
Conservative treatment, delayed evacuation was permitted if judged clinically appropriate. All patiënts were given the best medical treatment as defined according to their hospital settings.
|
Length of follow-up: 6 months
Received treatment not according to protocol (after two weeks): Intervention: N=13 (%) Reasons: families refused (N=6), rebleed or intraventricular hemorrhage (N=3), cardiac problem, respiratory problem, or fever (N=3) and logistical problems (N=1).
Control: N=63 (%) Reasons: for 1 patiënt no data were available and 62 had surgery, because of deterioration in GCS (N=36), oedema (N=1), rebleed (N=3), deterioration and oedema (N=7), deterioration and rebleed (N=5), deterioration, oedema and rebleed (N=4), rise in intracranial pressure (N=2), surgeon error (N=1), family request (N=2), and an underlying cause (N=1).
Loss-to-follow-up: Intervention: N=4 (0.9%) Reasons: 4 relatives refused surgery and further involvement, 1 patiënt withdrew because did not want to have surgery
Control: N=1 (0.3%) Reasons: all data were lost in the study centre for 1 patiënt
9 patiënts were lost to follow-up, of which 6 were known to be alive at 6 months
Incomplete outcome data: Not described |
Outcome measures and effect size (include 95%CI and p-value if available):
Functional status (6 months) based on the Extended Glasgow Outcome Scale (GOS): I: (123/305)=40% patiënts had a favourable outcome at 6 months C: (108/292)=37%
Infection as adverse event: Respiratory infection I:8/305= 3% C: 12/292= 4%
Mortality; I: (54/305)=18% C: 69/292=24%
Infections ( as cause of mortality I: 13/305=4% C: 20/292=7%
|
Low risk of bias
Single blind study |
|
Hattori, 2004 |
Type of study: RCT
Setting: Hospital
Country: Japan
Source of funding: unknown |
Inclusion criteria: patiënt age between 35 and 85 years, interval between stroke and start of treatment of less than 24 hours. patiënts with eyes closed who opened their eyes for weak or strong stimuli were included.
Exclusion criteria: patiënts in whom haemorrhage spread into brain tumours or came from cerebral aneurysms or arteriovenous malformations, patiënts with malignant neoplasms, patiënts with bleeding disorders or those receiving anticoagulant medications. patiënts with eyes open were excluded as well as patiënts with eyes closed that did not open in response to simuli.
N total at baseline: 242 Intervention: 121 Control: 121
Important prognostic factors2: For example age ± SD: I: 60 ± 10.2 C: 61 ± 8.2
Sex: I: 59 % M C: 64% M
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
Stereotactic evacuation of the hematoma
|
Describe control (treatment/procedure/test):
Conservative treatment |
Length of follow-up: unclear
Loss-to-follow-up: 0
Incomplete outcome data: 0
|
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality Grade 2 I: 4.3% C: 11.4%
Grade 3 I: 11.8% C: 23.5%
Independent: Grade 2 I: 52.9% C: 40%
Grade 3 I: 47.1% C: 21.6% |
Percentages indepent/dependent do not add to 100%.
Moderate risk of bias: Method of blinding of outcome assessment is not described.
|
|
Mendelow, 2005 |
Type of study: RCT
Setting: multicentre trial
Country: UK
Source of funding: MRC (UK), Stroke Association (UK), Northern Brainwave Appeal |
Inclusion criteria: CT evidence of a spontaneous supratentorial intracerebral haemorrhage that had arisen within 72H and if the responsible neurosurgeon was uncertain about the benefits of either treatment, hematoma >=2cm diameter, GCS>=5
Exclusion criteria: haematoma due to an aneurysm or arteriovenous malformation; haemorrhage secondary to a tumour or trauma, cerebellar haemorrhage or extension of a supratentorial haemorrhage into the brainstem, severe pre-existing physical or mental disability or severe comorbidity that might interfere with assessment of outcome
N total at baseline: Intervention: 503 Control: 530
Important prognostic factors2: age ± SD: I: 62 C: 62
Sex: I: 57% M C: 58% M
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test
Early surgery: haematoma evacuated within 24 hours by the method of choice of the responsible neurosurgeon, combined with the appropriate and best medical treatment. Mostly craniotomy (77%) |
Describe control (treatment/procedure/test):
Initial conservative treatment: best medical treatment. Later evacuation was allowed if it became necessary because of neurological detoriation. Primary outcome was death or disability using the extended Glasgow outcome scale 6 months after the ictus. Secondary outcomes included mortality, the Bartel index and the modified Rankin scale. |
Length of follow-up: 6 months
Loss-to-follow-up: Intervention: 26 (5%) Control: 25 (5%) Reasons (describe) ineligible centre, withdrawn by the centre, all data lost,
Incomplete outcome data: Intervention: 9 (2%) Control: 8 (2%) Reasons (describe)
140 (26%) patiënts initially assigned to conservative treatment underwent surgery after an initial period of observation. Reasons for these patiënts undergoing operations were: rebleeding, neurological detoriation, clinical detoriation, no improvement on conservative treatment, raised intracranial pressure, oedema, altered consciousness, coma, aneurysm, not waking after external ventricular drain, family request and reason not recorded. |
Outcome measures and effect size (include 95%CI and p-value if available):
Functional outcome favourable I: 26% C: 24%
Mortality I: 36% C: 37% |
Low risk of bias, observer blind randomized study |
|
Morgenstern, 1998 |
Type of study: RCT
Setting: university hospital
Country: USA
Source of funding: unknown |
Inclusion criteria: ICH>9 mL(lobar or deep extending outside the thalamus), diagnosed by head CT within 3 hours of screening , GCS 5-15
Exclusion criteria: ICH secondary to known or suspected arteriovenous malformation, aneurysm, brain tumour, or head trauma; brain stem or cerebellar ICH, or ICH limited to the thalamus or ventricular system; low level of function; coagulopathy or current anticoagulant or thrombolytic use within the previous 24 hours; a serious pre-existing condition that, in the investigator’s judgement, increased surgical risk significantly or precluded 6-month survival, biopsy-proved amyloid angiopathy; hematoma volume of 10-19 mL and a GCS score of 15 and better than antigravity strength on the affected side; ventricular extension greater than one-half of one lateral ventricle or one-third of both lateral ventricles.
N total at baseline (RCT): Intervention: 18 Control: 17
Important prognostic factors2: age ± SD: I: 56 C: 51
Sex: I: 71% M C: 59% M
Groups comparable at baseline? In surgical patiënts more frequent representation of deep ICH (94%) putamenal versus 59% putamenal among medically treated group. |
Describe intervention (treatment/procedure/test):
Open craniotomy: surgery was performed within 12 hours of onset or the last time the patiënt was seen as ‘normal’. They underwent open craniotomy and hematoma evacuation. After the bone flap was turned and the dura was opened, a small cortical incision was made and, carefully, either through the microscopic loops or a microscope or both, the clot was removed with suction device only. No thrombolytic agents were used.
|
Describe control (treatment/procedure/test):
Best medical treatment: This was standardized between the two groups and supervised by a team of neurologists, neurosurgeons, and neuroanesthesiologists in a dedicated neuroscience intensive care unit. Intracranial pressure (ICP) monitors were placed in all patiënts with a GCS score <9, and patiënts were treated with ventricular drainage, osmotic diuretics, sedation, paralysis, and hyperventilation as needed to maintain ICP<21 cm H2O. IV steroids were not used. Blood pressure treatment was individualized for each patiënt depending on admission blood pressure. |
Length of follow-up: 6 months
Loss-to-follow-up: Intervention: N (%) 1 (6%) Reasons (describe): excluded after randomisation
Control: N (%): 1 (6%) Reasons (describe): One patiënt had a crossover to surgery
Incomplete outcome data: -
|
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality: I: 19% C: 24%
Functional Outcome (Barthel): C: 55 |
41 patiënts were in a prospective nonrandomized study and 34 patiënts were randomized. Randomization occurred using sealed, opaque envelopes with equal treatment: only RCT results included in this table
Risk of bias : primary endpoint evaluation was not blind |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patiënts between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Exclusietabel neurochirurgisce evacuatie.
|
H5.2 Neurochirurgie evacuatie |
|
|
|
Referenties geselecteerde systematic review (auteur, jaartal, tijdschrift) |
Selectie? |
Evt. reden exclusie |
|
Adeoye, 2008 |
Ja |
overwegingen |
|
Adeoye, 2010 |
Nee |
Geen systematische search |
|
Adeoye, 2010 |
Nee |
Surgical management voor en na STICH |
|
Beslow, 2014 |
Nee |
kinderen |
|
Brouwers, 2012 |
Nee |
Geen systematische search |
|
Chilton, 2009 |
Nee |
Letter uit 2005 |
|
Choy, 2010 |
Nee |
Beschrijft alleen verwijdering hematoma |
|
Delcourt, 2012 |
Nee |
Geen systematische search |
|
Dey, 2012 |
Nee |
Geen systematische search |
|
Dey, 2014 |
Nee |
Geen systematische search |
|
Dun, 2013 |
Nee |
Niet conform PICO: gebruik chirurgisch planning systeem |
|
Elijovich, 2008 |
Nee |
Geen systematische search |
|
Gaberel, 2013 |
Nee |
letter |
|
Gregson, 2012 |
Nee |
Geincludeerde studies voldoen niet aan kwaliteitseisen |
|
Gregson, 2012 |
Nee |
spaanstalig |
|
Gregson, 2012 |
Nee |
Protocol STITCH |
|
Gregson, 2012 |
Nee |
Statistische analyse STITCH |
|
Heuts, 2013 |
Nee |
5 cases |
|
Imberti, 2012 |
Nee |
Niet conform PICO: factor VII: effect postoperative rebleeding |
|
Kaliaperumal, 2012 |
Nee |
Chronisch subdural hematoom: andere P |
|
Kase, 2008 |
Nee |
Geen systematische search |
|
Khan, 2010 |
Nee |
Implications STICH in Pakistan |
|
Kirkman, 2008 |
Nee |
Weinig patiënten voldoen aan STICHII inclusiecriteria, effects on management, overwegingen |
|
Kuo, 2011 |
Nee |
Case series |
|
Li, 2013 |
Nee |
Vergelijking neuroendoscopy met EVD alleen of met intraventriculaire fibrinolyse, niet conform PICO |
|
Lapchak, 2007 |
Nee |
Geen systematische search |
|
Lopponen, 2013 |
Nee |
Retrospectieve vergelijking hematoma evacuation met afwachten |
|
Ma, 2010 |
Nee |
Niet conform PICO: craniectomy & hematoma evacuation |
|
Mendelow, 2007 |
Nee |
Geen systematische search, wel overzicht van trials |
|
Mendelow, 2011 |
Ja |
STICH II protocol |
|
Mendelow, 2013 |
Ja |
STICHII |
|
Miller, 2007 |
Nee |
Niet conform PICO: beschrijving neurochemische veranderlingen perihamatoma tissue |
|
Miller, 2007 |
Nee |
Niet conform PICO: stereotactic hematoma evacuation |
|
Mitchell, 2007 |
Nee |
Geen systematische search |
|
Morgan, 2008 |
Nee |
Niet conform PICO: effect rt PA MISTI |
|
Mould, 2014 |
Nee |
Niet conform PICO: effect rtPA |
|
Muir, 2005 |
Nee |
Letter |
|
Nagasaka, 2011 |
Nee |
Niet gerandomiseerd: vergelijking neuroendoscopy/craniotomy |
|
Nagasaka, 2013 |
Nee |
Niet systematische search |
|
Newell, 2011 |
Nee |
Niet conform PICO: ultrasound en rtPA |
|
Rubinstein, 2007 |
Nee |
Case series |
|
Ramanan, 2013 |
Nee |
Niet conform PICO: minimally invasive surgery |
|
Rohde, 2009 |
Nee |
Niet conform PICO: fibrinolytic therapy bij anticoagulated patiënts |
|
Sampron, 2010 |
Nee |
Spaanstalig |
|
Steiner. 2011 |
Nee |
Niet main outcome, beschrijving van patiënten die neurochirurgie ondergingen bij een RCT met recombinant factor VIIa |
|
Sutherland, 2008 |
Nee |
Niet conform PICO: recombinant Factor VIIa |
|
Tagliaferri, 2012 |
Nee |
Retrospective chart review |
|
Warburton, 2011 |
Nee |
Niet conform PICO: overzichtsartikel referenties gebruiken |
|
Wu, 2010 |
Nee |
Niet conform PICO: niet juiste uitkomstmaat: CST |
|
Wu, 2010 |
Nee |
Niet conform PICO: studie bij honden |
|
Wu, 2011 |
Nee |
Niet conform PICO: studie bij konijnen |
|
Wu, 2012 |
Nee |
Niet conform PICO: studie bij konijnen |
|
Wu, 2013 |
Nee |
Niet conform PICO: studie bij konijnen |
|
Wu, 2013 |
Nee |
Niet conform PICO: basale ganglia en perihematoma glutamate level |
|
Wu, 2013 |
Nee |
Niet conform PICO: focus op motor function |
|
Xiao, 2012 |
Nee |
Niet conform PICO: Hematome puncture and partial aspiration gevolgd door carniectomy vs craniectomy |
|
Yamamoto. 2011 |
Nee |
Retrospective review, in Japanse tekens |
|
Young, 2009 |
Nee |
Niet conform PICO: stereotactic guided evacuation versus conservative treatment, niet gerandomiseerd |
|
Zan, 2012 |
Nee |
Niet conform PICO: wel meenemen |
|
Zhu, 2012 |
Nee |
Niet conform PICO: keyhole endoscopic hematoma evacuation |
|
Zuo, 2009 |
Nee |
Niet conform PICO: gross-total hematoma removal versus sub-total hematoma removal, long-term follow-up |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 26-10-2017
Beoordeeld op geldigheid : 12-09-2024
De ontwikkelingen op het gebied van de acute opvang, secundaire preventie en revalidatie volgen elkaar in steeds sneller tempo op. Daarom werd in 2018 een kerngroep van neurologen, revalidatiearts en huisarts geïnstalleerd om snel op nieuwe ontwikkelingen te kunnen inspelen. In 2018 werden de modules over plaatjesaggregatieremmers en Directe Orale Anticoagulantia geupdate en nieuwe modules over tenecteplase en endovasculaire behandeling ontwikkeld. In 2019 wordt opnieuw geprioriteerd welke wijzigingen nodig zijn.
Deze kerngroep vergadert tenminste tweemaal per jaar om op basis van eigen inzichten en/of signalen uit het veld te beoordelen of hernieuwde aanvulling en/of revisie van (onderdelen van) de richtlijn gewenst is. Andere disciplines namen zitting in een klankbordgroep en worden betrokken afhankelijk van het onderwerp van de te reviseren module.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Op sommige plaatsen in deze richtlijn wordt verwezen naar de richtlijn Beroerte uit 2008. Het hoofdstuk Verantwoording uit deze richtlijn is op te vragen bij de Nederlandse Vereniging voor Neurologie.
In samenwerking met:
Koninklijk Nederlands Genootschap voor Fysiotherapie
Nederlands Huisartsen Genootschap
Nederlands Instituut van Psychologen
Nederlandse Vereniging voor Logopedie & Foniatrie
Nederlandse Vereniging voor Klinische Neurofysiologie
Nederlandse Vereniging voor Spoedeisende Hulp Artsen
Verenso Vereniging van Specialisten Ouderengeneeskunde
Verpleegkundigen & Verzorgenden Nederland (Neuro/stroke verpleegkundigen en Ambulancezorg)
Nederlandse Vereniging voor Ergotherapie
Doel en doelgroep
Doel
Het doel van deze op wetenschappelijk bewijs gebaseerde (evidence based) richtlijn is het bieden van een basis voor optimale zorg voor patiënten met een herseninfarct of hersenbloeding. Daarnaast draagt de richtlijn bij aan afstemming van de zorg tussen de verschillende zorgverleners en aan het terugdringen van ongewenste praktijkvariatie.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met een herseninfarct of hersenbloeding.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met TIA, herseninfarct of hersenbloeding. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende drie jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- prof. dr. D.W.J. Dippel (voorzitter), neuroloog, Erasmus MC Rotterdam, namens de Nederlandse Vereniging voor Neurologie (NVN)
- dr. H.B. van der Worp, neuroloog, UMC Utrecht, namens de NVN
- dr. J. Hofmeijer, neuroloog, Rijnstate ziekenhuis Arnhem, namens de NVN
- dr. R.M. van den Berg-Vos, neuroloog, OLVG West Amsterdam, namens de NVN
- dr. E.J. van Dijk, neuroloog, Radboudumc Nijmegen, namens de NVN
- M. Geurts, AIOS neurologie, UMC Utrecht, namens de NVN en de Vereniging Arts-Assistenten in opleiding tot Neuroloog (VAAN)
- prof. Dr. W. Mess, neuroloog/klinisch neurofysioloog, Maastricht UMC, namens de NVN
- dr. L.M.L. de Lau, neuroloog, Slotervaartziekenhuis Amsterdam, namens de NVN
- M. Kouwenhoven, revalidatiearts, De Hoogstraat Utrecht, namens de Nederlandse Vereniging van Revalidatiearsten (VRA)
- dr. B.J. Bouma, cardioloog, AMC Amsterdam, namens de Nederlandse Vereniging voor Cardiologie (NVvC)
- prof. dr. G.J. de Borst, vaatchirurg, UMC Utrecht, namens de Nederlandse Verenging voor Vaatchirurgie (NVvV)/Nederlandse Vereniging voor Heelkunde (NVvH)
- dr. J.A.H.R. Claassen, klinisch geriater, Radboudumc Nijmegen, namens de Nederlandse Vereniging voor Klinische Geriatrie (NVKG)
- dr. M. van Eijk, specialist ouderengeneeskunde, LUMC Leiden, namens Verenso Vereniging van Specialisten Ouderengeneeskunde
- dr. B.J.H. van den Born, internist, AMC Amsterdam, namens de Nederlandse Internisten Vereniging (NIV)/ Internistisch Vasculair Genootschap (IVG)
- dr. H.D. Boogaarts, neurochirurg, Radboudumc Nijmegen, namens de Nederlandse Vereniging voor Neurochirurgie (NVvN)
- dr. W. van Zwam, radioloog, Maastricht UMC, namens de Nederlandse Vereniging voor Radiologie (NVvR)
- I. Brummer, SEH-arts, Scheper ziekenhuis Emmen, namens de Nederlandse Vereniging van Spoedeisende Hulp Artsen (NVSHA)
- prof. dr. G. Kwakkel, hoogleraar neurorevalidatie, Vrije Universiteit Amsterdam, namens het Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF)
- A.F.E. Verburg, huisarts, namens het Nederlands Huisartsen Genootschap (NHG)
- K. Kanselaar, MANP, verpleegkundig specialist vasculaire neurologie Radboudumc Nijmegen, namens Verpleegkundigen & Verzorgenden Nederland (V&VN) afdeling Neuro & Revalidatie, werkgroep CVA
- G.J. Deddens, Verpleegkundig Specialist Acute Zorg, namens V&VN afdeling Ambulancezorg
- prof. dr. C.M. van Heugten, hoogleraar klinische neuropsychologie, Maastricht University, namens het Nederlands Instituut van Psychologen (NIP) sectie neuropsychologie.
- dr. S.K. Schiemanck, revalidatiearts, Leiden UMC, namens de VRA
- A. Harbers, klinisch linguist en logopediste, Klimmendaal, namens Nederlandse Vereniging voor Logopedie en Foniatrie (NVLF)
Met medewerking van
- dr. P.J. Nederkoorn, neuroloog, Academisch Medisch Centrum, Amsterdam
- dr. E. Steultjens, Hogeschool van Arnhem en Nijmegen, namens Ergotherapie Nederland
- E. van Gorp, namens de Patiëntenvereniging Hersenletsel.nl
- dr. R.H. Wimmers, namens de Hartstichting
- Ir. K. Idema, namens de Hart&Vaatgroep
Met ondersteuning van
- dr. M. Molag, adviseur, Kennisinstituut van Medisch Specialisten
- dr. I. Mostovaya, adviseur, Kennisinstituut van Medisch Specialisten
- dr. M. A. Pols, senior adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen door middel van reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten, een overzicht vindt u hieronder.
|
Werkgroeplid |
Functie |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
|
Berg-Vos |
Neuroloog |
Geen |
Geen |
Bestuurslid kennisnetwerk CVA |
Geen |
Geen |
Geen |
|
Boogaarts |
Neurochirurg |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Born |
Internist-vasculair geneeskundige |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Borst |
Vaatchirurg |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Bouma |
Cardioloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Brummer |
SEH-arts |
Geen |
Geen |
Lid richtlijnencommissie NVSHA |
Geen |
Geen |
Geen |
|
Claassen |
Klinisch geriater (0,6 fte) |
Geen |
Geen |
Geen |
Onderzoeksleider van 3 onderzoeksprojecten, (mede)gefinancierd door het onderzoeksfonds van Alzheimer Nederland (patiëntenvereniging), en 1 project gefinancierd door ISAO (Alzheimerfonds) |
Geen |
Mijn werkgever (Radboudumc) heeft financiele vergoedingen ontvangen van bedrijven (farmaceutische industrie) voor presentaties die ik op uitnodiging van die bedrijven heb gegeven, of voor symposia die ik voor die brdrijven heb (nede)georganiseerd. De vergoeding betrof steeds een vergoeding voor de gewerkte uren. |
|
Deddens |
Verpleegkundige Specialist Acute Zorg en Ambulanceverpleegkundige |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Dippel |
Neuroloog, hoogleraar acute behandeling neurovasculaire aandoeningen |
Geen |
Geen |
Niet van toepassing |
Het MR CLEAN onderzoek (www.mrclean-trial.org) wordt in geringe mate (10%) zonder voorwaarden gesteund door enkele medische industriën en importeurs. Deze staan vermeld op de website. Ik ben een van de hoofdonderzoekers van deze trial. |
Geen |
Geen |
|
Geurts |
AIOS neurologie |
Geen |
Geen |
Geen |
M. Geurts is studie-coordinator van de COOLing for Ischaemic Stroke Trial (COOLIST), dat wordt gefinancierd door de Nederlandse Hartstichting (2010B239). |
Geen |
Geen |
|
Harbers |
Logopediste & Klinisch Linguist |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Hofmeijer |
Neuroloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Kanselaar-Martens |
Verpleegkunde specialist Radboudumc |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Kwakkel |
Hoogleraar Neurorevalidatie |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Schiemanck |
Revalidatiearts Tot 31-12-2014: AMC ; Medisch Leidinggevende Neuroteam, AMC; Consulent Revalidatiegeneeskunde aan Zorgcentrum Berkenstede, Stichting Cordaan, Diemen, sinds 01-07-2006, Heden: subafdelingshoofd Leids Universitair Medisch Centrum |
Geen |
Geen |
Geen |
* Onderzoeksproject ism Radboudumc Efficacy of functional electrical stimulation of the peroneal nerve with the Actigait system on walking efficiency and patient satisfaction in stroke patients suffering from a drop foot, 2007-2014; studie is afgerond; financiering door Otto Bock Healthcare |
Geen |
Geen |
|
Spruit-Van Eijk |
Specialist Ouderengeneeskunde en UD PHEG |
Geen |
Geen |
Geen |
2007 - 2012 GRAMPS studie gefinancierd door 2 grote zorginstanties de Zorgboog en SVRZ, zorgt in Zeeland |
Geen |
Geen |
|
Van den Born |
internist |
Geen |
Geen |
Bestuurslid van de Nederlandse Hypertensievereniging |
Geen |
Geen |
Geen |
|
Van Dijk |
Neuroloog |
Geen |
Geen |
Bestuurslid Stafconvent Radboudumc: betaald |
Onderzoek naar effectiviteit en veiligheid DOACs in Nederland (gefinancierd door GGG-ZonMw / VWS): 110Keuro |
Geen |
Geen |
|
Van Heugten |
Psycholoog, hoogleraar Klinisch Neuropsychologie |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Verburg |
Wetenschappelijk medewerker en |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Zwam |
Radioloog |
Geen |
Geen |
Geen |
Stuurgroeplid MrClean studie |
Geen |
Geen |
Meelezers
|
Werkgroeplid |
Functie |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
|
Idema |
Beleidsadviseur (De Hart&Vaatgroep) |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Kouwenhoven |
Revalidatiearts |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Steultjens |
ass. Lector Neurorevalidatie |
Geen |
Geen |
lid raad van advies Ergotherapie Nederland |
Geen |
eigen onderneming gericht op bijscholing aan ergotherapeuten m.b.t. twee specifieke methoden van diagnostiek en interventie ook toepasbaar bij cliënten na bereorte. Scholing is niet gericht op toepassing multi-disciplinaire richtlijnen |
Geen |
|
Van Gorp-Clion |
Tot 1 juli 2014 Voorzitter, daarna bestuurslid |
Geen |
Doelgroep/ achterban van de patiëntenvereniging |
Belangen van CVA-patiënten bij de patiëntenorganisatie |
Geen |
Geen |
Geen |
|
Wielemaker |
Hoofd patiëntenzorg Hersenstichting Nederland |
Geen |
Geen |
Geen |
Geen deelname aan onderzoek. Ben zelf werkzaam bij een gezondheidsfonds, de Hersenstichting verleent wel subsidie aan wetenschappelijk onderzoek. |
Geen |
De Hersenstichting heeft een puur faciliterende rol als het gaat om ontwikkeling van bijvoorbeeld een zorgstandaard, zoals nu de zorgstandaard Traumatisch Hersenletsel. Zij heeft het zorgveld de opdracht gegeven een dergelijke zorgstandaard te ontwikkelen en stelt daarvoor de middelen ter beschikking. Meer informatie op www.zorgstandaardnah.nl |
|
Wimmers |
Teammanager Kennis & Trends, Hartstichting |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het raadplegen van afgevaardigden van de patiëntenvereniging hersenletsel.nl, de Hartstichting en de Hart&Vaatgroep. Deze partijen werden ook uitgenodigd om tijdens de invitational conference de door hen ervaren knelpunten aan te dragen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan deze partijen.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit (www.demedischspecialist.nl/richtlijnen). Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreetrust.org) dat een internationaal breed geaccepteerd instrument is en op Richtlijnen voor richtlijnen voor de beoordeling van de kwaliteit van richtlijnen (www.zorginstituutnederland.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Achmea en VGZ namens Zorgverzekeraars Nederland, het College voor Zorgverzekeringen (tegenwoordig Zorginstituut Nederland), de Inspectie voor de Gezondheidszorg, CVA Patiëntenvereniging Hersenletsel.nl, de Hart&Vaatgroep en de Hartstichting, via een invitational conference.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken, waarna de definitieve uitgangsvragen werden vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk en onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt inhoudt.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen, via de websites van enkele grote organisaties, zoals de American Heart Association en de European Stroke Organization. Tevens werd in de tijdschriften Stroke en Int J Stroke gezocht naar richtlijnen. Vervolgens werd op de website van de Cochrane Library gezocht naar systematische reviews. Tot slot werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases (NLM Pubmed, Google Scholar, Embase, Cochrane Library). De zoektermen werden geformuleerd aan de hand van een searchvraag. De searchvraag werd vertaald in een PICO (patient, intervention, control, outcome). Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepsleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in het hoofdstuk van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van vertrouwen in de literatuurconclusie (zie http://www.guidelinedevelopment.org/handbook/).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden.
Formuleren van de conclusies
Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusies, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt deze getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen door de werkgroep en beschreven in de literatuursamenvatting.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld binnen de clinical audit van de NVN om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de paragraaf Kennislacunes behorend bij elke module.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
Engels, Nederlands, Duits, Frans
2007-juni 2014 |
1 exp cerebral hemorrhage/ [narrower terms: exp basal ganglia hemorrhage/ or putaminal hemorrhage/] (27452) 2 ((cerebral or cerebrum or intracerebral or brain or intracranial or stroke) adj3 (h?emorrhag* or bleeding)).ti,ab. (28971) 3 hematoma, epidural, cranial/ or exp hematoma, subdural/ (9435) 4 h?ematoma*.ti,ab. (39899) 5 1 or 2 or 3 or 4 (81633) 6 limit 5 to (dutch or english or german or french) (69284) 7 limit 6 to yr=2007 -Current (23738) 11 stich.ti,ab. (170) 12 7 and 11 (34) 13 (h?ematoma* adj6 evacuat*).ti,ab. (2208) 14 *hematoma, epidural, cranial/su or exp *hematoma, subdural/su (1164) 15 12 or 13 or 14 (3171) 16 limit 15 to (yr=2007 - 2014 and (dutch or english)) (993) 17 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp Review Literature as Topic/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and review/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (209962) 18 16 and 17 (65) 19 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1369751) 20 16 and 19 (118) 21 evacuat*.ti. (3169) 22 7 and 21 (145) 23 16 or 22 (1011) 24 17 and 23 (65) – 61 uniek 25 19 and 23 (126) 26 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective.tw. or prospective.tw. or Cross sectional.tw. or Cross-sectional studies/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (1995078) 27 23 and 26 (335) 28 25 not 24 (111) – 98 uniek 29 27 not (25 or 24) (260)- eventueel later |
182 |
|
Embase (Elsevier) |
(h?ematoma* NEAR/6 evacuat*):ab,ti OR ('brain hemorrhage'/exp OR 'brain hemorrhage' OR ((cerebral OR cerebrum OR intracerebral OR brain OR intracranial OR stroke) NEAR/3 (hemorrhag* OR bleeding OR haemorrhag*)):ab,ti AND stich:ti) OR ('brain hemorrhage'/exp OR 'brain hemorrhage' OR ((cerebral OR cerebrum OR intracerebral OR brain OR intracranial OR stroke) NEAR/3 (hemorrhag* OR bleeding OR haemorrhag*)):ab,ti AND evacuat*:ti)
('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp) 6 referenties. 4 uniek
('clinical trial'/exp OR 'clinical trial' OR 'randomization'/exp OR 'randomization' OR 'single blind procedure'/exp OR 'single blind procedure' OR 'double blind procedure'/exp OR 'double blind procedure' OR 'crossover procedure'/exp OR 'crossover procedure' OR 'placebo'/exp OR 'placebo' OR 'prospective study'/exp OR 'prospective study' OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR 'randomized controlled trial' OR placebo*:ab,ti) NOT 'conference abstract':it AND ([dutch]/lim OR [english]/lim) AND [embase]/lim 48 referenties, 19 uniek |
|
Database: Medline (OVID) 2007 – 07 juni, 2014
Aantal hits: 182

