Combinatiebehandeling TACE en ablatie
Uitgangsvraag
Wat is de plaatsbepaling van een combinatiebehandeling van TACE en ablatie?
Aanbeveling
Overweeg TACE voorafgaand aan ablatie (tijdsinterval 4 tot 6 weken) bij patiënten met een irresectabel solitair HCC van 3-5 cm waarbij een ablatie wordt overwogen waar er twijfel is of er adequate ablatiemarges kunnen worden bereikt.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de verschillen in klinische uitkomsten tussen een combinatiebehandeling met transarteriële radio-embolisatie (TACE) en ablatie in vergelijking met TACE of ablatie alleen bij patiënten met early-stage hepatocellulair carcinoom. Er werden acht gerandomiseerde gecontroleerde studies (RCTs) geselecteerd en uitgewerkt (Liu, 2011; Liu, 2014; Morimoto, 2010; Peng, 2012; Peng, 2013; Sheta, 2016; Zaitoun, 2021; Zhang, 2021).
Bij de meeste studies waren de lesies tussen de 3 en 5 cm. Enkele studies keken (ook) naar grotere lesies. Conclusies en aanbevelingen binnen deze module beperken zich tot lesies tussen de 3 en 5 cm, omdat ablatie in de regel in Nederland niet wordt toegepast bij lesies boven de 5 cm. Het aantal patiënten in de studies met grotere lesies is zeer beperkt.
Er werden alleen RCTs geïncludeerd in de analyse, waardoor de kwaliteit van bewijs initieel hoog was. De geïncludeerde studies hadden in wisselende mate methodologische beperkingen (risk of bias). Er was in sommige studies een risico op bias door onder andere ontoereikende documentatie, loss of follow-up en blindering. Daarnaast waren de studiebevindingen soms moeilijk met elkaar te vergelijken omdat de controle interventies en de populaties van elkaar verschilden (indirectness) en waren er meerdere studies met een relatief kleine populatie en mede hierdoor een grote spreiding van de puntschatter van de uitkomstmaat (imprecision), waardoor de kwaliteit van dit bewijs ook naar beneden werd bijgesteld. De bewijskracht van de literatuur werd voor zowel de cruciale als belangrijke uitkomstmaten, door bovenstaande bevindingen gegradeerd als ‘laag’ of ‘zeer laag’.
De geïncludeerde studies zijn allen uitgevoerd in niet-westerse populaties en het ontbreekt aan studies die de resultaten bevestigen in een overwegend kaukasische patiëntenpopulatie met een andere etiologie voor cirrose en HCC. Daarbij zijn de meeste studies gedateerd en uitgevoerd met RFA. In recente jaren zijn ablatiesystemen verbeterd en is in veel centra RFA (groten)deels vervangen door MWA. Bovendien zijn recidiefpercentages hedentendage ook bij grotere lesies (3 tot 5 cm) laag wanneer gebruik gemaakt wordt van geavanceerde planningssoftware, naaldpositioneringssystemen, multipele naalden en/of confirmatiesoftware (Beermann, 2020; Laimer, 2020; Schullian, 2022). Wanneer gebruik gemaakt wordt van deze technologieën is er grotere zekerheid op het behalen van technisch succes, i.e. complete tumorablatie met een adequate marge, en is het onzeker of (neo)adjuvante TACE nog van meerwaarde is (Laimer, 2020; Rai, 2023). Bij patiënten bij wie er op voorhand twijfel is of er adequate marges kunnen worden behaald door bijvoorbeeld een centrale ligging of nabijgelegen groot bloedvat, kan worden overwogen neoadjuvant TACE te verrichten met het doel de lesie in grootte te doen afnemen en zo wel adequate marges te verkrijgen.
Tussen de verschillende studies waren er aanzienlijke verschillen in gebruikte materialen en het interval tussen TACE en ablatie. Er is op dit moment geen eenduidige aanbeveling te geven welke technieken de voorkeur genieten (RFA of MWA, conventionele TACE of drug-eluting bead TACE) of het interval dat dient te worden aangehouden tussen TACE en ablatie (Hendriks, 2021). In zeven van de acht geïncludeerde studies werd TACE verricht voorafgaand aan de ablatie.
In deze module is combinatietherapie met TACE en ablatie onderzocht bij de behandeling van één en dezelfde lesie. Er is geen analyse verricht naar de combinatie behandeling bij verschillende lesies. Bij individuele patienten kunnen er redenen zijn de ene lesie met ablatie te behandelen en een andere met TACE. Hierover wordt binnen deze module geen uitspraak gedaan.
Concluderend laten de acht geïncludeerde studies aanwijzingen zien voor een mogelijk positief effect van de combinatiebehandeling van TACE en ablatie op totale overleving, ziektevrijeoverleving en lokale tumorcontrole bij patiënten met tumoren van 3 tot 5 cm. Er werden klinisch relevante verschillen gevonden voor meerdere uitkomstmaten, maar de totale bewijskracht is onvoldoende om hier een eenduidige conclusie uit te trekken.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
De combinatietherapie met TACE en ablatie resulteert in een grotere belasting voor de patiënt ten opzichte van een van beide behandelingen alleen. In de meeste studies wordt er een interval van 2 tot 4 weken tussen TACE en ablatie aangehouden. Voor patiënten betekent dit een extra opname en langer behandeltraject. Bovendien vergroot de extra behandeling mogelijk de kans op complicaties. De geïncludeerde studies vonden evenwel geen significant hoger percentage complicaties bij de combinatie TACE en ablatie ten opzichte van ablatie alleen, maar de kwaliteit van het bewijs hiervoor werd als zeer onzeker beoordeeld. In individuele patienten (zie overwegingen hierboven) kunnen de extra belasting en risico’s mogelijk opwegen tegen de potentieel hogere effectiviteit van de combinatiebehandeling.
Kosten (middelenbeslag)
De kosten van combinatiebehandeling en de benodigde inzet van medisch personeel en faciliteiten zijn hoger in geval van de combinatietherapie ten opzichte van monotherapie. Er is in het kader van deze richtlijn geen kostenanalyse verricht. De geïncludeerde studies wijzen op een betere ziektevrije overleving en lager lokaal recidief percentage. Het ligt in de rede dat dat leidt tot een afname van het aantal reinterventies wat kan compenseren voor de initieel hogere kosten van de combinatiebehandeling. Het beschikbare wetenschappelijk bewijs werd echter als laag tot zeer laag beschouwd en er kan derhalve geen eenduidige conclusie worden getrokken. Over kosteneffectiviteit van de combinatiebehandeling kan geen uitspraak worden gedaan.
Aanvaardbaarheid, haalbaarheid en implementatie
De werkgroep is van mening dat er geen bezwaren of voorwaarden zijn voor aanvaardbaarheid, haalbaarheid of implementatie van de aanbeveling.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Er zijn verschillende gerandomiseerde studies die aantonen dat de combinatie TACE plus ablatie superieur is ten opzichte van ablatie alleen bij patiënten met een HCC groter dan 3 cm. We berekenden op basis van de geïncludeerde studies een relatief risico van respectievelijk 0.33 (95% CI: 0.16 to 0.66) en 0.65 (0.52 to 0.82) voor totale overleving na 1 en 3 jaar, ten gunste van de combinatiebehandeling. Dit heeft evenwel niet geleid tot een harde aanbeveling de combinatietherapie standaard aan te bieden in de klinische praktijk. Volgens de GRADE systematiek is de bewijskracht van onderliggende studies laag. De beschikbare studies kennen methodologische beperkingen en zijn niet gevalideerd in westerse populaties. Bovendien zijn de meeste studies gedateerd; sinds het verschijnen van deze studies zijn de ablatietechnieken en resultaten verbeterd (Cassinotto, 2021; Laimer, 2020; Puijk, 2022; Schullian, 2022). Daar staat niet alleen tegenover dat de verschillende studies wijzen op een gunstig effect, maar ook dat de rationale voor neoadjuvante TACE sterk is. Ten eerste leidt TACE tot krimp van een lesie, waardoor het makkelijker wordt een lesie compleet te ableren met voldoende marge. Ten tweede is als gevolg van de afsluiting van tumor-voedende arterieën, er een kleinere kans op een recidief als gevolg van ‘heat-sink’. Ten derde vormt TACE een behandeling voor eventuele satelliet-metastasen, die nabij maar net buiten de ablatiezone zijn gelegen. Satelliet-metastasen komen zeer frequent voor bij HCC, met name bij grotere lesies, en liggen meestal in nabijheid van de primaire tumor.
Voornoemde overwegingen hebben ertoe geleid dat twijfel persisteert over de toegevoegde waarde van neoadjuvante TACE bij patiënten met een HCC van 3-5 cm waarbij een ablatie is gekozen als behandeling van keuze. Er lijkt voldoende grond om dit aan te bevelen voor patiënten waarbij er twijfel bestaat of voldoende marge kan worden behaald. Met de TACE wordt dan beoogd de lesie te laten krimpen om zo een ablatie met voldoende marge te vergemakkelijken.
Onderbouwing
Achtergrond
Voor een solitair hepatocellulair carcinoom (HCC) tot 2 cm is de effectiviteit van ablatie vergelijkbaar met die van resectie. Bij grotere tumoren wordt doorgaans de voorkeur gegeven aan resectie. In het algemeen wordt de kans op een lokaal recidief na ablatie groter geacht dan na resectie bij tumoren groter dan 2 tot 3 cm. De resultaten van ablatie zijn in voorbije jaren evenwel steeds beter geworden, dankzij verbeteringen in ablatiesytemen en naaldpositionering. Daarbij is een aanzienlijk deel van de patiënten met een tumor >2 cm geen kandidaat voor resectie, ten gevolge van cirrose met portale hypertensie, hoge leeftijd, co-morbiditeit en/of een ongunstige ligging van de tumor.
Om de effectiviteit van ablatie bij grotere tumoren te vergroten, zijn er diverse trials verricht waarbij ablatie is gecombineerd met transarteriële chemoembolisatie (TACE). De combinatie met TACE is mogelijk effectiever dan ablatie alleen.
Conclusies / Summary of Findings
Overall survival
|
Low GRADE |
Combination therapy of TACE and ablation may result in a higher overall survival than TACE or ablation alone in patients with early-stage hepatocellular carcinoma, but the evidence is uncertain.
Sources: (Liu, 2011; Morimoto, 2010; Peng, 2012; Peng, 2013; Zaitoun, 2021; Zhang, 2021) |
Disease-free survival
|
Low GRADE |
Combination therapy of TACE and ablation may result in a higher disease-free survival than ablation alone in patients with early-stage hepatocellular carcinoma, but the evidence is uncertain.
Sources: (Peng, 2012; Peng, 2013; Zhang, 2021) |
Local tumor control
|
Very low GRADE |
Combination therapy of TACE and ablation may result in a higher local tumor control than TACE or ablation alone in patients with early-stage hepatocellular carcinoma, but the evidence is very uncertain.
Sources: (Morimoto, 2010) |
Complications
|
Very low GRADE |
The evidence is very uncertain about the effect of combination therapy of TACE and ablation on complications compared with the effect of TACE or ablation alone in patients with early-stage hepatocellular carcinoma.
Sources: (Liu, 2011; Morimoto, 2010; Peng, 2012; Peng, 2013; Sheta, 2016; Zaitoun, 2021) |
Samenvatting literatuur
Description of studies
Li (2021) conducted a systematic review on hyperthermia ablation (HA) combined with TACE versus monotherapy for the treatment of hepatocellular carcinoma. The effects of HA (radiofrequency ablation (RFA)/microwave ablation (MWA)) combined with TACE and monotherapy (HA or TACE) on overall survival, adverse effects and complications were evaluated. Multiple databases (Cochrane Library, Web of Science, PubMed, Embase, and Scopus) were searched up to May 2021. Thirty-six studies were included, of which 15 (randomized) controlled trials (RCTs). Seven RCTs (Liu, 2011; Liu, 2014; Morimoto, 2010; Peng, 2012; Peng, 2013; Sheta, 2016; Zaitoun, 2021) were included in this literature analysis. The other RCTs were excluded because of publication date <2010, no randomization, double cohorts or wrong outcome measures.
Liu (2011) evaluated the efficacy and safety of TACE followed by MWA compared to TACE alone for unresectable large-sized (>5 cm) hepatocellular carcinoma. A total of 16 patients was randomized into the combination group (mean age 52.1±14.5; 88% male) and 18 into the TACE group (mean age 51.9±13.6; 83% male). The study had an open-label design.
Liu (2014) evaluated the efficacy of TACE followed by RFA compared to TACE alone for advanced hepatocellular carcinoma (>3 cm). A total of 45 patients was randomized into the combination group (age, range 45 to 75; 80% male) and 43 into the TACE group (age, range 44-78; 79% male). The study had an open-label design, and no information was given on randomization and allocation concealment methods.
Morimoto (2010) evaluated the efficacy of TACE followed by RFA compared to RFA alone for intermediate-sized (3.1 to 5.0 cm) hepatocellular carcinoma. A total of 19 patients was randomized into the combination group (mean age 70, range 57 to 78; 79% male) and 18 nto the RFA group (mean age 73, range 48 to 84; 67% male). The study had an open-label design.
Peng (2012) evaluated the efficacy of TACE followed by RFA compared to RFA alone for recurrent hepatocellular carcinoma (≤5 cm). A total of 69 patients was randomized into the combination group (mean age 57.5±10.0; 86% male) and 70 into the RFA group (mean age 55.1±9.5; 79% male). The study had an open-label design.
Peng (2013) evaluated the efficacy of TACE followed by RFA compared to RFA alone for hepatocellular carcinoma (≤7 cm). A total of 94 patients was randomized into the combination group (mean age 53.3±11.0; 80% male) and 95 into the RFA group (mean age 55.3±13.3; 75% male). The study had an open-label design.
Sheta (2016) compared combination treatments (RFA or MWA followed by TACE) with TACE alone for non-resectable single-lesion hepatocellular carcinoma (>4 cm). A total of 50 patients was divided into three groups: a combination group of TACE and RFA (n=20), a combination group of TACE and MWA (n=10) and a TACE group (n=20). Baseline characteristics such as age and sex were not described. The study had an open-label design, and no information was given on randomization and allocation concealment methods.
Zaitoun (2021) evaluated the efficacy and safety of TACE followed by MWA compared to TACE or MWA alone for treatment of hepatocellular carcinoma (3-5 cm). A total of 89 patients was randomized into the combination group (mean age 52.1±9.5; 58% male), 84 into the TACE group (51.3±9.2; 62% male) and 92 into the MWA group (mean age 53.8±10.3; 54% male). The study had an open-label design, and it was unknown in which group the lost-to-follow-up (n=12) occurred.
One additional RCT was published after the search date of the systematic review by Li (2021).
Zhang (2021) evaluated the long-term outcomes and safety of TACE followed by RFA compared to RFA alone for early hepatocellular carcinoma (≤ 7 cm). A total of 94 patients was randomized into the combination group (mean age 53.3±11.0; 80% male) and 95 into the RFA group (mean age 55.3±13.3; 75% male). The study had an open-label design. The study was based on long-term follow-up of patients who were recruited into the previously reported RCT by Peng (2013).
Results
Overall survival (critical)
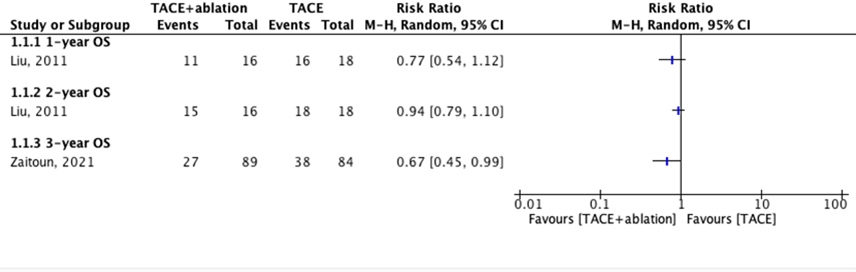
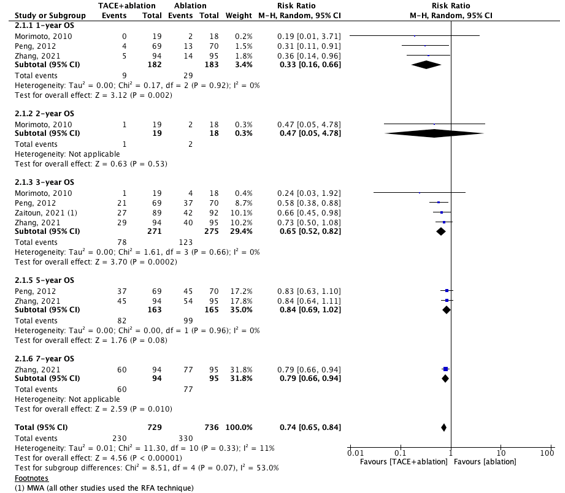
Six studies reported overall survival (OS). The results are split by type of monotherapy: two studies compared the OS in a combination group and a TACE group (figure 7.2.1) and four studies compared the OS in a combination group and an ablation group (figure 7.2.2).
All results for the OS on different time-points (1-, 2-, 3-, 5- and 7-year) favored the combination group, both in comparison with TACE and ablation alone.
Results were pooled for the 1-year OS and 3-year OS for the combination versus ablation. For the 1-year OS, the pooled RR was 0.33 (95% CI: 0.16 to 0.66). For the 3-year OS, the pooled RR was 0.65 (0.52 to 0.82). These differences are clinically relevant.
The study population of Zhang (2021) is equal to the population of Peng (2013), so the overall survival results of Peng (2013) were not meta-analyzed.
Figure 7.2.1. Outcome 1-, 2- and 3-year overall survival with TACE+ablation versus TACE
Figure 7.2.2. Outcome 1-, 2-, 3-, 5- and 7-year overall survival with TACE+ablation versus ablation
Z: p-value of pooled effect; df: degrees of freedom, I2: statistical heterogeneity, CI: confidence interval
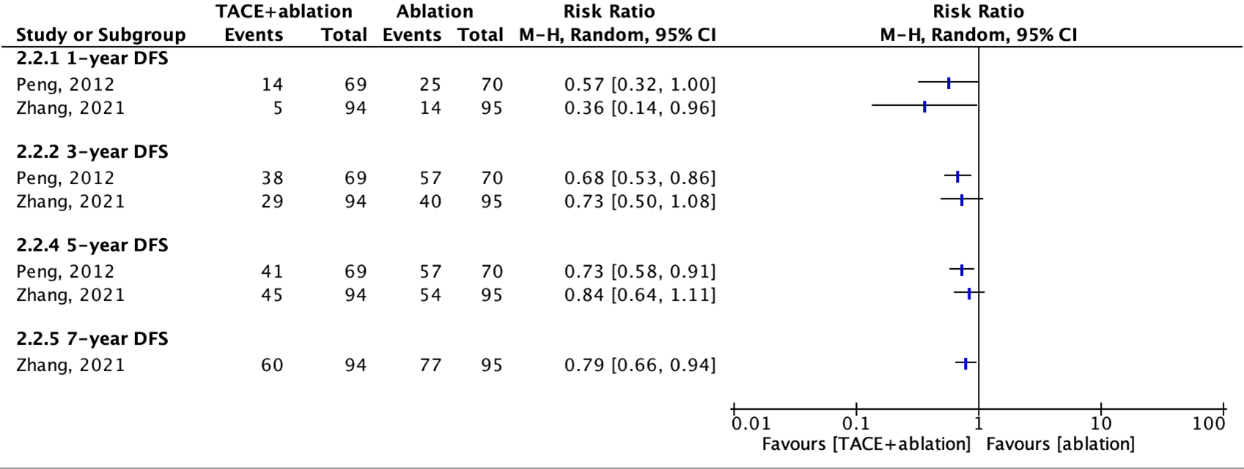
Disease-free survival (critical)
Three studies reported disease-free survival (DFS). These studies compared the DFS in a combination group and an ablation group (figure 7.2.3). None of the included studies compared the DFS in a combination group and a TACE group.
All results for the DFS on different time-points (1-, 3-, 5-, 7-year) favored the combination group.
The study population of Zhang (2021) is equal to the population of Peng (2013), so the disease-free survival results of Peng (2013) were not meta-analyzed.
Figure 7.2.3. Outcome 1-, 3-, 5-, and 7-year disease-free survival with TACE+ablation versus ablation
Z: p-value of pooled effect; df: degrees of freedom, I2: statistical heterogeneity, CI: confidence interval
Local tumor control (important)
Local tumor control was not defined as such by the included studies.
However, one study reported the (local) tumor progression.
Morimoto (2010) reported a local tumor progression rate of 6% in the combination group and a rate of 39% in the ablation group after 1, 2 and 3 years. The risk difference is 33%, which is clinically relevant.
Peng (2012), Peng (2013) and Zhang (2021) reported the number of patients that died because of (local) tumor progression in the follow-up.
Peng (2012) reported that local tumor progression was the cause of death in 28.9% of the patients in the combination group (21/69) and 32.8% in the ablation group (23/70).
Peng (2013) reported that tumor progression was the cause of death in 22.3% of the patients in the combination group (21/94) and 44.2% of the patients in the ablation group (42/95). In the follow-up results of this study (Zhang, 2021), 47.9% of the patients in the combination group (45/94) and 72.6% of the patients in the ablation group (69/95) had died because of tumor progression.
Complications (important)
Major complications were reported by six studies.
Morimoto (2010) reported no major complications in both the combination group and the ablation group.
Peng (2012) reported major complications in 2.9% of the patients in the combination group (2/69, moderate ascites/liver failure) and in 2.8% of the patients in the ablation group (2/70, severe ascites/persistent jaundice). Grade 3 pain was observed in 1 patient in the combination group (1.4%) and 1 patient in the ablation group (1.4%). Grade 3 vomiting was observed in 1 patient in the combination group (1.4%). These differences are not clinically relevant.
Peng (2013) reported grade 3 pain in 2.1% of the patients in the combination group (2/94) and in 1.1% of the patients in the ablation group (1/95). Grade 3 vomiting was observed in 1 patient in the ablation group (1.1%). These differences are not clinically relevant.
Liu (2011) reported no major complications in both the combination group and the ablation group.
Sheta (2016) reported major complications in 10% of the patients in the TACE+RFA combination group (2/20, ascites/tumor rupture/renal impairment), in 10% of the patients in the TACE+MWA combination group (1/10, decompensation/ascites) and in 40% of the patients in the TACE group (8/20, decompensation/ascites/tumor rupture/renal impairment). These differences are clinically relevant.
Zaitoun (2021) reported major complications in 1.1% of the patients in the combination group (1/89, severe hepatic dysfunction), in 2.2% of the patients in the ablation group (2/92, tumor seeding) and in 3.6% of the patients in the TACE group (3.84, severe hepatic dysfunction). These differences are not clinically relevant.
Level of evidence of the literature
The level of evidence of randomized controlled trials is considered high according to the GRADE methodology. Therefore, the level of evidence of these cohort studies starts at high GRADE.
Overall survival
The level of evidence regarding the outcome measure overall survival was downgraded by two levels because of study limitations (risk of bias, -1 (see RoB assessment)) and indirectness (-1; different populations and use of different treatment regimens in the intervention and control group). The level of evidence was therefore graded as low.
Disease-free survival
The level of evidence regarding the outcome measure disease-free survival was downgraded by two levels because of study limitations (risk of bias, -1 (see RoB assessment)) and low number of patients (imprecision, -1). The level of evidence was therefore graded as low.
Local tumor control
The level of evidence regarding the outcome measure local tumor control was downgraded by three levels because of study limitations (risk of bias, -1 (see RoB assessment)), indirectness (-1; different populations and use of different treatment regimens in the intervention and control group) and low number of patients (imprecision, -1). The level of evidence was therefore graded as very low.
Complications
The level of evidence regarding the outcome measure complications was downgraded by three levels because of study limitations (risk of bias, -1 (see RoB assessment)), indirectness (-1; different populations and use of different treatment regimens in the intervention and control group) and low number of patients (imprecision, -1). The level of evidence was therefore graded as very low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effectiveness of the combination of transarterial chemoembolization (TACE) and ablation compared to TACE or ablation alone in patients with early stage HCC (BCLC A)?
P: Patients with a hepatocellular carcinoma (early-stage HCC/BCLC A, >2 cm);
I: Combination therapy of TACE and ablation;
C: TACE or ablation alone;
O: Overall survival, disease-free survival, local recurrence, quality of life, bridge to transplant, local tumor control, complications.
Relevant outcome measures
The guideline development group considered overall survival and disease-free survival as critical outcome measures for decision making; and local recurrence, quality of life, bridge to transplant, local tumor control and complications as important outcome measures for decision making.
The working group defined the outcome measures as follows:
- Overall survival: Time to death from any cause with a minimum follow-up of one year.
- Disease-free survival: Time from randomization or initiation of treatment to recurrence of tumor or death from any cause.
- Local tumor control: Lack of tumor progression (complete response + partial response + stable disease).
- Complications: Adverse events following treatment (grade 3 and higher or serious/major adverse events).
The working group arbitrarily defined the following differences as a minimal clinically (patient) important difference:
- Overall survival: Absolute difference >5% or absolute difference >3% and Risk Ratio (RR) <0.7.
- Disease-free survival: Absolute difference >5% or absolute difference >3% and Risk Ratio (RR) <0.7.
- Local tumor control: Absolute difference >5%.
- Complications: Absolute difference >3% for lethal complications, or >10% for serious complications.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2010 until 03-02-2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 515 hits. Studies were selected based on the following criteria:
- Systematic reviews or randomized controlled trials.
- full-text English language publication.
- complying with the PICO criteria.
Fifty-seven studies were initially selected based on title and abstract screening. After reading the full text, 56 studies were excluded (see the table with reasons for exclusion under the tab Methods). One systematic review comparing radioembolization to chemoembolization was selected. One additional RCT was included.
Results
One systematic review was selected, of which seven RCTs were extracted. One additional RCT was included, resulting in eight studies for the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Beermann M, Lindeberg J, Engstrand J, Galmén K, Karlgren S, Stillström D, Nilsson H, Harbut P, Freedman J. 1000 consecutive ablation sessions in the era of computer assisted image guidance - Lessons learned. Eur J Radiol Open. 2018 Dec 5;6:1-8. doi: 10.1016/j.ejro.2018.11.002. Erratum in: Eur J Radiol Open. 2020 Dec 17;8:100308. PMID: 30547062; PMCID: PMC6282637.
- Cassinotto C, Nogue E, Morell M, Panaro F, Molinari N, Guiu B. Changing trends in hepatocellular carcinoma management: Results from a nationwide database in the last decade. Eur J Cancer. 2021 Mar;146:48-55. doi: 10.1016/j.ejca.2021.01.009. Epub 2021 Feb 11. PMID: 33582392.
- Hendriks P, Sudiono DR, Schaapman JJ, Coenraad MJ, Tushuizen ME, Takkenberg RB, Oosterveer TTM, de Geus-Oei LF, van Delden OM, Burgmans MC. Thermal ablation combined with transarterial chemoembolization for hepatocellular carcinoma: What is the right treatment sequence? Eur J Radiol. 2021 Nov;144:110006. doi: 10.1016/j.ejrad.2021.110006. Epub 2021 Oct 26. PMID: 34717187.
- Laimer G, Schullian P, Jaschke N, Putzer D, Eberle G, Alzaga A, Odisio B, Bale R. Minimal ablative margin (MAM) assessment with image fusion: an independent predictor for local tumor progression in hepatocellular carcinoma after stereotactic radiofrequency ablation. Eur Radiol. 2020 May;30(5):2463-2472. doi: 10.1007/s00330-019-06609-7. Epub 2020 Jan 30. PMID: 32002642; PMCID: PMC7160081.
- Liu C, Liang P, Liu F, Wang Y, Li X, Han Z, Liu C. MWA combined with TACE as a combined therapy for unresectable large-sized hepotocellular carcinoma. Int J Hyperthermia. 2011;27(7):654-62. doi: 10.3109/02656736.2011.605099. Epub 2011 Oct 3. PMID: 21966941.
- Liu HC, Shan EB, Zhou L, Jin H, Cui PY, Tan Y, Lu YM. Combination of percutaneous radiofrequency ablation with transarterial chemoembolization for hepatocellular carcinoma: observation of clinical effects. Chin J Cancer Res. 2014 Aug;26(4):471-7. doi: 10.3978/j.issn.1000-9604.2014.08.18. PMID: 25232222; PMCID: PMC4153924.
- Morimoto M, Numata K, Kondou M, Nozaki A, Morita S, Tanaka K. Midterm outcomes in patients with intermediate-sized hepatocellular carcinoma: a randomized controlled trial for determining the efficacy of radiofrequency ablation combined with transcatheter arterial chemoembolization. Cancer. 2010 Dec 1;116(23):5452-60. doi: 10.1002/cncr.25314. Epub 2010 Jul 29. PMID: 20672352.
- Peng ZW, Zhang YJ, Liang HH, Lin XJ, Guo RP, Chen MS. Recurrent hepatocellular carcinoma treated with sequential transcatheter arterial chemoembolization and RF ablation versus RF ablation alone: a prospective randomized trial. Radiology. 2012 Feb;262(2):689-700. doi: 10.1148/radiol.11110637. Epub 2011 Dec 12. PMID: 22157201.
- Peng ZW, Zhang YJ, Chen MS, Xu L, Liang HH, Lin XJ, Guo RP, Zhang YQ, Lau WY. Radiofrequency ablation with or without transcatheter arterial chemoembolization in the treatment of hepatocellular carcinoma: a prospective randomized trial. J Clin Oncol. 2013 Feb 1;31(4):426-32. doi: 10.1200/JCO.2012.42.9936. Epub 2012 Dec 26. PMID: 23269991.
- Puijk RS, Dijkstra M, van den Bemd BAT, Ruarus AH, Nieuwenhuizen S, Geboers B, Timmer FEF, Schouten EAC, de Vries JJJ, van der Meijs BB, Nielsen K, Swijnenburg RJ, van den Tol MP, Versteeg KS, Lissenberg-Witte BI, Scheffer HJ, Meijerink MR. Improved Outcomes of Thermal Ablation for Colorectal Liver Metastases: A 10-Year Analysis from the Prospective Amsterdam CORE Registry (AmCORE). Cardiovasc Intervent Radiol. 2022 Aug;45(8):1074-1089. doi: 10.1007/s00270-022-03152-9. Epub 2022 May 18. PMID: 35585138; PMCID: PMC9307533.
- Rai P, Ansari MY, Warfa M, Al-Hamar H, Abinahed J, Barah A, Dakua SP, Balakrishnan S. Efficacy of fusion imaging for immediate post-ablation assessment of malignant liver neoplasms: A systematic review. Cancer Med. 2023 May 16. doi: 10.1002/cam4.6089. Epub ahead of print. PMID: 37191030.
- Schullian P, Laimer G, Johnston E, Putzer D, Eberle G, Scharll Y, Widmann G, Kolbitsch C, Bale R. Technical efficacy and local recurrence after stereotactic radiofrequency ablation of 2653 liver tumors: a 15-year single-center experience with evaluation of prognostic factors. Int J Hyperthermia. 2022;39(1):421-430. doi: 10.1080/02656736.2022.2044522. PMID: 35227136.
- Sheta E, El-Kalla F, El-Gharib M, Kobtan A, Elhendawy M, Abd-Elsalam S, Mansour L, Amer I. Comparison of single-session transarterial chemoembolization combined with microwave ablation or radiofrequency ablation in the treatment of hepatocellular carcinoma: a randomized-controlled study. Eur J Gastroenterol Hepatol. 2016 Oct;28(10):1198-203. doi: 10.1097/MEG.0000000000000688. PMID: 27362551.
- Zaitoun MMA, Elsayed SB, Zaitoun NA, Soliman RK, Elmokadem AH, Farag AA, Amer M, Hendi AM, Mahmoud NEM, Salah El Deen D, Alsowey AM, Shahin S, Basha MAA. Combined therapy with conventional trans-arterial chemoembolization (cTACE) and microwave ablation (MWA) for hepatocellular carcinoma >3-<5?cm. Int J Hyperthermia. 2021;38(1):248-256. doi: 10.1080/02656736.2021.1887941. PMID: 33615957.
- Zhang YJ, Chen MS, Chen Y, Lau WY, Peng Z. Long-term Outcomes of Transcatheter Arterial Chemoembolization Combined With Radiofrequency Ablation as an Initial Treatment for Early-Stage Hepatocellular Carcinoma. JAMA Netw Open. 2021 Sep 1;4(9):e2126992. doi: 10.1001/jamanetworkopen.2021.26992. Erratum in: JAMA Netw Open. 2022 Jan 4;5(1):e2148091. PMID: 34570206; PMCID: PMC8477266.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
Research question: What is the effectiveness of the combination of transarterial chemoembolization (TACE) and ablation compared to TACE or ablation alone in patients with early stage HCC (BCLC A)?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Liu, 2011 |
Type of study: Open-label randomized controlled trial with blinded assessment.
Setting: Chinese PLA General Hospital.
Enrolled between May 2004 and December 2006.
Country: China.
Source of funding: No information.
Conflicts of interest: Not clearly stated. |
Patients with large unresectable hepatocellular carcinoma (>5cm);
Inclusion criteria:
Exclusion criteria:
N total at baseline: N = 34 Intervention: N=16 Control: N=18
Important characteristics: Age, mean (SD): I: 52.1 y (14.5) C: 51.9 y (13.6)
Sex, n/N (%) male: I: 14/16 (87.5%) C: 15/18 (83.3%)
Size of the largest tumor (median, cm): I: 6.8 ± 1.5 C: 6.7 ± 1.5
Groups comparable at baseline? Yes. |
Intervention: TACE + percutaneous ablation with microwave ablation (MWA) 2–4 weeks after TACE |
Control: TACE |
Length of follow-up: Median follow-up of 8 months (range, 2–28 months)
Loss-to-follow-up: No loss to follow-up
Incomplete outcome data: No information.
|
Overall survival 1-year I: 33.3% C: 11.1%
2-year
3, 4, 5-years overall survival not reported.
Disease-free survival not reported.
Local tumor control not reported.
Complications |
Also reported:
Definition:
Remarks:
|
|
Liu, 2014 |
Type of study: Open-label randomized controlled trial.
Setting: The First Affiliated Hospital of Bengbu Medical College.
Enrolled between June 2005 and June 2011.
Country: China.
Source of funding: No information.
Conflicts of interest: None to declare. |
Patients with middle-late stage primary carcinoma of the liver who could or should not be accepted for surgical treatment, according with the AASLD diagnostic criteria
Inclusion criteria:
Exclusion criteria:
N total at baseline: N = 88 Intervention: N=45 Control: N=43
Important characteristics: Age, range: I: 45-75 C: 44-78
Sex, n/N (%) male: I: 36/45 (80.0%) C: 34/43 (79.1%)
Tumor size I: 4-15 C: 5-14
Groups comparable at baseline? Yes. |
Intervention: TACE followed by radiofrequency ablation (RFA) |
Control: TACE |
Length of follow-up: Not reported
Loss-to-follow-up: No information.
Incomplete outcome data: No information.
|
Overall survival 1,2, 3, 4, 5-years overall survival not reported.
Disease-free survival not reported.
Local tumor control not reported.
Complications Eight patients (6.2%) developed liver function damage after all 125 RFA treatments.
|
Also reported:
Outcomes are not clearly defined
Remarks:
|
|
Morimoto, 2010 |
Type of study: Open-label randomized controlled trial.
Setting: Yokohama City University Medical Center.
Enrolled between August 01, 2005 and April 2009.
Country: Japan.
Source of funding: Grant from Yokohama City University
Conflicts of interest: No information. |
Patients with solitary HCCs (diameter, 3.1-5.0 cm in the greatest dimension)
Inclusion criteria:
Exclusion criteria:
N total at baseline: N = 37 Intervention: N=19 Control: N=18
Important characteristics: Age, mean (range): I: 70 y (57-78) C: 73 y (48-84)
Sex, n/N (%) male: I: 15/19 (79%) C: 12/18 (67%)
Tumor diameter (mean, cm): I: 3.6 ± 0.7 C: 3.7 ± 0.6
Groups comparable at baseline? Yes. |
Intervention: Transcatheter arterial chemoembolization (TACE) was performed by selectively introducing a microcatheter into the right/left hepatic artery or tumor feeding arteries injecting epirubicin, lipiodol, and gelatin sponge. Within 24 hours after TACE, radiofrequency ablation (RFA) was performed percutaneously using multitined expandable electrodes or internally cooled electrodes. |
Control: RFA |
Length of follow-up: 3-year
Loss-to-follow-up: No information.
Incomplete outcome data: No information.
|
Overall survival 1-year I: 100% C: 89%
2-year I: 93% C: 89%
3-year I: 93% C: 80% Log-rank test, P=0.369
4, 5-years overall survival not reported.
Disease-free survival not reported.
Local tumor progression rate I: 6% C: 39%
Complications I: 1/18 (5.6%) C: 5/19 (26.3%) No grade ≥ 3 are reported |
Also reported:
The overall recurrence rate was measured from the date of randomization until the date of detection of local tumor progression or new HCC foci in the liver in the arterial-phase CT images
Remarks:
|
|
Peng, 2012 |
Type of study: Open-label randomized controlled trial.
Setting: Cancer Center at Sun Yat-sen University
Enrolled between January 2002 and December 2006.
Country: China.
Source of funding: Supported by the Sciences and Technology Committee of Guangdong Province, China (grant 2006B36002008), and the State Key Project on Infectious Diseases of China (grant 2012ZX10002-016)
Conflicts of interest: None to declare.
|
Patients with recurrent HCC measuring 5 cm in diameter or smaller
Inclusion criteria:
Exclusion criteria:
N total at baseline: N = 139 Intervention: N=69 Control: N=70
Important characteristics: Age, mean (SD): I: 57.5 y (10.0) C: 55.1 y (9.5)
Sex, n/N (%) male: I: 59/69 (85.6%) C: 55/70 (78.6%)
Tumor size (mean, cm): I: 2.1 ± 0.5 C: 2.1 ± 0.4
Groups comparable at baseline? Yes. |
Intervention: TACE followed by RFA |
Control: TACE |
Length of follow-up: I: 39.2 months (21.1) C: 33.6 months (24.7) Not stated by the authors if they report mean or median
Loss-to-follow-up: No information.
Incomplete outcome data: No information.
|
Overall survival 1-year I: 94% C: 82%
3-year I: 69% C: 47%
5-year I: 46% C: 36% P=0.037(1 versus. 3 versus. 5-year)
2, 4-years overall survival not reported.
Disease-free survival 1-year I: 80% C: 64%
3-year I: 45% C: 18%
5-year I: 40% C: 18% P=0.005 (1 versus. 3 versus. 5-year)
2, 4-years disease-free survival not reported.
Local tumor control not reported.
Complications I: 2/69 (2.9%) C: 2/70 (2.8%)
|
Also reported:
Local tumor progression was defined as the appearance of tumor enhancement around the ablated area after treatment
Remarks:
|
|
Peng, 2013 |
Type of study: Open-label randomized controlled trial.
Setting: Cancer Center at Sun Yat-sen University
Enrolled between October 2006 and June 2009.
Country: China.
Source of funding: Supported by a grant from the National Natural Science Foundation of China (Grant No. 30872995), the State Key Project on Infectious Diseases of China (Grant No. 2012ZX10002-016), and the 5010 Foundation of Sun Yat-sen University (Grant No. 2007043
Conflicts of interest: None to declare.
|
Patients with recurrent HCC measuring ≤ 7 cm
Inclusion criteria:
Exclusion criteria:
N total at baseline: N = 189 Intervention: N=94 Control: N=95
Important characteristics: Age, mean (SD): I: 53.3 y (11.0) C: 55.3 y (13.3)
Sex, n/N (%) male: I: 75/94 (79.8%) C: 71/95 (74.7%)
Size of main tumor (mean, cm): I: 3.47 ± 1.44 C: 3.39 ± 1.35
Groups comparable at baseline? Yes. |
Intervention: TACE followed by RFA |
Control: RFA |
Length of follow-up: Median (range) I: 47.5 months (29-62) C: 47.0 months (28-62)
Loss-to-follow-up: I: 1/84 (1.1%) C: 0
Incomplete outcome data: I: 1/84 (1.1%) Reason: withdrew
C: 1/95 (1.1%) Reason: withdrew
|
Overall survival 1-year I: 92.6% C: 85.3%
3-year I: 66.6% C: 59%
4-year I: 61.8% C: 45%
2, 5-years overall survival not reported.
Disease-free survival 1-year I: 79.4% C: 66.7%
3-year I: 60.6% C: 44.2%
4-year I: 54.8% C: 38.9%
2, 5-years disease-free survival not reported.
Local tumor control not reported.
Complications I: 2/94 (2.1%) C: 2/95 (2.1%)
|
Remarks:
|
|
Sheta, 2016 |
Type of study: Open-label randomized controlled trial.
Setting: Algeish St Tanta University Hospital
Unknown enrolment dates
Country: Egypt.
Source of funding: No information.
Conflicts of interest: None to declare. .
|
Patients with non-resectable single-lesion HCC
Inclusion criteria:
Exclusion criteria:
N total at baseline: N = 50 Intervention: Group B TACE + RFA: N=20
Group C TACE + MWA: M=10
Control: TACE: N=20
Important characteristics: Age: Not reported
Sex, n/N (%) male: Not reported
Size of lesion (mean, cm): I: 4.87 ± 0.42 (group B) I: 5.15 ± 0.27 (group C) C: 4.82 ± 0.57 (group A)
Groups comparable at baseline? Unknown Authors stated: In our three groups of patients with HCC, there was no statistically significant difference before intervention in age, sex, liver function tests, platelet count, Child class, size of the lesion, or position of the lesion as shown in (Table 1).
The information regarding age and sex is not provided by the authors. |
Intervention: Group B Single session: RFA followed by TACE
Group C Single session: MWA followed by TACE
|
Control: Group A TACE |
Length of follow-up: Not reported
Loss-to-follow-up: No information.
Incomplete outcome data: No information.
|
Overall survival not reported.
Disease-free survival not reported.
Local tumor control not reported.
Complications I: 10% (group C) C: 40% (group A)
|
Remarks:
|
|
Zaitoun, 2021 |
Type of study: Open-label randomized controlled trial.
Setting: Zagazig University hospital
Enrolled between January 2017 and May 2020.
Country: Egypt.
Source of funding: No information.
Conflicts of interest: None to declare. .
|
Patients with HCC >3 - <5 cm
Inclusion criteria:
Exclusion criteria:
N total at baseline: N = 278 Intervention: Combined (TACE+MWA) N=89
Control: TACE: N=84
Control: MWA: N=92
Important characteristics: Age, mean (SD): I (Combined): 52.1 y (9.5) C (TACE): 51.3 y (9.2) C (MWA): 53.8 y (10.3)
Sex, n/N (%) male: I (Combined): 52/89 (58.6%) C (TACE): 52/84 (61.9%) C (MWA): 50/92 (54.3%)
Tumor size (mean, cm): I (Combined): 3.7 ± 0.8 C (TACE): 3.6 ± 0.8 C (MWA): 3.9 ± 0.9
Groups comparable at baseline? Yes.
|
Intervention: TACE followed by MWA
|
Control: TACE
Control: MWA |
Length of follow-up: Not reported
Loss-to-follow-up: No information.
Incomplete outcome data: No information.
|
Overall survival 3-year I (combined): 62 (69.6%) C (TACE): 46 (54.8%) C (MWA): 50 (54.3%) P=-.02
Disease-free survival not reported.
Local tumor control not reported.
Complications C: 3.6% (TACE) C: 2.2% (MWA)
|
Remarks:
|
|
Zhang, 2021 |
Type of study: Open-label randomized controlled trial.
Setting: Cancer Center at Sun Yat-sen University
(follow-up study from Peng 2013)
Enrolled between October 2006 and June 2009.
Country: China.
Source of funding: supported by the National Natural Science Foundation of China (No. 81770608, 82072029) and the National High Level Talents Special Support Plan-Ten Thousand Plan-Young Top-notch Talent Support Program (Dr Peng).
Conflicts of interest: None to declare.
|
Patients with recurrent HCC measuring ≤ 7 cm
Inclusion criteria:
Exclusion criteria:
N total at baseline: N = 189 Intervention: N=94 Control: N=95
Important characteristics: Age, mean (SD): I: 53.3 y (11.0) C: 55.3 y (13.3)
Sex, n/N (%) male: I: 75/94 (79.8%) C: 71/95 (74.7%)
Size of main tumor (mean, cm): I: 3.47 ± 1.44 C: 3.39 ± 1.35
Groups comparable at baseline? Yes. |
Intervention: TACE followed by RFA |
Control: RFA |
Length of follow-up: 6 years after trial was closed
Loss-to-follow-up: I: 3/94 (3.2%) C: 3/95 (3.2%) Incomplete outcome data: No information.
|
Overall survival 1-year I: 94.9% C: 85.4%
3-year I: 69.1% C: 57.9%
5-year I: 52.0% C: 43.2%
7-year I: 36.4% C: 19.4%
HR: 0.55 (95% CI, 0.39 to 0.78; p=0.001)
Disease-free survival 1-year I: 78.7% C: 64.2%
3-year I: 54.3% C: 37.9%
5-year I: 41.4% C: 27.4%
7-year I: 34.5% C: 18.1%
HR: 0.66 (95% CI, 0.49 to 0.89; p=0.007)
Local tumor control not reported.
Complications I: 6/94 (6.4%) C: 2/95 (2.1%)
|
Remarks:
|
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
Research question: What is the effectiveness of the combination of transarterial chemoembolization (TACE) and ablation compared to TACE or ablation alone in patients with early stage HCC (BCLC A)?
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Liu, 2011 |
Probably yes;
Reason: Patients were consecutively enrolled at clinical presentation and were alternately assigned to one of the treatment groups. |
Definitely no;
Reason: Method was based on an open random allocation schedule. |
Probably no;
Reason: Open-label trial (patients and health care providers not blinded), outcome assessors blinded (blinding of data collectors and analysts not reported). |
Definitely yes;
Reason: No loss to follow-up. |
Probably no;
Reason: Results with regard to the complications are not stratified by treatment groups. |
Definitely no;
Reason: Open-label trial; CONSORT flow chart was not provided by the authors; incorrect numbers are presented in the article with regard to the tumor response; unclear if and to what constitutes the possible conflict of interest. |
HIGH |
|
Liu, 2014 |
Probably no;
Reason: No information. |
Probably no;
Reason: No information. |
Probably no;
Reason: Open-label trial, no information provided by the authors. |
Probably yes; |
Probably no; Results with regard to the complications are not stratified by treatment groups.
|
Definitely no;
Reason: Open-label trial; CONSORT flow chart was not provided by the authors; outcomes lack of a clear definition.
|
HIGH |
|
Morimoto, 2010 |
Probably yes;
Reason: Patients were consecutively enrolled at clinical presentation and were alternately assigned to one of the treatment groups. |
Probably yes;
Reason: Central registration.
|
Probably no;
Reason: Open-label trial, no information provided by the authors. |
Probably yes; |
Probably yes; Reason: All outcome measures described in the trial protocol are reported in the results. |
Probably no;
|
Some concerns |
|
Peng, 2012 |
Definitely yes;
Reason: Randomization was centralized and performed with a computer-generated allocation list. |
Definitely yes:
Reason: Allocation was put into sequentially numbered, opaque, sealed envelopes. |
Probably no;
Reason: Open-label trial (patients and health care providers not blinded), unknown if outcome assessors blinded were blinded. |
Probably yes; |
Probably yes;
Reason: The study assessed the outcome measures described in the clinical trial register. |
Probably no;
Reason: Open-label trial; CONSORT flow chart was not provided by the authors; unknown source of funding.
|
Some concerns |
|
Peng, 2013 |
Definitely yes;
Reason: Randomization was centralized and performed with a computer-generated allocation list. |
Probably yes;
Reason: Central allocation. |
Probably yes;
Reason: Open-label trial (patients and health care providers not blinded), outcome assessors blinded (blinding radiologist and statistician). |
Probably yes Reason: Infrequent number of patients excluded from analysis due to withdrawn consent. |
Probably yes;
Reason: All outcome measures described in the trial protocol are reported in the results. |
Probably no;
Reason: Unknown source of funding (financial support by one of the authors). |
LOW |
|
Sheta, 2016 |
Probably no;
Reason: No information. |
Probably no;
Reason: No information. |
Probably no;
Reason: Open-label trial, no information provided by the authors. |
Probably yes; |
Probably yes;
Reason: The study assessed the outcome measure described in the clinical trial register. |
Probably no;
|
HIGH |
|
Zaitoun, 2021 |
Probably yes;
Reason: Patients were randomized to one of the three groups by one of the authors using serially numbered containers. |
Probably no;
Reason: No information. |
Probably no;
Reason: Open-label trial, no information provided by the authors. |
Probably no;
Reason: Unknown in which group the lost-to follow up (n=12) occurred.
|
Probably yes; Reason: All outcome measures described in the trial protocol are reported in the results. |
Probably no;
Reason: Unknown source of funding. |
Some concerns |
|
Zhang, 2021 |
Definitely yes;
Reason: Randomization was centralized and performed with a computer-generated allocation list. |
Probably yes;
Reason: Central allocation. |
Probably no;
Reason: Open-label trial (patients and health care providers not blinded), unknown if outcome assessors blinded were blinded. |
Probably yes; Reason: Infrequent number of patients excluded from analysis due to withdrawn consent. |
Probably yes;
Reason: All outcome measures described in the trial protocol are reported in the results. |
Probably no;
Reason: This is a follow-up study on Peng, 2013. The overall survival and disease-free survival results do not correspond. |
LOW |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Cao JH, Zhou J, Zhang XL, Ding X, Long QY. Meta-analysis on radiofrequency ablation in combination with transarterial chemoembolization for the treatment of hepatocellular carcinoma. J Huazhong Univ Sci Technolog Med Sci. 2014 Oct;34(5):692-700. doi: 10.1007/s11596-014-1338-5. Epub 2014 Oct 16. PMID: 25318879. |
Systematic review did not address ablation as comparison (only TACE). |
|
Chen QW, Ying HF, Gao S, Shen YH, Meng ZQ, Chen H, Chen Z, Teng WJ. Radiofrequency ablation plus chemoembolization versus radiofrequency ablation alone for hepatocellular carcinoma: A systematic review and meta-analysis. Clin Res Hepatol Gastroenterol. 2016 Jun;40(3):309-314. doi: 10.1016/j.clinre.2015.07.008. Epub 2015 Oct 1. PMID: 26428660. |
Systematic review did not address TACE as comparison (only ablation). |
|
Chen, Z. G. and Huang, C. Y. and Lian, F. and Zhao, Y. N. and Wu, G. B. Percutaneous radiofrequency ablation combined with transarterial chemoembolization versus surgical resection in the treatment for early-stage hepatocellular carcinoma: a Meta-analysis |
Full text in Chinese. |
|
Dong W, Zhang T, Wang ZG, Liu H. Clinical outcome of small hepatocellular carcinoma after different treatments: a meta-analysis. World J Gastroenterol. 2014 Aug 7;20(29):10174-82. doi: 10.3748/wjg.v20.i29.10174. PMID: 25110446; PMCID: PMC4123348. |
Wrong comparisons. |
|
Gu L, Liu H, Fan L, Lv Y, Cui Z, Luo Y, Liu Y, Li G, Li C, Ma J. Treatment outcomes of transcatheter arterial chemoembolization combined with local ablative therapy versus monotherapy in hepatocellular carcinoma: a meta-analysis. J Cancer Res Clin Oncol. 2014 Feb;140(2):199-210. doi: 10.1007/s00432-013-1528-8. PMID: 24077865. |
Wrong comparison (monotherapy is not always TACE or ablation). |
|
Gui CH, Baey S, D'cruz RT, Shelat VG. Trans-arterial chemoembolization + radiofrequency ablation versus surgical resection in hepatocellular carcinoma - A meta-analysis. Eur J Surg Oncol. 2020 May;46(5):763-771. doi: 10.1016/j.ejso.2020.01.004. Epub 2020 Jan 7. PMID: 31937433. |
Wrong comparison (TACE+ablation versus surgical resection). |
|
Guo W, He X, Li Z, Li Y. Combination of Transarterial Chemoembolization (TACE) and Radiofrequency Ablation (RFA) versus. Surgical Resection (SR) on Survival Outcome of Early Hepatocellular Carcinoma: A Meta-Analysis. Hepatogastroenterology. 2015 May;62(139):710-4. PMID: 26897959. |
Wrong comparison (TACE+ablation versus surgical resection). |
|
Han, X., & Lv, W. (2013). Transcatheter arterial chemoembolization combined with radiofrequency ablation for the treatment of hepatocellular carcinoma: A meta-analysis of long-term efficacy. Journal of Interventional Radiology, 22(5), 387-391. |
Full text in Chinese. |
|
Jiang C, Cheng G, Liao M, Huang J. Individual or combined transcatheter arterial chemoembolization and radiofrequency ablation for hepatocellular carcinoma: a time-to-event meta-analysis. World J Surg Oncol. 2021 Mar 19;19(1):81. doi: 10.1186/s12957-021-02188-4. PMID: 33741001; PMCID: PMC7980330. |
The systematic review included observational studies. |
|
Jiang FQ, Lu W, Yang C, Du P, Ma JP, Yang J, Xie P, Zhang Z. Curative effect of transcatheter arterial chemoembolization combined with radiofrequency ablation in treating hepatic cell carcinoma and its effect on serum markers. Cancer Biomark. 2017 Jul 19;20(1):17-22. doi: 10.3233/CBM-160508. PMID: 28582848. |
Included in selected systematic review (Li, 2021). |
|
Jiang G, Xu X, Ren S, Wang L. Combining transarterial chemoembolization with radiofrequency ablation for hepatocellular carcinoma. Tumour Biol. 2014 Apr;35(4):3405-8. doi: 10.1007/s13277-013-1449-9. Epub 2013 Nov 26. PMID: 24277379. |
The systematic review included observational studies. |
|
Katsanos K, Kitrou P, Spiliopoulos S, Maroulis I, Petsas T, Karnabatidis D. Comparative effectiveness of different transarterial embolization therapies alone or in combination with local ablative or adjuvant systemic treatments for unresectable hepatocellular carcinoma: A network meta-analysis of randomized controlled trials. PLoS One. 2017 Sep 21;12(9):e0184597. doi: 10.1371/journal.pone.0184597. PMID: 28934265; PMCID: PMC5608206. |
Wrong comparisons. |
|
Keshavarz P, Raman SS. Comparison of combined transarterial chemoembolization and ablations in patients with hepatocellular carcinoma: a systematic review and meta-analysis. Abdom Radiol (NY). 2022 Mar;47(3):1009-1023. doi: 10.1007/s00261-021-03368-2. Epub 2022 Jan 4. PMID: 34982183. |
The systematic review included observational studies. |
|
Kong QF, Jiao JB, Chen QQ, Li L, Wang DG, Lv B. Comparative effectiveness of radiofrequency ablation with or without transarterial chemoembolization for hepatocellular carcinoma. Tumour Biol. 2014 Mar;35(3):2655-9. doi: 10.1007/s13277-013-1349-z. Epub 2013 Nov 7. PMID: 24197985. |
Systematic review did not address TACE as comparison (only ablation). |
|
Lan T, Chang L, Mn R, Wu L, Yuan YF. Comparative Efficacy of Interventional Therapies for Early-stage Hepatocellular Carcinoma: A PRISMA-compliant Systematic Review and Network Meta-analysis. Medicine (Baltimore). 2016 Apr;95(15):e3185. doi: 10.1097/MD.0000000000003185. PMID: 27082558; PMCID: PMC4839802. |
Wrong comparisons. |
|
Li L, Tian J, Liu P, Wang X, Zhu Z. Transarterial chemoembolization combination therapy versus monotherapy in unresectable hepatocellular carcinoma: a meta-analysis. Tumori. 2016 Jun 2;2016(3):301-10. doi: 10.5301/tj.5000491. Epub 2016 Mar 22. PMID: 27002950. |
Wrong comparisons. |
|
Liao M, Huang J, Zhang T, Wu H. Transarterial chemoembolization in combination with local therapies for hepatocellular carcinoma: a meta-analysis. PLoS One. 2013 Jul 3;8(7):e68453. doi: 10.1371/journal.pone.0068453. PMID: 23844203; PMCID: PMC3701086. |
The systematic review included observational studies. |
|
Lin JJ, Wu W, Jiang XF, Jin XJ, Lu LJ, Bao LW. (Clinical outcomes of radiofrequency ablation combined with transcatheter arterial chemoembolization for the treatment of hepatocellular carcinoma: a single-center experience). Zhonghua Zhong Liu Za Zhi. 2013 Feb;35(2):144-7. Chinese. doi: 10.3760/cma.j.issn.0253-3766.2013.02.016. PMID: 23714672. |
Full text in Chinese. |
|
Liu B, Zhang Y, Chen H, Li W, Tsochatzis E. The combination of transcatheter arterial chemoembolisation (TACE) and thermal ablation versus TACE alone for hepatocellular carcinoma. Cochrane Database Syst Rev. 2022 Jan 4;1(1):CD013345. doi: 10.1002/14651858.CD013345.pub2. PMID: 34981511; PMCID: PMC8724539. |
Systematic review did not address ablation as comparison (only TACE). |
|
Liu C, Li T, He JT, Shao H. TACE combined with microwave ablation therapy versus. TACE alone for treatment of early- and intermediate-stage hepatocellular carcinomas larger than 5 cm: a meta-analysis. Diagn Interv Radiol. 2020 Nov;26(6):575-583. doi: 10.5152/dir.2020.19615. PMID: 32965220; PMCID: PMC7664747. |
Systematic review did not address ablation as comparison (only TACE). |
|
Liu H, Wang ZG, Fu SY, Li AJ, Pan ZY, Zhou WP, Lau WY, Wu MC. Randomized clinical trial of chemoembolization plus radiofrequency ablation versus partial hepatectomy for hepatocellular carcinoma within the Milan criteria. Br J Surg. 2016 Mar;103(4):348-56. doi: 10.1002/bjs.10061. Epub 2016 Jan 18. PMID: 26780107. |
Wrong comparison (TACE+ablation versus surgical resection). |
|
Liu, T. Z. and Shao, Y. W. and Yuan, G. P. Therapeutic effect of multipolar percutaneous radio-frequency ablation combined with TACE on massive hepatocellular carcinoma |
Full text in Chinese. |
|
Liu, Y., Zhuo, L., Zhu, B., HE, M., XU, Y., Wang, T., ... & Liu, G. (2017). Transcatheter arterial chemoembolization in combination with percutaneous ablation therapy for the treatment of hepatocellular carcinoma: a meta-analysis. Journal of Interventional Radiology, 830-835. |
Full text in Chinese. |
|
Liu Z, Gao F, Yang G, Singh S, Lu M, Zhang T, Zhong Z, Zhang F, Tang R. Combination of radiofrequency ablation with transarterial chemoembolization for hepatocellular carcinoma: an up-to-date meta-analysis. Tumour Biol. 2014 Aug;35(8):7407-13. doi: 10.1007/s13277-014-1976-z. Epub 2014 Apr 29. PMID: 24777334. |
Systematic review did not address TACE as comparison (only ablation). |
|
Lu Z, Wen F, Guo Q, Liang H, Mao X, Sun H. Radiofrequency ablation plus chemoembolization versus radiofrequency ablation alone for hepatocellular carcinoma: a meta-analysis of randomized-controlled trials. Eur J Gastroenterol Hepatol. 2013 Feb;25(2):187-94. doi: 10.1097/MEG.0b013e32835a0a07. PMID: 23134976. |
Systematic review did not address TACE as comparison (only ablation). |
|
Majumdar A, Roccarina D, Thorburn D, Davidson BR, Tsochatzis E, Gurusamy KS. Management of people with early- or very early-stage hepatocellular carcinoma: an attempted network meta-analysis. Cochrane Database Syst Rev. 2017 Mar 28;3(3):CD011650. doi: 10.1002/14651858.CD011650.pub2. PMID: 28351116; PMCID: PMC6464490. |
Wrong comparison (surgery versus ablation). |
|
Morimoto M, Numata K, Kondou M, Nozaki A, Morita S, Tanaka K. Midterm outcomes in patients with intermediate-sized hepatocellular carcinoma: a randomized controlled trial for determining the efficacy of radiofrequency ablation combined with transcatheter arterial chemoembolization. Cancer. 2010 Dec 1;116(23):5452-60. doi: 10.1002/cncr.25314. Epub 2010 Jul 29. PMID: 20672352. |
Included in selected systematic review (Li, 2021). |
|
Ni JY, Liu SS, Xu LF, Sun HL, Chen YT. Meta-analysis of radiofrequency ablation in combination with transarterial chemoembolization for hepatocellular carcinoma. World J Gastroenterol. 2013 Jun 28;19(24):3872-82. doi: 10.3748/wjg.v19.i24.3872. PMID: 23840128; PMCID: PMC3699038. |
Systematic review did not address TACE as comparison (only ablation). |
|
Ni, J. Y. and Liu, S. S. and Xu, L. F. and Sun, H. L. and Chen, Y. T. Meta-analysis of the combination of transarterial chemoembolization and radiofrequencyablation for treatment of hepatocellular carcinoma |
Full text in Chinese.
|
|
Ni JY, Liu SS, Xu LF, Sun HL, Chen YT. Transarterial chemoembolization combined with percutaneous radiofrequency ablation versus TACE and PRFA monotherapy in the treatment for hepatocellular carcinoma: a meta-analysis. J Cancer Res Clin Oncol. 2013 Apr;139(4):653-9. doi: 10.1007/s00432-012-1369-x. Epub 2013 Jan 5. PMID: 23292073. |
Overlap with selected systematic review (Li, 2021). |
|
Ni, J. Y. and Sun, H. L. and Luo, J. H. and Wang, W. D. and Chen, Y. T. and Xu, L. F. Meta-analysis of randomized controlled trials: percutaneous radiofrequency ablation in the treatment of hepatocullular carcinoma |
Full text in Chinese.
|
|
Peng ZW, Zhang YJ, Chen MS, Xu L, Liang HH, Lin XJ, Guo RP, Zhang YQ, Lau WY. Radiofrequency ablation with or without transcatheter arterial chemoembolization in the treatment of hepatocellular carcinoma: a prospective randomized trial. J Clin Oncol. 2013 Feb 1;31(4):426-32. doi: 10.1200/JCO.2012.42.9936. Epub 2012 Dec 26. PMID: 23269991. |
Included in selected systematic review (Li, 2021). |
|
Peng ZW, Zhang YJ, Liang HH, Lin XJ, Guo RP, Chen MS. Recurrent hepatocellular carcinoma treated with sequential transcatheter arterial chemoembolization and RF ablation versus RF ablation alone: a prospective randomized trial. Radiology. 2012 Feb;262(2):689-700. doi: 10.1148/radiol.11110637. Epub 2011 Dec 12. PMID: 22157201. |
Included in selected systematic review (Li, 2021). |
|
Qu, X. Y. and Qin, C. H. and Wu, J. and Chen, Z. L. and Yang, W. J. Transcatheter hepatic arterial chemoembolization in combination with radiofrequency ablation for treatment of patients with hepatocellular carcinoma: Curative efficacy and effect on serum BDNF level |
Full text in Chinese. |
|
Sheta E, El-Kalla F, El-Gharib M, Kobtan A, Elhendawy M, Abd-Elsalam S, Mansour L, Amer I. Comparison of single-session transarterial chemoembolization combined with microwave ablation or radiofrequency ablation in the treatment of hepatocellular carcinoma: a randomized-controlled study. Eur J Gastroenterol Hepatol. 2016 Oct;28(10):1198-203. doi: 10.1097/MEG.0000000000000688. PMID: 27362551. |
Included in selected systematic review (Li, 2021). |
|
Tian G, Yang S, Yuan J, Threapleton D, Zhao Q, Chen F, Cao H, Jiang T, Li L. Comparative efficacy of treatment strategies for hepatocellular carcinoma: systematic review and network meta-analysis. BMJ Open. 2018 Oct 18;8(10):e021269. doi: 10.1136/bmjopen-2017-021269. PMID: 30341113; PMCID: PMC6196801. |
Wrong comparisons. |
|
Wang H, Liu Y, Shen K, Dong Y, Sun J, Shu Y, Wan X, Ren X, Wei X, Zhai B. A comparison between radiofrequency ablation combined with transarterial chemoembolization and surgical resection in hepatic carcinoma: A meta-analysis. J Cancer Res Ther. 2019;15(7):1617-1623. doi: 10.4103/jcrt.JCRT_503_19. PMID: 31939446. |
Wrong comparison (TACE+ablation versus surgical resection). |
|
Wang L, Ke Q, Lin N, Huang Q, Zeng Y, Liu J. The efficacy of transarterial chemoembolization combined with microwave ablation for unresectable hepatocellular carcinoma: a systematic review and meta-analysis. Int J Hyperthermia. 2019;36(1):1288-1296. doi: 10.1080/02656736.2019.1692148. PMID: 31852267. |
Systematic review did not address ablation as comparison (only TACE). |
|
Wang W, Shi J, Xie WF. Transarterial chemoembolization in combination with percutaneous ablation therapy in unresectable hepatocellular carcinoma: a meta-analysis. Liver Int. 2010 May;30(5):741-9. doi: 10.1111/j.1478-3231.2010.02221.x. Epub 2010 Mar 18. PMID: 20331507. |
There are more recent systematic reviews available. |
|
Wang WD, Zhang LH, Ni JY, Jiang XY, Chen D, Chen YT, Sun HL, Luo JH, Xu LF. Radiofrequency Ablation Combined with Transcatheter Arterial Chemoembolization Therapy Versus Surgical Resection for Hepatocellular Carcinoma within the Milan Criteria: A Meta-Analysis. Korean J Radiol. 2018 Jul-Aug;19(4):613-622. doi: 10.3348/kjr.2018.19.4.613. Epub 2018 Jun 14. PMID: 29962868; PMCID: PMC6005934. |
Wrong comparison (TACE+ablation versus surgical resection). |
|
Wang X, Hu Y, Ren M, Lu X, Lu G, He S. Efficacy and Safety of Radiofrequency Ablation Combined with Transcatheter Arterial Chemoembolization for Hepatocellular Carcinomas Compared with Radiofrequency Ablation Alone: A Time-to-Event Meta-Analysis. Korean J Radiol. 2016 Jan-Feb;17(1):93-102. doi: 10.3348/kjr.2016.17.1.93. Epub 2016 Jan 6. PMID: 26798221; PMCID: PMC4720818. |
Systematic review did not address TACE as comparison (only ablation). |
|
Wang Y, Deng T, Zeng L, Chen W. Efficacy and safety of radiofrequency ablation and transcatheter arterial chemoembolization for treatment of hepatocellular carcinoma: A meta-analysis. Hepatol Res. 2016 Jan;46(1):58-71. doi: 10.1111/hepr.12568. Epub 2015 Sep 2. PMID: 26265000. |
The systematic review included observational studies. |
|
Xiong, L., Zhang, L., Ma, J., & Li, J. (2017). Efficacy of radiofrequency ablation plus hepatic arterial chemoembolization in primary hepatic carcinoma and its effect on serum markers. International Journal Of Clinical And Experimental Medicine, 10(9), 14076-82. |
Not included in selected systematic review (Li, 2021). |
|
Yan S, Xu D, Sun B. Combination of radiofrequency ablation with transarterial chemoembolization for hepatocellular carcinoma: a meta-analysis. Dig Dis Sci. 2013 Jul;58(7):2107-13. doi: 10.1007/s10620-013-2570-8. Epub 2013 Jan 30. PMID: 23361576. |
Systematic review did not address TACE as comparison (only ablation). |
|
Yang DJ, Luo KL, Liu H, Cai B, Tao GQ, Su XF, Hou XJ, Ye F, Li XY, Tian ZQ. Meta-analysis of transcatheter arterial chemoembolization plus radiofrequency ablation versus transcatheter arterial chemoembolization alone for hepatocellular carcinoma. Oncotarget. 2017 Jan 10;8(2):2960-2970. doi: 10.18632/oncotarget.13813. PMID: 27936465; PMCID: PMC5356855. |
Systematic review did not address ablation as comparison (only TACE). |
|
Yi PS, Huang M, Zhang M, Xu L, Xu MQ. Comparison of Transarterial Chemoembolization Combined with Radiofrequency Ablation Therapy versus Surgical Resection for Early Hepatocellular Carcinoma. Am Surg. 2018 Feb 1;84(2):282-288. PMID: 29580359. |
Wrong comparison (TACE+ablation versus surgical resection). |
|
Yi Y, Zhang Y, Wei Q, Zhao L, Han J, Song Y, Ding Y, Lu G, Liu J, Ding H, Dai F, Tang X. Radiofrequency ablation or microwave ablation combined with transcatheter arterial chemoembolization in treatment of hepatocellular carcinoma by comparing with radiofrequency ablation alone. Chin J Cancer Res. 2014 Feb;26(1):112-8. doi: 10.3978/j.issn.1000-9604.2014.02.09. PMID: 24653633; PMCID: PMC3937757. |
Included in selected systematic review (Li, 2021). |
|
Yin, J., Lyu, T., Guan, H., Song, L., Wang, J., & Tong, X. (2017). Efficacy and safety of radiofrequency ablation combined with or without TACE for hepatocellular carcinomas: Meta-analysis. Chinese Journal of Interventional Imaging and Therapy, 606-612. |
Full text in Chinese. |
|
Yuan-Dong S, Hao Z, Hui-Rong X, Jing-Zhou L, Hui-Yong W, Jian-Jun H, Yu JM. Combination therapy: Meta-analysis of the effects of TACE and cryoablation on hepatocellular carcinoma. Medicine (Baltimore). 2019 Dec;98(49):e18030. doi: 10.1097/MD.0000000000018030. PMID: 31804309; PMCID: PMC6919413. |
The systematic review included observational studies. |
|
Zaitoun MMA, Elsayed SB, Zaitoun NA, Soliman RK, Elmokadem AH, Farag AA, Amer M, Hendi AM, Mahmoud NEM, Salah El Deen D, Alsowey AM, Shahin S, Basha MAA. Combined therapy with conventional trans-arterial chemoembolization (cTACE) and microwave ablation (MWA) for hepatocellular carcinoma >3-<5 cm. Int J Hyperthermia. 2021;38(1):248-256. doi: 10.1080/02656736.2021.1887941. PMID: 33615957. |
Included in selected systematic review (Li, 2021). |
|
Zhang, S. J., & Ma, Y. L. (2013). TACE combined with percutaneous microwave ablation in treatment of large primary hepatocellular carcinoma. Chin J Interv Imaging Ther, 10(7), 397-400. |
Full text in Chinese. |
|
Zhao J, Wu J, He M, Cao M, Lei J, Luo H, Yi F, Ding J, Wei Y, Zhang W. Comparison of transcatheter arterial chemoembolization combined with radiofrequency ablation or microwave ablation for the treatment of unresectable hepatocellular carcinoma: a systemic review and meta-analysis. Int J Hyperthermia. 2020;37(1):624-633. doi: 10.1080/02656736.2020.1774667. PMID: 32525724. |
Wrong comparison (TACE+MWA versus TACE+RFA). |
|
Zhao J, Zhang H, Wei L, Xie S, Suo Z. Comparing the long-term efficacy of standard and combined minimally invasive procedures for unresectable HCC: a mixed treatment comparison. Oncotarget. 2017 Feb 28;8(9):15101-15113. doi: 10.18632/oncotarget.13145. PMID: 27835871; PMCID: PMC5362470. |
Wrong comparisons. |
|
Zhao, S. and Chen, X. C. and Long, Q. Y. and Zhang, X. L. Transcatheter arterial chemoembolization combined with radiofrequency ablation for the treatment of hepatocellular carcinoma: A systematic review and meta analysis |
Full text in Chinese. |
|
Zheng RN, You ZJ, Lin SH, Jia J, Cai YM, Liu C, Han S, Wang SM. Efficacy of percutaneous radiofrequency ablation for the treatment of hepatocellular carcinoma. Genet Mol Res. 2015 Dec 22;14(4):17982-94. doi: 10.4238/2015.December.22.24. PMID: 26782445. |
Systematic review did not address TACE as comparison (only ablation). |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-01-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met hepatocellulaircarcinoom.
Werkgroep
- Prof. dr. R.A de Man, MDL-arts, Erasmus MC, Rotterdam, NVMDL (voorzitter)
- Dr. K.J. van Erpecum, MDL-arts, UMC Utrecht, Utrecht, NVMDL
- Dr. E.T.T.L. Tjwa, MDL-arts, Radboud UMC, Nijmegen, NVMDL
- Dr. R.B. Takkenberg, MDL-arts, Amsterdam UMC, Amsterdam, NVMDL
- Dr. F.G.I. van Vilsteren, MDL-arts, UMCG, Groningen, NVMDL
- Dr. D. Sprengers, MDL-arts, Erasmus MC, Rotterdam, NVMDL
- Dr. M.J. Coenraad, MDL-arts, LUMC, Leiden, NVMDL
- Prof. dr. B. van Hoek, MDL-arts, LUMC, Leiden, NVMDL
- Dr. N. Haj Mohammad, Internist-oncoloog, UMC Utrecht, Utrecht, NIV
- Dr. J. de Vos-Geelen, Internist-oncoloog, MUMC, Maastricht, NIV
- Drs. J.A. Willemse, Directeur Nederlandse Leverpatiënten Vereniging
- Prof. dr. M.G.E. Lam, Nucleair geneeskundige, UMC Utrecht, Utrecht, NVNG
- Prof. dr. J. Verheij, Patholoog, Amsterdam UMC, Amsterdam, NVvP
- Dr. M. (Michail) Doukas, Patholoog, Erasmus MC, Rotterdam, NVvP
- Dr. A.M. Mendez Romero, Radiotherapeut, Erasmus MC, Rotterdam, NVvR
- Dr. A.E. Braat, Chirurg, LUMC, Leiden, NVvH
- Dr. M.W. Nijkamp, Chirurg, UMCG, Groningen, NVvH
- Prof. Dr. J.N.M. Ijzermans, Chirurg, ErasmusMC, Rotterdam, NVvH
- Drs. J.I. Erdmann, Chirurg, Amsterdam UMC, Amsterdam, NVvH
- Dr. M.C. Burgmans, Radioloog, LUMC, Leiden, NVvR
- Drs. F.E.J.A. Willemssen, Radioloog, ErasmusMC, Rotterdam, NVvR
- Prof. Dr. O.M. (Otto) van Delden, Radioloog, AmsterdamUMC, Amsterdam, NVvR
- J.I. Franken, Verpleegkundig specialist, ErasmusMC, Rotterdam, V&VN
Met ondersteuning van
- Dr. C. Gaasterland, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. D. Nieboer, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. N. Zielonke, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. M. Oerbekke, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. M. te Lintel Hekkert, Junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. S van Duijn, Junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. A. van Hoeven, Junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- D.P. Gutierrez, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
|
De Man (vz.) |
Hoogleraar Hepatologie, Erasmus MC Rotterdam |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Haj Mohammad |
Internist-oncoloog, Universitair Medisch Centrum Utrecht |
Penningmeester Dutch Upper GI Cancer (DUCG), onbetaald |
Geen |
Geen |
Geen |
Lid wetenschappelijke raad Dutch Hepato and Cholangio Carcinoma Group(DHCG) |
Geen |
|
Burgmans |
Sectiehoofd interventie radiologie LUMC |
Voorzitter Nederlandse Vereniging Interventieradiologie |
Geen |
Geen |
PROMETHEUS studie, subsidie KWF, project leider |
Geen |
Geen |
|
Lam |
Nucleair geneeskundige, UMC Utrecht |
Geen |
Geen |
Geen |
Terumo, Quirem Medical en Boston scientific leveren financiële steun aan wetenschappelijke projecten |
Geen |
Het UMC Utrecht ontvangt royalties en milestone payments van Terumo/Quirem Medical |
|
Franken |
Verpleegkundig Specialist Levertumoren |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Verheij |
Hoogleraar hepatopancreatobiliaire Pathologie aan de Universiteit van Amsterdam |
lid medische adviesraad NLV (onbezoldigd) |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Sprengers |
MDL-arts Erasmus MC |
Geen |
Geen |
Geen |
Ik doe translationeel onderzoek met als doel behandeling van patiënten met een HCC te verbeteren. Daarbij wordt soms samengewerkt met famaceutische partijen die producten ontwikkelen die hieraan bij kunnen dragen. Te allen tijde betreft dit objectief wetenschappelijk onderzoek zonder winstoogmerk. |
Geen |
Geen |
|
Van Vilsteren |
MDL-arts UMCG 0,9 fte |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Takkenberg |
Maag- Darm Leverarts met specifiek aandachtsgebied leverziekten. Sinds 1-4-2015 in deinst van het Amsterdam UMC, locatie AMC. |
Geen |
Betaald adviesschap: |
Geen |
Ik ben PI van de PEARL studie. Dit is een dubbelblind gerandomiseerde studie bij patiënten die een transjugulaire intrahepatische portosysthemische shunt (TIPS) krijgen. Patiënten worden gerandomiseerd tussen profylactisch lactulose en rifaximin versus lactulose en placebo. Doel is het voorkomen van post-TIPS hepatische encafalopathie (EudraCT-nummer 2018-004323-37). Deze studie wordt gefinancierd door ZonMW en ondersteund door Norgine. Zij leveren de rifaximin en placebo tabletten. |
Secretaris Dutch Hepatocellular and cholangiocarcinoma Group (DHCG) |
Geen |
|
Van Erpecum |
MDL-arts UMC Utrecht |
Associate Editor European Journal of Internal Medicine (onbetaald) |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Willemssen |
Abdominaal Radioloog |
Bestuurslid abdominale sectie NVvR (onbetaald) |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Méndez Romero |
Staflid afdeling radiotherapie in het Erasmus MC |
Als staflid in ee adademisch ziekenhuis ben ik in loondienst van het ErasmusMC |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Tjwa |
MDL arts / hepatoloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Braat |
chirurg |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Nijkamp |
Chirurg Universitair Medisch Centrum Groningen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Willemse |
Directeur Nederlandse Leverpatiënten Vereniging |
* Bestuurslid Liver Patients International (onbetaald) |
Geen |
Geen |
Geen |
Geen |
Geen |
|
IJzermans |
Hoofd HPB & Transplantatiechirurgie Erasmus MC |
- |
Niet van toepassing |
Nee |
Niet van toepassing |
Niet van toepassing |
Nee |
|
Vos, de - Geelen |
* Internist - Medisch Oncoloog Maastricht UMC+ |
Has served as a constultant for Amgen, AstraZeneca, MSD, Pierre Fabre and Servier and has received institutional research funding from Servier |
Has served as a constultant for Amgen, AstraZeneca, MSD, Pierre Fabre and Servier and has received institutional research funding from Servier. Geen directe financiële belangen in een farmaceutisch bedrijf |
Geen |
* Servier: Microbioomonderzoek - Projectleider |
Geen |
Geen |
|
Hoek, van |
* Hoogleraar Hepatologie, Universiteit Leiden |
* Norgine Pharma - patient voorlichtingsmateriaal maken, onder andere podcast - betaald |
Geen |
Nee |
* Roche - Piranga Studie (hepatitis B) - Projectleider |
Geen |
Nee |
|
Delden, van |
Radioloog, Amsterdam UMC |
Voorzitter DHCG |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Doukas |
Universitair Medisch Specialist, Patholoog, Afdeling Pathologie Erasmus MC, Rotterdam |
Geen |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
|
Coenraad |
Associate professor, MDL arts Leids Universitair Medisch Centrum (1.0 fte) |
Nevenfuncties: |
Niet van toepassing |
Niet van toepassing |
* Horizon2020 - EU Project id 945096. Title ‘Novel treatment of acute-on-chronic liver failure using synergistic action of G-CSF and TAK-242 - Geen projectleider |
Niet van toepassing |
Niet van toepassing |
|
Erdmann |
Chirurg AUMC |
geen |
geen |
geen |
AGEM - perfusie onderzoek (50K), rol als projectleider |
geen |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname van de afgevaardigde patiëntenvereniging Nederlandse Leverpatiëntenvereniging in de werkgroep. De afgevaardigde heeft meebeslist bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Nederlandse Leverpatiëntenvereniging en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er geen substantiële financiële gevolgen zijn voor deze richtlijn, gezien het aantal patiënten kleiner is dan 5000.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met Hepatocellulaircarcinoom. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijn Hepatocellulaircarcinoom op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door de deelnemende WV-en, de V&VN en de Nederlandse Leverpatiëntenvereniging.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.