Startpagina bij de richtlijn Hematurie 2023
Deze richtlijn beschrijft de diagnostiek bij asymptomatische patiënten (ouder dan 18 jaar) met macroscopische en microscopische hematurie.
De prevalentie van microscopische hematurie is in de populatie afhankelijk van leeftijd, geslacht, risicofactoren tussen 2,4 en 31,1 % (Davis, 2012).
ICPC-code U06 (hematurie) heeft in de huisartsenpraktijk een prevalentie van 4,6 en een incidentie van 4,2 per 1000 patiënten per jaar (Hendriksen, 2022). Hematurie komt bij mannen 1,5 keer vaker voor dan bij vrouwen. Met name de verwijzingen in verband met microscopische hematurie zijn de afgelopen jaren fors toegenomen.
De analyse van asymptomatische microscopische hematurie heeft de afgelopen jaren wereldwijd veel aandacht gekregen. Er is een tendens naar een meer risico-gestuurde werkwijze. In 2010 heeft de NVU hier al een start mee gemaakt. De werkgroep is van mening dat we met onderstaande aanbevelingen hier een vervolgstap in hebben gezet. Een nog meer uitgebalanceerde risicostratificatie (man/vrouw, hoeveelheid microscopische hematurie, pakjaren bij roken) is zeer goed verdedigbaar, maar maakt het in de ogen van de werkgroep ook complex om hiermee in de dagelijkse praktijk te werken.
Bij asymptomatische macroscopische hematurie is de kans op een maligniteit afhankelijk van geslacht, leeftijd en risicofactoren 11-18% (Rai, 2022).
Bij patiënten met asymptomatische microscopische hematurie is de kans op een maligniteit veel lager, afhankelijk van geslacht, leeftijd en risicofactoren gemiddeld 3%.
In de eerste lijn (huisarts, keuringsarts) zal meestal een urine dipstick zijn verricht. De kans op een fout positieve uitslag is groot, tussen 61 en 5% bij respectievelijk ‘spoor’ en 4+.
Deze patiënten kunnen zowel een urologische als nefrologische aandoening hebben. Het is relevant om naar factoren te zoeken die hiertussen kunnen differentiëren: bloeddruk, nierfunctiestoornis en eiwit in de urine. Als deze afwijkend zijn is de kans op een nefrologische aandoening groter, en zal eerst analyse via de nefroloog moeten plaatsvinden.
Conclusie
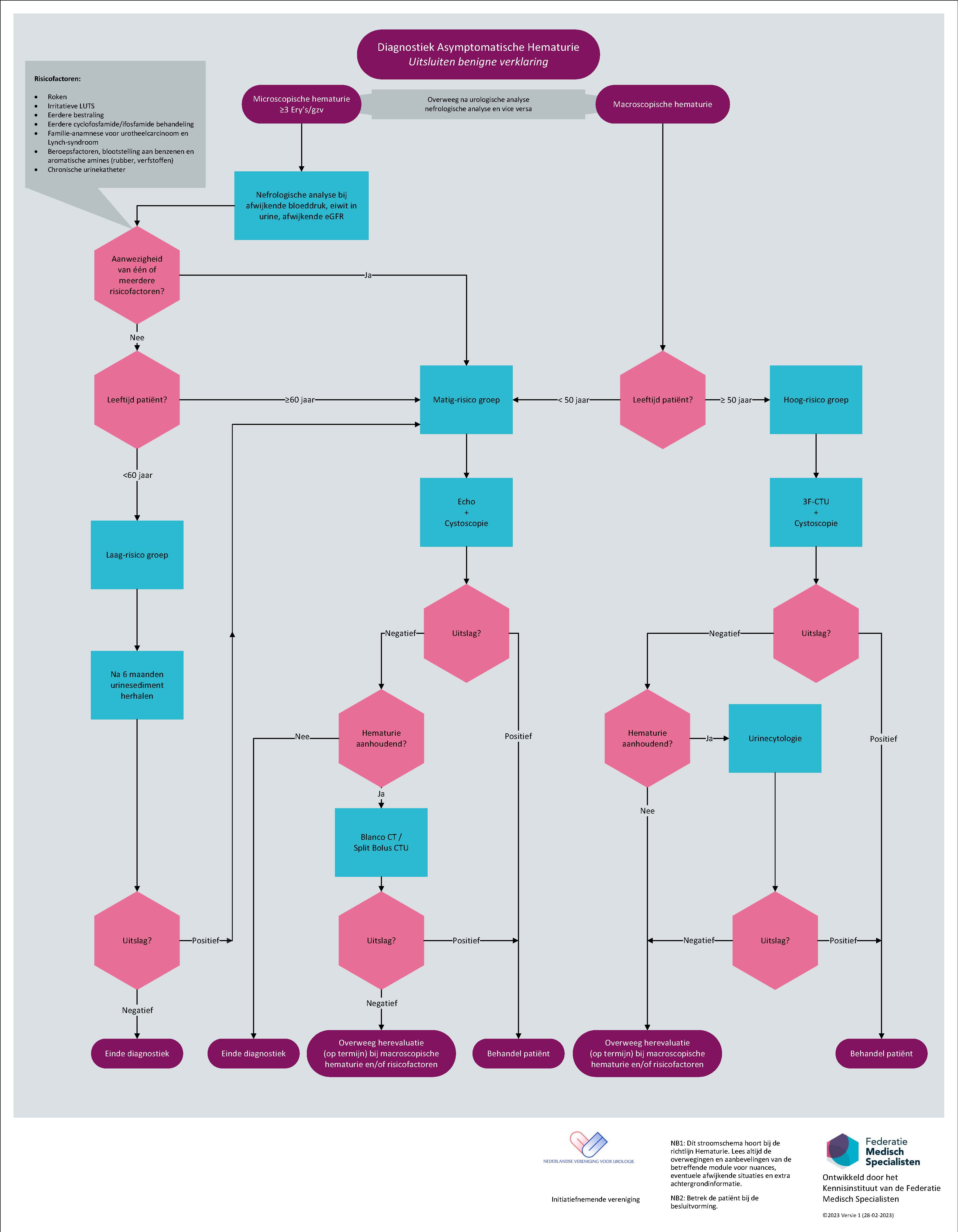
- Microscopische hematurie is ≥ 3 erytrocyten per gezichtsveld (Voor de omrekening naar erytrocyten /µl uw eigen laboratorium raadplegen). Een positieve dipstick moet in urinesediment worden bevestigd.
- De werkgroep heeft op basis van een risico inschatting aanbevelingen gedaan over de noodzakelijke aanvullende diagnostiek bij verwijzing. Patiënt wordt ingedeeld in laag, matig of hoog risico groep.
- Urologische en nefrologische analyse zijn soms beide noodzakelijk. Relevante factoren bepalen de volgorde.
Verandering ten opzichte van richtlijn asymptomatische hematurie NVU 2010:
- Analyse in verband met microscopische hematurie: leeftijd van 50 naar 60 jaar.
- Zonder risicofactoren, jonger dan 60 jaar: geen analyse, tenzij na 6 maanden bij controle urinesediment aanhoudend microscopische hematurie wordt aangetoond.
Modules uit de richtlijn 2010 die niet herzien zijn:
Module 5. Urinekweek
Module 6. Symptomatische patiënt met hematurie
Module 7. Diagnostiek hematurie – laboratoriumbepaling
Module 8. Diagnostiek hematurie – stollingsstoornissen
Module 9. Diagnostiek hematurie – proteïnurie
Module 10. Diagnostiek hematurie - cystoscopie
Module 14. Screening op hematurie
Module 17. Hematurie en trauma
Module 18. Hematurie en sport
Module 19. Hematurie en kinderen
Samenvatting van de aanbevelingen:
|
Laag risico |
Matig risico |
Hoog risico |
|
<60 jaar ZONDER risicofactoren *: Nooit gerookt of <10 pakjaren |
< 60 jaar MET risicofactoren |
≥ 50 jaar met macroscopische hematurie |
|
|
≥ 60 jaar |
|
|
|
< 50 jaar met macroscopische hematurie |
|
|
|
< 60 jaar zonder risicofactoren, na 6 maanden aanhoudende microscopische hematurie. |
|
*Risicofactoren:
- Roken
- Irritatieve LUTS (Lower Urinary Tract Symptoms);
- Eerdere bestraling;
- Eerdere cyclofosfamide/ifosfamide behandeling;
- Familie-anamnese voor urotheelcarcinoom en Lynch-syndroom;
- Beroepsfactoren, blootstelling aan benzeen of aromatische amines (rubber, verfstoffen);
- Chronische blaaskatheter
De werkgroep adviseert bij asymptomatische hematurie zonder aanwijzingen voor een benigne oorzaak en/of gynaecologische pathologie of bewezen urinewegontsteking:
Microscopische hematurie: bij positieve dipstick altijd urinesediment om microscopische hematurie te bevestigen.
Bloeddruk, eGFR (estimated Glomerular Filtration Rate), urine op eiwit, lichamelijk onderzoek: afhankelijk hiervan eerst nefrologische analyse.
Laag risico: urinesediment herhalen na 6 maanden.
Microscopische hematurie, leeftijd < 60 jaar ZONDER risicofactoren
Matig risico: echo nieren en cystoscopie
Microscopische hematurie, leeftijd < 60 jaar MET risicofactoren
Na 6 maanden aanhoudende microscopische hematurie, leeftijd < 60 jaar ZONDER risicofactoren
Microscopische hematurie, leeftijd ≥ 60 jaar
Macroscopische hematurie, Leeftijd < 50 jaar
Hoog risico: Meerfasen CT-Urografie en cystoscopie
Macroscopische hematurie, leeftijd ≥ 50 jaar
Na negatieve urologische analyse:
Bij aanhoudende macroscopische hematurie: urinecytologie
Bij aanhoudende microscopische hematurie overweeg: blanco CT of split-bolus CTU en eventueel urinecytologie met name bij patiënten met verhoogd risico, of macroscopische hematurie.
Overweeg: nefrologische analyse
Samenvatting aanbevelingen
Module Instructies voor urineverzameling
|
Sluit voor de hand liggende oorzaken voor hematurie, zoals urineweginfectie en recente urologische en gynaecologische interventies die kunnen hebben geleid tot bloed in de urine uit. Instrueer de patiënt om urine te verzamelen buiten de menstruatieperiode en om zware fysieke inspanning of seksuele activiteit te vermijden vanaf de dag voorafgaand aan het verzamelen.
|
|
Bespreek de stap-voor-stap instructie voor het verzamelen van de urine met de patiënt. Geef een instructie en achtergrondinformatie op papier en/of digitaal mee.
Als het laboratorium vraagt om (meegeleverde) buizen in te leveren in plaats van een urinepotje, bespreek ook het vullen van de buizen.
|
|
Instrueer de patiënt om middenstroom eerste of tweede ochtendurine te verzamelen.
Wanneer een ingeleverde willekeurige urineportie niet geschikt blijkt, laat de patiënt alsnog een eerste of tweede ochtendurine inleveren.
|
|
Instrueer de patiënt om de urine met het aanvraagformulier zo snel mogelijk na verzamelen in te leveren bij een inleverpunt zoals vermeld op het aanvraagformulier of op het patiëntbericht.
|
Module Urinesediment na urinestrip analyse
|
Sluit voorafgaand aan urinesedimentanalyse voor de hand liggende oorzaken van hematurie of van een positieve urine dipstickuitslag uit.
|
|
Bevestig een positieve uitslag van de dipstick voor het erytrocytentestveld bij patiënten zonder evidente verklaring voor de hematurie altijd door middel van urinesedimentanalyse.
|
Module De rol van urine biomarkers bij de diagnostiek van hematurie
|
Gebruik geen urinemarkers bij patiënten met hematurie teneinde urotheelcarcinoom op te sporen of uit te sluiten, behalve in onderzoek setting. |
Module Cystoscopie bij vrouwen met microscopisch hematurie
|
Verricht bij iedere vrouw met microscopische hematurie ≥60 jaar een cystoscopie.
Verricht geen cystoscopie bij vrouwen met microscopische hematurie <60 jaar, tenzij…
|
Module Radiologische diagnostiek van hematurie
|
Gebruik echografie als de initiële beeldvorming bij hematuriepatiënten met een matig risico op maligniteit van de urinewegen.
|
|
Gebruik een blanco CT of split-bolus CT urografie als vervolg beeldvorming bij hematuriepatiënten met een matig risico op maligniteit van de urinewegen als de initiële beeldvorming negatief is en de symptomen aanhouden.
|
|
Gebruik een meerfasen CT urografie als de initiële beeldvorming bij hematuriepatiënten met een hoog risico op maligniteit van de urinewegen.
|
|
Overweeg MR urografie, indien beschikbaar, als alternatief voor CT urografie bij:
|
Module Nefrologische / urologische oorzaken van hematurie
|
Bepaal bij iedere patiënt die zich presenteert met (asymptomische) microscopische hematurie de nierfunctie en de mate van proteïnurie.
Verwijs patiënten met hematurie in combinatie met persisterend ernstig verhoogde proteïnurie (>500mg/24 uur of EKR >50mg/mmol) of albuminurie (>300 mg/24 uur of AKR > 30 mg/mmol), primair naar een internist-nefroloog, naast een eventuele urologische analyse bij patiënten met een matig tot hoog risico op een maligniteit.
Beschouw het urinesediment en de mate van dysmorfie van erytrocyten:
Verwijs patiënten met hematurie ten gevolge van een vermoeden/vastgestelde erfelijke nierziekte, bv cystenieren, naar een internist-nefroloog. |
Module Herevaluatie na negatieve analyse bij hematurie
|
Voer herevaluatie uit na eerdere negatieve analyse van microscopische hematurie bij patiënten met:
|
|
Voer herevaluatie uit bij patiënten met herhaalde macroscopische hematurie.
|
Module Hematurie en antistolling
|
Evalueer patiënten met hematurie die antistolling zoals een DOAC gebruiken op dezelfde manier als patiënten die geen antistolling gebruiken. Het risico op het hebben van een urologische maligniteit is voor patiënten die een DOAC of andere antistolling gebruiken namelijk vergelijkbaar met patiënten die geen antistolling hebben.
|
Module Organisatie van zorg
Samenvattend:
- Positieve urinedipstick dient altijd bevestigd te worden met urinesediment
- Er wordt gebruik gemaakt van risicostratificatie op basis van micro- of macroscopische hematurie, leeftijd en aanwezig zijn van risicofactoren.
- Microscopische hematurie < 60 jaar zonder risicofactoren: na 6 maanden urinesediment herhalen (laag risico). Alle overige patiënten verwijzen naar uroloog en/of nefroloog (matig en hoog risico)
- Macroscopische hematurie bij gebruik van antistolling is indicatie voor analyse.
- Verwijstermijn macroscopische hematurie obv Soncosnormen: < 3 weken.
- Over verwijstermijn microscopische hematurie doet werkgroep geen uitspraak.
- Patiëntenvoorlichting hematurie via thuisarts.nl
Volgorde van diagnostiek: cystoscopie en radiologisch onderzoek
De meeste centra werken met triage vooraf en/of hebben een one-stop poli, waarbij radiologisch onderzoek heeft plaatsgevonden voor cystoscopie. De recente EAU guideline voor niet-spierinvasieve blaaskanker geeft aan dat een CT-U om simultaan aanwezige kanker van de hoge urinewegen (UTUC) aan te tonen noodzakelijk is bij: tumoren in trigonum, multifocaal of hoog risico tumoren (Babjuk, 2022). Gold et al. beschrijven naar aanleiding van de 2020 AUA richtlijn update dat ten opzichte van de eerdere AUA richtlijn uit 2012 de kosten per gediagnosticeerde maligniteit gereduceerd zijn van ruim $100.000 naar $62.000, dit komt met name door afname van het aantal (duurdere) CT-U’s ten opzichte van de (goedkopere) echo nieren, waardoor de totale kosten van radiologisch onderzoek fors zijn afgenomen (Gold, 2022). Halpern (2017) beschrijft een studie met daarin een simulatie model, gebruik makend van onder andere de toen nog vigerende AUA guideline, de Canadese en Nederlandse richtlijn. Echo nieren in combinatie met cystoscopie is het meest kosteneffectief (Halpern, 2017). Georgieva et al. hebben het risico onderzocht op radiatie-geïnduceerde kanker en op schade bij fout-positieve uitslagen, als je uitgaat van de microscopische hematurie AUA richtlijn uit 2012, waarin een CT-U bij alle patiënten boven de 35 jaar werd geadviseerd. Per 100.000 gescreende personen betrof dit respectievelijk 575 en 22.189 patiënten (Georgieva, 2019).
Lokaal kan een afweging gemaakt worden om bij patiënten ouder dan 50 jaar met macroscopische hematurie te starten met een cystoscopie voor CT-U in plaats van een CT-U voor cystoscopie. Afhankelijk van de bevindingen bij cystoscopie zal een CT-U moeten volgen bij negatieve analyse of bij die patiënten waar blaaskanker wordt gevonden met de eerdergenoemde risicofactoren op simultaan UTUC.
Conclusie
De werkgroep doet geen uitspraak over de volgorde van aanvullende diagnostiek: cystoscopie voor of na radiologisch onderzoek.
Wel of niet PSA bepalen.
De NICE criteria (voor huisartsen) adviseren een RT en PSA test na informed consent bij mannen met macroscopische hematurie ouder dan 45 jaar (NICE, 2015). Bromage (2022) beschrijft in een retrospectieve single-center studie dat bij 4,7% van de mannen ouder dan 50 jaar met macroscopische hematurie prostaatkanker is aangetoond. Opvallend is dat deze kliniek dit zelfs bij 8,5% van de mannen met microscopische hematurie aantoonde (Bromage, 2006). Chandrasekharan et al. beschrijven dat in hun praktijk de kans op prostaatkanker bij mannen van 50-69 jaar 3,1% was, waaruit zij concludeerden dat dit lager was dan de kans hierop in de meeste prostaatkanker screening studies uit die tijd (Chandrasekaran, 2010).
Conclusie
De werkgroep is van mening dat het standaard verrichten van een PSA bepaling zonder informed consent niet hoort bij de initiële analyse van hematurie. Wel hoort lichamelijk onderzoek, waaronder een rectaal toucher (RT) hiertoe.
Referenties:
Babjuk M, Burger M, Capoun O, Cohen D, Compérat EM, Dominguez Escrig JL, et al. European Association of Urology guidelines on non-muscle-invasive bladder cancer (Ta, T1, and carcinoma in situ). Eur Urol. 2022 Jan; 81(1): 75-94.
Bromage SJ, Napier-Hemy RD, Payne SR, Pearce I, McIntyre IG. he use of prostate-specific antigen testing in men presenting with haematuria. BJU Int. 2006 Dec; 98(6): 1221-1224; discussion 1224.
Chandrasekharan S, Shafik AA, Eaton JD. PSA testing of men in the haematuria clinic, a useful additional test or unnecessary investigation. Br J Med Surg Urol. 2010; 3: 11-14.
Georgieva MV, Wheeler SB, Erim D, Smith-Bindman R, Loo R, Ng C, et al. Comparison of the harms, advantages, and costs associated with alternative guidelines for the evaluation of hematuria. JAMA Intern Med. 2019 Oct 1; 179(10): 1352-136.
Gold SA, Kenigsberg AP, Lotan Y. Diagnostic and cost implications of the 2020 AUA microhematuria guidelines: modeling impact in a large public health care system. J Urol. 2022 Jan; 207(1): 52-60.
Halpern JA, Chughtai B, Ghomrawi H. Cost-effectiveness of common diagnostic approaches for evaluation of asymptomatic microscopic hematuria. JAMA Intern Med 2017; 177: 800–807.
National Institute for Health and Care Excellence (NICE). Suspected cancer: recognition and referral. NICE guideline NG-12 (2015). Beschikbaar via: https://www.nice.org.uk/guidance/ng12/resources/suspected-cancer-recognition-and-referral-pdf-1837268071621 Laatst geraadpleegd 15 November 2022.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 29-08-2023
Beoordeeld op geldigheid : 01-05-2023
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2028 bepaalt het bestuur van de Nederlandse Vereniging voor Urologie of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Urologie is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Algemene gegevens
De Patiëntenfederatie Nederland en Leven met Blaas- of Nierkanker hebben de richtlijn goedgekeurd.
Aanleiding voor het maken van de richtlijn
In dit project zal de huidige richtlijn Hematurie worden herzien. De huidige richtlijn is verjaard
(2010) en voldoet niet aan de methodologische kwaliteitseisen van Richtlijnen 2.0.
Doel van de richtlijn
Het doel is het herzien van de richtlijn dat patiëntenzorg voor patiënten met hematurie beschrijft. Deze herziening richt zich op modules over de optimale diagnostiek en daaropvolgend ook beleid te bewerkstelligen bij patiënten die zich bij de uroloog presenteren met hematurie en het terugdringen van praktijkvariatie en onnodige kosten om de juiste onderliggende oorzaak van hematurie te vinden. De richtlijnmodules leveren een heldere beslisboom en patiënteninformatie op waardoor behandelaars de juiste diagnostiek kunnen inzetten voor de patiënt met hematurie.
Afbakening van de richtlijn
De aard en omvang
Deze richtlijn bespreekt onder meer de diagnostiek die nodig is om een maligniteit aan te tonen dan wel uit te sluiten. In deze richtlijn wordt aandacht besteed aan zowel de diagnostiek van macroscopische als microscopische hematurie.
Beoogde gebruikers van de richtlijn
De richtlijn is bedoeld voor met name urologen, maar ook aanpalende disciplines die met de diagnostiek van hematurie te maken hebben, zoals radiologen, nefrologen en klinisch chemici.
Doel en doelgroep
Het doel is het herzien van de richtlijn dat patiëntenzorg voor patiënten met hematurie beschrijft. Deze herziening richt zich op modules over de optimale diagnostiek en daaropvolgend ook beleid te bewerkstelligen bij patiënten die zich bij de uroloog presenteren met hematurie en het terugdringen van praktijkvariatie en onnodige kosten om de juiste onderliggende oorzaak van hematurie te vinden. De richtlijnmodules leveren een heldere beslisboom en patiënteninformatie op waardoor behandelaars de juiste diagnostiek kunnen inzetten voor de patiënt met hematurie.
Beoogde gebruikers van de richtlijn
De richtlijn is met name bedoeld voor urologen. Voor de volgende disciplines is het ook waardevol om kennis te nemen van de richtlijn: huisartsen, radiologen, internisten, nefrologen en klinisch chemici.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met hematurie. De werkgroep leden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Drs. M.C. (Marina) Hovius, uroloog, OLVG, NVU (voorzitter)
- Dr. P.W. (Paul) Veenboer, uroloog, Ommelander Ziekenhuis Groningen en UMCG, NVU
- Dr. L.S. (Laura) Mertens, uroloog, Antoni van Leeuwenhoek Ziekenhuis, NVU
- Dr. B.P. (Bart) Schrier, uroloog, Jeroen Bosch Ziekenhuis, NVU
- Dr. A.H. (Arnold) Boonstra, internist-nefroloog, Flevoziekenhuis Almere, NIV
- Dr. A.Y. (Ayşe) Demir, klinisch chemicus, Meander Medisch Centrum Amersfoort, NVKC
- Dr. E.M. (Eelco) Fennema, heelkunde, UMC Groningen, NVvH (tot mei 2022)
- Drs. S. (Saskia) Kolkman, radioloog, Amsterdam UMC, NVvR (tot mei 2021)
- Drs. B. (Bram) Westerink, radioloog, Antoni van Leeuwenhoek Ziekenhuis, NVvR (vanaf mei 2021)
Namens patiëntenvereniging Leven met blaas- of nierkanker
- Dr. H. (Hans) Ubbels, patiëntenvereniging Leven met blaas- of nierkanker (tot mei 2021)
- Drs. E. (Else) Wolak, NFK
Klankbordgroep
- Dr. C.F. La Chapelle, urogynaecoloog, Elkerliek ziekenhuis (tot januari 2023) daarna Viecuri, NVOG
- Dr. M.E. (Mariëlle) Donker, gynaecoloog, Diaconessen Ziekenhuis Utrecht, NVOG
- Dr. J.G. (Iris) Ketel, NHG
- Drs. A.J. (Aart) van der Molen, radioloog, LUMC, NVvR
Met ondersteuning van
- Dr. I.M. (Irina) Mostovaya, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J.H. (Hanneke) van der Lee, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroep leden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroep leden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie |
|
* Voorzitter werkgroep Hovius |
Uroloog, OLVG Amsterdam |
Lid kwaliteitsvisitatie NVU (onkostenvergoeding) |
geen |
geen |
geen |
geen |
geen |
04/07/2020 |
Geen restrictie |
|
Demir |
Klinisch Chemicus, Meander MC, Amersfoort |
Voorzitter FMS-NVKC Richtlijn Eenduidige en accurate laboratoriumdiagnostiek bij bloed in urine (hematurie) (vacatiegelden) Medisch Coördinator voor de eerstelijn, Meander MC (betaald) Vakdeskundige Raad voor Accreditatie (betaald) |
nvt |
nvt |
nvt |
nvt |
nvt |
15/04/2020 |
Geen restrictie |
|
Mertens |
Uroloog, Antoni van Leeuwenhoek Ziekenhuis |
Deelname werkgroep Europese richtlijn spierinvasief en gemetastaseerd blaascarcinoom |
Nee |
Nee |
Nee |
Nee |
nvt |
26/06/2020 |
Geen restrictie |
|
Schrier |
Uroloog, opleider Urologie JBZ |
Proctor robotchirurgie (begeleidt onervaren urologen bij opstarten robotchirurgie) |
geen |
Nee |
geen |
geen |
geen |
28/06/2020 |
Geen restrictie |
|
Ubbels |
Patientenvereniging Leven met blaas- of nierkanker |
Vrijwilliger, niet betaald |
geen |
Nee |
geen |
geen |
geen |
24/07/2020 |
Geen restrictie |
|
Veenboer |
Uroloog, Ommelander Ziekenhuis Groningen (0,6 FTE) en UMCG (0,2 FTE) |
Redactielid Urograaf |
geen |
geen |
geen |
geen |
In 2019 eenmalig vergoeding ontvangen van Sanofi voor EAU review van nieuwe chirurgische behandelingen voor BPH, in 2019 eenmalig vergoeding van Astra Zeneca voor congresbezoek. |
02/07/2020 |
Geen restrictie |
|
Boonstra |
Internist-nefroloog in het Flevoziekenhuis te Almere |
Principal Investigator voor Fidelio en Figaro studie, internationale multicenter trial bij diabetes mellitus patiënten met nefropathie, met betaald |
geen |
geen |
geen |
geen |
geen |
23/06/2020 |
Geen restrictie (Genoemde onderzoeken hebben geen relatie met de diagnostiek van hematurie) |
|
Wolak |
Projectleider Patientenorganisatie Leven met blaas- of nierkanker, neem in deze hoedanigheid deel aan de werkgroep (16 uur). Projectleider kwaliteit van zorg NFK (16 uur) |
Geen |
Geen |
Geen |
Geen |
Werkzaam bij patiëntenorganisatie, geen boegbeeldfunctie. |
Nee |
11/09/2020 |
Geen restrictie |
|
Kolkman |
Radioloog, 80% aanstelling |
Screeningsradioloog voor het BOB-MW (bevolkingsonderzoek borstkanker), betaald omvang 1 dagdeel per week |
geen |
geen |
geen |
geen |
nee |
18/09/2020 |
Geen restrictie |
|
Westerink |
Radioloog, Antoni Van Leeuwenhoek Ziekenhuis - Nederlands Kanker Instituut |
nvt |
nvt |
nvt |
nvt |
nvt |
nvt |
07/11/2022 |
Geen restrictie |
|
Fennema |
Traumachirurg, UMCG |
Geen |
geen |
geen |
geen |
geen |
nee |
28/10/2020 |
Geen restrictie |
|
|
|
|
|
|
|
|
|
|
|
|
Klankbordgroep |
|
|
|
|
|
|
|
|
|
|
Ketel |
Wetenschappelijk medewerker NHG Utrecht, Kaderhuisarts Urogynaecologie Zorroo Oosterhout, waarnemend huisarts regio Eindhoven |
deelname werkgroep richtlijn herziening PCOS, FMS kennisinstituut, betaald |
nvt |
nvt |
nvt |
nvt |
nvt |
31/08/2020 |
Geen restrictie |
|
van der Molen |
Radioloog, LUMC Leiden |
geen |
geen |
geen |
geen |
geen |
In afgelopen 3 jaar consultancy fees ontvangen van Guerbet; ging over publicatie over contrastmiddelen veiligheid (contrast nefropathie preventie) |
24/07/2020 |
Geen restrictie |
|
Donker |
Urogynaecoloog, Diakonessenhuis Utrecht |
geen |
geen |
geen |
geen |
geen |
geen |
14/11/2022 |
Geen restrictie |
|
La Chapelle |
Urogynaecoloog, Viecuri, Venlo |
geen |
nee |
nee |
nee |
nee |
nee |
18/09/2020 |
Geen restrictie |
|
Adviseurs |
|
|
|
|
|
|
|
|
|
|
Mostovaya |
Senior adviseur Kennisinstituut FMS |
geen |
geen |
geen |
geen |
geen |
geen |
|
|
|
Van der Lee |
Senior adviseur Kennisinstituut FMS |
Onderzoeker Amsterdam UMC (0,05 FTE) |
geen |
geen |
geen |
geen |
geen |
|
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiënten perspectief door een afgevaardigde van Leven met blaas- of nierkanker. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Leven met blaas- of nierkanker en de Patiëntenfederatie Nederland.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Module Instructies voor urineverzameling |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Urinesediment na urinestrip analyse |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module De rol van urine biomarkers bij de diagnostiek van hematurie |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Cystoscopie bij vrouwen met microscopische hematurie |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Radiologische diagnostiek van hematurie |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Nefrologische / urologische oorzaken van hematurie |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Herevaluatie na negatieve analyse bij hematurie |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Hematurie en antistolling |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Organisatie van zorg |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in Module 7 Organisatie van zorg. De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, om de registratielast niet toe te laten nemen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens werden stakeholders uitgenodigd voor een knelpuntenbijeenkomst (Invitational conference). Het verslag van de Invitational Conference bevindt zich in de bijlage.
De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Er was financiële ruimte om 8 uitgangsvragen uit te werken met een systematische literatuursearch. Daarom moest de werkgroep een prioritering maken van de relevante klinische knelpunten. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen zoekvragen geformuleerd. Zoekvragen werden vertaald naar PICO’s (Patient, Intervention, Control, Outcome). Aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroep leden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiënten perspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottawa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading of Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroep leden maakten de balans op van elke interventie (algehele conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een algehele conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroep leden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten samen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep overwogen om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten. De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn om de registratielast niet toe te laten nemen.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/werkwijze/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from https://gdt.gradepro.org/app/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
