Hartrevalidatie bij hartfalen
Uitgangsvraag
Hartrevalidatie bij hartfalen
Aanbeveling
Het is sterk aan te bevelen om patiënten met hartfalen klasse NYHA II-III, die optimaal zijn ingesteld met medicatie, fysieke training te geven (niveau A; klasse I)
Het is aannemelijk dat stabiele patiënten met chronisch hartfalen de fysieke training levenslang moeten continueren (niveau B; klasse IIa).
De revalidatiecommissie adviseert een specifiek informatieprogramma voorhartfalenpatiënten omdat dit bijdraagt aan een meer actieve leefstijl (niveau C; klasse IIb).
Met betrekking tot de psychische en sociale doelen gelden voor patiënten met hartfalen dezelfde aanbevelingen als elders beschreven in deze richtlijn.
Overwegingen
Er zijn bij deze uitgangsvraag geen overwegingen geformuleerd.
Onderbouwing
Achtergrond
Deze module gaat in op de specifieke kenmerken van hartrevalidatie bij hartfalen. Hartfalen is een complex van klachten en verschijnselen ten gevolge van een tekortschietende pompfunctie van het hart (Mosterd 2002). In Nederland heeft 1% tot 2% van de bevolking hartfalen. De groep patiënten met hartfalen groeit snel door de vergrijzing. De medicamenteuze behandeling van hartfalen bestaat uit het gebruik van ACE-remmers1, diuretica en bètablokkers (Komajda 2003). Nieuwe therapieën voor de behandeling van hartfalen zijn anno 2003 volop in onderzoek, zoals re-synchronisatietherapie (biventriculaire pacemakers), linkerkamer assist devices en stamceltherapie. Fysieke training van patiënten met chronisch hartfalen is een andere vorm van behandeling die volop in de belangstelling staat. Bij de herziening van de richtlijn in 2011 is relevante nieuwe informatie over psychisch en sociaal functioneren toegevoegd.
1 Dit advies is inmiddels achterhaald. Dit gedeelte van de richtlijntekst is echter niet herzien in 2011
Conclusies
Psychische doelen
- Een derde van de patiënten met chronisch hartfalen krijgt een milde depressie. (Niveau van bewijs 1)
- Een vijfde van de patiënten met chronisch hartfalen krijgt een depressieve stoornis. (Niveau van bewijs 1)
- Een vijfde van de patiënten met chronisch hartfalen krijgt een angststoornis. (Niveau van bewijs 2)
- Depressieve symptomen komen meer voor bij patiënten met meer klachten van hartfalen (hogere NYHA classificering). (Niveau van bewijs 1)
Depressieve symptomen bij patiënten met chronisch hartfalen verslechteren de prognose met betrekking tot:
- Toegenomen zorgconsumptie (bezoek eerste hulp, cardiale en psychiatrische polikliniek). (Niveau van bewijs 1)
- Toegenomen mortaliteit en cardiale incidenten. (Niveau van bewijs 1)
- Interventies gericht op het verbeteren van het psychisch functioneren bij patiënten met chronisch hartfalen hebben vergelijkbare effecten op psychische klachten als interventies gericht op verbetering van psychisch functioneren bij patiënten met coronarialijden (matige verbetering psychische symptomen, en geen effect cardiale prognose). (Niveau van bewijs 3)
Sociale doelen
Gebrek aan sociale steun bij patiënten met chronisch hartfalen verslechtert de prognose met betrekking tot:
- Meer heropnames. (Niveau van bewijs 1)
- Meer mortaliteit. (Niveau van bewijs 1)
- Slechtere kwaliteit van leven. (Niveau van bewijs 2)
- Meer, langer depressieve symptomen. (Niveau van bewijs 2)
- Minder goede zelfzorg (o.a. therapietrouw). (Niveau van bewijs 2)
- Een vijfde van de mantelzorgers van patiënten met chronisch hartfalen krijgt een milde depressie.(Niveau van bewijs 1)
- Interventies gericht op het verhogen van de sociale steun bij patiënten met chronisch hartfalen hebben vergelijkbare effecten als interventies gericht op verhogen van de sociale steun bij patiënten met coronarialijden. (Niveau van bewijs 1)
Samenvatting literatuur
Pathofysiologische en klinische aspecten
Patiënten met hartfalen hebben klachten als (spier)vermoeidheid en kortademigheid. Chronisch hartfalen wordt gekarakteriseerd door een verminderde pompfunctie van de linkerkamer en een toegenomen perifere vaatweerstand. De klachten van hartfalenpatiënten kunnen leiden tot lichamelijke inactiviteit en verdere atrofie van de skeletspieren (Anker 1997, Harrington 1997). Er bestaat bij patiënten met chronisch hartfalen geen relatie tussen het maximale inspanningsvermogen en verminderde linkerkamer-ejectiefractie (Franciosa 1981).
Perifere bloeddoorstroming
De perifere bloeddoorstroming bij patiënten met hartfalen gedurende inspanning is onder meer gestoord door een verminderde afgifte van ‘endothelium derived factor’ in de arteriolen. Deze verminderde afgifte leidt tot een verhoogde concentratie van vasoconstrictieve neurohormonen zoals endotheline, norepinefrine, renine, angiotensine-II en vasopressine (Linke 2001). De verminderde perifere bloeddoorstroming is niet alleen een gevolg van een abnormale vasodilatatie, maar ook van een afname van het totale aantal en de totale oppervlakte van de capillairen in de skeletspier (Drexler 1992, Gottlieb 1999, Giannattasio 2001).
Functie en structuur van de skeletspier
Bij patiënten met hartfalen leidt de atrofie van type-I-spiervezels tot een groter aandeel type-IIA-spiervezels en type-IIB-spiervezels (Lipkin 1988, Mancini 1989, Sullivan 1992, Adamopoulos 1995). De relatieve verschuiving van type-I- naar type-IIA en type-IIB-spiervezels wordt gekarakteriseerd door een relatief lage dichtheid van capillairen, een kleiner volume en een lagere oppervlaktedichtheid van mitochondriën, en een verminderde oxidatieve capaciteit in de skeletspier. Het resultaat is een lager verbruik van energie en zuurstof in de skeletspier (Drexler 1992). Als gevolg daarvan kan het maximale inspanningsvermogen bij patiënten met hartfalen verder dalen. Het maximale inspanningsvermogen, gemeten als piek VO2, is een onafhankelijke variabele die geassocieerd wordt met de prognose bij deze patiënten (Willenheimer 2001).
Spierergoreflex, autonome controle en neurohormonale activatie
Ergoreceptoren zijn kleine zenuwen die gevoelig zijn voor de stofwisseling in de skeletspier. Bij patiënten met hartfalen zijn de reflexen van de ergoreceptoren overactief. Deze overactiviteit leidt tot een verhoogde ventilatie, sympato-excitatiekoppeling en vasoconstrictie bij patiënten met hartfalen tijdens inspanning (Piepoli 1996). De verlaagde activiteit van de parasympaticus bij patiënten met hartfalen veroorzaakt een hogere hartfrequentie in rust en een lagere variabiliteit van het hartritme. Fysieke training normaliseert de activiteit van de parasympaticus en heeft zo een gunstige invloed op de hartritmevariabiliteit en de hartfrequentie in rust (Adamopoulos 1995). Compensatiemechanismen bij patiënten met hartfalen leiden tot een activatie van het neuro-endocriene systeem. Door deze activatie is de cardiopulmonale baroreflex verhoogd en neemt het aantal bètareceptoren af (downregulatie). Fysieke training verbetert de autonome controle bij patiënten met hartfalen, leidend tot een lagere tonus van de sympaticus, een verhoogde vagustonus en een verminderde activatie van het renineangiotensinesysteem (Coats 1994).
Cardiac output
De cardiac output tijdens maximale inspanning is bij patiënten met hartfalen gehalveerd in vergelijking met gezonde leeftijdgenoten. De maximaal bereikbare hartfrequentie tijdens maximale inspanning bij patiënten met hartfalen is ongeveer gelijk aan die van gezonde leeftijdgenoten. De maximale cardiac output tijdens inspanning bij patiënten met hartfalen is verminderd door een verhoogde perifere vaatweerstand.
Inspanningsvermogen en zuurstofopnamevermogen
Uit inspanningstrials bij patiënten met hartfalen blijkt dat fysieke training een gunstige invloed heeft op het maximale inspanningsvermogen, de maximale cardiac output bij inspanning en de anaërobe drempel. Regelmatige lichamelijke inspanning verbetert de endotheelfunctie waardoor de perifere vaatweerstand vermindert en de bloeddoorstroming naar de perifere skeletspier toeneemt (Sullivan 1989, Hornig 1996, Hambrecht 1998, Hambrecht 2000). Fysieke training verhoogt bij patiënten met hartfalen het totale oppervlak en het totale aantal capillairen in de skeletspieren (Drexler 1993). Onder invloed van training kan de achteruitgang van type-I-spiervezels teruggedraaid worden en het aandeel van type-I-spiervezels in de spier weer toenemen. Als gevolg van al deze veranderingen neemt het zuurstofopnamevermogen weer toe (zie voor een overzicht van het gerandomiseerde onderzoek naar de effecten van fysieke training bij patiënten met hartfalen Aanverwant Gerandomiseerd klinisch onderzoek).
De basis voor de adviezen voor fysieke training van patiënten met hartfalen in deze richtlijn wordt gevormd door gepubliceerde richtlijnen (Piepoli, 1998, Gianuzzi 2001, Pina 2003), gerandomiseerd klinisch onderzoek en de adviezen van de revalidatiecommissie.
Indicaties en contra-indicaties voor fysieke training bij patiënten met hartfalen
Voor fysieke training komen in aanmerking hartfalenpatiënten:
- Die langer dan 3 weken hemodynamisch stabiel zijn;
- Die niet kortademig zijn tijdens praten;
- Met een ademhalingsfrequentie van minder dan 30 per minuut;
- Met een hartslagfrequentie in rust van minder dan 110 slagen per minuut;
- Met een VO2max van meer dan 10 ml/kg per minuut;
- Die geen ventriculaire tachycardieën hebben tijdens toenemende inspanning;
- Die optimaal medicamenteus zijn ingesteld.
Contra-indicaties voor fysieke training bij patiënten met hartfalen zijn:
- Progressieve toename van klachten ten gevolge van hartfalen;
- Ernstige cardiale ischemie bij lage tot middelmatige inspanning;
- Sterk ontregelde diabetes mellitus;
- Koorts;
- Acute systeemziekten;
- Een recente longembolie (minder dan 3 maanden geleden) die hemodynamisch zwaar belastend is;
- Tromboflebitis;
- Acute pericarditis of myocarditis;
- Hemodynamisch ernstige aortastenose of mitralisklepstenose;
- Hartklepinsufficiëntie die een indicatie vormt voor chirurgie;
- Hartinfarct in de 3 weken voorafgaand aan de training;
- Boezemfibrilleren met een hoge kamerrespons in rust (> 100/min).
Fysieke doelen
Algemene fysieke doelen voor patiënten met hartfalen zijn:
- Het leren kennen van eigen fysieke grenzen (1);
- Het leren omgaan met fysieke beperkingen (2);
- Het overwinnen van angst voor lichamelijke inspanning (4);
- Het ontwikkelen of onderhouden van een lichamelijk actieve levensstijl (13).
Daarbij zijn er specifieke doelen voor patiënten met hartfalen:
- Het verbeteren van het (sub)maximale inspanningsvermogen;
- Het afstemmen van de belasting in relatie tot de belastbaarheid;
- Het verminderen van vermoeidheid, kortademigheid en inactiviteit.
Fysieke training
De fysieke doelen kunnen het best bereikt worden door een combinatie van krachten duurtraining. De accenten liggen hierbij op het trainen van de perifere skeletspieren (functioneel), (extensieve) intervaltraining en het trainen van de ademhalingsspieren.
Het is aan te bevelen om de trainingssessies te starten met een lage belasting en vervolgens de duur en de frequentie van de sessies uit te breiden. Duur en frequentie kunnen worden afgestemd op de individuele, functionele en klinische status van de patiënt. Patiënten met een maximale inspanningscapaciteit van minder dan 3 MET (25 tot 50 Watt) lijken het meest gebaat bij zeer korte, maar frequente trainingssessies. Als de patiënt een inspanningstolerantie heeft bereikt van 3 tot 5 MET (40 tot 80 Watt) kan de frequentie van trainingssessies verminderd worden tot 1 à 2 trainingssessies per dag gedurende 15 minuten. Patiënten met een maximaal inspanningsvermogen van 5 MET (75 tot 125 Watt) kunnen volstaan met 3 tot 5 trainingssessies per week gedurende 20 tot 30 minuten. De training kan bestaan uit fietsergometrische training, looptraining, circuittraining en functionele oefenvormen.
Fietsergometrische training heeft als voordeel dat getraind kan worden met een lage intensiteit, dat de intensiteit nauwkeurig te doseren is en dat grote spiergroepen kunnen worden getraind. Bij deze training bestaat ook de mogelijkheid om het hartritme en de bloeddruk van de patiënt te monitoren. Looptraining is een van de meest natuurlijke vormen van trainen voor patiënten met hartfalen. Deze trainingsvorm kan in de oefenzaal, op een (speciaal ontwikkeld) circuit of op een loopband plaatsvinden. In vergelijking met fietsergometrische training is looptraining specifieker voor het functioneren op ADL-niveau bij patiënten met hartfalen (lopen is primair, fietsen is secundair).
Circuittraining is specifiek voor het trainen van ADL-activiteiten en voor het trainen van bepaalde spiergroepen. Deze vorm van training neemt een belangrijke plaats in het totale programma voor patiënten met hartfalen in. Het is aan te bevelen om 3 keer per week de ademhaling te trainen gedurende 15-20 minuten met een intensiteit van 25% tot 35% van de Pimax (Pimax is de maximaal geforceerde inademing). Bij krachttraining wordt geadviseerd om te starten met een lage weerstand en een wat hogere herhalingsfrequentie (10 à 12 herhalingen). De belasting mag maximaal 60% tot 80% van het eerste herhalingsmaximum bedragen, verdeeld over 1 minuut arbeid en 2 minuten rust.
De intensiteit van duurtraining kan uitgevoerd worden in een percentage van VO2max, een percentage van verkregen maximale hartfrequentie tijdens de maximale inspanningstest of een percentage van het maximale inspanningsvermogen. Bij ernstige klachten kan het noodzakelijk zijn om het trainingsprogramma te stoppen of te veranderen. Dit geldt met name bij:
- Ernstige moeheid of kortademigheid (Borgschaal > 13);
- Verhoogde ademhalingsfrequentie tijdens inspanning (> 40/min);
- Toename van basale crepitaties;
- Lage polsdruk (< 10 mm Hg);
- Daling van systolische bloeddruk tijdens inspanning (> 10 mm Hg);
- Toename van (supra)ventriculaire ritmestoornissen;
- Gewichtstoename van meer dan 1 kilo binnen enkele dagen, al dan niet
- Met toename van kortademigheid in rust.
Bij patiënten die een hoog risico op complicaties lopen, is het aan te bevelen om de lichamelijke training te starten in een gespecialiseerd centrum met een staf van artsen, fysiotherapeuten en verpleegkundigen. Gespecialiseerde centra hebben de beschikking over hartritme- en bloeddrukbewaking en een reanimatieteam. Deze centra zijn bij voorkeur gelokaliseerd bij een cardiologische kliniek of gespecialiseerd hartrevalidatiecentrum.
Inspanningstest
Inspanningstesten kunnen het best uitgevoerd worden als de patiënt optimaal is ingesteld met medicatie. Om het inspanningsvermogen zo objectief mogelijk te meten, verdient het aanbeveling om tijdens de inspanningstest parameters met betrekking tot ventilatie en gaswisseling te meten. De uitkomsten van de cardiopulmonale inspanningstest moeten gebruikt worden bij het bepalen van het trainingsprotocol en bij het bewaken van de conditie van de patiënt.
Om een goed trainingsadvies te kunnen geven, is het noodzakelijk om een maximale inspanningstest uit te voeren. De volgende parameters moeten worden bepaald:
- Hartfrequentie en bloeddrukverloop tijdens inspanning;
- Ademhalingsparameters zoals VO2, VCO2, O2-pols, VE, Respiratory exchange Rate (RER) en anaerobe of ventilatoire drempel;
- Maximale inspanningscapaciteit uitgedrukt als percentage van de norm;
- De reden van het stoppen van de inspanningstest.
Duur van het trainingsprogramma
Patiënten met chronisch hartfalen hebben na een trainingsperiode van 8 tot 26 weken een maximaal niveau voor inspanningsvermogen en fysieke fitheid bereikt. Na de trainingsperiode moet de conditie en fitheid op peil worden gehouden door blijvende training (Sullivan 1989). De lichamelijke conditie gaat snel achteruit als met regelmatige lichamelijke inspanning wordt gestopt of de patiënt minder actief wordt. Daarom wordt met name aan patiënten met hartfalen geadviseerd om, na de trainingsperiode in een gespecialiseerde hartrevalidatiekliniek of een hartrevalidatiecentrum (fase II), hun trainingsarbeid te continueren in een fysiotherapiepraktijk, cardiofitness- of sportcentrum met bevoegde professionals (fase III).
Psychische doelen1
De (na)zorg voor patiënten met hartfalen is vooral gericht op de lichamelijke verschijnselen en beperkingen. In Nederland is er nog geen structurele aandacht voor screening en behandeling van psychosociale problemen bij patiënten met hartfalen (van Erp 2006), ondanks het feit dat er veel wetenschappelijke literatuur is over depressieve symptomen in deze populatie en de negatieve invloed daarvan op de cardiovasculaire prognose. Herkenning en behandeling van depressieve symptomen bij patiënten met hartfalen zou verbeterd kunnen worden door multidisciplinaire zorg (Piepoli 2010).
Patiënten met chronisch hartfalen worden sneller ongerust door het ervaren van symptomen en de beperkte fysieke functie, en zij hebben last van machteloosheid en hopeloosheid. Tevens rapporteren zij een grote mate van sociale beperkingen en dysfunctioneren in diverse rollen (Yu 2008). Vrouwen rapporteren vaker dat ze de situatie (ziekte, beperkingen) hebben geaccepteerd en er positief tegenover staan.
Twee systematische literatuurstudies en een meta-analyse beschrijven het voorkomen van depressieve symptomen bij patiënten met chronisch hartfalen. Depressieve symptomen komen voor bij 9 tot 60% van de patiënten. Bij 33,6% van de patiënten met hartfalen is sprake van een subklinische depressie. Een vijfde (19,3%) van de patiënten vertoont een depressieve stoornis. Een recente studie van Moser en collega’s (Moser 2010) vergeleek verschillende groepen oudere hartpatiënten met elkaar. Hieruit bleek dat patiënten met hartfalen meer depressieve symptomen hadden dan patiënten na een hartinfarct of na een CABG (resp. 63%, 56% en 53%). Klinische patiënten hebben evenveel depressieve symptomen als poliklinische patiënten, maar waarschijnlijk speelt hier een overschatting van de symptomen bij poliklinische patiënten een rol. Rutledge 2006, Pelle 2008 Depressieve symptomen komen ook in deze populatie significant vaker voor bij vrouwelijke en jongere (<60 jaar) patiënten (Rutledge 2006). In Amerikaanse studies lijken depressieve symptomen minder voor te komen bij allochtonen dan bij autochtonen (resp. 18,7% en 25,3%) (Rutledge 2006). Naarmate de NYHA klasse toeneemt, nemen ook de depressieve symptomen toe; NYHA klasse IV-patiënten hebben vier keer vaker depressieve symptomen dan patiënten met NYHA klasse I (Rutledge 2006). Er zijn geen betrouwbare cijfers met betrekking tot het voorkomen van angst bij patiënten met chronisch hartfalen (Pelle 2008). Uit een systematische literatuurstudie bleek dat bij 18,4% van de patiënten met een verminderde systolische hartfunctie sprake is van een angststoornis (Haworth 2005). Moser en collega’s (Moser 2010) toonden bij oudere patiënten met hartfalen aan dat 44% van de patiënten angstsymptomen heeft.
Prognose
De mate waarin depressieve symptomen de cardiale prognose bij patiënten met hartfalen beïnvloeden is niet eenduidig. In een meta-analyse worden de volgende negatieve uitkomsten gerapporteerd: toegenomen zorgconsumptie (bezoek eerste hulp, psychiatrische en cardiale polikliniek en cardiale opnames), twee keer hogere mortaliteit, twee keer vaker klinische incidenten (Rutledge 2006). Bij klinische patiënten is de relatie tussen depressieve symptomen en cardiovasculaire prognose niet eenduidig aangetoond, bij poliklinische patiënten wel. De etiologie van het hartfalen lijkt mogelijk ook een rol te spelen in de conflicterende uitkomsten (Pelle 2008). Er zijn nauwelijks betrouwbare gegevens over de prognose van patiënten met angstsymptomen en hartfalen (Pelle 2008). Zowel depressieve symptomen als angstsymptomen doen de kwaliteit van leven van patiënten met hartfalen significant afnemen (Scherer 2007a).
Interventies
Er is matig sterk bewijs voor een positief effect van interventies voor psychische symptomen bij hartfalen (Lip 2003). Rutledge en collega’s (Rutledge 2006) vonden op basis van zes kwalitatief matige interventiestudies (psychologische/psychotherapeutische interventies, medicatie alsmede bewegingsprogramma’s) een matig positief effect op psychische symptomen, vergelijkbaar met de resultaten bij patiënten met coronarialijden. In een recente studie van matige kwaliteit werkte de combinatie fysieke inspanning en cognitieve gedragstherapie het beste om depressieve symptomen te reduceren bij patiënten met hartfalen met NYHA klasse II-III, beter dan cognitieve gedragstherapie alleen (Gary 2010).
Sociale doelen1
Sociale steun, bijvoorbeeld van de partner, verlaagt de kans op (her)opnames in het ziekenhuis en de mortaliteit bij patiënten met hartfalen (vooral als er weinig spanningen in de partnerrelatie zijn (geen huwelijksstress)), bevordert de kwaliteit van leven en leidt tot minder depressieve symptomen (Scherer 2007b). Depressieve patiënten met goede sociale steun hebben een lagere mortaliteit (Luttik 2005), mogelijk door het positieve effect op zelfzorg (Sayers 2008, Scherer 2008, Sebern 2009). Bij vrouwen is er een sterker verband tussen sociale steun en minder heropnames alsmede lagere cardiale mortaliteit dan bij mannen (Luttik 2005).
Mantelzorgers
Ongeveer een vijfde van de primaire mantelzorgers voor patiënten met hartfalen heeft een subklinische depressie. Dit is vergelijkbaar met de prevalentie van depressieve symptomen bij mantelzorgers voor patiënten met andere chronische aandoeningen. De kwaliteit van leven van vrouwelijke mantelzorgers is significant lager dan die van mannelijke mantelzorgers (Luttik 2009). Leeftijd en relatie met de partner lijken geen verschil te maken (Molloy 2005, Bakas 2006). Mantelzorgers ervaren het geven van zorg als positief wanneer er waardering vanuit de patiënt blijkt, de omgeving van de patiënt de zorg ondersteunt en de mantelzorger betrokken wordt bij de medische zorg van de patiënt (Martensson 2001). Bij patiënten met hartfalen is het dus zeker zo belangrijk als bij andere hartpatiënten om de primaire mantelzorger bij de hartrevalidatie te betrekken. De meeste interventies gericht op het vergroten van sociale steun zijn onderzocht bij patiënten met chronisch hartfalen en hun mantelzorgers (zie module Interventies sociale doelen).
Werkhervatting
Over de participatie in sociale rollen van patiënten met chronisch hartfalen is in tegenstelling tot de populatie patiënten met coronarialijden zeer weinig bekend in de internationale literatuur (Phillips 2005). In het verzekeringsgeneeskundige protocol Chronisch Hartfalen wordt de belastbaarheid beschreven in het kader van de werkhervatting. Hartfalen is een dynamische stoornis en het ontbreekt aan vaste criteria om de belastbaarheid te bepalen. De verzekeringsarts baseert zich op recente klinische informatie. Patiënten met chronisch hartfalen ervaren over het algemeen meer comorbiditeit en fysieke gevolgen van het cardiale incident, wat werkhervatting kan belemmeren. Hartfalen komt niet vaak voor onder mensen jonger dan 65 jaar en minder dan 1% van alle arbeidsongeschiktheidsbeoordelingen heeft betrekking op hartfalen (zie verzekeringsgeneeskundige protocollen COPD en Chronisch Hartfalen van de NVVG, 2008, NVVG 2008).
Beïnvloeden van risicogedrag
Een multidisciplinaire aanpak levert de beste kans op het ontwikkelen en continueren van een lichamelijk actieve leefstijl. De revalidatiecommissie beveelt net als voor coronaire hartpatiënten ook voor patiënten met hartfalen een informatieprogramma aan. De vorm van het informatieprogramma kan gelijk zijn aan die voor coronaire hartpatiënten. De inhoud moet worden aangepast aan vragen en problemen van hartfalenpatiënten. De levensverwachting, vooruitzichten en problemen van hartfalenpatiënten verschillen immers duidelijk van die van de gemiddelde coronaire hartpatiënt. De revalidatiecommissie adviseert aanbieding van een gespecialiseerd voorlichtingsprogramma aan patiënten met hartfalen, met uitleg over de medische achtergronden en medicatie bij hartfalen, voorlichting over gezonde voeding en voedingsvoorschriften bij hartfalen en aandacht voor de maatschappelijke en psychische gevolgen van (ernstig) hartfalen. Belangrijke voedingsvoorschriften voor patiënten met hartfalen zijn het beperken van de inname van natrium en vocht (Grady 2000, Remme 2001). De mate van beperking is zowel voor natrium als vocht afhankelijk van de functionele klasse van het hartfalen. Aan patiënten met hartfalen klasse II wordt een natriumbeperking van 3000 mg per dag geadviseerd, aan patiënten met hartfalen klasse III en IV een beperking van 2000 mg per dag. Er is geen onderzoek bekend naar de effecten van natriumbeperking bij patiënten met hartfalen. Wel is bekend dat een vermindering van de natriuminname bij gezonde vrijwilligers leidt tot een afname van extracellulair vocht (Antonius 1996).
Patiënten met hartfalen klasse II krijgen het advies om niet overmatig te drinken (maximaal 2500 ml per 24 uur) (Grady 2000, Remme 2001). Patiënten met hartfalen klasse III en IV krijgen een vochtbeperking van 1500 tot 2000 ml per 24 uur. Wanneer patiënten met hartfalen in klasse III en IV een hoge dosis lisdiuretica (> 80 mg furosemide of > 2 mg bumetanide) nodig hebben om vochtretentie te voorkomen, dan krijgen zij een vochtbeperking van 1500 ml per 24 uur voorgeschreven. Bij een verdunnings-hyponatriëmie moet de vochtinname (tijdelijk) verder worden beperkt tot 1200-1500 ml per 24 uur. De natriumbeperking blijft gehandhaafd.
Een ongewenst gewichtsverlies van 5% binnen een maand of 10% binnen 6 maanden of een BMI < 20 kg/m2 zijn uitingen van cachexie. In dat geval zijn voedingsadviezen noodzakelijk om verder gewichtsverlies te beperken (Grady 2000). Overgewicht is een van de cardiovasculaire risicofactoren. Voor patiënten met hartfalen is overgewicht extra nadelig omdat de circulatie overbelast wordt. Begeleiding door een diëtist wordt geadviseerd bij patiënten met ernstig hartfalen (klasse III en IV). Voor meer informatie over voedingsadviezen verwijst de commissie naar de Multidisciplinaire Richtlijn Chronisch Hartfalen (Van Erp 2006). In Nederland bieden de goed functionerende hartfalenpoliklinieken de mogelijkheid om verschillende programma’s voor de revalidatie van patiënten met hartfalen te coördineren en te integreren. Het ligt voor de hand dat een gespecialiseerd team hieraan het beste vorm kan geven.
1 Herzien in 2011
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-01-2011
Laatst geautoriseerd : 01-01-2011
Geplande herbeoordeling :
In oktober 2000 vroeg de Commissie Kwaliteit van de NVVC de revalidatiecommissie om de Richtlijnen Hartrevalidatie 1995/1996 te actualiseren. Immers, ervaring met hartrevalidatie en wetenschappelijk onderzoek hebben inmiddels geleid tot nieuwe inzichten. Uit het wetenschappelijk onderzoek blijkt dat ook patiënten met hartfalen, aangeboren hartafwijkingen en ritmestoornissen in aanmerking kunnen komen voor hartrevalidatie. Hetzelfde geldt voor patiënten die een harttransplantatie hebben ondergaan. De groep patiënten voor wie hartrevalidatie is bestemd, is daarmee vergroot. Ook de wetenschappelijke kennis over het belang van een gezonde leefstijl is toegenomen. Het veranderen van de leefstijl kan indien gecombineerd met medicamenteuze behandeling het atherosclerotische proces vertragen of zelfs terugdringen. Daarmee vermindert de kans op nieuwe vasculaire gebeurtenissen.
Begin 2008 initieerde de NVVC een subsidieaanvraag bij het Kennisbeleid Kwaliteit Curatieve Zorg (KKCZ)-programma van ZonMW om de Richtlijn Hartrevalidatie 2004 te herzien met betrekking tot psychische en sociale doelen. De richtlijn uit 2004 bood onvoldoende houvast om het verhoogde niveau van psychische symptomen, die voorkomen bij driekwart van de patiënten die voor hartrevalidatie in aanmerking komen, effectief te behandelen. Bovendien is de wetenschappelijke kennis over dergelijke psychische symptomen na een cardiaal incident en over de behandeling daarvan enorm toegenomen. Daarnaast waren er inmiddels richtlijnen met betrekking tot hartpatiënten voor bedrijfsartsen en voor verzekeringsartsen en was de wens ontstaan om de richtlijn voor de tweedelijns gezondheidszorg beter te laten aansluiten op deze nieuwe richtlijnen. Ook was er behoefte aan meer houvast met betrekking tot het bereiken van werkhervatting. Bij de herziening, die in oktober 2008 in het project Psychische en Arbeidsgerelateerde Aspecten van HartRevalidatie (PAAHR) van start ging, is besloten om de richtlijn niet alleen te herzien met betrekking tot werkhervatting maar ook met betrekking tot sociale steun. Uit de wetenschappelijke literatuur komt namelijk naar voren dat patiënten met weinig sociale steun een hogere cardiale morbiditeit en mortaliteit, een hogere kans op depressie en een lagere kwaliteit van leven hebben.
Algemene gegevens
De herzieningen uit 2011 zijn geautoriseerd / geaccepteerd door:
- De Hart&Vaatgroep
- NVHVV
- NVVA
Doel en doelgroep
Doel
De Richtlijn Hartrevalidatie is in 1996 voor het eerst verschenen. In 2004 werd het nut ervan als volgt omschreven:
Richtlijnen leveren op drie niveaus een belangrijke bijdrage aan het verbeteren van de zorg voor hartpatiënten:
- Ze bieden een onderbouwing van het nut van hartrevalidatie.
- Ze leiden tot standaardisatie van de zorg bij hartrevalidatie, naast een op het individu toegesneden aanpak.
- Ze benadrukken het belang van een multidisciplinaire aanpak voor hartrevalidatie, waarbij hartrevalidatie zich niet beperkt tot training, maar ook psychische counseling en secundaire preventie omvat.
Er is inmiddels overtuigend bewijs voor de positieve effecten van hartrevalidatie in termen van verminderde morbiditeit, mortaliteit, verbeterde kwaliteit van leven en kosteneffectiviteit. Ades 1997, Oldridge 1997, Lowensteyn 2000, Papdakis 2005, Lee 2007, Piepoli 2010 Richtlijnen bevorderen de implementatie van hartrevalidatie.
Recent heeft de Cardiac Rehabilitation Section van de European Association of Cardiovascular Prevention and Rehabilitationeen position paperopgesteld waarin zij praktische aanbevelingen geeft met betrekking tot de kerncomponenten van hartrevalidatie Piepoli 2010. De huidige richtlijn sluit aan bij deze aanbevelingen, maar is gebaseerd op nieuwe literatuurstudies.
Doelgroep
Het proces van hartrevalidatie is een bij uitstek multidisciplinaire aangelegenheid. Bij de hartrevalidatie zijn vele zorgverlenende deskundigen betrokken, zoals cardiologen, revalidatieartsen, huisartsen, bedrijfsartsen, inspanningsfysiologen, verpleegkundigen, diëtisten, psychologen, maatschappelijk werkers, fysiotherapeuten, bewegingsagogen, ergotherapeuten, psychiaters, verzekeringsartsen en arbeidsdeskundigen. Alle betrokkenen kunnen gebruik maken van deze richtlijn. Ook patiëntenverenigingen kunnen baat hebben bij de informatie in deze richtlijn, hoewel voor patiënten een specifieke patiëntenrichtlijn ontwikkeld zal worden (zie www.hartenvaatgroep.nl).
Samenstelling werkgroep
Auteurs herziening 2011 met betrekking tot psychische en sociale doelen (naast oorspronkelijke auteurs richtlijn 2004)
- Inleiding: Richtlijn 2004: drs. P.J. Senden; herziening 2011: mw. dr. A.E. de Rijk
- Kosteneffectiviteit herziening 2011: drs. A.M.W. van Stipdonk, mw. dr. S. Evers
- Doorverwijzing naar de cardioloog: Richtlijn 2004: dr. J. Brügemann, drs. H.J. van Exel; herziening 2011: drs. A.M.W. van Stipdonk, mw. dr. P.M.J.C. Kuijpers, mw. dr. A.E. de Rijk, prof. dr. A. Gorgels en projectgroep PAAHR
- Revalidatie op maat (de doelen): Richtlijn 2004: mw. dr. M. Chatrou, mw. J.A. Lestra, drs. M.W.A. Jongert,dhr. H. Koers, dhr. S. van der Voort; herziening 2011: mw. dr. A.E. de Rijk, drs. A.M.W. van Stipdonk en projectgroep PAAHR
- Revalidatie op maat (hulpmiddelen indicatiestelling): Richtlijn 2004: mw. dr. M. Chatrou, mw. prof. dr. Th. van Elderen, mw. J.A.Lestra, drs. M.W.A. Jongert, dhr. H. Koers, mw. drs. A.M. Strijbis, dhr. S. van der Voort; herziening 2011: mw. dr. A.E. de Rijk, drs. A.M.W. van Stipdonk, mw. dr. P.M.J.C. Kuijpers en projectgroep PAAHR
- Interventies: Richtlijn 2004: mw. dr. M. Chatrou, drs. J.L. van Dijk, dr. J.J. van Dixhoorn,mw. J.A. Lestra, dhr. H. Koers, drs. M.W.A. Jongert, dhr. S. van der Voort; herziening 2011: drs. A.M.W. van Stipdonk, mw. dr. A.E. de Rijk, mw. dr. P.M.J.C. Kuijpers, projectgroep PAAHR (par. 5.3); mw. dr. A.E. de Rijk, drs. A.M.W. van Stipdonk, mw. dr. P.M.J.C. Kuijpers, drs. J. van Dijk en overige leden projectgroep PAAHR (par. 5.4)
- Hartfalen: Richtlijn 2004: drs. P.J. Senden
- Bijzondere diagnosegroepen: Richtlijn 2004: dr. J. Brügemann; herziening 2011: drs. A.M.W. van Stipdonk,mw. dr. P.M.J.C. Kuijpers, prof. dr. A. Gorgels, mw. dr. A.E. de Rijk en projectgroep PAAHR
- Klinische hartrevalidatie: Richtlijn 2004: dr. J. Brügemann, drs. M.H. Oosterwijk
- Overgang naar nazorg: (in 2011 toegevoegd) mw. dr. A.E. de Rijk, drs. A.M.W. van Stipdonk, mw. dr.P.M.J.C. Kuijpers, mw. dr. M. Bouma en projectgroep PAAHR
- Implementatie: (in 2011 toegevoegd) mw. dr. A.E. de Rijk
Werkgroep PAAHR (Psychische en Arbeidsgerelateerde Aspecten van
HartRevalidatie) ten behoeve van de herziening 2011 met betrekking tot psychische en sociale doelen
- dhr. H. Koers, fysiotherapeut, KNGF-VHVL, Amersfoort (lid PAAHR vanaf 2008)
- drs. A.M.T.M. Derks, revalidatiearts, VRA, Utrecht (lid PAAHR vanaf 2008)
- dhr. dr. C.H.Z. Kuiper, lector participatie, ergotherapeut, Ergotherapie Nederland, Utrecht(lid PAAHR vanaf 2008)
- mw. drs. I. van den Broek, adviseur belangenbehartiging, De Hart&Vaatgroep,Soesterberg (lid PAAHR vanaf 2008)
- dhr. mr. J.A.M. Wijnekus, arbeidsdeskundige NVAA, Nijkerk (lid PAAHR vanaf 2008)
- mw. drs. G. Casteelen, psychiater, NVVP, Utrecht (lid PAAHR vanaf 2009)
- dhr. dr. R.A. Kraaijenhagen, cardioloog, NVVC, Utrecht (lid PAAHR vanaf 2008)
- mw. drs. E.H.N. Stoffers, adviseur, Huis voor de zorg, Sittard (lid PAAHR vanaf 2008)
- dhr. dr. P.R.J. Falger, GZ-psycholoog, Maastricht University, Maastricht (lid PAAHR vanaf2008)
- mw. ir. K.T. Idema, adviseur belangenbehartiging, De Hart&Vaatgroep, Soesterberg (lidPAAHR vanaf 2008 tot 2009)
- mw. E.R. Geleijnse, maatschappelijk werker Capri Hartrevalidatie Rotterdam, NVMW/LOMH, Utrecht (lid PAAHR vanaf 2008)
- mw. C.E. Muller-Grijzenhout, verpleegkundig coördinator hartrevalidatie, Sint FranciscusGasthuis, Rotterdam (lid PAAHR vanaf 2009)
- mw. J.J. Doornenbal, gedifferentieërd hart- en vaatverpleegkundige en verpleegkundig coördinator hartrevalidatie, Academisch Medisch Centrum, Amsterdam (lid PAAHR vanaf 2009)
Namens de revalidatiecommissie (richtlijn 2004):
- drs. P.J. Senden, cardioloog, Meander Medisch Centrum, Amersfoort (voorzitter revalidatiecommissie vanaf 1997)
- mw. drs. A.M. Strijbis, secretaris, Nederlandse Hartstichting, Den Haag (lid revalidatiecommissie vanaf 1998)
Werkgroep bijzondere diagnosegroepen (richtlijn 2004)
- dr. J. Brügemann, cardioloog, Academisch Ziekenhuis Groningen, Groningen (lid revalidatiecommissie vanaf 1997)
- drs. H.J. van Exel, cardioloog, Rijnlands Revalidatiecentrum, Leiden (lid revalidatiecommissie vanaf 2001)
- mw. E. Schück, verpleegkundige, Isala Klinieken locatie Weezenlanden, Zwolle (lid revalidatiecommissie van 1999 t/m 2002)
- Adviseurprof. dr. W.A. Helbing, kindercardioloog, Erasmus Medisch Centrum/ Sophia Kinderziekenhuis, Rotterdam
Werkgroep psychosociale ondersteuning en secundaire preventie (richtlijn 2004)
- drs. E.L.D. Angenot, revalidatiearts, Revalidatiecentrum Amsterdam, Amsterdam (lidrevalidatiecommissie van 1996 t/m 2002)
- mw. dr. M. Chatrou, psycholoog, Máxima Medisch Centrum, Eindhoven (lid revalidatiecommissie vanaf 2001)
- drs. J.L. van Dijk, bedrijfsarts, Achmea-Arbo, Amsterdam (lid revalidatiecommissie vanaf2001)
- mw. E.R. Geleijnse, maatschappelijk werkster, Rotterdamse Stichting voorCardiologische Revalidatie (lid revalidatiecommissie van 1994 t/m 2002)
- mw. dr. I.M. Hellemans, cardioloog, Alant Cardio, (lid revalidatiecommissie vanaf 1997)
- drs. J.A.M. Hoevenaar, huisarts, Elsendorp (lid revalidatiecommissie vanaf 2001)
- mw. J.A. Iestra, diëtist, Universitair Medisch Centrum, Utrecht (lid revalidatiecommissievanaf 1999)
- drs. H.C.A.M. Kruijssen, cardioloog, Academisch Ziekenhuis Rotterdam, Rotterdam (lidrevalidatiecommissie vanaf 1984)
- drs. E.C. de Melker, cardioloog, Sint Lucas Andreas ziekenhuis, Amsterdam (lid revalidatiecommissie vanaf 2001)
- mw. P.M. Muns, maatschappelijk werker, Universitair Medisch Centrum, Utrecht (lidrevalidatiecommissie vanaf 2003)
- Adviseurs
- mw. ir. S.J. van Dis, epidemioloog, Nederlandse Hartstichting, Den Haag drs. F. Duysens, psycholoog, Centrum voor Hart- en Longrevalidatie Rijnlands Revalidatiecentrum, Leiden
- mw. prof. dr. Th. van Elderen, psycholoog, Klinische en Gezondheidspsychologie, Universiteit Leiden (lid revalidatiecommissie van 1992 t/m 2000) mw. drs. I. Kersten, psycholoog, Sint Lucas Andreas Ziekenhuis, Amsterdam dhr. H. Koers, fysiotherapeut/ manueel therapeut, Groene Hart Ziekenhuis, Gouda (lid revalidatiecommissie van 1994 t/m 2000)
- mw. A.B. Nieuwveld, verpleegkundig consulent cardiologie, Isala Klinieken locatie Weezenlanden, Zwolle
Werkgroep lichamelijke activiteit en hartfalen (richtlijn 2004)
- drs. E.L.D. Angenot, revalidatiearts, Revalidatiecentrum Amsterdam (lid revalidatiecommissie van 1996 t/m 2002)
- dr. J. Brügemann, cardioloog, Academisch Ziekenhuis Groningen, Groningen (lid revalidatiecommissie vanaf 1997)
- drs. W.A.J. Bruggeling, cardioloog, Amphiaziekenhuis locatie Pasteurlaan, Oosterhout (lidrevalidatiecommissie vanaf 2001)
- drs. H.J. van Exel, cardioloog, Centrum voor Hart- en Longrevalidatie RijnlandsRevalidatiecentrum, Leiden (lid revalidatiecommissie vanaf 2001)
- drs. J.A.M. Hoevenaar, huisarts, Elsendorp (lid revalidatiecommissie vanaf 2001)
- drs. P.J. Senden, cardioloog, Meander Medisch Centrum, Amersfoort (voorzitter revalidatiecommissie vanaf 1997)
- drs. E.P. Viergever, cardioloog, Groene Hart Ziekenhuis, Gouda (lid revalidatiecommissievanaf 2001)
- dhr. S. van der Voort, fysiotherapeut, Hart-, Long-, Vaatrevalidatie Zonnestraal,Ziekenhuis Hilversum (lid revalidatiecommissie vanaf 2001)
- Adviseursmw. dr. H.J.G. van den Berg-Emons, bewegingswetenschapper, Erasmus Medisch Centrum, Rotterdam
- dr. J.J. van Dixhoorn, arts/ ontspanningstherapeut, Kennemer Gasthuis, locatie Deo, Haarlem
- drs. E. Hulzebos, fysiotherapeut/gezondheidswetenschapper, Universitair Medisch Centrum, Utrecht drs. M.W.A. Jongert, inspanningsfysioloog, TNO Preventie en Gezondheid, Leiden dhr. H. Koers, fysiotherapeut/ manueel therapeut, Gouda (lid revalidatiecommissie van
- 1994 t/m 2000) mw. P.M. Rijke-van Zeijl, diëtist, Leids Universitair Medisch Centrum mw. dr. M.L. Zonderland, medisch fysioloog, Universitair Medisch Centrum, Utrecht
Met dank voor hun deskundige advies (richtlijn 2004)
- drs. A.M.T.M. Derks, revalidatiearts, Stichting Revalidatie Limburg, RevalidatiecentrumHoensbroeck, Hoensbroek (lid revalidatiecommissie vanaf 2003)
- dr. J.W. Deckers, cardioloog, coördinator richtlijnen NVVC
- mw. dr. I.C. van Gelder, cardioloog, Academisch Ziekenhuis Groningen, Groningen
- drs. R. Goud, medisch informatiekundige, Academisch Medisch Centrum, Amsterdam
- prof. dr. D.E. Grobbee, klinisch epidemioloog, Julius Centrum voor Gezondheidsweten-schappen en Eerstelijns Geneeskunde, Universitair Medisch Centrum, Utrecht
- mw. C.J. Koppelaar, verpleegkundig onderzoeker, Erasmus Medisch Centrum,Rotterdam (lid revalidatiecommissie vanaf 2003)
- prof. dr. ir. D. Kromhout, directeur sector Voeding en Consumenten VeiligheidRijksinstituut voor Volksgezondheid en Milieu (RIVM), Bilthoven
- prof. dr. J. Perk, cardioloog, streekziekenhuis Oskarshamn, Zweden, lid van “3rd JointEuropean Societies Task Force on Preventive Cardiology”
- dr. A. Vermeulen, cardioloog, niet praktiserend (lid revalidatiecommissie vanaf 1984)
- mw. drs. M.H.L. van der Wal, verpleegkundige, onderzoeker COACH (lid revalidatiecommissie van 1995 t/m 1998)
Commentatoren herziening 2011
- drs. J. Brügemann, cardioloog, Thoraxcentrum / Cardiologie, Universitair MedischCentrum Groningen, Groningen
- drs. G.A.H.M Castermans, huisarts, vertegenwoordiger RHZ Hart en Vaatcentrum AZM,lid werkgroep Vasculair Risicomanagement, Stichting RHZ Heuvelland, Maastricht
- mw. Y.M.C.H. Curfs, ergotherapeut, Adelante zorggroep, Hoensbroek
- De Hart&Vaatgroep, Soesterberg
- Ergotherapie Nederland, Utrecht
- drs. A.H.M. van Erp, psycholoog en programmacoördinator ‘Hart voor Mensen’,Nederlandse Hartstichting, Den Haag
- drs. H.J. van Exel, cardioloog, centrum voor Hart- en Longrevalidatie, Rijnlands
- Revalidatie Centrum, Leiden (lid commissie Cardiovasculaire Preventie en Hartrevalidatie van de Nederlandse Vereniging voor Cardiologie)
- mw. dr. J. Fleer, psycholoog en onderzoeker, Universitair Medisch Centrum Groningen,afdeling Gezondheidswetenschappen, sectie Gezondheidspsychologie, Groningen
- mw. drs. M.M. van Engen-Verheul, gezondheidswetenschapper en promovenda, VakgroepKlinische Informatiekunde, Academisch Medische Centrum Amsterdam
- mw. dr. I.M. Hellemans, cardioloog (lid commissie Cardiovasculaire Preventie enHartrevalidatie van de Nederlandse Vereniging voor Cardiologie)
- Huis voor de Zorg, Sittard
- mw. dr. A. Huizing, gezondheidswetenschapper en cöordinator eerstelijnsketen DBC,stichting RHZ Heuvelland, Maastricht
- H.M.C. Kemps, cardioloog, Cardiologie, Maxima Medisch Centrum, Veldhoven (lid commissie Cardiovasculaire Preventie en Hartrevalidatie van de Nederlandse Vereniging voor Cardiologie)
- mw. drs. A.B.A. Klabbers, gezondheidswetenschapper en promovenda, vakgroep Sociale
- Geneeskunde / onderzoeksschool CAPHRI, Faculty of Health, Medicine & Life Sciences, Universiteit Maastricht, Maastricht
- mw. prof. mr. S. Klosse, jurist en hoogleraar Sociaal Recht, Faculteit der
- Rechtsgeleerdheid, Capaciteitsgroep Publiekrecht, Universiteit Maastricht, Maastricht
- Kwaliteitsbureau Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde, Utrecht
- prof. dr. C.M.J.G. Maes, psycholoog en hoogleraar Gezondheidspsychologie, InstituutPsychologie, Faculteit der Sociale wetenschappen, Universiteit Leiden
- Nederlands Huisarts Genootschap, Utrecht
- Nederlands Instituut van Psychologen, Amsterdam
- Nederlandse Vereniging van Revalidatie Artsen (VRA), Utrecht
- Nederlandse Vereniging voor Hart en Vaat Verpleegkundigen, Woerden
- dr. N.B. Peek, medisch informaticus en projectleider CARDSS, Vakgroep KlinischeInformatiekunde, Academisch Medische Centrum Amsterdam, Amsterdam
- drs. R.Y. Schouten, psycholoog en projectmanager ‘Hart voor Mensen’, NederlandseHartstichting, Den Haag
- prof. dr. A. Honig, psychiater, afdeling psychiatrie, Sint Lucas Andreas Ziekenhuis,Amsterdam
- prof. dr. P. de Jonge, vakgroep Medische psychologie en Neuropsychologie, Faculteit
- Sociale Wetenschappen, Tilburg University, Tilburg
- Nederlandse Vereniging van Maatschappelijk Werkers, Utrecht
- Nederlandse Vereniging voor Verzekeringsgeneeskunde, Utrecht
- Prof. dr. A.H. Schene, psychiater, afdeling Psychiatrie, Academisch Medisch CentrumAmsterdam
Met dank voor hun deelname aan interviews over hartrevalidatie (herziening 2011)
- Respondenten en hun partners die deelnamen aan de achterbanconsultatie in het kadervan PAAHR door de Hart&Vaatgroep
- Het hartrevalidatieteam van het Maastricht Universitair Medisch Centrum + (MUMC+)
Methode ontwikkeling
Evidence based
Implementatie
Ter bevordering van de implementatie van deze richtlijn, zijn de volgende implementatiehulpmiddelen ontwikkeld:
- Algoritmen, gebaseerd op algoritmen gepubliceerd bij de Europese richtlijn (aangepast na de update) (zie bijlagen “Flowchart”);
- Indicatoren (te vinden op de website van de NVU) (zie bijlage Indicatoren);
- Een vormgegeven samenvatting (aangepast na de update) (zie bijlage Samenvattingskaart);
- Een samenvatting voor patiënten (aangepast na de update) (zie bijlage Samenvatting voor Patiënten);
- Een artikel voor de Prostaatkankerstichting
Tevens is een artikel voor het Tijdschrift voor Urologie geschreven. Daarnaast adviseert de Werkgroep om lokale behandelprotocollen zoveel mogelijk te baseren op deze Richtlijn, rekening houdende met de lokale situatie.
Werkwijze
Wetenschappelijke onderbouwing
De conclusies en aanbevelingen in deze richtlijn zijn onderbouwd met wetenschappelijk onderzoek. Bij de herziening in 2004 heeft de revalidatiecommissie de onderzoeksresultaten gewogen en afhankelijk van de mate van bewijskracht is aan de conclusies en aanbevelingen een niveau van bewijskracht toegekend. Daarbij is een indeling in drie niveaus gehanteerd (A, B en C).
Daarnaast kan over een conclusie of aanbeveling meer of minder consensus bestaan over het nut/de effectiviteit van behandelen. Aan het niveau van bewijskracht is een indeling in twee klassen (I en II) toegevoegd over de mate van acceptatie van behandelen. Klasse II is onderverdeeld in a en b, hetgeen een extra aanduiding is voor de mate van acceptatie bij een verdeelde mening. Deze indeling in niveaus en klassen is in overeenstemming met de criteria van de European Society of Cardiology.
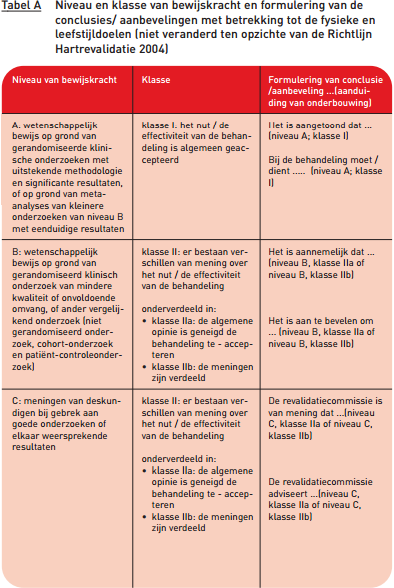

De formulering van de conclusies en aanbevelingen is aangepast aan het niveau van uit wetenschappelijk onderzoek verkregen bewijskracht (zie tabel A).
Voor de delen herzien in 2011 is uitgegaan van nieuwe standaarden voor richtlijnontwikkeling. CBO 2007 Eerst zijn knelpunten geformuleerd en geprioriteerd. Naar aanleiding daarvan zijn uitgangsvragen voor de literatuurstudies geformuleerd. In de literatuurstudies is de literatuur stapsgewijs geselecteerd (zie ‘Werkwijze project PAAHR’ op https://www.nvvc.nl/richtlijnen/bestaande-richtlijnen#risicomanagement). Aan de conclusies uit de wetenschappelijke literatuur is een niveau van bewijskracht toegekend, dat aangeeft hoe goed de conclusie door het wetenschappelijke onderzoek wordt onderbouwd. Als bijvoorbeeld de uitkomsten tegenstrijdig zijn, dan is een conclusie daaruit minder goed onderbouwd dan bij uitkomsten die overeenkomen. Hiertoe is eerst de methodologische kwaliteit van individuele kwantitatieve studies bepaald (A1, A2, B, C of D; waarbij A voor de hoogste kwaliteit staat en D voor de laagste kwaliteit) (zie bijlage Kwaliteitscriteria). Vervolgens zijn conclusies opgesteld op basis van meerdere studies en is daar een bepaald niveau van bewijskracht aan toegekend. Die niveaus van bewijskracht zijn weergegeven in tabel B. In vergelijking met de niveaus zoals gehanteerd in 2004, hebben de niveaus gehanteerd in 2011 dus alleen betrekking op de conclusies uit de literatuur en niet op de aanbevelingen die daaruit afgeleid zijn.
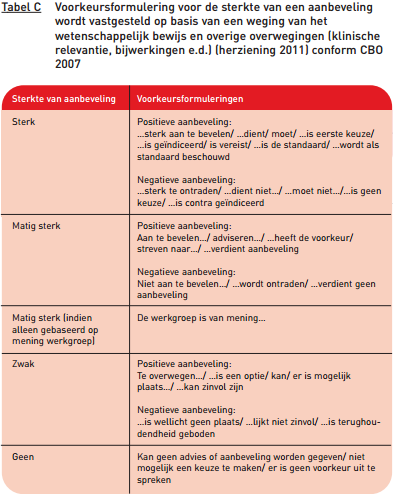
Aanbevelingen zijn gevormd op basis van 1) de conclusies uit de wetenschappelijke literatuur en 2) overige overwegingen van de projectgroep. Voorbeelden van overige overwegingen zijn: klinische relevantie, schade of bijwerkingen, de beschikbaarheid van voorzieningen, de kosten van zorg, de organisatie van zorg, patiëntenperspectief, professioneel perspectief, juridische aspecten, en ethische aspecten. De formulering van de aanbevelingen geeft de sterkte van de aanbeveling weer, dit is weergegeven in tabel C. CBO 2007
Kosteneffectiviteit hartrevalidatie
Al langere tijd is bekend dat de meeste economische evaluaties van hartrevalidatie laten zien dat hartrevalidatie een kosteneffectieve behandeling is. Oldridge 1998, Ades 2001, Piepoli 2010 In het kader van de vernieuwing van de richtlijn in
2011, is een literatuuronderzoek uitgevoerd naar de effecten van hartrevalidatie
en interventies met betrekking tot de psychische en sociale doelen in het bijzonder.
In totaal zijn 24 studies gevonden met betrekking tot kosteneffectiviteit van hartrevalidatie. Op basis van vijf systematische reviews Ades 1997, Oldridge 1997,
Lowensteyn 2000, Papdakis 2005, Lee 2007 en een meer recente studie Kruse 2006 van matige tot goede kwaliteit kan geconcludeerd worden dat zowel hartrevalidatie in multidisciplinaire vorm (met name secundaire preventie en bewegingsprogramma’s) als ook bewegingsprogramma’s kosteneffectief zijn voor patiënten met coronaire hartziekten. Dit wordt vooral verklaard door vermindering van het aantal cardiovasculaire opnames en een kortere opnameduur.
Er zitten echter beperkingen aan deze conclusie. De studies zijn erg divers met betrekking tot:
- onderzochte indicatoren voor kosteneffectiviteit (cardiovasculaire en andereheropnames; jaren tot overlijden; bezoek eerste hulp en polikliniek; behandelingen; functioneel herstel en kwaliteit van leven; stijging van levensverwachting in aantal jaren goede gezondheid (Quality Adjusted Life Years, QALYs))
- berekende kosten (directe, tijdgebonden kosten evaluatie van alle separatekostenposten, alleen kosten interventies en kosten specifieke uitkomstmaat).
Deze diversiteit vermindert de vergelijkbaarheid van de studies. Oldridge 1997, Papadakis 2005, Lee 2007 Voorts zijn in de bepaling van de kosteneffectiviteit maatschappelijke kosten (kosten door verminderde hervatting van betaald werk wanneer er geen revalidatie plaatsvond) niet meegenomen.
Voor de overige interventies en de meer uitgebreide multidisciplinaire interventies zijn onvoldoende kwalitatief goede studies gevonden om de kosteneffectiviteit goed te kunnen beoordelen. Begeleiding bij psychische symptomen en bij arbeidsre-integratie leiden tot matige kosteneffectiviteit, maar waarschijnlijk worden de effecten onderschat door een te korte follow-up en andere methodologische beperkingen Southard 2003, Yu 2004, Briffa 2005, Turner 2008
Hierover is wel meer bekend bij patiënten met hartfalen. Bij deze groep blijkt dat een uitgebreide multidisciplinaire aanpak met psychosociale begeleiding en ontslagbegeleiding kostenbesparend is, met name door vermindering van het aantal opnames, en verkorting van de opnameduur van nieuwe opnames. Rich 1995, Riegel 2000, O’Connell 2001, Kasper 2002, Capomolla 2002, Krumholz 2002, Turner 2008 Er zijn geen betrouwbare gegevens gevonden met betrekking tot patiënten die een omleidingsoperatie (Coronary Artery Bypass Grafting (CABG), ook wel genoemd: bypassoperatie) hebben ondergaan. Penque 1999 Bij de specifiekere groep van hartpatiënten met depressieve symptomen en/of angstsymptomen zijn er bemoedigende resultaten met betrekking tot kosteneffectiviteit van hartrevalidatie, zowel hartrevalidatie in het algemeen als hartrevalidatie met interventies specifiek gericht op deze symptomen. Oldridge 1993, O’Connor 2001, Lee 2007 Uit meerdere studies blijkt dat hartpatiënten (zowel patiënten met coronaire hartziekten als met hartfalen) met een hoog risico op complicaties (in termen van behandelingen en heropnames) meer baat hebben bij hartrevalidatie. Hierdoor is de kosteneffectiviteit bij hartpatiënten met een laag risico minder of niet kosteneffectief. Riegel 2000, O’Connell 2001, Hall 2002, Kaspar 2002 Dit onderstreept het belang van screening (zie ook Revalidatie op maat (hulpmiddelen indicatiestelling)).
Noord-Amerikaanse studies geven aanwijzingen voor de kosteneffectiviteit van poliklinische hartrevalidatie versus klinische hartrevalidatie Rich 1995, Robertson 2001, Naylor 2004, Lee 2007, Taylor 2007, Turner 2008. Hierbij moet opgemerkt worden dat de patiëntenpopulaties voor klinische hartrevalidatie verschillen van die in Nederland, waar klinische hartrevalidatie alleen voor complexe gevallen geïndiceerd is.
Concluderend zijn er voldoende aanwijzingen dat de in deze richtlijn beschreven hartrevalidatie kosteneffectief is, hoewel meer onderzoek wenselijk is.
Hoe is deze richtlijn opgebouwd?
Deze richtlijn volgt min of meer chronologisch het traject van zorg voor hartrevalidatie zoals dat grafisch is weergegeven in de figuurmodel voor Hartrevalidatie in de Inleiding.
De doorverwijzing door de cardioloog wordt in de module Doorverwijzing Cardioloog beschreven. Alle patiënten moeten door een cardioloog naar hartrevalidatie worden doorverwezen. In de module Doorverwijzing Cardioloog wordt beschreven welke patiënten voor hartrevalidatie in aanmerking komen.
Welke doelen kunnen worden vastgesteld bij een individuele patiënt, wordt in de module Revalidatie op maat (doelen) beschreven. Hartrevalidatie kent vier hoofddoelen: (1) fysieke doelen, (2) psychische doelen, (3) sociale doelen en (4) beïnvloeden van risicogedrag (leefstijldoelen). Hartrevalidatie wordt op maat aangeboden. Dat betekent dat per patiënt vastgesteld wordt wat de doelen voor die patiënt zijn, en welke interventies aangeboden worden.
Hoe de doelen bij een individuele patiënt vastgesteld worden, wordt in de module Revalidatie op maat (hulpmiddelen indicatiestelling) beschreven. Daarin komen de volgende hulpmiddelen bij de indicatiestelling aan bod: het intakegesprek, de beslisboom en het multidisciplinair overleg. De beslisboom is een hulpmiddel om aan de hand van screening vast te kunnen stellen welke interventies geïndiceerd zijn.
De interventies die binnen hartrevalidatie aangeboden kunnen worden, worden per hoofddoel beschreven in de module Interventies. Binnen hartrevalidatie worden groepsinterventies aangeboden, maar het is ook mogelijk om patiënten door te verwijzen voor individuele behandeling. Nadere diagnostiek kan onderdeel uitmaken van de individuele behandeling. Screening, zoals beschreven in de module Revalidatie op maat (doelen), geeft slechts aan of er een verhoogde kans is op bijvoorbeeld een depressieve stoornis. Met diagnostiek kan vastgesteld worden welke aandoening een patiënt heeft en hoe de individuele behandeling vorm moet krijgen. In de module Interventies wordt ook beschreven hoe de evaluatie van de interventies die zijn aangeboden binnen hartrevalidatie moet plaatsvinden.
De module Hartfalen is gewijd aan hartfalen. De module Bijzondere diagnosegroepen is gewijd aan bijzondere diagnosegroepen en de module Klinische Hartrevalidatie aan klinische hartrevalidatie.
Tenslotte wordt in de module 'Overgang naar zorg' de nazorg beschreven. Hierin staat, conform de transmurale afspraken, de overdracht naar de huisarts centraal.
De referenties zijn weergegeven in een digitale referentielijst die te vinden is op de website van de NVVC (https://www.nvvc.nl/richtlijnen/bestaande-richtlijnen#risicomanagement). De bijlage Afkortingen en begrippen bevat een lijst met afkortingen en begrippen.
Hoewel we ons ervan bewust zijn dat de vrouwelijke hartpatiënt meer aandacht behoeft, zullen patiënten in deze richtlijn als ‘hij’ worden aangeduid. Daar waar ‘hij’ of ‘zijn’ staat, kan met evenveel reden ‘zij’ of ‘haar’ gelezen worden, tenzij specifiek is aangegeven dat de gegevens alleen op mannen betrekking hebben.
Als de gegevens specifiek op vrouwen betrekking hebben, is dat ook aangegeven.
We volgen hiermee de keuze die in de Richtlijn Hartrevalidatie 2004 is gemaakt.
