Anesthesie bij chirurgische ingreep bij hallux valgus
Uitgangsvraag
Wat is de effectiviteit (pijn (scores), bijwerkingen, ontslagtijd, kosten, patiënttevredenheid, opioid consumptie) van zenuwblokkade versus spinale anesthesie en algehele anesthesie bij chirurgische ingreep van hallux valgus?
Aanbeveling
Pas voor hallux valgus chirurgie bij voorkeur een anesthesievorm toe die gebruik maakt van zenuw (poplitea, enkel, midvoet) blokkade, al dan niet in combinatie met algehele of spinale anesthesie.
Overweeg postoperatief vragenlijsten (na 6 en/of 12 maanden).
Overwegingen
Voor een snelle en veilige mobilisatie na hallux valgus chirurgie is adequate analgesie nodig. De anesthesievormen die dit kunnen bewerkstelligen, dienen daarnaast een gunstig profiel te hebben qua bijwerkingen en dienen bij te dragen aan veilige en idealiter vlotte mobilisatie zonder risico op vallen.
Vergelijkende studies tussen de eerder genoemde anesthesievormen geven aan dat de analgesie beter is na chirurgische ingrepen aan enkel en voet inclusief hallux valgus chirurgie onder zenuwblokkade, al dan niet gecombineerd met algehele of spinale anesthesie dan na algehele anesthesie alleen. De opioidconsumptie is navenant lager (White 2003, Zaric, 2004). Enkelblokkade heeft mogelijk een betere analgesie dan algehele of spinale anesthesie (Kullenberg 2006) met mogelijk een lagere opioidconsumptie (Kullenberg 2006, Clough 2003). Blokkade op midvoetniveau geeft een analgesie die vergelijkbaar is met perifere zenuwblokkade al dan niet gecombineerd met algehele anesthesie; de opioidconsumptie is vergelijkbaar (Adam, 2012, Migues 2005). Het gebruik van bloedleegte met tourniquets wordt in geen van voornoemde studies expliciet vermeld.
Patiënten geven aan dat zij even tevreden zijn over zenuwblokkade, al dan niet gecombineerd met algehele of spinale anesthesie als met enkel- of midvoetblokkade (Adam, 2012; Migues 2005). Patiënten geven aan tevredener te zijn na hallux valgus chirurgie onder een poplitablokkade al dan niet gecombineerd met algehele of spinale anesthesie dan na algehele anesthesie alleen (White 2003; Zaric 2004). De conclusie op pagina 115 is gebaseerd op de studies van White en Zaric uit respectievelijk 2003 en 2004. In deze studies werd de popliteablokkade verricht met behulp van zenuwstimulatie. Tegenwoordig is het gebruik van ultrageluid bij perifere zenuwblokkades in de meeste Nederlandse ziekenhuizen routine en diverse publicaties van de laatste tien jaar tonen aan dat echogeleide perifere zenuwblokkade gepaard gaat met een snellere onset, een hoger succespercentage en langere werkingsduur. Het plaatsen van een popliteakatheter bij halluxchirurgie is in Nederland geen usance. Een zgn single dosis van levobupivacaine (chirocaine of ropivacaine) wordt gegeven met een werkingsduur van 1-2 dagen, meestal ruim voldoende om bij het merendeel van de patienten opioidconsumptie te voorkomen. Patiënten zijn mogelijk tevredener na hallux valgus chirurgie onder poplitea blokkade dan onder spinale anesthesie (Jeon, 2013).
Vergelijking tussen voornoemde anesthesievormen lijkt geen verschil te geven in tijd tot ontslag uit het ziekenhuis en/of tijd tot het mogelijk is zonder hulpmiddelen te lopen. Mogelijk leidt enkel- en voetchirurgie onder een enkelblok tot een kortere tijd tot ontslag en lopen zonder hulpmiddelen dan algehele of spinale anesthesie (Kullenberg 2006). Als patiënten goed geïnstrueerd zijn over gebruik van krukken, treedt vallen niet of nauwelijks op (Capdevila 2006, Lee 2014). Over het algemeen is de hallux populatie zo jong dat vallen als uiting van comorbiditeit nauwelijks een issue is.
Over bijwerkingen zoals het risico van vallen wordt in de diverse studies niet of nauwelijks gerapporteerd. Geen van voornoemde studies rapporteerde over kosten. Het zetten van een popliteablok duurt in handen van een ervaren anesthesioloog 5-10 minuten, een tijdsduur die vergelijkbaar is met die van een midvoet- of enkelblok.
Onderbouwing
Achtergrond
Chirurgie aan de voet en enkel wordt vaak poliklinisch of in dagbehandeling toegepast. Een ideale anesthesie van deze procedures leidt daarom voor een snel herstel van de patiënt, behoeft zo min mogelijk zorg op de post-anesthesie unit, en maakt een vroeg ontslag uit het ziekenhuis mogelijk. Het moet echter ook zorgen voor betrouwbare postoperatieve analgesie, vooral omdat ingrepen aan de voet er om bekend staan matig- tot ernstige pijn te veroorzaken (Adam, 2012).
In de praktijk wordt meestal een zenuwblokkade (n.poplitea) uitgevoerd, meestal in combinatie met algehele anesthesie of spinaal anesthesie ter bestrijding van de pijn die optreedt na aanleggen van bloedleegte rond boven- of onderbeen. Het is de vraag of het verantwoord is patiënten na poplitea blokkade te ontslaan uit het ziekenhuis, vooral (oudere) patiënten die moeilijkheden hebben met het lopen (op krukken). Doordat de proprioceptie en beschermende pijn-reflex afwezig zijn lopen patiënten risico op vallen, trauma, problemen met lopen en beschadiging van de voet op de plaats van de ingreep. Zenuwblokkade via infiltratie-anesthesie of via zenuwblokkade (enkelblok) worden in enkele klinieken, vooral in het buitenland uitgevoerd. Daarbij blijft het probleem van pijn door de bloedleegte band om het bovenbeen, dat opgelost kan worden door de band om het onderbeen aan te leggen. Omdat het enkelblok in Nederland toegepast wordt, wordt ook deze blokkade beschreven.
Het doel van deze module is om inzicht te verschaffen in de mogelijkheden voor anesthesie bij de chirurgische ingreep van hallux valgus, en de indicatie voor de verschillende opties.
De mogelijkheden voor pijnstilling tijdens hallux valgus chirurgie zijn:
-
Perifere zenuwblokkade: poplitea- met saphenus- of femoralisblokkade, al of niet in combinatie met sedatie
-
Perifere zenuwblokkade (popliteablokkade) met algehele anesthesie
-
Perifere zenuwblokkade (popliteablokkade) met spinale anesthesie
-
Perifere zenuwblokkade: enkel blok al dan niet in combinatie met algehele anesthesie of spinale anesthesie;
-
blokkade ter hoogte van de middenvoet (midvoetblok);
-
spinale anesthesie;
-
algehele anesthesie.
Conclusies / Summary of Findings
Algehele anesthesie versus algehele anesthesie met enkelblok
|
Matig GRADE |
Het is waarschijnlijk dat patiënten kort na de operatie vergelijkbare pijn hebben na algehele anesthesie en algehele anesthesie in combinatie met een enkelblok.
Het is mogelijk dat patiënten na alleen algehele anesthesie minder lang pijnvrij zijn na de operatie.
Bronnen (Clough, 2003; Turan, 2007) |
|
Laag GRADE |
Er zijn te weinig gegevens om een conclusie te trekken over het voorkomen van complicaties na algehele anesthesie versus algehele anesthesie met enkelblok.
Bronnen (Clough, 2003; Turan, 2007) |
|
Laag GRADE |
De patiënttevredenheid lijkt na algehele anesthesie en algehele anesthesie plus enkel blok gelijk.
Bronnen (Clough, 2003) |
Anesthesie versus anesthesie met continue popliteablokkade
|
Laag GRADE |
De toevoeging van continue popliteablokkade de eerste dagen na de operatie aan algehele of spinale anesthesie lijkt een klinisch relevant voordeel te hebben op de postoperatieve pijn.
Bronnen (White, 2003; Zaric, 2004) |
|
Laag GRADE |
Er zijn aanwijzingen dat de opioid consumptie na continue popliteablokkade lager is dan wanneer geen continu popliteablok wordt toegediend.
Bronnen (White, 2003; Zaric, 2004) |
|
Laag GRADE |
Het is mogelijk dat het aantal bijwerkingen gelijk is na continue popliteablokkade met actieve agent en placebo. Wel werd in een studie gerapporteerd dat patiënten na popliteablok een tintelend gevoel in de voet ervoeren.
Het is mogelijk dat technische problemen aan de elastomeerpomp (of problemen met op de plaats blijven van de katheter) ontstaan.
Bronnen (White, 2003; Zaric, 2004) |
|
Laag GRADE |
Het is mogelijk dat patiënten met continue popliteablokkade eerder met ontslag naar huis kunnen dan patiënten die geen continue popliteablokkade hebben.
Bronnen (White, 2003; Zaric, 2004) |
|
Laag GRADE |
Het is mogelijk dat patiënten met gecontinueerde popliteablok meer tevreden zijn met de behandeling en pijnstilling dan patiënten die geen gecontinueerde popliteablok hebben.
White, 2003; Zaric, 2004 |
Algehele anesthesie / spinale anesthesie versus enkelblok
|
Zeer laag GRADE |
Het is mogelijk dat patiënten die voetchirurgie ondergaan na enkelblokkade minder postoperatieve pijn hebben dan na algehele/spinale anesthesie.
Bronnen (Kullenberg, 2006) |
|
Zeer laag GRADE |
Het is mogelijk dat de opioid consumptie na enkel blok lager is dan na algehele/spinale anesthesie.
Bronnen (Kullenberg, 2006) |
|
Zeer laag GRADE |
Het is mogelijk dat patiënten na enkelblok eerder met ontslag naar huis kunnen dan patiënten na algehele/spinale anesthesie.
Bronnen (Kullenberg, 2006) |
|
GRADE |
Er waren geen studies van voldoende kwaliteit die de bijwerkingen, patiënttevredenheid en kosten na enkelblok en algehele/spinale chirurgie met elkaar vergeleken. |
Spinale anesthesie versus poplitea blok
|
Zeer laag GRADE |
Het is mogelijk dat er minder bijwerkingen optreden na poplitea blok dan na spinale anesthesie.
Bronnen (Jeon, 2013) |
|
Zeer laag GRADE |
Het is mogelijk dat patiënten vaker tevreden zijn na poplitea blok dan na spinale anesthesie.
Bronnen (Jeon, 2013) |
|
Zeer laag GRADE |
Er waren geen onderzoeken van voldoende kwaliteit die pijn, ontslagtijd, opioidconsumptie en kosten na poplitea blok vergeleken met spinale anesthesie.
Bronnen (Jeon, 2013) |
Midvoetblokversus popliteablok
|
Laag GRADE |
Het is waarschijnlijk dat de postoperatieve pijn na voetchirurgie gelijk is na midvoet blok en popliteablok.
Bronnen (Adam, 2012; Migues, 2005) |
|
Laag GRADE |
Het is waarschijnlijk dat de consumptie van opioiden na chirurgische ingreep van de voet gelijk is na midvoet blok en poplitea blok.
Bronnen (Adam, 2012; Migues, 2005) |
|
Laag GRADE |
Het is mogelijk dat bijwerkingen even vaak voorkomen na midvoet blok en poplitea blok.
Bronnen (Adam, 2012; Migues, 2005) |
|
Laag GRADE |
Het is onbekend of de tijd tot ontslag uit het ziekenhuis na voetchirurgie verschillend is na midvoet blok of poplitea blok.
De tijd tot patiënten kunnen lopen zonder hulpstukken is mogelijk korter na voetblok dan na poplitea blok.
Bronnen (Adam, 2012) |
|
Laag GRADE |
Het is waarschijnlijk dat patiënten die voetchirurgie ondergaan even tevreden zijn na voetblok en poplitea blok.
Bronnen (Adam, 2012) |
|
- |
Er waren geen studies van voldoende kwaliteit die de kosten van voet blok en poplitea blok met elkaar vergeleken. |
Samenvatting literatuur
Er werden in de literatuur verschillende vergelijkingen gevonden:
-
algehele anesthesie versus algehele anesthesie met enkelblok;
-
algehele anesthesie versus algehele anesthesie met continue popliteablokkade;
-
algehele anesthesie / spinale anesthesie versus enkelblok;
-
spinale anesthesie versus popliteablokkade;
-
midvoetblok versus popliteablokkade;
Voor andere vergelijkingen werden geen studies van voldoende kwaliteit gevonden. De vergelijkingen worden hier onder apart uitgewerkt.
Algehele anesthesie versus algehele anesthesie met enkelblok
Er werden twee studies gevonden waarin algehele anesthesie met en zonder enkelblok worden vergeleken (Clough, 2003; Turan, 2007). In de studie van Clough werden patiënten die unilaterale benige voorvoetchirurgie ondergingen met ASA klasse 1 of 2 geïncludeerd. Patiënten die alleen een soft-tissue procedure ondergingen werden geëxcludeerd. Patiënten werden gerandomiseerd voor algehele anesthesie (n=21) met algehele anesthesie in combinatie met een enkelblok(n=21) met isobare bupivacaine 0,5%, in totaal 20ml. Drie zenuwen (n. peroneus superficialis, n. peroneus profundus en n. tibialis posterior) werden geblokkeerd. De patiënten werden twee dagen gevolgd. In de studie van Turan werden patiënten die hallux valgus chirurgie ondergingen, ASA klasse 1 of 2 geïncludeerd. Patiënten werden gerandomiseerd in een van drie groepen: algehele anesthesie met enkelblok met 15 ml levobupivacaïne 0,25%; algehele anesthesie met enkelblok met 15 ml lidocaïne 1% en algehele anesthesie met placebo. Postoperatief kregen patiënten een dosis etoricoxib 120mg en 30mg/kg paracetamol. Patiënten werden 24 uur gevolgd.
Pijn
In de studie van Clough worden verschillende pijn gerelateerde uitkomstmaten gerapporteerd. De pijn score was een verbale pijnscore (VRS; 1=geen pijn tot 10=ernstige pijn). In de eerste nacht hadden patiënten na algehele anesthesie plus enkelblok een mediane pijnscore van 4, en na algehele anesthesie van 5 (p=0.32). Ook de eerste (5 vs. 5, p=0.46) en tweede dag (4 vs. 4, p=0.24) waren er geen significante verschillen in de pijnscores. Ook de totale consumptie van analgesie is niet verschillend na een van beide methoden (gemiddeld aantal tabletten: 8.4±3.0 vs. 9.9±2.9 p=0.12). Wel rapporteert deze studie een significant verschil in de tijd vanaf de operatie dat patiënten voor het eerst pijn beleven: na algehele anesthesie plus enkel blok is dit gemiddeld na 12±5.5 uur, in vergelijking met 7.0±5.2 uur na alleen algehele anesthesie (p=0.002) (Clough, 2003). Van belang is wel te vermelden dat de toediening van intra-operatieve opioiden door de anesthesist (die niet geblindeerd was) verschillend was: patiënten in de controlegroep ontvingen meer opioiden. Dit heeft mogelijk de tijd tot eerste pijn in de controlegroep verlengd. Dit verandert niet de richting van het verschil (het verschil zou mogelijk juist groter zijn), maar levert mogelijk wel een verklaring waarom de tijd tot eerste pijn in de controlegroep langer is dan op basis van andere studies/literatuur te verwachten is.
In de studie van Turan werd de pijnscore gerapporteerd (geen pijn, een beetje pijn, ernstige pijn). In de studie worden de resultaten alleen in een figuur gerepresenteerd, en wordt in de tekst gerapporteerd dat er geen significante verschillen waren in de pijnscores tussen de drie groepen op de avond na chirurgie, en de ochtend en middag van de eerste postoperatieve dag. Tevens wordt in deze studie het aantal patiënten dat geen escape medicatie (pijnstilling) nodig had: na bupivacaïne hadden 21 patiënten, na lidocaïne negen patiënten en na placebo 13 patiënten geen escape medicatie nodig. De verschillen tussen de twee enkelblok groepen en de placebo/controlegroep waren niet statistisch significant (Turan, 2007).
Complicaties
In de studie van Clough werden chirurgische of anesthesiologische complicaties (postoperatieve misselijkheid en braken) gerapporteerd. Een patiënt had perifere zenuwschade (mogelijk secundair aan de toediening van de enkel blok of druk van het gips) na enkel blokkade. Er werden geen andere complicaties gerapporteerd. In de studie van Turan wordt vermeld dat er geen complicaties of adverse events gerapporteerd werden tijdens de follow up periode.
Patiënttevredenheid
De patiënttevredenheid werd in de studie van Clough (n=42) gerapporteerd (1=patiënt zou procedure opnieuw ondergaan, 4= zou de procedure niet opnieuw ondergaan). Er was geen statistisch significant verschil tussen de beide groepen (mediaan 1 vs. 1, p=0.24).
Overige uitkomstmaten
De uitkomstmaten vallen en kosten werden in geen van de studies gerapporteerd.
De bewijskracht voor de uitkomstmaat pijn is met twee niveaus verlaagd gezien beperkingen in de studieopzet (onduidelijke procedure van randomisatie, geen blindering) en verschillen in de interventies (indirectheid) die werden onderzocht in de studies. De uitkomstmaten complicaties en patiënttevredenheid zijn met drie niveaus verlaagd naar zeer laag gezien beperkingen in de studieopzet en het lage aantal patiënten/events.
Anesthesie versus anesthesie met continue popliteablokkade
Er werden twee studies gevonden waarin algehele anesthesie (White, 2003) en spinale anesthesie (Zaric, 2004) werden vergeleken met algehele anesthesie in combinatie met een continue popliteablokkade (White, 2003; Zaric, 2004). Voor de continue blokkade werd een (epidurale) katheter ingebracht.
In de studie van White werden patiënten die voorvoetchirurgie of enkelchirurgie ondergingen geïncludeerd. In totaal kregen alle patiënten 30ml 0.25% bupivacaine toegediend. Patiënten werden gerandomiseerd in een interventiegroep (n=10 ) en controle/placebo groep (n=10). Beide groepen ontvingen algehele anesthesie, deze bestond uit intraveneuze toediening van propofol 1.75-2.5mg/kg en fentanyl 0.75-1.5µg/kg. Additionele fentanyl werd toegediend wanneer nodig. In de interventiegroep kregen patiënten 30ml 0.25% racemisch bupivacaïne toegediend, en in de eerste 48 uur na de operatie middels een elastomeerpomp een continue toediening van 5 ml 0.25% bupivacaïne per uur. In de controlegroep hadden de patiënten ook een elastomeer pomp, maar werd 0.9% fysiologisch zout toegediend tijdens de eerste 48 uur. Patiënten met ernstige pijn (VRS>6) kregen op de PACU morfine; een PCA (patient controlled anesthesie) morfinepomp werd gestart (bolus doses 1 tot 2 mg, 5 tot 10 minuten lock out interval). Patiënten werden uit het ziekenhuis ontslagen als er sprake was van voldoende controle van de pijn met orale pijnstillers, en als patiënten mobiel waren zonder gebruik van krukken. Patiënten konden zelf de katheter verwijderen wanneer het reservoir leeg was. De follow-up duur van deze studie was één week (White, 2003).
In de studie van Zaric werden patiënten met ASA klasse 1 of 2 die electieve voetchirurgie ondergingen onder spinale anesthesie gerandomiseerd voor de interventie (n=30) of controle (n=30). De spinale anesthesie bestond uit lidocaïne 2%, 2.5 tot 3.5 ml. Direct na de operatie werden op de PACU de n.ischiadicus (poplitea) en n.saphenus geblokkeerd. Een bolus van 30ml ropivacaïne 0,5%werd gegeven; de n.saphenus werd geblokkeerd met 10ml ropivacaïne 0,75%). Een (18g epidurale) katheter werd ingebracht. De katheter werd verbonden aan een elastomeerpomp met een inhoud van 275ml en een gefixeerde toediening van 5ml/h. In de interventiegroep kregen patiënten 2mg/ml ropivacaïne toegediend tot het reservoir leeg was. In de controlegroep kregen patiënten fysiologisch zout toegediend. Patiënten werden drie dagen gevolgd (Zaric, 2004).
Pijn
Pijn werd in de studie van White gemeten met een VRS (Verbal Rating Scale) (0=geen pijn en 10=ergst voorstelbare pijn). De maximale pijnscore tijdens ziekenhuis verblijf was significant lager na continue toediening van bupivacaïne dan na placebo (mediaan 4 vs. 8, p<0.05). De maximale pijnscore na ontslag (binnen 1 week) was tevens lager in de interventiegroep dan in de controlegroep (mediaan 2.5 vs. 7.5, p<0.05).
In de studie van Zaric werd de pijn gemeten aan de hand van een telefoon interview. De resultaten worden in de studie alleen weergegeven in een figuur (geen exacte getallen) (zie figuur 1). Hier is te zien dat patiënten in de interventiegroep significant minder pijn hadden dan patiënten in de controlegroep op de 1e en 2e postoperatieve dag. Op de dag van ontslag, dag van operatie en 3e postoperatieve dat was dit verschil niet statistisch significant.
Figuur 1 Postoperatieve pijn (VAS score) (Zaric, 2004)
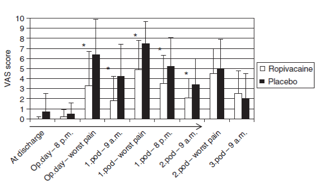
In de beide studies wordt een significant verschil in pijnscore gevonden tussen de interventie en controlegroep. Een verschil van 2 punten op een 10 punts-VAS of VRS werd als klinisch relevant beschouwd. De verschillen in de beide studies waren groter dan 2 punten, en lijken daarmee ook klinisch relevant.
Opioid consumptie
In de studie van White wordt de gemiddelde totale hoeveelheid morfine (op de PACU gegeven aan patiënten met ernstige of matige pijn) gerapporteerd. Patiënten in de interventiegroep gebruikten significant minder morfine (10.3±13.6 vs. 34.7±19.4 p<0.05). Tevens wordt het aantal patiënten dat orale opioid analgesie nodig had gerapporteerd. In de interventiegroep gebruikten 6 (60%) patiënten orale opioiden, in vergelijking met 10 patiënten (100%) in de controlegroep. Dit verschil was niet significant. In de studie van Zaric werd de gemiddelde totale ketobemidon (een opioid) consumptie de eerste drie dagen na operatie gerapporteerd (2 (0-7) vs. 3 (0-16) p=0.067). Ook dit verschil was niet significant (Zaric, 2004).
Bijwerkingen
In de studie van White werden postoperatieve bijwerkingen niet duidelijk gerapporteerd. Duizeligheid, zwakte, urine retentie, ileus, misselijkheid en/of braken werden niet gezien. Wel rapporteerden 8 (80%) van de patiënten in de interventiegroep een tintelend gevoel in de voet, in de controlegroep was dit 1 (10%) patiënt (p=0.05). In de studie van Zaric komt misselijkheid en braken niet vaker voor in de interventiegroep of controlegroep op de dag van de operatie (7 vs. 6 p=0.82); na 1 dag ( 11 vs. 8 p=0.54) en na 2 dagen (9 vs. 5 p=0.27). Slaapproblemen kwamen minder vaak voor in de interventie dan de controlegroep (6 vs. 15, p=0.029). Ook werden technische problemen met de pomp vermeld, patiënten meldden disconnectie (n=1), lekkage (n=5), problemen met slapen (n=2), problemen met naar toilet gaan i.v.m. pomp (3). Er waren geen problemen met toxische effecten en het verwijderen van de pomp (Zaric, 2004).
Ontslagtijd
In de studie van White wordt de gemiddelde duur van verblijf in het ziekenhuis gerapporteerd. Patiënten werden ontslagen als er sprake was van voldoende controle van de pijn, en wanneer patiënten veilig konden mobiliseren zonder hulpmiddelen. Patiënten in de interventiegroep verbleven significant korter in het ziekenhuis dan patiënten in de controlegroep (gemiddeld aantal dagen: 0.7±0.7 vs. 1.4±0.5 p=0.05). In de studie van Zaric was er geen significant verschil in de tijd van operatie tot ontslag (gemiddeld aantal minuten 203.9±64.3 vs. 209.2±59.2). Er wordt in de studie niet gerapporteerd wat de ontslagcriteria waren (“standaard ontslagcriteria”).
Patiënttevredenheid
In de studie van White werd in een telefonisch interview 24 uur na operatie naar patiënttevredenheid gevraagd (verbale schaal van 100 punten). De patiënttevredenheid was significant hoger na continue toediening van bupivacaïne dan na fysiologisch zout (placebo) (gemiddeld 98±3 vs. 77±13p <0.05). In de studie van Zaric werd de patiënttevredenheid gemeten op een 5-puntsschaal. Van de patiënten was 60% na interventie versus 43% na controle zeer tevreden; 36.7% versus 46.6% tevreden; 3.3% versus 6.6% neutraal en 0 versus 3.3% ontevreden. De verschillen waren niet statistisch significant verschillend (p=0.47).
Kosten
De kosten werden niet gerapporteerd.
De bewijskracht voor de uitkomstmaten pijn, opioid consumptie, bijwerkingen en patienttevredenheid werd met twee niveaus verlaagd gezien beperkingen in de studieopzet en het geringe aantal patiënten (imprecisie)
Algehele anesthesie / spinale anesthesie versus enkelblok
Er werd een studie gevonden waarin algehele anesthesie of spinale anesthesie werd vergeleken met een enkelblok (Kullenberg, 2006). Patiënten die voorvoet chirurgie ondergingen werden gerandomiseerd voor enkelblokkade (met een mix van 10 ml mepivacaïne 1% en 10ml ropivacaïne 1%) van vijf zenuwen: n. tibialis posterior, peroneus profundus en peroneus superficialis, saphenus en suralis (n=54) of spinale of algehele anesthesie (n=62). In totaal ondergingen 56 patiënten een osteotomie van de metatarsale één, 14 patiënten een osteotomie van metatarsale twee tot vijf, 20 patiënten geïsoleerde “lesser toe procedures” en 26 patiënten een combinatie van metatarsale één en een “lesser toe” procedure. De follow-up bedroeg 48 uur.
Pijn
Pijn tijdens lopen werd bij ontslag gemeten aan de hand van de VAS. De gemiddelde pijnscore was na enkel blok 2.3±2.1 versus 2.1±1.8 na spinale/algehele anesthesie. Daarbij is van belang te melden dat de consumptie van intra-operatieve aanvullende anesthesie in de interventiegroep significant lager was dan in de controlegroep (gemiddeld µg:60±16 vs. 123±32 p=0.012) (Kullenberg, 2006).
Opioid consumptie
Het gemiddelde gebruik van morfine (mg/24 uur) was 11.6±7.3 na enkel blok in vergelijking met 15.8±6.2 na spinale/algehele anesthesie. Dit verschil was statistisch significant verschillend (p=0.04) (Kullenberg, 2006).
Ontslagtijd
Gemiddeld verbleven patiënten na de operatie 280±62 minuten in het ziekenhuis na enkel blok, en 375±90 minuten na spinale/algehele anesthesie (p<0.001) (Kullenberg, 2006).
Overige uitkomstmaten
De uitkomstmaten bijwerkingen, patiënttevredenheid en kosten werden niet gerapporteerd.
De bewijskracht voor de uitkomstmaten pijn, opioid consumptie en ontslagtijd is met drie niveaus verlaagd gezien beperkingen in studieopzet (geen blindering, onduidelijk proces van randomisatie), gebrekkige rapportage van uitkomstmaten (en daarmee kans op bias) en het geringe aantal patiënten (imprecisie).
Spinale anesthesie versus poplitea blok
Er werd een studie uit Korea gevonden waarin poplitea blok met een mix van 10 ml fysiologisch zout met 30 ml 0.75% ropivacaïne werd vergeleken met spinale anesthesie met 2.5ml 0.5% hyperbare bupivacaïne (Jeon, 2013). Patiënten tussen de 20 en 65 jaar met ASA klasse 1 of 2 die hallux valgus chirurgie ondergaan werden gerandomiseerd voor de interventiegroep (poplitea blok) (n=20) of controlegroep (spinale anesthesie) (n=20). Patiënten in de poplitea blok groep kregen voor postoperatieve pijncontrole een PCA pomp. De follow-up bedroeg 3 dagen. In deze studie werden vooral intra-operatieve uitkomsten beschreven die voor de beantwoording van deze uitgangsvraag niet als relevant benoemd werden.
Bijwerkingen
Er werden na poplitea blok geen postoperatieve nadelige effecten gerapporteerd, na spinale chirurgie werden de volgende nadelige effecten gemeld: postspinale hoofdpijn (10%), urine retentie (20%), hypotensie (15%), bradycardie (10%) rillen (5%), braken (5%), postoperatieve hoofdpijn (20%). De verschillen waren echter niet statistisch significant.
Patiënttevredenheid
De patiënttevredenheid met procedure en postoperatieve pijnstilling werd gemeten aan hand van 5 classificaties: zeer tevreden tot zeer ontevreden. In totaal waren 17 patiënten (85%) na poplitea blok en 12 patiënten (60%) na spinale anesthesie zeer tevreden tot voldoende tevreden.
Overige uitkomstmaten
De uitkomstmaten pijn, ontslagtijd, opioidconsumptie en kosten werden niet gerapporteerd.
De bewijskracht voor de uitkomstmaten bijwerkingen en patiënttevredenheid is met drie niveaus verlaagd naar zeer laag gezien beperkingen in de studieopzet (onduidelijke beschrijving van de procedure van randomisatie, geen blindering) en het geringe aantal patiënten (imprecisie).
Midvoetblok versus popliteablok
Er werden twee studies gevonden waarin een mid-voet blok werd vergeleken met een poplitea blok. In de studie van Adam werden patiënten met ASA klasse 1 of 2 die electieve percutane hallux valgus chirurgie ondergaan gerandomiseerd voor mid-voet blok met 30ml 7.5% ropivacaïne (n=20) of poplitea blok met 30ml 7.5% ropivacaïne. In het geval van onvoldoende analgesie werd 1-1.5mg/kg/uur van propofol toegediend. Postoperatieve analgesie bestond uit paracetamol/codeïne (100mg en 60mg drie maal daags), ketoprofene LP (150mg tweemaal daags) en indien nodig tramadol (100mg twee maal). Patiënten werden één week gevolgd (Adam, 2012).
In de studie van Migues werden patiënten die electieve unilaterale voorvoetchirurgie (hallux valgus, hallux rigidus, hamerteen, mortons neuroom, hallux varus, phalanx fractuur) ondergaan geïncludeerd. In de interventiegroep (n=26) kregen patiënten een voetblok (blokkade van de n tibialis posterior met 4ml 0.5 bupivacaïne en 2ml 2% lidocaïne; nn peronei met 2ml 0.5% bupivacaïne en 1ml 2% lidocaïne). De n.saphenus werd geblokkeerd indien er gebruik werd gemaakt van een enkeltourniquet. In de controlegroep (n=25) kregen patiënten een poplitea blok met 7.5ml 0.5% bupivacaïne en 7.5ml 2% lidocaïne rond de n. tibialistak en 5ml 0.5% bupivacaïne en 5ml 2 lidocaïne rond de n.peroneustak (Migues, 2005).
Pijn
In de studie van Adam werd de pijnscore gemeten aan de hand van een VAS van 100mm. De resultaten worden alleen in een figuur (en niet in cijfers) weergegeven. De auteurs melden in de tekst dat er geen statistisch significante verschillen tussen de twee groepen werden gezien in de VAS score tijdens ontslag en tijdens de eerste 48 uur postoperatief. In de studie van Migues wordt de pijn (VAS score) 6, 12, 18 en 24 uur postoperatief beschreven in een figuur (geen cijfers). Er zijn geen significante verschillen tussen de groepen. Tevens wordt gerapporteerd dat de tijd tussen het einde van de chirurgische procedure en het beginnen van de pijn niet significant verschilde na voet blok (10.96±7.56 uur) in vergelijking met poplitea blok (14.32±7.73 p=0.123) (Migues, 2005).
Gebruik opioiden
In de studie van Adam wordt het aantal patiënten dat tramadol gebruikte gerapporteerd. Na voet blok gebruikte 30% van de patiënten tramadol, in vergelijking met 42% van de patiënten na poplitea blok. Dit verschil was niet significant. Ook de mediane dosis (100 vs. 100) was niet verschillend.
Bijwerkingen
De bijwerkingen misselijkheid, braken en constipatie worden in de methodesectie van de studie van Adam beschreven. In de resultaten beschrijven ze echter alleen dat het voorkomen van deze bijwerkingen in beide groepen “vergelijkbaar” was (Adam, 2012). In de studie van Migues werden postoperatieve neurologische complicaties 4 tot 8 maanden na de operatie onderzocht: in geen van beide groepen traden deze op (Migues, 2005).
Tijd tot ontslag
De tijd tot ontslag werd in de studie van Adam niet gerapporteerd. Wel wordt de tijd tot de patiënt in staat was zonder krukken of hulp te staan gerapporteerd. Deze tijd was significant lager na voet blok (gemiddeld 3.8±1.4 uur) dan na spinale anesthesie (gemiddeld 19.2±9.5 uur). Na spinale anesthesie moesten veel patiënten met krukken lopen in verband met motor blokkade die langer duurde.
Patiënttevredenheid
De patiënttevredenheid werd in de studie van Adam een week na de chirurgie beoordeeld, vermoedelijk een schaal van 0 tot 100. De gemiddelde patiënttevredenheid was niet verschillend in de beide groepen (97±5 vs. 92±10). Ook in de studie van Migues was de patiënttevredenheid tussen de beide groepen niet verschillend (96.1 vs. 96 p=1.00).
Overige uitkomstmaten
De uitkomstmaat kosten werd in geen van de studies beschreven.
De bewijskracht voor de uitkomstmaat pijn is met twee niveaus verlaagd naar laag gezien beperkingen in de studieopzet (geen blindering, onvolledige rapportage van sommige uitkomstmaten) en het geringe aantal patiënten (imprecisie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling(en): Wat is de effectiviteit (pijn, bijwerkingen, vallen, ontslagtijd, kosten, patiënttevredenheid, opioid consumptie) van zenuwblokkade en enkel- en midvoetblokkade versus spinale anesthesie en algehele anesthesie bij chirurgische ingreep van hallux valgus?
Relevante uitkomstmaten
De werkgroep achtte pijnscores, bijwerkingen en patiënt tevredenheid) voor de besluitvorming kritieke uitkomstmaten; en opioid consumptie en ontslagtijd voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities. De werkgroep definieerde een verschil van VAS (NRS) > 2 als een klinisch relevant verschil.
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase and Cochrane is met relevante zoektermen voor de periode van 2000 tot mei 2014 gezocht naar vergelijkend onderzoek naar anesthesie bij hallux valgus chirurgie in het Nederlands en Engels. De zoekverantwoording is weergegeven onder desbetreffende kop. De literatuurzoekactie leverde 151 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: gerandomiseerd vergelijkend onderzoek, vergelijking van twee methoden, voldoende data presentatie met minimaal een van de volgende uitkomstmaten: pijn (scores), bijwerkingen, vallen, ontslagtijd, kosten, patiënt tevredenheid en opioid consumptie. Op basis van titel en abstract werden in eerste instantie 21 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 12 studies geëxcludeerd (zie exclusietabel), en 9 studies definitief geselecteerdenopgenomen in de literatuuranalyse. De evidencetabellen hiervan en beoordeling van individuele studiekwaliteit kunt u in de desbetreffende sectie vinden.
Referenties
- Adam F, Pelle-Lancien E, Bauer T, et al. Anesthesia and postoperative analgesia after percutaneous hallux valgus repair in ambulatory patients. Annales Francaises d Anesthesie et de Reanimation 2012 Nov;31(11):e265-e268.
- Burg A, Tytiun Y, Velkes S, Heller S, Haviv B, Dudkiewicz I. Ankle tourniquet pain control in forefoot surgery: A randomized study. Foot Ankle Int 2011;32(6):595-8.
- Capdevila X, Dadure C, Bringuier S, et al. Effect of patient-controlled perineural analgesia on rehabilitation and pain after ambulatory orthopedic surgery: a multicenter randomized trial. Anesthesiology 2006;105(3):566-73.
- Clough TM, Sandher D, Bale RS, et al. The use of a local anesthetic foot block in patients undergoing outpatient bony forefoot surgery: A prospective randomized controlled trial. J Foot Ankle Surg 2003;42(1):24-9.
- Kullenberg B, Topalis C, Resch S. Ankle nerve block-perioperative pain relief in surgery of the forefoot. Foot 2006;16(3):135-7.
- Lee KT, Park YU, Hyuk J, et al. Femoral and sciatic nerve block for hindfoot and ankle surgery. J Orthop Sci. 2014;19(4):546-51.
- Migues A, Slullitel G, Vescovo A, et al. Peripheral foot blockade versus popliteal fossa nerve block: a prospective randomized trial in 51 patients. Journal of Foot & Ankle Surgery 2005;44(5):354-7.
- Turan I, Assareh H, Rolf C, et al. Multi-modal-analgesia for pain management after hallux valgus surgery: a prospective randomised s?tudy on the effect of ankle block. Journal of Orthopaedic Surgery 2007;2:26.
- White PF, Issioui T, Skrivanek GD, et al. The Use of a Continuous Popliteal Sciatic Nerve Block After Surgery Involving the Foot and Ankle: Does It Improve the Quality of Recovery? Anesth Analg 2003;97(5):1303-9.
- Zaric D, Boysen K, Christiansen J, et al. Continuous popliteal sciatic nerve block for outpatient foot surgery--a randomized, controlled trial. Acta Anaesthesiol Scand 2004;48(3):337-41.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Midfoot block (+sedation) versus posterior popliteal sciatic nerve block |
|||||||
|
Adam, 2012 |
Type of study: RCT
Setting: Hospital
Country: France
Source of funding: not stated |
Inclusion criteria: ASA 1 or 2, ambulatory patients scheduled for elective percutaneous hallux valgus repair
Exclusion criteria: Age <18 or >75, obesity (>130% ideal body weight), anticipated general anaesthesia, history of chronic pain, routine use of analgesics or analgesic consumption within 24h of surgery, drug or alcohol abuse, psychiatric disorders or contraindications to ketoprofene, tramadol or paracetamol/codeine.
N total at baseline: Intervention: 20 Control: 20
Important prognostic factors2: For example age ± SD: I: 53±13 C:56±9
Sex (m/f): I: 2/18 C:1/19
Groups comparable at baseline? yes
|
Mid-foot block with 30ml of 7.5% ropivacaïne (I)
Infiltration was performed with 22-gaugse, short-bevel needle, and ropivacaïne was injected after initial aspiration test was negative. Performed by surgeon and consisted in four punctures.
Patients were given propofol sedation (1-2mg/kg) for procedure
In case of inadequate block, a rescue light sedation by infusion of 1-1.5mg/lg/hr of propofol was used.
Postoperative analgesia: paracetamol/codeine (100mg and 60mg, 3x daily) and ketoprofene LP (150mg twice daily) systematically, and tramadol LP (100mg 2x) if necessary. |
Posterior popliteal sciatic nerve block with 30ml of 7.5% ropivacaïne (C).
Short-bevel, insulated needle, and the block was facilitated by a nerve stimulator. Patients were positioned prone and double injections were made in posterior popliteal region. Block was realized by an experienced practitioner.
No propofol sedation.
In case of inadequate block, a rescue light sedation by infusion of 1-1.5mg/lg/hr of propofol was used.
Postoperative analgesia: paracetamol/codeine (100mg and 60mg, 3x daily) and ketoprofene LP (150mg twice daily) systematically, and tramadol LP (100mg 2x) if necessary. |
Length of follow-up: 1 week
Loss-to-follow-up: none
Incomplete outcome data: none
|
I vs. C
Pain (100mm VAS, only figure provided, data is estimated based on figure) At discharge 0 vs. 3 NS
Within 48h: “no statistically significant differences” No numbers stated
Tramadol (% used) 30 vs. 42 NS
Cumulative dose tramadol (median mg) 100 vs. 100 NS
Sleep quality first postoperative night (diary) (% did not sleep) 5 vs. 35 p=0.01
Side effects (diary) Nausea, vomiting, constipation “comparable”
Satisfaction (asked by doctor 1 week after surgery) 97±5 vs. 92±10 NS
Time to ambulation (hours to ability to walk without assistance of another person or crutches) 3.8±1.4 vs. 19.2±9.5 p<0.001
Not blinded
|
Power calculation performed
In summary: after percutaneous hallux valgus repair, mid-foot block and sciatic nerve block provided comparable postoperative analgesia. However, mid-foot block seems preferable since the time to safe ambulation is much reduced.
“Continuous popliteal sciatic nerve blocks have been successfully used in outpatients. However, the advisability of discharging patients with such long-acting sciatic blocks remains controversial. Particularly in the elderly people who may have difficulty to get about on crutches. Because of the loss of proprioception and the protective pain reflex, outpatients are at risk of falls, trauma, inability to ambulate and accidental injury of the limb at the surgical side. None of our patients suffered trauma at home, but our study was in no way powered for this sort of presumably rare complication.
Gebruik bloedleegte wordt niet vermeld. Twee technieken (infiltratie I vs. popliteal C) worden vergeleken; de arts die de techniek uitvoert is verschillend: chirurg (I) vs. anesthesist C) |
|
Migues, 2005 |
Type of study: RCT
Setting: Hospital
Country: Argentina
Source of funding: not stated |
Inclusion criteria: Elective unilateral forefoot (hallux valgus, hallux rigidus, hammer toe, mortons neuroma, hallux varus, phalanx fracture) procedures on outpatient basis
Exclusion criteria: Midfoot and hind foot procedures, iliac crest bone grafts at same time, history of peripheral neuropathy, alcoholism, rheumatoid arthritis, substance abuse.
N total at baseline: 51 Intervention: 26 Control: 25
Important prognostic factors: age ± SD: I: 61±11 C: 56±17
Sex (%f): I: 88.5% C: 92%
Groups comparable at baseline? yes |
Foot block
Patient in supine position. IV midazolam (1-2mg). Using nerve stimulator. Posterior tibial nerve was blocked using 4ml of 0.5% bupivacaine and 2ml of 2% lidocaine. Common peroneal nerves (superficial and deep) were blocked with 2ml of 0.5% bupivacaine and 1ml of 2% lidocaine in each nerve.
Saphenous nerve was blocked at the groin if tourniquet was used (Ankle tourniquet haemostatic was used whenever necessary).
|
Popliteal sciatic nerve block
Patient in prone position. IV midazolam (1-2mg). Using nerve stimulator. 7.5ml of 0.5% bupivacaine and 7.5ml of 2% lidocaine were infiltrated (25g needle) around the tibial nerve, and 5ml of 0.5% bupivacaine and 5ml of 2% lidocaine around the common peroneal nerve.
Saphenous nerve was blocked at the groin if tourniquet was used (Ankle tourniquet hemostatis was used whenever necessary). |
Length of follow-up: Mean 5.7 months
Loss-to-follow-up: None
Incomplete outcome data: Not stated |
I vs. C
Effectiveness (if it was sole anaesthetic technique required for forefoot surgery) 92.3 vs. 96 p=0.972
Pain (VAS) 6,12,18 and 24h postoperatively): No numbers provided, only figure. No significant differences.
Time to onset of pain (hours between end of surgical procedure and onset of pain) 10.96±7.56 vs. 14.32±7.73 p=0.123
Postoperative neurological complications (assessed 4-8 months postoperatively) 0 vs. 0
Patient satisfaction 96.1 vs. 96 p=1.00 |
Author conclusion: both anaesthesia blocks are safe and effective and well suited for forefoot ambulatory surgery settings. Furthermore, they provide good postoperative analgesia, reducing the need for opioids and minimizing the risk of side effects. |
|
General anaesthesia + ankle block versus general anaesthesia alone ( placebo or no block) |
|||||||
|
Turan, 2007 |
Type of study: RCT
Setting: Hospital
Country: Sweden
Source of funding: none. |
Inclusion criteria: ASA 1-2, elective hallux valgus surgery.
Exclusion criteria: -
N total at baseline: Intervention1: 30 Intervention2: 30 Control: 30
Important prognostic factors2: age ± SD: I1: 50±12 I2: 45±15 C: 46±13
Sex (m/f): I1 1/29: I2:6/24 C:4/26
Surgery (HV / HVA+hammertoe) I1: 28/2 I2: 26/4 C: 27/3
Groups comparable at baseline? yes
|
I1: General anaesthesia + ankle block (posterior tibial nerve, peroneal nerve, superficial and deep, sural nerve) with 15cc levobupivacaïne 2.5mg/ml
I2: : General anaesthesia + ankle block (posterior tibial nerve, peroneal nerve, superficial and deep, sural nerve) witch 15cc lidocaine 10mgl/ml
All patients received: IV 8mg betamethasone, 0.3mg alfentanil, 30-50mg propofol. After sedation patients received ankle block. General anaesthesia by sevoflurane in oxygen/air by mask.
Postoperative: initial oral dose of etoricoxib 120mg, loading dose 30 mg/kg paracetamol |
C: General anaesthesia + ankle block (posterior tibial nerve, peroneal nerve, superficial and deep, sural nerve) with placebo 15cc saline.
All patients received: IV 8mg betamethasone, 0.3mg alfentanil, 30-50mg propofol. After sedation patients received ankle block. General anaesthesia by sevoflurane in oxygen/air by mask.
Postoperative: initial oral dose of etoricoxib 120mg, loading dose 30 mg/kg paracetamol
|
Length of follow-up: 24h
Loss-to-follow-up: None stated
Incomplete outcome data: None stated
|
No rescue analgesia needed (vs. C) I1: 21 p=0.052 I2: 9 C: 13
Pain: “no difference in pain ratings was seen between the groups”. Only figure provided no numbers.
No complications or adverse events were noticed during the follow-up period. |
Take home analgesics: - 120mg once daily etoricoxib - 1gr oral paracetamol when needed (max 4mg) - Additional dextropropoxyphene 100mg oral if paracetamol had reviled pain within 30min.
Conclusion: when added to a multimodal pain management single shot ankle block was not enough to show any significant difference in the need for further analgesic and did not change the pain ratings during the first 24h after elective hallux valgus surgery as compared to placebo.
*data representation is below average (only 1 outcome measure is reported on in numbers, all others are mentioned in text or presented in figure)
|
|
Clough, 2003 |
Type of study: RCT
Setting: Hospital
Country: UK
Source of funding: not stated |
Inclusion criteria: unilateral out-patient bony forefoot surgery, ASA 1 or 2
Exclusion criteria: undergoing merely soft-tissue procedure
N total at baseline: 42 Intervention: 21 Control: 21
Important prognostic factors2: age (range): I: 51 (21-77) C: 57 (25-78)
Patients needing Intraoperative NSAID I: 9 C: 14 p=0.052
Patients needing morphine supplements I: 3 C: 9 p=0.035
Surgical procedure (n, I vs. C) Distal first MT osteotomy: 9 vs. 11 Keller’s procedure: 2 vs. 5 First MTP fusion: 2 vs. 2 First MTP implant: 0 vs. 2 Bunionectomie: 3 vs. 1 Chielectomy: 2 vs. 0
Groups comparable at baseline? no
|
General anaesthesia + foot block
No premedication. Standard general anaesthetic: 2, 3,-diisopropulphenol induction, fentanyl, and spontaneous respiration of isoflurane in a nitrous oxide/oxygen mixture via a laryngeal mask airway. Further intraoperative morphine and/or nonsteroidal anti-inflammatory (NSAID) was given according to he routine practice and discretion of the anaesthetist.
Foot block: 20ml 0.5% plain bupivacaine using 25-g needles to 3 nerves (superficial personal, deep peroneal, posterior tibial).
Postoperative: oral analgesia (combined codeine phosphate 30mg and acetaminophen 500mg p. tablet) to take as required (max 8/day).
|
General anaesthesia
No premedication. Standard general anaesthetic: 2, 3,-diisopropulphenol induction, fentanyl, and spontaneous respiration of isoflurane in a nitrous oxide/oxygen mixture via a laryngeal mask airway. Further intraoperative morphine and/or nonsteroidal anti-inflammatory (NSAID) was given according to the routine practice and discretion of the anaesthetist. |
Length of follow-up: 2 days
Loss-to-follow-up: Patients who were not able to be contacted by telephone postoperatively were excluded. It is not stated how many patients from which group.
Incomplete outcome data: Intervention: 2 (9.5%) Reasons: exclusion because 1 needed overnight admission owing to poor pain control, 1 because of poor control of epilepsy needing overnight admission.
Control: 1 (4.3%) Reasons: exclusion because 1 needed overnight admission owing to poor pain control
|
I vs C
Time to first postoperative pain (assessed by follow-up telephone call 24h postoperatively), mean hours±sd: 12.0 ±5.5 vs. 7.0±5.2 p=0.002
Pain (verbal incremental pain score (1=no pain, 10=severe pain) First night, median (range): 4 (1-10) vs. 5 (1-8) p=0.32
First day, median (range): 5 (2-10) vs. 5 (1-10) p=0.46
Second day, median (range): 4 (1-9) vs. 4 (1-7) p=0.24
Analgesic consumption, Mean number of tablets ±sd 8.4±3.0 vs. 9.9±2.9 p=0.12
Sleep disturbance (0=none, 1=<hrs., 2=<4hrs, 3=>4 hrs.) median (range): 1 (0-3) vs. 1 (0-3) p=0.32
Complications (surgical or anaesthetic, e.g. postoperative nausea and vomiting) 1 patient in FB group reported peripheral nerve injury that might have been secondary to administration of the FB or pressure from the plaster cast.
Overall satisfaction (assessed by telephone call after 48h, 1=would definitely have procedure again to 4= would not have procedure again), median (range) 1 (1-4) vs. 1 (1-4) p=0.24 |
Bias due to differences in perioperative drug use. The authors believe that the intraoperative opioid administration by the anaesthesist to patients in the control group probably contributed to the extended time to first perception of pain (longer than expected). Anaesthetist was not blinded.
In conclusion, we found a local anaesthetic FB supplement to general anaesthesia in patients having outpatient bony forefoot surgery gave improved early postoperative pain relieve with no worsening of pain control on the first postoperative night. We conclude that FB is not detrimental to patients having outpatient surgery, although its use did not improve overall patient satisfaction.
Note: gebruik bloedleegte wordt niet vermeld. Statistiek is vreemd (voor alle uitkomstmaten worden zowel mean, median, SD, range, en een 95%CI (maar waarvan..) gemeld. |
|
General anaesthesia or spinal anesthesia+ continued popliteal nerve block (home catheter) versus general anaesthesia + placebo |
|||||||
|
White, 2003
|
Type of study: RCT
Setting: Hospital
Country: US
Source of funding: none |
Inclusion criteria: Age 18-85, undergoing foot (bunionectomie, claw toe/hammertoe corrections) or ankle (bone fusions or internal fixation) procedures. Exclusion criteria: Allergic to local anaesthetics, active infection involving lower extremity, pregnant or lactating, neurological dysfunction, diabetes, history of chronic opioid analgesic use or drugs abuse, unstable cardiovascular, renal or hepatic disease.
N total at baseline: 14 (see incomplete outcome data) Intervention: 10 Control: 10
Important prognostic factors: age ± SD: I: 58±11 C: 50±15
Sex m/f: I: 4/6 C: 3/7
Surgical procedure Ankle / foot I: 1/9 C: 2/8
Groups comparable at baseline? yes |
20g epidural catheter was inserted: 30 ml 0.25% bupivacaïne was injected in all patients in prone position. Generic bupivacaine 0.25% 5 ml/h was infused for up to 48h after surgery by using a disposable elastomeric pump.
General anaesthesia was induced within 15 min after the block was performed by propofol 1.75-2.5mg/kg IV and fentanyl 0.75-1.5µg /kg IV. Supplemental sufentanil as needed.
Patients with severe pain (VRS>6) in PACU received 1- to 2mg IV bolus doses of morphine and were started on PCA morphine 1-2mg bolus on demand with 5- to 10 minute interval. Patients with moderate pain were treated with morphine until acceptable pain relieve was achieved. Patients with VRS pain scores of 2–3 received an oral opioid-containing analgesic (e.g., hydrocodone [5 mg] and acetaminophen [500 mg]). |
20g epidural catheter was inserted: 30 ml 0.25% bupivacaïne was injected in all patients in prone position. Infusion of 0.9% saline for up to 48h after surgery by using a disposable elastomeric pump.
General anaesthesia was induced within 15 min after the block was performed by propofol 1.75-2.5mg/kg IV and fentanyl 0.75-1.5µg /kg IV. Supplemental sufentanil as needed.
Patients with severe pain (VRS>6) in PACU received 1- to 2mg IV bolus doses of morphine and were started on PCA morphine 1-2mg bolus on demand with 5- to 10 minute interval. Patients with moderate pain were treated with morphine until acceptable pain relieve was achieved. Patients with VRS pain scores of 2–3 received an oral opioid-containing analgesic (e.g., hydrocodone [5 mg] and acetaminophen [500 mg]). |
Length of follow-up: 1wk
Loss-to-follow-up: None
Incomplete outcome data: 4 eliminated from data analysis because of catheter dislodgement before discharge.
|
Pain (11-point verbal rating scale, 0=no pain, 10=worst pain imaginable) mean (range).
Maximal pain score at hospital 4 (0-10) vs. 8 (6-10) p<0.05
Maximal pain score after discharge 2.5 (0-10) vs. 7.5 (2-10) p<0.05
Postoperative side effects (pain, dizziness, nausea, vomiting)
Side effects after discharge (dizziness, weakness, urinary retention, ileus, nausea and/or vomiting) No weakness or numbness, Tingling sensation in foot: 80% vs. 10% p=0.05
Requirements for rescue analgesic 100% vs. 60%
Duration of stay in PACU (min) 69±33 vs. 98±50 NS
Average length of hospital stay (days) 0.7±0.7 vs. 1.4±0.5 p=0.05
Discharge (satisfactory pain control, ability to mobilize safely with or without assistance devices)
Use of oral pain medication Total morphine (mg) 10.3±13.6 vs. 34.7±19.4 p<0.05
Required oral opioid analgesics, n (%) 10 (100) vs. 6 (60)
Patient satisfaction with postoperative pain management (after 24h, by 100 point VRS) 98±3 vs. 77±13p <0.05 |
major concern regarding the use of CPNB relates to the ability to maintain the catheter in the correct position as patients increase their physical activity in the post discharge period. Problems with catheter displacement were observed after ambulation in the first four patients enrolled in this study (two in each treatment group), necessitating a modification in the procedure used for securing the catheter in the popliteal fossa. Other concerns regarding the use of this technique outside the hospital relate to the potential for local anaesthetic toxicity and complications secondary to the residual sensory and motor Block
continuous popliteal nerve block with an elastomeric pump infusing bupivacaine 0.25% at rate of 5mL/h decreases postoperative pain and the need for opioid analgesic medication and improves patient satisfaction with pain management after painful orthopaedic procedures involving the foot and ankle. |
|
Zaric, 2004 |
Type of study: RCT
Setting: Hospital
Country: Denmark
Source of funding: not stated |
Inclusion criteria: ASA 1 or 2, scheduled for elective outpatient foot surgery (hallux valgus, metatarsal osteotomies and great toe arthrodesis), in spinal anaesthesia, age >18yrs, able to understand possible complications and wiling to remove catheter themselves.
Exclusion criteria: contraindication sciatic nerve block, allergy for treatment medicine, current chronic analgesic therapy, peripheral neuropathy, coagulopathy.
N total at baseline: 63 Intervention: 30 Control: 30* Unclear which patients were excluded due to breach of protocol
Important prognostic factors: age ± SD: I: 47±12.5 C:46±14.9
Sex (F/M): I: 25/5 C: 27/3
Procedure (I vs. C), n: Hallux valgus correction: 24 vs. 22 Metatarsal osteotomy: 3 vs. 4 Great toe arthrodesis: 3 vs. 4
Groups comparable at baseline? yes
|
Spinal anaesthesia + ropivacaïne
Preoperative: Spinal anaesthesia with 20mg/ml lidocaine 2.5-3.5 ml.
Thigh tourniquet IV midazolam and alfentanil. Lornoxicam 16mg or propacetamol 2g were given IV at the end of surgery. Immediately after surgery sciatic and saphenous nerve blocks were undertaken in the postoperative care unit.
Bolus of 30ml ropivacaïne 5mg/ml was given, and 18g epidural catheter was inserted . The catheter was connected to an elastomeric infusor pump containing 275ml, giving a fixated rate infusion rate of 5ml/h. The saphenous nerve was blocked separately at the level of the tibial tuberosity by subcutaneous infiltration of 10ml of ropivacaïne 7.5ml/ml.
2mg/ml ropivacaïne
Home medication: lornoxicam 8mg x2 (or paracetamol 2g x 4) for 4 postoperative days and ketomibon 5mg as en escape opioid. |
Spinal anaesthesia + saline
Preoperative: Spinal anaesthesia with 20mg/ml lidocaine 2.5-3.5 ml.
Thigh tourniquet IV midazolam and alfentanil. Lornoxicam 16mg or propacetamol 2g were given IV at the end of surgery. Immediately after surgery sciatic and saphenous nerve blocks were undertaken in the postoperative care unit.
Bolus of 30ml ropivacaïne 5mg/ml was given, and 18g epidural catheter was inserted. The catheter was connected to an elastomeric infusor pump containing 275ml, giving a fixated rate infusion rate of 5ml/h. The saphenous nerve was blocked separately at the level of the tibial tuberosity by subcutaneous infiltration of 10ml of ropivacaïne 7.5ml/ml.
2mg/ml saline |
Length of follow-up: 3 days
Loss-to-follow-up: -
Incomplete outcome data: 3 patients were excluded because of breach of protocol (unclear from which group)
|
I vs. C
Time to discharge (min) 203.9±64.3 vs. 209.2±59.2
Pain Pain free period, mean±SD 23h 44m ±14h 34m vs. 18h 16m ±7h p=0.07
VRS (0=10) assessed by telephone call Data is not stated in numbers, only figure provided. Patients had significantly more pain in placebo group at 1st and 2nd postoperative days. At discharge, operative day 8pm and 3rd postoperative day no significant differences were found.
Analgesic consumption (mean total ketobemidon consumption for 3 postop days (range): 2 (0-7) vs. 3 (0-16) p=0.067
Sleep problems, n: 6 vs. 15, p=0.029
Adverse effects (post operative nausea and vomiting) Operation day: 7 vs. 6 p=0.82 Day 1: 11 vs. 8 p=0.54 Day 2: 9 vs. 5 p=0.27
Technical problems: 1 disconnection (child pulled out catheter), 5 pts. reported leakage, 2 pts. had difficulties sleeping, 3 pts. problems using toilet with the pump, no toxic effects, no problems with termination.
Patient satisfaction: Very satisfactory: 18 vs. 13 Satisfactory: 11 vs. 14 Neutral: 1 vs. 2 Unsatisfactory: 0 vs. 1 Very unsatisfactory: 0 vs. 0 P=0.47 |
The long-lasting effect of bolus injection in the study might be the explanation for the lack of differences in pain experience between our two groups on the operation day.
Conclusion: continuous sciatic nerve block is a valuable and safe method for pain control after outpatients’ foot surgery. It gives better analgesia and less pronounced sleep disturbance on the first night at home than placebo. No adverse effects were reported.
|
|
Popliteal sciatic nerve block versus spinal anesthesia |
|||||||
|
Jeon, 2013 |
Type of study: RCT
Setting: hospital
Country: Korea
Source of funding: not stated |
Inclusion criteria: 20 – 65 yrs, ASA 1-2, due for elective hallux valgus surgery
Exclusion criteria: spinal malformation, nerve system conditions, regular administration of medication due to medical or surgical disease, hemostatic disorders or infection at the anesthetic injection site
N total at baseline: 40 Intervention: 20 Control: 20
Important prognostic factors2: age ± SD: I: 50.4±8.1 C:49.9±8.5
Sex: (f/m) I: 0/20 C: 0/20
Groups comparable at baseline? yes
|
Popliteal sciatic nerve block (PSNB) group was administered with a mixture of 10 ml of normal saline and 30 ml of 0.75% ropivacaïne
For postoperative pain control, a PCA pump (was connected (basal rate: 10 ml/h, bolus: 2 ml, lock out interval: 30 min) to administer a mixture of 50 ml mepivacaïne and 150 ml of normal saline solution. The PCA provided pain block for up to 1 day after surgery, and it was not refilled when all the medication was used.
Extra analgesics and sedatives were administered relative to the degree of the block. About 50-100 μg of fentanyl was administered IV if the patient complained of pain, and 2 mg of midazolam was administered IV if the patient complained of anxiety. During surgery, 5-10 mg of ephedrine was administered IV when the systolic blood pressure fell below 100 mmHg, and 0.5 mg of atropine was administered IV when bradycardia occurred (heart rate < 50 BPM). |
In the spinal anesthesia group (n = 20 2.5 ml of 0.5% hyperbaric bupivacaine ) was administered
|
Length of follow-up: 3 days
Loss-to-follow-up: -
Incomplete outcome data: -
|
Time from block to op. start (min) 21.8 ± 8.1 vs. 13.4 ± 3.1 p<0.05
Postoperative adverse events PDPH 0 vs. 2 (10%) Urinary retention 0 vs. 4 (20%) Hypotension 0 vs. 15% Bradycardia 0 vs. 10% Shivering 0 vs. 5% Vomiting 0 vs. 5% Postoperative headache 0 vs. 20%
Patient satisfaction (surveyed with 5 classifications, very satisfied-average, survey) 17 (85%) vs. 12 (60%) NS
|
This study, which was conducted in patients who underwent hallux valgus surgery, resulted in a longer duration for application of anesthesia and longer surgery time in the ropivacaïne-administered PSNB group relative to the spinal anesthesia group. The PSNB group was associated with a low incidence of anesthesia-related complications, relatively high patient satisfaction with the anesthesia procedure, and effective post-surgical pain control. The authors suggest that PSNB be considered as the anesthetic procedure for hallux valgus surgery anesthesia and for postoperative pain control, especially in patients for whom spinal anesthesia is not feasible. |
|
Ankle block vs. spinal / general anaesthesia |
|||||||
|
Kullenberg, 2006 |
Type of study: RCT
Setting: hospital
Country: Sweden
Source of funding: not stated |
Inclusion criteria: Patients undergoing forefoot surgery.
Exclusion criteria: Not described
N total at baseline:116 Intervention: 54 Control: 62
Important prognostic factors2: For example age ± SD: I: 62±10.3 C: 49.0±12.6
Sex (m/f: I: 4/54 C: 7/62
Type of procedure: First metatarsal osteotomy: 56 Osteotomy of 2-5 metatarsal: 14 Isolated lesser toe procedures: 20 Combined first and lesser toe: 26
Groups comparable at baseline? Yes |
Ankle block using a mixture of 10 ml mepivacaïne (10mg/ml) + 10ml ropivacaïne (10mg/ml), blocking 5 nerves (posterior tibial, deep peroneal, saphenous, superficial peroneal, sural (only with lateral foot surgery).
Surgery using pneumatic ankle tourniquet
|
Spinal/general anaesthesia
Surgery using pneumatic ankle tourniquet
|
Length of follow-up: 48h
Loss-to-follow-up: Not described
Incomplete outcome data: Not described
|
I vs. C
Pain (VAS) on discharge during walking mean±sd 2.3±2.1 vs. 2.1±1.8
Use of morphine (mean mg/24h): 11.6±7.3 vs. 15.8±6.2 p=0.04
Intraoperative anaesthetic agents mean µg: 60±16 vs. 123±32 p=0 0012
In hospital care time (min) 280±62 vs. 375±90, p<0.001 |
|
Notes:
1. Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
2. Provide data per treatment group on the most important prognostic factors [(potential) confounders]
3. For case-control studies, provide sufficient detail on the procedure used to match cases and controls
4. For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Adam, 2012 |
Computer generated, randomised assignments |
unlikely |
Unclear (no blinding) |
Unlikely (no blinding) |
Unclear (no blinding) |
Unlikely |
Unlikely |
Unlikely |
|
Samuel, 2008 |
Computerized random number generator |
Unlikely |
Unlikely (blinding) |
Unlikely (blinding) |
Unlikely (blinding) |
Unlikely |
Unlikely |
Unlikely |
|
Turan, 2007 |
Not described |
Unlikely |
Unlikely (blinding) |
Unlikely (blinding) |
Unlikely (blinding) |
Unlikely |
Unlikely |
Unlikely |
|
White, 2003 |
Computer generated randomization number table |
Unclear |
Unlikely (blinding) |
Unlikely (blinding) |
Unlikely (blinding) |
Unclear (some outcomes in methods – results do not correspond) |
Unlikely |
Unlikely |
|
Jeon, 2013 |
Unclear |
Unclear |
Unclear (no blinding, could influence outcome assessment) |
Unlikely (blinding) |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Clough, 2003 |
Unclear |
Unlikely |
Unlikely |
Likely (anesthesist was not blinded, and intraoperative pain control was different) |
Unlikely |
Unlikely |
Unclear |
Unclear (patients who could not be contacted for follow-up were excluded, not stated how many, from which group, and how they were analysed. |
|
Zaric, 2004 |
Unclear |
Unlikely |
Unlikely (blinding) |
Unlikely (blinding) |
Unlikely (blinding) |
Unclear (some outcomes are not clearly reported on) |
unclear |
Unclear (patients were excluded because of breach of protocol, not clearly stated from which group, and how results are analysed). |
|
Migues, 2005 |
Random numbers table |
Unlikely |
Unlikely (not described, but unlikely to influence) |
Unlikely |
Unlikely |
Unlikely |
Unclear (not described) |
Unlikely |
|
Kullenberg, 2006 |
Randomised (process unclear) |
Unclear (nor |
Unlikely (not described, but unlikely to influence) |
Unlikely (no blinding) |
Unlikely (no blinding) |
Unclear (outcomes are not described in methods section, but not all relevant outcomes are described) |
Unclear (not described) |
Unlikely |
1. Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
2. Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
3. Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
4. Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
5. If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
6. Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 29-07-2021
De Nederlandse Orthopaedische Vereniging is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
In samenwerking met
- Nederlandse Huisartsen Genootschap (NHG)
- Nederlandse Vereniging van Podotherapeuten (NVvP)
- Stichting Landelijk Overkoepelend Orgaan voor de Podologie (LOOP)
- Vereniging Gipsverbandmeesters Nederland (VGN)
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel van de richtlijn
Het doel van de werkgroep was het opstellen van multidisciplinaire landelijke richtlijn over hallux valgus. De richtlijnwerkgroep heeft als doel waar mogelijk te komen tot evidence based aanbevelingen ten aanzien van diagnostiek, conservatieve dan wel operatieve behandeling, de keuze van de operatietechniek en tot slot nabehandeling.
Het doel van de richtlijn is om te komen tot optimalisatie van de zorg rondom patiënten met primaire idiopatische en verworven hallux valgus bij volwassenen (exclusief iatrogene hallux valgus).
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met hallux valgus. Hierbij wordt in eerste instantie geadresseerd aan orthopedisch chirurgen, huisartsen, radiologen, anesthesiologen-pijnbestrijders, fysiotherapeuten, podotherapeuten, registerpodologen en gipsverbandmeesters. Tevens kan de richtlijn gebruikt worden door de patiëntenvereniging om uniforme voorlichting mogelijk te maken.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2013 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met hallux valgus te maken hebben (zie hiervoor de samenstelling van de werkgroep). De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende één jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
-
Dr. B.J. Burger, orthopedisch chirurg, werkzaam in Medisch Centrum Alkmaar (voorzitter) (NOV);
-
Dr. I.V. van Dalen, orthopedisch chirurg, werkzaam in de Bergman Kliniek te Naarden (NOV);
-
J.E. Fluit, gipsverbandmeester, werkzaam in het Onze LieveVrouwe Gasthuis te Amsterdam (VGN);
-
M. van der Goot, fysiotherapeut en registerpodoloog, werkzaam in Back in shape te Badhoevedorp (KNGF, stichting LOOP);
-
Drs. J.F. Hoekstra, huisarts, werkzaam in Huisartsenpraktijk Dros Hoekstra te Den Burg Texel (NHG);
-
E. Poppe, MSc, podotherapeut en beleidsmedeweker, werkzaam bij Sportpodotherapie Fuit te Rijswijk en bij Nederlandse Vereniging van Podotherapeuten te Hilversum (NVvP);
-
Drs. A.G.F. Witteveen, orthopedisch chirurg, werkzaam in st. Maartenskliniek te Nijmegen (NOV);
-
Dr. M.A. Witlox, orthopedisch chirurg, werkzaam in MUMC te Maastricht (NOV).
-
Dr. P. Hennis. Anesthesioloog, werkzaam in Zuwe Hofpoort ziekenhuis te Woerden (NVA)
Meelezers:
-
Mw. drs. Ing. A.S.D. van der Wilk, Orthopedisch Technoloog, bewegingswetenschapper, werkzaam bij Universitair medisch centrum Groningen (UMCG), bestuurslid Nederlandse Beroepsvereniging Orthopedisch Technologen (NBOT).
-
Mw. H. Schepers, Orthopedisch schoenmaker, NBOT
Met ondersteuning van:
-
Dr. M.A. Pols, senior adviseur, Kennisinstituut van Medisch Specialisten;
-
Drs. S. Mulder, adviseur, Kennisinstituut van Medisch Specialisten;
-
E.E Volmeijer, MSc, junior adviseur Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen door middel van reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten (KiMS ), een overzicht vindt u hieronder:
|
|
Financiële belangen |
Overige belangen |
|
I.V. Van Dalen |
Geen gemeld |
Geen gemeld |
|
JF Hoekstra |
Geen gemeld |
Geen gemeld |
|
J.E. Fluit |
Geen gemeld |
Geen gemeld |
|
B.J. Burger |
Geen gemeld |
Geen gemeld |
|
E. Poppe |
Geen gemeld |
Geen gemeld |
|
A.G.H. Witteveen |
Geen gemeld |
Geen gemeld |
|
A. Witlox |
Geen gemeld |
Geen gemeld |
|
M. van der Goot |
Geen gemeld |
Geen gemeld |
|
P. Hennis |
Geen gemeld |
Geen gemeld |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het houden van een focusgroep en search naar het patiëntenperspectief. Een verslag van de focusgroep is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Het verslag is te vinden in aanverwant 'Verslag patiëntengroep'. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de deelnemers van de focusgroep.
Methode ontwikkeling
Evidence based
Implementatie
Bij deze richtlijn is een implementatieplan opgesteld (zie aanverwante producten).
Werkwijze
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van de volgende verenigingen: Zorgverzekeringen Nederland (ZN), Nederlandse Orthopaedische Vereniging (NOV), Nederlands Huisartsen Genootschap (NHG), Vereniging Gipsverbandmeesters Nederland (VGN) via een invitational conference. Een verslag hiervan kunt u vinden in aanverwant 'Verslag invitational conference richtlijn hallux valgus'.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk en onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt is.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en naar systematische reviews. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de quality assessment tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADEmethode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) (Atkins et al, 2004).
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden. De bewijskracht van de conclusie is bepaald volgens de gebruikelijke EBRO-methode (van Everdingen et al, 2004).
Formuleren van de conclusies
Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusie, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in module 'Organisatie van zorg bij hallux valgus'.
Indicatorontwikkeling
Bij deze richtlijn werden geen indicatoren ontwikkeld.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in aanverwant 'Lacunes in kennis'.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
