GBS Prognose
Uitgangsvraag
- Is de prognose van GBS op het functioneren (stoornissen, activiteiten en participatie) en de kwaliteit van leven in een vroeg stadium te voorspellen?
- Zijn er specifieke kritische factoren bekend die de prognose van GBS op de langere termijn positief of negatief beïnvloeden?
Aanbeveling
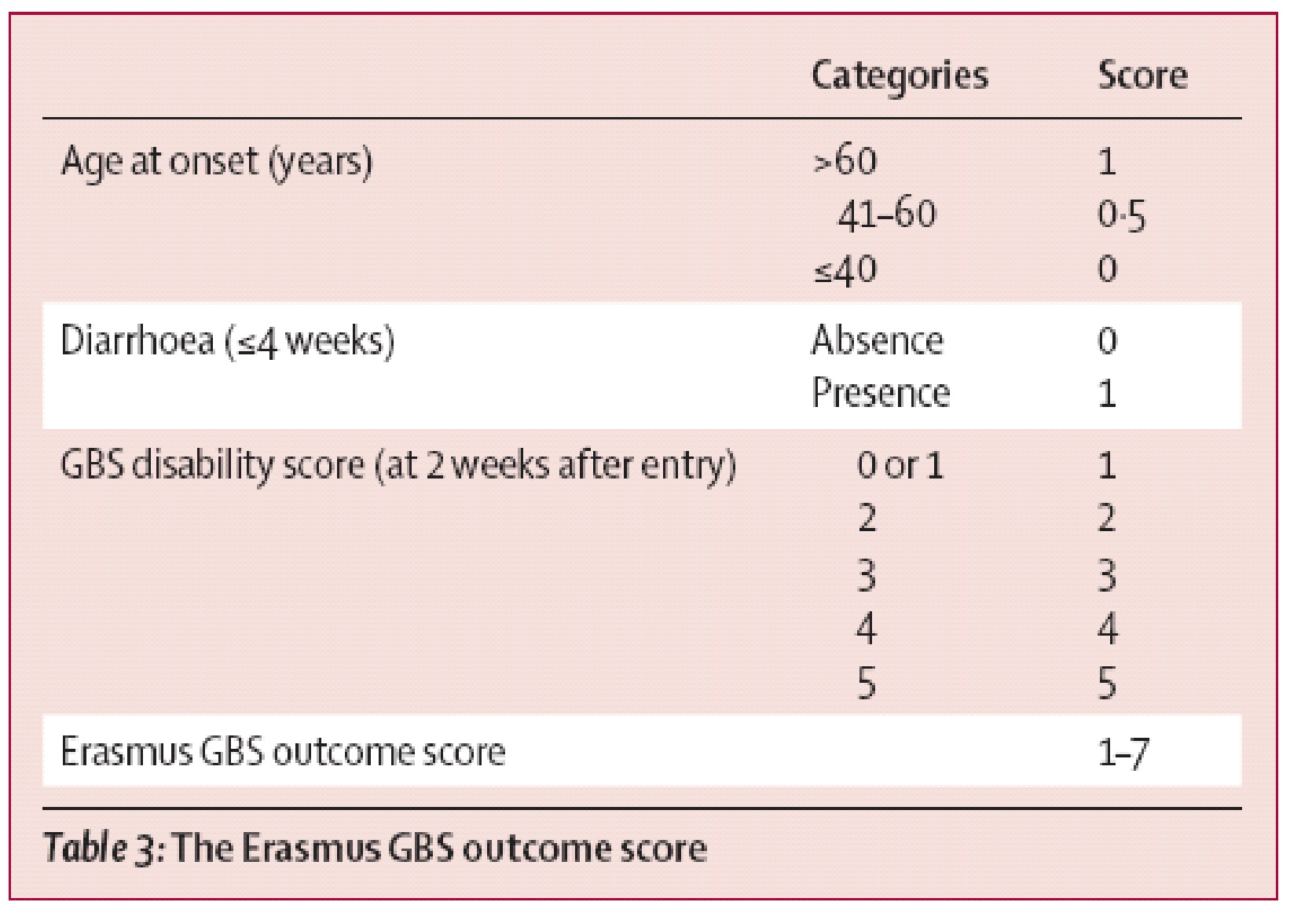
Om meer duidelijkheid te krijgen over de prognose van GBS wordt aanbevolen hiervoor een prognostisch model te gebruiken. Met behulp van de 'Erasmus GBS outcome score' (EGOS) kan al in de eerste twee weken na opname in het ziekenhuis eenvoudig de kans worden bepaald of een patiënt een half jaar na het begin van GBS weer zelfstandig kan lopen.
Hiervoor zijn de volgende gegevens noodzakelijk: leeftijd van de patiënt, aanwezigheid van diarree vóór het ontstaan van de zwakte, ernst van de zwakte (MRC-sumscore of ‘GBS disability score’) één tot twee weken na opname. Het wordt daarom aanbevolen om deze gegevens te noteren.
Overwegingen
Alhoewel de ernst van de gevoelsstoornissen en het al of niet ontbreken van peesreflexen in de literatuur ook worden geassocieerd met de prognose, is de werkgroep van mening dat deze parameters in het praktisch gebruik vrij subjectief en afhankelijk van de expertise van de onderzoeker zijn. Ook de aan- of afwezigheid van een bovensteluchtweginfectie is in de dagelijkse praktijk lastig goed te definiëren en aan te tonen. Om deze redenen is gekozen deze parameters uiteindelijk niet op te nemen in de aanbevelingen.
Een van de belangrijkste klinische parameters in het voorspellen van de prognose is de ‘GBS disability score’ (zie ‘Beoordelingsschalen’). De werkgroep beveelt gebruik van deze score dan ook aan in de progressieve fase.
Vanaf twee weken na het ontstaan van de klachten kan met een EMG de mate van axonale schade bij GBS worden bepaald (zie module ‘Diagnostiek’).
In een recente studie (Kuitwaard, 2009) is gebleken dat de mate van stijging van het IgG-gehalte tijdens immuunglobulinebehandeling een onafhankelijke voorspeller is van de prognose. Hierbij geldt dat hoe groter de toename van de IgG-spiegel in serum is, hoe beter het herstel.
Deze parameter zou een belangrijke voorspeller kunnen worden van de kans op herstel bij patiënten behandeld met IVIg. De waarde ervan in de praktijk wordt momenteel in een prospectieve trial onderzocht.
Onderbouwing
Achtergrond
Het Guillain-Barré syndroom is een zeldzame ziekte met vaak ernstige verschijnselen. Het herstel is wisselend: veel patiënten herstellen volledig maar bij een aanzienlijk aantal patiënten blijven restverschijnselen bestaan. Het kan zinvol zijn al in een vroeg stadium te trachten in te schatten hoe het herstel van een patiënt zal verlopen. Dit maakt het mogelijk om adequaat te beslissen over behandeling en begeleiding van de patiënt. In deze module wordt uiteengezet welke factoren de prognose van de patiënt na minimaal een half jaar mogelijk kunnen beïnvloeden. Dit betreft de prognose op het functioneren in ADL-activiteiten, vrijetijdsbesteding, sociale omgang en arbeid. Ook werd in de literatuur gezocht naar de prognose op kwaliteit van leven, dat deels ook samenhangt met het functioneren.
Voor de prognose wat betreft de kans op beademing: zie module ‘Monitoring in de progressieve fase’.
Conclusies / Summary of Findings
|
Niveau 2 |
Hogere leeftijd lijkt een voorspeller te zijn van een slechtere uitkomst bij patiënten met GBS, zowel na zes maanden als na meer dan een jaar.
B Fletcher, 2000; Rees, 1995; Durand, 2006; Dhar, 2008 C Hadden, 2001; Visser, 1999; Winer, 1988; Chio, 2003; The Italian GBS Study Group, 1996; Van Koningsveld, 2007 |
|
Niveau 2 |
Ernstig krachtverlies, gevoelsstoornissen en de mate van beperkingen op het dieptepunt van de ziekte en de noodzaak tot beademing kunnen mogelijk eveneens een slechtere uitkomst bij patiënten met GBS voorspellen. Voor het krachtverlies en de gevoelsstoornissen is dit zowel voor de prognose na zes maanden als voor de prognose na één jaar onderzocht; voor noodzaak tot beademing is dit alleen bekend voor de prognose na een jaar.
B Cheng, 2003; Rees, 1995; Fletcher, 2000 C Chio, 2003; The Italian GBS Study Group, 1996; Visser, 1999; Hadden, 2001; Winer, 1988; Van Koningsveld, 2007 |
|
Niveau 3 |
Er zijn aanwijzingen dat voorafgaande gastro-intestinale infectie of bewezen C. jejuni-infectie, maar mogelijk ook een langere initiële progressie en veel of vooral axonale schade op het EMG voorspellers zijn van een slechtere uitkomst, zowel voor de periode korter dan een jaar als voor een periode van meer dan een jaar.
B Fletcher, 2000; Rees, 1995 C Visser, 1999; Hadden, 2001; The Italian GBS Study Group, 1996; Kuwabara, 2001; Chio, 2003; Van Koningsveld, 2007 |
|
Niveau 3 |
Een lagere leeftijd, voorafgaande infectie met H. influenza of een voorafgaande bovenste luchtweginfectie, minder ernstige uitval, behouden peesreflexen en behandeling met intraveneus immuunglobuline lijken voorspellers van een betere uitkomst na zes maanden bij patiënten met GBS.
C Kuwabara, 2001; Van Koningsveld, 2007 |
Samenvatting literatuur
Er werden acht artikelen geselecteerd die een follow-up van een half jaar tot een jaar beschrijven en dertien artikelen met een follow-up van een jaar en langer.
Uit de geselecteerde literatuur kwam een aantal factoren naar voren die de prognose van GBS in een vroeg stadium in meer of mindere mate kunnen geven. In deze tekst zal een onderscheid gemaakt worden tussen klinische factoren, laboratoriumparameters en bevindingen bij elektrofysiologisch onderzoek. Onder klinische factoren worden die factoren verstaan die door middel van anamnese, lichamelijk onderzoek of observatie van de patiënt kunnen worden vastgesteld.
Indien mogelijk wordt vermeld of een factor de prognose op korte termijn (minder dan een jaar) dan wel op lange(re) termijn geeft.
Alle studies richten zich op de functionele uitkomst waarbij in de meeste gevallen onderscheid wordt gemaakt tussen een goede en een slechte(re) uitkomst. Een goede uitkomst wordt in vrijwel alle studies gedefinieerd als graad 2 of minder op de ‘GBS disability’-schaal (zie bijlage ‘Beoordelingschalen’). In de studie van Chio (2003) en Rees (1995) wordt een goede uitkomst gedefinieerd als graad 1 of minder op deze schaal. Alleen in de studie van Cheng werd een goede uitkomst gedefinieerd als graad 3 of minder (Cheng, 2003) en in de studie van Winer werd de definitie voor goede uitkomst na twaalf maanden bepaald als ‘in staat handwerk te verrichten’ (Winer, 1988). Studies met als eindpunt ‘kwaliteit van leven’ werden niet gevonden.
In tabel 1 (item 1-4) zijn de klinische factoren weergegeven waarvan duidelijk vaststaat dat ze geassocieerd zijn met een slechtere prognose. Voor een hogere graad op de ‘GBS disability’-schaal ten tijde van het dieptepunt van de ziekte wordt in één studie geen duidelijk afkappunt gegeven (Cheng, 2003), één studie hanteert een waarde van 3 of hoger (Chio, 2003) en de twee resterende studies een waarde van 4 of hoger (Italian GBS study Group, 1996; Lee, 2008). Eén studie betrof GBS bij kinderen (n=56; gemiddelde leeftijd 8,6 jaar) (Lee, 2008).
Ook voor een hogere leeftijd ten tijde van de diagnose GBS is er geen eensluidende leeftijdsgrens. Sommige studies hanteren puur het begrip ‘hogere leeftijd’. In studies waarin wel een afkapwaarde voor de leeftijd wordt gegeven, varieert deze van ouder dan veertig jaar tot ouder dan zestig jaar. In het algemeen geldt wel: hoe hoger de leeftijd, des te slechter de prognose.
Een aantal factoren is minder frequent onderzocht maar lijkt ook een voorspellende waarde te hebben over een slechtere prognose (tabel 1; item 5-9). De definitie van “langere periode tot dieptepunt ziekte” is in de literatuur vaak niet duidelijk omschreven. In de studie van Fletcher werd de tijd tot het dieptepunt van de ziekte na het ontstaan van neurologische symptomen beschouwd als een continue variabele. Er werd een ‘odds ratio’ (OR) van 1,1 voor de kans op een slechter herstel gevonden per dag ‘uitstel’. In een andere studie werd de periode opgedeeld in perioden van één à twee weken. Ook uit deze studie bleek: hoe langer wordt gewacht met behandeling, hoe slechter de prognose.
Ook een lagere MRC-sumscore werd in drie studies genoemd als voorspeller van een slechte prognose. In de studie van Visser ging het om een sumscore < 40 (bij een maximaal te behalen score van 60, dus < 66%) ten tijde van de start van behandeling. In de studie van Cheng (2000) werd een sumscore < 32 op het dieptepunt van de ziekte als negatieve voorspeller genoemd. In deze studie werd uitgegaan van een maximaal te behalen score van 40 (dus < 80%). In de studie van Van Koningsveld werd de score in vijf categorieën ingedeeld van vier keer tien en één keer twintig punten. Daarbij geldt: hoe lager de scorecategorie, hoe groter de kans op een slechte prognose.
Tabel 1. Klinische factoren geassocieerd met een slechtere prognose
|
Factor |
Aantal studies |
Duur van de follow-up |
|
5 |
> 1 jaar: 4 studies; < 1 jaar: 1 studie |
|
2. Noodzaak tot beademing** 2 |
2 |
> 1 jaar |
|
3. Voorafgaande gastro-intestinale infectie 3
|
4
|
< 1 jaar: 3 studies; ≥ 1 jaar: 1 studie |
|
10 |
< 1 jaar: 4 studies; > 1 jaar: 6 studies |
|
2 |
< 1 jaar: 1 studie; ≥ 1 jaar: 1 studie |
|
2 |
< 1 jaar: 1 studie; ≥ 1 jaar: 1 studie |
|
1 |
> 1 jaar |
|
2 |
> 1 jaar |
|
1 |
> 1 jaar |
1 Chio, 2003; Cheng, 2003; Italian GBS study Group, 1996; Lee, 2008; Van Koningsveld, 2007
2 Winer, 1985; Rees, 1995
3 Visser, 1999; Hadden, 2001; Van Koningsveld, 2007; The Italian GBS Study Group, 1996
4 Winer, 1988; Rees, 1995; The Italian GBS Study Group, 1996; Visser, 1999; Fletcher, 2000; Hadden, 2001; Chio, 2003; Durand, 2006; Dhar, 2008; Van Koningsveld, 2007
5 Rees, 1995; Visser, 1999
6 Fletcher, 2000; Hadden, 2001
7 Dhar, 2008
8 Fletcher, 2000; The Italian GBS Study Group, 1996
9 The Italian GBS Study Group, 1996
** Noodzaak tot beademing komt tevens overeen met een ‘GBS disability score’ van 5.
Voor een aantal klinische factoren werd een associatie gevonden met een betere prognose (tabel 3): behouden peesreflexen, behandeling met IVIg, voorafgaande infectie met Haemophilus influenzae (Kuwabara, 2001) en voorafgaande bovenste luchtweginfectie (Van Koningsveld, 2007). Deze factoren werden gevonden in een studie met een follow-up van zes maanden. Het is niet bekend in hoeverre de genoemde factoren ook de prognose na een jaar en langer kunnen geven.
Een aantal laboratoriumparameters geeft een indicatie voor een slechtere prognose. Deze zijn samengevat in tabel 2. De aanwezigheid van IgG1-anti-GM1-antistoffen geeft een slechtere prognose terwijl de aanwezigheid van IgG3-anti-GM1-antistoffen, eventueel naast IgG1-anti-GM1-antistoffen juist een betere prognose indiceert (Koga, 2003; Jacobs, 2008).
De genoemde laboratoriumparameters zijn grotendeels gevonden in studies met een follow-up van zes maanden. De waarde van deze parameters voor de langeretermijnprognose is niet bekend.
Tabel 2. Laboratoriumparameters geassocieerd met een slechtere prognose
|
Factor |
Aantal studies |
follow-up in de studies |
|
C. jejuni positiviteit 1 |
5 |
< 1 jaar: 4 studies; ≥ 1 jaar: 1 studie |
|
Verhoogde concentraties van “soluble” interleukine 2R (sIL-2R) (> 4 ng/ml) 2 |
1 |
< 1 jaar |
|
Aanwezigheid IgG1-anti-GM1-antistoffen 3 |
1 |
< 1 jaar |
|
Geringe stijging serum IgG na IVIg 4 |
1 |
< 1 jaar |
1 Rees, 1995; Visser, 1999; Kuwabara, 2001; Van Koningsveld, 2007; Hadden, 2001
2 Hadden, 2001
3 Koga, 2003; Jacobs, 2008
4 Kuitwaard, 2009
Tabel 3. Klinische en laboratoriumparameters geassocieerd met een betere prognose
|
Factor |
Aantal studies |
follow-up in de studies |
|
Behouden peesreflexen1 |
1 |
< 1 jaar: 1 studie |
|
Behandeling met IVIg1 |
1 |
< 1 jaar: 1 studie |
|
Voorafgaande infectie met Haemophilus Influenza1 |
1 |
< 1 jaar: 1 studie |
|
Aanwezigheid IgG3-anti-GM1-antistoffen2 |
2 |
< 1 jaar: 2 studies |
|
Voorafgaande bovenste luchtweginfectie3 |
1 |
< 1 jaar: 1 studie |
1 Kuwabara, 2001
2 Koga, 2003; Jacobs, 2008
3 Van Koningsveld, 2007
Wat betreft elektrofysiologische bevindingen zijn met name niet-stimuleerbare motorische zenuwen (Hadden, 2001; Fletcher, 2000) en een axonaal of gemengd (axonaal en demyeliniserend) patroon (Chio, 2003; Italian GBS Study Group, 1996) voorspellers van een slechtere prognose. Ook een geleidingsblok van de n. peroneus werd gevonden als een voorspeller van slecht herstel na zes maanden (Durand, 2006).
Over de prognostische factoren voor kinderen met GBS zijn weinig studies beschikbaar. In drie restrospectieve case-series van 175, 57 en 56 kinderen (Korinthenberg, 1996; Ammache, 2001; Lee, 2008) en één prospectief onderzoek bij 59 kinderen (Korinthenberg, 2007) wordt met name de maximale ernst van de uitval en beperkingen zoals weergegeven door de 'GBS disability score' bevestigd als geassocieerd met de prognose (hoe ernstiger het beeld, hoe groter de kans op minder snel herstel). Ook een hoger eiwitgehalte in de liquor en axonale schade bij EMG-onderzoek lijken geassocieerd met een grotere kans op langdurige beperkingen.
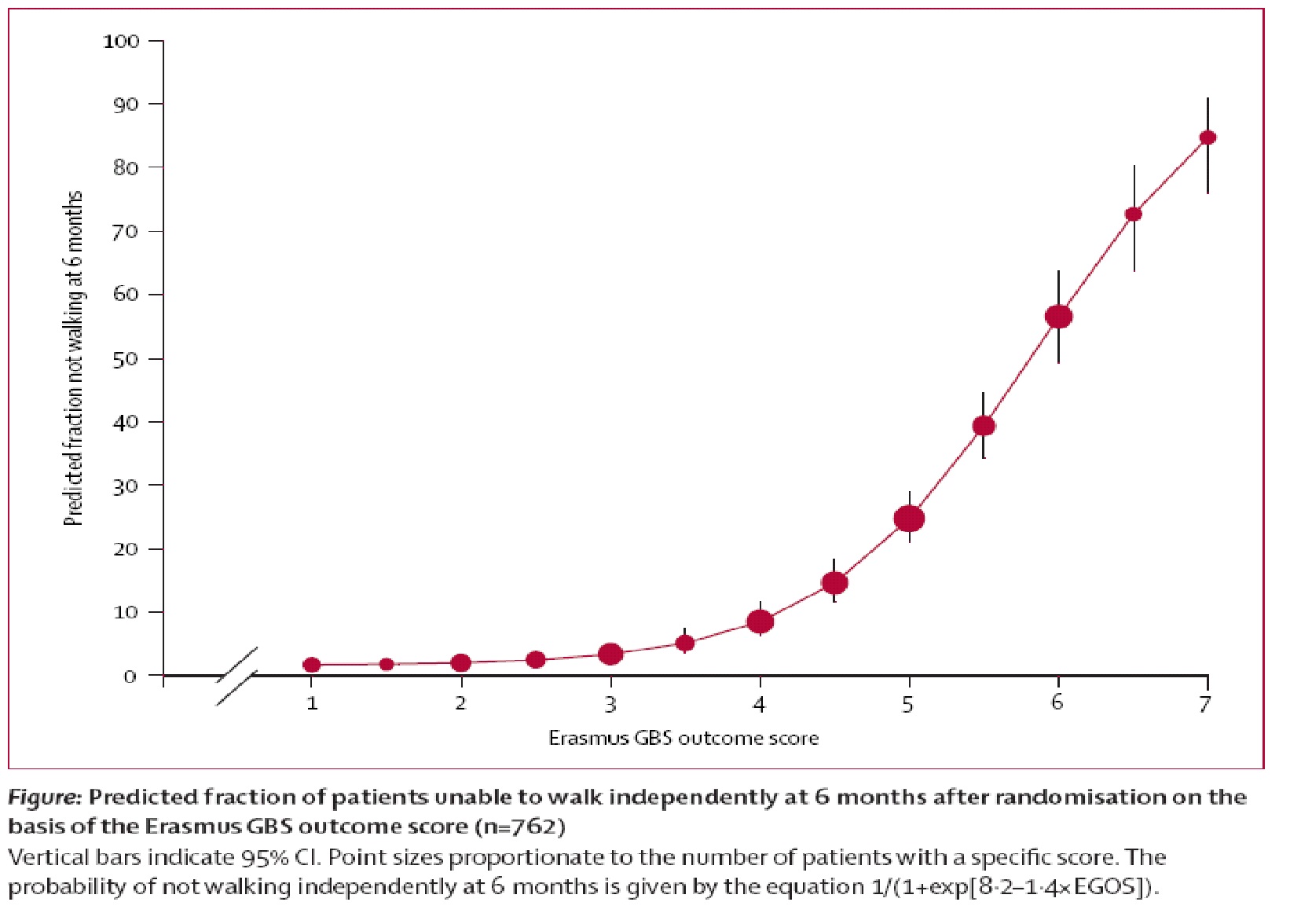
In de studie van Van Koningsveld werd een gevalideerde prognostische scoreformule ontwikkeld: de ‘Erasmus GBS Outcome Score’ (EGOS). De formule werd ontwikkeld in een cohort van 388 patiënten met GBS, die deelnamen aan twee RCT’s en een pilotstudie. De formule werd vervolgens getest op validiteit in een cohort van 374 patiënten met GBS uit een andere RCT. Met het finale model, waarin leeftijd, voorafgaande diarree en ‘GBS disability score’ na twee weken waren opgenomen, kon de uitkomst na zes maanden voorspeld worden. Het model had een goed onderscheidend vermogen met een 'area under the curve' (AUC) van 0,85 (Van Koningsveld, 2007). De opbouw van de score is weergegeven in tabel 4. Bij een score van 4 is 10% van de patiënten niet in staat tot zelfstandig lopen na zes maanden, bij een score van 6 is dat circa 55% (zie tabel en figuur hieronder). De auteurs geven aan dat de generaliseerbaarheid beperkt zou kunnen worden door het feit dat de score is ontwikkeld bij uitsluitend ernstig aangedane volwassen patiënten.
Tabel 4. Erasmus GBS Outcome Score (EGOS)
Tabel en figuur zijn met toestemming overgenomen uit de Lancet Neurology 6(7). Van Koningsveld R, Steyerberg EW, Hughes RAC, Swan AV, van Doorn PA, Jacobs BC. A clinical prognostic scoring system for Guillain-Barré syndrome. 589-94, Copyright Elsevier 2007.
Referenties
- Ammache Z. Childhood Guillain-Barré Syndrome: Clinical and Electrophysiologic Features Predictive of Outcome. J Child Neurol 2001;16:477-83
- Cheng QJ, Jianga G-X, Pressa R, Andersson M, Ekstedt B, Vrethem M et al. Clinical epidemiology of Guillain-Barré syndrome in adults in Sweden 1996-97: A prospective study. Eur J Neurol 2000;7:685-92.
- Cheng B-C, Chang W-N, Chang C-S, Chee C-Y, Huang C-R, Chen J-B et al. Guillain-Barré syndrome in southern Taiwan: clinical features, prognostic factors and therapeutic outcomes. Eur J Neurol 2003;10:655662.
- Chio A Cocito D, Leone M, Giordana MT, Mora G, Mutani R. Guillain-Barré syndrome: A prospective, population-based incidence and outcome survey. Neurology 2003;60(7):1146-50.
- Dhar R, Stitt L, Hahn AF. The morbidity and outcome of patients with Guillain-Barré syndrome admitted to the intensive care unit. J Neurol Sci 2008;264:121-28.
- Durand MC, Porcher R, Orlikowski D, Aboab J, Devaux C, Clair B, et al. Clinical and electrophysiological predictors of respiratory failure in Guillain-Barré syndrome: a prospective study. Lancet Neurol 2006;5(12):1021-8.
- Fletcher DD, Lawn ND, Wolter TD, Wijdicks EF. Long-term outcome in patients with Guillain-Barré syndrome requiring mechanical ventilation. Neurology 2000;54(12):2311-5.
- Hadden RD, Karch H, Hartung HP, Zielasek J, Weissbrich B, Schubert J, et al. Preceding infections, immune factors, and outcome in Guillain-Barré syndrome. Neurology 2001;56(6):758-65.
- Jacobs BC, Koga M, van Rijs W, Geleijns K, van Doorn PA, Willison HJ, Yuki N. Subclass IgG to motor gangliosides related to infection and clinical course in Guillain-Barré syndrome. J Neuroimmunol 2008;194(1-2):181-90.
- Koga M, Yuki N, Hirata K, Morimatsu M, Mori M, Kuwabara S. Anti-GM1 antibody IgG subclass: a clinical recovery predictor in Guillain-Barré syndrome. Neurology 2003;60(9):1514-8.
- Korinthenberg R. Natural history and treatment effects in GuillainBarré syndrome: A multicentre study. Arch Dis Child 1996;74:2817.
- Korinthenberg R. Clinical presentation and course of childhood Guillain-Barré syndrome: a prospective multicentre study. Neuropediatrics 2007:38(1):10-7.
- Kuitwaard K, de Gelder J, Tio-Gillen AP, Hop WC, van Gelder T, van Toorenenbergen AW, van Doorn PA, Jacobs BC. Pharmacokinetics of intravenous immunoglobulin and outcome in Guillain-Barré syndrome. Ann Neurol 2009;66(5):597-603.
- Kuwabara S, Mori M, Ogawara K, Hattori T, Yuki N. Indicators of rapid clinical recovery in Guillain-Barré syndrome. J Neurol Neurosurg Psychiatry 2001;70:560562.
- Lee J, Young Sung I, Sun Rew I. Clinical presentation and prognosis of childhood Guillain-Barré syndrome. J Paediatr Child Health 2008,(44):449-454.
- Rees JH, Soudain SE, Gregson NA, Hughes RAC. Campylobacter jejuni infection and Guillain-Barré syndrome. N Eng J Med 1995;333(21):1374-9.
- The Italian Guillain-Barré Study Group. The prognosis and main prognostic indicators of Guillain-Barré syndrome. A multicentre prospective study of 297 patients. Brain 1996;119:2053-61.
- Van Koningsveld R, Steyerberg EW, Hughes RAC, Swan AV, van Doorn PA, Jacobs BC. A clinical prognostic scoring system for Guillain-Barré syndrome. Lancet Neurology 2007;6(7):589-94.
- Visser LH, Schmitz PI, Meulstee J, van Doorn PA, van der Meche FG. Dutch Guillain-Barré Study Group. Prognostic factors of Guillain-Barré syndrome after intravenous immunoglobulin or plasma exchange. Neurology 1999;53(3):598-604.
- Winer JB, Hughes RA, Greenwood RJ, Perkin GD, Healy MJ. Prognosis in Guillain-Barré syndrome. Lancet 1985;1(8439):1202-1203.
- Winer JB, Hughes RAC, Osmond C. A prospective study of acute idiopathic neuropathy. I. Clinical features and their prognostic value. Journal of Neurology, Neurosurgery & Psychiatry 1988;51(5):605-612.
Evidence tabellen
Bewijsklassetabel Prognose follow-up minder dan een jaar
|
Auteur en jaar |
Bewijs kracht |
studie-type |
patiënten kenmerken |
inclusiecriteria |
methoden |
eindpunten |
resultaten |
opmerkingen/ |
|
Hadden, 2001 |
C |
prospectieve cohortstudie in een RCT (internationaal multicenter) |
n=229 (in dit artikel geen info over verdeling geslacht, leeftijd e.d.) |
Voor de trial: lft. > 16 jaar, niet kunnen lopen zonder hulpmiddel en begin ziekte < 14 dagen voor randomisatie. |
|
Hier alleen “outcome” genomen |
Alleen de resultaten m.b.t. outcome in evidencetabel opgenomen. “poor outcome” geassocieerd met infectie met C. Jejuni, IgA-antilichamen op Western-Blot en diarree: 35% van patiënten met diarree had “poor outcome” t.o.v. 11% zonder diarree (p=< 0,0001). Met logistische regressie sign. associatie met: diarree, hogere leeftijd, ernstige zwakte arm, “inexcitable” motorische zenuwen, verhoogde serum sIL-2R concentraties en afwezige IgM antilichamen tegen ganglioside GM1. Logistische regressie met uitsluitend simpele variabelen: aritmie waarvoor noodzaak behandeling, diarree, “inexcitable” zenuwen, lft.>50, ernstige zwakte arm. |
Definitie “poor outcome”: sterfte of onvermogen 5 meter te lopen zonder hulp(middel) 48 weken na begin GBS.
|
|
Koga, 2003 |
B |
prospectieve cohortstudie |
n=134, waarvan 42 (31%) anti-GM1 IgG antilichamen |
Criteria van Asbury en Cornblath |
Bepaling van de subklassen van IgG antilichamen |
klinisch herstel en uitkomst na 1,3 en 6 maanden |
IgG1: (n=32; 76%), vaak voorafgaande symptomen gastro-intestinale infectie en pos. serologie voor C. Jejuni IgG3: (n=13; 31%), vaak voorafgaande bovenste luchtweginfectie. Bij nadir geen verschil tussen beide subklassen m.b.t. ernst. Na 6 maanden bij 25% van IgG1 “disability grade” ≥ 3; bij IgG3 na 1 maand 100% “disability grade” ≤ 2. |
Alleen uitkomst na 6 maanden genomen. |
|
Kuwabara, 2001 |
C |
prospectieve cohortstudie met als doel het vinden van factoren die geassocieerd zijn met snel herstel. F-up 6 maanden. |
n=80, mediane lft. 42 jaar (3-80) |
Criteria van Asbury muv. areflexie. |
|
|
9 (11%) snel herstel (bij nadir niet sign. verschillend van overige 71 patiënten). Associatie met snel herstel: behouden peesreflexen, IVIg-behandeling en voorafgaande infectie met H. influenzae. Geassocieerd met zowel snel als traag herstel: anti-GM1 IgG antilichamen en “acute motor axonal neuropathy”. Geassocieerd met traag herstel: infectie met C. jejuni |
Snel herstel gedefinieerd als: verbetering van 2 of meer graden op de GBS “disability scale” binnen 2 weken na nadir. Traag herstel: onvermogen tot zelfstandig lopen na 6 maanden. |
|
Visser, 1999 |
C |
Prospectieve studie bij 147 deelnemers aan de GBS-trial, waarin het effect van IVIg en PF vergeleken worden. |
n=147 (voor overige gegevens wordt verwezen naar het artikel betreffende de GBS-trial) |
|
|
zelfstandig lopen na 8 weken en 6 maanden sinds de start van de behandeling. |
Sign. associatie met het niet zelfstandig kunnen lopen na 6 maanden: lft. ≥ 50 jaar, MRC sumscore < 40 (bij de start van behandeling), voorafgaande gastro-intestinale ziekte, snel optreden van zwakte (≤ 4). |
Alleen uitkomst na 6 maanden voor deze uitgangsvraag meegenomen |
|
Van Koningsveld, 2007 |
C |
Prognostische studie met 2 cohorten samengesteld uit deelnemers aan trials. Doel: ontwikkelen en valideren van een model waarmee in de acute fase van GBS de uitkomst na 6 maanden voorspeld kon worden. |
“Derivation set” (n=397): deelnemers aan 2 RCT’s en 1 pilotstudie. Validatieset (n=379): deelnemers aan multicenter RCT. |
criteria van Asbury, zwakte ontstaan binnen 2 weken voor start studie, niet in staat 10 meter te lopen zonder hulp, lft. > 5 jaar. Validatieset: idem, maar leeftijdsgrens 16 jaar. |
Uit artikelen kenmerken gehaald die sign. geassocieerd zijn met uitkomst. Sign. factoren in univariate analyse getest in multivariate analyse via backward stepwise methode. |
GBS “disability” score na 6 maanden |
Na exclusie 388 patiënten in derivatieset, waarvan 18% (n=71) niet in staat tot zelfstandig lopen na 6 maanden. Gem. lft. 49 jaar. Na exclusie 374 patiënten in validatieset, waarvan 22% (n=83) niet in staat tot zelfstandig lopen na 6 maanden. Gem. lft. 52 jaar.
Univariaat voorspellende factoren: leeftijd, voorafgaande diarree, voorafgaande bovenste luchtweginfectie (voorspelt betere uitkomst), voor afgaande infectie met C. jejuni, GBS disability score bij start studie en na 2 weken, MRC somscore bij start studie.
Finale model: leeftijd, voorafgaande diarree, GBS “disability”score 2 weken na inclusie in studie (AUC: 0,85).
|
“poor outcome”: GBS “disability” score na 6 maanden ≥ 3. “fairly good outcome”: GBS “disability” score ≤ 2.
Commentaar van Leger et al: niet geschikt voor milde gevallen van GBS, validatie in prospectief cohort noodzakelijk, geen Aziatische patiënten in studie. |
|
Durand, 2006 |
B |
Prospectieve cohortstudie met als doel het identificeren van klinische en elektrofysiologische factoren die ademinsufficiëntie voorspellen. |
n=154 (34 beademd, 120 niet) |
criteria van Asbury, complete elektrofysiol. testbatterij ondergaan, geen beademing voor of binnen 24 uur na elektrofysiol. tests. |
In eerste instantie een model geselecteerd om beademing te voorspellen. Naderhand geanalyseerd of het model ook lange-termijn prognose (6 mnd.) kan voorspellen. |
GBS “disability grade” na 6 maanden |
Na 6 maanden 42 patiënten met een “disability grade” ≥ 2. Voorspellers van “poor” recovery waren leeftijd > 40 jaar en de proximale/distale compound muscle action potential (p/dCMAP) < 55,6%.
N.B. auteurs plaatsen zelf in de discussie enkele kanttekeningen: - lange-termijn “disability” was geen prim. eindpunt, - diverse factoren die geassocieerd zijn met slecht herstel waren niet correct onderzocht, - f-up van 6 maanden is erg kort. |
Artikel focust m.n. op voorspellen beademing. Een klein deel is gewijd aan voorspellen outcome na maanden. Alleen dit stukje beschreven in de evidencetabel. |
|
Jacobs, 2008 |
B |
Prospectieve studie (f-up 6 maanden) naar de rol van “subclass IgG tegen motor gangliosiden”. |
176 deelnemers aan een RCT naar het effect van IVIg en placebo tov. IVIg en methyl-prednisolon waarvan serum samples beschikbaar waren. Bovendien serum samples van 50 gezonde controles. |
Diagn. criteria van Asbury, niet in staat 10 m te lopen zonder hulp en verwezen binnen 2 weken na ontstaan zwakte. |
|
|
Sign. slechter herstel bij patiënten met alleen IgG1 antilichamen tegen “motor gangliosides” t.o.v. patiënten met zowel IgG1 als IgG3 antilichamen (percentage niet in staat tot zelfstandig lopen na 6 maanden: 38% t.o.v. 0%). |
|
|
Korinthen berg, 2007 |
B |
Prospectieve multicenter studie. Mediane follow-up 288 dagen (10-604) |
n=95: 53 m/ 42 v, mediane lft. 6,2 jaar (12 maanden-16,5 jaar).
|
Kinderen van leeftijd waarop ze zelfstandig kunnen lopen tot 18 jaar. Diagn. criteria van Asbury, incl. liquor. informed consent van ouders of patiënt. |
Kaplan-Meier analyse. Variabelen met p<0,1 bij Kaplan-Meier analyseals onafhankelijke variabelen in multivariate Cox regressie analyse. |
|
75% symptoomvrij bij laatste follow-up. CSF-eiwit en IVIg op eerste dag diagnose sign. gerelateerd aan verbetering van 1 graad op GBS-schaal. Tijd tot zelfstandig lopen alleen sign. gerelateerd aan ernst op dieptepunt. Jongere lft. en pos. Coxackievirus-serologie sign. pos. relatie met snelheid symptoomvrij raken. |
|
Bewijsklassetabel Prognose follow-up van een jaar en langer
|
Auteur en jaar |
Bewijs kracht |
studie-type |
patiënten kenmerken |
inclusiecriteria |
methoden |
resultaten |
opmerkingen/ |
|||
|
Fletcher, 2000 |
B |
Retrospectief cohortonderzoek Doel: in een ongeselecteerde groep beademde patiënten de belangrijkste voorspellende factoren voor uitkomst bepalen. |
n=114 IC- patiënten met GBS (incl. 10 kinderen). n=60 (v.d. 114) beademd. Voor 105 f-up beschikbaar. |
Diagn. criteria van Asbury (ook kinderen en patiënten met atypische varianten) |
review van medische statussen. Indien een patiënt bij de laatste controle niet graad 2 bereikt had,werd telefonisch een “semigestructureerd” interview afgenomen. |
n=79 (75%) goede uitkomst, n=26 (25%) “poor outcome”. Beademingsbehoefte geassocieerd met “poor outcome”. Voorspellende factoren voor uitkomst bij max. herstel in beademde patiënten (univariaat): hogere leeftijd, langere beademingsduur (duur > 4 maanden altijd “poor outcome”), paralyse bovenste ledematen bij dieptepunt “disability”, “inexcitable nerves” In multivariate analyse: hogere leeftijd. Univariate voorspellers van “poor outcome” na 1 jaar: hogere leeftijd, beademingsduur, paralyse bovenste ledematen, “inexcitable nerves” en langere periode tot dieptepunt “disability”. Onafhankelijke (multivariate) voorspellers van “poor 1 year outcome”: hogere leeftijd en langere periode tot dieptepunt “disability” en insturen naar gespecialiseerde kliniek na > 2 dagen. Onafh. voorspellers van max. outcome: leeftijd en insturen naar gespecialiseerde kliniek na > 2 dagen. |
Definities: goede uitkomst: ≤ 2. “poor outcome”: graad 3-6. Max. herstel: max. bereikte functionele graad waarbij geen verdere klinische verbetering meer optreedt (zonder aanwezige comorbiditeit). |
|||
|
Cheng, 2000 |
B |
Prospectief follow-up (min. 1 jaar) onderzoek van incidente patiënten |
n=53, gem. lft. 52,6 jaar (18-89). Gem. duur tot “nadir” 16 dagen, 88% na 1 jaar volledig hersteld of met milde restsymptomen. 35% PF, 46% IVIg, 6% steroïden, 7% meer dan 1 type behandeling. 6% (n=3) beademd. |
NINCDS criteria |
MRC score |
Alleen de “MRC-sumscore” (<32) bij “nadir” had een sign. associatie met restverschijnselen na 1 jaar. |
|
|||
|
Rees, 1995 |
B |
Prospectieve case-controle studie naar de rol van C. Jejuni infecties. Aanvullend werden alle patiënten een jaar gevolgd om het effect van C. jejuni op de prognose te onderzoeken. |
n=103 (96 GBS en 7 MFS); gem. lft. 48 jaar. Voor elke patiënt twee controles (1 “household control” en 1 “hospital control”) zonder acute neuropathie of diarree. |
Criteria van Asbury |
Vragenlijst, 5 aspecten neurol. status via graderingschaal en onderzoek van bloed en ontlasting. Elektrofysiologisch onderzoek.
Verschillen in uitkomst na 1 jaar d.m.v. chi2 test. Logistische regressie om odds-ratio’s voor slechte prognostische factoren. |
Sign. grotere mate van “disability” na 1 jaar in de C.Jejuni-positieve groep.
13 patiënten geclassificeerd als “poor outcome” (6 overleden, 7 disability grade ≥ 3). Multivariate analyse liet sign. effecten zien van hogere leeftijd, C.jejuni pos., noodzaak tot beademing en gebonden zijn aan bed binnen 2 dagen na het optreden van de symptomen. |
Voor deze uitgangsvraag alleen de gegevens over C.Jejuni als prognostische factor gebruikt. |
|||
|
Winer, 1985 |
C |
Prospectieve follow-up studie (12 maanden) van deelnemers aan 2 trials. |
n=71; deelnemers aan een trial met prednisolon en een trial met plasmaferese. |
Niet genoemd in het artikel. |
Twee groepen gevormd o.b.v. de uitkomst na 12 maanden: “good outcome” en “poor outcome” (≥ 2: in staat tot 5 meter lopen zonder hulp, echter niet in staat tot handwerk incl. huishouden, winkelen en tuinieren). Frequentie van diverse kenmerken in beide groepen bepaald. Mogelijke associaties getest met chi2 test. |
“poor outcome” groep gem. ernstigere afwijkingen en gem. langere tijd tot begin van verbetering. Sign. kenmerken: noodzaak tot beademing, niet optreden van verbetering < 1 maand na begin ziekte en interval > 3 weken tussen dieptepunt en begin verbetering. Geen sign. associaties gevonden voor: leeftijd, aantal cellen in de liquor en aanwezigheid van bulbaire verschijnselen. |
8 overleden patiënten opgenomen in “poor outcome” groep. Zowel behandelde als onbehandelde patiënten in deze studie. |
|||
|
Winer, 1988 |
C |
Prospectieve cohortstudie |
n=100. 10 patiënten plasmaferese, 12 prednisolon, 2 iv methyl prednisolon |
Progr. zwakte > 1 ledemaat, afwezige reflexen of verminderde reflexen in aanwezigheid van elektrofysiologische afwijkingen, bestaan symptomen < 2 maanden, geen andere verklarende oorzaken. |
Review van de statussen van aangemelde patiënten, interview, lich. onderzoek. Onderzoek en bepaling “disability scale” na 3, 12 en 52 weken. |
Na 12 maanden: 13 patiënten overleden, 19 nog “disabled” (graad ≥ 2). De 4 belangrijkste factoren die “poor outcome” voorspelden (zie ook tabel 8 in het artikel): - leeftijd ≥ 40 (rel. risico (RR) op “poor outcome na 1 jaar: 4,4), - bereiken van “disability grade” 4 na < 4 dagen (RR 3,1), - noodzaak tot beademing (RR 2,6) - “abductor pollicis muscle action potentials (APB MAP) ≤ 1mV (RR 3,8). |
Voor deze vraag alleen “poor outcome” gedefinieerd als graad 2 of meer na 12 maanden genomen. Logistische regressie van associatie van diverse factoren op uitkomst voor 82 patiënten (17 patiënten hadden zodanig mild verloop dat zij nimmer het criterium voor “poor outcome” bereikt hebben, 1 patiënt met ataxie van Friedreich werd ook geëxcludeerd). |
|||
|
Lee, 2008 |
B |
Retrospectieve review van statussen van kinderen met GBS verwezen naar FT en revalidatie afdeling na behandeling met PF of IVIg. |
n=56 (35 m/ 21 m; gem. lft. 8,6 ± 5 jaar. |
|
Groep opgedeeld naar GBS “disability scale” 1t/m3 enerzijds en 4 en 5 anderzijds op het dieptepunt van de ziekte. |
Patiënten met “disability scale” 4 of 5 op het dieptepunt van de ziekte hebben een sign. slechtere uitkomst na 2 jaar. |
|
|||
|
Dhar, 2008 |
B |
Review van statussen van patiënten die tussen 1983 en 2003 naar ICU waren verwezen met GBS. |
n=76 (46 m/30v), gem. lft. 56 jaar. Voor 70% f-up gegevens voor min. 1 jaar beschikbaar, voor 37% zelfs voor ≥ 4 jaar. |
geen kinderen en geen CIDP of andere op GBS gelijkende ziektebeelden. |
|
goede uitkomst: n=56, slechte uitkomst n=19. Hogere leeftijd (“good outcome” groep gem. 52,2 en “poor outcome” groep gem. 67,6 jaar) en ernstige comorbiditeit waren sign. geassocieerd met een slechte uitkomst. |
Definitie goede uitkomst: GBS-schaal ≤ 2. |
|||
|
Chio, 2003 |
C |
Prospectieve studie, f-up 2 jaar (voor 108 patiënten: 7 overleden, 5 lost to f-up) |
n=120, 74m/46v, gem. lft. 51,2 jaar (3 mnd.– 86 jaar). 113 GBS, 7 MFS. |
Standaard diagnostische criteria. Exclusie-criteria: zie artikel blz. 1147 (“diagnostic criteria”) |
Factoren die gerelateerd waren aan de lange-termijn prognose werden geanalyseerd dmv. een forward stepwise multivariate logistische regressie. |
Na 2 jaar 79,6% (n=86) goed herstel (graad < 2). Factoren die univariaat sign. gerelateerd waren aan slechte uitkomst: graad ≥ 3 op het dieptepunt, lft. ≥ 50, ademhalingsinsufficiëntie, axonaal of gemengd EMG, geen voorafgaande infectie, autonome betrokkenheid. Multivariaat: graad op dieptepunt en lft. ≥ 50. Model zonder graad op dieptepunt: lft. ≥ 50, axonaal of gemengd EMG en geen voorafgaande luchtweginfecties. |
|
|||
|
The Italian GBS Study Group, 1996 |
C |
prospectieve studie, f-up 2 jaar |
n=297, 193m/104v, lft. 3-87. F-up gem. 309 dagen. 11% (n=33) overleden, incompl. evaluatie voor 10% (n=32). |
Standaard diagnostische criteria met een geringe aanpassing.
|
vragenlijsten, compleet neurologisch onderzoek bij elke controle, elektrofysiologisch onderzoek. Voor elke prognostische factor univariate analyse |
Na 2 jaar: 212 (71%) hersteld, 48 (16%) restverschijnselen. Multivariaat: leeftijd (>54), voorafgaande gastroenteritis, “disability” at “nadir” (≥4), elektrofysiol. patroon suggestief voor “axonopathy”, tijd tot dieptepunt en langere duur van de actieve ziekte negatief geassocieerd met herstel. Goede uitkomst na voorafgaande influenza. |
Over de tijd tot het dieptepunt (nadir) is niet duidelijk wanneer dit een negatief effect heeft. Uit tabel 4 zou geconcludeerd kunnen worden “hoe langer, hoe slechter”. Echter in de discussie wordt aangegeven dat de bevinding uit eerdere studies dat een kortere tijd tot nadir een slechtere prognose geeft, bevestigd wordt in deze studie. |
|||
|
Cheng, 2003 |
B |
Retrospectieve studie |
n=96, 61m, gem. lft. 42,8 (2-86)/ 35v, gem. lft. 37,3 (2-78) |
Standaard diagnostische criteria. Exclusiecriteria: zie blz. 656 van het artikel |
Analyse van factoren tussen groepen met goede en slechte uitkomst. Stepwise logistic regression om relatie tussen klinische factoren en “treatment failure rate” te analyseren. |
F-up ≥ 1jaar: 64% hersteld, 31% restverschijnselen, 5% overleden. Alleen “disability” op het dieptepunt onafhankelijk geassocieerd met “treatment failure rate”. |
|
|||
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-06-2014
Beoordeeld op geldigheid : 24-01-2011
Uiterlijk in 2020 wordt door de Vereniging Spierziekten Nederland (VSN), na raadpleging van of op advies van aan de richtlijn participerende verenigingen, bepaald of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om (delen van) de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Algemene gegevens
Ook geautoriseerd door
- Uitvoeringsinstituut WerknemersVerzekeringen
In samenwerking met
- Agis Zorgverzekeringen
- Koninklijk Nederlands Genootschap voor Fysiotherapie
- Nederlands Huisartsen Genootschap
- Nederlandse Vereniging voor Cardiologie
- Nederlandse Vereniging voor Psychologen
- Vereniging Samenwerkingsverband Chronische Ademhalingsondersteuning
De richtlijn is tot stand gekomen met ondersteuning van Kwaliteitsinstituut voor de Gezondheidszorg (CBO) en met financiële steun ZonMw in het kader van het programma Kennisbeleid, Kwaliteit Curatieve Zorg.
Het Guillain-Barré syndroom (GBS) is een zeldzame ziekte met een zeer zware ziektelast. De ziekte leidt binnen enkele uren tot dagen tot verlammingsverschijnselen. Ongeveer 25% van de patiënten met het Guillain-Barré syndroom heeft kunstmatige beademing nodig waarvoor de patiënt wordt opgenomen op de IC.
Sommige patiënten herstellen volledig, maar een groot deel niet. Oud-patiënten geven aan dat met name de niet-zichtbare handicaps van de ziekte zoals een snelle vermoeidheid, beperkte belastbaarheid en pijn niet onderkend worden door bedrijfs- en verzekeringsartsen. Hierdoor worden regelmatig verkeerde re-integratietrajecten ingezet met alle gevolgen van dien.
Het zeldzaam vóórkomen van het Guillain-Barré syndroom maakt dat de parate kennis van veel behandelaars over deze ziekte beperkt is. Dit heeft tot gevolg dat er regelmatig gekozen wordt voor een eigen beleid dat afwijkt van de ‘best practice’. Dit gebeurt zowel tijdens de progressieve en plateaufase als tijdens de herstel- en late fase. Het is daarom belangrijk na te gaan welke behandeling de beste is en hoe het re-integratietraject optimaal vorm gegeven kan worden.
Bovengenoemde overwegingen waren voor de patiëntenvereniging, de Vereniging Spierziekten Nederland (VSN), aanleiding het initiatief te nemen voor de ontwikkeling van een multidisciplinaire, ‘evidence-based’ richtlijn voor diagnostiek en behandeling van het Guillain-Barré syndroom. Het Kwaliteitsinstituut voor de Gezondheidszorg CBO verleende hierbij methodologische expertise.
Doel en doelgroep
Doelstelling
Deze richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het vaststellen van goed medisch handelen. Er wordt aangegeven wat in het algemeen de beste zorg is voor patiënten met het Guillain-Barré syndroom. De richtlijn geeft aanbevelingen over de diagnostiek, verwijzing, behandeling en re-integratie van patiënten met het Guillain-Barré syndroom en kan worden gebruikt bij het geven van voorlichting aan patiënten. Ook biedt de richtlijn aanknopingspunten voor bijvoorbeeld transmurale afspraken of lokale protocollen ter bevordering van de implementatie.
Het doel is het verkrijgen van uniformiteit in de diagnostiek, behandeling en begeleiding in de diverse centra en het definiëren van de kaders waarbinnen de multidisciplinaire zorg van patiënten met het Guillain-Barré syndroom moet plaatsvinden. Deze richtlijn zal naar verwachting ook bijdragen aan verbeterde communicatie tussen behandelaars en patiënten en tussen behandelaars onderling.
Specifieke doelen van deze richtlijn zijn:
- het voorkómen van gezondheidsschade bij patiënten door het geven van concrete aanbevelingen over verbeterde diagnostische en therapeutische mogelijkheden;
- het doen van duidelijke uitspraken over te verrichten diagnostiek en behandeling van GBS bij volwassenen en kinderen en over het te volgen re-integratietraject.
Doelgroep
De richtlijn is bedoeld voor alle zorgverleners die bij de behandeling en begeleiding van patiënten met het Guillain-Barré syndroom betrokken zijn, met name huisartsen, (kinder)neurologen, revalidatieartsen, kinderartsen, bedrijfs-/verzekeringsartsen, fysiotherapeuten, psychologen en (IC-)-verpleegkundigen.
Samenstelling werkgroep
Voor het ontwikkelen van deze richtlijn is in 2008 een multidisciplinaire werkgroep samengesteld bestaande uit vertegenwoordigers van alle bij de diagnostiek, behandeling en begeleiding van patiënten met het Guillain-Barré syndroom betrokken medische disciplines, beleidsmedewerkers van de patiëntenvereniging, de Vereniging Spierziekten Nederland (VSN) en adviseurs van het Kwaliteitsinstituut voor de Gezondheidszorg CBO (zie hieronder).
Bij het samenstellen van de werkgroep is rekening gehouden met de geografische spreiding van de werkgroepleden, met een evenredige vertegenwoordiging van de verschillende betrokken verenigingen en instanties alsmede met een spreiding al dan niet in academische achtergrond. De werkgroepleden hebben onafhankelijk gehandeld en waren gemandateerd door hun vereniging. Een overzicht van de belangenverklaringen van werkgroepleden over mogelijke financiële belangenverstrengeling is als addendum bij de richtlijn gevoegd.
Samenstelling werkgroep
- Dhr. prof.dr. P.A. van Doorn, neuroloog, Eramus Medisch Centrum, Rotterdam, voorzitter
- Dhr. dr. J.W.G. Meijer, revalidatiearts, Revant Revalidatiecentrum Breda, vicevoorzitter
- Dhr. drs. E.S. Alberga, bedrijfsarts, Groningen
- Mw. dr. N. van Alfen, neuroloog, Universitair Medisch Centrum St. Radboud, Nijmegen
- Dhr. mr.drs. E.R. Berends, verzekeringsgeneeskundige, UWV, Assen
- Mw. drs. H.A. Berendsen, revalidatiearts, Sophia Revalidatie, Delft
- Dhr. dr. R.A.J.A.M. Bernsen, neuroloog, Jeroen Bosch Ziekenhuis, ’s Hertogenbosch
- Mw. mr. P.H. Blomkwist-Markens, voorzitter diagnosewerkgroep GBS/CIDP, Vereniging Spierziekten Nederland, Amsterdam
- Mw. dr. J.G. Broeks, revalidatiearts, Scheperziekenhuis, Emmen
- Dhr. dr. P.G. Erdmann, fysiotherapeut / bewegingswetenschapper, Universitair Medisch Centrum, Utrecht
- Mw. T. Dingelhoff, secretaresse Vereniging Spierziekten Nederland, Baarn
- Mw. drs. J.M. van Haelst, revalidatiearts, Revalidatiecentrum Tolbrug, Oss
- Mw. dr. A.M.C. Horemans, hoofd kwaliteit van zorg, Vereniging Spierziekten Nederland, Baarn, projectleider
- Dhr. dr. M. van der Jagt, neuroloog-intensivist, Erasmus Medisch Centrum, Rotterdam
- Mw. dr. L. Kok, arts-epidemioloog, Kwaliteitsinstituut voor de Gezondheidszorg CBO, Utrecht
- Dhr. W.J. Lubbers, huisarts, Gezondheidscentrum Parkwijk, Almere
- Mw. J.H.A.T. van Mierlo, lid diagnosewerkgroep GBS/CIDP, Vereniging Spierziekten Nederland, ’s Hertogenbosch
- Dhr. dr. W.L. van der Pol, neuroloog, Universitair Medisch Centrum, Utrecht
- Mw. drs. M. Rol, revalidatiearts, Den Haag
- Mw. dr. K. Rosenbrand, arts, Kwaliteitsinstituut voor de Gezondheidszorg CBO, Utrecht
- Mw. dr. E.H. Tromp, klinisch neuropsycholoog, Revalidatiecentrum Tolbrug, Oss
- Mw. M. Twigt, IC-verpleegkundige, Hoofddorp
- Mw. drs. F. de Wit, beleidsmedewerker kwaliteit van zorg, Vereniging Spierziekten Nederland, Baarn
- Mw. drs. M. van der Wurff, medewerker communicatie, Vereniging Spierziekten Nederland, Baarn
Adviseurs GBS-richtlijn
- Dhr. dr. B. van den Berg, internist-intensivist, Erasmus Medisch Centrum, Rotterdam
- Mw. drs. J. Blees, kinderrevalidatiearts, Revalidatiecentrum De Trappenberg, Huizen
- Mw. dr. N.A.M. Cobben, longarts-intensivist, Academisch Ziekenhuis – Centrum voor Thuisbeademing, Maastricht
- Dhr. A. Comuth, kinderfysiotherapeut, Adelante kinderrevalidatie, speciaal onderwijs & wonen, Valkenburg
- Dhr. J. Crasborn, directeur strategie, AGIS, Amersfoort
- Dhr. dr. M.P.J. Garssen, neuroloog, Jeroen Bosch Ziekenhuis, ’s Hertogenbosch
- Dhr. dr. B.C. Jacobs, neuroloog, Erasmus Universiteit, Rotterdam
- Dhr. dr. J.L.M. Jongen, neuroloog, Erasmus Medisch Centrum, Rotterdam
- Dhr. dr. E.J.O. Kompanje, senior onderzoeker/klinische ethicus Intensive Care, Erasmus Medisch Centrum, Rotterdam
- Mw. dr. R. van Koningsveld, neuroloog, Elkerliek Ziekenhuis, Helmond
- Mw. G. Lammers, maatschappelijk werker, Revalidatiecentrum ’t Roessingh, Enschede
- Dhr. dr. I.S.J. Merkies, neuroloog, Spaarne Ziekenhuis, Hoofddorp
- Dhr. K.D. Pelger, fysiotherapeut, Mytylschool Gabriel, ’s Hertogenbosch
- Mw. dr. L. Ruts, neuroloog, Havenziekenhuis Rotterdam
- Mw. dr. L.T.L. Sie, kinderneuroloog, Universitair Medisch Centrum St. Radboud, Nijmegen
- Dhr. B. Verdonk, fysiotherapeut, Universitair Medisch Centrum, Utrecht
- Mw. M. Versluis, senior-beleidsmedewerker, NPCF, Utrecht
- Mw. drs. C. Walgaard, neuroloog i.o., Erasmus Medisch Centrum, Rotterdam
- Mw. E. Wiarda Rosen Jacobson, logopedist, Erasmus Medisch Centrum, Rotterdam
- Mw. J.C. Wijnen, diëtist, lid werkgroep diëtisten en spierziekten DVN, Oss
Inbreng patiëntenperspectief
Bij het opstellen van de richtlijn is rekening gehouden met het patiëntenperspectief. In de knelpuntanalyse heeft de betrokken patiëntenvereniging (VSN) eigen knelpunten tijdens een focusgroepbijeenkomst ingebracht. De conceptrichtlijn is ook voorgelegd aan de betrokken patiëntenvereniging (VSN). Tot slot zijn of worden de gegevens uit deze richtlijn verwerkt in het voorlichtingsmateriaal van deze patiëntenvereniging.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de ontwikkeling van het concept van de richtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen. De richtlijn wordt verspreid onder alle relevante beroepsgroepen en ziekenhuizen. Ook wordt een samenvatting van de richtlijn ter publicatie aangeboden aan het Nederlands Tijdschrift voor Geneeskunde en zal er in verschillende specifieke vaktijdschriften aandacht worden besteed aan de richtlijn. Daarnaast wordt de integrale tekst van de richtlijn op de websites van de patiëntenvereniging (VSN), het CBO en de betrokken beroepsverenigingen geplaatst.
Om de implementatie en evaluatie van deze richtlijn te stimuleren, zal de werkgroep een implementatieplan opstellen en een lijst van indicatoren ontwikkelen aan de hand waarvan de implementatie kan worden gemeten. Indicatoren geven in het algemeen de zorgverleners de mogelijkheid te evalueren of zij de gewenste zorg leveren. Zij kunnen daarmee ook onderwerpen voor verbeteringen van de zorgverlening identificeren.
De richtlijn wordt getoetst bij de eindgebruiker in de verschillende regio’s en wetenschappelijke verenigingen, waarbij ook visitaties zullen worden georganiseerd.
Werkwijze
Gezien de omvang van het werk werd een aantal subgroepen gevormd met vertegenwoordigers van relevante disciplines. De voorzitter en subvoorzitter zorgden samen met beleidsmedewerkers van de VSN en de adviseurs van het CBO voor de coördinatie en onderlinge afstemming van de subgroepen.
De werkgroep heeft gedurende een periode van ongeveer twee jaar gewerkt aan de tekst voor de conceptrichtlijn. De subgroepen beoordeelden de door de adviseurs van het CBO geschreven wetenschappelijke onderbouwingen en formuleerden vervolgens de overige overwegingen en aanbevelingen. Tevens schreven de subgroepen consensusteksten wanneer wetenschappelijk bewijs voor het beantwoorden van de uitgangsvraag ontbrak. De teksten werden tijdens plenaire vergaderingen besproken en na verwerking van de commentaren geaccordeerd. De voltallige werkgroep is twintigmaal (tien keer lijfelijk en tien keer telefonisch) bijeengeweest om de resultaten van de subgroepen in onderling verband te bespreken. De teksten van de subgroepen zijn door een redactieteam samengevoegd en op elkaar afgestemd tot één document: de conceptrichtlijn. Deze werd in juni 2010 aan de bij de richtlijn betrokken verenigingen verstuurd voor commentaar. Na verwerking van het commentaar is de richtlijn in november 2010 door de voltallige werkgroep vastgesteld en ter autorisatie naar de relevante beroepsverenigingen gestuurd.
De kwaliteit van deze artikelen werd door epidemiologen van het CBO beoordeeld aan de hand van ‘evidence-based richtlijnontwikkeling’ (EBRO)-beoordelingsformulieren. Artikelen van matige of slechte kwaliteit werden uitgesloten. Na deze selectie bleven de artikelen over die als onderbouwing bij de verschillende conclusies in de richtlijn staan vermeld. De geselecteerde artikelen zijn vervolgens gegradeerd naar de mate van bewijs waarbij de volgende indeling is gebruikt (tabel 1). De mate van bewijskracht en niveau van bewijs zijn in de conclusies van de verschillende hoofdstukken weergegeven. De belangrijkste literatuur waarop de conclusies zijn gebaseerd, is daarbij vermeld.
Indeling van de literatuur naar mate van bewijskracht
Tabel 1. Indeling van methodologische kwaliteit van individuele studies
|
|
Interventie |
Diagnostisch accuratesse onderzoek |
Schade of bijwerkingen, etiologie, prognose* |
|
A1 |
Systematische review van ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang. |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad. |
Prospectief cohortonderzoek van voldoende omvang en follow-up waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten. |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiëntcontrole- onderzoek, cohort-onderzoek). |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiëntcontroleonderzoek, cohortonderzoek). |
Vergelijkend onderzoek maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiëntcontroleonderzoek, cohortonderzoek). |
|
C |
Niet-vergelijkend onderzoek |
||
|
D |
Mening van deskundigen |
||
* Deze classificatie is alleen van toepassing in situaties waarin om ethische of andere redenen gecontroleerde trials niet mogelijk zijn. Zijn die wel mogelijk, dan geldt de classificatie voor interventies.
Tabel 2. Niveau van conclusies
|
|
Conclusie gebaseerd op |
|
1 |
Onderzoek van niveau A1 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2, met consistent resultaat |
|
2 |
Eén onderzoek van niveau A2 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
3 |
Eén onderzoek van niveau B of C |
|
4 |
Mening van deskundigen |
Totstandkoming van de aanbevelingen
Voor het komen tot een aanbeveling zijn er naast het wetenschappelijk bewijs vaak andere aspecten van belang zoals patiëntenvoorkeuren, beschikbaarheid van speciale technieken of expertise, organisatorische aspecten, maatschappelijke consequenties of kosten. Deze aspecten worden besproken na de ‘Conclusie’ in de ‘Overige overwegingen’. Hierin wordt de conclusie op basis van de literatuur in de context van de dagelijkse praktijk geplaatst en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van het beschikbare bewijs in combinatie met deze overwegingen. Het volgen van deze procedure en het opstellen van de richtlijn in dit ‘format’ heeft als doel de transparantie van de richtlijn te verhogen. Het biedt ruimte voor een efficiënte discussie tijdens de werkgroepvergaderingen en vergroot bovendien de helderheid voor de gebruiker van de richtlijn.
De richtlijn is niet allesomvattend
Bij het opstellen van de richtlijn is uitgegaan van de op dit moment belangrijkste knelpunten en aandachtspunten in de behandeling en begeleiding van patiënten met GBS. Deze punten zijn door oud-patiënten en zorgverleners aangedragen en vertaald in uitgangsvragen voor de richtlijn. De richtlijn beoogt geen allesomvattend leerboek te zijn maar biedt praktische aanknopingspunten voor zorgverleners bij de belangrijkste uitgangsvragen.
Bij het beantwoorden van de uitgangsvragen is uitgegaan van de zorg die specifiek is voor patiënten met GBS. De gebruikelijke zorg en de algemeen gangbare activiteiten zijn niet vermeld in de richtlijn. Dit houdt in dat bijvoorbeeld algemeen therapeutische zorg alleen dan vermeld wordt als deze afwijkt van de algemeen gangbare therapeutische interventies (zoals verwacht volgens de algemeen geldende stand van wetenschap en praktijk).
Zoekverantwoording
De aanbevelingen uit deze richtlijn zijn voor zover mogelijk gebaseerd op bewijs uit gepubliceerd wetenschappelijk onderzoek. Relevante artikelen werden gezocht door het verrichten van systematische zoekacties in de Cochrane Library, Medline, Embase. Hierbij werd de taal gelimiteerd tot Nederlands, Engels, Duits en Frans. Daarnaast werden handmatige zoekacties verricht. Er werd gezocht vanaf 1966 (Medline) of 1980 (Embase) tot mei 2008. Als trefwoorden voor de patiëntenpopulatie in Medline werden gebruikt: de MESH (Medical Subject Heading) termen: Guillain-Barré Syndrome / all subheadings or "Polyradiculoneuropathy" / all subheadings.
Verder werd gezocht met de vrije tekstwoorden: Guillain or (gbs near syndrome) or (acute inflammatory demyelinating polyneuropathie) or AIDP or (Acute Motor Axonal Neuropathy or AMAN) or [(Acute Motor adj sensory Neuropathy) or AMSAN] or (Fisher* Syndrome or Miller-Fisher).
Belangrijke selectiecriteria hierbij waren: vergelijkend onderzoek met hoge bewijskracht zoals meta-analyses, systematische reviews, randomized controlled trials (RCT’s) en controlled trials (CT). Waar deze niet voorhanden waren, werd verder gezocht naar vergelijkend cohort-onderzoek, vergelijkende patiëntcontrolestudies of niet-vergelijkend onderzoek. Voor de beantwoording van sommige uitgangsvragen werd ter meningsvorming ook gebruik gemaakt van case-reports.
