GBS Pijn
Uitgangsvraag
- Welke vormen van pijn komen voor, hoe vaak en in welke fase van de ziekte?
- Hoe kan pijn worden voorkómen, onderkend en behandeld?
- Hoe te handelen bij pijn bij patiënten met GBS (faseoverstijgend)?
Aanbeveling
Gezien het zeer frequente voorkomen van pijn bij GBS is aandacht hiervoor bij elke patiënt noodzakelijk. Het is aan te bevelen extra alert te zijn op het vóórkomen van pijn bij patiënten met GBS in de progressieve fase en bij patiënten die moeilijk of niet kunnen communiceren, zoals patiënten die beademd worden.
Pijnmeting bij patiënten met GBS is belangrijk en moet bij voorkeur regelmatig plaatsvinden (zowel in de progressieve fase als in de andere fasen van GBS) zodat pijn zo adequaat mogelijk behandeld kan worden. In de progressieve fase van GBS wordt aangeraden om ten minste dagelijks naar het vóórkomen en naar de ernst van de pijn te vragen. Hiervoor kan bij volwassenen met GBS onder andere de VAS of NRS gebruikt worden en bij kinderen de Smiley-scale.
Er dient onderscheid gemaakt te worden tussen pijn in het bewegingsapparaat, viscerale pijn of neuropathische pijn daar dit samen met de ernst van de pijn mede bepalend is voor het type en de intensiteit van de behandeling.
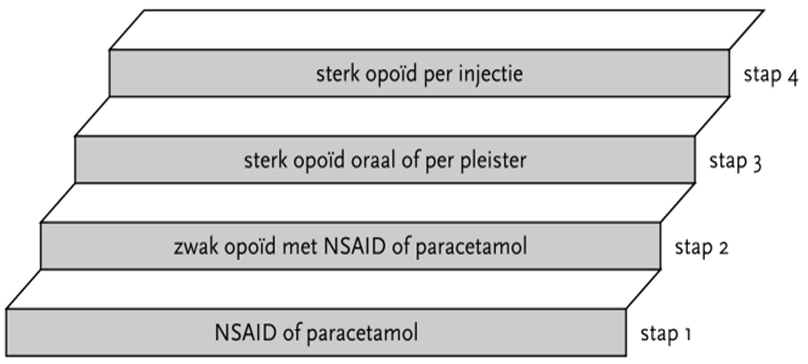
Pijnlijke neuropathieën bij patiënten met GBS worden bij voorkeur behandeld volgens de aanbevelingen in de Richtlijn Polyneuropathie (2005). De WHO-pijnladder kan hierbij behulpzaam zijn. Voorzichtigheid is geboden bij stap 4 van de WHO-pijnladder in verband met de kans op autonome klachten en ademdepressie. Bij gebruik van opioïden dient rekening te worden gehouden met respiratoire insufficiëntie en het mogelijk optreden van een ileus.
In het algemeen wordt het gebruik van tricyclische antidepressiva (zoals amitriptyline) in de progressieve fase van de ziekte ontraden in verband met een mogelijk verhoogde kans op hartritmestoornissen.
Overwegingen
Pijn komt zeer veel voor en is daarmee een belangrijk probleem bij patiënten met GBS in alle fasen van de ziekte. Aandacht hiervoor is absoluut noodzakelijk. Zowel bij kinderen als bij volwassen kan pijn de eerste uiting van de ziekte zijn. Onbekendheid hiermee blijkt in de praktijk het stellen van de diagnose soms te bemoeilijken. In de progressieve fase van de ziekte kan pijn traumatisch zijn voor patiënten die moeilijk of niet kunnen communiceren, zoals tijdens beademing (zie Module ' IC en beademing’ en ‘Communicatie’). De werkgroep adviseert dan ook met name in de progressieve en plateaufase pijn regelmatig te scoren (minstens eenmaal per dag, maar ook als controle na bijstelling van de medicatie). Hiervoor kunnen eenvoudig de VAS-, NRS- of Smiley-scale-scoremethodes worden gebruikt. Ook in de herstel- en late fase kan pijn een rol spelen zich uitend in spierpijn, kramp en neuropathische pijn.
Omdat verschillende typen pijn voorkomen bij patiënten met GBS is naast analyse van de ernst ook bepaling van het pijntype noodzakelijk om het juiste analgeticum te selecteren. De WHO-pijnladder kan hierbij als richtlijn dienen. Met name dient onderscheid gemaakt te worden tussen pijn in het bewegingsapparaat (nociceptieve pijn), viscerale pijn of neuropathische pijn.
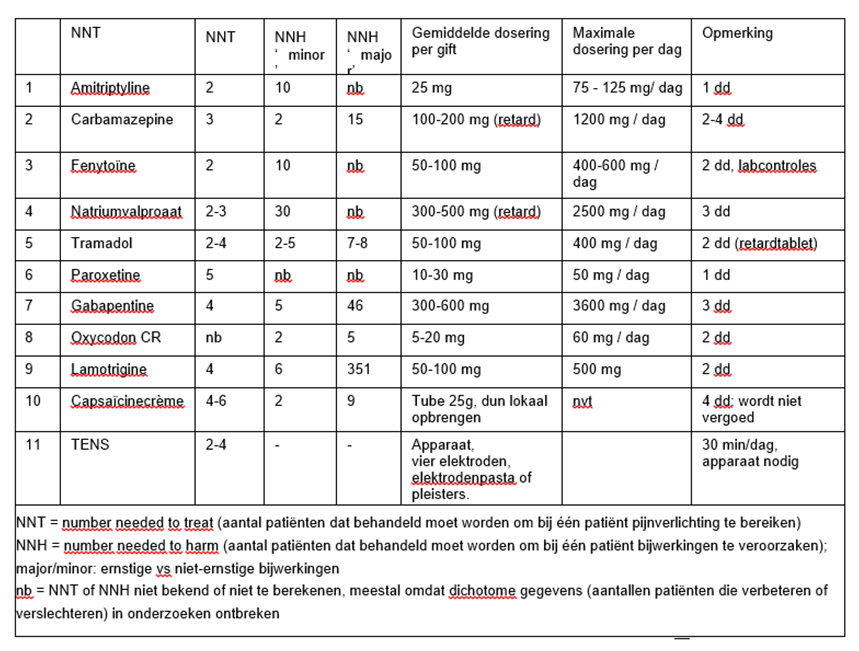
De werkgroep is van mening dat neuropathische pijn tengevolge van GBS kan worden behandeld volgens de aanbevelingen in de Richtlijn Polyneuropathie (2005). In verband met de kans op autonome functiestoornissen (hartritme, darmmotiliteit) en respiratoire insufficiëntie bij GBS is hierbij specifieke voorzichtigheid geboden bij het gebruik van tricyclische antidepressiva en opioïden. Een middel als amitriptyline heeft bij GBS dus geen voorkeur in verband met mogelijk verhoogde kans op hartritmestoornissen. Tabel 1 geeft de aanbevolen volgorde van behandeling voor pijnlijke neuropathieën zoals geadviseerd in de Richtlijn Polyneuropathie. Opgemerkt moet worden dat meer recent op de markt gebrachte pijnmedicatie (zoals pregabaline) niet in deze tabel is opgenomen. In de dagelijkse praktijk van de werkgroepleden hebben deze nieuwe medicijnen geen prominente rol in de behandeling van pijn bij patiënten met GBS.
Doorbraakpijnen kunnen bestreden worden door medicatie voor te schrijven waarvan de patiënt zelf de dosering bepaalt.
Gewrichtspijn kan soms verminderd worden door een andere lichaamshouding aan te nemen (bijvoorbeeld wisselligging om de twee uur).
Tabel 1. Aanbevolen behandeling volgens de Richtlijn Polyneuropathie, 2005; aangepast aan advies werkgroep (bron: Farmacotherapeutisch Kompas 2010).
NB: Er zijn geen goede vergelijkbare studies. De volgorde van behandeling is gekozen afhankelijk van de combinatie van NNT, NNH, beschikbaarheid en prijs. Enkele meer recent beschikbaar gekomen medicamenten (met name pregabaline en duloxetine) zijn niet in dit overzicht opgenomen.
Figuur 1. WHO-pijnladder
Onderbouwing
Conclusies / Summary of Findings
Vóórkomen van pijn
|
Niveau 2 |
Pijn komt zeer vaak voor bij patiënten met GBS. In de progressieve fase lijkt er meestal sprake van radiculaire pijn in rug, benen en schouders.
Pijn kan bij patiënten met GBS ook na de progressieve fase van GBS langdurig aanhouden. Er lijkt dan meestal sprake van pijnlijke paresthesieën en dysesthesie.
Bij patiënten met GBS kan pijn al aanwezig zijn voordat de spierzwakte optreedt.
B Ruts, 2007; Pandey, 2002 C Pentland, 1994; Ruts 2010 (a en b) |
|
Niveau 3 |
Pijn komt ook voor bij patiënten met MFS en bij patiënten met een puur motore GBS.
C Koga, 2000 C Ruts, 2008; Ruts 2010 (a en b) |
|
Niveau 3 |
Pijn komt ook voor bij patiënten met MFS en bij patiënten met een puur motore GBS.
C Korinthenberg, 2007 |
Behandeling van pijn
|
Niveau 3 |
Er is enige indicatie dat Gabapentin mogelijk effectief is bij pijnbestrijding bij patiënten met GBS in de progressieve fase.
C Pandey, 2002 B Pandey, 2005 |
|
Niveau 4 |
De werkgroep is van mening dat pijn ten gevolge van polyneuropathie bij patiënten met GBS kan worden behandeld volgens de aanbevelingen in de Richtlijn Polyneuropathie.
D Werkgroepleden; Richtlijn Polyneuropathie, 2005 |
Samenvatting literatuur
Vóórkomen van pijn
Pijn komt zeer vaak voor bij patiënten met het Guillain-Barré syndroom en wordt beschreven bij 72-89% van de gevallen (Pentland, 1994; Pandey, 2002). Het is in de literatuur vaak lastig een duidelijk onderscheid te maken in het soort pijn dat patiënten ervaren. Verschillende typen worden beschreven: paresthesieën en dysesthesie, rugpijn, radiculaire pijn, meningisme, spierpijn, gewrichtspijn, viscerale pijn en ‘overig’.
Pijn bij volwassenen met GBS
In een studie van Ruts (2007) met zowel een prospectief als retrospectief deel afkomstig uit een RCT waarin 225 patiënten met GBS werden geïncludeerd, werden 223 patiënten gerandomiseerd. Pijn werd gerapporteerd door 123 (55%) van de patiënten en 48 (22%) van de patiënten had ernstige pijn. Van alle patiënten met pijn, gaf 70% aan dat de pijn voorafging aan het optreden van de spierzwakte. In 84% van de patiënten die eerst pijn hadden begon de verlamming binnen één week na het optreden van de pijn (Ruts, 2007). Rugpijn, pijn tussen de schouderbladen en radiculaire pijn kwamen het meest frequent voor in de progressieve fase. Gedurende de plateaufase en daarna bleven juist pijnlijke par- en dysesthesieën tamelijk constant aanwezig bij 17-29 % van de patiënten gedurende de follow-up van een jaar (Ruts, 2007).
In een prospectieve evaluatie van Gorson (1996) werd bij 14 van de 24 patiënten met GBS (58%) pijn vastgesteld gedurende de progressieve fase van de ziekte. Patiënten hadden lage rugpijn en radiculaire pijn in het been. De ernst van de pijn in rug of benen werd in dit onderzoek bepaald op basis van de pijnmedicatie die de patiënt nodig had. Vijf patiënten hadden geen pijn of milde pijn (alleen paracetamol of NSAID’s nodig) en negen patiënten hadden matige tot ernstige pijn (waarvoor opioïde pijnstillers of epidurale anesthesie noodzakelijk). De pijn duurde gemiddeld veertien dagen (range, 1 tot 90).
Ook Marchettini (2006) beschrijft in een review (niet systematisch) dat in de progressieve fase van de ziekte pijnscheuten in de lage rug die uitstralen naar de benen het meest voorkomen. De helft van de patiënten rapporteert pijnlijke paresthesieën en dysesthesie in de extremiteiten met brandende of tintelende eigenschappen. Een kleine groep patiënten rapporteert spier- en gewrichtspijn. Het is mogelijk dat de beginnende rugpijn nocisensorisch van aard is en gerelateerd aan radiculaire ontsteking, terwijl de pijn distaal in de extremiteiten neuropatisch van aard is.
Kramp en spierpijn zijn bij 48% van de patiënten aanwezig en zijn significant gerelateerd aan verlies van sensibiliteit (Bernsen, 2001).
In de studie van Green (2001) werd specifiek gekeken naar patiënten met een milde vorm van GBS. Zeven van de twaalf patiënten (58%) met milde GBS hadden ernstige pijn.
Het blijkt dat ook patiënten met een puur motore vorm van GBS pijn kunnen hebben. Ruts (2008) vond op basis van de prospectief verzamelde gegevens uit een RCT (n=225) en de retrospectief verzamelde gegevens uit Curaçao (n=83) dat 38 van de 77 patiënten (49%) met de klinische verschijnselen van een puur motore GBS pijn hebben.
In een prospectief onderzoek in Nederland (GRAPH-studie) bij het volledige spectrum van patiënten met GBS (mild tot ernstig) konden vijf verschillende vormen van pijn worden onderscheiden. (Ruts, 2010). Bij 36% werd het krachtverlies voorafgegaan door pijn. 26% van de patiënten had extreme pijn in de eerste twee weken na opname in het ziekenhuis voor GBS. Pijn kan voorkomen in het gehele spectrum van GBS (inclusief Miller-Fisher syndroom, gering aangedane patiënten en patiënten met een puur motore GBS). Ernstige pijn was vooral aanwezig bij patiënten met gevoelsstoornissen en bij patiënten met ernstige zwakte. De meeste symptomen van pijn namen af in de eerste week tot maanden na het ontstaan van zwakte maar pijnlijke par- en dysesthesieën en spierpijn bleven vaak de eerste zes maanden aanwezig (Ruts, 2010).
Pijn bij kinderen met GBS
In een prospectieve multicenter studie van Korinthenberg (2007) werden de klinische presentatie en het verloop van GBS bij 59 kinderen bestudeerd. Gedurende de progressieve fase van de ziekte was pijn een probleem bij 79% van de kinderen. Neuropathische pijn behoorde met 34% tot de meest voorkomende pijnsymptomen bij kinderen. In 30% van de gevallen was deze pijn ernstig of zeer ernstig.
Pijn bij MFS
Het Miller-Fisher syndroom (MFS) is een variant van GBS (Koga, 2000). In de studie van Koga had 22% van de patiënten pijn gedurende de progressievefase van MFS. De pijn was voornamelijk gelokaliseerd in distale ledematen. Ook in de Nederlandse studie (GRAPH-studie) werd gevonden dat patiënten met MFS frequent pijn kunnen hebben (Ruts, 2010).
Pijnmeting bij GBS
Een praktische algemene richtlijn is dat voor het inschatten van de ernst van pijn en welke behandeling nodig is men de patiënt een ‘rapportcijfer’ laat geven aan de pijn op een schaal van 0 tot 10, waarbij 0 geen pijn betekent en 10 de meest verschrikkelijke pijn voorstelbaar; de zogenaamde VAS (visual analogue scale)- of NRS (numerical rating scale)-score. Pijn kan dus worden onderkend door patiënten met GBS te laten aangeven of en zo ja waar ze pijn hebben, en de mate ervan door middel van VAS/NRS of ‘Smiley-scale’ bij kinderen. Systematisch controleren van de pijn en gebruik van analgetica is een vereiste bij patiënten met GBS (Moulin, 1997).
Kogos (2005) heeft in een studie bij 18 patiënten gekeken naar de relatie tussen pijn en kwaliteit van leven. De auteurs vonden een relatie tussen pijn en de fysieke en mentale gezondheid van de patiënt (een jaar na diagnose) en stellen dat de aard van deze relatie nader bestudeerd dient te worden.
Behandeling van pijn
Er zijn weinig RCTs verschenen die het effect van medicatie op een pijnlijke polyneuropathie bij GBS hebben onderzocht.
In het algemeen geldt dat voor de behandeling van pijn een stapsgewijze aanpak kan worden gevolgd volgens de zogenaamde ‘pijnladder’ van de WHO (figuur 1).
Bij meting op een VAS of NRS geven scores tussen de 0 en 4 geringe pijn weer, waardoor iemand niet gehinderd wordt. Zo nodig kan een licht analgeticum zoals paracetamol gegeven worden. Een score van 4 tot 7 geeft matige pijn aan die duidelijk ongemak meebrengt in het dagelijks leven. Vaak zijn een combinatie van paracetamol en/of een NSAID met eventueel een matig sterk opiaat zoals tramadol voldoende. Scores van 7 of meer duiden op ernstige pijn die het normale dagelijkse leven sterk beïnvloedt of onmogelijk maakt. Pijnscores van 7 of meer vragen om krachtige pijnstilling, vaak in de vorm van de combinatie van NSAID met een langwerkend morfinometicum. Voor de behandeling van neuropathische pijn is vaak de toevoeging van een zogenaamd co-analgeticum noodzakelijk. Bij gelokaliseerde pijnklachten kan behandeling met verdovende crèmes of transcutane elektrische zenuwstimulatie (TENS) geprobeerd worden. Bij zeer ernstige pijn kan de noodzaak tot invasieve pijnbehandeling (bijvoorbeeld epidurale pijnstilling of neurostimulatie) bestaan. Hierna wordt het bewijs voor de verschillende behandelingen bij GBS besproken. Verder wordt voor de behandeling van een pijnlijke polyneuropathie bij patiënten met GBS verwezen naar de Richtlijn Polyneuropathie (CBO, 2005).
Paracetamol en NSAID’s
Er zijn geen studies over het gebruik van paracetamol en NSAID’s bij GBS. Theoretisch kan men verwachten dat deze middelen bij neuropathische of radiculaire pijnen weinig verlichting zullen bieden. Bij spier- of gewrichtspijnen als gevolg van GBS kan men ze conform de WHO-pijnladder inzetten.
Opiaten
Er zijn geen systematische studies naar het gebruik van opiaten bij GBS. Uit de studie van Pandey (2002) blijkt dat een opioïd in de praktijk vaak wordt toegevoegd als de pijnscores te hoog zijn (> 5), conform de WHO-richtlijn. In de EFNS-richtlijn (European Federation of Neurological Societies) (Attal, 2006) wordt door een consensuswerkgroep gesteld dat opioïde middelen kunnen worden gebruikt maar monitoring van bijwerkingen hierbij vereist is. Respiratoire depressie door opioïde analgetica is een zorg bij patiënten die niet beademd worden, maar het risico kan beperkt worden door zorgvuldige titratie en bewaking door screening van de vitale capaciteit en respiratoire functie.
Naast ademdepressie kunnen opioïde analgetica ook leiden tot constipatie en ileus ondanks het gebruik van darmstimulerende middelen (Moulin, 1997).
Co-analgetica
In een dubbelblinde placebogecontroleerde cross-overstudie (n=18) van Pandey (2002) die van korte duur was (zeven dagen) werd gabapentin (GBP) vergeleken met een placebo. In beide groepen eventueel gecombineerd met Fentanyl, namelijk op verzoek van de patiënt en bij pijnscore > 5 op een schaal van 0-10. De studie gaf betere resultaten voor de gabapentingroep ten opzichte van de placebogroep (Pandey, 2002). De numerieke pijnscore nam af en de behoefte aan Fentanyl was significant lager in de gabapentingroep ten opzichte van de placebogroep. In een andere RCT van dezelfde onderzoeksgroep bleek gabapentin ook superieur te zijn aan carbamazepine (CBZ) (n=36) (Pandey, 2005) resulterend in een snelle (dag 2-3) afname van pijn en opioïdconsumptie.
In een prospectieve gerandomiseerde cross-overstudie van Tripathi (2000) werd bij volwassen patiënten met GBS het effect van carbamezapine op pijnscores geëvalueerd. De pijnscores tijdens het gebruik van carbamezapine waren statistisch significant lager ten opzichte van de dagen dat deze patiënten een placebo kregen. De studie was echter van zeer korte duur. Het effect van carbamezapine werd bekeken na drie dagen carbamezapine, één dag geen medicatie en vervolgens placebo (in andere groep, eerst placebo, één dag geen medicatie, dan carbamezapine).
In een Cochrane Review (Wiffen, 2005) wordt ook de studie van Pandey (2002) in beschouwing genomen. Er wordt geconcludeerd dat het bewijs van effectiviteit van gabapentin bij pijnbestrijding bij patiënten met het Guillain-Barré syndroom beperkt is. In de EFNS-richtlijn (European Federation of Neurological Societies) (Attal, 2006) worden beide studies van Pandey in beschouwing genomen en wordt door een consensuswerkgroep het gebruik van gabapentin en carbamazepine in de intensive care unit in de progressieve fase toch ondersteund.
In een gerandomiseerde placebogecontroleerde trial werd de toediening van intraveneus immuunglobuline + prednisolon vergeleken met immuunglobuline + placebo bij 225 patiënten. Deze RCT was niet gericht op het effect van methylprednisolon op pijn. Uit de prospectief verzamelde gegevens kon geen positief effect van prednisolon op de aanwezigheid of de afname van de intensiteit van de pijn worden aangetoond (Ruts, 2007).
Lokale pijnbehandelingen
Over lokale pijnbehandeling bij GBS is geen literatuur voorhanden. In de studie van Koga (2000) bij patiënten met het Miller-Fisher syndroom werd gevonden dat de meeste patiënten baat zouden hebben bij een combinatie van oraal gabapentin en lokaal capsaïcine (Koga, 2000).
Invasieve pijnbehandeling
Er werden geen studies gevonden over invasieve pijnbehandeling bij GBS.
Referenties
- Attal N, Cruccu G, Haanpa M, Hansson P, Jensen TS, Nurmikko T, et al. EFNS guidelines on pharmacological treatment of neuropathic pain. Eur J Neurol 2006;13:11531169.
- Beniczky S, Tajti J, Tímea Varga E, Vécsei L. Evidence-based pharmacological treatment of neuropathic pain syndromes. J Neural Transm 2005;112:735749.
- Bernsen RAJAM, Jager AEJ de, Schmitz PIM, Meché FGA van der. Residual physical outcome and daily living 3 to 6 years after GBS; Neurology 1999;53:409-410.
- Bernsen RA, Jager AE, Schmitz PI, Meche FG van der. Long-term sensory deficit after Guillain-Barré syndrome. J Neurol 2001;248:483-486.
- Gorson KC, Ropper AH, Muriello MA, Blair R. Prospective evaluation of MRI lumbosacral nerve root enhancement in acute Guillain-Barré syndrome. Neurology 1996;47:813-817.
- Green DM, Ropper AH. Mild Guillain-Barré syndrome. Arch Neurol 2001;58(7):1098-1101.
- Kabore R, Magy L, Boukhris S, Mabrouk T, Lacoste M, Vallat JM. Interet de la corticotherapie dans le traitement de la douleur a la phase aigue du syndrome de Guillain-Barré. [Contribution of corticosteroid to the treatment of pain in the acute phase of Guillain-Barré syndrome]. Rev Neurol 2004;160:821-823.
- Koga M, Yuki N, Hirata K. Pain in Miller Fisher syndrome. J Neurol 2000;247:720-721.
- Kogos SC, Richards JS, Banos J, Schmitt MM, Brunner RC, Meythaler JM, et al. A descriptive study of pain and quality of life following Guillain-Barré syndrome: One year later. Journal of Clinical Psychology in Medical Settings 2005;12:111-116.
- Korinthenberg R, Schessl J, Kirschner J. Clinical presentation and course of childhood Guillain-Barré syndrome: a prospective multicentre study. Neuropediatrics 2007;38:10-17.
- Marchettini P, Lacerenza M, Mauri E, Marangoni C. Painful peripheral neuropathies. Current Neuropharmacology 2006;4:175-181.
- Moulin DE, Hagen N, Feasby TE, Amireh R, Hahn A. Pain in Guillain-Barré syndrome. Neurology 1997;48[2]:28-331.
- Pandey CK, Bose N, Garg G, Singh N, Baronia A, Agarwal A, et al. Gabapentin for the treatment of pain in Guillain-Barré syndrome: a double-blinded, placebo-controlled, crossover study. Anesth Analg 2002;95:1719-1723.
- Pandey CK, Raza M, Tripathi M, Navkar DV, Kumar A, Singh UK. The comparative evaluation of gabapentin and carbamazepine for pain management in Guillain-Barré syndrome patients in the intensive care unit. Anesth Analg 2005;101:220-225.
- Pentland B, Donald SM. Pain in the Guillain-Barré syndrome: a clinical review. Pain 1994;59:159-164.
- Ruts L, Van KR, Jacobs BC, Doorn PA van. Determination of pain and response to methylprednisolone in Guillain-Barré syndrome. J Neurol 2007;254:1318-1322.
- Ruts L, Rico R, Koningsveld R van, Botero JD, Meulstee J, Gerstenbluth I et al. Pain accompanies pure motor Guillain-Barré syndrome. J Periperal Nervous system 2008;13:305-306.
- Ruts, L. Pain Autonomic Dysfunction and Course of Disease in Guillain-Barré Syndrome, 2010, ISBN 978-90-9025241-4. [a]
- Ruts L, Drenthen J, Jacobs BC, van Doorn PA; Dutch GBS Study Group. Distinguishing acute-onset CIDP from fluctuating Guillain-Barré syndrome: a prospective study. Neurology 2010; 25;74(21):1680-6. [b]
- Tripathi M, Kaushik S. Carbamezapine for pain management in Guillain-Barré syndrome patients in the intensive care unit. Crit Care Med 2000;28:655-658.
- Wiffen PJ, McQuay HJ, Rees J, Moore RA. Gabapentin for acute and chronic pain. Cochrane Database.Syst.Rev. 2005, Issue 3.
Evidence tabellen
Bewijsklassetabel Pijn
|
Auteur en jaartal |
Mate van bewijs |
Studie type |
Aantal patiënten |
Patiënten kenmerken |
Interventie (incl. duur, dosering) |
Controle/vergelijking (incl. duur, dosering) |
Uitkomstmaten
|
Resultaten
|
Overige opmerkingen |
|
Pandey, 2002 |
B |
Dubbel Blind placebo gecontroleerde Cross Over Studie |
18 |
GBS patiënten opgenomen op SEH voor beademing |
Gabapentin (15 mg/kg/dag in 3 doseringen) gedurende 7 dagen |
(Matching) Placebo |
Numeric pain score, Ramsay sedation score, and requirement for a rescue analgesic (fentanyl) |
Lagere pijnscores en sadatie scores voor gabapentin gebruikers t.o.v. placebo.
Numeric pain score decreased from 7.22 ± 0.83 to 2.33±1.67 on the second day of gabapentin therapy and remained low during gabapentin therapy (2.06±0.63) (P<0.001). Also significant decrease in fentanyl need from day 1 to day 7 during the gabapentin therapy period (211.11±21.39 to 65.53±16.17 [mg]) versus placebo (319.44 ± 25.08 to 316.67 ± 24.25 [mg]) (P<0.001)
|
Geen lange termijn effecten
7 dgn therapie, 2 dgn washout, 7 dgn therapie
|
|
Pandey, 2005 |
B |
Randomized, prospective double blind, placebo controlled study |
36 |
GBS patiënten opgenomen op SHE voor beademing (12-60 jaar). |
Gabapentin en Carbamazepine
|
Placebo |
Numeric pain score, Ramsay sedation score, and requirement for a rescue analgesic (fentanyl) |
Gabapentin group lower (P < 0.05) median numeric pain rating scale scores versus placebo and carbamazepine group. No significant difference in fentanyl consumption between the gabapentin and carbamazepine groups on Day 1 (340.1 ± 34.3 mg and 347.5 ± 38.0 mg, respectively), but consumption was significantly less in these 2 groups versus placebo (590.4±35.0mg) (P< 0.05). For the rest of the study period, there was a significant difference in fentanyl consumption among all treatment groups, and it was minimal in the gabapentin group (P< 0.05).
|
Geen lange termijn
22 van de 58 ’eligible’ patiënten die op de ICU werden opgenomen voldeden niet aan de inclusiecriteria (selectiebias niet uit te sluiten (ernstige patiënten) |
|
Ruts, 2007 |
B |
Prospectieve en retrospectieve studie (patiënten komen uit RCT) |
225 |
GBS patiënten afkomstig uit RCT (eligible when onset of weakness was within 2 weeks before the date of randomization and the patient was unable to walk 10 meters across an open space without assistance (GBS disability score ³3)) |
NVT
In RCT waar patiënten uit werden gerekruteerd:
IVIg + prednisolone (500mg/5 days) |
NVT
In RCT: IVIg + placebo |
O.a. pain level severity |
Pain frequently occurs, often starts before onset of weakness and may cause severe complaints. Especially painful par-/ dysesthesie and muscle pain may persist for months. Methylprednisolone seems to have no significant effect on the presence and intensity of pain. |
|
|
Tripathi, 2000 |
B? |
Prospective double-blind, randomly allocated cross over study |
12 |
Conscious GBS (22-54 yrs) patients during recovery from the muscular weakness and receiving pressure-support ventilation in the ICU |
Carbamezapine (CBZ) (100 mg every 8 hrs), 3 dagen
Groep 1: eerst placebo, dan CBZ
Groep 2: eerst CBZ, dan placebo |
Placebo (3 dagen) |
Pain scores (1, no pain; 5, severe pain), sedation scores (1, alert; 6, asleep, does not respond to verbal command) and total pethidine requirement per day |
Group 1: patients, a significant (p < .001) improvement in the sedation score and a low requirement for pethidine was observed 3 days later, when CBZ was started.
Group 2: gradual increase in the pethidine requirement and a high sedation score in later days of placebo medication.
Observations also analyzed for CBZ days vs. placebo days. Overall, the pain score (1.7 ± 0.8) during the CBZ period of both regimens was significantly (p < .001) lower versus placebo days (3.1 ± 0.9). Significantly higher doses of pethidine (3.7 ± 0.9 mg/kg/day) were used on the placebo days versus CBZ days (1.7 ± 1.0 mg/kg/day). |
Tijd tussen CBZ en placebo (slechts 1 dag) te kort ?
|
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-06-2014
Beoordeeld op geldigheid : 24-01-2011
Uiterlijk in 2020 wordt door de Vereniging Spierziekten Nederland (VSN), na raadpleging van of op advies van aan de richtlijn participerende verenigingen, bepaald of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om (delen van) de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Algemene gegevens
Ook geautoriseerd door
- Uitvoeringsinstituut WerknemersVerzekeringen
In samenwerking met
- Agis Zorgverzekeringen
- Koninklijk Nederlands Genootschap voor Fysiotherapie
- Nederlands Huisartsen Genootschap
- Nederlandse Vereniging voor Cardiologie
- Nederlandse Vereniging voor Psychologen
- Vereniging Samenwerkingsverband Chronische Ademhalingsondersteuning
De richtlijn is tot stand gekomen met ondersteuning van Kwaliteitsinstituut voor de Gezondheidszorg (CBO) en met financiële steun ZonMw in het kader van het programma Kennisbeleid, Kwaliteit Curatieve Zorg.
Het Guillain-Barré syndroom (GBS) is een zeldzame ziekte met een zeer zware ziektelast. De ziekte leidt binnen enkele uren tot dagen tot verlammingsverschijnselen. Ongeveer 25% van de patiënten met het Guillain-Barré syndroom heeft kunstmatige beademing nodig waarvoor de patiënt wordt opgenomen op de IC.
Sommige patiënten herstellen volledig, maar een groot deel niet. Oud-patiënten geven aan dat met name de niet-zichtbare handicaps van de ziekte zoals een snelle vermoeidheid, beperkte belastbaarheid en pijn niet onderkend worden door bedrijfs- en verzekeringsartsen. Hierdoor worden regelmatig verkeerde re-integratietrajecten ingezet met alle gevolgen van dien.
Het zeldzaam vóórkomen van het Guillain-Barré syndroom maakt dat de parate kennis van veel behandelaars over deze ziekte beperkt is. Dit heeft tot gevolg dat er regelmatig gekozen wordt voor een eigen beleid dat afwijkt van de ‘best practice’. Dit gebeurt zowel tijdens de progressieve en plateaufase als tijdens de herstel- en late fase. Het is daarom belangrijk na te gaan welke behandeling de beste is en hoe het re-integratietraject optimaal vorm gegeven kan worden.
Bovengenoemde overwegingen waren voor de patiëntenvereniging, de Vereniging Spierziekten Nederland (VSN), aanleiding het initiatief te nemen voor de ontwikkeling van een multidisciplinaire, ‘evidence-based’ richtlijn voor diagnostiek en behandeling van het Guillain-Barré syndroom. Het Kwaliteitsinstituut voor de Gezondheidszorg CBO verleende hierbij methodologische expertise.
Doel en doelgroep
Doelstelling
Deze richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het vaststellen van goed medisch handelen. Er wordt aangegeven wat in het algemeen de beste zorg is voor patiënten met het Guillain-Barré syndroom. De richtlijn geeft aanbevelingen over de diagnostiek, verwijzing, behandeling en re-integratie van patiënten met het Guillain-Barré syndroom en kan worden gebruikt bij het geven van voorlichting aan patiënten. Ook biedt de richtlijn aanknopingspunten voor bijvoorbeeld transmurale afspraken of lokale protocollen ter bevordering van de implementatie.
Het doel is het verkrijgen van uniformiteit in de diagnostiek, behandeling en begeleiding in de diverse centra en het definiëren van de kaders waarbinnen de multidisciplinaire zorg van patiënten met het Guillain-Barré syndroom moet plaatsvinden. Deze richtlijn zal naar verwachting ook bijdragen aan verbeterde communicatie tussen behandelaars en patiënten en tussen behandelaars onderling.
Specifieke doelen van deze richtlijn zijn:
- het voorkómen van gezondheidsschade bij patiënten door het geven van concrete aanbevelingen over verbeterde diagnostische en therapeutische mogelijkheden;
- het doen van duidelijke uitspraken over te verrichten diagnostiek en behandeling van GBS bij volwassenen en kinderen en over het te volgen re-integratietraject.
Doelgroep
De richtlijn is bedoeld voor alle zorgverleners die bij de behandeling en begeleiding van patiënten met het Guillain-Barré syndroom betrokken zijn, met name huisartsen, (kinder)neurologen, revalidatieartsen, kinderartsen, bedrijfs-/verzekeringsartsen, fysiotherapeuten, psychologen en (IC-)-verpleegkundigen.
Samenstelling werkgroep
Voor het ontwikkelen van deze richtlijn is in 2008 een multidisciplinaire werkgroep samengesteld bestaande uit vertegenwoordigers van alle bij de diagnostiek, behandeling en begeleiding van patiënten met het Guillain-Barré syndroom betrokken medische disciplines, beleidsmedewerkers van de patiëntenvereniging, de Vereniging Spierziekten Nederland (VSN) en adviseurs van het Kwaliteitsinstituut voor de Gezondheidszorg CBO (zie hieronder).
Bij het samenstellen van de werkgroep is rekening gehouden met de geografische spreiding van de werkgroepleden, met een evenredige vertegenwoordiging van de verschillende betrokken verenigingen en instanties alsmede met een spreiding al dan niet in academische achtergrond. De werkgroepleden hebben onafhankelijk gehandeld en waren gemandateerd door hun vereniging. Een overzicht van de belangenverklaringen van werkgroepleden over mogelijke financiële belangenverstrengeling is als addendum bij de richtlijn gevoegd.
Samenstelling werkgroep
- Dhr. prof.dr. P.A. van Doorn, neuroloog, Eramus Medisch Centrum, Rotterdam, voorzitter
- Dhr. dr. J.W.G. Meijer, revalidatiearts, Revant Revalidatiecentrum Breda, vicevoorzitter
- Dhr. drs. E.S. Alberga, bedrijfsarts, Groningen
- Mw. dr. N. van Alfen, neuroloog, Universitair Medisch Centrum St. Radboud, Nijmegen
- Dhr. mr.drs. E.R. Berends, verzekeringsgeneeskundige, UWV, Assen
- Mw. drs. H.A. Berendsen, revalidatiearts, Sophia Revalidatie, Delft
- Dhr. dr. R.A.J.A.M. Bernsen, neuroloog, Jeroen Bosch Ziekenhuis, ’s Hertogenbosch
- Mw. mr. P.H. Blomkwist-Markens, voorzitter diagnosewerkgroep GBS/CIDP, Vereniging Spierziekten Nederland, Amsterdam
- Mw. dr. J.G. Broeks, revalidatiearts, Scheperziekenhuis, Emmen
- Dhr. dr. P.G. Erdmann, fysiotherapeut / bewegingswetenschapper, Universitair Medisch Centrum, Utrecht
- Mw. T. Dingelhoff, secretaresse Vereniging Spierziekten Nederland, Baarn
- Mw. drs. J.M. van Haelst, revalidatiearts, Revalidatiecentrum Tolbrug, Oss
- Mw. dr. A.M.C. Horemans, hoofd kwaliteit van zorg, Vereniging Spierziekten Nederland, Baarn, projectleider
- Dhr. dr. M. van der Jagt, neuroloog-intensivist, Erasmus Medisch Centrum, Rotterdam
- Mw. dr. L. Kok, arts-epidemioloog, Kwaliteitsinstituut voor de Gezondheidszorg CBO, Utrecht
- Dhr. W.J. Lubbers, huisarts, Gezondheidscentrum Parkwijk, Almere
- Mw. J.H.A.T. van Mierlo, lid diagnosewerkgroep GBS/CIDP, Vereniging Spierziekten Nederland, ’s Hertogenbosch
- Dhr. dr. W.L. van der Pol, neuroloog, Universitair Medisch Centrum, Utrecht
- Mw. drs. M. Rol, revalidatiearts, Den Haag
- Mw. dr. K. Rosenbrand, arts, Kwaliteitsinstituut voor de Gezondheidszorg CBO, Utrecht
- Mw. dr. E.H. Tromp, klinisch neuropsycholoog, Revalidatiecentrum Tolbrug, Oss
- Mw. M. Twigt, IC-verpleegkundige, Hoofddorp
- Mw. drs. F. de Wit, beleidsmedewerker kwaliteit van zorg, Vereniging Spierziekten Nederland, Baarn
- Mw. drs. M. van der Wurff, medewerker communicatie, Vereniging Spierziekten Nederland, Baarn
Adviseurs GBS-richtlijn
- Dhr. dr. B. van den Berg, internist-intensivist, Erasmus Medisch Centrum, Rotterdam
- Mw. drs. J. Blees, kinderrevalidatiearts, Revalidatiecentrum De Trappenberg, Huizen
- Mw. dr. N.A.M. Cobben, longarts-intensivist, Academisch Ziekenhuis – Centrum voor Thuisbeademing, Maastricht
- Dhr. A. Comuth, kinderfysiotherapeut, Adelante kinderrevalidatie, speciaal onderwijs & wonen, Valkenburg
- Dhr. J. Crasborn, directeur strategie, AGIS, Amersfoort
- Dhr. dr. M.P.J. Garssen, neuroloog, Jeroen Bosch Ziekenhuis, ’s Hertogenbosch
- Dhr. dr. B.C. Jacobs, neuroloog, Erasmus Universiteit, Rotterdam
- Dhr. dr. J.L.M. Jongen, neuroloog, Erasmus Medisch Centrum, Rotterdam
- Dhr. dr. E.J.O. Kompanje, senior onderzoeker/klinische ethicus Intensive Care, Erasmus Medisch Centrum, Rotterdam
- Mw. dr. R. van Koningsveld, neuroloog, Elkerliek Ziekenhuis, Helmond
- Mw. G. Lammers, maatschappelijk werker, Revalidatiecentrum ’t Roessingh, Enschede
- Dhr. dr. I.S.J. Merkies, neuroloog, Spaarne Ziekenhuis, Hoofddorp
- Dhr. K.D. Pelger, fysiotherapeut, Mytylschool Gabriel, ’s Hertogenbosch
- Mw. dr. L. Ruts, neuroloog, Havenziekenhuis Rotterdam
- Mw. dr. L.T.L. Sie, kinderneuroloog, Universitair Medisch Centrum St. Radboud, Nijmegen
- Dhr. B. Verdonk, fysiotherapeut, Universitair Medisch Centrum, Utrecht
- Mw. M. Versluis, senior-beleidsmedewerker, NPCF, Utrecht
- Mw. drs. C. Walgaard, neuroloog i.o., Erasmus Medisch Centrum, Rotterdam
- Mw. E. Wiarda Rosen Jacobson, logopedist, Erasmus Medisch Centrum, Rotterdam
- Mw. J.C. Wijnen, diëtist, lid werkgroep diëtisten en spierziekten DVN, Oss
Inbreng patiëntenperspectief
Bij het opstellen van de richtlijn is rekening gehouden met het patiëntenperspectief. In de knelpuntanalyse heeft de betrokken patiëntenvereniging (VSN) eigen knelpunten tijdens een focusgroepbijeenkomst ingebracht. De conceptrichtlijn is ook voorgelegd aan de betrokken patiëntenvereniging (VSN). Tot slot zijn of worden de gegevens uit deze richtlijn verwerkt in het voorlichtingsmateriaal van deze patiëntenvereniging.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de ontwikkeling van het concept van de richtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen. De richtlijn wordt verspreid onder alle relevante beroepsgroepen en ziekenhuizen. Ook wordt een samenvatting van de richtlijn ter publicatie aangeboden aan het Nederlands Tijdschrift voor Geneeskunde en zal er in verschillende specifieke vaktijdschriften aandacht worden besteed aan de richtlijn. Daarnaast wordt de integrale tekst van de richtlijn op de websites van de patiëntenvereniging (VSN), het CBO en de betrokken beroepsverenigingen geplaatst.
Om de implementatie en evaluatie van deze richtlijn te stimuleren, zal de werkgroep een implementatieplan opstellen en een lijst van indicatoren ontwikkelen aan de hand waarvan de implementatie kan worden gemeten. Indicatoren geven in het algemeen de zorgverleners de mogelijkheid te evalueren of zij de gewenste zorg leveren. Zij kunnen daarmee ook onderwerpen voor verbeteringen van de zorgverlening identificeren.
De richtlijn wordt getoetst bij de eindgebruiker in de verschillende regio’s en wetenschappelijke verenigingen, waarbij ook visitaties zullen worden georganiseerd.
Werkwijze
Gezien de omvang van het werk werd een aantal subgroepen gevormd met vertegenwoordigers van relevante disciplines. De voorzitter en subvoorzitter zorgden samen met beleidsmedewerkers van de VSN en de adviseurs van het CBO voor de coördinatie en onderlinge afstemming van de subgroepen.
De werkgroep heeft gedurende een periode van ongeveer twee jaar gewerkt aan de tekst voor de conceptrichtlijn. De subgroepen beoordeelden de door de adviseurs van het CBO geschreven wetenschappelijke onderbouwingen en formuleerden vervolgens de overige overwegingen en aanbevelingen. Tevens schreven de subgroepen consensusteksten wanneer wetenschappelijk bewijs voor het beantwoorden van de uitgangsvraag ontbrak. De teksten werden tijdens plenaire vergaderingen besproken en na verwerking van de commentaren geaccordeerd. De voltallige werkgroep is twintigmaal (tien keer lijfelijk en tien keer telefonisch) bijeengeweest om de resultaten van de subgroepen in onderling verband te bespreken. De teksten van de subgroepen zijn door een redactieteam samengevoegd en op elkaar afgestemd tot één document: de conceptrichtlijn. Deze werd in juni 2010 aan de bij de richtlijn betrokken verenigingen verstuurd voor commentaar. Na verwerking van het commentaar is de richtlijn in november 2010 door de voltallige werkgroep vastgesteld en ter autorisatie naar de relevante beroepsverenigingen gestuurd.
De kwaliteit van deze artikelen werd door epidemiologen van het CBO beoordeeld aan de hand van ‘evidence-based richtlijnontwikkeling’ (EBRO)-beoordelingsformulieren. Artikelen van matige of slechte kwaliteit werden uitgesloten. Na deze selectie bleven de artikelen over die als onderbouwing bij de verschillende conclusies in de richtlijn staan vermeld. De geselecteerde artikelen zijn vervolgens gegradeerd naar de mate van bewijs waarbij de volgende indeling is gebruikt (tabel 1). De mate van bewijskracht en niveau van bewijs zijn in de conclusies van de verschillende hoofdstukken weergegeven. De belangrijkste literatuur waarop de conclusies zijn gebaseerd, is daarbij vermeld.
Indeling van de literatuur naar mate van bewijskracht
Tabel 1. Indeling van methodologische kwaliteit van individuele studies
|
|
Interventie |
Diagnostisch accuratesse onderzoek |
Schade of bijwerkingen, etiologie, prognose* |
|
A1 |
Systematische review van ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang. |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad. |
Prospectief cohortonderzoek van voldoende omvang en follow-up waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten. |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiëntcontrole- onderzoek, cohort-onderzoek). |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiëntcontroleonderzoek, cohortonderzoek). |
Vergelijkend onderzoek maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiëntcontroleonderzoek, cohortonderzoek). |
|
C |
Niet-vergelijkend onderzoek |
||
|
D |
Mening van deskundigen |
||
* Deze classificatie is alleen van toepassing in situaties waarin om ethische of andere redenen gecontroleerde trials niet mogelijk zijn. Zijn die wel mogelijk, dan geldt de classificatie voor interventies.
Tabel 2. Niveau van conclusies
|
|
Conclusie gebaseerd op |
|
1 |
Onderzoek van niveau A1 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2, met consistent resultaat |
|
2 |
Eén onderzoek van niveau A2 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
3 |
Eén onderzoek van niveau B of C |
|
4 |
Mening van deskundigen |
Totstandkoming van de aanbevelingen
Voor het komen tot een aanbeveling zijn er naast het wetenschappelijk bewijs vaak andere aspecten van belang zoals patiëntenvoorkeuren, beschikbaarheid van speciale technieken of expertise, organisatorische aspecten, maatschappelijke consequenties of kosten. Deze aspecten worden besproken na de ‘Conclusie’ in de ‘Overige overwegingen’. Hierin wordt de conclusie op basis van de literatuur in de context van de dagelijkse praktijk geplaatst en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van het beschikbare bewijs in combinatie met deze overwegingen. Het volgen van deze procedure en het opstellen van de richtlijn in dit ‘format’ heeft als doel de transparantie van de richtlijn te verhogen. Het biedt ruimte voor een efficiënte discussie tijdens de werkgroepvergaderingen en vergroot bovendien de helderheid voor de gebruiker van de richtlijn.
De richtlijn is niet allesomvattend
Bij het opstellen van de richtlijn is uitgegaan van de op dit moment belangrijkste knelpunten en aandachtspunten in de behandeling en begeleiding van patiënten met GBS. Deze punten zijn door oud-patiënten en zorgverleners aangedragen en vertaald in uitgangsvragen voor de richtlijn. De richtlijn beoogt geen allesomvattend leerboek te zijn maar biedt praktische aanknopingspunten voor zorgverleners bij de belangrijkste uitgangsvragen.
Bij het beantwoorden van de uitgangsvragen is uitgegaan van de zorg die specifiek is voor patiënten met GBS. De gebruikelijke zorg en de algemeen gangbare activiteiten zijn niet vermeld in de richtlijn. Dit houdt in dat bijvoorbeeld algemeen therapeutische zorg alleen dan vermeld wordt als deze afwijkt van de algemeen gangbare therapeutische interventies (zoals verwacht volgens de algemeen geldende stand van wetenschap en praktijk).
Zoekverantwoording
De aanbevelingen uit deze richtlijn zijn voor zover mogelijk gebaseerd op bewijs uit gepubliceerd wetenschappelijk onderzoek. Relevante artikelen werden gezocht door het verrichten van systematische zoekacties in de Cochrane Library, Medline, Embase. Hierbij werd de taal gelimiteerd tot Nederlands, Engels, Duits en Frans. Daarnaast werden handmatige zoekacties verricht. Er werd gezocht vanaf 1966 (Medline) of 1980 (Embase) tot mei 2008. Als trefwoorden voor de patiëntenpopulatie in Medline werden gebruikt: de MESH (Medical Subject Heading) termen: Guillain-Barré Syndrome / all subheadings or "Polyradiculoneuropathy" / all subheadings.
Verder werd gezocht met de vrije tekstwoorden: Guillain or (gbs near syndrome) or (acute inflammatory demyelinating polyneuropathie) or AIDP or (Acute Motor Axonal Neuropathy or AMAN) or [(Acute Motor adj sensory Neuropathy) or AMSAN] or (Fisher* Syndrome or Miller-Fisher).
Belangrijke selectiecriteria hierbij waren: vergelijkend onderzoek met hoge bewijskracht zoals meta-analyses, systematische reviews, randomized controlled trials (RCT’s) en controlled trials (CT). Waar deze niet voorhanden waren, werd verder gezocht naar vergelijkend cohort-onderzoek, vergelijkende patiëntcontrolestudies of niet-vergelijkend onderzoek. Voor de beantwoording van sommige uitgangsvragen werd ter meningsvorming ook gebruik gemaakt van case-reports.
