GBS Monitoring in de progressieve fase
Uitgangsvraag
- Welke specifieke symptomen die monitoring behoeven, komen voor bij een patiënt met GBS die in de progressieve fase van de ziekte is opgenomen op een gewone verpleegafdeling?
- Hoe vaak komen deze symptomen voor?
- Hoe kunnen levensbedreigende complicaties bij patiënten met GBS tijdig worden herkend?
- Wat is het nut van monitoring?
Aanbeveling
De Erasmus GBS Respiratory Insufficiency Score (EGRIS) is een voorspeller voor het ontstaan van respiratoire insufficiëntie en de noodzaak tot kunstmatige beademing. Om de EGRIS te bepalen zijn de volgende gegevens noodzakelijk: aantal dagen tussen begin spierzwakte en opname, aanwezigheid van aangezichtszwakte en/of bulbaire zwakte bij opname, MRC-sumscore bij opname. Bepaling van de EGRIS kan mede richting geven aan de noodzaak, frequentie en vorm van respiratoire monitoring alsmede het beoordelen van de indicatie voor IC-opname. Het wordt daarom aanbevolen om deze gegevens te noteren.
In de progressieve fase van GBS wordt geadviseerd om de patiënten eens per twee tot vier uur te controleren op insufficiënte ademhalingsfunctie door middel van het meten en vervolgen van de vitale capaciteit en beoordeling van de aanwezigheid van klinische tekenen van ademhalingszwakte (tachypnoe, tachycardie, zweten, paradoxale ademhaling en gebruik van accessoire ademhalingsspieren). Een indruk van de ademhalingsfunctie kan verkregen worden door het uitvoeren van praktische ´bedside´-testen zoals het vervolgen van de kracht van het hoesten en het herhaaldelijk testen tot hoeveel een patiënt hardop kan tellen in één ademteug.
Uitsluitend bloedgasanalyse dient in het algemeen niet leidend te zijn in de beoordeling van (de kans op) respiratoire insufficiëntie omdat afwijkingen in pO2 of pCO2 vaak een laat teken van respiratoire insufficiëntie zijn.
Zowel klinische vaststelling van insufficiënte ademhalingsfunctie van patiënten met GBS (zoals de verschijnslen van tachypneu) als afwijkende testen (zoals een sterk verminderde vitale capaciteit of een afwijkende bloedgasanalyse) kunnen elk afzonderlijk een IC-opname rechtvaardigen.
Opname op de IC dient sterk te worden overwogen bij een vitale capaciteit (VC) <15-20ml/kg of bij een VC < 1 liter. Bij een hoge EGRIS (score 5-7) passend bij een grote kans op respiratoire insufficiëntie dient tijdige opname op de IC te worden overwogen.
Opname op de IC dient ook te worden overwogen bij ernstige cardiovasculaire autonome dysfunctie, ernstige slikstoornissen en bij een snelle progressie van de spierzwakte bij een reeds ernstig aangedane patiënt.
Gedurende de opname in het ziekenhuis moet met name in de progressieve fase van GBS rekening worden gehouden met het vóórkomen van autonome functiestoornissen.
Autonome dysfunctie kan worden gemonitord door regelmatige controle (in de progressieve fase in het algemeen eens per twee tot vier uur) van bloeddruk, polsfrequentie, pupilreacties en de aanwezigheid van tekenen van ileus.
Bij aanwijzingen voor autonome instabiliteit (bijvoorbeeld bradycardie, grote wisselingen in bloeddruk) dienen continue ECG-monitoring en regelmatige bloeddrukmeting overwogen te worden.
Overwegingen
Monitoring potentieel levensbedreigende complicaties
Uit het voorgaande blijkt dat de noodzaak voor en methoden van monitoring bij patiënten met GBS in de progressieve fase van de ziekte die zijn opgenomen op een gewone verpleegafdeling nauwelijks zijn onderzocht. Er zijn drie studies die informatie verstrekken over het bepalen van de kans op respiratoire insufficiëntie en kunstmatige beademing (Sharshar, 2003; Durand, 2006; Walgaard, 2010). Onderbouwde informatie over (de frequentie van) het monitoren van andere potentieel levensbedreigende symptomen bij GBS dan respiratoire insufficiëntie ontbreekt. De werkgroep geeft als indicatie voor monitoring van levensbedreigende complicaties de volgende frequentie: in de progressieve fase elke twee tot vier uur, in de plateaufase elke zes uur en in de herstelfase elke twaalf uur.
- Monitoring respiratoire insufficiëntie
Voor de klinische praktijk kunnen mede op basis van de beschikbare literatuur de volgende praktische adviezen betreffende monitoring van respiratie op de verpleegafdeling worden geformuleerd (zie ook: Van Doorn, 2008):
- gebruik de EGRIS;
- indien binnen de eerste zes dagen na opname een EMG is verricht kan ook de CPN- p/d CMAP-ratio (zie samenvatting van de literatuur) in combinatie met metingen vitale capaciteit worden gebruikt voor het inschatten van de kans op respiratoire insufficiëntie;
- frequente monitoring van de ademhalingsfunctie (dat wil zeggen minstens elke twee tot vier uur zolang patiënt nog in de progressieve fase is) dient in ieder geval te gebeuren bij patiënten met intermediair of hoog risico (zie wetenschappelijke onderbouwing voor definities van de verschillende risicogroepen) op respiratoire insufficiëntie;
- laagdrempelige consultatie van een IC-arts over indicatie voor opname op de IC dient plaats te vinden bij alle risicogroepen, maar overweeg tijdige IC-opname bij patiënten met een zeer hoog risico volgens de EGRIS.
Klinische symptomen om dreigende respiratoire insufficiëntie vast te stellen
Verschillende instrumenten kunnen worden gebruikt om de ademhalingsfunctie te monitoren. Klinische tekenen van ademhalingszwakte zijn tachypnoe, tachycardie, zweten, asynchrone bewegingen van borstwand en buik (paradoxale ademhaling) en gebruik van accessoire ademhalingsspieren. De werkgroep is van mening dat het vervolgen van de vitale capaciteit een zinvolle test is om de spierkracht van de ademhalingsspieren te vervolgen. Diverse studies tonen een verband aan tussen vitale capaciteit en de kans op respiratoire insufficiëntie (Sharshar, 2003; Durand, 2006). In het algemeen wordt een vitale capaciteit van minder dan 15-20 ml/kg beschouwd als een indicatie voor opname op de IC (Hughes, 2005; Durand, 2006). Een vitale capaciteit lager dan 15-20 ml/kg is in diverse studies sterk geassocieerd met de kans op respiratoire insufficiëntie (Lawn, 2001). De vitale capaciteit kan niet betrouwbaar worden gemeten bij patiënten met ernstige zwakte van de aangezichtsspieren.
Naar de mening van de werkgroep is het onverstandig alleen op de uitslagen van bloedgasanalyse of zuurstofsaturatie gemeten door middel van plethysmografie te varen voor de beoordeling van de kans dat een patiënt respiratoir insufficiënt is of dreigt te worden. Zowel een lage pO2 (lager dan ondergrens van normaalwaarde), een hoge pCO2 (hoger dan bovengrens van normaalwaarde) of een lagere saturatie dan voor de patiënt normaal is, zijn in het algemeen tekenen dat de patiënt reeds respiratoir insufficiënt is. Naar de mening van de werkgroep kan een tweede pCO2-bepaling worden gebruikt. Dit om CO2-toename vast te stellen bij patiënten die ernstige zwakte van de extremiteiten hebben maar klinisch geen tekenen vertonen van respiratoire insufficiëntie (zoals subjectieve uitputting of dyspnoe, tachypnoe) of sufheid ten gevolge van CO2-stapeling. Elke duidelijke CO2-toename in de bloedgasanalyse in de progressieve fase van GBS rechtvaardigt naar de mening van de werkgroep consultatie van een IC-arts. In elk geval dient IC-opname te worden nagestreefd voordat sufheid ten gevolge van CO2-stapeling optreedt.
Een praktische (maar niet-gevalideerde) ‘bedside’-test om progressie van ademhalingszwakte vast te kunnen stellen is: herhaaldelijk testen tot hoeveel een patiënt hardop kan tellen (1, 2, 3 enzovoort) in één ademteug. Duidelijke afname van het aantal tellen kan een aanwijzing zijn dat de patiënt dreigend respiratoir insufficiënt is. Andere (eveneens niet-gevalideerde) ´bedside’-testen om een indruk te krijgen van de progressie van ademhalingszwakte is het in de tijd vervolgen van de kracht van het hoesten of meten van de borstomvang bij maximale inspiratie.
Men dient zich te realiseren dat geen enkele test de klinische beoordeling en eigen inschatting van de patiënt te allen tijde kan vervangen. Met andere woorden: indien de patiënt uitgeput is naar het oordeel van de arts of wanneer de patiënt dit zelf als zodanig duidelijk aangeeft dient vrijwel zonder uitzondering en ongeacht welke test of bloedbepaling een IC-arts geconsulteerd te worden voor IC-opname. Andersom geldt dat, indien er een duidelijke aanwijzing is op basis van bovengenoemde testen (zoals daling van de vitale capaciteit tot 15-20ml/kg of <1L) ondanks ontbreken van klinische tekenen van ademhalingszwakte of dreigende respiratoire insufficiëntie, ook consultatie van een IC-arts wordt geadviseerd.
2. Monitoring autonome functiestoornissen
Op basis van de literatuur zijn geen harde aanbevelingen te doen betreffende monitoring van autonome dysfunctie op de verpleegafdeling. Daarom zijn alleen praktische adviezen te geven op basis van ‘common sense’ (Van Doorn, 2008). Autonome dysfunctie kan worden gemonitord door regelmatige controle van bloeddruk, polsfrequentie, pupilreacties en de aanwezigheid van tekenen van ileus, zoals bolle buik met veel lucht in de darmen, misselijkheid, braken of langdurig geen ontlasting ondanks laxantia. Met name de bloeddruk- en polscontroles zouden elke twee tot vier uur kunnen worden uitgevoerd bij snel progressieve klachten van spierzwakte aangezien er een relatie is beschreven tussen de ernst van spierzwakte en autonome dysfunctie door sommige, maar niet alle, auteurs (Mukerji, 2009; Lyu, 2002; Ruts 2010). Bij aanwijzingen voor autonome instabiliteit (bijvoorbeeld bradycardie, grote wisselingen in bloeddruk) dient continu ECG-monitoring en regelmatige bloeddrukmeting overwogen te worden op een medium, high of intensive care-unit. Het potentiële risico dat gepaard gaat met provocatietesten als oogboldruk, Valsalva-manoeuvre, orthostasetesten en dergelijke (ernstige bradycardie, asystolie) is naar de mening van de werkgroep vooralsnog te groot in vergelijking met de opbrengst om dergelijke testen standaard aan te bevelen bij patiënten die niet op een bewakingsmonitor zijn aangesloten.
Het is waarschijnlijk verstandig om bij patiënten met GBS die op de verpleegafdeling zijn opgenomen en bij wie autonome dysfunctie is vastgesteld of bij wie dit wordt vermoed, terughoudend te zijn met tracheaal uitzuigen van sputum, aangezien dit een krachtige vagale prikkel kan zijn die kan leiden tot bradycardie en zelfs asystolie (Mukerji, 2009). Indien er een noodzaak is tot tracheaal uitzuigen kan worden overwogen om bij dergelijke patiënten continue ECG-registratie toe te passen en atropine 0,5 mg iv/im binnen handbereik te hebben.
Bij obstipatie of ileus als gevolg van immobilisatie of autonome dysfunctie kan overwogen worden lactulose te geven. Bij voorkeur dan geen morfinemimetica.
3. Monitoring bulbaire stoornissen/slikstoornissen
Het vóórkomen van ernstige slikstoornissen kan een indicatie zijn voor IC-opname. Bij patiënten met GBS komen deze slikstoornissen vaak voor in combinatie met een verminderde hoestreflex. Een aanwijzing voor het bestaan van slikklachten en gevaar van aspiratie bestaat indien een patiënt zich geregeld of snel verslikt bij eten of drinken. Bij verdenking op slikstoornissen kan een logopedist gevraagd worden voor nader onderzoek en advisering.
Onderbouwing
Achtergrond
Incidentie van potentieel levensbedreigende complicaties
Patiënten met GBS kunnen diverse complicaties krijgen in de progressieve fase (die volgens de definitie van GBS maximaal vier weken duurt na het begin van de zwakte). Er kan een onderscheid worden gemaakt in complicaties die wel en die niet potentieel levensbedreigend zijn. Potentieel levensbedreigende complicaties zijn:
- zwakte van ademhalingsspieren waardoor er respiratoire insufficiëntie kan optreden;
- bulbaire stoornissen, met name slikklachten waardoor er een verhoogde kans is op aspiratie;
- autonome functiestoornissen zoals hartritmestoornissen (bradycardie, tachycardie, asystolie), extreme bloeddrukschommelingen, ileus (Van Doorn 2008; Flachenecker, 2007; Burns, 2001; Ruts, 2010).
Overige complicaties die bij GBS vóórkomen worden in de andere hoofdstukken behandeld: bacteriële infecties in module ‘Bacteriële infecties’, pijn in module ‘pijn’, mictiestoornissen en cornea-ulceraties bij aangezichtszwakte in module ‘Fysieke complicaties’.
Ook van groot belang is aandacht voor preventie van complicaties die gepaard gaan met immobilisatie (trombosebeen, decubitus, contracturen, zie module ‘Fysieke complicaties’.
Met behulp van ‘bedside’-testen (zoals metingen vitale capaciteit) en/of klinische observaties (zoals gebruik van hulpademhalingsspieren duidend op dreigende respiratoire uitputting) kan worden getracht om deze complicaties te voorspellen of tijdig op het spoor te komen. Door tijdige behandeling op een intensive care-afdeling (zie module ‘IC en beademing’) kunnen ernstige gevolgen zoals respiratoire insufficiëntie of hartstilstand/ritmestoornissen dan mogelijk voorkómen worden.
Monitoring van potentieel levensbedreigende complicaties
Tijdige herkenning van potentieel levensbedreigende complicaties is van groot belang voor patiënten met GBS. De belangrijkste complicaties in de progressieve fase van GBS worden hierna besproken; samengevat wordt op welke wijze deze gemonitord kunnen worden. De niet potentieel levensbedreigende complicaties (pijnklachten enzovoort) worden hier niet besproken (zie module ‘Fysieke complicaties’).
Conclusies / Summary of Findings
Incidentie van potentieel levensbedreigende complicaties
|
Niveau 1 |
De incidentie van respiratoire insufficiëntie bij patiënten met GBS varieert van 9 tot 43% in observationele studies en van 11 tot 38% in GBS-trials. De incidentie is afhankelijk van de studieopzet, populatie en de periode (immuuntherapie wel of niet als standaardtherapie).
A GBS Steroid Trial Group, 1993;, Van Koningsveld, 2004 B French Cooperative Group on Plasma Exchange in GBS, 1987; Plasma Exchange / Sandoglobulin GBS Trial Group, 1997; Durand, 2006; Sharshar, 2003; Walgaard, 2010; Cheng, 2004 C Alsheklee, 2008 |
|
Niveau 2 |
Autonome stoornissen komen frequent voor (6-46%) bij patiënten met GBS maar over de klinische relevantie is weinig bekend.
B Durand, 2006; Sharshar,2003; Cheng, 2004 C Alsheklee, 2008; Ruts, 2010 |
|
Niveau 3 |
Beademingsgerelateerde pneumonie en andere intensive care-behandelinggerelateerde complicaties zijn belangrijker als oorzaken voor mortaliteit bij patiënten met GBS dan potentieel levensbedreigende complicaties (respiratoire insufficiëntie, slikklachten en autonome instabiliteit) in de progressieve fase van GBS.
B Lawn, 1999 C Henderson, 2003; Alshekhlee, 2008 |
Monitoring van potentieel levensbedreigende complicaties
|
Niveau 3 |
De EGRIS is een gevalideerd prognostisch instrument om de kans op kunstmatige beademing van patiënten met GBS te voorspellen met behulp van eenvoudige klinische variabelen die beschikbaar zijn bij opname.
B Walgaard 2010 |
|
Niveau 3 |
Onder gestandaardiseerde omstandigheden kan het meten van proximale en distale CMAP van de nervus peroneus communis binnen zes dagen na opname in combinatie met het meten van de vitale capaciteit een betrouwbare inschatting geven van de kans dat een patiënt met GBS kunstmatige beademing nodig zal hebben.
B Durand 2006 |
Samenvatting literatuur
Incidentie van potentieel levensbedreigende complicaties
In zeven observationele studies werd de incidentie van ernstige (levensbedreigende) complicaties bij patiënten met GBS beschreven (tabel 1). De studies betroffen niet alleen IC-patiënten of beademde patiënten, aangezien gezocht is naar studies die de incidentie hiervan beschrijven bij (nog) niet op de IC opgenomen patiënten. In vier studies werd gekeken naar het optreden van respiratoire insufficiëntie (Cheng, 2004; Durand, 2006; Sharshar, 2003; Walgaard, 2010). De incidentie varieerde van 22 tot 43%. In twee studies (Alshekhlee, 2008; Chio, 2003) werden lagere incidenties van respiratoire insufficiëntie en kunstmatige beademing gevonden. Dit heeft waarschijnlijk te maken met het feit dat dit populatiestudies waren en minder zieke patiënten zijn geïncludeerd. De studie van Sharshar was gebaseerd op de data van de gerandomiseerde klinische trials van de French Cooperative Group on Plasma Exchange die patiënten recruteerden in de perioden 1981-1985 en 1986-1993. De hogere incidentie van respiratoire insufficiëntie en noodzaak van kunstmatige beademing in de studie van Sharshar (zie tabel 1) vergeleken met de studies van Walgaard en Durand is te verklaren door het feit dat in deze studies de helft van de patiënten (de placebogroep) geen immuuntherapie (plasmaferese of IVIg) kregen, in tegenstelling tot in de studies van Walgaard en Durand waarin alle patiënten die niet meer zelfstandig konden lopen met immuuntherapie (IVIg of plasmaferese) werden behandeld. Zowel in de studie van Sharshar als van Walgaard, beide grote prospectieve series, was de incidentie van bulbaire dysfunctie, gedefinieerd als aangezichtszwakte of slikklachten, hoog (38 en 50%). Hierbij moet worden aangetekend dat er in de studie van Walgaard uitsluitend ernstiger aangedane patiënten (‘GBS disability’ score ≥ 3) zijn geïncludeerd.
In andere gerandomiseerde klinische trials bij patiënten met GBS (Plasma Exchange / Sandoglobulin GBS Trial Group, 1997; GBS Steroid Trial Group, 1993; Van Koningsveld, 2004) varieerde de incidentie van kunstmatige beademing van 11 tot 34%. In de Plasma Exchange / Sandoglobulin GBS Trial (1997) en de studie van Van Koningsveld (2004) was het inclusiecriterium “niet in staat om zonder hulp te lopen” en werden lagere incidenties gevonden van kunstmatige beademing (respectievelijk 11 en 22%) dan in de studie van de GBS Steroid Trial Group (1993), waarin kunstmatige beademing noodzakelijk was bij 34% ondanks dat patiënten met minder zwakte werden geïncludeerd (inclusiecriterium: “te zwak om te kunnen rennen”). Ook dit verschil kan goed verklaard worden door het feit dat IVIg nog geen standaardtherapie was in 1993.
Autonome instabiliteit trad op bij 6-23% van de patiënten afhankelijk van de studiepopulatie (tabel 1). De studies zijn moeizaam te vergelijken in verband met de verschillende inclusiecriteria en de variabele definitie van autonome instabiliteit, of soms het ontbreken van enige definitie. In een retrospectieve studie werd er bij 11 van de 35 patiënten (31%) die op een IC waren opgenomen een bradyaritmie gerapporteerd (Flachenecker 2000). Echter, de klinische relevantie van het optreden van bradycardie in deze studie was onduidelijk.
Asystolie en dientengevolge pacemaker-indicatie zijn beschreven bij patiënten met GBS, maar dit is zeldzaam (Kordouni, 2007; Tonelli,2007). In de GRAPH-studie (Ruts 2010, N=138 patiënten met GBS) werden hogere incidenties van autonome dysfunctie in de eerste drie weken van de ziekte gevonden. Autonome dysfunctie werd gedefinieerd als hypertensie (systole>140 en/of diastole>90 mmHg), hypotensie (systole<90), tachycardie (hartfrequentie>100), bradycardie (hartfrequentie<60), gastro-intestinale dysfunctie (diarree, obstipatie of incontinentie), blaasdysfunctie (urineretentie of incontinentie). Incidenties varieerden van 9% (bradycardie) tot 67% (hypertensie) (zie tabel 1). Milder aangedane (‘GBS disability’ schaal ≤3) patiënten hadden minder vaak autonome dysfunctie. Mogelijk is er sprake van enige overschatting omdat niet duidelijk is of de patiënten al bekend waren met hypertensie bij opname.
Ondanks het feit dat er levensbedreigende problemen kunnen ontstaan bij patiënten opgenomen op een gewone neurologische afdeling, lijkt het grootste deel van de mortaliteit van GBS toch veroorzaakt te worden door beademingsgerelateerde pneumonie en andere complicaties bij patiënten die op een IC zijn opgenomen (Cheng, 2004; Chio, 2003; Henderson, 2003; Lawn, 1999; Plasma exchange / Sandoglobulin GBS Trial Group, 1997). In een studie van Wijdicks (2003) wordt beschreven dat spoed-intubaties in verband met acute ademstilstand op de verpleegafdeling afdeling na 1987 niet meer voorgekomen zouden zijn. Dit komt mogelijk door betere monitoring van de ademhaling en de introductie van IVIg. Deze patiënten hebben dus in het algemeen geen zeer ernstige complicatie (overlijden door respiratoire insufficiëntie) op een gewone verpleegafdeling door te laat onderkende complicaties zoals in deze module beschreven. Op basis hiervan zou men kunnen veronderstellen dat patiënten goed worden gecontroleerd en heden ten dage in het algemeen tijdig op een IC worden opgenomen.
Tabel 1. Frequenties van vóórkomen van potentieel levensbedreigende complicaties bij patiënten met GBS in observationele studies (alleen indien in studie gemeld).
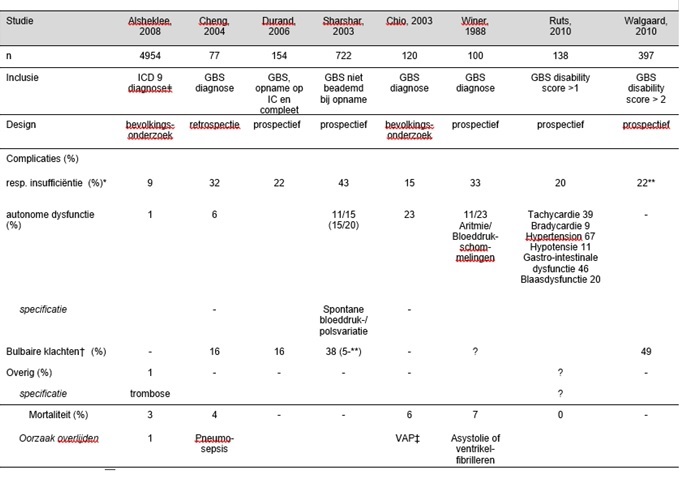
ǂ International Classification of Diseases, 9th Edition-code voor GBS
* respiratoire insufficiëntie waarvoor kunstmatige beademing noodzakelijk was
** beademing binnen een week na opname
† aangezichtszwakte of slikklachten
‡ VAP: ventilator associated pneumonia
Monitoring van potentieel levensbedreigende complicaties
Respiratoire insufficiëntie
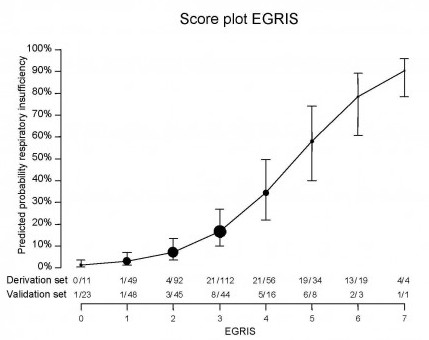
Walgaard (2010) heeft een scoresysteem ontwikkeld en geëvalueerd waarmee op basis van eenvoudige klinische variabelen bij opname de kans op het optreden van respiratoire insufficiëntie binnen een week voorspeld kan worden (EGRIS: Erasmus Guillain-Barré Respiratory Insufficiency Score). Dit model werd ontwikkeld op basis van een groep van 377 patiënten met GBS (derivatiecohort) en gevalideerd in een groep van 188 patiënten (validatiecohort). Deze voorspelling is gebaseerd op:
- het aantal dagen tussen het ontstaan van spierzwakte en ziekenhuisopname;
- de aan- of afwezigheid van faciale en/of bulbaire zwakte op het moment van ziekenhuisopname;
- de MRC-sumscore op het moment van ziekenhuisopname.
Tabel 2. Erasmus GBS Respiratory Insufficiency Score (EGRIS)
Onderstaande tabel en figuur zijn met toestemming overgenomen uit Annals of Neurology (Walgaard, 2010)
|
|
Categorieën |
Score |
|
Dagen tussen begin spierzwakte en opname |
> 7 dagen |
0 |
|
|
4 – 7 dagen |
1 |
|
|
≤ 3 dagen |
2 |
|
Aangezichtszwakte en/of bulbaire zwakte bij opname |
Afwezig |
0 |
|
|
Aanwezig |
1 |
|
MRC-sumscore bij opname‡ |
60 – 51 |
0 |
|
|
50 – 41 |
1 |
|
|
40 – 31 |
2 |
|
|
30 – 21 |
3 |
|
|
≤ 20 |
4 |
|
EGRIS |
|
0 – 7 |
‡ MRC-sumscore is een score voor de spierkracht opgeteld voor alle ledematen (score 0-60, zie Kleyweg, 1991)
Op basis van dit scoresysteem kunnen patiënten onderscheiden worden in drie groepen:
- laag risico, EGRIS 0-2 : 4% kans op respiratoire insufficiëntie (95% CI 1-6%);
- Intermediair risico, EGRIS 3-4 : 24% kans op respiratoire insufficiëntie (95% CI 19-30%);
- hoog risico, EGRIS 5-7 : 65% kans op respiratoire insufficiëntie (95% CI 54-76%).
Figuur 1. In de onderstaande figuur kan met behulp van de EGRIS de kans op respiratoire insufficiëntie worden bepaald (Walgaard, 2010).
Durand (2006) heeft een model ontwikkeld voor het voorspellen van de kans of beademing nodig is op basis van dubbelzijdige metingen van de CMAP aan het proximale en distale deel van de peroneuszenuwen. Op basis van de gegevens van een groep van 103 patiënten (derivatiegroep) werd een model ontwikkeld dat in een groep van 51 patiënten werd gevalideerd (validatiegroep). Voor inclusie in de studie moest een compleet EMG zijn verricht en mochten patiënten niet vierentwintig uur voor of na het EMG (dat verricht werd door eenzelfde ervaren klinisch neurofysioloog verbonden aan een universiteitskliniek) kunstmatig beademd zijn. Gemiddeld werd een EMG verricht twee dagen na opname en bij alle geïncludeerde patiënten werd een EMG verricht binnen zes dagen na opname. De ratio van proximale en distale CMAP van de nervus peroneus communis (CPN p/d CMAP-ratio) werd gebruikt als maat voor de ernst van zenuwschade (demyelinisatie). Ook werd bij geïncludeerde patiënten de vitale capaciteit gemeten in zittende of halfzittende positie. Op basis van een regressiemodel werd een prognostische indeling gemaakt voor de kans op kunstmatige beademing op basis van de volgende kenmerken:
- categorie 1 (laag risico): CPN p/d CMAP ratio > 55,6% en VC 81-100%: kunstmatige beademing noodzakelijk bij 2,4% (1/42, derivatiegroep) en 0% (0/20, validatiegroep);
- categorie 2 (intermediair risico): CPN p/d CMAP-ratio > 55,6% en VC 17-80%: kunstmatige beademing noodzakelijk bij 28% (11/39) en 29% (4/14);
- categorie 3 (hoog risico): CPN p/d CMAP-ratio ≤ 55,5%: kunstmatige beademing noodzakelijk bij 50% (11/22) en 41% (7/17). In deze categorie viel de VC-meting weg als onafhankelijke prognostische factor in regressiemodellen.
De odds ratio (OR) voor noodzaak tot beademing in de validatieset bedroeg in categorie 2 ten opzichte van categorie 1 17,6; in categorie 3 was de OR 29,3 (beide OR’s significant).
In een studie van Sharshar (2003) bij 722 patiënten met GBS bij wie bij opname nog geen kunstmatige beademing nodig was maar van wie er uiteindelijk 43% kunstmatig beademd werden, is getracht een indruk te krijgen van de voorspellende waarde van testen en observaties. Stapsgewijze logistische regressie is gebruikt om de belangrijkste voorspellers in samenhang te analyseren en te bepalen.
Daarbij zijn twee analyses uitgevoerd: een waarbij de vitale capaciteit wel en een waarbij deze meting niet in de analyse is opgenomen. Dit vanwege het feit dat vitale capaciteit niet altijd gemeten is.
De analyse zonder vitale capaciteit gaf de volgende resultaten:
|
Voorspellers voor kunstmatige beademing (bij opname) |
OR |
95% CI |
|
Ineffectief hoesten |
9,09 |
4,00-20,00 |
|
Niet in staat om het hoofd boven het bed te heffen |
4,34 |
2,70-6,66 |
|
Niet in staat om ellebogen boven het bed te heffen |
2,99 |
1,80-4,97 |
|
Niet kunnen staan |
2,53 |
1,40-3,30 |
|
Tijd van begin tot opname <= 7 dagen |
2,51 |
1,68-3,77 |
|
Verhoogde leverenzymen |
2,09 |
1,38-3,17 |
Als de vitale capaciteit in de analyse werd meegenomen, restten er nog maar drie significante voorspellers, namelijk:
|
Voorspeller voor kunstmatige beademing (bij opname) |
OR |
95% CI |
|
Tijd van begin tot opname <= 7 dagen |
5 |
1,42-5,68 |
|
Niet in staat om het hoofd boven het bed te heffen |
5 |
1,92-12,50 |
|
Vitale capaciteit < 60% van de voorspelde waarde |
2,86 |
2,43-10,00 |
Uit dit onderzoek is wel af te leiden welke aspecten belangrijk zijn voor het monitoren van patiënten met GBS. De laatste twee studies zijn verricht door dezelfde onderzoeksgroep (Durand en Sharshar). In de studie van Durand wordt in de discussie gesteld dat de categorie-indeling met behulp van CMAP-metingen in combinatie met metingen vitale capaciteit een betere voorspellende waarde heeft (vastgesteld met C-index, een maat analoog aan de ROC-curve, maar dan geldend voor het gehele model en meerdere prognostische factoren tegelijk) dan de klinische criteria uit de eerdere studie van Sharshar.
Er kon geen literatuur worden gevonden over de waarde van bloedgasanalyse voor het tijdig voorspellen van respiratoire insufficiëntie en de noodzaak tot kunstmatige beademing of IC-opname.
Autonome dysfunctie
Ernstige autonome dysfunctie in de progressieve fase van GBS kan leiden tot hartritmestoornissen, grote variaties in de bloeddruk of stoornissen in darmmotiliteit (ileus).
In de studies van Flachenecker werd gebruik gemaakt van het 24-uurs ‘heart rate power spectrum’ om het optreden van bradyaritmieën te voorspellen (Flachenecker 1996, 1997, 2007). Dit is echter een zeer gespecialiseerde analyse waardoor deze waarschijnlijk niet breed toepasbaar is bij patiënten met GBS, die bovendien gebruik maakt van provocatietesten zoals de Valsalva-manoeuvre en oogboldruktest (Flachenecker 1996, 2007) die niet zonder risico zijn. Diverse testen zijn beschreven om autonome dysfunctie in patiënten met GBS te testen (Flachenecker, 1997; Lyu, 2002; Asahina, 2002). Testen, beschreven in deze studies, zijn: reactie bloeddruk op diverse provocatietesten (Valsalva-manoeuvre, ‘sustained handgrip’, hand onderdompelen in koud water en orthostase), en reactie van polsfrequentie op diep ademhalen. De aantallen patiënten in deze studies waren klein (n=5 tot 15). Dit waren observationele studies en er konden geen conclusies worden getrokken over de waarde van de testen voor het voorspellen van levensbedreigende complicaties op de verpleegafdeling.
Een studie van Burns (2001) beschrijft het vóórkomen van ileus bij op de IC opgenomen patiënten met GBS (n=114, incidentie 15%). Hoewel deze studie reeds op de IC opgenomen patiënten met GBS betreft, wordt een bruikbare definitie voor ileus gebruikt: ontbreken van ontlasting > 96 uur ondanks het gebruik van darmmotiliteitstimulerende medicatie, weekmakers, voldoende vocht en klysma’s.
Autonome stoornissen komen vaker voor bij patiënten die respiratoir insufficiënt worden dan bij hen die dit niet worden, mogelijk samenhangend met de ernst en uitgebreidheid van zenuwschade (Lawn, 2001; Ruts, 2010).
Literatuur over de klinische relevantie en risico’s van autonome stoornissen specifiek bij patiënten met GBS in de progressieve fase die op een gewone verpleegafdeling zijn opgenomen ontbreken.
Bulbaire stoornissen
In de geselecteerde literatuur worden geen testen of observaties vergeleken die voorspellend zijn voor het ontstaan van bulbaire stoornissen. Ook zijn er geen vergelijkende studies gevonden die de frequentie aangeven waarin slik- en spraakproblemen geobserveerd dienen te worden.
Referenties
- Alshekhlee A, Hussain Z, Sultan B, Katirji B. Immunotherapy for Guillain-Barré syndrome in the US hospitals. J Clin Neuromuscul Dis 2008;10(1):4-10.
- Asahina M, Kuwabara S, Suzuki A, Hattori T. Autonomic function in demyelinating and axonal subtypes of Guillain-Barré syndrome. Acta Neurol Scand 2002;105(1):44-50.
- Burns TM, Lawn ND, Low PA, Camilleri M, Wijdicks EF. Adynamic ileus in severe Guillain-Barré syndrome. Muscle Nerve 2001;24(7):963-5.
- Cheng B-CC. Predictive factors and long-term outcome of respiratory failure after Guillain-Barré syndrome. Am J Med Sci 2004;327(6):336-340.
- Chio AC. Guillain-Barré syndrome: A prospective, population-based incidence and outcome survey. Neurology 2003;60(7):1146-1150.
- Durand MC, Porcher R, Orlikowski D, Aboab J, Devaux C, Clair B, et al. Clinical and electrophysiological predictors of respiratory failure in Guillain-Barré syndrome: a prospective study. Lancet Neurol 2006;5(12):1021-8.
- Flachenecker P, Müllges W, Wermuth P, Hartung HP, Reiners K. Eyeball pressure testing in the evaluation of serious bradyarrhythmias in Guillain-Barré syndrome. Neurology 1996;47(1):102-8.
- Flachenecker P, Wermuth P, Hartung HP, Reiners K. Quantitative assessment of cardiovascular autonomic function in Guillain-Barré syndrome. Ann Neurol 1997;42(2):171-9.
- Flachenecker P, Lem K, Müllges W, Reiners K. Detection of serious bradyarrhythmias in Guillain-Barré syndrome: sensitivity and specificity of the 24-hour heart rate power spectrum. Clin Auton Res 2000;10(4):185-91.
- Flachenecker P. Autonomic dysfunction in Guillain-Barré syndrome and multiple sclerosis. J Neurol 2007;254 Suppl 2:II96-II101.
- French Cooperative Group on Plasma Exchange in Guillain-Barré Syndrome. Efficiency of plasma exchange in Guillain-Barré syndrome: role of replacement fluids. Ann Neurol 1987;22(6):753-61.
- Guillain-Barré Syndrome Steroid Trial Group.Double-blind trial of intravenous methylprednisolone in Guillain-Barré syndrome. Lancet 1993;341(8845):586-90.
- Henderson RD, Lawn ND, Fletcher DD, McClelland RL, Wijdicks EF. The morbidity of Guillain-Barré syndrome admitted to the intensive care unit. Neurology 2003;60(1):17-21.
- Hughes RA, Wijdicks EF, Benson E, Cornblath DR, Hahn AF, Meythaler JM, Sladky JT, Barohn RJ, Stevens JC; Multidisciplinary Consensus Group. Supportive care for patients with Guillain-Barré syndrome. Arch Neurol 2005;62(8):1194-8.
- Kleyweg RP, van der Meché FG, Schmitz PI. Axonal damage in Guillain-Barré syndrome. Muscle Nerve 1991;14(11):1103-9.
- Kordouni M, Jibrini M, Siddiqui MA. Long-term transvenous temporary pacing with active fixation bipolar lead in the management of severe autonomic dysfunction in Miller-Fisher syndrome: a case report. Int J Cardiol 2007;117(1):10-2.
- Lawn ND, Wijdicks EF. Fatal Guillain-Barré syndrome. Neurology 1999;52(3):635-8.
- Lawn ND, Fletcher DD, Henderson RD, Wolter TD, Wijdicks EFM. Anticipating mechanical ventilation in Guillain-Barré syndrome. Arch Neurol 2001;58:893-8
- Lyu RK, Tang LM, Hsu WC, Chen ST, Chang HS, Wu YR. A longitudinal cardiovascular autonomic function study in mild Guillain-Barré syndrome. Eur Neurol 2002;47(2):79-84.
- Mukerji S, Aloka F, Farooq MU, Kassab MY, Abela GS. Cardiovascular complications of the Guillain-Barré syndrome. Am J Cardiol 2009;104(10):1452-5.
- Plasma Exchange/Sandoglobulin Guillain-Barré Syndrome Trial Group. Randomised trial of plasma exchange, intravenous immunoglobulin, and combined treatments in Guillain-Barré syndrome. Lancet 1997;349(9047):225-230.
- Ruts L. Pain, autonomic dysfunction, and course of disease in Guillain-Barré syndrome. Thesis Erasmus Universiteit Rotterdam, 2010. ISBN987-90-9025241-4.
- Sakakibara R, Hattori T, Kuwabara S, Yamanishi T, Yasuda K. Micturitional disturbance in patients with Guillain-Barré syndrome. J Neurol Neurosurg Psychiatry 1997;63(5):649-53.
- Sharshar T, Chevret S, Bourdain F, Raphaël J-C, for the French Cooperative Group on Plasma Exchange in Guillain-Barré Syndrome. Early predictors of mechanical ventilation in Guillain-Barré syndrome. Crit Care Med 2003;31:278283.
- Tonelli A, Khasnis A, Abela GS. Peaked T - waves and sinus arrhythmia before prolonged sinus pauses and atrioventricular block in Guillain-Barré syndrome. Indian Pacing Electrophysiol J. 2007;7(4):249-52.
- van Doorn PA, Ruts L, Jacobs BC. Clinical features, pathogenesis, and treatment of Guillain-Barré syndrome. Lancet Neurol 2008;7(10):939-50.
- van-Koningsveld R, Schmitz PI, Meche FG, Visser LH, Meulstee J, van-Doorn PA. Effect of methylprednisolone when added to standard treatment with intravenous immunoglobulin for Guillain-Barré syndrome: randomised trial. Lancet 2004;363(9404):192-196.
- Walgaard et al. Prediction of respiratory insufficiency in Guillain-Barré syndrome. Ann Neurol 2010;67(6):781-7
- Winer JB, Hughes RAC. Identification of patients at risk of arrhythmia in the Guillain-Barré syndrome. Q J Med 1988;68:735-9.
- Wijdicks EF, Henderson RD, McClelland RL. Emergency intubation for respiratory failure in Guillain-Barré syndrome. Arch Neurol 2003;60(7):947-8.
Evidence tabellen
Bewijsklassetabel Monitoring in de progressieve fase
|
Auteur, jaartal |
Mate van bewijs |
Studie type |
Populatie |
Inclusiecriteria |
Eindpunt |
Monitorfactor |
Controle |
Resultaat |
Opmerkingen |
|
Durand, 2006 |
B |
Case Controle |
GBS patiënten (n=154) 51% vrouwen, Leeftijd: onbekend |
GBS patiënten van 1998 tot 2006 verwezen naar IC van Raymond Pointcarré Teaching hospital en complete electrofysiol. test |
mechanische ventilatie |
p/dCMAP ratio van de peroneus zenuwen |
|
Demyelinisering was aanwezig bij 0.85 die mech. ventilatie kregen en bij 51% van de patiënten die dat niet nodig hadden. as screening method p/dCMAP ratio <= 55,5%: OR 41,0 (95%CI: 4,8-353) (p/dCMAP ratio > 55,5%) & (VC>80%): OR 1 (p/dCMAP ratio > 55,5%) & (VC<=80%): OR 16,1 (95%CI: 1,9-132) |
Criteria voor demyelinisering niet duidelijk p/dCMAP = (proximal CAMP amplitude/distale CMAP amplitude). Aan beide kanten gedeeld door 2 van de “common peroneal nerves”. |
|
Flachenecker, 2000 |
C |
Retrospectieve cases |
n=35; 11 vrouwen, 24 mannen; gem. leeftijd 52,4 jaar (18-81) |
GBS patiënten opgenomen tussen 1993-1996 op IC afdeling Neurologie Universiteit Würzburg Duitsland, bij wie gedetailleerde medische gegevens en 24-uurs “heart rate power spectrum” beschikbaar waren. |
Blijvende asystolie die een pacemaker noodzakelijk maakt of cardiopulmonaire resuscitatie. Bradycardie < 40 slagen/minuut, noodzaak tot toediening van atropine. Bradycardie < 40 slagen/minuut met spontaan herstel Abnormale reactie op oogboldruktest met < 40 slagen/minuut tijdens proef |
Hoek in HRPS grafiek,log P4 in HRPS grafiek |
|
Kans op bradycardie gebaseerd op continue hartritme registratie slope <-1,2 sens .55 spec 0.82 log P4 < 4,9 sens .55 spec 0.82 log P4 < 4,9 or slope <-1,2 sens .73 sens .73 |
Zwak: inclusie van patiënten met abnormale reactie op oogboldruktest. Geen test op 2e populatie. |
|
Lawn, 2001 |
B |
Retrospectieve survey |
60 met mech. ventilatie vergeleken met 54 zonder mech. ventilatie. |
|
Mech. ventilatie |
test bulbaire functies (slikken - spreken) |
54 pt die geen mech. ventilatie nodig hadden
|
Hoger risico bij bulbaire dysfunctie; VC<20 ml/kg; Pi max<30 cm/H2O; Delta VC>30%; Delta Pi max>30%; Delta Pe max >30%; Bulbaire dysfunctie: 17,5 (CI95% 5,2-59,1) VC<20 ml/kg: 15,0 (95% CI: 4,1-54,5) |
Klinische verschijnselen zijn niet voorspellend |
|
Sharshar, 2003 |
B |
Case-controle |
n=722; |
patiënten uit 2 RCT’s voor GBS 1981-1985 en 1986-1993. |
Mechanische ventilatie. |
VC,test staan,test hoesten |
|
313 cases, 409 controles OR voor mech. vent: 2,51 (95%CI: 1,68-3,77) Begintijd tot opname <= 7 dagen 2,53 (95%CI: 1,40-3,30) Kan niet staan 2,99 (95%CI: 1,80-4,97) Kan elleboog niet boven bed optillen 4,34 (95%CI: 2,70-6,66) Kan hoofd niet boven bed heffen 9.09 (95%CI: 4,00-20,00) Ineffectief hoesten 2.09 (95%CI: 1,38-3,17) Lever enzymen verhoogd OR (when VC is available) 5,00 (95%CI: 1,42-5,68) Begintijd tot opname <= 7 dagen 5,00 (95%CI: 1,92-12,50) Kan hoofd niet boven bed heffen 2,86 (95%CI: 2,43-10,00) VC < 60% t.o.v. voorspelde waarde Vergelijking met de studie van Lawn: Deze studie is gebaseerd op opnamegegevens, Lawn baseert zich op gegevens verzameld tussen opname en kunstmatige beademing. |
|
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-06-2014
Beoordeeld op geldigheid : 24-01-2011
Uiterlijk in 2020 wordt door de Vereniging Spierziekten Nederland (VSN), na raadpleging van of op advies van aan de richtlijn participerende verenigingen, bepaald of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om (delen van) de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Algemene gegevens
Ook geautoriseerd door
- Uitvoeringsinstituut WerknemersVerzekeringen
In samenwerking met
- Agis Zorgverzekeringen
- Koninklijk Nederlands Genootschap voor Fysiotherapie
- Nederlands Huisartsen Genootschap
- Nederlandse Vereniging voor Cardiologie
- Nederlandse Vereniging voor Psychologen
- Vereniging Samenwerkingsverband Chronische Ademhalingsondersteuning
De richtlijn is tot stand gekomen met ondersteuning van Kwaliteitsinstituut voor de Gezondheidszorg (CBO) en met financiële steun ZonMw in het kader van het programma Kennisbeleid, Kwaliteit Curatieve Zorg.
Het Guillain-Barré syndroom (GBS) is een zeldzame ziekte met een zeer zware ziektelast. De ziekte leidt binnen enkele uren tot dagen tot verlammingsverschijnselen. Ongeveer 25% van de patiënten met het Guillain-Barré syndroom heeft kunstmatige beademing nodig waarvoor de patiënt wordt opgenomen op de IC.
Sommige patiënten herstellen volledig, maar een groot deel niet. Oud-patiënten geven aan dat met name de niet-zichtbare handicaps van de ziekte zoals een snelle vermoeidheid, beperkte belastbaarheid en pijn niet onderkend worden door bedrijfs- en verzekeringsartsen. Hierdoor worden regelmatig verkeerde re-integratietrajecten ingezet met alle gevolgen van dien.
Het zeldzaam vóórkomen van het Guillain-Barré syndroom maakt dat de parate kennis van veel behandelaars over deze ziekte beperkt is. Dit heeft tot gevolg dat er regelmatig gekozen wordt voor een eigen beleid dat afwijkt van de ‘best practice’. Dit gebeurt zowel tijdens de progressieve en plateaufase als tijdens de herstel- en late fase. Het is daarom belangrijk na te gaan welke behandeling de beste is en hoe het re-integratietraject optimaal vorm gegeven kan worden.
Bovengenoemde overwegingen waren voor de patiëntenvereniging, de Vereniging Spierziekten Nederland (VSN), aanleiding het initiatief te nemen voor de ontwikkeling van een multidisciplinaire, ‘evidence-based’ richtlijn voor diagnostiek en behandeling van het Guillain-Barré syndroom. Het Kwaliteitsinstituut voor de Gezondheidszorg CBO verleende hierbij methodologische expertise.
Doel en doelgroep
Doelstelling
Deze richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het vaststellen van goed medisch handelen. Er wordt aangegeven wat in het algemeen de beste zorg is voor patiënten met het Guillain-Barré syndroom. De richtlijn geeft aanbevelingen over de diagnostiek, verwijzing, behandeling en re-integratie van patiënten met het Guillain-Barré syndroom en kan worden gebruikt bij het geven van voorlichting aan patiënten. Ook biedt de richtlijn aanknopingspunten voor bijvoorbeeld transmurale afspraken of lokale protocollen ter bevordering van de implementatie.
Het doel is het verkrijgen van uniformiteit in de diagnostiek, behandeling en begeleiding in de diverse centra en het definiëren van de kaders waarbinnen de multidisciplinaire zorg van patiënten met het Guillain-Barré syndroom moet plaatsvinden. Deze richtlijn zal naar verwachting ook bijdragen aan verbeterde communicatie tussen behandelaars en patiënten en tussen behandelaars onderling.
Specifieke doelen van deze richtlijn zijn:
- het voorkómen van gezondheidsschade bij patiënten door het geven van concrete aanbevelingen over verbeterde diagnostische en therapeutische mogelijkheden;
- het doen van duidelijke uitspraken over te verrichten diagnostiek en behandeling van GBS bij volwassenen en kinderen en over het te volgen re-integratietraject.
Doelgroep
De richtlijn is bedoeld voor alle zorgverleners die bij de behandeling en begeleiding van patiënten met het Guillain-Barré syndroom betrokken zijn, met name huisartsen, (kinder)neurologen, revalidatieartsen, kinderartsen, bedrijfs-/verzekeringsartsen, fysiotherapeuten, psychologen en (IC-)-verpleegkundigen.
Samenstelling werkgroep
Voor het ontwikkelen van deze richtlijn is in 2008 een multidisciplinaire werkgroep samengesteld bestaande uit vertegenwoordigers van alle bij de diagnostiek, behandeling en begeleiding van patiënten met het Guillain-Barré syndroom betrokken medische disciplines, beleidsmedewerkers van de patiëntenvereniging, de Vereniging Spierziekten Nederland (VSN) en adviseurs van het Kwaliteitsinstituut voor de Gezondheidszorg CBO (zie hieronder).
Bij het samenstellen van de werkgroep is rekening gehouden met de geografische spreiding van de werkgroepleden, met een evenredige vertegenwoordiging van de verschillende betrokken verenigingen en instanties alsmede met een spreiding al dan niet in academische achtergrond. De werkgroepleden hebben onafhankelijk gehandeld en waren gemandateerd door hun vereniging. Een overzicht van de belangenverklaringen van werkgroepleden over mogelijke financiële belangenverstrengeling is als addendum bij de richtlijn gevoegd.
Samenstelling werkgroep
- Dhr. prof.dr. P.A. van Doorn, neuroloog, Eramus Medisch Centrum, Rotterdam, voorzitter
- Dhr. dr. J.W.G. Meijer, revalidatiearts, Revant Revalidatiecentrum Breda, vicevoorzitter
- Dhr. drs. E.S. Alberga, bedrijfsarts, Groningen
- Mw. dr. N. van Alfen, neuroloog, Universitair Medisch Centrum St. Radboud, Nijmegen
- Dhr. mr.drs. E.R. Berends, verzekeringsgeneeskundige, UWV, Assen
- Mw. drs. H.A. Berendsen, revalidatiearts, Sophia Revalidatie, Delft
- Dhr. dr. R.A.J.A.M. Bernsen, neuroloog, Jeroen Bosch Ziekenhuis, ’s Hertogenbosch
- Mw. mr. P.H. Blomkwist-Markens, voorzitter diagnosewerkgroep GBS/CIDP, Vereniging Spierziekten Nederland, Amsterdam
- Mw. dr. J.G. Broeks, revalidatiearts, Scheperziekenhuis, Emmen
- Dhr. dr. P.G. Erdmann, fysiotherapeut / bewegingswetenschapper, Universitair Medisch Centrum, Utrecht
- Mw. T. Dingelhoff, secretaresse Vereniging Spierziekten Nederland, Baarn
- Mw. drs. J.M. van Haelst, revalidatiearts, Revalidatiecentrum Tolbrug, Oss
- Mw. dr. A.M.C. Horemans, hoofd kwaliteit van zorg, Vereniging Spierziekten Nederland, Baarn, projectleider
- Dhr. dr. M. van der Jagt, neuroloog-intensivist, Erasmus Medisch Centrum, Rotterdam
- Mw. dr. L. Kok, arts-epidemioloog, Kwaliteitsinstituut voor de Gezondheidszorg CBO, Utrecht
- Dhr. W.J. Lubbers, huisarts, Gezondheidscentrum Parkwijk, Almere
- Mw. J.H.A.T. van Mierlo, lid diagnosewerkgroep GBS/CIDP, Vereniging Spierziekten Nederland, ’s Hertogenbosch
- Dhr. dr. W.L. van der Pol, neuroloog, Universitair Medisch Centrum, Utrecht
- Mw. drs. M. Rol, revalidatiearts, Den Haag
- Mw. dr. K. Rosenbrand, arts, Kwaliteitsinstituut voor de Gezondheidszorg CBO, Utrecht
- Mw. dr. E.H. Tromp, klinisch neuropsycholoog, Revalidatiecentrum Tolbrug, Oss
- Mw. M. Twigt, IC-verpleegkundige, Hoofddorp
- Mw. drs. F. de Wit, beleidsmedewerker kwaliteit van zorg, Vereniging Spierziekten Nederland, Baarn
- Mw. drs. M. van der Wurff, medewerker communicatie, Vereniging Spierziekten Nederland, Baarn
Adviseurs GBS-richtlijn
- Dhr. dr. B. van den Berg, internist-intensivist, Erasmus Medisch Centrum, Rotterdam
- Mw. drs. J. Blees, kinderrevalidatiearts, Revalidatiecentrum De Trappenberg, Huizen
- Mw. dr. N.A.M. Cobben, longarts-intensivist, Academisch Ziekenhuis – Centrum voor Thuisbeademing, Maastricht
- Dhr. A. Comuth, kinderfysiotherapeut, Adelante kinderrevalidatie, speciaal onderwijs & wonen, Valkenburg
- Dhr. J. Crasborn, directeur strategie, AGIS, Amersfoort
- Dhr. dr. M.P.J. Garssen, neuroloog, Jeroen Bosch Ziekenhuis, ’s Hertogenbosch
- Dhr. dr. B.C. Jacobs, neuroloog, Erasmus Universiteit, Rotterdam
- Dhr. dr. J.L.M. Jongen, neuroloog, Erasmus Medisch Centrum, Rotterdam
- Dhr. dr. E.J.O. Kompanje, senior onderzoeker/klinische ethicus Intensive Care, Erasmus Medisch Centrum, Rotterdam
- Mw. dr. R. van Koningsveld, neuroloog, Elkerliek Ziekenhuis, Helmond
- Mw. G. Lammers, maatschappelijk werker, Revalidatiecentrum ’t Roessingh, Enschede
- Dhr. dr. I.S.J. Merkies, neuroloog, Spaarne Ziekenhuis, Hoofddorp
- Dhr. K.D. Pelger, fysiotherapeut, Mytylschool Gabriel, ’s Hertogenbosch
- Mw. dr. L. Ruts, neuroloog, Havenziekenhuis Rotterdam
- Mw. dr. L.T.L. Sie, kinderneuroloog, Universitair Medisch Centrum St. Radboud, Nijmegen
- Dhr. B. Verdonk, fysiotherapeut, Universitair Medisch Centrum, Utrecht
- Mw. M. Versluis, senior-beleidsmedewerker, NPCF, Utrecht
- Mw. drs. C. Walgaard, neuroloog i.o., Erasmus Medisch Centrum, Rotterdam
- Mw. E. Wiarda Rosen Jacobson, logopedist, Erasmus Medisch Centrum, Rotterdam
- Mw. J.C. Wijnen, diëtist, lid werkgroep diëtisten en spierziekten DVN, Oss
Inbreng patiëntenperspectief
Bij het opstellen van de richtlijn is rekening gehouden met het patiëntenperspectief. In de knelpuntanalyse heeft de betrokken patiëntenvereniging (VSN) eigen knelpunten tijdens een focusgroepbijeenkomst ingebracht. De conceptrichtlijn is ook voorgelegd aan de betrokken patiëntenvereniging (VSN). Tot slot zijn of worden de gegevens uit deze richtlijn verwerkt in het voorlichtingsmateriaal van deze patiëntenvereniging.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de ontwikkeling van het concept van de richtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen. De richtlijn wordt verspreid onder alle relevante beroepsgroepen en ziekenhuizen. Ook wordt een samenvatting van de richtlijn ter publicatie aangeboden aan het Nederlands Tijdschrift voor Geneeskunde en zal er in verschillende specifieke vaktijdschriften aandacht worden besteed aan de richtlijn. Daarnaast wordt de integrale tekst van de richtlijn op de websites van de patiëntenvereniging (VSN), het CBO en de betrokken beroepsverenigingen geplaatst.
Om de implementatie en evaluatie van deze richtlijn te stimuleren, zal de werkgroep een implementatieplan opstellen en een lijst van indicatoren ontwikkelen aan de hand waarvan de implementatie kan worden gemeten. Indicatoren geven in het algemeen de zorgverleners de mogelijkheid te evalueren of zij de gewenste zorg leveren. Zij kunnen daarmee ook onderwerpen voor verbeteringen van de zorgverlening identificeren.
De richtlijn wordt getoetst bij de eindgebruiker in de verschillende regio’s en wetenschappelijke verenigingen, waarbij ook visitaties zullen worden georganiseerd.
Werkwijze
Gezien de omvang van het werk werd een aantal subgroepen gevormd met vertegenwoordigers van relevante disciplines. De voorzitter en subvoorzitter zorgden samen met beleidsmedewerkers van de VSN en de adviseurs van het CBO voor de coördinatie en onderlinge afstemming van de subgroepen.
De werkgroep heeft gedurende een periode van ongeveer twee jaar gewerkt aan de tekst voor de conceptrichtlijn. De subgroepen beoordeelden de door de adviseurs van het CBO geschreven wetenschappelijke onderbouwingen en formuleerden vervolgens de overige overwegingen en aanbevelingen. Tevens schreven de subgroepen consensusteksten wanneer wetenschappelijk bewijs voor het beantwoorden van de uitgangsvraag ontbrak. De teksten werden tijdens plenaire vergaderingen besproken en na verwerking van de commentaren geaccordeerd. De voltallige werkgroep is twintigmaal (tien keer lijfelijk en tien keer telefonisch) bijeengeweest om de resultaten van de subgroepen in onderling verband te bespreken. De teksten van de subgroepen zijn door een redactieteam samengevoegd en op elkaar afgestemd tot één document: de conceptrichtlijn. Deze werd in juni 2010 aan de bij de richtlijn betrokken verenigingen verstuurd voor commentaar. Na verwerking van het commentaar is de richtlijn in november 2010 door de voltallige werkgroep vastgesteld en ter autorisatie naar de relevante beroepsverenigingen gestuurd.
De kwaliteit van deze artikelen werd door epidemiologen van het CBO beoordeeld aan de hand van ‘evidence-based richtlijnontwikkeling’ (EBRO)-beoordelingsformulieren. Artikelen van matige of slechte kwaliteit werden uitgesloten. Na deze selectie bleven de artikelen over die als onderbouwing bij de verschillende conclusies in de richtlijn staan vermeld. De geselecteerde artikelen zijn vervolgens gegradeerd naar de mate van bewijs waarbij de volgende indeling is gebruikt (tabel 1). De mate van bewijskracht en niveau van bewijs zijn in de conclusies van de verschillende hoofdstukken weergegeven. De belangrijkste literatuur waarop de conclusies zijn gebaseerd, is daarbij vermeld.
Indeling van de literatuur naar mate van bewijskracht
Tabel 1. Indeling van methodologische kwaliteit van individuele studies
|
|
Interventie |
Diagnostisch accuratesse onderzoek |
Schade of bijwerkingen, etiologie, prognose* |
|
A1 |
Systematische review van ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang. |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad. |
Prospectief cohortonderzoek van voldoende omvang en follow-up waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten. |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiëntcontrole- onderzoek, cohort-onderzoek). |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiëntcontroleonderzoek, cohortonderzoek). |
Vergelijkend onderzoek maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiëntcontroleonderzoek, cohortonderzoek). |
|
C |
Niet-vergelijkend onderzoek |
||
|
D |
Mening van deskundigen |
||
* Deze classificatie is alleen van toepassing in situaties waarin om ethische of andere redenen gecontroleerde trials niet mogelijk zijn. Zijn die wel mogelijk, dan geldt de classificatie voor interventies.
Tabel 2. Niveau van conclusies
|
|
Conclusie gebaseerd op |
|
1 |
Onderzoek van niveau A1 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2, met consistent resultaat |
|
2 |
Eén onderzoek van niveau A2 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
3 |
Eén onderzoek van niveau B of C |
|
4 |
Mening van deskundigen |
Totstandkoming van de aanbevelingen
Voor het komen tot een aanbeveling zijn er naast het wetenschappelijk bewijs vaak andere aspecten van belang zoals patiëntenvoorkeuren, beschikbaarheid van speciale technieken of expertise, organisatorische aspecten, maatschappelijke consequenties of kosten. Deze aspecten worden besproken na de ‘Conclusie’ in de ‘Overige overwegingen’. Hierin wordt de conclusie op basis van de literatuur in de context van de dagelijkse praktijk geplaatst en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van het beschikbare bewijs in combinatie met deze overwegingen. Het volgen van deze procedure en het opstellen van de richtlijn in dit ‘format’ heeft als doel de transparantie van de richtlijn te verhogen. Het biedt ruimte voor een efficiënte discussie tijdens de werkgroepvergaderingen en vergroot bovendien de helderheid voor de gebruiker van de richtlijn.
De richtlijn is niet allesomvattend
Bij het opstellen van de richtlijn is uitgegaan van de op dit moment belangrijkste knelpunten en aandachtspunten in de behandeling en begeleiding van patiënten met GBS. Deze punten zijn door oud-patiënten en zorgverleners aangedragen en vertaald in uitgangsvragen voor de richtlijn. De richtlijn beoogt geen allesomvattend leerboek te zijn maar biedt praktische aanknopingspunten voor zorgverleners bij de belangrijkste uitgangsvragen.
Bij het beantwoorden van de uitgangsvragen is uitgegaan van de zorg die specifiek is voor patiënten met GBS. De gebruikelijke zorg en de algemeen gangbare activiteiten zijn niet vermeld in de richtlijn. Dit houdt in dat bijvoorbeeld algemeen therapeutische zorg alleen dan vermeld wordt als deze afwijkt van de algemeen gangbare therapeutische interventies (zoals verwacht volgens de algemeen geldende stand van wetenschap en praktijk).
Zoekverantwoording
De aanbevelingen uit deze richtlijn zijn voor zover mogelijk gebaseerd op bewijs uit gepubliceerd wetenschappelijk onderzoek. Relevante artikelen werden gezocht door het verrichten van systematische zoekacties in de Cochrane Library, Medline, Embase. Hierbij werd de taal gelimiteerd tot Nederlands, Engels, Duits en Frans. Daarnaast werden handmatige zoekacties verricht. Er werd gezocht vanaf 1966 (Medline) of 1980 (Embase) tot mei 2008. Als trefwoorden voor de patiëntenpopulatie in Medline werden gebruikt: de MESH (Medical Subject Heading) termen: Guillain-Barré Syndrome / all subheadings or "Polyradiculoneuropathy" / all subheadings.
Verder werd gezocht met de vrije tekstwoorden: Guillain or (gbs near syndrome) or (acute inflammatory demyelinating polyneuropathie) or AIDP or (Acute Motor Axonal Neuropathy or AMAN) or [(Acute Motor adj sensory Neuropathy) or AMSAN] or (Fisher* Syndrome or Miller-Fisher).
Belangrijke selectiecriteria hierbij waren: vergelijkend onderzoek met hoge bewijskracht zoals meta-analyses, systematische reviews, randomized controlled trials (RCT’s) en controlled trials (CT). Waar deze niet voorhanden waren, werd verder gezocht naar vergelijkend cohort-onderzoek, vergelijkende patiëntcontrolestudies of niet-vergelijkend onderzoek. Voor de beantwoording van sommige uitgangsvragen werd ter meningsvorming ook gebruik gemaakt van case-reports.
