Prenatale verdenking skeletdysplasieën
Uitgangsvraag
Wanneer is gerichte DNA-diagnostiek geïndiceerd naar skeletdysplasieën?
Aanbeveling
Let bij de verdenking op een skeletdysplasie bij een prenatale echografie goed op de kenmerken van de tien meest aangetoonde skeletdysplasieën:
- osteogenesis imperfecta;
- thanatofore dysplasie;
- achondroplasie;
- achondrogenesis;
- short rib polydactylie;
- Ellis van Creveld-syndroom;
- Jeune-syndroom;
- campomele dysplasie;
- hypochondroplasie;
- diastrofe dysplasie.
Let daarbij op schedelvorm, thoraxvorm, cystenieren, lengte en vorm lange pijpbeenderen, fracturen en mineralisatie van het skelet, scapulae, stand van de duimen (zogenaamde hitch hikers thumb), polydactylie en klompvoeten en op kenmerken van lethale skeletdysplasie: thorax/AC verhouding (<0,7), de cor/thorax ratio (>50%) en de AC/FL ratio (<0,16).
Bied een consult aan bij de klinisch geneticus voor counseling, differentiatie tussen de verschillende skeletdysplasieën en indien geïndiceerd het verrichten van DNA-diagnostiek.
Overweeg bij aspecifieke maar sterk afwijkende prenatale skeletafwijkingen een genpakket of Whole exome sequencing (WES), zodra dit diagnostisch haalbaar is, en indien gewenst door ouders.
Overwegingen
De kans op het stellen van de diagnose skeletdysplasie bij een prenatale echoscopische verdenking op een skeletdysplasie is hoog (84%). De wisselende expertise in gebruik van de prenatale echografie voor het stellen van de diagnose kan een mogelijke verklaring zijn voor de gevonden verschillen tussen de studies. Wanneer de prenatale echografie in een derdelijns centrum wordt verricht door ervaren prenatale echoscopisten is het percentage waarschijnlijk hoger dan 84%. Dat betekent dat de prenatale echografie goed kan voorspellen of er sprake is van een skeletdysplasie, en de lijst van de tien meest gestelde diagnosen laat zien dat het dan meestal een lethale of ernstige skeletdysplasie betreft (wanneer de echografie rond de 20 weken zwangerschap verricht is). De achondroplasie en hypochondroplasie zijn hier de uitzondering op, en worden vaak pas vermoed in het derde trimester van de zwangerschap.
De kans op het stellen van de diagnose skeletdysplasie is veel kleiner (15%) wanneer er uitgegaan wordt van een verkort femur bij de prenatale echografie. Dan is er vaak sprake van small for gestational age (30%), zoals bijvoorbeeld veroorzaakt zou kunnen zijn door placentaire insufficiëntie. De niet-lethale skeletdysplasie achondroplasie is de meest frequent vastgestelde diagnose wanneer een kort femur als uitgangsvraag gehanteerd wordt.
Krakow (2009) publiceerde een American College of Medical Genetics-richtlijn Foetale Skeletdysplasie, met aandachtspunten voor prenatale echografie, om te komen tot een differentiaaldiagnose. Meerdere auteurs hebben hier aanbevelingen over gedaan (Hurst, 2005; Noel, 2014; Mortier, 2003). Dighe (2008) heeft een aantal flow charts gemaakt die gevolgd kunnen worden uitgaande van een typische echografisch kenmerk, zoals echogeniciteit van het bot, korte ledematen, fracturen maar ook bijvoorbeeld faciale kenmerken, en die leiden tot een differentiaaldiagnose (zie onderstaand voorbeeld).
Figuur 1
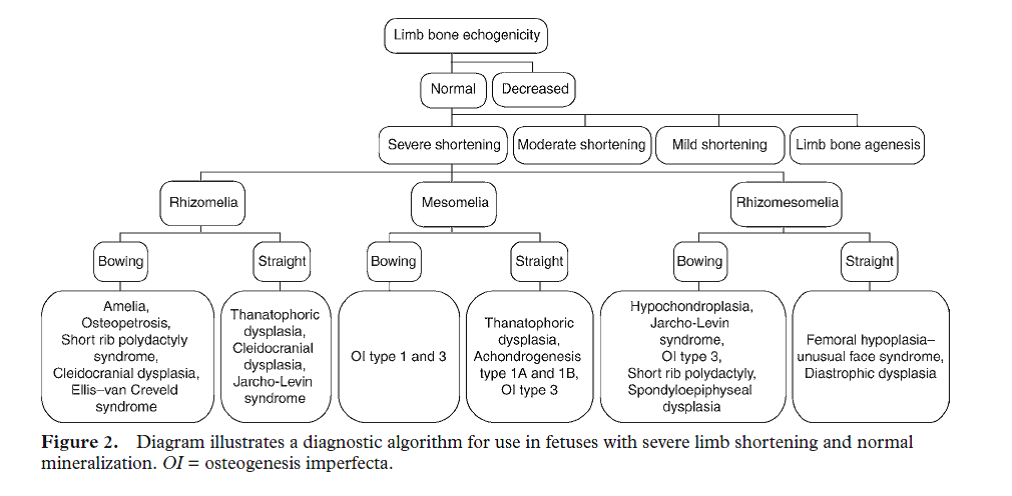
Voor de besluitvorming tot een eventuele zwangerschapsafbreking is het van groot belang om een zo hoog mogelijke zekerheid over een diagnose en een prognose te kunnen geven bij de prenatale verdenking op een skeletdysplasie. Om een uitspraak te doen over de kans op een lethale skeletdysplasie is een aantal ratio’s van belang: de thorax/AC-verhouding (<0,7), de cor/thorax ratio (>50%) en de AC/FL-ratio (<0,16). Deze ratio’s zijn sterk geassocieerd met lethaliteit. Ondanks dat uit de literatuurstudie blijkt dat de kans op een diagnose skeletdysplasie, bij een verdenking hierop bij de prenatale echografie, hoog is (84%), zou in veel gevallen een zekerheid verkregen kunnen worden door prenatale DNA-diagnostiek waarbij een mutatie aangetoond wordt. In het geval dat er zeer specifieke afwijkingen gezien worden die typisch zijn voor een bepaalde skeletdysplasie kan er naar deze ene aandoening DNA-diagnostiek verricht worden. Indien geen mutatie in het onderzochte gen wordt gevonden, is er vaak onvoldoende tijd om voor de 24ste week van de zwangerschap nog tot een definitieve diagnose te komen. Daarom zouden de genen die de meest voorkomende skeletdysplasieën veroorzaken goed in een genenpanel ondergebracht kunnen worden. De NGS-techniek die voor een genenpanel wordt gehanteerd maakt het tegelijkertijd onderzoeken van meerdere genen mogelijk en versnelt de uitslagtermijn. Bovendien is het uiteindelijk kostenbesparend en inmiddels is er veel ervaring opgedaan met andere genenpanels. Om zekerheid te kunnen bieden bij het stellen van de diagnose en het geven van de prognose, komen wij in deze richtlijn dan ook tot de aanbeveling om een genenpanel Prenatale DNA-diagnostiek naar skeletdysplasie aan te bieden.
In de USA worden door meerdere (commerciële) laboratoria genenpanels voor DNA-diagnostiek naar (prenatale) skeletdysplasieën aangeboden, waarbij een uitslagtermijn van 2 tot 4 weken wordt genoemd. Door Krakow (2015) wordt gewaarschuwd voor het missen van niet eerder aangetoonde en niet beschreven mutaties die ontbreken in een genenpakket. Bijvoorbeeld geldt voor osteogenesis imperfecta dat een mutatie ten onrechte niet gedetecteerd wordt wanneer alleen de bekende mutaties in een genenpanel zijn opgenomen. Het uitsluiten van een skeletdysplasie is niet altijd mogelijk. Wel is dit goed mogelijk voor bijvoorbeeld achondroplasie (>95% veroorzaakt door dezelfde mutatie in het FGFR3-gen: Gly380Arg). Om te voorkomen dat mutaties/genen niet gedetecteerd worden doordat zij ontbreken in het genenpanel, kan een prenatale WES (whole exome sequencing) aangeboden worden met eventueel het gebruik van een filter bestaande uit (een deel van) de 364 genen die opgenomen zijn in de Nosology and Classification van de ISDS (Bonafé, 2015). Echter, op dit moment zal de WES-uitslag waarschijnlijk niet gerealiseerd kunnen worden voor de 24ste zwangerschapsweek, (de verdenking op een skeletdysplasie ontstaat meestal bij de 20 weken echografie). Een ander nadeel van een WES-benadering is een kans op een toevalsbevinding die niet gerelateerd is aan de vraagstelling. Met het gebruik van een specifiek gen-panel is deze kans kleiner. Er zijn enkele artikelen verschenen over het gebruik van prenatale WES bij verschillende echoafwijkingen, waarbij ook enkele skeletdysplasieën werden gediagnosticeerd, zoals hypofosfatasia, achondrogenesis, osteogenesis imperfecta en Ellis van Creveld syndroom (Drury, 2015; Amillo, 2015; Pangalos, 2016).
Met de komst van de techniek van de Niet-invasieve prenatale test (NIPT) op celvrij foetaal DNA in het maternale bloed is het ook mogelijk geworden om gericht niet-invasieve prenatale (DNA) diagnostiek (NIPD) toe te passen. Voor het aantonen van FGFR3-gen mutaties passend bij thanatophore dysplasie, achondroplasie en hypochondroplasie lijkt de NIPD ook in Nederland binnen handbereik te liggen. De werkgroep doet dan ook een aanbeveling voor NIPD, zodra mogelijk in Nederland, voor de skeletdysplasieën van de FGFR3-gen groep. In de UK wordt NIPD naar FGFR3-mutaties reeds aangeboden (thanatofore dysplasie, achondroplasie, SADDAN, craniosynostosis, Muenke syndroom en hypochondroplasie). Het nadeel van NIPD is dat er geen foetaal weefsel wordt veiliggesteld voor diagnostiek in de toekomst.
Het advies is om de zwangere te verwijzen naar een klinisch geneticus, waarbij tijdens de counseling aandacht is voor de differentiaaldiagnose, de mogelijkheid van aanvullende DNA-diagnostiek en de mogelijke (neven)bevindingen daarvan.
Onderbouwing
Achtergrond
Er is een verdenking op een prenatale skeletdysplasie wanneer bij de biometrie van het foetale skelet metingen gedaan worden die onder de normaalwaarden vallen; uitgedrukt in percentielen (< p5 of p<2.3), standaarddeviaties of Z-scores. Metingen van alle lange pijpbeenderen, thorax omvang (TC), hoofdomvang (HC) en voetzoollengte zijn hierbij van belang (Schramm, 2009; Snijders, 1994; WHO, 1995; Laudy, 2000). Een skeletdysplasie wordt gekenmerkt door het voorkomen van generaliseerde structurele afwijkingen in de groei van het bot en kraakbeen (Hurst, 2005). In het verleden werd een skeletaandoening beschreven als een osteodysplasie (botafwijking), een chondrodysplasie (kraakbeenafwijking) of dysostose (afwijking van een specifieke groep van botten). De overlap tussen de groepen heeft geleid tot de voorkeur voor de overkoepelende term skeletdysplasie. De Internationale Werkgroep Skeletdysplasie onderhoudt een classificatie van de verschillende skeletdysplasieën: Nosology and Classification of Genetic Skeletal Disorders (Bonafé, 2015). In deze nieuwste versie worden 436 skeletaandoeningen ingedeeld in 42 groepen, waaraan 364 genen ten grondslag liggen.
Een specifieke skeletdysplasie is een zeldzame aandoening. Echter, de totale prevalentie van alle skeletdysplasieën is ongeveer 2,4 tot 4 op 10.000 pasgeborenen (Orioli, 1986). De kans op chromosoomafwijkingen (inclusief microdeleties en -duplicaties) bij een echoscopische verdenking op een skeletdysplasie is laag. Skeletafwijkingen kunnen voorkomen bij een trisomie 13 of trisomie 18. Onderzoek naar chromosoomafwijkingen bij de foetus wordt standaard aangeboden in Nederland met prenatale rapid aneuploidy detection analyse (QF-PCR) en array-onderzoek op vlokkenmateriaal of vruchtwater (prenatale invasieve diagnostiek). In het geval van een sterke verdenking op een specifieke (lethale) skeletdysplasie wordt onderzoek naar chromosoomafwijkingen echter niet altijd verricht vanwege de lage kans hierop.
Bij een prenatale verdenking op een skeletdysplasie is het van belang voor de prognose, het beleid en besluitvorming van de ouders, om te proberen echografisch vast te stellen of er sprake is van een lethale vorm van skeletaandoening of een niet-lethale vorm (Krakow, 2009; Noel, 2014; Offiah, 2003). Daarbij kunnen sommige skeletdysplasieën gepaard gaan met andere orgaanafwijkingen zoals bijvoorbeeld een congenitale hartafwijking (Mortier, 2001). Een eerste prenatale uiting van een skeletdysplasie is vaak een verkort femur (of een verkorting van alle lange pijpbeenderen). In Nederland wordt een kort femur gedefinieerd als kleiner dan de p2,3 (Richtlijn NVOG). Het onderscheid tussen een skeletdysplasie en een IUGR (intra-uteriene groeivertraging) op basis van andere factoren (bijvoorbeeld placentaire insufficiëntie) of een syndromale aandoening kan prenataal lastig zijn. Krakow meldde dat bij een prenatale echografie de juiste diagnose van skeletdysplasie gesteld kan worden in ongeveer 78% (Krakow, 2008). Schramm vond in 68% prenataal de juiste diagnose, en vond een vals-positieven percentage van 0,7%. (Schramm, 2009). Het gebruik van een 3D echografie, CT-scan of MRI-scan kan soms een bijdrage leveren aan het stellen van de diagnose skeletdysplasie.
Om prenataal meer duidelijkheid te verkrijgen over de diagnose van een specifieke skeletdysplasie kan het zinvol zijn om DNA-diagnostiek aan te bieden. Dit gebeurt wisselend in de verschillende Nederlandse centra. Internationaal worden sporadisch genenpanels voor enkele skeletdysplasieën prenataal aangeboden, waarbij gewaarschuwd wordt voor het niet detecteren van onbekende mutaties, die niet in de panels opgenomen zijn (Krakow, 2015).
Het doel van deze richtlijn is om een evidence-based advies op te stellen over wanneer en waarnaar DNA-diagnostiek geïndiceerd is om de waarschijnlijkheid van een, al dan niet lethale, skeletdysplasie te ondersteunen of uit te sluiten.
Conclusies / Summary of Findings
|
Matig |
Bij een prenatale echoscopische verdenking op een skeletdysplasie wordt in 84% van de casus perinataal een skeletdysplasie gediagnosticeerd. Verder wordt bij 10,3% van de casus perinataal een syndroom anders dan een skeletdysplasie vastgesteld en bij 4,7% is er sprake van een vals-positieve bevinding. |
|
Matig |
Bij een prenatale echoscopische verdenking op een skeletdysplasie werden de volgende tien skeletdysplasieën het meest gediagnosticeerd.
*deze aandoeningen kunnen pas in het derde trimester vermoed worden |
|
Laag |
Bij een prenataal echoscopisch gedetecteerd verkort femur wordt in 15,3% van de casus perinataal een skeletdysplasie gediagnosticeerd. Bij 6% van de casus wordt perinataal een syndroom anders dan een skeletdysplasie vastgesteld, bij 30,1% wordt de diagnose Small for gestational age gesteld en bij 4,7% is er sprake van een vals-positieve bevinding. |
Samenvatting literatuur
Beschrijving studies
In totaal werden tien studies geïncludeerd. Zeven studies gaven een antwoord op de vraag: Wat is de kans op (perinataal gediagnosticeerde) skeletdysplasieën of een syndroom bij prenatale echoscopische verdenking op skeletdysplasieën? (vraagstelling 1) (Ahmed, 2010; Doray, 2000; Khalil, 2011; Krakow, 2008; Parilla, 2003; Schramm, 2009; Yeh, 2011). De studie van Krakow (2008), is een retrospectief en een prospectief onderzoek, waarbij alleen het retrospectieve onderzoek een antwoord geeft op de eerste vraagstelling. Het prospectieve onderzoek is daardoor niet meegenomen in deze literatuur samenvatting.
Drie studies gaven antwoord op de vraag: Wat is de kans op (perinataal gediagnosticeerde) skeletdysplasieën of een syndroom bij prenatale echoscopische detectie van verkort femur? (vraagstelling 2) (Arahori, 2007; Todros, 2004; Vermeer, 2013).
Resultaten vraagstelling 1
In totaal werden er door de zeven studies die een antwoord geven op de eerste vraagstelling 1829 casus geïncludeerd met prenataal echoscopisch verdenking op een skeletdysplasie (Ahmed, 2010; Doray, 2000; Khalil, 2011; Krakow, 2008; Parilla, 2003; Schramm, 2009; Yeh, 2011).
Bij 1536 (84,0%) van deze casus werd perinataal een skeletdysplasie gediagnosticeerd. Bij 190 (10,4%) van de casus werd een syndroom gediagnosticeerd, dat geen skeletdysplasie was en bij 87 (4,8%) van de casus was er sprake van een vals-positieve prenatale echo bevinding. De resultaten van de studies zijn uitgesplitst in tabel 1.
Tabel 1 Kans op perinatale diagnose bij verdenking van skeletdysplasieën per studie
|
Studie |
Skelet dysplasie (%) |
Syndroom (%) |
Vals-positief (%) |
|
Ahmed, 2010 |
80,0 |
3,3 |
10,0 |
|
Doray, 2000 |
89,4 |
6,4 |
4,3 |
|
Khalil, 2011 |
100,0 |
0,0 |
0,0 |
|
Krakow, 2008 |
83,0 |
12,0 |
5,0 |
|
Parilla, 2003 |
88,0 |
12,0 |
8,0 |
|
Schramm, 2009 |
93,0 |
1,7 |
2,9 |
|
Yeh, 2011 |
70,0 |
0,0 |
0,0 |
In tabel 2 wordt weergegeven welke specifieke skeletdysplasieën en syndromen er perinataal werden gediagnosticeerd en de prevalentie bij een prenataal vermoeden op een skeletdysplasie door middel van echoscopisch onderzoek. In deze tabel is de studie van Krakow (2008) alleen meegenomen bij de berekening van de prevalentie van een skeletdysplasie, een syndroom of een vals-positieve bevinding. De studie is niet meegenomen bij het specificeren van de diagnoses, omdat Krakow (2008) alleen de vier skeletdysplasieën heeft benoemd die het meest werden gezien: thanatofore dysplasie (11%), osteogenesis imperfecta type 2 (20%), achondrogenesis type 2 (8,2%), campomele dysplasie (3,6%). De overige diagnoses zijn niet gerapporteerd. De specificaties genoemd in de tabel zijn dus gebaseerd op de zes overige, voor vraagstelling 1, geïncludeerde studies, met in totaal 291 geïncludeerde casus waarbij een diagnose skeletdysplasie is vastgesteld en 10 casus waarbij een ander syndroom is vastgesteld.
Tabel 2 Specificatie diagnoses bij verdenking van skeletdysplasieën
|
Diagnose |
Voorkomen |
Specificaties* |
||||||||||||||||||||||||||
|
Skeletdysplasie |
84,0% (1536/1829) |
|
||||||||||||||||||||||||||
|
Syndroom |
10,4% (190/1829) |
|
||||||||||||||||||||||||||
|
Vals-positieve bevinding |
4,8% (87/1829) |
|
* Bij het specificeren van de diagnoses is de studie van Krakow (2008), buiten beschouwing gelaten. De specificaties zijn gebaseerd op de zes overige, voor vraagstelling 1, geïncludeerde studies, met in totaal 291 geïncludeerde casus waarbij een diagnose skeletdysplasie is vastgesteld en tien casus waarbij een ander syndroom is vastgesteld.
* voor indeling in de groep diagnose skeletdysplasie werd het voorkomen in de Nosology and Classification of skeletal disorders-lijst gehanteerd (Bonafé, 2015).
Resultaten vraagstelling 2
In totaal werden er door de drie studies die een antwoord geven op de tweede vraagstelling 203 casus geïncludeerd met een prenataal echoscopisch gedetecteerd verkort femur (Arahori, 2007; Todros, 2004; Vermeer, 2013). Bij 31 (15,3%) van deze casus werd perinataal een skeletdysplasie gediagnosticeerd. Bij zes (3%) van de casus werd een syndroom gediagnosticeerd dat geen skeletdysplasie was en bij 62 (30,1%) casus was er sprake van de diagnose small for gestational age (SGA). Verder was er bij 46 (22,7%) van de casus sprake van een vals-positieve verdenking op verkort femur. Tabel 3 geeft per studie de kans op een perinatale gediagnosticeerde skelet dysplasie, een syndroom, SGA, en een vals-positieve bevinding weer bij een prenatale echoscopische detectie van verkort femur.
Tabel 3 Kans op perinatale diagnose bij verkort femur per studie
|
Studie |
Skeletdysplasie (%) |
Syndroom (%) |
Small for gestational age (%) |
Vals-positief (%) |
|
Arahori, 2010 |
59,3 |
11,1 |
25,9 |
3,7 |
|
Todros, 2004 |
12,9 |
2,9 |
25,7 |
40,0 |
|
Vermeer, 2013 |
5,7 |
0,9 |
34,9 |
16,0 |
In de onderstaande tabel (tabel 4) wordt weergegeven welke specifieke skeletdysplasieën en syndromen er perinataal werden gediagnosticeerd en hoe vaak deze voorkomen bij een prenatale echoscopische detectie van verkort femur.
Tabel 4. Specificatie diagnoses bij prenataal echoscopisch gedetecteerd verkort femur
|
Diagnose |
Voorkomen |
Specificaties |
||||||
|
Skeletdysplasie |
15,3% (31/203) |
|
||||||
|
Syndroom |
3% (6/203) |
|
||||||
|
Small for gestational age |
30,1% (62/203) |
|
||||||
|
Vals-positieve bevinding |
22,7% (46/203) |
|
Bewijskracht van de literatuur
De bewijskracht van de conclusies die uit de literatuuranalyse volgen, wordt verminderd doordat de studies wisselende resultaten laten zien. Zoals in tabel 1 in deze module en in tabel 3 in de module ‘Patiëntenperspectief echoafwijkingen’ weergegeven is, varieert de kans op een perinataal gediagnosticeerde skeletdysplasie of een syndroom tussen de studies aanzienlijk. Dit is zowel het geval bij de studies die een antwoord geven op de eerste vraagstelling (70% tot 100% kans op skeletdysplasie en 0% tot 12% kans op een syndroom), als bij de studies die een antwoord geven op de tweede vraagstelling (5,7 tot 59,3% kans op een skeletdysplasie en 0,9% tot 11,1% kans op een gediagnosticeerd syndroom). Ook de kans op een vals-positieve bevinding is verschillend. Dit verschil wordt mede veroorzaakt door heterogeniteit in inclusiecriteria en opzet tussen de studies. Dit is met name bij de studies, die een antwoord geven op de tweede vraagstelling. Bij deze studies is er namelijk een verschil in definitie van het inclusiecriterium verkort femur, waarbij Todros (2004) een femurlengte onder de tiende percentiel gemeten tussen de 15 en 24 weken zwangerschap aanhield en Vermeer (2013) een femurlengte onder de vijfde percentiel aanhield als criterium. In de studie van Arahori (2007) werd een verkort femur niet nader gespecificeerd. Tot slot kan het zijn dat nieuwere studies beter in staat zijn diagnoses te stellen door verbeterde diagnostiek. Door de inconsistentie van de bevindingen wordt de bewijskracht voor de conclusies van beide vraagstellingen verlaagd van hoog naar matig.
Verder werden er door de drie studies passend bij de tweede vraagstelling 203 casus geïncludeerd met een prenataal echoscopisch gedetecteerde verkort femur, waarvan bij 37 casus een skeletdysplasie of syndroom werd gediagnosticeerd. Door dit gering aantal casus is er kans op imprecisie van de gemeten kans, waardoor de bewijskracht voor vraagstelling twee laag is.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstellingen:
- Wat is de kans op (perinataal gediagnosticeerde) skeletdysplasieën of een syndroom bij prenatale echoscopische verdenking op skeletdysplasieën?
- Wat is de kans op (perinataal gediagnosticeerde) skeletdysplasieën of een syndroom bij prenatale echoscopische detectie van verkort femur?
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase en de Cochrane Library is met relevante zoektermen gezocht naar diverse soorten studies die een antwoord geven op bovenstaand geformuleerde vraagstellingen. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 555 treffers op.
Studies werden geselecteerd op grond van onderstaande selectiecriteria.
Inclusie:
- relevant voor beantwoording van de uitgangsvraag;
- primair (origineel) onderzoek of een systematische review;
- studiepopulatie betreft ongeboren kinderen met een prenataal echoscopisch gedetecteerde skeletdysplasie of verkort femur;
- uitkomstmaten: een perinataal vastgestelde skeletdysplasie, een syndroom of een vals-positieve bevinding, waarbij de diagnose kan worden vastgesteld zowel door verschillende technieken, waaronder obductie, radiologisch onderzoek en/of DNA-onderzoek.
Exclusie:
- studies van voor 2000;
- studies over gevoeligheidsgenen (associaties);
- studies met skeletdysplasieën in een populatie waarbij geen skeletdysplasie (of verkort femur) prenataal echoscopisch gedetecteerd was;
- case reports.
Op basis van titel en abstract werden in eerste instantie zeventien studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens zeven studies geëxcludeerd en tien studies definitief geselecteerd (zie exclusietabel onder Verantwoording).
Zeven van de tien studies geven een antwoord op vraagstelling 1 en drie studies geven antwoord op vraagstelling 2. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabel.
Referenties
- Ahmed B, Fakhry A-B, Luetic AT, et al. Pattern and prenatal diagnosis of skeletal dysplasias in Qatar population. The journal of maternal-fetal & neonatal medicine, 2010;23(12):1500-1503.
- Alamillo CL, Powis Z, Farwell K, et al. Exome sequencing positively identified relevant alterations in more than half of cases with an indication of prenatal ultrasound anomalies. Prenatal diagnosis. 2015;35:1073-1078.
- Arahori H, Tamura A, Wasada K, et al. Sonographic femur length to trunk cross area ratio: Prediction of fetal outcome in 30 case in which micromelia was suspected. J. Obstet. Gynaecol. Res. 2007;33(3):248-253.
- Bonafe L, Cormier-Daire V, Hall C, et al. Nosology and Classification of Genetic Skeletal Disorders: 2015 Revision. Am J Med Genet Part A. 2015;167A:28692892.
- Dighe M, Fligner C, Cheng E, et al. Fetal Skeletal Dysplasia: An Approach to Diagnosis with Illustrative Cases. RadioGraphics. 2008;28:10611077.
- Doray B, Favre R, Viville B, et al. Prenatal sonographic diagnosis of skeletal dysplasias. A report of 47 cases. Annales de Génétique. 2000;43:163-169.
- Drury S, Williams H, Trump N, et al. Exome sequencing for prenatal diagnosis of fetuses with sonographic abnormalities. Prenatal diagnosis. 2005;35:1-8.
- Hurst JA, Firth HV, Smithson, S. Skeletal dysplasias. Seminars in Fetal & Neonatal Medicine. 2005;10:233-241 Oxford Desk Reference - Clinical Genetics. Skeletal dysplasia charts (Chart 1).
- Khalil A, Pajkrt E, Chitty LS. Early prenatal diagnosis of skeletal anomalies. Prenatal diagnosis. 2011;31:115-124.
- Krakow D, Rimion DL. The skeletal dysplasias. Genet Med. 2010;12(6):327341.
- Krakow D, Lachmann RS, Rimion DL. Guidelines for the prenatal diagnosis of fetal skeletal dysplasia Genet Med. 2009;11(2):127-133.
- Laudy JAM, Wladimiroff JW. The fetal lung (2): pulmonary hypoplasia. Ultrasound Obstet Gynecol. 2000;16:482494.
- Mortier GR. The diagnosis of skeletal dysplasias: a multidisciplinary approach, European Journal of Radiology. 2001;40:161167.
- Noel A-E, Brown RN. Advances in evaluating the fetal skeleton. International journal of womens health. 2014;6:489-500.
- Offiah AC, Hall CM. Radiological diagnosis of the constitutional disorders of bone. As easy as A, B, C? Pediatr Radiol. 2003;33:153161.
- Orioli IM, Castilla EE, Barbosa-Neto JG. The birth prevalence rates for the skeletal dysplasias. J Med Genet. 1986;23:328 332.
- Pangalos C, Hagnefelt B, Lilakos K, et al. First applications of a targeted exome sequencing approach in fetuses with ultrasound abnormalities reveals an important fraction of cases with associated gene defects. PeerJ. 2016;4:e1955. DOI 10.7717/peerj.1955.
- Parilla BV, Leeth MS, Kambich MP, et al. Antenatal detection of skeletal dysplasias. Journal of Ultrasound in Medicine. 2003;22:255-258.
- Schramm T, Gloning KP, Minderer S, et al. Prenatal sonographic diagnosis of skeletal dysplasias. Ultrasound Obstet Gynecol. 2009;34:160-170.
- Snijders RJM, Nicolaides KH. Fetal biometry at 1440 weeksgestation. Ultrasound Obstet Gynecol. 1994;4:3448.
- Todros T, Massarenti I, Gaglioti P, et al. Fetal short femur length in the second trimester and the outcome of pregnancy. BJOG: an international journal of obstetrics and gynaecology. 2004;111:83-85.
- Van den Veyver I.B. Recent advances in prenatal genetic screening and testing. F1000Research. 2016;5(F1000 Faculty Rev):2591 (doi: 10.12688/f1000research.9215.1.
- Vermeer N, Bekker M. Association of isolated short fetal femur with intrauterine growth restriction. Prenatal Diagnosis. 2013;33:365-370.
- World Health Organization (WHO). Physical Status: The Use and Interpretation of Anthropometry (WHO Technical Report Series No. 854). WHO: Geneva, Switzerland. 1995.
- Yeh P, Saeed F, Paramasivam G, et al. Accuracy of prenatal diagnosis and prediction of lethality for fetal skeletal dysplasias. Prenatal diagnosis. 2011;31:515-518.
Evidence tabellen
Research question:
- What is the probability of a perinatally diagnosed skeletal dysplasia or syndrome in children prenatally suspected to have a skeletal dysplasia by ultrasound
- What is the probability of a perinatally diagnosed skeletal dysplasia or syndrome in children with a short femur prenatally detected by ultrasound
|
Study reference |
Study characteristics |
Patient characteristics |
Follow-up |
Outcome measures and effect size |
Comments ? |
|
Ahmed, 2010 |
Type of study: retrospective descriptive study
Setting: Fetomaternal Unit of the Department of Obstetrics and Gynecology from 2004 to 2008
Country: Qatar
Source of funding: not stated, no conflicts of interest |
Inclusion criteria: Pregnant women with high risk for skeletal dysplasia; suspected anomalies in routine ultrasound, medical or family history of skeletal anomalies, advanced maternal age, IUGR, diabetes and multiple gestations
Cases (n): 30 Chromosomal abnormalities unclear
|
Endpoint of follow-up:
Incomplete outcome data (n (%)): none
|
Perinatally diagnosed syndromes 25 cases Skeletal dysplasia 24 cases 11 Achondroplasia 8 Thanatophoric dysplasia 2 Osteogenesis imperfecta 1 type III 1 Achondrogenesis 2 Dwarfism ns
Other syndrome 1 1 Caudal regression
Other 2 Other not specified. 3 false-positive findings of isolated mild long bone shortening. |
The prenatal sonographic findings were compared with the postnatal or postmortem diagnosis. Final diagnosis was based on clinical examination, skeletal survey, autopsy and/or molecular testing.
No cases diagnosed postpartum |
|
Arahori, 2007 |
Type of study: Retrospective
Setting: Osaka University Hospital Between 1 April 1996 and 31 March 2005
Country: Japan
Source of funding: not stated |
Inclusion criteria: fetuses that were identified with a presumptive prenatal diagnosis of micromelia by obstetricians based on ultrasonic skeletal biometry
Cases (n): 30 27 without chromosomal anomalies
|
Endpoint of follow-up:
Incomplete outcome data (n (%)): none |
Perinatally diagnosed syndromes 19 cases Skeletal dysplasia 16 cases 6 Osteogenesis imperfecta 3 Achondroplasia 2 Hypophosphatasia 1 Thanatophoric dysplasia 1 Short rib syndrome 1 Ellis-van Creveld syndrome 1 Hypochondroplasia 1 Chondroplasia punctata
Other syndromes 3 1 Freeman-Sheldon syndrome 1 Marden-Walker syndrome 1 PDHC deficiency
Other 7 Small -for gestational age infants, without abnormalities 1 false-positive, healthy infant |
Short femur
ultrasonic skeletal biometry, clinical features including the timing of diagnosis, mode of delivery, gestational age, birth weight, neonatal height, head circumference, final diagnoses, and outcomes. |
|
Doray, 2000 |
Type of study: retrospective
Setting: four referral sonographic centres of Strasbourg
Country: France
Source of funding: not stated |
Inclusion criteria: suspected skeletal dysplasias at referral; family history of skeletal dysplasia, spontaneous miscarriage and anomaly on routine ultrasound
Exclusion criteria: isolated single limb deficiencies and limb reduction deficiencies
Cases (n): 47 without chromosomal abnormalities
|
Endpoint of follow-up:
Incomplete outcome data (n (%)): none |
Perinatally diagnosed syndromes 45 cases Skeletal dysplasia; 42 cases 13 Osteogenesis imperfecta 7 Achondroplasia 5 Achondrogenesis 4 Thanatophoric dysplasia 3 Ellis-van Creveld syndrome 2 Jeune syndrome 1 Campomelic dysplasia 1 Short rib polydactyly 1 Spondyloepiphyseal dysplasia 1 Lethal diaphyseal dysplasia 1 Diastrophic dysplasia 3 Skeletal dysplasia unclassified
Other syndromes 3 cases 3 Dysmorphic syndrome ns.
Other 2 cases 2 false positives, normal fetus |
Systematic ultrasound scanning, foetal karyotype, when foetal or neonatal death, a full post-mortem examination and X-ray examination was performed. In liveborn infants, assessment by paediatric and clinical genetics teams followed delivery. Skeletal radiographic examination was performed in each case.
The final postnatal diagnosis was made by consensus of the clinical geneticist, the paediatric radiologist and the paediatric pathologist using the clinical genetic evaluations, radiographs, and autopsy information. |
|
Khalil, 2011 |
Type of study: retrospective
Setting: Fetal Medicine Unit between 1995 - 2010
Country: England
Source of funding: not stated |
Inclusion criteria: cases with a skeletal dysplasia identified by 14 weeks gestation, with diagnosis confirmed postnatally
Cases (n): 15
Chromosomal abnormalities unclear
|
Endpoint of follow-up:
Incomplete outcome data (n (%)):
|
Perinatally diagnosed syndromes 15 cases Skeletal dysplasia; 2 Osteogenesis imperfecta 2 Achondrogenesis 2 Thanatophoric dysplasia 1 Ellis-van Creveld syndrome 1 Jeune syndrome 1 Greenberg skeletal dysplasia 1 Spondyloepiphyseal dysplasia congenita 1 Boomerang dysplasia 1 Roberts syndrome 3 Short rib polydactyly II (Majewski) |
The FMU databases, neonatal records and pathology records were reviewed to determine the prenatal features, the gestational age at which a skeletal dysplasia was suspected, and the final diagnosis confirmed postnatally. |
|
Krakow, 2008 |
Type of study: retrospective and prospective analysis
Setting: International Skeletal Dysplasia Registry, a referral registry Retrospective: between 1990-2004 Prospective between 1996-2006
Country: USA
Source of funding: NIHCD; Joseph Drown Foundation; General Clinical Research Center; Grant sponsor: Winnick Family Scholar awardees. |
Retrospective Inclusion criteria: propositus ascertained between 14 weeks gestation and one month neonatal age; at least one prenatal sonogram was performed during gestation and a referring diagnosis was based on sonographic findings; and postnatal radiographs and available histology were used for final diagnosis.
Cases (n): 1500
Prospective Inclusion criteria: prenatal-onset skeletal dysplasia by referred ultrasound images (14-38 weeks gestation)
Cases (n): 500 405 with complete data |
Endpoint of follow-up:
Incomplete outcome data (n (%)):
|
Retrospective Perinatally diagnosed syndromes Skeletal dysplasia; 83% 11% Thanatophoric dysplasia 20% Osteogenesis imperfecta 2 8,2% Achondrogenesis type 2 3,6% Campomelic dysplasia 35,7% Other specific skeletal dysplasia 4,5% skeletal dysplasia unclassified
Other syndromes 12% 12% genetic syndromes
Other 5% False-positive, normal
Prospective Perinatally diagnosed syndromes; not specified Skeletal dysplasia; 65 osteogenesis imperfecta type 2 50, thanatophoric dysplasia 24 achondrogenesis type 2
|
Prospective study: only 34% of diagnoses specified and no percentage of total diagnoses made (skeletal dysplasia) is provided. Prospective part therefore not included in analysis of the literature. |
|
Parilla, 2003 |
Type of study: retrospective
Setting: Maternal-Fetal Medicine Unit of hospital from June 1993- December 2001
Country: USA
Source of funding: not stated |
Inclusion criteria: Cases in ultrasound and genetics database with skeletal dysplasia, antenatally diagnosed
Cases (n): 37, 31 cases complete follow-up available and included in study
|
Endpoint of follow-up:
Incomplete outcome data (n (%)): 6 |
Perinatally diagnosed syndromes 25 cases Skeletal dysplasia 22 cases; 8 Thanatophoric dysplasia 6 Osteogenesis imperfecta 2 Roberts syndrome 3 Achondroplasia 1 Ellis-van Creveld syndrome 1 metaphyseal dysplasia 1 spondyloepiphyseal dysplasia
Other syndromes 3 case 1 Glycogen storage disorder 1 caudal regression 1 distal arthrogryposis
Other 2 false-positives of isolated mild long bone shortening, healthy infants |
Case reviewed for the degree of bone shortening and other distinguishing characteristics. Prenatal sonographic findings and diagnosis were compared with the postnatal or postmortem diagnosis. Final diagnosis was based on clinical examination, skeletal survey, autopsy and/or molecular testing |
|
Schramm, 2009 |
Type of study: retrospective
Setting: tertiary center between 1985 and 20007
Country: Germany
Source of funding: |
Inclusion criteria: foetuses with a prenatal ultrasound diagnosis of skeletal dysplasias in a mixed screening and referral population in large tertiary centre
Cases (n); 178, of which 176 with prenatal diagnosis (2 false negatives, not included), 4 lost-to follow up, 172 cases
|
Endpoint of follow-up:
Incomplete outcome data (n (%)): 4 |
Perinatally diagnosed syndromes 163 cases Skeletal dysplasia 160 cases; 40 Thanatophoric dysplasia 35 Osteogenesis imperfecta 10 Short rib dysplasias 8 Ellis-van Creveld syndrome 8 Achondroplasia 8 Achondrogenesis 8 Campomelic dysplasia 7 Jeune syndrome 6 Hypochondrogenesis 5 Diastrophic dysplasia 2 chondrodysplasia punctata 2 spondyloepimetaphyseal dysplasia 2 lethal hypophosphatasia 1 dyssegmental dysplasia Rolland Desbuquios 1 Kniest dysplasia 1 kyphomelic dysplasia 1 opsismodysplasia 1 osteocraniostenosis 1 otopalatodigital syndrome type 2 1 platyspondylic chondrodysplasia Shiraz type 1 spondyloepiphyseal dysplasia 1 sponastrimic dysplasia 1 metaphyseal dysplasia McKusick type 9 skeletal dysplasia unclassified.
Other syndromes 3 cases 2 dysostoses 1 dysmorphic syndrome ns
Other 9 cases 3 IUGR 1 IUGR with joint position anomalies and porencephaly 5 false-positives with no significant morbidity |
Details of prenatal management and postnatal pediatric or pathological studies from all cases were reviewed. Wherever possible, molecular diagnosis was sought.
2 cases with diagnosis skeletal dysplasia, did not have a prenatal diagnosis and are not included here. 1 with chondroectodermal dysplasia Ellis-van Creveld (prenatally diagnosed at 39 completed weeks as ‘suspected genetic syndrome, short long bones’) and one with achondroplasia (diagnosed at 31 weeks as ‘structurally normal fetus, suspect familial large head, intrauterine growth restriction (IUGR) affecting mainly extremities’). |
|
Todros, 2004 |
Type of study: retrospective
Setting: Maternal-Fetal Medicine Unit between 1998 - 2002
Country: Italy
Source of funding: not stated |
Inclusion criteria: foetuses with a FL below the 10th centile, measured between 15 and 24 weeks of gestational age.
Cases (n): 86,70 without chromosomal abnormalities
|
Endpoint of follow-up:
Incomplete outcome data (n (%)):
|
Perinatally diagnosed syndromes 11 cases Skeletal dysplasia 9 cases; 4 Thanatophoric dysplasia 4 achondroplasia 1 osteogenesis imperfecta
Other syndromes 2 cases 2 Dandy Walker syndrome
Other 59 cases 18 small for gestational age 4 isolated clubfoot 3 kidney dysplasia 1 obstructive uropathy 5 cystic hygroma 28 normal |
Short femur evaluation of fetal biometry and anatomy, including echocardiography, as well as uterine and umbilical Doppler ultrasound starting at 22–24 weeks. A karyotype analysis was offered whenever a malformation was detected and the possibility of invasive procedures was discussed in cases with an isolated short FL. We obtained a karyotype in all cases of termination of pregnancy. Details of the perinatal outcome were available in all cases. |
|
Vermeer, 2013 |
Type of study: retrospective cohort
Setting: tertiary referral center from January 2001 – August 2011
Country: the Netherlands
Source of funding: none |
Inclusion criteria: foetuses with short femur length diagnosed at antenatal ultrasound
Exclusion criteria: twin pregnancies
Cases (n):118, 6 lost to follow-up =112 cases, 106 without chromosomal abnormalities
|
Endpoint of follow-up:
Incomplete outcome data (n (%)): 6 |
Perinatally diagnosed syndromes 7 cases Skeletal dysplasia 6 cases; 4 achondroplasias 1 hypochondroplasia 1 skeletal dysplasia unclassified
Other syndrome 1 case 1 Robinow syndrome
Other 12 structural anomalies 37 IUGR 33 unexplained 17 false positive, healthy |
Short femur In case the advanced ultrasound revealed fetal anomalies karyotyping was offered. Abnormal results of karyotyping, ultrasound anomalies or structural abnormalities revealed at postnatal examination were defined as non-isolated |
|
Yeh, 2011 |
Type of study: retrospective
Setting: Fetal Care Unit of hospital between October 2002- August 2010
Country: UK
Source of funding: not stated |
Inclusion criteria: cases with fetal skeletal dysplasia
Cases (n): 40
|
Endpoint of follow-up:
Incomplete outcome data (n (%)):
|
Perinatally diagnosed syndromes 28 cases Skeletal dysplasia 28 cases; 8 osteogenesis imperfecta 4 thanatophoric dysplasia 6 achondroplasia 2 achondrogenesis 3 Jeune syndrome 2 short rib polydactyly syndrome 1 tibial aplasia ectrodactyly 1 femur-fibula-ulna complex 1 Antley-Bixler syndrome
Other 4 declined autopsy , no diagnosis 8 no final diagnosis was possible despite analyses |
All patients were scanned and detailed evaluation of the fetal skeleton as well as the presence of additional abnormalities was recorded. Fetal echocardiography was performed in all the cases. Karyotyping was offered in all the cases. Specific molecular genetic testing was performed if a likely diagnosis was suspected. Post-mortem investigation and X-rays. |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 13-09-2017
Beoordeeld op geldigheid : 14-11-2017
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2022 bepaalt het bestuur van de Vereniging Klinische Genetica Nederland (VKGN) of de modules van deze richtlijn nog actueel zijn. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De VKGN is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft tijdens het ontwikkelproces op geen enkele wijze invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Deze multidisciplinaire richtlijn Genetische diagnostiek bij echoafwijkingen beoogt de standaardisatie van DNA-diagnostiek tijdens de zwangerschap. Voor echoscopische afwijkingen die als knelpunten ervaren worden, beoogt deze richtlijn een leidraad te zijn voor aanvullende gerichte DNA-diagnostiek.
Doelgroep
Zwangere vrouwen, waarbij met echoscopisch onderzoek is geconstateerd dat er sprake is van echoscopische afwijkingen bij de foetus. CNV-detectie diagnostiek bij de foetus laat geen afwijkingen zien, die het echobeeld verklaren. DNA-diagnostiek is geïndiceerd en mogelijk.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende drie jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Drs. K. Bouman, klinisch geneticus, werkzaam in het Universitair Medisch Centrum Groningen, Groningen, Vereniging Klinische Genetica Nederland (voorzitter)
- Dr. K.D. Lichtenbelt, klinisch geneticus, werkzaam in het Universitair Medisch Centrum Utrecht, Utrecht, Vereniging Klinische Genetica Nederland
- Dr. M.W. Elting, klinisch geneticus, werkzaam in het VUmc, Amsterdam, Vereniging Klinische Genetica Nederland
- Dr. N.S. den Hollander, klinisch geneticus, werkzaam in het Leids Universitair Medisch Centrum, Leiden, Vereniging Klinische Genetica Nederland
- Dr. P. Lakeman, klinisch geneticus, werkzaam in het Academisch Medisch Centrum, Amsterdam, Vereniging Klinische Genetica Nederland (tot 11 februari 2016)
- Drs. K.E. Stuurman, klinisch geneticus, werkzaam in het Erasmus Medisch Centrum, Amsterdam, Vereniging Klinische Genetica Nederland (vanaf 11 februari 2016)
- Dr. A.C. Knegt, laboratoriumspecialist klinische genetica, werkzaam in het Academisch Medisch Centrum, Amsterdam, Vereniging Klinisch Genetische Laboratoriumdiagnostiek
- Dr. B.H.W. Faas, laboratoriumspecialist klinische genetica, werkzaam in het Radboudumc, Nijmegen, Vereniging Klinisch Genetische Laboratoriumdiagnostiek
- Dr. T. Rinne, laboratoriumspecialist klinische genetica, werkzaam in het Radboudumc, Nijmegen, Vereniging Klinisch Genetische Laboratoriumdiagnostiek
- Dr. M.C. Haak, gynaecoloog, werkzaam in het Leids Universitair Medisch Centrum, Leiden, Nederlandse Vereniging van Obstetrie en Gynaecologie
- Dr. A.B.C. Coumans, gynaecoloog, werkzaam in het Maastricht Universitair Medisch Centrum, Maastricht, Nederlandse Vereniging van Obstetrie en Gynaecologie
- Dr. H. IJsselstijn, kinderarts, werkzaam in het Erasmus Medisch Centrum, Rotterdam, Nederlandse Vereniging voor Kindergeneeskunde
- Drs. I. Cuppen, neuroloog, werkzaam in het Wilhelmina Kinderziekenhuis, Utrecht, Nederlandse Vereniging voor Neurologie
Meelezer
- Prof. dr. E. Pajkrt, gynaecoloog, werkzaam in het Academisch Medisch Centrum, Amsterdam, leeropdracht ‘Verloskunde, in het bijzonder prenatale diagnostiek en foetale echoscopie’, Nederlandse Vereniging van Obstetrie en Gynaecologie
Met ondersteuning van
- K. Venhorst MSc, adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
- Dr. M. van Buuren - van Ruler, adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
- M.E. Wessels MSc, literatuurspecialiste, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
Getekend |
|
Knegt |
Laboratorium specialist klinische genetica/ hoofd laboratorium cytogenetica AMC |
niet van toepassing |
geen |
geen |
geen |
geen |
geen |
geen |
5-12-2014 |
|
Lakeman |
klinisch geneticus |
Lid VKN/VKGN richtlijncommissie "Richtlijn Counseling bij CNV detectie diagnostiek" (eerder genaamd "Richtlijn Pre- en Posttest Counseling bij pre- en postnatale array diagnostiek) (betaald via Orde van Medisch Specialisten / VKN) |
niet van toepassing |
niet van toepassing |
Coördinator PGD transportcentrum AMC |
niet van toepassing |
niet van toepassing |
niet van toepassing |
11-12-2014 |
|
Elting |
klinisch geneticus |
Geen |
Geen. |
Geen. |
Geen. |
Geen. |
Geen. |
Geen. |
18-12-2014 |
|
Ijsselstijn |
Kinderarts erfelijke en aangeboren aandoeningen Erasmus MC - Sophia Kinderziekenhuis |
secretaris sectiebestuur EAA van de NVK; onbetaald |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
29-12-2014 |
|
Faas |
Laboratorium specialist Klinische Genetica |
Associate Editor Genetics and Genomics section Prenatal Diagnosis (betaald) |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
9-1-2015 |
|
Rinne |
Laboratoriumspecialist klinische genetica |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
9-1-2015 |
|
Bouman |
Klinische geneticus 0,8 FTE |
|
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
9-1-2015 |
|
Lichtenbelt |
klinisch geneticus, deelnemer aan de werkgroep |
werkgroep prenatale genetica (WPG) VKGN, onbetaald |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
31-3-2015 |
|
Cuppen |
kinderneuroloog |
GEEN |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
9-4-2015 |
|
Den Hollander |
klinisch geneticus |
geen |
geen |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
neen |
28-4-2015 |
|
Haak |
gynaecoloog-perinatoloog |
geen |
geen |
geen |
geen |
geen |
geen |
nee |
1-6-2015 |
|
Coumans |
gynaecoloog-perinatoloog MUMC+ |
secretaris Otterlo (werkgroep NVOG) |
geen |
geen |
geen |
geen |
geen |
neen |
18-9-2015 |
|
Venhorst |
Adviseur Kennisinstituut & Promovendus |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
7-12-2015 |
|
Van Buuren-van Ruler |
Adviseur Kennisinstituut |
geen |
geen |
Geen persoonlijke relaties die baat kunnen hebben bij een bepaalde uitkomst van een advies |
niet van toepassing |
Momenteel bezig, in eigen tijd, met het afronden van wetenschappelijk artikelen naar processen in het brein die ten grondslag liggen aan geheugen. Dit onderzoek is ondersteund door een beurs vanuit de EU (ERC) aan mijn toenmalige supervisor, Guillén Fernández |
niet van toepassing |
nee |
20-6-2016 |
|
Pajkrt |
Gyneacoloog: Hoofd prenetale diagnostiek AMC |
Directeur Stichting Prenatale Screening Amsterdam en Omstreken (betaald) |
Geen |
Collega's uit het AMC |
- Voorzitter Werkgroep Foetale Echoscopie (NVOG) |
2014 'Costs and effects of a cervical pessary in women who have been discharged after an episode of threatened preterm lab.' (APOSTEL VI). (ZonMW (837001507): Co-applicant/ €83.494) |
geen |
|
15-12-2015 |
|
Stuurman |
AIOS klinische genetica |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
niet van toepassing |
22-2-2016 |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door patiëntenverenigingen te betrekken bij de knelpuntenanalyse. Tijdens de oriënterende zoekactie werd gezocht op literatuur naar patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de VSOP, Vereniging VGnetwerken, Erfocentrum en de Patiëntenvereniging Aangeboren Hartafwijkingen.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft tevens interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken (zie Indicatoren).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd oriënterend gezocht naar bestaande buitenlandse richtlijnen, systematische reviews, en literatuur over patiëntenvoorkeuren en patiëntrelevante uitkomstmaten (patiëntenperspectief; Medline). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie met daarin het patiëntenperspectief zijn opgenomen onder aanverwante producten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd bepaald volgens een generieke GRADE-methode. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de generieke GRADE-methodiek. De werkgroepleden maakten de balans op van elke prognostische factor/interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Een lage bewijskracht van conclusies in de systematische literatuuranalyse sluit een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de richtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan alle betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42.
Kennisinstituut van de Federatie Medisch Specialisten. Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwaliteit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html. 2012.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10.
Van Everdingen JJE, Burgers JS, Assendelft WJJ, et al. Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum. 2004.
Zoekverantwoording
|
Database |
Zoektermen |
|
Medline (OVID)
2000-apr. 2016 |
5 Ultrasonography, Prenatal/ or ((prenatal or fetal) adj3 (ultrasonograph* or ultrasound or echo* or sonograph*)).ti,ab,kf. (30526) 6 ("Autopsy"/ or autops*.ti,ab,kf.) and (fe?tal or prenatal*).ti,ab,kf. (2770) 7 (prenatal adj3 diagnos*).ti,ab,kf. (21847) 8 5 or 6 or 7 (48242) 9 4 and 8 (3) 10 "Bone Diseases, Developmental"/ (5056) 11 (((musculoskeletal or skeletal) adj3 dysplasia*) or ((limb or skeletal) adj3 (abnormalit* or malformation*))).ti,ab,kf. (7787) 12 exp Osteochondrodysplasias/ (26969) 13 osteochondrodysplasia*.ti,ab,kf. (512) 14 (short* adj3 (bone* or limb*)).ti,ab,kf. (3665) 15 ((narrow* adj3 thorax) or fracture* or (bone adj3 mineral*)).ti,ab. (228968) 16 exp Fractures, Bone/ (155433) 17 exp Thorax/ab [Abnormalities] (3362) 18 Bone Density/ (43779) 19 10 or 11 or 12 or 13 or 14 or 15 or 16 or 17 or 18 (322131) 20 9 and 19 (3) 21 8 and 19 (1360) 22 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (263969) 23 21 and 22 (24) 24 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (2506695) 25 21 and 24 (237) 26 23 or 25 (258) 27 Syndrome/ or syndrom*.ti,ab,kf. or "Abnormalities, Multiple"/ or genetics.fs. or genetic*.ti,ab,kf. (3712861) 28 21 and 27 (851) 29 *Syndrome/ or syndrom*.ti,ab,kf. or *"Abnormalities, Multiple"/ or genetics.fs. or genetic*.ti,ab,kf. (3693866) 30 21 and 29 (832) 31 30 not 26 (702) 32 case reports.pt. (1770802) 33 limit 26 to yr="2000 -Current" (182) 34 limit 28 to yr="2000 -Current" (522) 35 34 not 32 (210) 36 33 or 35 (327) 37 from 36 keep 1-327 (327) – 324 uniek |
|
Embase (Elsevier) |
'prenatal diagnosis'/exp OR ((prenatal* OR 'pre natal' OR antenatal* OR 'ante natal') NEAR/3 (diagnos OR detect* OR screen*)):ab,ti OR 'fetus echography'/exp OR ((prenatal OR fetal) NEAR/3 (ultrasonograph* OR ultrasound OR echo* OR sonogr*)):ab,ti AND [embase]/lim AND [2000-2016]/py
AND ('bone dysplasia'/exp OR 'chondrodysplasia'/exp OR 'fracture'/exp OR 'thorax malformation'/exp OR 'bone density'/exp OR ((musculoskeletal OR skeletal) NEAR/3 dysplasia*):ab,ti OR ((limb OR skeletal) NEAR/3 (abnormalit* OR malformation*)):ab,ti OR osteochondrodysplasia*:ab,ti OR (short* NEAR/3 (bone* OR limb*)):ab,ti OR (narrow* NEAR/3 thorax):ab,ti OR fracture*:ab,ti OR (bone NEAR/3 mineral*):ab,ti)
AND ('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp)
OR 'major clinical study'/de)
OR ('syndrome'/exp OR 'clinical genetics'/exp OR syndrom*:ab,ti OR ((additional OR associated) NEAR/3 (anomal* OR syndrome* OR abnormalit* OR malformation*)):ab,ti OR dna:ab,ti) NOT ('case report'/exp OR 'conference abstract':it)) (322) >231 uniek |
Exclusietabel
|
Auteur, jaartal |
Inclusie/Exclusie |
Reden van exclusie |
|
Ahmed, 2010 |
Inclusie, vraag 1 |
|
|
Arahori, 2007 |
Inclusie, vraag 2 |
|
|
Barbosa-Buck, 2012 |
Exclusie |
Niet bij alle geïncludeerde casus is er sprake van een prenataal echoscopische verdenking op een skeletdysplasie, en er is geen onderscheid mogelijk tussen casus met en zonder prenatale verdenking. |
|
Barkove, 2015 |
Exclusie |
Onduidelijk of er sprake is van een prenatale echoscopische verdenking op een skeletdysplasie |
|
Doray, 2000 |
Inclusie, vraag 1 |
|
|
Khalil, 2011 |
Inclusie, vraag 1 |
|
|
Konstantinidou, 2009 |
Exclusie |
Niet bij alle geïncludeerde casus is er sprake van een prenataal echoscopische verdenking op een skeletdysplasie, en er is geen onderscheid mogelijk tussen casus met en zonder prenatale verdenking. |
|
Krakow, 2008 |
Inclusie, vraag 1 |
|
|
Ngo, 2007 |
Exclusie |
Case report van 5 casus die individueel worden besproken |
|
Parilla, 2003 |
Inclusie, vraag 1 |
|
|
Puri, 2007 |
Exclusie |
Inclusie is een skeletafwijking (short limbed dwarfism) bij een overleden casus, waarbij niet bij alle casus sprake is van een prenataal echoscopische verdenking op een skeletdysplasie. |
|
Schramm, 2009 |
Inclusie, vraag 1 |
|
|
Todros, 2004 |
Inclusie, vraag 2 |
|
|
Toru, 2015 |
Exclusie |
Inclusie is een skeletdysplasie bij een overleden casus |
|
Trujillo-Tiebas, 2009 |
Exclusie |
inclusie is verwijzing voor gen-onderzoek door verdenking op skeletdysplasia door echo of afwijkingen bij familie of eerdere zwangerschap |
|
Vermeer, 2013 |
Inclusie, vraag 2 |
|
|
Yeh, 2011 |
Incluse, vraag 1 |
|
