Spondylodese techniek spondylolisthesis
Uitgangsvraag
Wat is de beste chirurgische techniek van spondylodese voor de indicaties spondylolysis, degeneratieve spondylolisthesis, of spondylolytische spondylolisthesis?
Aanbeveling
Zowel de PLF, PLIF en MIS T-LIF dragen vergelijkbaar bij aan afname van pijn na operatie. De overige verschillende voor en nadelen van de beschreven technieken zijn of klinisch niet relevant of nog onduidelijk. Daarom kunnen al deze drie technieken worden gebruikt in de behandeling van patiënten met spondylolisthesis, spondylolysis of spondylolithische spondylolisthesis.
Overwegingen
Op basis van de wetenschappelijk bewijs kan er geen eenduidig antwoord worden gegeven wat de beste chirurgische techniek van spondylodese voor de indicaties degeneratieve spondylolisthesis, spondylolysis of spondylolytische spondylolisthesis is.
Zowel de PLF, PLIF en MIS T-LIF dragen bij aan afname van pijn na operatie. Daarom kunnen deze drie technieken worden gebruikt in de behandeling van bovengenoemde patiëntencategorieën.
PLIF liet minder non-union zien (Fallatah, 2013; RR 0,22 (95% CI 0,08 tot 0,62) met een hogere discushoogte en minder residuele listhese. PLIF was effectiever dan PLF voor tevredenheid (Liu, 2014) met een OR van 0,49 (95 %CI 0,28 tot 0,88, P=0,02; moderate evidence). Of dit verschil tussen PLIF en PLF ook op de langere termijn een betere uitkomst geeft, is onduidelijk. Wel is een PLIF een uitgebreidere ingreep met meer kosten en potentieel meer risico’s dan een PLF.
De minimaal invasieve benadering dient voornamelijk voor sneller herstel en betere korte termijn resultaten. Consistente verschillen werden gevonden op peroperatieve parameters: Bloedverlies, opnameduur, operatieduur en postoperatieve pijn was minder met minimaal invasieve chirurgie. Een studie (Peng, 2009) vond meer complicaties met de open techniek (13,8 vs 6,9%, p<0,05), de andere studies konden geen verschillen vinden.
Kennishiaat
Er zijn onvoldoende studies naar minimaal invasieve operatietechnieken verricht.
Een aanbeveling is om een degelijke kosten effectiviteit studie uit te voeren betreffende bovengenoemde chirurgische technieken (PLF, PLIFF en MIS T-LIFF) aangezien het kosten aspect dan wellicht een rol gaat spelen in de overweging welke techniek de voorkeur geniet.
Onderbouwing
Achtergrond
Er bestaan diverse chirurgische benaderingen en operatietechnieken voor het verrichten van een geïnstrumenteerde spondylodese van de lage rug. Hierin is de afgelopen jaren een enorme ontwikkeling geweest qua aantallen operaties en qua diversiteit aan operatieve technieken en implantaten, mede gedreven door de omvangrijke industrie op dit gebied. Uiteraard is de keuze van de chirurgische benadering (anterieur, posterieur, lateraal of circumferent) afhankelijk van de specifieke indicatie en de aard van de aandoening waarvoor de spondylodese wordt verricht. Ook andere factoren zoals voorkeur van de patiënt en de chirurg of comorbiditeit kunnen daarbij een rol spelen. Maar los van deze overwegingen rijst de vraag of de effectiviteit van de verschillende beschikbare technieken op voldoende bewijs is gebaseerd en of een bepaalde techniek betere resultaten en/of minder complicaties geeft dan een andere.
Conclusies / Summary of Findings
Minimaal invasieve versus open spondylodese-technieken voor lumbale spondylolisthesis
|
Laag |
Minimaal invasieve implantatie van pedikelschroeven leidt tot meer afname van pijn, op de korte termijn, in vergelijking met de open technieken.
Minimaal invasieve implantatie van pedikelschroeven leidt niet tot meer afname van pijn, op de lange termijn, in vergelijking met de open technieken.
Bronnen (Kotani, 2012; Ghareman, 2010; Parker, 2012; Wang, 2010; Peng, 2009) |
|
Laag |
Minimaal invasieve implantatie van pedikel schroeven leidt niet tot een beter functioneren wanneer er vergeleken wordt met de open technieken.
Bronnen (Kotani, 2012; Ghareman, 2010; Parker, 2012; Wang, 2010; Peng, 2009) |
|
Laag |
Minimaal invasieve pedikelschroeffixatie leidt niet tot een betere kwaliteit van leven wanneer er vergeleken wordt met de open technieken.
Bronnen (Kotani, 2012; Ghareman, 2010; Parker, 2012; Wang, 2010; Peng, 2009) |
|
Laag |
Op basis van de wetenschappelijke literatuur kan er geen eenduidig antwoord worden gegeven wat de beste chirurgische techniek van spondylodese is voor de indicaties degeneratieve spondylolisthesis, spondylolysis of spondylolytische spondylolisthesis
Bronnen (Kotani, 2012; Ghareman, 2010; Parker, 2012; Wang, 2010; Peng, 2009) |
Posterolaterale (PLF) versus intervertebrale fusie (PLIF)
|
Laag |
PLIF leidt tot vergelijkbare pijnverbetering als PLF.
Bronnen (Fallatah, 2013; Liu, 2014; Korovessis, 2012; Hallet, 2007; Kim, 2006; Swan, 2006) |
|
Laag |
PLIF leidt tot een beter functioneren dan PLF.
Bronnen (Fallatah, 2013; Liu, 2014; Korovessis, 2012; Hallet, 2007; Kim, 2006; Swan, 2006) |
|
Laag |
PLIF leidt niet tot een betere kwaliteit van leven dan PLF.
Bronnen (Fallatah, 2013; Liu, 2014; Korovessis, 2012; Hallet, 2007; Kim, 2006; Swan, 2006) |
|
Laag |
Op basis van de wetenschappelijke literatuur kan er geen eenduidig antwoord worden gegeven wat de beste chirurgische techniek van spondylodese voor de indicaties degeneratieve spondylolisthesis, spondylolysis of spondylolytische spondylolisthesis
Bronnen (Fallatah, 2013; Liu, 2014; Korovessis, 2012; Hallet, 2007; Kim, 2006; Swan, 2006) |
Samenvatting literatuur
Minimaal invasieve versus open technieken
Voor de vergelijking van minimaal invasieve en open technieken werden vijf vergelijkende niet-gerandomiseerde studie (Kotani, 2012) geïncludeerd (Kotani, 2012; Ghareman 2010; Parker 2012; Wang 2010; Peng 2009). Kotani vergeleek (MIS-PLF) met open-PLF.
Pijn (VAS-schaal)
De studie van Kotani liet geen verschil zien: de preoperatieve VAS-scores waren 73,0 in de minimaal invasieve PLF (MIS-PLF)-groep en 73,7 in de open-PLF-groepen. Postoperatief werd er in 14 dagen een flinke afname gezien en was de VAS net onder de 20 in beide groepen. Lange termijn VAS-scores waren niet beschikbaar.
Minimaal invasieve benadering voor het implanteren van pedikel schroeven geeft een betere rugpijn score postoperatief op de korte termijn (na drie dagen, p=0,02). Andere studies (Wang, 2010; Parker, 2010; Peng, 2009; Ghareman, 2010) lieten geen verschil zien op lange termijn (24 tot 26 maanden) qua pijnscores (zie evidencetabel). Wang kijkt overigens alleen naar VAS-rugpijn, de andere drie studies zowel naar VAS-rug- als -beenpijn.
Functioneren (Disability)
De studie van Kotani toonde een significant en klinisch relevant effect. De preoperatieve ODI-waardes waren 52,0 in de MIS-PLIF-groep en 48,9 in de open-PLF-groep, na twee jaar was de ODI-waarde 38 in de open-PLF-groep en 13 in de MIS-PLF-groep. Minimaal invasieve benadering voor het implanteren van pedikelschroeven geeft dus een beter functioneren op de korte en de lange termijn. Drie studies (Wang, 2010; Parker, 2010; Peng, 2009) lieten geen verschil zien op lange termijn (24 tot 26 maanden) in ODI-scores (zie evidence-tabel).
Kwaliteit van leven
Drie studies (Parker, 2012; Peng, 2009; Ghahreman, 2010) vonden geen verschillen in kwaliteit van leven (EQ5D). Kwaliteit van leven is niet in de andere studies meegenomen.
Posterolaterale (PLF) versus intervertebrale spondylodese (PLIF)
Voor de vergelijking van posterolaterale lumbale fusie (PLF) en posterieure lumbale intervertebrale fusie (PLIF) werden twee reviews (Liu, 2014; Fallatah, 2013) geïncludeerd. Liu poolde studies voor postoperatieve rugpijn en includeerde één RCT (Musluman, 2011) en vier vergelijkende observationele studies (Cunningham, 2013; Dantas, 2007; Dehoux, 2004; La Rosa, 2001). Daarnaast werden nog drie vergelijkende observationele studies gevonden (Korovessis, 2012; Hallett, 2007; Kim, 2006). De review van Fallatah 2013 richtte zich op functioneren middels de Oswestry Disability Index (ODI), deze review poolde vijf gecontroleerde observationele studies (Dehoux, 2004; La Rosa, 2003; Lidar, 2005; Madan, 2003; Suk, 1997). Daarnaast leverde de literatuursearch nog vier gecontroleerde observationele studies op (Swan, 2006; Korovessis 2012; Hallett 2007, Kim 2006).
Pijn (VAS-schaal)
In de review van Liu was PLIF effectiever dan PLF voor rugpijn met een gewogen gemiddeld verschil van 9,2 op een schaal van 100 (95 % BI 4,8 tot 13,5, P<0,0001), zie figuur 1. Deze resultaten bedroegen de lange termijn en de follow-up in deze studies varieerde van twee tot zeven jaar. Drie additionele RCTs (Korovessis, 2012; Hallet, 2007; Kim, 2006) laten geen relevante of significante verschillen zien in rugpijn. Derhalve is het onduidelijk of PLIF daadwerkelijk leidt tot meer pijnverbetering ten opzichte van PLF. Alleen Kim en Korovessis (Kim, 2006; Korovessis, 2012) evalueerden beenpijn en liet geen significante verschillen zien tussen PLIF en PLF.
Figuur 1 Postoperatieve rugpijn na lange termijn (twee tot zeven jaar) van PLF versus PLIF voor de behandeling van lumbale spondylolisthesis
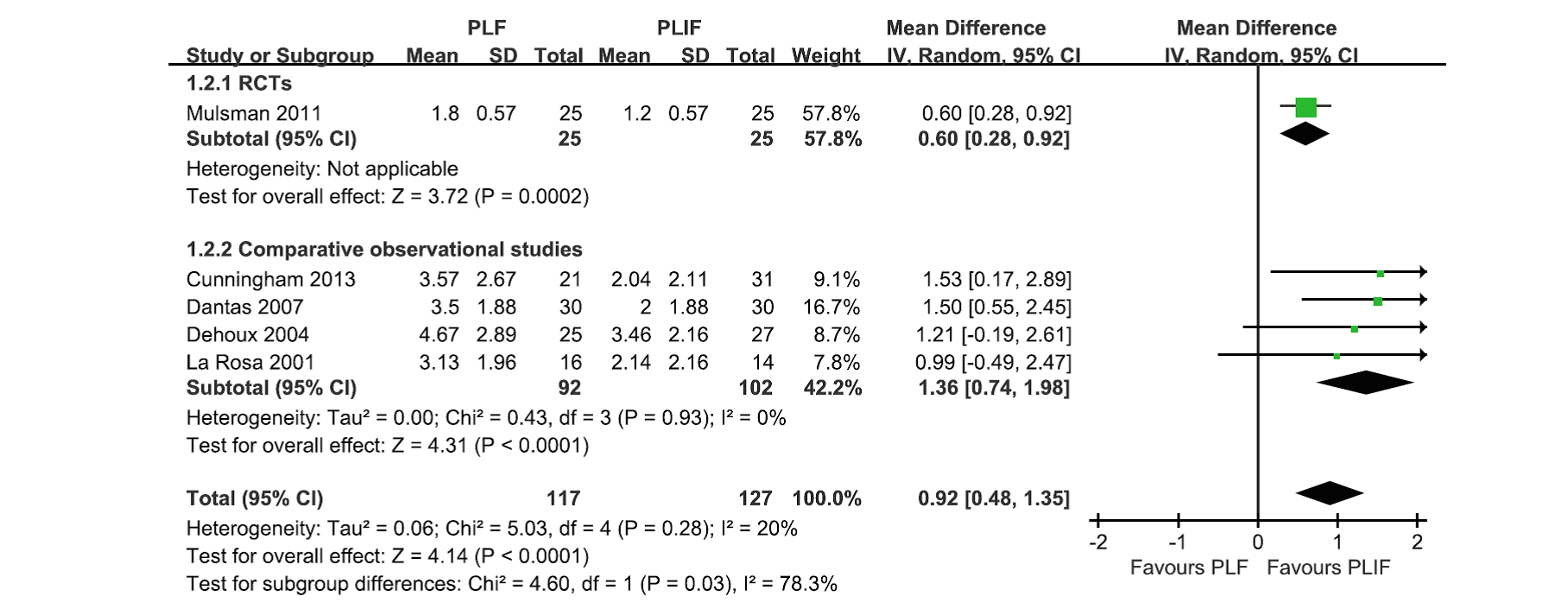
Functioneren (Disability)
De review van Fallatah 2013 met vijf vergelijkende observationele studies vond geen relevante verschillen op functioneren tussen PLF en PLIF. PLIF was effectiever dan PLF in het verbeteren van de ODI met een gewogen gemiddelde van 1,30 (Liu, 2014; 95 % BI 0,25 tot 2,35, P=0,01. Een observationele studie (Swan, 2006) laat voor meer patiënten een herstel op de ODI-score tot onder de 20 zien na circumferente fusie op één jaar (20 versus 34; RR 1,66, 95% BI 1,14-2,42; p<,005). Drie additionele RCTs (Korovessis, 2012; Hallet, 2007; Kim, 2006) laten geen relevante of significante verschillen zien tussen PLIF en PLF.
Kwaliteit van leven
Twee additionele RCTs (Korovessis, 2012; Hallet, 2007) laten geen relevante of significante verschillen zien tussen PLIF en PLF. De overige studies vermelden geen kwaliteit van leven uitkomsten.
Bewijskracht van de literatuur
Minimaal invasieve versus open technieken
Alle studies waren observationele studies, deze hebben de bewijskracht laag. Voor pijn en functioneren werd geen verschil gevonden tussen beide groepen. De bewijskracht is laag omdat het observationele studies zijn. Voor kwaliteit van leven werden twee observationele studies gevonden die kwalitatief slecht werden uitgevoerd daarom is de bewijskracht zeer laag.
Posterolaterale (PLF) versus intervertebrale fusie (PLIF)
Hier werd uitgegaan van twee reviews van observationele studies (Liu, 2014; Fatallah, 2013). Deze hebben de bewijskracht laag. Voor kwaliteit van leven is de bewijskracht Laag (publicatiebias, risk of bias) Dit werd gebaseerd op één RCT (50 patiënten) en vier observationele studies (194 patiënten). Drie RCTs (Korovessis, 2012; Hallet, 2007; Kim, 2006) hebben een hoog risico op bias door gebrek aan duidelijke randomisatie technieken, mogelijk selectieve uitval en gebrek aan blindering.
Zoeken en selecteren
In de databases Medline (Pubmed), Embase en Cochrane is met relevante zoektermen gezocht naar studies over geïnstrumenteerde chirurgische ingrepen bij spondylolisthesis. Er werd eerst een overkoepelende search verricht gericht op reviews en vervolgens een aanvullende search naar mogelijke nieuwe primaire studies.
Vanuit de overkoepelende search werden vijf reviews geselecteerd.
- voor de vergelijking van minimaal invasieve en open technieken werd geen review en één vergelijkende studie geïncludeerd en vier studies werden via additionele bronnen geïncludeerd;
- voor de vergelijking van posterolaterale lumbale fusie (PLF) en posterieure lumbale intervertebrale fusie (PLIF) werden vier studies en twee reviews geïncludeerd.
Relevante uitkomstmaten
De werkgroep achtte pijnbeleving (VAS); functioneren (Oswestry Disability Index (ODI)); en kwaliteit van leven (SF-36; EQ-5D); voor de besluitvorming kritieke uitkomstmaten.
Pijn (VAS-schaal)
Pijn werd gemeten met de VAS-schaal. Scores op deze schaal lopen van 0 tot 100, waarbij 0 geen pijn aangeeft en 100 de ergst voorstelbare pijn.
Functioneren (Disability)
Functioneren werd gemeten met behulp van de Oswestry Disability Index score (ODI). Scores op deze schaal lopen van 0 tot 100, waarbij lagere scores minder ernstige invaliditeit aangeven.
Kwaliteit van leven
Kwaliteit van leven werd gemeten met de SF-36 vragenlijst en EQ-5D vragenlijst. Scores op de SF-36 vragenlijst lopen van 0 tot 100, waarbij hogere scores een betere gezondheidsstatus aangeven.
Referenties
- Cunningham JE, Elling EM, Milton AH, et al. What is the optimum fusion technique for adult isthmic spondylolisthesis--PLIF or PLF? A long-term prospective cohort comparison study. J Spinal Disord Tech. 2013;26(5):260-7. doi: 10.1097/BSD.0b013e3182417103. PubMed PMID: 22158302.
- Dantas FL, Prandini MN, Ferreira MA. Comparison between posterior lumbar fusion with pedicle screws and posterior lumbar interbody fusion with pedicle screws in adult spondylolisthesis. Arq Neuropsiquiatr. 2007;65(3B):764-70. PubMed PMID: 17952277.
- Dehoux E, Fourati E, Madi K, et al. Posterolateral versus interbody fusion in isthmic spondylolisthesis: functional results in 52 cases with a minimum follow-up of 6 years. Acta Orthop Belg 2004;70:578582
- Fallatah S, Wai E, Baily CS. The value of adding posterior interbody fusion in the surgical treatment of degenerative lumbar spine disorders: A systematic review. Int J Spine Surg. 2013;7:e24-8.
- Ghahreman A, Ferch RD, Rao PJ, et al. Minimal access versus open posterior lumbar interbody fusion in the treatment of spondylolisthesis. Neurosurgery. 2010;66(2):296-304; discussion 304. doi: 10.1227/01.NEU.0000363600.24074.D0. PubMed PMID: 20087129.
- Hallett A, Huntley JS, Gibson JN. Foraminal stenosis and single-level degenerative disc disease: a randomized controlled trial comparing decompression with decompression and instrumented fusion. Spine (Phila Pa 1976). 2007;32(13):1375-80. PubMed PMID: 17545903.
- Kim KT, Lee SH, Lee YH, et al. Clinical outcomes of 3 fusion methods through the posterior approach in the lumbar spine. Spine (Phila Pa 1976) 2004;31(1351):1357. doi: 10.1097/01.brs.0000218635.14571.55
- Kotani Y, Abumi K, Ito M, et al. Mid-term clinical results of minimally invasive decompression and posterolateral fusion with percutaneous pedicle screws versus conventional approach for degenerative spondylolisthesis with spinal stenosis. Eur Spine J. 2012;21(6):1171-7. doi: 10.1007/s00586-011-2114-x. Epub 2011 Dec 16. PubMed PMID: 22173610; PubMed Central PMCID: PMC3366131.
- Korovessis P, Koureas G, Zacharatos S, et al. Correlative radiological, self-assessment and clinical analysis of evolution in instrumented dorsal and lateral fusion for degenerative lumbar spine disease. Autograft versus coralline hydroxyapatite. Eur Spine J. 2005;14(7):630-8. PubMed PMID: 15789231
- La Rosa G, Cacciola F, Conti A, et al. Posterior fusion compared with posterior interbody fusion in segmental spinal fixation for adult spondylolisthesis. Neurosurg Focus 2001;10:E9.
- La Rosa G, Conti A, Cacciola F, et al. Pedicle screw fixation for isthemic spondylolisthesis: Does posterior lumbar interbody fusion improve outcome over posterior fusion? J Neurosurg 2003;99(Suppl):14350.
- Lidar Z, Beaumont A, Lifshutz J, et al. Clinical and radiological relationship between posterior lumbar interbody fusion and posterolateral lumbar fusion. Surg Neurol 2005;64:303 8.
- Liu X, Wang Y, Qiu G, et al. A systematic review with meta-analysis of posterior interbody fusion versus posterolateral fusion in lumbar spondylolisthesis. Eur Spine J. 2014;23(1):43-56.
- Madan SS, Boeree NR. Comparison of instrumented anterior interbody fusion with instrumented circumferential lumbar fusion. Eur Spine J. 2003 Dec;12(6):567-75. Epub 2003 Aug 28. PubMed PMID: 14673717; PubMed Central PMCID: PMC3467994.
- Müslüman AM, Yilmaz A, Cansever T, et al. Posterior lumbar interbody fusion versus posterolateral fusion with instrumentation in the treatment of low-grade isthmic spondylolisthesis: midterm clinical outcomes. J Neurosurg Spine. 2011;14(4):488-96. doi: 10.3171/2010.11.SPINE10281. Epub 2011 Feb 11. PubMed PMID: 21314280.
- Parker SL, Adogwa O, Bydon A, et al. Cost-effectiveness of minimally invasive versus open transforaminal lumbar interbody fusion for degenerative spondylolisthesis associated low-back and leg pain over two years. World Neurosurg. 2012;78(1-2):178-84. doi: 10.1016/j.wneu.2011.09.013. Epub 2011 Nov 7. PubMed PMID: 22120269.
- Peng CW, Yue WM, Poh SY, et al. Clinical and radiological outcomes of minimally invasive versus open transforaminal lumbar interbody fusion. Spine (Phila Pa 1976). 2009;34(13):1385-9. doi: 10.1097/BRS.0b013e3181a4e3be. PubMed PMID: 19478658.
- Suk SI, Lee CK, Kim WJ, et al. Adding posterior lumbar interbody fusion to pedicle screw fixation and posterolateral fusion after decompression in spondylolytic spondylolisthesis. Spine (Phila Pa 1976) 1997;22:210 20.
- Swan J, Hurwitz E, Malek F, et al. Surgical treatment for unstable low-grade isthmic spondylolisthesis in adults: a prospective controlled study of posterior instrumented fusion compared with combined anterior-posterior fusion. Spine J. 2006 Nov-Dec;6(6):606-14. Epub 2006 Oct 2. PubMed PMID: 17088191.
- Wang J, Zhou Y, Zhang ZF, et al. Comparison of one-level minimally invasive and open transforaminal lumbar interbody fusion in degenerative and isthmic spondylolisthesis grades 1 and 2. Eur Spine J. 2010;19(10):1780-4. doi: 10.1007/s00586-010-1404-z. Epub 2010 Apr 22. PubMed PMID: 20411281; PubMed Central PMCID: PMC2989221.
Evidence tabellen
Table of quality assessment
Research question: Wat is de beste chirurgische techniek van spondylodese?
Indicatie degeneratieve spondylolisthesis, spondylolysis of spondylolytische spondylolisthesis
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Bias due to method of randomisation (Describe method) 1
(unlikely/likely/unclear) |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Kim 2006 |
Unclear |
Unclear |
Unclear |
Likely |
Unclear |
Unclear |
Likely |
Unlikely |
|
Hallet 2007 |
Unclear |
Unlikely |
Unclear |
Likely |
Likely |
Unclear |
Likely |
Unlikely |
|
Korovessis 2012 |
Unlikely |
Unclear |
Unclear |
Likely |
Unclear |
Unclear |
Unlikely |
Unlikely |
Risk of bias table for observational studies (prospective controlled trials)
|
Study reference
(first author, publication year) |
Representativeness of the exposed cohort |
Selection of the non exposed cohort |
Ascertainment of exposure |
Demonstration that outcome of interest was not present at start of study |
Comparability of cohorts on the basis of the design or analysis |
Assessment of outcome |
Was follow-up long enough for outcomes to occur |
Adequacy of follow up of cohorts |
|
Ohtori 2011 |
truly representative of the average degenerative spondylolisthesis patient |
drawn from the same community as the exposed cohort |
secure record (eg surgical records) |
Yes |
No control for confounding |
self report |
yes |
complete follow up - all subjects accounted for |
|
Kotani 2012 |
truly representative of the average degenerative spondylolisthesis patient |
drawn from the same community as the exposed cohort |
secure record (eg surgical records) |
Yes |
No control for confounding |
self report |
yes |
complete follow up - all subjects accounted for |
|
Ghareman 2010 |
truly representative of the average degenerative spondylolisthesis patient |
drawn from the same community as the exposed cohort |
secure record (eg surgical records) |
Yes |
No control for confounding – some radiographical differences |
Self report |
Yes |
subjects lost to follow up unlikely to introduce bias - small number lost - >93 % follow up. No description provided. |
|
Parker 2012 |
truly representative of the average degenerative spondylolisthesis patient |
drawn from the same community as the exposed cohort |
secure record (eg surgical records) |
Yes |
No control for confounding – small groups |
Self report |
Yes |
complete follow up - all subjects accounted for |
|
Wang 2010 |
Somewhat representative of the average degenerative spondylolisthesis patient (isthmic included) |
drawn from the same community as the exposed cohort |
secure record (eg surgical records) |
Yes |
No control for confounding |
Self report |
Yes |
Unclear |
|
Peng 2009 |
truly representative of the average degenerative spondylolisthesis patient |
Unsure, severe cases stated as being contraindicated for MIS |
secure record (eg surgical records) |
Yes |
No control for confounding |
Self report |
Yes |
complete follow up - all subjects accounted for |
|
Swan 2006 |
truly representative of the average isthmic spondylolisthesis patient |
drawn from the same community as the exposed cohort |
secure record (eg surgical records) |
Yes |
No control for confounding |
self report |
yes |
subjects lost to follow up unlikely to introduce bias - small number lost - >93 % follow up, and description provided of those lost |
Evidence tables
Research question: Wat is de beste chirurgische techniek van spondylodese?
Indicatie degeneratieve spondylolisthesis, spondylolysis of spondylolytische spondylolisthesis
Systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics SR meta-analysis type of studies Literature search date Studies Source of funding |
Patient characteristics Selection criteria # studies included Important patient characteristics at baseline (per study:N, mean age) Type of back pain: Groups comparable at baseline? |
Intervention (I)
|
Comparison / control (C)
|
Follow-up End-point of follow-up For how many participants were no complete outcome data available? |
Outcome measures and effect size Outcome measure-1 Defined as.Oswestry Disability Score (ODI). Outcome measure-2 |
Comments |
|
Jacobs |
SR
|
surgical treatment sufficient description of the intervention low-grade (gr I and II, or <50% slip) isthmic SPL at 1 lumbar level; failed to respond to conservative treatment. outcome parameter had to be a radiological, clinical, or functional measure. >10 patients Homogeneous Peer reviewed |
Instrumented |
Non-instrumented |
|
|
|
|
|
|
|
PLF |
PLF+AIF |
|
|
|
|
Martin |
SR RCT, Observational controlled studies June 2005 Federal funds |
RCT or comparative observational study Surgical management of degenerative lumbar SPL fusion versus decompression; instrumented fusion versus noninstrumented fusion. >1-year followup. >5 patients per treatment group. English, German, and French Excluded: previous spine surgery, cervical injuries, spinal fractures, tumors, or isthmic SPL. Heterogeneity not clearly a comparative study. |
Instrumented fusion |
Non-instrumented fusion |
|
|
|
|
Watters |
|
|
|
|
|
|
|
|
Liu |
SR with MA RCTs RoB Cochrane Grade 1960 to 12/2012 No funding |
>= 18 years spinal fusion for lumbar SPL; PLIF versus PLF; at least one desirable outcome; follow up for at least 1 year <5 % of with acute spinal fracture, infection, revision, tumor, osteoporosis, rheumatoid arthritis, degenerative kyphosis, or degenerative lumbar scoliosis exceeding 10 . |
PLIF |
PLF |
|
|
|
|
Fallatah |
SR with MA Observational controlled Newcastle-Ottawa 1966-2006 Coi not stated |
Adult patients surgical treatment lumbar spine degenerative conditions minimum follow-up of 2 years PLF with/without instrumentation compared with PIF (either PLIF or TLIF with/without instrumentation) patient-centered disease-specific functional outcome. excluding tumor trauma and infection |
PLIF |
PLF |
|
|
|
Intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
|
Study reference Ref |
Study characteristics Type of study: Setting: Country: Source of funding: |
Patient characteristics 2 Inclusion criteria: Exclusion criteria: N total at baseline: Important prognostic factors2 |
Intervention (I) Describe intervention (treatment/procedure/test):
|
Comparison / control (C) 3 Describe control (treatment/ procedure/test):
|
Follow-up Length of follow-up: Loss-to-follow-up: Incomplete outcome data |
Outcome measures and effect size 4 Outcome measures and effect size (include 95%CI and p-value if available): Disability (Oswestry index, mean change, mixed model): Pain (VAS, mm): Functional (SF-36) Functional EQ-5D Quality of life Psychosocial functioning |
Comments |
|
Ohtori 2011 |
Prospectief observationeel gecontroleerd Hospital Japan No commercial funding |
Low back and leg pain continuing for at least 12 months. pain corresponding only to L5 spinal nerves lumbar degenerated spondylolisthesis at L4 (5% Lat X or 3mm F/E X) spinal stenosis L4/L5 level on X-ray, myelogram, CT after myelography, and MRI Exclusie: cauda equina symptoms due to severe stenosis Patients showing claudication symptoms but no lateralizing leg pains severe central stenosis previousspinal surgery spinal tumor, infection, and trauma |
decompression between levels L4 and L5, and instrumented posterolateral fusion using local bone (PLF; L4–L5 level)
n=24 |
extraperitoneal anterior interbody fusion using an iliac bone graft (ALIF; L4–L5 level)
n=22 |
24 months No loss |
VAS LB pain: ALIF 12 (5), PLF 27 (6) VAS leg pain: ALIF 25 (7), PLF 20 (6) JOA: Unclear ODI: ALIF 15 (5), 20 (7) |
Low back pain better with instrumented fusion |
|
Anderson 2008, Christensen 2002 |
Primary and Christensen 2002 Incl in review Jacobs |
|
posterolateral lumbar fusion with Cotrell–Doubousset pedicle screw instrumentation
n=53 |
posterolateral lumbar fusion without Cotrell–Doubousset pedicle screw instrumentation
n=54 |
11-13 year 28% lost to fu |
Dallas Pain Questionnaire ODI: Instr 33, Non instr 30.6 SF36 |
No differences, subgroup spondylolisthesis better ODI and SFMental for non-instrumented |
|
Ekman 2005 |
Primary Moller 2000 included in review Jacobs |
|
posterolateral fusion with (n = 37) pedicle screw instrumentation
n = 40 |
posterolateral fusion without pedicle screw instrumentation
n = 40 |
9 years (5-13) 9% lost to fu
|
VAS pain: Instr 36, non-instr 45 (N.S.) ODI: Instr 30, non instr 27 (n.s.) Disability rating index SF36 n.s. Global outcome (4q) n.s. |
Instrumentation neither positively nor negatively affects the long-term outcome |
|
Ekman 2009 |
Primary Moller 2000 included in review Jacobs |
|
posterolateral fusion with (n = 37) pedicle screw instrumentation
n = 40 |
posterolateral fusion without pedicle screw instrumentation
n = 40 |
12.6 years (10-17) 28% |
ASD |
fusion accelerates deg changes at the adjacent level (vs natural history). Laminectomy may be of pathogenetic importance. Clinical importance seems limited, (only severe forms affect outcome). |
|
Kotani 2012 |
Prospectief observationeel gecontroleerd Hospital Japan No conflict of interest stated |
intermittent neurological claudication and/or radicular neurological symptoms explained by neural compression due to lumbar spondylolisthesis with spinal stenosis. Exclusie: Low back pain alone |
Minimal invasive (Sextant) pedicle screws + iliac crest PLF
N=43 |
Open insertion of pedicle screws + iliac crest PLF
N=37 |
2, 3, 6 weeks 6, 12, 24 months |
LBP VAS No data ODI (3 months) MIS 13.2, Open 32.1 RMDQ (3 months) MIS: 5.1, Open 10.9 JOA No specific data |
ODI and RMDQ scores consistently lower for MIS over fu period from 2 weeks to 24 months. VAS LBP lower on day 3. |
|
Ghareman 2010 |
Prospectief observationeel gecontroleerd Hospital Australia Financial help was received for this project from DePuy Spine, Inc, Raynham, MA. The authors have no personal financial or institutional interest in any of the drugs, materials, or devices described. |
lytic or degenerative spondylolisthesis with a maximum slip of 50% radicular pain that had persisted for at least 6 months despite treatment with physical therapy, analgesic medications, and transforaminal injection of corticosteroids (if performed). Excluded patients with iatrogenic spondylolisthesis or grade III to V spondylolisthesis and those undergoing revision surgery. |
METRx-MD; Medtronic Sofamor Danek, Memphis, TN Bilateral hemilaminectomies and facetectomies the disc was excised totally. interbody spacers (R-90; Medtronic Sofamor Danek) Polyaxial pedicle screws with reduction tabs or long reduction bolts (Expedium; DePuy Spine, Inc, Raynham, MA)
N=25 |
A 10-cm midline incision with midline muscle detachment full laminectomy. Further same as MIS
N=27 |
12 months |
Median VAS Back pain preoperative MAPTLIF: 8 OPLIF-group 8 Postoperative MAPLIF:2 OPLIF-group: 2) These differences were not statistically significant or clinically relevant
Median Leg pain preoperative MAPLIF: 8 OPLIF-group: 8 Postoperative MAPLIF: 1 OPLIF-group: 1
Median ODI Not reported
SF36 n.s. preoperative MAPLIF: (sd) OPLIF-group: (sd ) Postoperative MAPLIF: (sd ) OPLIF-group: (sd ) |
MAPLIF and OPLIF both reduce leg and back pain and restore function to a similar extent. MAPLIF is as effective as OPLIF in reducing the slip in patients with spondylolisthesis of less than 50%. MAPLIF promotes faster recovery and shortens hospital stay |
|
Parker 2012 |
Prospectief observationeel gecontroleerd Hospital USA The authors declare that the article content was composed in the absence of any commercial or financial relationships that could be construed as a potential conflict of interest. |
(i) evidence on MRI of grade I degenerative lumbar spondylolisthesis, (ii) mechanical low-back pain and radicular symptoms, (iii) a nonresponse to at least six weeks of conservative Therapy (iv) be 18–70 years of age. excluded (i) a history of a previous back operation (ii) an extraspinal cause of back pain or sciatica; (iii) an active medical or workman’s compensation lawsuit; (iv) any pre-existing spinal pathology; (v) were unwilling or unable to participate with follow-up procedures. Patients with notable associated abnormalities, such as inflammatory arthritis or metabolic bone disease, were also excluded. |
TLIF with lamina and foramina decompressed. Sequential soft-tissue dilators Facetectomy Discectomy interbody graft four pedicle screws were percutaneously placed A rod was then placed percutaneously to connect the screws
N=15 |
Midline incision Paravertebral muscles dissected Bilateral pedicle screw-rod constructs were inserted laminectomy and unilateral facetectomy Discectomy interbody graft
N=15 |
24 months |
VAS Back pain preoperative MIS: 8,4 (sd 1.7) Open 9.3 (sd 0.9) Postoperative MIS: 5.5 (sd 2.6) OPEN: 4.7 (sd 3.2) These differences were not statistically significant or clinically relevant VAS Leg pain preoperative MIS: 8.5 (sd 1.3) Open 8.2 (sd 1.3) Postoperative MIS: 5.5 (sd 2.9) OPEN: 3.5 (sd 3.5) These differences were not statistically significant or clinically relevant
ODI preoperative MIS: 36.9 (sd 6.3) Open: 34.3 (sd 11.5) Postoperative MIS: 15.7 (sd 8.9) Open: 17.1 (sd 9.5) These differences were not statistically significant or clinically relevant |
MIS- versus open-TLIF was associated with reduced costs over two years while providing equivalent improvement in QALYs. |
|
Wang 2010 |
Alternating prospective trial Hospital China No funds were received in support of this work. No benefits in any form have been or will be received from a commercial party related directly or indirectly to the subject of this manuscript. |
low back pain as predominant complaint, with varying degrees of radiating pain, neurological complaints, or a combination of these. treated conservatively for at least 3 months without success. |
Minimal invasive TLIF (Mi-TLIF) Quadrant retractor system Sextant system percutaneous pedicle screw system, Medtronic Sofamor Danek, USA)
N=42 |
Open TLIF as described by Harms et al. midline open approach.
N=43 |
26.3 months (13-35) |
VAS Back pain Preoperative MiTLIF: 7,2 (sd 2,1) OTLIF-group en 7,4 (sd 1,6) Postoperative MiTLIF: 0,92 (sd 0,5) OTLIF-group: 1,1 (sd 0,6) These differences were not statistically significant or clinically relevant ODI Preoperative MiTLIF: 41.2 (sd 6.6) OTLIF-group: 38.5 (sd 7.4) Postoperative MiTLIF: (sd ) OTLIF-group: 10.8 (sd 3.3) These differences were not statistically significant or clinically relevant |
No longer term clinical differences. Less postoperative pain, less blood loss, less transfusion, shorter hospital stay for MIS. |
|
Peng 2009 |
Matched cohorts Hospital Singapore No funds were received in support of this work. No benefits in any form have been or will be received from a commercial party related directly or indirectly to the subject of this manuscript |
grade 1 or 2 spondylolisthesis degenerate discs presenting with mechanical low back pain and radicular symptoms. failed conservative management (>6 weeks) before surgery. Relative contraindications for MIS: patients with severely collapsed disc space, which does not move on flexion/extension revision/repeat surgery in which there is significant scar tissue present at the foraminal region where the compromised exiting nerve root and proposed entrance for bone graft and cage introduction are. |
Sequential soft tissue dilators Facetectomy Discectomy Autograft followed by an interbody cage. facet and lamina are removed. percutaneous pedicle screw–rod construct placed through the same incision rod placed percutaneously to connect the screws
n=29 |
midline skin incision paravertebral muscles dissected Bilateral pedicle screw-rod constructs inserted laminectomy and bilateral facetectomy discectomy and placement of bone graft and interbody cage
n=29 |
2 years |
VAS Back pain preoperative MIS: 6 Open 6.5 Postoperative MIS: 1 OPEN: 1.2 (sd ) These differences were not statistically significant or clinically relevant VAS Leg pain preoperative MIS: 7 Open 6.5 Postoperative MIS: 1 OPEN: 1.1 These differences were not statistically significant or clinically relevant
ODI preoperative MIS: 45.2 (sd 3.5) Open: 47.7 (sd 3.2) Postoperative MIS: 16.2 (sd 3.4) Open: 17.5 (sd 3.8) These differences were not statistically significant or clinically relevant |
MIS TLIF has similar good long-term clinical outcomes and high fusion rates of Open TLIF with the additional benefits of less initial postoperative pain, early rehabilitation, shorter hospitalization, and fewer complications. |
|
Korovessis 2012 |
RCT Hospital Greece No benefits from commercial parties |
persistent LBP and sciatica for at least 6 months non-operative treatment protocol for at least 4 months. DDD or single-level lumbar degenerative stenosis and olisthesis. Exclusion previous surgery, isthmic olisthesis, history of spine infection, tumour, known metabolic bone disease, osteoporotic fractures and drug or alcohol abuse. |
Monosegmental circumferential instrumented fusion (Synergy, Biomet-EBI, Indiana NJ, USA) with PLIF (B-twin, Disc-O-Tech, Medical Technologies Ltd., Herzliya, Israel)
N=75 |
two-vertebrae pedicle screw fixation.
N=75 |
6 months
|
VAS Back pain preoperative Posterolateral: Intervertebral Postoperative Posterolateral: Intervertebral These differences were not statistically significant or clinically relevant VAS Leg pain preoperative Posterolateral: Intervertebral Postoperative Posterolateral: Intervertebral These differences were not statistically significant or clinically relevant
ODI preoperative Posterolateral: Intervertebral Postoperative Posterolateral: Intervertebral These differences were not statistically significant or clinically relevant
ODI improved significantly (ANOVA, P\0.000) at an average 50 and 39 points postoperatively in group A and B, respectively, postoperatively. VAS (LBP) and VAS (sciatica) improved at an average of 6.7 points and 7.7, respectively, postoperatively in group A. In group B, VAS (LBP) and VAS (sciatica) improved at an average 6.6 and 6.1, respectively, postoperatively.
Improvements VAS sciatica Circ 77 PLF 61 VAS LBP Circ 67 PLF 66 ODI Circ 50 PLF 39 SF36 PF Circ 40 PLF 37 BP Circ 31 PLF 27 |
Differences not formally tested
novel expandable cage, exclusion? |
|
Hallet 2007 |
RCT Hospital Scotland Corporate/Industry funds were received in support of this work. |
unilateral or bilateral leg pain with or without positive nerve root tension signs, associated muscle weakness, and/or sensory loss. conservative therapy over at least the 3 months. excluded degenerative spondylolisthesis of Grade II at index or adjacent level; vertebral translocation in excess of 1 cm; adjacent disc space narrowing of greater than 50%; malignancy. |
Instrumented posterolateral fusion coupled to a TLIF (360°).
N=14 |
instrumented pedicular posterolateral fusion (180°)
n=16 |
1, 2, 5 years |
RMDQ DPQ VAS LBOS SF36 EuroQol No group data presented |
No differences |
|
Swan 2006 |
Sequential cohort Hospital US Nothing of value received from a commercial entity related to this manuscript. |
Consecutive patients (1995–2001) intractable low back pain (with or without leg pain) radiographically confirmed, unstable Grade I or II isthmic spondylolisthesis Single level L5–S1 or L4–L5 documented slip progression (3 mm or one Meyerding grade) under observation in the 2 years before surgery; or $3 mm translation and/or $22[1] of angulation as seen on standing flexion-extension or recumbent (prone) lateral radiographs. excluded greater than trace motor weakness; retrolisthesis, disc protrusion, painful disc injection, or instability of an adjacent segment; positive straight leg raising sign; metabolic bone disease; previous spinal surgery, other lumbar deformity (O15[1] scoliosis), or fracture; inflammatory arthritis/autoimmune disease. |
anterior mini-laparotomy (retroperitoneal approach), femoral ring allograft and buttress screw, Posterior instrumented fusion, pedicle screws, iliac crest autograft
n=47 |
Posterior instrumented fusion, pedicle screws, iliac crest autograft
N=46 |
6, 12 and 24 months |
VAS pain (6 months) Circ 29 (17) PLF 36 (17) ODI (6 months) Circ 22.4 (9.3) PLF 34.3 (11) |
Circumferential fusion better outcomes at 6 and 12 months |
|
Kim 2006 |
RCT Hospital Korea No funds were received in support of this work. No benefits in any form have been or will be received from a commercial party related directly or indirectly to the subject of this manuscript. |
disabling back and/or leg pain with or without neurologic symptoms refractory to at least 6 weeks of conservative treatment moderate-to-severe degree of neural canal stenosis in the relevant level based on MRI. Exclusion Acute spinal fracture, infection, tumor, revision, or a possibility of secondary gains from surgical fusion. litigious cases, including traffic accidents and workers’ compensation. |
PLIF (interbody cages (Harms titanium mesh cage; DePuy-AcroMed, Cleveland, OH)), Pedicle screw instrumentations (TSRH system; Sofamor-Danek, Memphis, TN) N=57 PLIF + PLF(interbody cages (Harms titanium mesh cage; DePuy-AcroMed, Cleveland, OH)), Pedicle screw instrumentations (TSRH system; Sofamor-Danek, Memphis, TN) Iliac crest autograft for PLF N=48 |
PLF Iliac crest autograft for PLF, Pedicle screw instrumentations (TSRH system; Sofamor-Danek, Memphis,TN)
N=62 |
6 months 1, 2, 3 years |
VAS leg pain (6 months) PLIF 8.7 (10.6) PLF/PLIF 9.8 (12) PLF 15.2 (12) p=0.099 VAS LBP (6 months) PLIF 13.1 (8.1) PLIF/PLF 15.2 (7.3) PLF 17.3 (10.7) p=0.127 ODI (1 year) PLIF 21.7 (11) PLF/PLIF 21.6 11 PLF 26.3 (10) p=0.099 |
No relevant differences |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Risk of bias assessment – Scoring definitions
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 29-05-2017
Beoordeeld op geldigheid : 22-04-2017
Uiterlijk in 2021 bepaalt het bestuur van de NOV of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NOV is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel van de richtlijn
Het doel van deze richtlijn is het ontwikkelen van een eenduidige indicatiestelling voor geïnstrumenteerde wervelkolomchirurgie (operaties met gebruik van spinale implantaten) en het beoordelen van de effectiviteit van dergelijke ingrepen bij degeneratieve aandoeningen van de thoracolumbosacrale wervelkolom. Deze ingrepen beogen correctie en/of stabilisatie van de wervelkolom, al dan niet gepaard met neurologische decompressie. In de praktijk betreft het voornamelijk patiënten met degeneratieve scoliose, spondylolysis/spondylolisthesis, of patiënten met chronische lage rug- en/of beenpijn verondersteld te zijn veroorzaakt door discusdegeneratie en/of facetartrose die op beeldvorming werd geconstateerd.
Deze richtlijn beoogt een bijdrage te leveren aan het verhogen van de kwaliteit van zorg met betrekking tot de geïnstrumenteerde operatieve behandeling van degeneratieve wervelkolomaandoeningen. Daarbij is tevens het doel om middels heldere, eenduidige indicatiestelling ongewenste praktijkvariatie terug te dringen.
Afbakening van de richtlijn
De richtlijn richt zich op alle patiënten:
- van 18 jaar en ouder;
- met langer dan drie maanden bestaande rug- en/of beenpijn op basis van degeneratieve aandoeningen van de thoracolumbosacrale wervelkolom;
- bij wie conservatieve behandeling, indien geïndiceerd, met multidisciplinaire gestructureerde oefenprogramma’s inclusief psychologische screening en eventuele pijninterventies, onvoldoende baat heeft gehad;
- die door hun klachten dermate ernstig zijn geïnvalideerd dat ze gemotiveerd zijn om een wervelkomingreep met bijbehorende herstelfase en revalidatie te doorlopen.
Specifiek gaat het in deze richtlijn om de volgende patiëntencategorieën:
- lumbale spondylolysis / laaggradige (graad I of II) spondylolisthesis: patiënten met degeneratieve spondylolisthesis, spondylolysis of spondylolytische spondylolisthesis. Laaggradige lumbale spondylolisthesis kan gepaard gaan met rugpijn en/of radiculaire of niet-radiculaire beenpijn of neurogene claudicatie;
- adulte deformiteiten: het betreft hier patiënten met degeneratieve scoliose op basis van progressie van een reeds bestaande idiopathische scoliose, dan wel patiënten met een nieuw ontstane “De Novo” scoliose van de lumbale wervelkolom; daarnaast patiënten met een alignementsstoornis of deformiteit van de wervelkolom na trauma, tumor, infectie of chirurgie aan de wervelkolom in het verleden;
- chronische lage rug- en/of beenpijn: patiënten met lage rugpijn bij facetarthrosis of discusdegeneratie op röntgenfoto en/of MRI (osteofyten, discusversmalling, black discs, Modic veranderingen, annulus scheuren).
Instrumentatie betekent hier het gebruik van spinale implantaten. Hieronder vallen schroef-/haak- en staafconstructies, intervertebrale cages, discusprotheses en interspinosale spacers.
Deze richtlijn gaat niet over patiënten die geïnstrumenteerde chirurgie van de thoracolumbosacrale wervelkolom ondergaan wegens een tumor, infectie, fractuur of een congenitale afwijking. Zoals reeds vermeld zal voor ongeïnstrumenteerde operatieve behandeling bij HNP en lumbale kanaalstenose een separaat, hieraan gekoppelde richtlijn worden ontwikkeld, welke start in 2015. Ook operatieve behandeling van de cervicale wervelkolom valt buiten de huidige richtlijn.
Beoogde gebruikers van de richtlijn
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met degeneratieve aandoeningen van de wervelkolom, voor patiënten en voor beleidsmedewerkers in de gezondheidszorg: In het bijzonder is de richtlijn opgesteld voor orthopedisch chirurgen en neurochirurgen die zich bezighouden met de operatieve behandeling van degeneratieve aandoeningen van de wervelkolom. Daarnaast biedt de richtlijn houvast voor anesthesiologen en andere (para)medici die betrokken zijn bij de zorg voor patiënten met degeneratieve aandoeningen van de wervelkolom.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2013 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met aspecifieke degeneratieve rugklachten, spondylolisthesis en scoliose te maken hebben (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende drie jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. P.C. Willems, orthopedisch chirurg, Maastricht universitair medisch centrum, namens de Nederlandse Orthopaedische Vereniging (NOV), (voorzitter)
- Drs. E.A. Hoebink, othopedisch chirurg, Amphia ziekenhuis Breda, namens de NOV
- Prof. dr. B.J. van Royen, othopedisch chirurg, VUMC Amsterdam, namens de NOV
- Dr. G.J. Bouma, Amsterdam Medisch Centrum UvA, namens de Nederlandse Vereniging voor Neurochirurgie (NVvN)
- Dr. M.P. Arts, MC Haaglanden, namens de NVvN
- Dr. J.M.A. Kuijlen, Universitair Medisch Centrum Groningen, namens de NVvN
- Dhr. L. Voogt, namens de Nederlandse Vereniging voor Rugpatiënten
- Drs. M.A.M.B. Terheggen, Rijnstate ziekenhuis Arnhem, namens de Nederlandse Vereniging voor Anesthesiologie
- Dr. H. van de Meent, Radboud Universitair Medisch Centrum Nijmegen namens de Vereniging van Revalidatieartsen
- Dr. T. Hoogeboom, IQ Healthcare Nijmegen, namens het Koninklijk Nederlands Genootschap voor Fysiotherapie
- Dr. C.G.J. Saris, Radboud Universitair Medisch Centrum Nijmegen, namens de Nederlandse Vereniging voor Neurologie
Met ondersteuning van:
- Dr. M.L. Molag, adviseur, Kennisinstituut van Medisch Specialisten Utrecht
Met dank aan:
- Dr. W.H.G. Jacobs, epidemioloog, Dutch Spine Society
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen door middel van reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. Een overzicht van de ingevulde belangenverklaringen vindt u bij de verantwoording.
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname van een vertegenwoordiger van patiëntenvereniging de Wervelkolom aan de werkgroep. Er werd reeds een focusgroep gehouden met rugpatiënten tijdens de ontwikkeling van de richtlijn Wervelkolom gerelateerde pijnklachten, een belangrijk uitgangspunt voor de huidige richtlijn. Afgesproken werd om voor deze richtlijn geen nieuwe focusgroep te houden. De conceptrichtlijn zullen we tijdens de commentaarfase laten lezen door rugpatiënten via de Wervelkolom om op die manier hun input op de aanbevelingen te kunnen gebruiken. De verslagen van de invitational conference en focusgroep zijn besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Het verslag is te vinden in de bijlage.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwalititeit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreecollaboration.org), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen tijdens een invitational conference met de Vereniging van Scoliosepatiënten, patiëntenvereniging de Wervelkolom, zorgverzekeraars, Inspectie voor de Gezondheidszorg en Zorginstituut Nederland en door een focusgroepbijeenkomst met patiënten. Een verslag hiervan kunt u vinden onder aanverwante items.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk en onbelangrijk.
Als relevante uitkomstmaten waarop studies zullen worden geselecteerd en beoordeeld heeft de werkgroep gekozen:
- pijn middels een Visual Analogue Scale (VAS-beenpijn, VAS-rugpijn);
- functionele beperkingen middels gevalideerde vragenlijsten, zoals Oswestry Disability Index (ODI), Quebec Back Pain Disability Scale (QBPDS) of Roland Morris Disability Questionnaire (RMDQ);
- kwaliteit van Leven middels EuroQoL, EQ5D, SF-36;
- patiënt-tevredenheid.
De werkgroep wil benadrukken dat een deel van de vastgestelde conclusies sterk samenhangt met de door de werkgroep vastgestelde klinisch relevante verschillen tussen groepen patiënten die in studies zijn vergeleken. Klinisch relevante verschillen werden door de werkgroep vastgesteld op basis van een consensus—artikel van Ostelo (Ref Ostelo, Spine 2008). De resultaten kunnen uiteraard anders uitpakken als deze grenzen tussen succes en falen iets hoger of lager worden gelegd.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en naar systematische reviews in Medline, Cochrane en Cinahl. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld door de adviseur en medisch specialist, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook opgenomen in een meta-analyse.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) voor interventievragen:
de kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/) (Atkins, 2004).
B) voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose:
bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden. De bewijskracht van de conclusie is bepaald volgens de gebruikelijke EBRO-methode (Van Everdingen, 2004).
Formuleren van de conclusies
Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusies, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module ‘Organisatie van zorg bij spinaalchirurgie’.
Indicatorontwikkeling
De werkgroep kiest ervoor om aan te sluiten bij de Kwaliteitsindicatoren die door het DICA worden uitgevraagd in het kader van de Dutch Spine Registry.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is, dat is aangegeven waar van toepassing.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuur
- Appraisal of Guidelines for Research & Evaluation II, www.agreecollaboration.org.
- Atkins D, Best D, Briss PA, et al. Grading quality of evidence and strength of recommendations. BMJ 2004;328(7454):1490.
- Van Everdingen JJE, Burgers JS, Assendelft WJJ, et al. Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum, 2004.
Zoekverantwoording
Zoekverantwoording overkoepelende search gericht op indicatiestelling en type chirurgische ingreep (28-01-2014) zie de module ‘Chirurgische ingrepen bij spinaalchirurgie’.
Zoekverantwoording search Chirurgische ingrepen
|
Database |
Zoektermen |
Totaal |
|
Pubmed |
("Spondylosis"[Mesh] OR "Spondylolisthesis"[Mesh] OR "degenerative spondylolisthesis"[TIAB] OR "Isthmic"[TIAB] OR "Lytic"[TIAB] OR "Lumbar vertebrae"[MH] OR "Spinal Curvatures"[Mesh] OR "adult deformity"[TIAB] OR "Scoliosis"[Mesh] OR "scoliosis"[TIAB] OR "degenerative disc disease"[TIAB] OR "degenerative lumbar spine"[TIAB] OR "Intervertebral Disc Degeneration"[Mesh] OR "Chronic low back pain"[TIAB] OR "Low Back Pain"[Mesh]) AND ("Fusion"[TIAB] OR "Spondylodesis"[TIAB] OR "Lumbar fusion"[TIAB] OR "spinal fusion"[TIAB] OR "Spinal Fusion"[Mesh] OR "instrumentation"[TIAB] OR "Internal Fixators"[Mesh] OR "cage"[TIAB] OR "screws"[TIAB] OR "intercorporal"[TIAB] OR "Posterior interbody fusion"[TIAB] OR "Posterior lumbar interbody fusion"[TIAB] OR "PLIF"[TIAB] OR "Posterolateral fusion"[TIAB] OR "Postero-lateral fusion"[TIAB] OR "PLF"[TIAB] OR "Posterolateral fusion"[TIAB] OR "anterior interbody fusion"[TIAB] OR "anterior lumbar interbody fusion"[TIAB] OR "ALIF"[TIAB] OR "XLIF"[TIAB] OR "intertransverse process arthrodesis"[TIAB] OR "circumferential"[TIAB] OR "minimal invasive"[TIAB] OR "minimal access"[TIAB] OR "Surgical Procedures, Minimally Invasive"[Mesh]) AND ("lumbar spine"[TIAB] OR "Lumbar vertebrae"[TIAB] OR "Lumbar Vertebrae"[Mesh] OR "Thoracic spine"[TIAB] OR "thoracic vertebrae"[TIAB] OR "thoracic Vertebrae"[Mesh] OR ("spine"[TIAB] OR "spine"[MH] OR "spinal"[TIAB]) AND ("lumbar"[TIAB] OR "thoracic"[TIAB])) AND ("Randomized controlled trial"[PT] OR "Controlled clinical trial"[PT] OR "Comparative Study" [PT] OR "Clinical trial"[PT] OR "Trial"[TIAB] OR "Random"[TIAB] OR "Randomized"[TIAB] OR "Randomised"[TIAB] OR "Randomly"[TIAB] OR "Controlled"[TIAB] OR "comparison"[TIAB] OR "Prospective*"[TIAB]) AND 2000:2014[dp] |
2309 hits |
|
Embase
|
See below
|
1447, 725 unique |
|
Cochrane |
Limits: (2000-2014, trials) |
480, 130 unique |
Aantal hits: 3161
Dups, non-english: 294
Total 2867
Selectie: 1001-2000, 15/16 inclusies. kappa 0.44.
|
|
Searche EMbase |
Results |
|
1 |
exp spondylosis/ |
6116 |
|
2 |
spondylolisthesis/ |
5593 |
|
3 |
"degenerative spondylolisthesis".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
810 |
|
4 |
"Isthmic".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
2239 |
|
5 |
"Lytic".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
20681 |
|
6 |
lumbar vertebra/ |
14568 |
|
7 |
"Spinal Curvatures".mp. |
164 |
|
8 |
"adult deformity".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
148 |
|
9 |
scoliosis/ |
17227 |
|
10 |
" Scoliosis ".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
22840 |
|
11 |
"degenerative disc disease".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
1642 |
|
12 |
"degenerative lumbar spine".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
179 |
|
13 |
intervertebral disk degeneration/ |
6066 |
|
14 |
"Chronic low back pain".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
5099 |
|
15 |
"Low Back Pain".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
40398 |
|
16 |
1 or 2 or 3 or 4 or 5 or 6 or 7 or 8 or 9 or 10 or 11 or 12 or 13 or 14 or 15 |
110713 |
|
17 |
Fusion.mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
178111 |
|
18 |
Spondylodesis.mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
1731 |
|
19 |
"Lumbar fusion".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
1494 |
|
20 |
"spinal fusion".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
5401 |
|
21 |
spine fusion/ |
15700 |
|
22 |
((spine or spinal) and instrumentation).mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
11473 |
|
23 |
internal fixator/ |
1077 |
|
24 |
cage.mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
21248 |
|
25 |
screws.mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
15121 |
|
26 |
intercorporal.mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
82 |
|
27 |
"Posterior interbody fusion".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
102 |
|
28 |
"Posterior lumbar interbody fusion".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
737 |
|
29 |
PLIF.mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
688 |
|
30 |
"Posterolateral fusion".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
790 |
|
31 |
"Postero-lateral fusion".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
35 |
|
32 |
PLF.mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
721 |
|
33 |
"Posterolateral fusion".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
790 |
|
34 |
"anterior interbody fusion".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
373 |
|
35 |
"anterior lumbar interbody fusion".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
597 |
|
36 |
ALIF.mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
386 |
|
37 |
XLIF.mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
141 |
|
38 |
"intertransverse process arthrodesis".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
32 |
|
39 |
circumferential.mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
17468 |
|
40 |
"minimal invasive".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
5172 |
|
41 |
"minimal access".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
1861 |
|
42 |
minimally invasive surgery/ |
24365 |
|
43 |
17 or 18 or 19 or 20 or 21 or 22 or 23 or 24 or 25 or 26 or 27 or 28 or 29 or 30 or 31 or 32 or 33 or 34 or 35 or 36 or 37 or 38 or 39 or 40 or 41 or 42 |
261949 |
|
44 |
"lumbar spine".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
40771 |
|
45 |
"Lumbar vertebrae".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
3878 |
|
46 |
lumbar vertebra/ |
14568 |
|
47 |
"thoracic vertebrae".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
1312 |
|
48 |
"Thoracic spine".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
9716 |
|
49 |
vertebra/ |
12134 |
|
50 |
((spine or spinal) and (lumbar or thoracic)).mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
94511 |
|
51 |
44 or 45 or 46 or 47 or 48 or 49 or 50 |
107658 |
|
52 |
"Randomized controlled trial".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
406666 |
|
53 |
"Controlled clinical trial".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
392653 |
|
54 |
"Comparative Study".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
676876 |
|
55 |
"Clinical trial".mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
991272 |
|
56 |
Random.mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
197104 |
|
57 |
Randomized.mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
612206 |
|
58 |
Randomised.mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
82556 |
|
59 |
Randomly.mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
264254 |
|
60 |
Controlled.mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
4788952 |
|
61 |
comparison.mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
1184586 |
|
62 |
Prospective.mp. [mp=title, abstract, subject headings, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] |
554613 |
|
63 |
52 or 53 or 54 or 55 or 56 or 57 or 58 or 59 or 60 or 61 or 62 |
6949415 |
|
64 |
16 and 43 and 51 and 63 |
3103 |
|
65 |
limit 64 to (human and english language and embase and yr="2000 - 2014") |
1874 |
|
66 |
65 and "Journal: Article" [Publication Type] |
1447 |
