MRI bij hartklepprothese, annuloplastiekring of mitraclip
Uitgangsvraag
Kan een patiënt met een artificiële hartklepprothese, annuloplastiekring of een mitraclip een MRI-onderzoek ondergaan?
Aanbeveling
Scan de patiënt met een hartklepprothese, annuloplastiekring of mitraclip met een ‘whole body’ MRI-systeem van 1,5T of 3T met een horizontale en gesloten supergeleidende magneet; zonder verdere voorwaarden.
Overwegingen
Samenvatting informatie van implantaatfabrikanten
De databases van MagResource (MR:comp GmbH, Gelsenkirchen, Duitsland) en MRISafety.com zijn doorzocht op informatie over hartkleppen en annuloplastiekringen. De database van MagResource is op 6 april 2018 doorzocht met de zoekterm “heart valve” in het veld “generic”. Er werden 690 resultaten gevonden, waarbij soms verschillende (sub-) typen en afmetingen apart werden weergegeven en soms als combinatie. Na combinatie tot hoofdtypen gaf dit 288 resultaten. Deze zijn aangevuld met 38 extra hartkleppen gevonden in de database van MRISafety.com in de periode mei-juni 2018. De gevonden gegevens van deze 326 hoofdtypen hartkleppen en annuloplastiekringen zijn geanalyseerd.
Deze hoofdtypen hartkleppen en ringen in het verzamelde overzicht zijn MR veilig of MR voorwaardelijk:
- 43x MR veilig volgens ASTM-2013;
- 25x MR veilig volgens de oude ASTM-definitie (ook genoemd MR compatibel, vaak corresponderend met MR voorwaardelijk volgens de huidige definitie met beperking van veldsterkte);
- 17x MR veilig volgens MRIsafety.com maar volgens de fabrikanteninformatie in MagResource MR voorwaardelijk;
- 240x MR voorwaardelijk.
Van slechts één type van deze implantaten is de classificatie onbekend, aangezien de fabrikant (om onduidelijke redenen) niet in staat is hierover te adviseren. Het gaat om de annuloplastiekring van Carpentier-Edwards model 4400 en 4500, verkocht tussen 1980 en 1983, gemaakt van roestvaststaal (RVS). Het bewuste type ring wordt nog steeds geproduceerd, maar wordt vanaf 1984 van titanium gemaakt. De versie vervaardigd van titanium is als MR voorwaardelijk geclassificeerd, met als voorwaarde 3T of lager.
Bij de implantaten geclassificeerd als MR voorwaardelijk worden door de fabrikant limieten gesteld voor de maximale gradiëntsterkte van het statische magnetisch veld en op het maximale SAR-niveau. De limieten voor de maximale gradiëntsterkte variëren tussen de 3,9 en de 30 T/m (390 en 3000 Gauss/cm). In figuur 2A is weergegeven hoe vaak een limiet voorkomt voor de hartkleppen en annuloplastiekringen die gevonden zijn in de MagResource-database. De meest voorkomende limietwaarde is 7,2 T/m, de maximale gradiëntsterkte-testwaarde volgens de ASTM-standaard uit 2013. Ook valt op dat fabrikanten vaak een hogere maximale gradiëntsterkte adviseren. Geen van de fabrikanten geeft aan dat er sprake is van aantrekking van het implantaat bij de maximale gradiëntsterkte, deze gerapporteerde waarde komt waarschijnlijk voort uit de maximale testconditie waaronder het implantaat is getest.
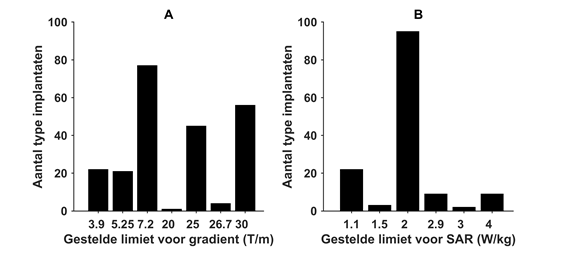
Figuur 2: Aantal keer dat een bepaalde gradiëntlimiet door de fabrikant gesteld wordt (A) en aantal keer dat een bepaalde SAR-limiet door de fabrikant gesteld wordt (B).
De maximale SAR-niveaus die fabrikanten aangeven, variëren sterk (zie figuur 2B). Ook hier valt op dat de gestelde conditie in de ASTM-standaard (2 W/kg) het meest gebruikt wordt door de fabrikanten.
Sommige fabrikanten rapporteren ook een verwachte of een gemeten temperatuurstijging bij de gestelde SAR-conditie weergegeven in figuur 3A en figuur 3B. Deze metingen zijn verricht ex vivo volgens de ASTM-standaard waarbij de opwarming is gemeten in een gelfantoom waarin het implantaat is ingebracht. Hierbij wordt er geen rekening gehouden met de koeling door de bloedsomloop. Van een aantal type implantaten (n=75) rapporteren fabrikanten zowel temperatuursverhogingen voor zowel 1,5 als 3T. Hierbij is er geen wezenlijk verschil in opwarming tussen deze twee veldsterkten te zien. Uit al deze metingen is de maximale gemeten temperatuursverhoging 3,5 graden Celsius bij 2 W/kg, en is de gemiddeld gemeten temperatuursverhoging voor een klep/ring een factor 2 lager.
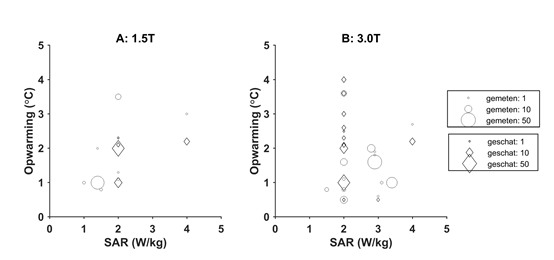
Figuur 3: Door fabrikanten geschatte (◊) en gemeten maximale (o) opwarming door RF in een gelfantoom met implantaat bij 1,5 T (A) en 3,0 T (B). De grootte van de symbolen is evenredig met het aantal gerapporteerde waarden van verschillende typen kleppen en/of ringen.
Fabrikant informatie van mitraclips: er is momenteel slechts één fabrikant die mitraclips op de markt brengt, Abbott Vascular. Deze clips zijn door de fabrikant geclassificeerd als MR voorwaardelijk. De voorwaarden zijn tot en met 3T, maximale spatiële gradiënt van 25 T/m, en ‘whole body’ SAR van 3 W/kg voor 15 minuten scannen. In vitro is onder deze condities een temperatuursverhoging van minder dan 1°C gemeten. De artefactgrootte was in een orde van 6 tot 7 cm bij 3T.
Samenvatting informatie uit incidentdatabases van implantaten.
Voor deze module zijn de volgende incident databases van implantaten doorzocht:
- de recall database van de FDA;
- de database van de Inspectie Gezondheidszorg en Jeugd (IGJ) met veiligheidsmeldingen vanaf 15 december 2015;
- het archief van Inspectie Gezondheidszorg (IGZ);
- de ‘Implant’ en ‘Event’ database van de het International Consortium of Investigative Journalists (ICIJ).
De zoekverantwoording in deze databases is te vinden in de tabel ‘Zoekverantwoording Databases van Recalls en Events’. In geen van deze databases zijn meldingen gevonden die relevant zijn voor deze richtlijn module.
Indeling risico’s implantaten in hoofdklassen
In het algemeen kunnen risico’s van metallische implantaten in de MRI in de volgende hoofdklassen ingedeeld worden:
- Risico op verplaatsing en rotatie van het implantaat door de aanwezigheid van het statische magneetveld en de spatiële gradiënt van dit veld.
- Risico op opwarming van het implantaat door interactie met het RF-veld.
- Risico op trilling of inductie van stromen door de oscillerende magnetische veldgradiënten die worden toegepast voor de ruimtelijke codering van het MRI-signaal.
- Artefact in het MRI-beeld.
- Risico van krachten door het Lenz-effect bij snelle beweging van geleidende implantaten in het statisch magnetisch veld van de MRI-scanner.
- Risico op verstoring van de werking van het implantaat.
Een aantal reviews en statements van verschillende organisaties of gerenommeerde onderzoekers geeft al sinds 2004 aan dat de risico’s van de MRI-scan voor de patiënt met een hartklepprothese of annuloplastiekring verwaarloosbaar klein zijn (Prasad, 2004; Shellock, 2004; Levine; 2007; Dill, 2008; Grainger, 2015). Dit wordt verder gestaafd door het ontbreken van cases waarbij complicaties zijn opgetreden tijdens of na een MRI-scan van patiënten met een klepprothese (Levine, 2007; ook in periode 2007 tot 2018 zijn geen cases geïdentificeerd met de systematische literatuur search, en de incident database search).
Op basis van deze informatie is bij vele patiënten in Nederland met hartklepprothesen en ringen een MRI-onderzoek uitgevoerd omdat de voordelen van de scan (betere diagnostiek of zelfs noodzakelijke MRI voor diagnostiek) groter geacht worden dan het risico van het ondergaan van de MRI-scan voor de patiënt. Ofschoon hiervan weinig gedocumenteerd is omtrent MRI-veiligheid van hartklepprothesen zijn er ook geen aanwijzingen voor risico’s.
De te verwachten effecten hangen af van de gebruikte materialen. Sinds 2000 is er bij fabrikanten van hartklepprothesen aandacht voor MRI-compatibiliteit en wordt hier bij de materiaalkeuze van nieuwe hartkleppen rekening mee gehouden. Daarom is de verwachting dat er geen MR-onveilige hartkleppen en annuloplastiekringen op de markt komen, en dat nieuwe modellen waarschijnlijk in een MRI van 1,5T of 3T gescand mogen worden. Indien er in de toekomst andere typen hartkleppen op de markt komen, bijvoorbeeld voorzien van elektronica of sensoren, dan moeten vanzelfsprekend voor deze typen de specifieke instructies van fabrikanten met betrekking tot de MR-veiligheid opgevolgd worden. Mochten dit soort kleppen op de markt komen dan zal overwogen moeten worden deze richtlijn hierop aan te passen.
1. Risico’s als gevolg van verplaatsing en rotatie
Fabrikanten stellen regelmatig beperkingen aan de maximale veldgradiënt. Doorgaans is dit 7,2 T/m, omdat dit de maximale gradiënt is waaraan de prothese is blootgesteld tijdens de testsituatie. Deze gradiënt is daarmee bewezen veilig, maar dit impliceert niet dat een sterkere veldgradiënt onveilig is. Gebaseerd op de eigenschappen van de huidige klinische MRI-scanners stelt de werkgroep vast dat er geen problemen met veldgradiënten bij horizontale en gesloten supergeleidende MRI-magneten tot en met 3T te verwachten zijn en worden er in de richtlijn derhalve geen voorwaarden voor opgenomen.
Tenslotte is er nog een type annuloplastiekring waarvan de MR-classificering niet is vastgesteld; model 4400 en 4500 van Carpentier-Edwards, verkocht tussen 1980 en 1983. Onbekend is of dit type klep voorkomt in de Nederlandse patiëntenpopulatie. Deze twee modellen van de Carpentier-Edwards Classic Annuloplasty Ring zijn gemaakt van een licht ferromagnetisch RVS, zoals blijkt uit experimenten die door Shellock bij 1,5 en 3T aan model 4400 zijn uitgevoerd [Shellock, 2001 en 2002]. Daarom acht de werkgroep dat deze niet MR onveilig zijn tot 3T, en dat de aantrekkingskrachten door de MR-scanner klein zijn ten opzichte van de krachten die in vivo in het werkend hart optreden, deze laatste liggen in de orde van 7,2 N (Soulen, 1985 en 1986). Tenslotte is er in de literatuur nooit melding gedaan van incidenten van dit type ring naar aanleiding van MRI.
2. Risico op opwarming van het implantaat door interactie met het RF-veld
Veel hartkleppen en -ringen worden als MR voorwaardelijk geclassificeerd door de fabrikant, met een beperking van het SAR-niveau, veelal ‘whole body’ SAR maximaal 2 W/kg, om weefselopwarming door het implantaat te limiteren. Deze classificering wordt gebaseerd op ex vivo-metingen volgens de ASTM-F2182 standaard (ASTM, 2002). Deze richtlijn stelt dat de temperatuursverhoging van een implantaat wordt gemeten door deze in een gel in de MRI-scanner bloot te stellen aan RF-straling. De fabrikanten rapporteren typisch uit deze test de maximaal gemeten temperatuursverhoging in het gelfantoom met implantaat; gemiddeld zo’n 1,5°C en maximaal 3,5°C. Echter zonder implantaat geeft deze test ook al een aanzienlijke temperatuursverhoging, welke niet wordt gerapporteerd. In de ASTM-richtlijn wordt aangegeven dat naast een meting nabij het implantaat zowel een referentiemeting in het fantoom als ook een herhaalde meting zonder implantaat moet worden uitgevoerd. In de wetenschappelijke literatuur wordt dit effect iets beter gerapporteerd, zie figuur 1. Aldaar is zichtbaar dat de additionele opwarming als gevolg van het implantaat beperkt is tot maximaal 0,8°C. Ook op theoretische gronden, gezien de golflengte van de RF en de fysieke grootte van de hartkleppen en ringen, verwacht de werkgroep dat de opwarming door RF bij 1,5 en 3T beperkt zal zijn.
De ASTM-richtlijn staat toe rekening te houden met additionele factoren zoals verhoogd warmtetransport door stromend bloed, waardoor de werkelijke temperatuursverhoging in vivo lager is dan gemeten in een gelfantoom. Een dergelijke correctie vereist echter extra inspanning van een fabrikant en aangezien er geen gevolgen zijn voor de marktwerking gebeurt dit in de praktijk niet. Hartkleppen worden eenduidig geïmplanteerd op een locatie (het hart) waar warmtetransport door stromende bloed - in tegenstelling tot de proeven in een gel - altijd van belang is. Dit betekent dat de daadwerkelijke maximale temperatuursverhoging van de hartklepprothese en de omgeving waarin deze geplaatst is in vivo lager uitvalt dan de temperatuursverhoging zoals die in een gel gemeten wordt, waarbij alleen warmtetransport via geleiding mogelijk is. In de wetenschappelijk literatuur is hierover weinig gepubliceerd. De werkgroep heeft aan een onderzoeksgroep van het UMCU gevraagd simulaties uit te voeren om enerzijds de verwachte opwarming van een klep of ring door RF in een gel-fantoom te bepalen en anderzijds het effect van koeling door perfusie te bepalen. Hieruit blijkt dat er door RF in een gel-fantoom opwarming kan ontstaan in de orde van enkele graden, maar dat de additionele opwarming als gevolg van een klep of ring veel kleiner is. Als vervolgens koeling door perfusie wordt meegenomen in de simulatie, dan is de opwarming van de klep of ring bij een RF belasting van 5 W/kg (het maximale niveau dat klinisch wordt gebruikt is 4 W/kg) kleiner dan 1°C. Zelfs in het geval dat de klep of ring resonant wordt gemaakt door elektrische capaciteiten toe te voegen in de simulatie (wat in de praktijk zeker niet het geval is), dan is de opwarming van het implantaat zonder perfusie slechts 1,5°C en met perfusie 0,7°C, bij een RF belasting van 5 W/kg (Stijnman, 2019).
In een deel van de Nederlandse ziekenhuizen zijn in de afgelopen jaren patiënten met hartklepprothesen zonder extra SAR-beperkingen (limiet whole body 4 W/kg) gescand bij 1,5T en 3T. Hierbij zijn voor zover bekend geen complicaties opgetreden.
Deze overwegingen tezamen leiden tot de conclusie dat SAR-beperking anders dan de gebruikelijke 4W/kg (“first level”) niet nodig is bij veldsterken tot en met 3T. Een SAR-beperking tot een lager niveau kan de kwaliteit van de beeldvorming negatief beïnvloeden en wordt daarom afgeraden, ook daar waar fabrikanten van kleppen of ringen wel een SAR-beperking als voorwaarde voor MRI stellen.
3. Risico op trilling of stroominductie door de oscillerende magnetische veldgradiënt
Het risico op trilling van of stroominductie in de hartklepprothese door de oscillerende magnetische veldgradiënt die wordt toegepast voor spatiële codering is verwaarloosbaar door het kleine oppervlak van interactie met de gradiëntvelden.
4. Artefact in het MRI-beeld
De aanwezigheid van een hartklepprothese heeft beperkte invloed op de beeldkwaliteit. Dit wordt in detail beschreven door Suchá (2015). Samengevat kan gesteld worden dat het signaalverlies beperkt is tot de nabijheid (< 1 cm) van de hartklep of ring indien deze geen ferromagnetische materialen bevat. Evaluatie van de hartfunctie door middel van cine beelden is doorgaans mogelijk. Bij hartkleppen die wel voorzien zijn van ferromagnetische materialen kan er bij gebruik van gradiënt-echotechnieken signaalverlies over een aanzienlijk groter gebied plaatsvinden, maar is het signaalverlies bij gebruik van spin-echotechnieken ook beperkt tot de directe nabijheid van de hartklep.
5. Gehinderde beweging van klepbladen
In de literatuur wordt naast bovengenoemde effecten het Lenz-effect beschreven. Dit effect ontstaat door het bewegen van een elektrisch geleidend voorwerp door een (statisch) magnetisch veld. Het resultaat is een (magnetische) kracht die de beweging tegenwerkt. De beweging van klepbladen zou hierdoor gehinderd kunnen worden.
Cordon (2000) beschrijft dit effect als relevant voor de werking van hartkleppen. De relevantie wordt echter ontkracht door een gedetailleerde modelstudie van Robertson (2000), waarin gerapporteerd wordt dat de kracht als gevolg van het Lenz-effect bij 1,5T minder dan 1% bedraagt van de krachten die door bloedstroming op de klep worden uitgeoefend, bij 3T bedraagt dit minder dan 4%. Theoretisch kan het Lenz effect relevant zijn voor de mitralisklep, die bij relatief kleine drukverschillen opent. Een theoretische studie door Golestanirad et al. (2012) laat zien dat het effect bij 1,5 T verwaarloosbaar klein is, maar wel mogelijk relevante effecten kan hebben bij 3T in geval van een mitralis hartklep met volledig metalen klepblad. Voor kleppen met slechts een dunne metalen versteviging blijken krachten door het Lenz effect verwaarloosbaar. Het primaire fysiologisch effect zou een vertraagde atriale inflow zijn over een mitralis of tricupidalus klep, vanwege de tegenwerkende kracht door het Lenz effect tijdens de klepbeweging.
Mitralis hartkleppen met volledig metalen klepbladen behoren (voor zover deze überhaupt gemaakt zijn) tot een oudere generatie hartkleppen. Voor zover bekend bij een geconsulteerde cardiochirurg zijn er nu geen mitralis kleppen met volledig metalen blad op de markt. Vanwege de diversiteit van kleppen op de markt is het lastig uit te sluiten dat deze wel bestaan, of weer geïntroduceerd zouden worden. De door Golestanirad et al. als voorbeeld genoemde klep is de Starr-Edwards 6500 klep. Deze werd tussen 1968 en 1970 geproduceerd (Morse, 2012) en is ca 2500 maal geïmplanteerd (Bonchek, 1973). Deze klep heeft inderdaad een volledig metalen klepblad, maar dit blad transleert, het roteert niet. De fluxveranderingen in het blad zijn derhalve nihil in een homogeen magneetveld (binnen de tunnel) en bij de in- en uitgang van de tunnel klein vergeleken met een rotatie in het isocentrum.
Er zijn wel diverse kleppen met roterende klepbladen op de markt die gemaakt zijn van pyrolitisch koolstof, wat een elektrisch geleidend materiaal is. Voorbeelden hiervan zijn Edwards Tekna en Medtronic Hall. De geleidbaarheid van pyrolitisch koolstof is echter meer dan een factor 106 lager dan titanium (Graham, 2010; website americanelements.com), waarmee Golestanirad de simulaties hadden uitgevoerd. De kracht door het Lenz effect schaalt met deze geleidbaarheid. De krachten door het Lenz effect op pyrolitisch koolstof kleppen zijn derhalve verwaarloosbaar klein ten opzichte van titanium kleppen.
Golestanirad gaat verder uit van een worst-case scenario dat naar oordeel van de werkgroep te zwaar is aangezet. In hun berekening wordt een openings- en sluitingstijd van de mitralisklep van 10 ms aangenomen. Een openingstijd van 50 ms lijkt realistischer voor zowel de aortaklep (Leyh, 1999) als voor de mitralisklep (Saito, 2006; Lynch, 1982; Yokote, 2019). Dit zou leiden tot een vijfmaal lagere kracht door het Lenz effect. Daarnaast is de oriëntatie van de mitralisklep niet loodrecht op het statisch magneetveld in een 1,5T of 3T scanner met een horizontale en gesloten supergeleidende magneet, wat een andere aanname in de berekening van Golestanirad is. Hierdoor zal de kracht ook significant zwakker zijn. In vitro metingen bij 1,5T door Edwards (2015) laten zien dat voor enkele kleppen een kleine afwijking in de beweging van de kleppen in het magneetveld optreedt, het effect van deze afwijking op de cardiale output is klein. Bij de ingang van de tunnel mag verwacht worden dat het Lenz effect door beweging in de gradiënt van het statisch veld vele malen kleiner is dan de effecten als gevolg van een 90 graden rotatie in 10 ms in de tunnel, omdat de snelheid van fluxverandering veel lager is.
In de literatuur en in incidentdatabases zijn er geen meldingen van patiëntencasuïstiek van problemen met hartkleppen bij MRI door het Lenz effect. Hiervoor zijn twee verklaringen mogelijk: de eerste verklaring is dat er voor zover bekend bij de werkgroep geen mitraliskleppen met volledig metalen bladen op de markt zijn gebracht, en de tweede verklaring is dat indien er wel mitraliskleppen op de markt zijn gebracht met een volledig metalen draaiend blad, er geen merkbaar effect is op de fysiologie.
Concluderend acht de werkgroep de kans op nadelige effecten op de patiënt als gevolg van het Lenz effect op de hartklep verwaarloosbaar bij 1,5T en 3T horizontale gesloten supergeleidende MRI systemen.
6. Risico op verstoring van de werking van het implantaat
Het enige potentiële risico betreft hier het bovengenoemde Lenz effect.
Mitraclips
Ook de mitraclips zijn in de aanbevelingen van deze module meegenomen. Deze hartimplantaten zijn buiten beschouwing gebleven in de systematische literatuuranalyse omdat dit type implantaat pas later in het proces voor de volledigheid is opgenomen in deze module. Gezien de overwegingen voor kleppen en ringen zoals vermeld in deze module worden deze mitraclips ook beschouwd als ‘MR Toegestaan voor 1,5 en 3T’, ondanks de MR-voorwaarden van de fabrikant.
Onderbouwing
Achtergrond
Er bestaat een grote variëteit aan typen hartklepprothesen en annuloplastiekringen, waarvoor evenzoveel specifieke condities gelden voor het uitvoeren van een MRI-onderzoek bij patiënten met een hartklep- of annuloplastiekring. Veel van deze door fabrikanten opgestelde condities zijn dusdanig conservatief dat bij grote aantallen patiënten mogelijk onnodig diagnostiek wordt beperkt of onthouden. Er is een grote variatie tussen ziekenhuizen hoe hiermee wordt omgegaan. Daarnaast is het type hartklep of het veiligheidsprofiel van de hartklep in sommige gevallen onbekend. Ook hierbij variëren ziekenhuizen in hun beleid rondom screening en gebruik van MRI. Het gaat hierbij om alle MRI-onderzoeken ook anders dan een MRI van het hart. Ook bij onderzoeken aan andere lichaamsdelen is de compatibiliteit van de hartklep met een MRI-scanner van belang.
In deze module zijn zowel hartklepprothesen als annuloplastiekringen in beschouwing genomen. In de tekst van deze module worden met de term “hartklepprothesen” of “hartklep” tevens annuloplastiekringen bedoeld. Voor de volledigheid zijn ook de mitraclips in de aanbevelingen van deze module meegenomen. Deze zijn buiten beschouwing gelaten in de systematische literatuuranalyse, maar kwamen later in het proces in beeld. Gezien het beperkt aantal typen mitraclips dat op de markt is, kon dit alsnog meegenomen worden in de aanbeveling.
Conclusies / Summary of Findings
|
- GRADE |
Met MRI-onderzoek op 3T of lager zijn geen interacties tussen een hartklepprothese en de door de MRI-scanner veroorzaakte magneetvelden en radiofrequente golven gedetecteerd die schadelijk kunnen zijn voor de patiënt.
Bronnen (Edwards, 2000; Edwards, 2002; Edwards, 2005a; Pruefer, 2001; Randall, 1988; Saeedi, 2015; Shellock, 1988; Shellock, 1994; Shellock, 2001; Shellock, 2002; Soulen, 1985) |
|
- GRADE |
Het is onwaarschijnlijk dat patiënten met degeneratief kleplijden een groter risico hebben op het losraken van de klep als gevolg van MRI-onderzoek.
Bronnen (Edwards, 2005b) |
|
Zeer laag GRADE |
Er is zeer beperkt bewijs dat MRI-onderzoek tot 1,5T geen hartritmestoornissen veroorzaakt bij patiënten met een artificiële hartklep.
Bronnen (Hartnell, 1997; Randall, 1988) |
Samenvatting literatuur
Ex vivo onderzoek
Elf studies onderzoeken ex vivo (buiten het lichaam) de interacties die optreden tussen hartklepprothesen en de door de MRI-scanner veroorzaakte magneetvelden en radiofrequente golven, waaronder één studie die tevens in vivo effecten (in het lichaam) onderzoekt (Edwards, 2000; Edwards, 2002; Edwards, 2005a; Pruefer, 2001; Randall, 1988; Saeedi, 2015; Shellock, 1988; Shellock, 1994; Shellock, 2001; Shellock, 2002; Soulen, 1985). In deze studies wordt MRI-apparatuur variërend van 0,35 tot 4,7 Tesla gebruikt. Er worden geen interacties gedetecteerd die schadelijk kunnen zijn voor de patiënt.
Details over welke hartklepprothese(n) zijn onderzocht, met welke apparatuur en welke interacties er werden gemeten, zijn beschreven in de evidencetabel.
In de studie van Edwards (2005b) wordt ex vivo onderzoek gedaan naar het effect van krachten veroorzaakt door de MRI-scanner op verouderd hartklepweefsel. Hierbij wordt bij 18 weefselmonsters, uitgesneden tijdens routineoperaties voor hartklepvervanging, getest hoeveel kracht er nodig is om het weefsel te laten scheuren en de hechtdraad volledig los te maken van het hartklepweefsel. Degeneratieve verkalking en stijfheid van het weefsel waren significant van invloed op de maximaal benodigde kracht om het weefsel te laten scheuren. De benodigde krachten zijn echter groter dan de krachten die een 4,7T MRI-scanner op de prothese veroorzaakt. Het is daarom onwaarschijnlijk dat patiënten met degeneratief kleplijden een groter risico lopen op het losraken van de klep als gevolg van MRI-onderzoek.
In verschillende studies zijn ex vivo temperatuursmetingen uitgevoerd om de opwarming als gevolg van de RF te meten [Soulen, 1985; Hassler, 1986, Randall, 1988; Shellock 94; Edwards, 2000; Shellock, 2001; Pruefer, 2001; Saeedi, 2015]. In figuur 1 worden deze metingen samengevat. In de meeste studies zijn naast de temperatuursverhoging in het fantoom bij het implantaat ook referentiemetingen uitgevoerd niet bij het implantaat maar met dezelfde RF-belasting, zoals beschreven in de ASTM-standaard (ASTM, 2002). Deze referentiemetingen laten door MR temperatuursstijgingen zien van 0,2 tot 0,5°C, behalve bij de enige meting volgens de ASTM-standaard met een temperatuursverhoging van 0,8°C door de klep, met een referentiemeting van 1,7°C (Saeedi, 2015).
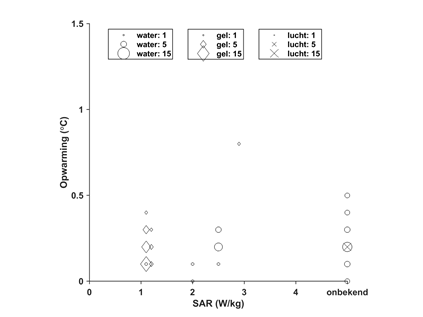
Figuur 1: Gemeten opwarming bij een implantaat in een fantoom van gel (◊), water (o), of lucht (X) (Soulen, 1985; Hassler, 1986, Randall, 1988; Shellock 94; Edwards, 2000; Shellock, 2001; Pruefer, 2001; Saeedi, 2015). In een aantal studies is de gebruikte SAR-waarde niet gerapporteerd, deze staan rechts weergegeven. De temperatuursstijging ten opzichte van de referentiemeting is weergegeven, als er geen referentie meting gerapporteerd zijn, is de absolute temperatuursstijging weergegeven. De metingen zijn voor het merendeel uitgevoerd bij 1,5T (met daarnaast een aantal datapunten bij 0,35 en 0,5T en één datapunt bij 3T). De grootte van de symbolen is evenredig met het aantal gerapporteerde waarden van verschillende typen kleppen en/of ringen.
In vivo-onderzoek
Hartnell (1997) onderzocht het optreden van ritmestoornissen zichtbaar op ECG of blijkend uit klinische symptomen tijdens MRI-onderzoek met een 1 of 1,5T MRI-scanner bij 25 patiënten die een operatie voor een hartklepvervanging hadden ondergaan. Het type hartkleppen werd niet vermeld.
Er werden geen klinische symptomen door patiënten gemeld die kunnen duiden op een hartritmestoornis. Ook werden geen veranderingen in ECG-ritme waargenomen. In alle gevallen, en met name bij gradiënt-echo-sequenties, was wel sprake van signaalverlies als gevolg van susceptibiliteitseffecten.
Randall (1988) onderzochten het optreden van klinische symptomen en het optreden van artefacten op MRI-beelden bij zes cases met de volgende vijf typen hartkleppen:
- Lillehei-Kaster (Medical Incorporated), Pyrolite carbon disc.
- St. Jude Medical (St. Jude Medical), Bileaflet pyrolite disc impregnated with small amount of tungsten.
- Björk-Shiley spherical disc (Shiley), Pyrolite tilting carbon disc.
- Bioprosthetic Carpentier-Edwards (American Edwards), Porcine valve.
- Ionescu-Shiley (Shiley), Calf pericardium.
Alle cases ondergingen MRI-onderzoek met een 0,5T MRI-scanner. Er werden geen ritmestoornissen of andere klinische symptomen waargenomen en er werden geen ongemakken door patiënten gemeld. Op de MRI-beelden waren lokaal milde artefacten waarneembaar als gevolg van het metaal en werden buiten het directe klepgebied kleine verstoringen gezien.
Bewijskracht van de literatuur
Bij de conclusies die volgen uit de ex vivo studies is geen maat voor de bewijskracht aangegeven omdat de GRADE-methodiek op dit moment niet geschikt is voor de beoordeling van dit type studies. De werkgroep geeft aan dat de interacties die bij ex vivoonderzoek gedetecteerd worden gelijk dan wel groter zullen zijn, dan de interacties die zich in vivo voor zullen doen. De risico’s zullen op basis van dit type onderzoek daarom eerder overschat dan onderschat worden.
De bewijskracht van de conclusie voor de uitkomstmaat “effect op de patiënt”, gebaseerd op de in vivo studies wordt als zeer laag gegradeerd vanwege een groot risico op bias, onnauwkeurigheid en indirectheid. De twee in vivo studies zijn namelijk niet vergelijkend, hebben een zeer kleine studiepopulatie en zijn gedeeltelijk uitgevoerd met verouderde apparatuur (0,5 en 1T) ten opzichte van de hedendaags gebruikte apparatuur (1,5 of 3T). De conclusie dient daarom met de grootste voorzichtigheid gelezen te worden.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de kans op negatieve uitkomsten bij patiënten met artificiële hartkleppen of ringen die MRI-onderzoek ondergaan?
P: patiënten met artificiële hartkleppen of annuloplastiekringen;
I: MRI-onderzoek;
C: geen MRI-onderzoek;
O: negatieve uitkomsten:
a) interacties tussen de hartklepprothese en de door de MRI-scanner gegenereerde magneetvelden en radiofrequente golven;
b) effecten op de patiënt ten gevolge van de onder a) beschreven interacties.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 07 maart 2018 met relevante zoektermen gezocht naar studies over MRI-onderzoek bij hartkleppen. De literatuurzoekactie leverde 321 treffers op. Aanvullend is in dezelfde databases op 17 mei 2018 met relevante zoektermen gezocht naar studies over MRI-onderzoek bij annuloplastiekringen. De literatuurzoekactie leverde 41 treffers op. Er werd niet beperkt op type studie. De zoekverantwoording van beide ‘searches’ is weergegeven onder het tabblad Verantwoording.
Studies werden geselecteerd op grond van de volgende selectiecriteria: studies naar effecten (interacties of klinische effecten) van MRI-onderzoek bij (patiënten met) hartklepprothesen. Op basis van titel en abstract werden in eerste instantie 46 studies voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens 31 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 15 studies definitief geselecteerd.
Twee van de geselecteerde studies gaan over het Lenz-effect (Robertson, 2000; Condon, 2000) en passen niet goed binnen het format van de evidencetabellen en samenvatting van de literatuur. Deze studies worden daarom verder beschreven onder de overwegingen, aldaar is meer literatuur opgenomen rond het Lenz-effect naar aanleiding van de commentaarfase. Elf ex vivo onderzoeken, één in vivo onderzoek en één gecombineerd in vivo en ex vivo onderzoek zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabel. De beoordeling van de individuele studieopzet van de in vivo-onderzoeken (risk of bias) is opgenomen in de risk of bias tabel.
Referenties
- American Elements: URL https://www.americanelements.com/pyrolytic-graphite-7782-42-5 Website geraadpleegd op 19/7/2019
- ASTM, F2182-11a, Standard test method for measurement of radiofrequency induced heating on or near passive implants during magnetic resonance imaging. (2002) ASTM International, West Conshohocken, PA, USA. www.astm.org.
- Bonchek L.I., Dobbs J.L., Matar A.F., Chappel P. and Starr A. Roentgenographic Identification of Starr-Edwards Prostheses, Circulation 1973, Volume XLVII: 154 161.
- Condon B., Hadley D.M. (2000). Potential MR hazard to patients with metallic heart valves: the Lenz effect. J. Magn. Reson Imaging 12:171176 (2000).
- Dill T. Contraindications to magnetic resonance imaging. Heart 2008;94;943-948.
- Edwards M-B., Phil M., Ordidge R.J., Hand J.W., Taylor K.M., Young I.R. Assessment of magnetic field (4.7 T) induced forces on prosthetic heart valves and annuloplasty rings. J. Magn. Reson Imaging 22:311317 (2005a).
- Edwards M-B., Draper E.R.C., Phil M., Hand J.W., Taylor K.M., Young I.R. Mechanical testing of human cardiac tissue: some implications for MRI safety. J. Cardiovasc. Magn. Reson. (2005b) 7, 835840.
- Edwards M-B., Phil M., Ordidge R.J., Thomas D.L., Hand J.W., Taylor K.M. Translational and rotational forces on heart valve prostheses subjected ex vivo to a 4.7-T MR System. J. Magn. Reson Imaging 16:653659 (2002).
- Edwards M-B., Phil M., Taylor K.M., Shellock F.G. Prosthetic heart valves: Evaluation of magnetic field interactions, heating, and artifacts at 1.5 T. J. Magn. Reson Imaging 2000, 12:363369.
- Edwards M-B, Mclean J, Solomonidis S, Condon B, and Gourlay T. In vitro assessement of the Lenz effect. J. Magn. Reson. Imag. 41,74-82 (2015).
- Golestanirad L, Dlala E, Wright G, Mosig JR, and Graham SJ. Comprehensive analysis of Lenz effect on the artificial heart valves during magnetic resonance imaging. Prog. Electromagn. Research 128,1-17 (2012).
- Graham A.P., Schindler G., Duesberg G.S., Lutz T., and Weber W.. An investigation of the electrical properties of pyrolytic carbon in reduced dimensions: Vias and wires. Journal of Applied Physics 2010; 107:114316.
- Grainger D. Safety guidelines for magnetic resonance imaging equipment in clinical use. Medicines and healthcare products regulatory agency, United Kingdom, 2015. https://www.gov.uk/government/publications/safety-guidelines-for-magnetic-resonance-imaging-equipment-in-clinical-use. Geraadpleegde versie: 4.2.
- Hassler M, Le Bas JF, Wolf JE, et al. Effects of magnetic fields used in MRI on 15 prosthetic heart valves. J Radiol 1986;67:661-666.
- Hartnell GG, Spence L, Hughes LA, Cohen MC, Saouaf R, Buff B. (1997). Safety of MR Imaging in Patients Who Have Retained Metallic Materials After Cardiac Surgery. Am J Roentgenol. 1997;168:1157-9.
- Levine G.N., Gomes A.S., Arai A.E., et al. Safety of magnetic resonance imaging in patients with cardiovascular devices: an American Heart Association scientific statement from the Committee on Diagnostic and Interventional Cardiac Catheterization, Council on Clinical Cardiology, and the Council on Cardiovascular Radiology and Intervention: endorsed by the American College of Cardiology Foundation, the North American Society for Cardiac Imaging, and the Society for Cardiovascular Magnetic Resonance. Circulation 2007;116:2878-2891.
- Leyh R.G., Schmidtke C., Sievers H.H., Yacoub M.H.. Opening and Closing Characteristics of the Aortic Valve After Different Types of Valve-Preserving Surgery. Circulation 1999;100:2153-2160.
- Lynch W. Cardiovascular implants. Implants 1982, 48-94.
- Morse D., Steiner R.M., Fernandez J (editors) Guide to Prosthetic Cardiac Valves, Chapter 10. Springer Science & Business Media, 6 dec. 2012.
- Prasad S.K., Pennell D.J. Safety of cardiovascular magnetic resonance in patients with cardiovascular implants and devices editorial - Heart 2004;90:12411244.
- Pruefer D., Kalden P., Schreiber W., Dahm M., Buerke M., Thelen M., Oelert H. In vitro investigation of prosthetic heart valves in magnetic resonance imaging: Evaluation of potential hazards. J Heart Valve Dis. 2001; 10:410-4.
- Randall P.A., Kohman L.J., Scalzetti E.M., Szeverenyi N.M., Panicek D.M. Magnetic Resonance Imaging of prosthetic cardiac valves in vitro and in vivo. Am. J. Cardiol., 1988. 973-976.
- Robertson N.M., et al. Estimation of torque on mechanical heart valves due to magnetic resonance imaging including an estimation of the significance of the Lenz effect using a computational model. Phys. Med. Biol. 45, 3793 (2000).
- Saeedi M., Thomas A., Shellock F.G. Evaluation of MRI issues at 3-Tesla for a transcatheter aortic valve replacement (TAVR) bioprosthesis. Magn. Reson. Imaging 2015, 33, 497501.
- Saito S., Araki Y., Usui A., Akita T., Oshima H., J. Yokote, Y. Ueda. Mitral valve motion assessed by high-speed video camera in isolated swine heart. European Journal of Cardio-thoracic Surgery 2006; 30: 584-591.
- Shellock F.G. Prosthetic heart valves and annuloplasty rings: Assessment of magnetic field interactions, heating, and artifacts at 1.5 Tesla. J Cardiovasc. Magn. Reson., 2001; 3, 317324.
- Shellock F.G. Biomedical implants and devices: assessment of magnetic field interactions with a 3.0-Tesla MR system. J Magn Reson Imaging. 2002;16:721-32.
- Shellock F.G. and Crues J.V. MR Procedures: Biologic Effects, Safety, and Patient Care. Radiology 2004; 232:635652.
- Shellock F.G. and Crues J.V. High-field-strength MR imaging and metallic biomedical implants: An ex vivo evaluation of deflection forces. Am J Roentgenol. 1988;151:389-92.
- Shellock F.G. and Morisoli S.M. Ex vivo evaluation of ferromagnetism, heating, and artifacts produced by heart valve prostheses exposed to a 1.5-T MR system. J. Magn. Reson Imaging 1994; 4, 756-758.
- Soulen R.L., Budinger T.F., Higgins C.B. Magnetic resonance imaging of prosthetic heart valves. Radiology 1985, 154, 705-707.
- Soulen RL. Magnetic resonance imaging of prosthetic heart valves [Letter]. Radiology 1986;158:279.
- Stijnman RS, van Nierop BJ, et al. Assessment of the alleviating impact of perfusion on RF-induced heating due to artificial cardiac valves. Annual Meeting ISMRM 2019, 4154.
- Suchá D., Symersky P., Tanis W. et al. Multimodality imaging assessment of prosthetic heart valves. Circ Cardiovasc Imaging. 2015;8
- Yokote J., Araki Y., Saito S., Hasegawa H., and Usui A. Effect of an artificial ring on mitral valve function. Nagoya J. Med. Sci. 2019; 81: 207215 .
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy - otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question: What is the risk of having a negative outcome when performing MRI in patients with artificial heart valves?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Type of study: ex vivo study
Country: USA
Source of funding: Unrestricted research grant provided by Vascular Innovations Company, Ltd, Thailand. |
Inclusion criteria: Hydra Aortic Valve, Percutaneous Heart Valve Prosthesis, Vascular Innovations Company, Ltd, Thailand |
3 Tesla MRI
|
Not applicable
|
Magnetic field interactions were negligible: - Torque, 0
MRI-related heating (at relative high specific absorption level, whole body average SAR, 2.9-W/kg) was minimal: - Max temp rise, 2.5°C - Background temp rise, 1.7°C
MRI-related heating extrapolatedto a whole body averaged SAR of 4.0-W/kg (i.e., the upper allowable limit as specified by the U.S. Food and Drug Administration), the temperature rise would be 3.4 °C, which is still an acceptable level for a human subject.
Artifacts (T1-weighted, spin echo, and gradient echo pulse sequences) were relatively small in relation to size and shape of implant
Conclusion: the TAVR bioprosthesis is "MR Conditional" (defined as an item that has been demonstrated to pose no known hazards in a specified MRI environment with specified conditions of use indicated) for patients at 3 Tesla or less. |
|
|
|
Edwards, 2005a |
Type of study: ex vivo study
Country: UK
Source of funding: not reported |
Inclusion criteria: 11 heart valve prosthesis and 12 annulosplasty rings:
1. Aspire, Porcine bioprosthesis, Mitral valve M55 2. Elan, Porcine bioprosthesis, Aortic valve AV33/P 3. Elan, Valve Graft Porcine bioprosthesis with valve graft, Aortic valve RE80/P 4. Carbon, Art Mechanical bileaflet valve graft, Aortic valve AVP27/30 5. Contegra, Pericardial bioprothesis, Pulmonary valve 200 6. Freedom, Pericardial bioprosthesis, Aortic valve PF 7. Freestyle, Porcine bioprosthesis, Aortic valve 995MS 8. MØre, Pericardial bioprosthesis, Aortic valve PN 9. Regent, Mechanical bileaflet, Aortic valve AGN-751 10. St Jude, Mechanical Valve Graft Mechanical bileaflet with root, Aortic valve CAVG 11. Toronto, Root Porcine bioprosthesis, Aortic valve Root 12. AnnuloFlex, Ring, Mitral Ring AF800 13. Carpentier Edwards Rigid/ Classic, Mitral ring 4425 14. Carpentier Edwards Rigid/ Classic, Tricuspid ring 4525S 15. Carpentier Edwards Physio, Mitral ring 4475 16. Colvin, Mitral ring 638B 17. Cosgrove, Atrioventricular ring 4625 18. Duran, Mitral ring H608 19. Duran, Tricuspid band H610 20. Mitral Repair System, Mitral ring MRS 21. Tailor, Mitral ring TARN 22. Seguin, Mitral ring SARP 23. Sovering, Mitral ring SB-M |
4.7 Tesla MRI
10 Carpentier Edwards (CE) Physio Rings were also evaluated for 1.5 Tesla MRI regarding their time-dependent ferromagnetic properties.
|
Not applicable
|
Magnetic field interactions (translational and rotational forces): 0 for 17/23 prostheses, but not for: 9, 10, 13, 14, 15 16 (2 valves, 4 rings).
Valves 9 and 10 demonstrated an interaction with the magnetic field deflecting by 2° and displaying a +2 measurement on our measurement scale for rotational force when oriented perpendicular to the magnetic field.
All rings demonstrated translational forces (2°, ring 15 20° and ring 16 5°), rings 15 and 16 also rotational forces when oriented perpendicular to the magnetic field (torque +2).
All prostheses attracted to the magnetic field were slightly paramagnetic/weakly ferromagnetic, and all demonstrated a magnetic acceleration less than that due to gravity.
Further testing of different samples of the CE Physio Ring revealed that without exception, all samples of the ring interacted with the magnetic field (Table 3). The five rings subjected to the 1.5 T MR system deflected by an angle of 2° with each exposure to the MR system and demonstrated a rotational force of 2 on the threepoint qualitative scale when oriented perpendicular to the magnetic field. The results of the remaining five rings tested at 4.7 T showed deflection angles of 17–20°, suggesting a threefold increase in magnetically induced forces compared to 1.5 T. Furthermore, the angles of deflection recorded at 4.7 T increased with increasing implant size
Conclusion: all prostheses are considered safe* in static fields up to 4.7 Tesla, except for ring 15, made from Elgiloy, which may not be acceptable for patients in MR ≥4.7 Tesla. |
This article refers to other studies which also detected effects of MRI at a field strength of 3T on implants from Elgiloy. It concludes that further investigations are required to confirm the safety of Elgiloy.
|
|
Edwards, 2005b |
Type of study: ex vivo study
Country: UK
Source of funding: not reported |
Inclusion criteria: - Eighteen tissue samples excised during routine heart valve replacement surgery |
A pull-out test using a tensile materials testing machine.
Five preconditioning cycles were applied before commencing the final destructive test. The test was complete when the sample ruptured and the suture was pulled completely free from the tissue.
Results were compared with previously calculated magnetically induced forces at 4.7 Tesla MRI. |
Not applicable
|
Significant factors determining initial yield were - stenosed calcific tissue (p < .01) - calcific degeneration (single pathology) (p < .04) - tissue stiffness (p < .01)
Calcific degeneration (p < .03) and tissue stiffness (p < .03) were also significant in determining maximum force required to cause total rupture.
Conclusion. The required forces to pull a suture through valve annulus tissue are significantly greater than magnetically induced 4.7 Tesla. Therefore, patients with degenerative valvular diseases are unlikely to be at risk of valve dehiscence. |
This article does not study the MR safety of specific types of heart valve implants. This article studies the forces required to cause partial or total detachment of a heart valve prosthesis in patients with age-related degenerative diseases exposed to MRI
|
|
Shellock, 2002 |
Type of study: ex vivo study
Country: USA
Source of funding: Contract grant sponsor: General Electric Medical Systems; Contract grant sponsor: Institute for Magnetic Resonance Safety, Education, and Research. |
Inclusion criteria: 109 different implants and devices, of which 9 heart valve prostheses (2, 3, 5, 6 and 8-12) and 3 annuloplasty rings (1, 4 and 7).
1. AnnuloFlo Mitral Annuloplasty Device, Model AR-736 2. Carboseal Ascending Aortic Valve Conduit, Model AP-033 3. Carboseal Ascending Aortic Valve Conduit, Model AP-033 4. Carpentier-Edwards Classic Annuloplasty Ring, Mitral model 4400 5. Carpentier-Edwards Low Pressure Bioprosthesis, Porcine, mitral model 6625 6. Carpentier-Edwards PERIMOUNT Pericardial Bioprosthesis, Mitral model 6900 7. Carpentier-Edwards Physio Annuloplasty Ring, Mitral model 4450 8. Edwards MIRA Mechanical Valve, Mitral, model 9600 9. Reduced Aortic CPHV Carbomedics Prosthetic Heart Valve, Model R5-029 10. Reduced Aortic CPHV Carbomedics Prosthetic Heart Valve, Model R5-029 11. Standard Mitral CPHV Carbomedics Prosthetic Heart Valve, Model R5-029 12. Standard Mitral CPHV Carbomedics Prosthetic Heart Valve, Model M7-033 |
3.0 Tesla MRI
|
Not applicable
|
Magnetic field interactions (translational attraction and torque): 0, except for ring nr 7 (deflection angle 4° and torque +1).
Conclusion: Based on the ASTM criteria all cardiac implants (rings and valves) are considered safe* from a magnetic field interaction viewpoint (i.e., deflection angle less than 45°) at 3.0 Tesla.
|
|
|
Edwards, 2002 |
Type of study: ex vivo study
Country: UK
Source of funding: not reported |
Inclusion criteria: 60 heart valves
For further details, see table 1 in article. |
4.7 Tesla MRI
|
Not applicable
|
Magnetic field interactions (translational and rotational forces):
Translational forces were detected on 58 heart valves ranging from 0.5° to 7.5°.
Seven valves exhibited paramagnetic/weakly ferromagnetic behaviour, and 51 valves exhibited diamagnetic behaviour.
Rotational forces were observed for 46 valves (max +2).
For further details, see table 2 in article.
Conclusion: Criteria previously used for safety assessment of heart valve prostheses and expressed in terms of magnetic forces suggest the forces observed in this study are compatible with the safe* use of these valves in magnetic resonance (MR) systems with static fields up to 4.7 Tesla. |
|
|
Shellock, 2001 |
Type of study: ex vivo study
Country: USA
Source of funding: Supported by an unrestricted research grant from Edwards Lifesciences, Irvine, California. |
Inclusion criteria: 3 heart valve prostheses: 1. Carpentier-Edwards PERIMOUNT Pericardial Bioprosthesis (mitral, model 6900) 2. Carpentier-Edwards Low Pressure Bioprosthesis (porcine, mitral, model 6625-LP) 3. Edwards MIRA Mechanical Valve (mitral, model 9600)
2 annuloplasty rings 4. Carpentier-Edwards Physiol Annuloplasty Ring (mitral, model 4450) 5. Carpentier-Edwards Classic Annuloplasty Ring (mitral, model 4400) |
1.5 Tesla MRI
|
Not applicable
|
Magnetic field interactions: Deflection angle 2. 0° 3. 2° 4. 6° 5. 0°
Torque 1. +1 2. 0 3. +1 4. +1 5. 0
MRI-related heating (using high level of exposure to RF radiation): 1. + 0.5 2. + 0.7 3. + 0.5 4. + 0.6 5. + 0.6
Artefacts (T1-weighted, spin echo, and gradient echo pulse sequences) Artefacts appeared as localized signal voids, easily recognized on MR images. Artefact size was dependent on amount and type of metal used for implant. GRE pulse sequence produced larger artefacts than T1-weoghted spin echo pulse sequence.
Conclusion: MR procedures may be conducted safely* in patients with these implants using MR systems operating with 1,5 Tesla or less. |
|
|
Pruefer, 2001 |
Type of study: ex vivo study
Country: Germany
Source of funding: not reported |
Inclusion criteria: 17 common heart valve prostheses (1-12 mechanical, 13-17 biological)
1. Baxter Mira 21 AF, Aortic 2. Baxter Mira 27M, Mitral 3. On-X 19 mm aortic valve prosthesis, Aortic 4. On-X 23 mm aortic valve prosthesis, Aortic 5. On-X 25 mm mitral valve prosthesis, Mitral 6. SJM 23 A 101, Aortic 7. SJM 25 MEC 102, Mitral 8. SJM (Silzone) 27MS-601, Mitral 9. Omniscience aortic valve, Aortic 10. Sorin Bicarbon 29 mm, Mitral 11. Ultracolor 27 mm, Mitral 12. Brörk-Shiley Monostrut, Mitral 13. Mitroflow 29 mm aortic valve, 11A29, Aortic 14. SJM Mitral 28 mm (Bioimplant), Mitral 15. Baxter CE SAV ® Mitral 33 mm, Mitral 16. Baxter CE Aortal 23 mm Perimount, Aortic 17. Baxter CE SAV aortic 31 mm, Aortic |
1.5 Tesla MRI
|
Not applicable
|
Magnetic field interactions were negligible: - The torque ranged from 0 - +2 - All type of materials used for the evaluated prostheses were either nonferromagnetic or only weakly ferromagnetic relative to the 1.5 Tesla MR environment.
Highest temp changes in the assessment of RF MRI-related heating, ranged from 0.5 – 0.8°C. Highest reference temperature changes ranged from 0.4 – 0.5°C.
Artefacts ranged from mild (+2) to severe (+4) and appeared as localized signal voids, easily recognizable on image. Gradient-echo pulse sequence produced larger artefact than T1-weighted pulse sequence. Artefacts were directly proportional to amount of metal present for a given prosthesis.
Conclusion: MR procedures performed with 1.5 Tesla MR system can be applied safely* in patients with heart valve prostheses evaluated in this study. |
|
|
Edwards, 2000 |
Type of study: ex vivo study
Country: USA/UK
Source of funding: Not reported |
Inclusion criteria: 31 heart valves.
For further details, see table 1 in article. |
1.5 Tesla MRI
|
Not applicable
|
Magnetic field interactions were negligible: - Torque, 0-2
MRI-related heating (at relative high specific absorption level, whole body average SAR, 1.1-W/kg) was minimal: - Max temp rise, up to 0.8°C - Background temp rise, 1.7°C
Artefacts were mild (+2) to severe (+4) and appeared as localized signal voids, easily recognizable on the image. Gradient echo pulse sequence produced larger artefact than T1-weighted pulse sequence.
For further details, see table 2 in article.
Conclusion: the results indicate that MR procedures may be conducted safely* in individuals with the evaluated heart implants using MR systems with static magnetic fields of 1.5 Tesla or less. |
|
|
Hartnell, 1997 |
Type of study: in vivo prospective cohort study
Setting: university hospital
Country: USA
Source of funding: NR |
Inclusion criteria: Patients who have undergone cardiac surgery and have retained metallic material, including valve replacements, and temporary epicardial pacing wires cut short at the skin. Presence of temporary epicardial pacing wires, prosthetic valves, and other metal materials was confirmed by chest radiography <7 dys of MRI.
Exclusion criteria: patients without a contemporary chest radiograph or radiopaque material visible on chest radiograph.
N total at baseline: 200 of whom 81 were examined with ECG monitoring.
52 coronary bypass surgery 25 valve replacement (With or without coronary bypass surgery) 51 temporary epicardial pacing wires 187 sternal wires 178 mediastinal surgical clips.
All 25 patients with valve replacement were examined with ECG monitoring.
Important prognostic factors2: No details of patient characteristics reported. Valve type unknown? |
1- or 1.5- Tesla MRI
|
Length of follow-up: Until end of MR imaging
Loss-to-follow-up: 0
Incomplete outcome data: 3/200
2 patients were examined to elucidate the cause of recurrent but self-terminating ventricular arrhythmias that did not change in frequency from baseline. In both cases imaging was terminated because of poor image quality from gating irregularity during ventricular arrhythmias.
1 patient who received dipyridamole as part of a MR imaging stress perfusion protocol, requested early cessation of the examination because angina developed after injection of the dipyridamole. On reversal of the stress agent with aminophylline the symptoms subsided, and no evidence showed that this outcome was related to the MR imaging sequences. |
Clinical signs: None of the patients reported symptoms suggesting arrhythmia or other cardiac dysfunction during MR imaging.
ECG rhythm: No changes from baseline
Signal loss because of susceptibility effects was seen with all valves and was more prominent with gradient-echo sequences.
Conclusion: 1- or 1.5- Tesla MR can be performed safely* in patients who have undergone cardiac surgery and have retained metallic material, including valve replacements, and temporary epicardial pacing wires cut short at the skin.
|
|
|
Shellock, 1994 |
Type of study: ex vivo study
Country: USA
Source of funding: Not reported |
Inclusion criteria: 13 heart valve prostheses
For further details see table in article.
|
1.5 Tesla MRI
|
Not applicable
|
Magnetic field interactions:
MRI-related heating: - Max temp rise immediately after 30 min MRI was +0.2°C for air experiment and +0.3°C for normal saline experiment. (For further details see table in article)
Artefacts were minimal (all +)
Conclusion: MR procedures performed with 1.5 Tesla (64-MHz) MR system may be performed safely in patients with heart valve prostheses evaluated in this study. |
|
|
Shellock, 1988 |
Type of study: ex vivo study
Country: USA
Source of funding: Supported by Public Health Service grant 1 AOl CA44014-01 from the National Cancer Institute and by a grant from the General Electric Co., Milwaukee, WI. I. |
Inclusion criteria: 36 different metallic biomedical implants, of which 7 heart valve protheses:
1. Bjork-Shiley, convexo/concave (Shiley, Irvine CA) 2. Hall-Kaster, Model A7700 (Medtronic, Minneapolis, MN) 3. Hancock I, porcine (Johnson & Johnson, Anaheim, CA) 4.Hancock II, porcine (Johnson & Johnson) 5. Lillehi-Kaster, model 3005 (Medical Inc., Inver Grove Heights, MN) 6. Starr-Edwards, model 2400 (American Edwards Laboratories, Santa Ana, CA) 7. St. Jude’s (St. Jude Medical, St. Paul, MN |
1.5 Tesla MRI (with high-field-strength)
|
Not applicable
|
Magnetic field interactions: 1. 59 2. 91 3. 10 4. 8 5. 170 6. 152 7. 0
Conclusion: patients with heart valves evaluated in this study can be safely* imaged with high-field 1.5-T MR systems. |
|
|
Randall, 1988 |
Type of study: ex vivo and in vivo study
Setting: University hospital
Country: USA
Source of funding: NR |
Inclusion criteria: 5 heart valve protheses:
1. Lillehei-Kaster (Medical Incorporated), Pyrolite carbon disc. 2. St. Jude Medical (St. Jude Medical), Bileaflet pyrolite disc impregnated with small amount of tungsten 3. Bjork-Shiley spherical disc (Shiley), Pyrolite tilting carbon disc. 4. Bioprosthetic Carpentier-Edwards (American Edwards), Porcine valve. 5. Ionescu-Shiley (Shiley), Calf pericardium.
In vivo examinations were performed on patients who had same prosthetic valves and signed informed consent form.
Exclusion criteria: patients with transvenous or epicardial pacing electrode or a pacemaker.
N total at baseline: 6. - Age 35 – 65 yrs - 2 women, 4 men - 5 aortic valves, 1 mitral valve |
0,5 and 2 Tesla MR (in vivo all 0,5-T)
|
Not reported
|
Ex vivo: Magnetic field interactions: no evidence of valve deflection at the mouth of the 2-T magnet in the presence of a very large magnetic field gradient.
MRI-related heating: No temp increase >0.2°C was observed.
In vivo: Mild localized artefacts traceable to the metal components of the valve. There is little distortion of the image outside of the immediate valve area.
Clinical signs: No arrhythmias were observed, no clinical signs or symptoms of discomfort were noted or volunteered.
MRI demonstration of the valves in vivo gave little information as to their condition or function because valves appear as a signal void and valves caused minimal distortion or artefact formation in surrounding structures.
Conclusion: these studies can be performed safely* and reliably when problems in the vicinity of the valve require evaluation. |
|
|
Soulen, 1985 |
Type of study: ex vivo study
Country: USA
Source of funding: This work was performed by a contractor of the U.S. government and supported in part under U.S. Department of Energy contract DE-AC03-76SF00098. |
Inclusion criteria: 9 different synthetic and tissue valves:
1. Carpentier-Edwards Bioprosthesis Model 6625 (Porcine valve) 2. Ionescu-Shiley Pericardial Xenograft (Bovine pericardial valve) 3. Björk-Shiley Unversal Spherical (Pyrolytic carbon disc) 4. Medtronic Hall (Pyrolytic carbon disc) 5. Beall (Surgitool) (Pyrolytic carbon disc) 6. Starr-Edwards Aortic Model 2320 (1970-1976) (Hollow stellite ball) 7. Starr-Edwards Aortic Model 1260 (1968 – present) (Silicone rubber ball with 2% BaSO4 by weight) 8. Smeloff-Cutter (Silicone elastomer ball) 9. Starr-Edwards Mitral Pre 6000 (1960 – 1964) (Silicone rubber ball)
|
0.35, 1.5 and 2.35 Tesla MRI
|
Not applicable
|
Magnetic field interactions: No deflection
1.5-T MR: 1. 0° 2. 0° 3. 0.25° (2.6 x10-4N) 4. 0° 5. 0.75° (1.1 x10-3N) 6. 1.0° (1.1 x10-3N) 7. 0.33° (4.5 x10-4N) 8. 0.75° (1.6 x10-3N) 9. 3.0° (6.7 x10-3N)
2.35-T MR 1. 6.0° (5.3 x10-3N) 2. 0.5° (3.2 x10-4N) 3. 3.0° (3.1 x10-3N) 4. 1.5° (1.1 x10-3N) 5. 1.0° (1.5 x10-3N) 6. 8.7° (9.4 x10-3N) 7. 2.7° (3.7 x10-3N) 8. NA 9. 27.0° (6.5 x10-2N)
Change in temp due to MRI-related heating: No significant temperature rise followed exposure of valves in either cryomagnet (range -0.2 - + 0.4°C)
Artefacts: image distortion varied from negligible to severe in both 0.35-T and 1.5-T images. Magnitude of distortion paralleled magnitude of prosthetic deflection, being most severe with valve 9. After removal of this valve, there was no alteration in adjacent images.
Conclusion: Patients with present-day prosthetic heart valves can be safely* imaged in present-day MR imagers. Prosthesis-induced artefacts will not interfere with interpretation in most instances. |
|
* Tested implants are "MR Conditional" according to ASTM 2013, which is defined as an item that has been demonstrated to pose no known hazards in a specified MRI environment with specified conditions of use indicated
Research question: What is the risk of having a negative outcome when performing MRI in patients with artificial heart valves?
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Hartnell, 1997 |
unlikely |
likely |
unlikely |
likely |
|
Randall, 1988 |
unlikely |
likely |
unlikely |
likely |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Exclusietabel
|
Auteur en jaartal |
Redenen van exclusie |
|
Lee, 2017 |
andere vraagstelling |
|
Suchá, 2015 |
niet systematische review |
|
Ripley, 2016 |
niet systematische review |
|
Karamitsos, 2017 |
opiniestuk, geen primair onderzoek |
|
Gulsin, 2017 |
niet systematische review |
|
Salaun, 2016 |
andere vraagstelling |
|
Musa, 2016 |
niet systematische review |
|
Mangold, 2015 |
andere vraagstelling |
|
Von Knobselsdorff-Brenkenhoff, 2014 |
niet systematische review |
|
Saremi, 2014 |
andere vraagstelling |
|
Ribeiro, 2014 |
andere vraagstelling |
|
Merli, 2014 |
betreft een video, geen artikel |
|
Lopez-Mattei, 2013 |
andere vraagstelling |
|
Pham, 2012 |
niet systematische review |
|
Myers, 2012 |
betreft een letter aan de editor |
|
Baikoussis, 2011 |
niet systematische review |
|
Kahlert, 2010 |
andere vraagstelling |
|
Hundley, 2010 |
expert opinion |
|
Walsh, 2008 |
niet systematische review. |
|
Pamboucas, 2008 |
niet systematische review |
|
Dill, 2008 |
niet systematische review |
|
Martin, 2007 |
niet systematische review |
|
D'Avenio, 2007 |
andere vraagstelling |
|
Giroletti, 2005 |
lijkt systematische review, artikel niet verkrijgbaar |
|
Shellock, 2004 |
Niet systematische review |
|
Prasad, 2004 |
editorial |
|
Shellock, 2002b |
niet systematische review. |
|
Ahmed, 2001 |
niet systematische review |
|
Sawyer-Glover, 2000 |
niet systematische review |
|
Shellock, 1991 |
niet systematische review |
|
Shellock, 1988b |
niet systematische review |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 30-10-2019
Beoordeeld op geldigheid : 28-11-2019
Bij het opstellen van de modules heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodule komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Hartklepprothese, annuloplastiekring of mitraclip |
NVKF |
2019 |
2024 |
Eens in de 5 jaar |
NVKF |
Nieuwe types hartklep, bijvoorbeeld verstelbaar of voorzien van sensoren of elektronica. |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (Half)jaarlijks, eens in twee jaar, eens in vijf jaar
[5] Regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel is om de kwaliteit van het advies van de MR veiligheidsdeskundige aan de zorgverlener te verbeteren en te borgen, en daarmee de veiligheid en de toegang tot MRI-onderzoeken bij patiënten met implantaten te borgen. Deze richtlijn richt zich met name op implantaattypen waarbij het niet geheel duidelijk is of een MRI wel of niet veilig kan worden toegepast, met als doel een reële risico-inschatting te kunnen maken. Daarnaast heeft de richtlijn tot doel te leiden tot tijdswinst in de praktijk, omdat bepaalde modules aanbevelingen geven voor generiek beleid bij bepaalde type implantaten, waardoor niet bij iedere individuele patiëntcasus specifieke informatie over het modeltype van het implantaat hoeft te worden ingewonnen.
Met deze richtlijn kan dus een betere inschatting worden gemaakt van het gezondheidsrisico dat een patiënt met een implantaat loopt met een MRI-onderzoek, in vergelijking tot de gezondheidswinst voor die patiënt met een MRI-onderzoek. Vanwege het huidige verschil in ziekenhuizen in de mate waarin conservatief beleid gevoerd wordt bij een gebrek aan voldoende informatie over de veiligheid van het implantaat, zal de richtlijn in sommige gevallen/ziekenhuizen leiden tot betere toegang tot MRI-diagnostiek, in andere gevallen/ziekenhuizen tot beter onderbouwde beperking van de mogelijkheid tot MRI-diagnostiek.
Doelgroep
De richtlijn is geschreven voor gebruik door MR veiligheidsdeskundigen zoals klinisch fysici. Daarnaast kan de richtlijn informatief zijn voor alle leden van beroepsgroepen die betrokken zijn bij de planning van MRI bij patiënten met implantaten; zijnde radiologen, MBB’ers (MR-laboranten) en verwijzers voor MRI-onderzoek.
Samenstelling werkgroep
Werkgroep
- Dr. M.B.M. Hofman, klinisch fysicus, Amsterdam UMC (Amsterdam), NVKF (voorzitter)
- Dr. M.J.W. Götte, cardioloog, Amsterdam UMC (Amsterdam), NVvC
- Dr. ir. M. van der Graaf, klinisch fysicus, Radboudumc (Nijmegen), NVKF
- P. Kappert, Systeem Specialist MRI, UMCG (Groningen), NVMBR
- Ir. C. Kloeze, klinisch fysicus, Catharina Ziekenhuis (Eindhoven), NVKF
- Dr. J.P.A. Kuijer, klinisch fysicus, Amsterdam UMC (Amsterdam), NVKF
- Dr. C. Lavini, MR fysicus, Amsterdam UMC (Amsterdam), NVKF
- Dr. S.H. Muller, klinisch fysicus, NKI (Amsterdam), NVKF
- Dr. ir. B.J. van Nierop, klinisch fysicus, UMCU (Utrecht), NVKF
- Dr. ir. C. van Pul, klinisch fysicus, Maxima Medisch Centrum (Eindhoven), NVKF
- Dr. ir. M.K. Stam, klinisch fysicus i.o., Amsterdam UMC (Amsterdam), NVKF
- Dr. W. Teeuwisse, LUMC (Leiden), NVKF
- Dr.ir. E.J. Vonken, radioloog, UMCU (Utrecht), NVvR
- Prof. dr. A. van der Zwan, neurochirurg, UMCU (Utrecht) NVvN
Met ondersteuning van
- Drs. E.E.M. Kolsteren, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. K. Venhorst, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- D.P. Gutierrez, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Götte |
Cardioloog, Amsterdam UMC |
Cardioloog, Cardiologie Centra Nederland 0-aanstelling, betaald |
Geen |
Geen |
|
van der Graaf |
Klinisch fysicus bij Radboudumc |
Geen |
Geen |
Geen |
|
Hofman |
Klinisch fysicus, Amsterdam UMC |
Geen |
Betrokken bij MRI-onderzoek VUmc, basisreputatie binnen de NVKF op gebied MRI |
Geen |
|
Kappert |
Systeem Specialist MRI, UMCG |
Voorzitter Sectie MRI v/d NVMBR (onbetaald) |
Geen |
Geen |
|
Kloeze |
Klinisch Fysicus Catharina Ziekenhuis |
Lid Mec-u (metc) betaald |
Geen |
Geen |
|
Kuijer |
Klinisch Fysicus, Amsterdam UMC |
Geen |
Betrokken bij wetenschappelijke onderzoeksprojecten waarbij gebruik wordt gemaakt van MRI. Dit betreft geen onderzoek naar veiligheid of werking van implantaten. Reputatie binnen de NVKF als klinisch fysicus RNG met aandachtsgebied MRI |
Geen |
|
Lavini |
MRI fysicus, Amsterdam UMC |
Geen |
Geen |
Geen |
|
Muller |
Klinisch Fysicus, Antoni van Leeuwenhoek ziekenhuis |
Geen |
Geen |
Geen |
|
Nierop |
Klinisch fysicus, UMC Utrecht |
Geen |
Geen |
Geen |
|
van Pul |
Klinisch fysicus, Maxima Medisch Centrum |
Deeltijdaanstelling bij TU Eindhoven - technische natuurkunde, op basis van een detacheringsovereenkomst tussen MMC en TU. |
Deelname aan het door NWO-TTP gesponsord onderzoek naar alarm-reductie op een neonatale intensive care. Bij dit project is TU Eindhoven en Philips Research- patient monitoring groep betrokken. Dit project heeft GEEN relatie met de MRI-richtlijn. |
Geen |
|
Stam |
Klinisch Fysicus in opleiding, Amsterdam UMC |
Onbetaald: visitator voor het college van Toetsing van de stichting Opleiding Klinsch Fysicus (OKF) |
Geen |
Geen |
|
Teeuwisse |
Staflid C.J. Gorter Center for High Field MRI, LUMC, Safety Expert MRI |
Geen |
Geen |
Geen |
|
Vonken |
Radioloog, UMC Utrecht |
Geen |
Geen |
Geen |
|
van der Zwan |
Neurochirurg, UMC Utrecht |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er heeft geen patient(vertegenwoordiger) aan de werkgroep deelgenomen.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze module is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Binnen de NVKF is een beperkte analyse geweest die geleid heeft tot de keuze voor de ontwikkeling van twee modules.
Uitgangsvraag en uitkomstmaten
Door de werkgroepleden en de adviseur zijn de uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad ‘Zoekverantwoording’ voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration:
- AMSTAR - voor systematische reviews.
- Cochrane - voor gerandomiseerd gecontroleerd onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Kennislacunes
Tijdens de ontwikkeling van deze module is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de Kennislacunes. Deze zijn te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodule werd aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt)organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve module werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Hultcrantz M, Rind D, Akl EA, et al. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1946 – mei 2018
|
1 exp Magnetic Resonance Imaging/ or MRI*.ti. or magnetic resonance imaging.ti. or fMRI*.ti. or cardiovascular magnetic resonance.ti. or CMR.ti. (409699) 2 MITRAL VALVE ANNULOPLASTY/ or annuloplast*.ab,ti. or 'prostatic ring*'.ab,ti. (3923) 3 exp Safety/ or safet*.ab,ti. or exp Contraindications/ or contraindication*.ab,ti. or evaluation.ab,ti. or issue*.ab,ti. or adverse event*.ab,ti. or adverse effect*.ab,ti. or complication*.ab,ti. or deflection.ab,ti. (2717075) 4 1 and 2 and 3 (12) 5 limit 4 to english language (12)
= 12 (12 uniek) |
41 |
|
Embase (Elsevier) |
('nuclear magnetic resonance imaging'/exp OR mri*:ti OR 'magnetic resonance imaging':ti OR fmri*:ti OR 'cardiovascular magnetic resonance':ti OR cmr:ti)
AND ('annuloplasty ring'/exp OR 'prostatic ring*':ab,ti OR annuloplast*:ab,ti)
AND ('safety'/exp OR safet*:ab,ti OR 'contraindication'/exp OR contraindication*:ab,ti OR evaluation:ab,ti OR issue*:ab,ti OR 'adverse event*':ab,ti OR 'adverse effect*':ab,ti OR complication*:ab,ti OR deflection:ab,ti)
AND [english]/lim NOT 'conference abstract':it
= 36 (36 uniek) |
Zoekverantwoording artificiële hartkleppen
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1946 – maart 2018
|
1 exp *Magnetic Resonance Imaging/ or MRI*.ti. or magnetic resonance imaging.ti. or fMRI*.ti. or cardiovascular magnetic resonance.ti. or CMR.ti. (190114) 2 exp *Heart Valves/ or exp Heart Valve Prosthesis/ or heart valve*.ab,ti. or cardiac valve*.ab,ti. or aortic valve*.ab,ti. or TAVI.ab,ti. or AVI.ab,ti. or SAVR.ab,ti. or THV.ab,ti. or PAVR.ab,ti. or TAVR.ab,ti. or 'pulmonary valve*'.ti. or 'mitral valve*'.ti. or 'tricuspid valve*'.ti. (103619) 3 exp Safety/ or safet*.ab,ti. or exp Contraindications/ or contraindication*.ab,ti. or evaluation.ab,ti. or issue*.ab,ti. or adverse event*.ab,ti. or adverse effect*.ab,ti. or complication*.ab,ti. or deflection.ab,ti. (2663165) 4 1 and 2 and 3 (303) 5 limit 4 to english language (272)
= 272 |
321 |
|
Embase (Elsevier) |
('nuclear magnetic resonance imaging'/exp/mj OR mri*:ti OR 'magnetic resonance imaging':ti OR fmri*:ti OR 'cardiovascular magnetic resonance':ti OR cmr:ti)
AND ('heart valve'/exp/mj OR 'heart valve prosthesis'/exp OR 'heart valve*':ti OR 'cardiac valve*':ti OR 'aortic valve*':ti OR tavi:ti OR avi:ti OR savr:ti OR thv:ti OR pavr:ti OR tavr:ti OR 'pulmonary valve*':ti OR 'mitral valve*':ti OR 'tricuspid valve*':ti)
AND ('safety'/exp OR safet*:ab,ti OR 'contraindication'/exp OR contraindication*:ab,ti OR evaluation:ab,ti OR issue*:ab,ti OR 'adverse event*':ab,ti OR 'adverse effect*':ab,ti OR complication*:ab,ti OR deflection:ab,ti)
AND [english]/lim NOT 'conference abstract':it
= 197 |
Zoekverantwoording Databases van Recalls en Events
|
Database |
Zoektermen1 |
Totaal |
|
FDA Recalls database2
doorzocht op 25-1-2019 |
1 ‘MR’ OR ‘magnetic’ (329) 2 betreft implantaat en MRI (9) 3 betreft relevant implantaat voor deze module (0)
= 0 |
0 |
|
IGJ database veiligheidsmeldingen3 meldingen vanaf 15-12-2015
doorzocht op 29-1-2019 |
1a ‘MR’ (22) 1b ‘MRI’ (15) 1c ‘Magnetic’ (11) 2 betreft implantaat en MRI (4) 3 betreft relevant implantaat voor deze module (0)
= 0 |
|
|
IGZ archief4
doorzocht op 17- en 29-1-2019 |
1a ‘MR’ (98) 1b ‘MRI’ (92) 1c ‘Magnetic’ (27) 2 betreft implantaat en MRI (0) 3 betreft relevant implantaat voor deze module (0)
= 0 |
|
|
ICIJ database Implants5
doorzocht op 18-1-2019 |
1a ‘heart valve’ (0) 1b ‘annuloplast’ (0) 1c ‘annuloplasty ring’ (0) 1d ‘prostatic ring’ (0) 1e ‘mitraclip’ (0)
= 0 |
|
|
ICIJ database Implants5
doorzocht op 18-1-2019 |
1a ‘MR’ (38) 1b ‘MRI’ (17) 2 betreft implantaat en MRI (0) 3 betreft relevant implantaat voor deze module (0)
= 0 |
|
|
ICIJ database Events5
doorzocht op 25-1-2019 |
1a Data_notes contains “mitraclip” OR “valve”) AND Reason contains “mr” OR “magnetic” (0) 1b Data_notes contains “ring” OR “annuloplasty”) AND Reason contains ”mr” OR “magnetic” (0)
= 0 |
|
|
ICIJ database Events5
doorzocht op 18 en 25-1-2019 |
1a ‘MR’ (603) 1b ‘magnetic’ (185) 2 beoordelen of de hits niet uit de FDA-database komen (0)
= 0 Deze database heeft overlap met de FDA database2. |
- De databases hebben beperkte en onderling verschillende mogelijkheden om deze te doorzoeken. Gekozen is voor de zoek strategieën via MRI. Daarna zijn alle hits hierop na stap 1 gelezen en beoordeeld of ze een implantaat betreffen, en vervolgens of het implantaat relevant is voor deze module. Daarnaast hebben de databases beperkingen, een voorbeeld hiervan is dat een MRI gerelateerde melding van een implantaat uit de database van IGZ niet wordt gevonden in de FDA database omdat aldaar de link naar MRI is weggevallen.
- https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfres/res.cfm.
- https://www.igj.nl/onderwerpen/waarschuwingen-medische-hulpmiddelen
- https://igj.archiefweb.eu/?subsite=igz#archive.
- https://medicaldevices.icij.org/.
