24-uurs refluxmeting
Uitgangsvraag
Hoe moeten we omgaan met het gebruik van maagzuursecretieremmende medicatie door volwassenen met een vermoeden op gastro-oesofageale refluxziekte die een 24-uurs refluxmeting ondergaan?
Aanbeveling
Staak bij voorkeur de maagzuursecretieremmende medicatie voorafgaand aan het uitvoeren van de 24-uurs refluxmeting.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Op basis van de geïncludeerde studies (Hemmink, 2008 en Ang, 2018) zijn we onzeker over het effect van stoppen met behandeling met protonpompremmers (PPI’s) op de cruciale uitkomstmaat positieve symptom association probability (SAP). De bewijskracht van de gevonden resultaten is beperkt vanwege het observationele karakter van de geïncludeerde studies, het risico op bias en imprecisie. Ook zijn we onzeker over het effect van de genoemde interventies op de belangrijke uitkomstmaat positieve symptoom index (SI). De studies geven voorzichtige aanwijzingen dat (tijdelijk) staken met maagzuurremmers voorafgaand aan een 24-uurs refluxmeting, vaker een positieve SAP en SI geeft, met name bij patiënten met zuurreflux. De overall bewijskracht voor deze module is echter zeer laag (zeer laag GRADE). Er is dus sprake van een kennislacune.
Een 24-uurs refluxmeting kan informatie verstrekken over verschillende aspecten van gastro-oesofageale reflux. Het geeft inzicht in de mate van zuurexpositie van de slokdarm en in het aantal reflux-episodes, het laat zien wanneer de reflux optreedt (overdag, ’s nachts, postprandiaal), en het maakt het mogelijk om een temporale relatie aan te tonen tussen het optreden van gastro-oesofageale reflux en het optreden van klachten. Daarnaast kan een 24-uurs refluxmeting – indien uitgevoerd terwijl patiënt een PPI gebruikt – inzicht geven in de mate van suppressie van de zuursecretie onder de ingenomen medicatie.
Patiënten met typische refluxklachten (zuurbranden, regurgitatie) zonder alarmsymptomen zullen in het algemeen een empirische behandeling met een PPI ondergaan. Een 24-uurs refluxmeting zal in de regel slechts toegepast worden als er twijfel is over de diagnose refluxziekte. Dit kan zijn omdat de patiënt zogenaamde atypische refluxklachten rapporteert (klachten anders dan zuurbranden en/of regurgitatie), of als de patiënt onvoldoende reageert op in adequate dosering voorgeschreven maagzuursecretie onderdrukkende medicatie (bijvoorbeeld 2x daags PPI). In dat geval is het aantonen of uitsluiten van reflux als oorzaak van de klachten de belangrijkste reden om een 24-uurs refluxmeting te verrichten. Een positief antwoord op die vraag kan immers leiden tot langdurig voorschrijven van PPI (in geval van atypische refluxklachten) en/of het verwijzen van patiënt voor een chirurgische fundoplicatie (bijvoorbeeld in geval van onvoldoende klachtenresolutie op PPI).
Indien een 24-uurs refluxmeting uitsluitsel moet geven of er sprake is van gastro-oesofageale refluxziekte (GORZ), zal de meting zodanig uitgevoerd moeten worden dat de kans op het stellen van de diagnose refluxziekte zo groot mogelijk is. Er is één RCT verricht door Hemmink (2008) die deze vraag heeft proberen te beantwoorden. Dertig patiënten ondergingen twee keer 24-uurs pH impedantie monitoring, éénmaal tijdens PPI-gebruik, en éénmaal na staken van PPI. De volgorde van deze twee metingen was gerandomiseerd. Een positieve SAP werd vastgesteld tijdens de meting na staken van de PPI in 15/30 patiënten (50%), terwijl de SAP slechts bij 11/30 (37%) van diezelfde patiënten positief was tijdens PPI-gebruik. Uit de meta-analyse van Ang (2018) blijkt dat de kans op een positieve symptoomassociatie met niet-zure reflux toeneemt als de meting verricht wordt tijdens PPI-gebruik. De studie van Ang (2018) geeft echter geen inzicht in de totale opbrengst van de symptoomanalyse (voor zowel zure als niet-zure refluxepisodes), en het verschil daarin tussen patiënten die tijdens de meting de PPI door gebruikten en hen die tevoren de PPI inname hadden gestaakt.
Gezien het feit dat naar de mening van de werkgroep de vraag of de klachten van patiënt werkelijk worden veroorzaakt door gastro-oesofageale reflux of niet (met andere woorden: of patiënten lijden aan GORZ) de grootste klinische relevantie heeft, is de werkgroep van mening dat een 24-uurs refluxmeting uitgevoerd dient te worden na staken van PPI, omdat de kans op een positieve diagnose dan het grootste is.
In zeldzame gevallen zal een 24-uurs refluxmeting worden ingezet om te beoordelen of de voorgeschreven medicatie de maagzuurproductie voldoende remt. De kosten van een 24-uurs refluxmeting, en het veroorzaakte ongemak voor de patiënt moeten in dit geval afgewogen worden tegen die van het empirisch ophogen van de dosering van de PPI of het switchen naar een ander middel. Ook is het mogelijk dat de aanvrager geïnteresseerd is in de vraag in hoeverre de klachten van de patiënt worden veroorzaakt door weakly acidic of niet-zure reflux. Ook in dit geval kan ervoor gekozen worden om de 24-uurs refluxmeting onder inname van PPI te verrichten. De werkgroep is echter van mening dat een antwoord op die vraag geen klinische relevantie heeft.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Voor patiënten kan het belastend zijn om de PPI gedurende vijf dagen te staken, omdat sommige patiënten dan ernstiger klachten krijgen. Daar staat tegenover dat een 24-uurs refluxmeting ook een belasting kan zijn.
Het belang van een zo’n eenduidig mogelijk te interpreteren uitkomst van de meting moet worden afgewogen tegen de extra belasting voor de patiënt om de PPI tijdelijk te onderbreken. Hierin is een goede communicatie tussen zorgverlener en patiënt belangrijk, enerzijds om voor de patiënt duidelijk te krijgen wat het effect van onderbreken of continueren van de maagzuurremmers betekent, anderzijds om voor de zorgverlener duidelijk te krijgen wat de impact van het tijdelijk staken van de medicatie voor de patiënt is. In samenspraak kan besloten worden om tijdelijk antacida te gebruiken (niet op de dag van de meting zelf), om de maagzuurremmers te continueren of voor kortere tijd dan vijf dagen te onderbreken.
Kosten (middelenbeslag)
Kostenoverwegingen spelen geen rol in de keuze tussen het tijdelijk staken van behandeling met PPI’s of het doorgebruiken hiervan tijdens een 24-uurs refluxmeting.
Aanvaardbaarheid, haalbaarheid en implementatie
Overwegingen omtrent aanvaarbaarheid, haalbaarheid en implementatie spelen geen rol bij de huidige aanbeveling.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Hoewel er weinig literatuur beschikbaar is die een antwoord geeft op de vraag of 24-uurs refluxmetingen tijdens PPI-gebruik moeten worden verricht of na het staken hiervan, wijst de enige beschikbare gerandomiseerde studie in de richting van staken van de PPI, omdat hiermee bij meer patiënten kan worden vastgesteld dat er sprake is van refluxziekte.
Hoewel de bewijskracht laag is, is de werkgroep van mening dat de klinische relevantie van het stellen van een positieve diagnose groot is.
Onderbouwing
Achtergrond
Een 24-uurs refluxmeting wordt door velen gezien als de gouden standaard voor het stellen van de diagnose gastro-oesofageale refluxziekte (GORZ). Er zijn verschillende manieren waarop en omstandigheden waaronder een 24-uurs refluxmeting kan worden uitgevoerd, bijvoorbeeld: meting tijdens gebruik van maagzuurremmers of na (tijdelijk) staken van maagzuurremmers. De indruk bestaat dat hierin een grote praktijkvariatie bestaat.
Conclusies / Summary of Findings
|
Very low GRADE |
The evidence is very uncertain about the effect of cessation of PPI therapy on the positive symptom association probability measured with 24-h pH metry, compared to continuation of PPI therapy, in adults with (symptoms of) gastro-esophageal reflux disease.
Sources: Hemmink (2008) and Ang (2018) |
|
Very low GRADE |
The evidence is very uncertain about the effect of cessation of PPI therapy on the positive symptom index measured with 24-h pH metry, compared to continuation of PPI therapy, in adults with (symptoms of) gastro-esophageal reflux disease.
Sources: Hemmink (2008) and Ang (2018) |
Samenvatting literatuur
Description of studies
Hemmink (2008) performed a multicentre randomized crossover study on the diagnostic yield of 24-h pH impedance monitoring off versus on PPI therapy. They included 37 patients with typical reflux symptoms (heartburn, regurgitation, and/or chest pain), who did not respond to PPI therapy. Data of 30 patients were included in their analysis. The mean age of the patients was 46.5 years (range 19.1 to 71.8), and 20/30 (67%) patients was men. The 24-h pH impedance monitoring was performed twice in a random order, with an interval of one to four weeks. One of the measurements was performed after cessation of PPI therapy for seven days. The other measurement was done on double dose PPI therapy.
Ang (2018) performed a systematic review and meta-analysis on the diagnostic yield of ambulatory esophageal monitoring studies, which were conducted respectively off versus on PPI-therapy. They searched Pubmed, Embase and the Cochrane library for studies published until December 2016. Ang (2018) included 15 cohort studies (N=5033). In total, 1672/5033 (33%) patients and 3361/5033 (67%) patients had ambulatory monitoring respectively on and off PPI therapy. No randomised controlled trials could be included. The quality of the studies was assessed with the ROBINS-I tool for cohort studies, which revealed moderate to serious risk of bias in the included studies. Important study characteristics of the included studies are reported in Table 1.
Table 1: Characteristics of studies included in Ang (2018).
|
Study |
N (on/off PPI) |
pH-monitoring |
Age (years)* |
Gender (% male) |
Symptomatic (%) |
|
Prakash (2005) |
157 (36/121) |
Bravo |
47±13 |
36 |
55 |
|
Zerbib (2006) |
150 (71/79) |
MII-pH |
52±13 |
32 |
94 |
|
Turner (2007) |
148 (33/115) |
Bravo |
50±13
|
31 |
100 |
|
Weigt (2007) |
32 (16/16) |
MII-pH |
54 (19-74) |
50 |
NR |
|
Pace (2007) |
20 (13/7) |
MII-pH/Bilitec |
56±17 |
25 |
40 |
|
Blondeau (2007) |
100 (23/77) |
Manometry/MII-pH |
54 (22-81) |
33 |
100 |
|
Blonski (2009) |
110 (70/40) |
MII-pH |
50±17 |
32 |
NR |
|
Lacy (2011) |
352 (175/177) |
Bravo |
51±14 |
28 |
NR |
|
Kushnir (2011) |
2067 (205/1862) |
MII-pH |
50±14 |
33 |
64 |
|
Blondeau (2011) |
95 (46/49) |
MII-pH |
51 (16-82) |
39 |
57 |
|
Slaugther (2011) |
254 (68/148) |
MII-pH or Bravo |
54 (45-61) |
22 |
NR |
|
Jodorkovsky (2014) |
188 (148/40) |
MII-pH |
54 |
31 |
65 |
|
Patel (2015) |
187 (93/94) |
MII-pH |
54±12 |
29 |
61 |
|
Garros (2015) |
168 (77/91) |
MII-pH |
52 (17-83) |
38 |
68 |
|
Abdul-Hussein (2016) |
1005 (600/405) |
MII-pH |
57 |
30 |
100 |
*Age reported as mean±SD or mean (range). MII-pH = multichannel intraluminal impedance pH-metry.
Results
Positive symptom association probability (SAP)
Hemmink (2008) reported on the outcome measure positive SAP, which was defined as SAP ≥ 95%. During the measurement off PPI therapy, 15/30 (50%) of the patients had a positive SAP, compared to 11/30 (37%) patients during the measurement on PPI therapy. The risk ratio (RR, 95%CI) is 1.36 (0.76 to 2.46), in favor of the measurement off PPI therapy. This difference is considered clinically relevant (RR>1.25).
Ang (2018) reported also on the outcome measure positive SAP, which was also defined as SAP ≥ 95%. They stratified the analysis by acidity of the reflux (acid reflux and non-acid reflux).
Acid reflux (AR)
In the group patients off PPI therapy, 225/513 (44%) patients had a positive SAP, compared to 65/414 (16%) patients in the group on PPI therapy (Figure 1). The RR (95%CI) was 2.94 (2.31 to 3.74), in favor of the group off PPI therapy. This difference is considered clinically relevant (RR>1.25).
Non-acid reflux (NAR)
In the group patients off PPI therapy, 36/192 (19%) patients had a positive SAP, compared to 54/169 (32%) patients in the group on PPI therapy (Figure 1). The RR (95%CI) was 0.54 (0.30 to 0.99), in favor of the group on PPI therapy. This difference is considered clinically relevant (RR<0.8).
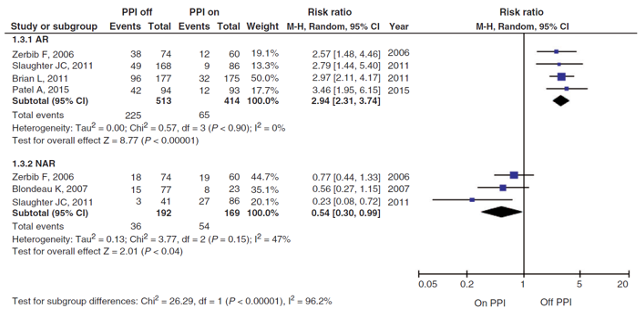
Figure 1: Forest plot of risk ratios (95%CI) for positive symptom association probability for the comparison between 24-h pH metry off or on PPIs, stratified by reflux types. Adapted from Ang (2018). AR: acid reflux, NAR: non-acid reflux
Positive symptom index (SI)
Hemmink (2008) reported on the outcome measure positive SI, which was defined as SI of ≥ 50%. During the measurement off PPI therapy 19/30 (63%) patients had a positive SI, compared to 12/30 (40%) patients during the measurement on PPI therapy. The RR (95%CI) is 1.58 (0.95 to 2.65), in favor of the measurement off PPI therapy. This difference is considered clinically relevant (RR>1.25).
Ang (2018) reported also on the outcome measure positive SI, which was also defined as SI ≥ 50%. They stratified the analysis by acidity of the reflux (acid reflux and non-acid reflux).
Acid reflux (AR)
In the group patients off PPI therapy, 132/473 (28%) patients had a positive SI, compared to 29/291 (10%) patients in the group on PPI therapy (Figure 2). The RR (95%CI) was 2.64 (1.52 to 4.57), in favor of the group off PPI therapy. This difference is considered clinically relevant (RR>1.25).
Non-acid reflux (NAR)
In the group patients off PPI therapy, 29/131 (22%) patients had a positive SI, compared to 35/162 (22%) patients in the group on PPI therapy (Figure 2). The RR (95%CI) was 0.96 (0.49 to 1.88), in favor of the group on PPI therapy. This difference is not considered clinically relevant (RR>0.8).
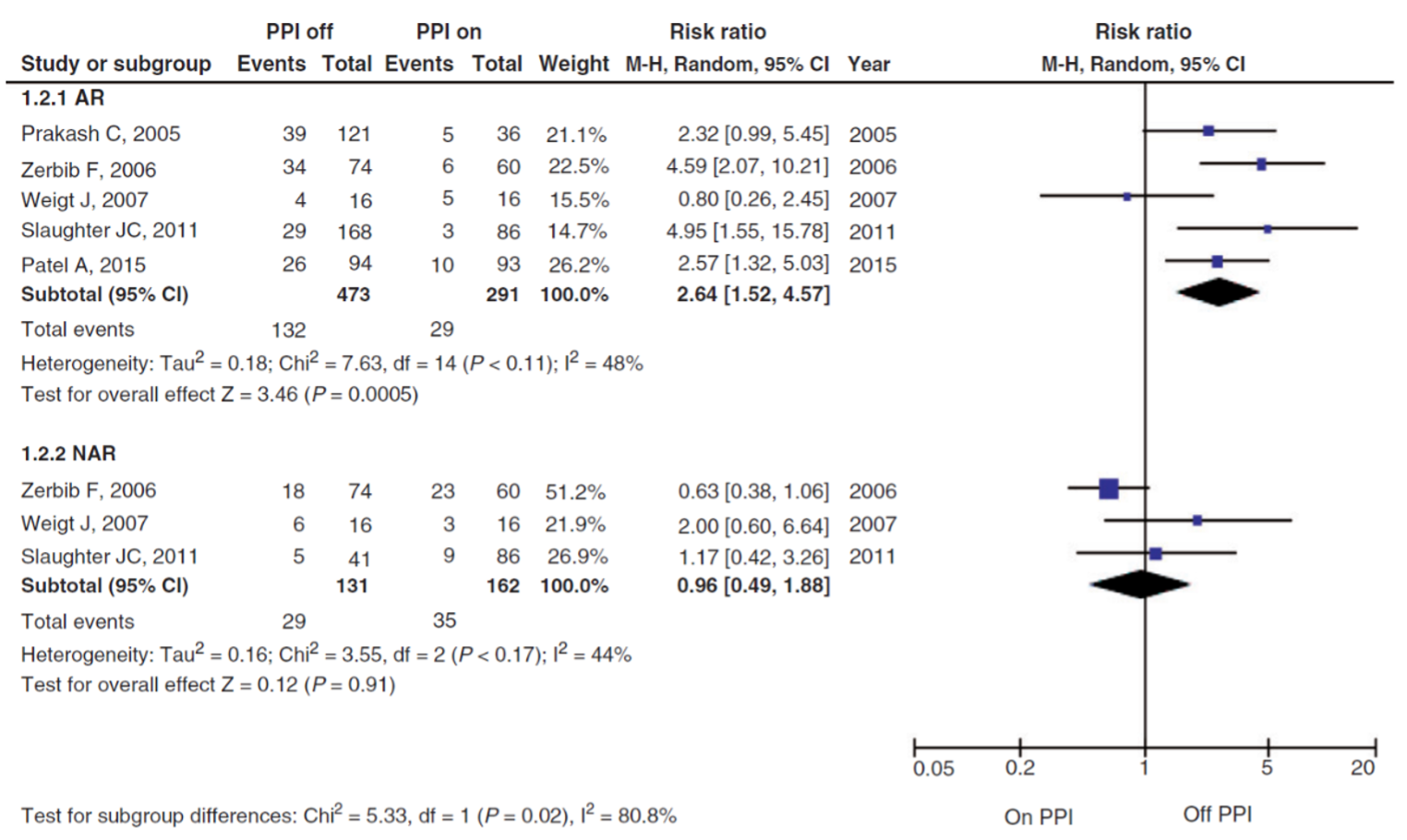
Figure 2: Forest plot of risk ratios (95%CI) for positive symptom index for the comparison between 24-h pH metry off or on PPIs, stratified by reflux types. Adapted from Ang (2018). AR: acid reflux, NAR: non-acid reflux
Level of evidence of the literature
Positive symptom association probability
The level of evidence for the outcome measure positive symptom association probability comes from observational studies and one RCT and therefore started at low certainty. The level of evidence was downgraded to very low. There was high risk of bias (e.g. confounding and patient selection, downgraded 1 level). Furthermore, for the subgroup NAR the effect estimate (95%CI) crossed one of the thresholds for clinical relevance (imprecision, downgraded 1 level).
Positive symptom index
The level of evidence for the outcome measure positive symptom index comes from observational studies and one RCT and therefore started at low certainty. The level of evidence was downgraded to very low. There was high risk of bias (e.g. confounding and patient selection, downgraded 1 level). Furthermore, for the subgroup NAR the results are inconsistent (inconsistency, downgraded 1 level) and the effect estimate (95%CI) crossed the thresholds for clinical relevance (imprecision, downgraded 1 level).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What is the diagnostic yield of 24-h pH impedance monitoring in adults with clinical suspicion of gastro-esophageal disease (GERD) off proton pump inhibitor (PPI)-therapy, compared to 24-h pH impedance monitoring on PPI therapy?
P (patients) adults with clinical suspicion of GERD
I (index test) 24-h pH impedance monitoring off PPI therapy
C (comparator test) 24-h pH impedance monitoring on PPI therapy
O (outcome measure) positive symptom association probability (SAP), positive symptom index (SI)
Timing prior to fundoplication, after period of PPI-therapy (lack of response to PPI-therapy in patients with typical reflux symptoms)
Setting secondary or tertiary care
Relevant outcome measures
The guideline development group considered positive SAP as a critical outcome measure for decision making; and positive SI as an important outcome measure for decision making.
The working group defined the outcomes measures as follows:
- Positive SAP: SAP ≥ 95%
- Positive SI: SI of 50% or greater, at least half of symptoms is associated with reflux
For all outcome measures, the default thresholds proposed by the international GRADE working group were used as a threshold for clinically relevant differences: a 25% difference in relative risk (RR) for dichotomous outcomes (RR< 0.8 or RR> 1.25), and 0.5 standard deviations (SD) for continuous outcomes.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 20 July 2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 85 hits. Studies were selected based on the following criteria: (systematic reviews of) RCTs or observational studies in which 24-h pH metry (whether or not combined with impedance monitoring) measurements after cessation of PPI therapy were compared with measurements on PPI therapy. 14 studies were initially selected based on title and abstract screening. After reading the full text, 12 studies were excluded (see the table with reasons for exclusion under the tab Methods), and two studies were included.
Results
Two studies were included in the analysis of the literature (Hemmink, 2008 and Ang, 2018). Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Ang, D., Zheng, Q., Shi, L., & Tack, J. (2018). Diagnostic yield of ambulatory oesophageal studies on versus off proton pump inhibitors: a systematic review and meta-analysis. United European Gastroenterology Journal, 6(9), 1294-1306.
- Hemmink, G. J., Bredenoord, A. J., Weusten, B. L., Monkelbaan, J. F., Timmer, R., & Smout, A. J. (2008). Esophageal pH-impedance monitoring in patients with therapy-resistant reflux symptoms:‘on’or ‘off’proton pump inhibitor?. Official journal of the American College of Gastroenterology| ACG, 103(10), 2446-2453.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: What is the diagnostic yield of 24-pH metry in adults with clinical suspicion of gastro-esophageal disease (GERD) off PPI therapy, compared to 24-h pH metry on PPI therapy?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Ang, 2018
Individual study characteristics deduced from Ang (2018)
|
SR and meta-analysis of cohort studies
Literature search up to December 2016
A: Prakash, 2005 B: Zerbib, 2006 C: Turner, 2007 D: Weigt, 2007 E: Pace, 2007 F: Blondeau, 2007 G: Blonski, 2009 H: Lacy, 2011 I: Kushnir, 2011 J: Blondeau, 2011 K: Slaugther, 2011 L: Jodorkovsky, 2014 M: Patel, 2015 N: Garros, 2015 O: Abdul-Hussein, 2016
Study design: cohort studies A: Prospective B: Prospective C: Prospective D: Prospective E: Prospective F: Prospective G: Retrospective H: Retrospective I: Retrospective J: Prospective K: Prospective L: Retrospective M:Retrospective N: Retrospective O: Retrospective
Setting and Country: A: USA B: France C: Canada D: Germany E: Italy F: Belgium G: Poland H: USA I: USA J: Belgium K: USA L: USA M: USA N: France O: USA
Source of funding and conflicts of interest: [commercial / non-commercial / industrial co-authorship]
|
Inclusion criteria SR:
Exclusion criteria SR:
15 studies included
Important patient characteristics at baseline: N A: 157 B: 150 C: 148 D: 32 E: 20 F: 100 G: 110 H: 352 I: 2067 J: 95 K: 254 L: 188 M: 187 N: 168 O: 1005
Mean age (years, ±SD/range) A: 47±13 B: 52±13 C: 50±13 D: 54 (19-74) E: 56±17 F: 54 (22-81) G: 50±17 H: 51±14 I: 50±14 J: 51 (16-82) K: 54 (45-61) L: 54 M: 54±12 N: 52 (17-83) O: 57
Sex (%male) A: 36 B: 32 C: 31 D: 50 E: 25 F: 33 G: 32 H: 28 I:33 J: 39 K: 22 L: 31 M: 29 N: 38 O: 30
Groups comparable at baseline? NR in Ang (2018). However, there was risk of confounding in all studies, which implicates imbalances between the groups.
|
Ambulatory pH-metry off PPI-therapy
A: off PPI-therapy, Bravo B: off PPI-therapy, MII-pH C: off PPI-therapy, Bravo D: off PPI-therapy, MII-pH E: off PPI-therapy, MII-pH/Bilitec F: off PPI-therapy, MII-pH/Manometry G: off PPI-therapy, MII-pH H: off PPI-therapy, Bravo I:off PPI-therapy, MII-pH J:off PPI-therapy, MII-pH K: off PPI-therapy, MII-pH or Bravo L: off PPI-therapy, MII-pH M: off PPI-therapy, MII-pH N: off PPI-therapy, MII-pH O: off PPI-therapy, MII-pH
|
Ambulatory pH-metry on PPI-therapy
A: on PPI-therapy, Bravo B: on PPI-therapy, MII-pH C: on PPI-therapy, Bravo D: on PPI-therapy, MII-pH E: on PPI-therapy, MII-pH/Bilitec F: on PPI-therapy, MII-pH/Manometry G: on PPI-therapy, MII-pH H: on PPI-therapy, Bravo I:on PPI-therapy, MII-pH J:on PPI-therapy, MII-pH K: on PPI-therapy, MII-pH or Bravo L: on PPI-therapy, MII-pH M: on PPI-therapy, MII-pH N: on PPI-therapy, MII-pH O: on PPI-therapy, MII-pH
|
End-point of follow-up: NA (results of 24h-pH metry)
For how many participants were no complete outcome data available? NA
|
Detection of raised oesophageal acid exposure time (AET) Defined as the total time oesophageal pH was less than 4 divided by the time of monitoring.
Effect measure: RR, RD, mean difference [95% CI]: A: 3.10 [1.57, 6.13] B: 3.06 [1.19, 7.86] C: 2.17 [1.32, 3.55] D: 1.20 [0.46, 3.15] E: 1.86 [0.33, 10.49] F: 8.06 [1.16, 56.17] G: 3.15 [1.61, 6.15] H: 2.37 [1.80, 3.13] I: 4.08 [2.91, 5.73] J: 2.41 [1.11, 5.24] K: 8.41 [4.10, 17.23] L: 2.25 [1.30, 3.88] M: 1.76 [1.16, 2.69] N: 0.30 [0.17, 0.54] O: 0.88 [0.70, 1.12]
Pooled effect (random effects model ): 2.16 [1.42 to 3.28] favoring off PPI-therapy. Heterogeneity (I2): 89%
Positive symptom index (SI) Defined as SI of 50% or greater (i.e. at least half of symptoms associated with reflux)
Subgroep AR A:2.32 [0.99, 5.45] B:4.59 [2.07, 10.21] D:0.80 [0.26, 2.45] K:4.95 [1.55, 15.78] M:2.57 [1.32, 5.03]
Pooled effect (random effects model ): 2.64 [1.52 to 4.57] favoring off PPI-therapy. Heterogeneity (I2): 48%
Subgroup NAR B:0.63 [0.38, 1.06] D:2.00 [0.60, 6.64] K:1.17 [0.42, 3.26]
Pooled effect (random effects model ): 0.96 [0.49 to 1.88] favoring on PPI-therapy. Heterogeneity (I2): 44%
Positive symptom association probability (SAP) Defined as SAP was 95% or greater.
Subgroup AR B: 2.57 [1.48, 4.46] H:2.97 [2.11, 4.17] K: 2.79 [1.44, 5.40] M: 3.46 [1.95, 6.15]
Pooled effect (random effects model ): 2.94 [2.31 to 3.74] favoring off PPI-therapy. Heterogeneity (I2): 0%
Subgroup NAR B: 0.77 [0.44, 1.33] F: 0.56 [0.27, 1.15] K: 0.23 [0.08, 0.72]
Pooled effect (random effects model ): 0.54 [0.30 to 0.99] favoring on PPI-therapy. Heterogeneity (I2): 96.2%
|
NAR: non-acid reflux AR: acid reflux
Authors conclusion Recognising the limitations of our meta-analysis, the decision to continue or stop PPIs prior to diagnostic tests should be individualised. In a patient with typical symptoms of heartburn and regurgitation despite a normal gastroscopy who is being considered for surgical treatment, ambulatory oesophageal pH monitoring off therapy would suffice. If symptoms persist despite PPIs, acid exposure is less likely to be the cause of symptoms; and hence combined MII-pH monitoring on therapy would provide an improved diagnostic yield. Documenting negative findings on MII-pH monitoring is equally important as a positive study, as it directs the clinician to search for a non- GERD cause and avoid unnecessary anti-reflux treatment.
Remarks Sensitivity analyses available (e.g. by excluding study with serious risk of bias), subgroup analyses available (e.g. cohort design, AET cut-off, pH monitoring tools and regions).
|
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Abdul-Hussein M, Zhang C, Castell D. Symptom Index or Symptom Association Probability?: A Closer Look at Symptom Association in Suspected GERD Patients. J Clin Gastroenterol. 2018 Jan;52(1):e7-e10. doi: 10.1097/MCG.0000000000000762. PMID: 27875359. |
Included in Ang, 2018 |
|
Bredenoord AJ, Weusten BL, Timmer R, Conchillo JM, Smout AJ. Addition of esophageal impedance monitoring to pH monitoring increases the yield of symptom association analysis in patients off PPI therapy. Am J Gastroenterol. 2006 Mar;101(3):453-9. doi: 10.1111/j.1572-0241.2006.00427.x. Epub 2006 Feb 8. PMID: 16464226. |
Wrong comparison (pH-metry vs combined pH- impedance-metry), all patients off PPI |
|
Clayton SB, Rife CC, Singh ER, Kalbfleisch JH, Castell DO. Twice-daily proton pump inhibitor therapy does not decrease the frequency of reflux episodes during nocturnal recumbency in patients with refractory GERD: analysis of 200 patients using multichannel intraluminal impedance-pH testing. Dis Esophagus. 2012 Nov-Dec;25(8):682-6. doi: 10.1111/j.1442-2050.2011.01310.x. Epub 2012 Jan 31. PMID: 22292567. |
Focus on recumbent reflux |
|
Frazzoni M, Frazzoni L, Ribolsi M, Bortoli N, Tolone S, Russo S, Conigliaro R, Penagini R, Fuccio L, Zagari RM, Savarino E. Applying Lyon Consensus criteria in the work-up of patients with proton pump inhibitory-refractory heartburn. Aliment Pharmacol Ther. 2022 Jun;55(11):1423-1430. doi: 10.1111/apt.16838. Epub 2022 Feb 28. PMID: 35229321. |
Wrong study design (study on applying the Lyon consensus in the work-up, with no comparison on diagnostic yield between off and on PPI) |
|
Frazzoni M, Frazzoni L, Tolone S, De Bortoli N, Savarino V, Savarino E. Lack of improvement of impaired chemical clearance characterizes PPI-refractory reflux-related heartburn. Am J Gastroenterol. 2018 May;113(5):670-676. doi: 10.1038/s41395-018-0044-5. Epub 2018 Apr 23. PMID: 29681623. |
Wrong study design (focus on clarifying mechanism of heartburn refractoriness to PPI by comparing on PPI impedance pH metry in patients with PPI-responsive heartburn with patients with PPI-refractory heartburn). |
|
Garrean CP, Zhang Q, Gonsalves N, Hirano I. Acid reflux detection and symptom-reflux association using 4-day wireless pH recording combining 48-hour periods off and on PPI therapy. Am J Gastroenterol. 2008 Jul;103(7):1631-7. doi: 10.1111/j.1572-0241.2008.01829.x. Epub 2008 Jun 28. PMID: 18557714. |
Full text not available |
|
Lacy BE, Chehade R, Crowell MD. A prospective study to compare a symptom-based reflux disease questionnaire to 48-h wireless pH monitoring for the identification of gastroesophageal reflux (revised 2-26-11). Am J Gastroenterol. 2011 Sep;106(9):1604-11. doi: 10.1038/ajg.2011.180. Epub 2011 Jun 21. PMID: 21691342. |
Included in Ang, 2018 |
|
Patel A, Sayuk GS, Gyawali CP. Parameters on esophageal pH-impedance monitoring that predict outcomes of patients with gastroesophageal reflux disease. Clin Gastroenterol Hepatol. 2015 May;13(5):884-91. doi: 10.1016/j.cgh.2014.08.029. Epub 2014 Aug 23. PMID: 25158924; PMCID: PMC4339660. |
Included in Ang, 2018 |
|
Patel A, Sayuk GS, Kushnir VM, Chan WW, Gyawali CP. GERD phenotypes from pH-impedance monitoring predict symptomatic outcomes on prospective evaluation. Neurogastroenterol Motil. 2016 Apr;28(4):513-21. doi: 10.1111/nmo.12745. Epub 2015 Dec 20. PMID: 26686239; PMCID: PMC4808441. |
Same study population as Patel, 2016 |
|
Becker V, Grotz S, Schlag C, Nennstiel S, Beitz A, Haller B, Schmid RM, Meining A, Bajbouj M. Positive predictors for gastroesophageal reflux disease and the therapeutic response to proton-pump inhibitors. World J Gastroenterol. 2014 Apr 14;20(14):4017-24. doi: 10.3748/wjg.v20.i14.4017. PMID: 24744591; PMCID: PMC3983457. |
Wrong study design (focus on the predictors for PPI response) |
|
Blonski W, Vela MF, Castell DO. Comparison of reflux frequency during prolonged multichannel intraluminal impedance and pH monitoring on and off acid suppression therapy. J Clin Gastroenterol. 2009 Oct;43(9):816-20. doi: 10.1097/MCG.0b013e318194592b. PMID: 19398927. |
Included in Ang, 2018 |
|
Zerbib F, Roman S, Ropert A, des Varannes SB, Pouderoux P, Chaput U, Mion F, Vérin E, Galmiche JP, Sifrim D. Esophageal pH-impedance monitoring and symptom analysis in GERD: a study in patients off and on therapy. Am J Gastroenterol. 2006 Sep;101(9):1956-63. doi: 10.1111/j.1572-0241.2006.00711.x. Epub 2006 Jul 18. PMID: 16848801. |
Included in Ang, 2018 |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 15-10-2024
Beoordeeld op geldigheid : 14-10-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met GORZ.
Werkgroep
- Prof. dr. A.J. Bredenoord, MDL-arts, Amsterdam UMC, NVMDL (voorzitter)
- Dr. J.M. Conchillo, MDL-arts, Maastricht UMC+, NVMDL
- Dr. R.C.H. Scheffer, MDL-arts, Jeroen Bosch Ziekenhuis, NVMDL
- Prof. dr. B.L.A.M. Weusten, MDL-arts, UMC Utrecht en Sint Antonius Ziekenhuis Nieuwegein, NVMDL
- Dr. V.B. Nieuwenhuijs, Chirurg, Isala, NVvH
- Dr. W.E. Hueting, Chirurg, Alrijne Ziekenhuis, NVvH
- Prof. dr. M.E. Numans, hoogleraar huisartsengeneeskunde/huisarts, Leiden Universitair Medisch Centrum, NHG
- I. van Ee, Adviseur patientenbelang, Patientenfederatie Nederland
Klankbordgroep
- M. Claassen, diëtist, Baseline Diëtisten, NVD
- Dr. J.W.K. van den Berg, longarts, Isala, NVALT
- Drs. R.N.P.M. Rinkel, KNO-arts, Amsterdam UMC, NVKNO
- Drs. A. Horikx, apotheker, KNMP
- Drs. A. van der Beek, Internist, Ziekenhuis Rivierenland, NIV
- Drs. I.B.Y. Tack, arts VG, Erasmus MC, NVAVG
- A.M.M. Botter – Mulder MSc, apotheker, Brocacef Ziekenhuisfarmacie, NVAVG
Met ondersteuning van
- H. Olthuis-van Essen MSc, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. N. Kampstra, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Werkgroep
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Prof. dr. A.J. Bredenoord (voorzitter) |
MDL-arts, Amsterdam UMC |
Lid Medische Ethische Toetsing Commissie AMC (onbetaald), Voorzitter Europese EoE research Network EUREOS (onbetaald), Lid Raad van Toezicht MLDS (onbetaald) |
Onderwijsvergoedingen door Laborie en Medtronic, Organisator diverse symposia welke deels gesponsord werden door commerciële partijen; PI van onderzoek EoE, financier Nutricia; PI van onderzoek medicatie nuldelijn, financier Bayer en Norgine (afgerond bij start richtlijn, niet behandeld in richtlijn); betrokken bij onderzoek experimenteel behandelapparaat, financier SST (niet behandeld in richtlijn). |
Geen restricties |
|
Dr. J.M. Conchillo |
MDL-arts, Maastricht UMC+ |
Secretaris sectie Neurogastroenterologie en Motiliteit NVGE (onbetaald) |
Geen |
Geen restricties |
|
Dr. R.C.H. Scheffer |
MDL-arts, Jeroen Bosch Ziekenhuis |
Geen |
Geen |
Geen restricties |
|
Prof. dr. B.L.A.M. Weusten |
MDL-arts, UMC Utrecht |
Geen |
Allen buiten de scope van de richtlijn: Consultancy Pentax Medical en financiering voor onderzoek over cryoballonablatie (in het kader van Barrett-slokdarm en behandeling diabetes), PI van onderzoek naar cryonballonablatie in Barrett-slokdarm; PI van dosefinding onderzoek voor cryoablatieballon, financier C2-therapeutics en Pentax MEdical; PI van (dierexperimenteel) onderzoek naar nieuwe vorm van ablatie bij Barrett-slokdarm. |
Geen restricties |
|
Dr. V.B. Nieuwenhuijs |
Chirurg, Isala |
Geen |
Geen |
Geen restricties |
|
Dr. W.E. Hueting |
Chirurg, Alrijne Ziekenhuis |
Voorzitter netwerk Zuur chirurgen antireflux en hiatale hernia, invited speaker B/D |
Geen |
Geen restricties |
|
Prof. dr. M.E. Numans |
hoogleraar huisartsengeneeskunde LUMC
|
Huisarts in Utrecht (betaald); Richtlijnontwikkeling NHG: maagklachten, leveraandoeningen |
Project leefstijlinterventies bij refluxklachten, geen projectleider, financier: MLDS |
Geen restricties |
|
I. van Ee |
Adviseur patiëntenbelang, Patientenfederatie Nederland |
Patiëntvertegenwoordiger EUPATI-fellow, Coördinator patiëntenparticipatie en onderzoek en lid central redactie bij Psoriasis patiënten Nederland (onbetaald). |
Geen |
Geen restricties |
Klankbordgroep
|
Klankbord-groep lid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
M. Claassen |
Diëtist, Baseline Diëtisten |
Geen |
Geen |
Geen restricties |
|
Dr. J.W.K. van den Berg |
Longarts, Isala |
Geen |
Chronische hoest studies, projectleider, financiële ondersteuning door MSD |
Geen restricties |
|
Drs. R.N.P.M. Rinkel |
KNO-arts, Amsterdam UMC |
Lid Beroepsgenoot Tuchtcollege; Raad van Advies Fontys Hogeschool Logopedie |
Geen |
Geen restricties |
|
Drs. A. Horikx |
Apotheker KNMP |
Geen |
Geen |
Geen restricties |
|
Drs. A. van der Beek |
Internist, Ziekenhuis Rivierenland |
voorzitter adviescommissie GE NIV (onbetaald) |
Geen |
Geen restricties |
|
Drs. I.B.Y. Tack |
Arts VG voor dokter Tack, Docent Erasmus MC |
Consulent CCe (betaald); gastdocent huisartsenopleiding/GZ Psychologen/LACCS (betaald); commissie onderwijs NVAVG (onbetaald) |
Geen |
Geen restricties |
|
A.M.M. Botter – Mulder MSc |
Apotheker, Brocacef Ziekenhuisfarmacie |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van de Patientenfederatie Nederland in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kopje waarden en voorkeuren van patiënten). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patientenfederatie Nederland en de aangeleverde commentaren zijn bekeken en verwerkt .
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
24-uurs refluxmeting |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling breed toepasbaar is (5.000 - 40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Methode ontwikkeling
Evidence based
Werkwijze
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met GORZ. Tevens zijn er (aanvullende) knelpunten aangedragen door de Nederlandse Vereniging van Maag-Darm-Leverartsen, Nederlandse Internisten Vereniging, Nederlandse Vereniging voor Klinische Geriatrie, Nederlands Huisartsen Genootschap, Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie, Nederlandse Vereniging van ZiekenhuisApothekers, Zorginstituut Nederland, Nederlandse Vereniging van Diëtisten, Verpleegkundigen & Verzorgenden Nederland, Nederlandse Vereniging Artsen Verstandelijk Gehandicapten, Nederlandse Vereniging voor Gynaecologie en Obstetrie, Nederlandse Vereniging voor Pathologie, Vereniging Innovatieve Geneesmiddelen en de Nederlandse Vereniging van Ziekenhuizen via een schriftelijke knelpuntenanalyse. Een verslag hiervan is opgenomen onder aanverwante producten. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
| GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd (pending).
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekverantwoording
Algemene informatie
|
Richtlijn: NVMDL Gastro-oesofageale refluxziekte |
|
|
Uitgangsvraag: Hoe dient een ambulante refluxmeting bij volwassenen met een vermoeden op refluxziekte uitgevoerd te worden? |
|
|
Database(s): Medline (OVID), Embase |
Datum: 20-07-2022 |
|
Periode: >2000 |
Talen: Geen beperking |
|
Literatuurspecialist: Linda Niesink |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting en opmerkingen:
→ Voor deze vraag is gezocht op de elementen gastro-oesofageale refluxziekte (in het blauw), PH-metrie (in het groen) en stoppen met PPI (in het rood).
De genoemde sleutelartikelen van Hemmink (2008), Zerbib (2006), Bredenoord (2006) en Herregods (2018) zitten in de zoekopbrengst. Sifrim (2005) gaat niet over (stoppen met) PPI en valt daarom buiten de zoekopbrengst.
Resultaten staan in Rayyan.
|
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase (via embase.com) en Medline (via OVID) is op 20-07-2022 met relevante zoektermen gezocht vanaf 2000 naar systematische reviews, RCT’s en observationele studiedesigns over ambulante refluxmeting waarbij PPI gestopt wordt bij patiënten met (verdenking op) gastro-oesofageale refluxziekte. De literatuurzoekactie leverde 85 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
2 |
1 |
2 |
|
RCT’s |
7 |
7 |
10 |
|
Observationele studies |
52 |
46 |
73 |
|
Totaal |
61 |
54 |
85 |
Zoekstrategie
|
Database |
Zoektermen |
||||||||||||||||||||||||||||||||||||
|
Embase
|
|
||||||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 *exp Gastroesophageal Reflux/ or ((ardioesophageal or cardiooesophageal or esophageal or esophagogastric or esophagus or oesophageal or gastroesophageal or gastroesophagus or gastrooesophageal or oesophagogastric or oesophagus) adj3 (reflux or reflex or regurgitation)).ti,ab,kf. or gerd.ti,kf. or gord.ti,kf. (34369) 2 exp Esophageal pH Monitoring/ or ((ardioesophageal OR cardiooesophageal OR esophageal OR esophagogastric OR esophagus OR oesophageal OR gastroesophageal OR gastroesophagus OR gastrooesophageal OR oesophagogastric OR oesophagus OR ambulatory) adj3 ph* adj3 (monitor* OR measur*)).ti,ab,kf. or (phmetry or ph-metry).ti,ab,kf. (5288) 3 ((exp Proton Pump Inhibitors/ or (proton-pump or 'ppi therapy').ti,ab,kf.) and cessat*.ti,ab,kf.) or ((proton-pump or ppi) adj3 off).ti,ab,kf. (484) 6 1 and 2 and 3 (99) 7 limit 6 to yr="2000 -Current" (98) 8 7 not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) (98) 9 (meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) (566916) 10 (exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf.) not (animals/ not humans/) (1378232) 11 Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) (5162966) 12 8 and 9 (1) – SRs 13 (8 and 10) not 12 (7) - RCTs 14 (8 and 11) not (12 or 13) (46) - observationele studies 15 12 or 13 or 14 (54)
|
