Meerwaarde PET bij biliaire tumoren
Uitgangsvraag
Wat is de waarde van Positron Emission Tomography (PET) in de work-up van patiënten met kanker van de galweg of galblaas voor het detecteren van afstandsmetastasen?
Aanbeveling
Aanbeveling 1
Verricht niet standaard een 18F-FDG-PET-scan bij de stadiëring van patiënten met galblaas- of galwegkanker.
Aanbeveling 2
Overweeg wél een 18F-FDG-PET-scan bij patiënten met:
- een grote kans op afstandsmetastasen
- een bovengemiddeld operatierisico
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
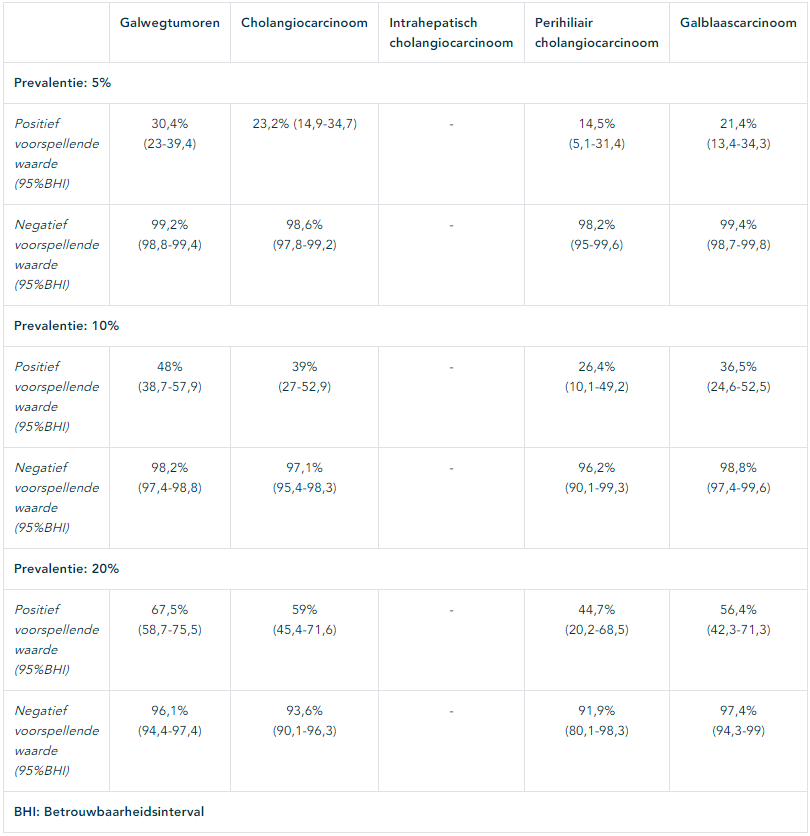
Het doel van PET in de stadiëring van biliaire tumoren is de detectie van metastasen die niet zichtbaar zijn op CT. Het voordeel van een PET is dat bij een bewezen metastase het behandelplan verandert van resectie naar palliatieve behandeling. Het nadeel is de matige positief voorspellende waarde van slechts 68% bij een prevalentie van bijvoorbeeld 20% (Tabel 1.3). De beslissing om af te zien van een operatie zal daarom altijd bevestigd moeten worden door een biopt. Een biopt van bijvoorbeeld een kleine afwijking centraal in de longen of het abdomen is niet zonder risico. Bovendien kan een dergelijk biopt ook fout negatief zijn. Tenslote vertraagt het verrichten van een PET-scan en verkrijgen van een biopt de stadiëring met enkele weken.
Tabel 1.3 Voorspellende waarden van PET voor het detecteren van afstandsmetastasen bij een veronderstelde prevalentie van 5%, 10% of 20%. De voorspellende waarden zijn op basis van de gepoolde sensitiviteit en specificiteit van de PET-scan.
Drie studies met in totaal 171 patiënten vonden een kans van 17% dat het behandelplan verandert door een aanvullende PET (Lamarca, 2019). Hierbij ging het niet altijd om afstandsmetastasen, maar ook bijvoorbeeld een tweede primaire tumor. In een recentere studie (Ferrone 2020) werd bij 5 van de 15 patiënten met resectabel intrahepatisch cholangiocarcinoom afgezien van een operatie op basis van de PET uitslag waarop uitgebreidere ziekte was gevonden. Echter, detectie hiervan is vaak ook mogelijk met een vriescoupe van een biopt van het peritoneum of de lever verkregen middels diagnostische laparoscopie.
Helaas is er geen RCT verricht waarin patiënten wel of niet een aanvullende PET scan kregen. Hierdoor weten we niet wat het effect van de PET scan is op overleving en kosten. Een dergelijke RCT voor patiënten met colorectale lever metastasen vond een verandering in behandelplan bij 8%, maar geen verschil in overleving (Moulton, 2014).
De kwaliteit van het bewijs voor sensitiviteit en specificiteit is afgewaardeerd door de heterogeniteit van de studies en de brede betrouwbaarheidsintervallen. Bovendien hebben de meeste patiënten in deze studies ongeveer 20 jaar geleden een CT-scan gehad. Inmiddels is de kwaliteit van CT-scans verbeterd waardoor een deel van de metastasen zichbaar op PET scan tegenwoordig waarschijnlijk ook zichtbaar is op CT. Bovendien is ook de kwaliteit van de PET-scans verbeterd, maar dit moet nog blijken uit studies voor deze indicatie. Hierbij wordt er ook verwezen naar de samenvatting van de EANM (European Association of Nuclear Medicine) richtlijnen over het gebruik van PET/CT in de oncologie (https://richtlijnendatabase.nl/gerelateerde_documenten/f/17259/18F-FDG%20PETCT%20in%20Oncology.pdf).
Gezien de kwaliteit van het bewijs en de verbetering van CT-scans, is de werkgroep niet overtuigd dat een aanvullende PET-scan in meer dan 20% van de patiënten die in aanmerking komen voor een resectie een afstandsmetastase zal vinden die leidt tot het afzien van een resectie. De lat van 20% is relatief hoog gekozen omdat een RCT ontbreekt om daadwerkelijk een voordeel in overleving aan te tonen en kosteffectiviteit vast te stellen. Bovendien heeft de PET-scan ook nadelen zoals een langere periode van diagnostiek en onzekerheid. Tenslotte gaat het vaak om peritoneale en levermetastasen die deels ook met een stadiëringslaparoscopie voorafgaand aan een resectie worden gevonden.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
De extra belasting van een PET-CT is beperkt; behalve een dieet op de dag van het onderzoek en achteraf extra vocht innemen, is de onderzoek duur ongeveer 45 min, waarbij er platgelegen dient te worden. Daarnaast leidt een aanvullende PET-scan tot een periode van onzekerheid over de uitgebreidheid van de ziekte en het behandelplan. Deze periode kan enkele weken duren als een afwijking wordt gevonden waarvan vervolgens een biopt nodig is ter bevestiging of er sprake is van een uitzaaiing.
Kosten (middelenbeslag)
Een kosten-effectiviteits analyse voor de Nederlandse setting ontbreekt in de literatuur. De kosten van een PET-scan zijn rond de 1000 euro. Bovendien leidt een PET-scan vaak tot aanvullende diagnostiek en kosten (bv voor een biopt) om afwijkingen op de PET-scan te bevestigen. Daar staat tegenover dat operaties voor biliaire tumoren veel kosten met zich meebrengen. Een PET-scan kan daarom ook kosten besparen door detectie van een voorheen onbekende afstandsmetastase. Een operatie is immers niet zinvol bij een bewezen afstandsmetastase.
Aanvaardbaarheid, haalbaarheid en implementatie
PET-scan wordt op het moment in Nederland slechts incidenteel verricht voor de stadiëring van patiënten met biliaire tumoren. Gezien de kleine patiënten aantallen voorzien we geen belemmerende factoren, mocht toekomstig onderzoek laten zien dat een PET-scan kosteneffectief is.
Rationale van aanbeveling 1: weging van argumenten voor en tegen de interventies
Er is onvoldoende bewijs om bij iedere patiënt met galblaas of galwegkanker een PET-scan uit te voeren ter stadiëring.
Rationale van aanbeveling 2: weging van argumenten voor en tegen de interventies
Een PET-scan is mogelijk wel van aanvullende waarde in patiënten met een grote kans op afstands metastasen; bijvoorbeeld, bij een lokaal uitgebreide tumor of bij hoge tumormarkers (CA 19-9 of CEA). De kans op verandering van behandelplan door het vinden van metastasen lijkt het grootst bij galblaaskanker en intrahepatisch cholangiocarcinoom. Ook kan een PET-scan zinvol zijn in patiënten met een bovengemiddeld operatierisico. Bij deze patiënten is het nog belangrijker om occulte afstandsmetastasen te ontdekken, omdat een hoger operatierisico alleen te rechtvaardigen is bij een aanzienlijk oncologisch voordeel van resectie.
Onderbouwing
Achtergrond
Bij patiënten met verdenking op galblaas of galweg kanker, wordt een CT Thorax-abdomen ter stadiëring uitgevoerd. Aanwezigheid van afstandsmetastasen bepaalt het beleid. Met CT is het echter moeilijk om kleine afstandsmetastasen te detecteren. 18F-FDG-PET CT (hierna PET) is door het verhoogde metabolisme in tumoren gevoelig voor het aantonen van metastasen. De vraag is of PET een meerwaarde heeft in de diagnostiek tov alleen een CT bij deze patiëntengroep. Een mogelijk voordeel is dat PET afstandsmetastasen aantoont waardoor een chirurgische resectie niet meer zinvol is. Mogelijke nadelen zijn de kans op fout-positieve uitslagen (i.e. vals alarm), de vertraging in het diagnostisch traject en de kosten. Nieuwe veelbelovende nucleaire scans zoals FAPI-PET vallen buiten de scope van deze module.
Conclusies / Summary of Findings
Survival
|
NO GRADE |
None of the included studies reported survival outcomes examined in a randomized controlled trial.
|
Cost-effectiveness
|
NO GRADE |
Cost-effectiveness was not reported in the included study.
|
Change in management
|
NO GRADE |
The results for change in management could not be assessed with GRADE.
|
Accuracy in biliary tract cancer (as a composite)
|
MODERATE GRADE |
The confidence is moderate in the sensitivity and specificity of PET for detecting distant metastases in patients with biliary tract cancer suspected of distant metastases after a negative CT-scan.
Sources: (Lamarca, 2019) |
Accuracy in cholangiocarcinoma (as a composite)
|
MODERATE GRADE |
The confidence is moderate in the sensitivity and specificity of PET for detecting distant metastases in patients with a cholangiocarcinoma suspected of distant metastases after a negative CT-scan.
Sources: (Lamarca, 2019) |
Accuracy in intrahepatic cholangiocarcinoma
|
NO GRADE |
None of the included studies reported data of PET for detecting distant metastases in patients with an intrahepatic cholangiocarcinoma suspected of distant metastases after a negative CT-scan. |
Accuracy in perihilar cholangiocarcinoma
|
MODERATE GRADE |
The confidence is moderate in the sensitivity and specificity of PET for detecting distant metastases in patients with a perihilar cholangiocarcinoma suspected of distant metastases after a negative CT-scan.
Sources: (Lamarca, 2019) |
Accuracy in gallbladder cancer
|
MODERATE GRADE |
The confidence is moderate in the sensitivity and specificity of PET for detecting distant metastases in patients with gallbladder cancer suspected of distant metastases after a negative CT-scan.
Sources: (Lamarca, 2019) |
Samenvatting literatuur
Description of studies
Lamarca (2019) conducted a systematic review by searching MEDLINE on September19, 2018 to assess the applicability of the PET-scan in patients suspected of a primary or relapsed biliary tract carcinoma. Studies were eligible for inclusion when the studies had a prospective or retrospective design, provided information to construct a 2-by-2 table for assessment on patient level or when data was reported about change in management based on PET, and when the reference standard was a pathologic assessment (histology or cytology) or radiologic imaging follow-up of at least 6 months. Case-reports, reviews and studies with other reference standards were excluded. Forty-six observational studies were included in the analysis. No randomized controlled trials were included. Thirty studies were used for the pooled analysis of biliary tract carcinomas with sub-analyses for several tumor sites and were conducted in Japan, Spain, Turkey, Germany, Italy, Korea, USA, China, Taiwan, or Switzerland. The QUADAS-2 tool was used by the authors to assess the risk of bias and the applicability. The study design was retrospective (n=14), prospective (n=6), or unclear (n=10).
The amount of 18F-FDG injected varied, when reported (in 14 studies), from 3 MBq/kg to the highest reported value of 555 MBq. Iodinated intravenous contrast was used in 1 study, while 20 studies did not use iodinated contrast (not reported in n=9 studies). Image acquisition time ranged between 45 and 100 minutes, with most studies reporting this variable had a time around 60 minutes. Image reconstruction was performed in 2D (in n=2 studies), 3D (in n=7 studies), or image reconstruction was not reported (in n=21 studies). The prevalence of biliary tract cancer ranged between 25% and 100% in the included studies (median: 78%, 29 studies, one study excluded due to a reporting error). Cancer status was assessed before surgery (in n=11 studies) or at all stages (in n=19 studies).
A total of 2125 patients were included in the systematic review. Nine studies were included for the meta-analyses concerning PET/CT detecting distant metastases. These individual studies reported prior testing with CT (including multirow detector and contrast enhanced), MRI, or both CT and MRI whereafter a PET/CT was conducted to detect distant metastases. Other prior testing included physical examination, ultrasonography, CA19-9 tumor marker, ERCP, PTCD, and/or MRCP.
Results
Survival
None of the included studies reported survival outcomes examined using a randomized controlled trial design.
Cost-effectiveness
None of the included studies reported this outcome.
Change of management
Lamarca (2019) pooled the results of three studies (Ruys, 2011; Corvera, 2008; Petrowski, 2006)), comprising of 171 patients, recording the change in management in the pre-operative phase. The pooled estimate was a change in management in 17% of the patients (95%CI: 9-25%, random effects model, I2: 48%, Chi2 p=0.15).
For 50 patients, Lamarca (2019) found that there were sufficient details reported about the implications of the change in management. A higher staging was present in 39 of the 50 patients after a PET-scan due to the identification of previously undetected tumor locations.
Ferrone (2020) described a retrospective cohort of 37 patients with intrahepatic cholangiocarcinoma who underwent additional PET scan. The cohort included 15 patients with resectable disease on conventional imaging, of whom 5 (33%) patients had new findings on PET-scan with a change in treatment plan. In one patient the PET-scan found involvement of the diaphragm and caval vein. Four patients were found to have distant metastatic disease on PET-scan; two patients had occult liver metastases, one patient peritoneal metastases, and one extraregional lymph node metastasis. All were confirmed by biopsy or follow-up and patients received palliative treatment rather that surgical resection.
Diagnostic accuracy
Pooled estimates of PET sensitivity, specifivity, and their respective 95% confidence intervals to detect distant metastases as reported by Lamarca (2019) are summarized in Table 1.1.
Table 1.1 Pooled sensitivity and specificity estimates for 18F-FDG-PET detecting distant metastases, from Lamarca (2019)
|
Cancer site |
Sensitivity (95%CI) for detecting distant metastasis |
Specificity (95%CI) for detecting distant metastasis |
|
Biliary tract cancer |
85.4 (79.5–90.2) |
89.7 (86.0–92.7) |
|
Cholangiocarcinoma |
76.4 (64.8–85.8) |
86.7 (80.5–91.5) |
|
Intrahepatic cholangiocarcinoma |
- |
- |
|
Perihilar cholangiocarcinoma |
72.7 (39.0–94.0) |
77.5 (61.5–89.2) |
|
Gallbladder cancer |
91.1 (82.6–96.4) |
82.4 (71.8–90.3) |
Biliary tract cancer (as a composite, including gallbladder cancer)
Lamarca (2019) pooled nine studies for the sensitivity of detecting distant metastases in patients with biliary tract cancer (random effects, I2: 53.2%, Chi2 p=0.029). The pooled sensitivity estimate was 85.4% (95%CI: 79.5-90.2). Pooling nine studies (random effects, I2: 89.1%, Chi2 p=<0.001) for the specificity in detecting distant metastases, the pooled specificity estimate was 89.7% (95%CI: 86.0 to 92.7).
Cholangiocarcinoma (as a composite, without gallbladder cancer)
Pooling five studies for the sensitivity of detecting distant metastases (random effects, I2: 89%, Chi2 p<0.001) in patients with cholangiocarcinoma, Lamarca (2019) reported a summary sensitivity estimate of 76.4% (95%CI: 64.8 to 85.8). Five studies were pooled for the specificity (random effects, I2: 89.0%, Chi2 p<0.001), where the summary specificity estimate was 86.7% (95%CI: 80.5 to 91.5).
Intrahepatic cholangiocarcinoma
None of the included studies in Lamarca (2019) were pooled for the diagnostic accuracy of detecting distant metastases in patients with intrahepatic cholangiocarcinoma.
Perihilar cholangiocarcinoma
Lamarca (2019) pooled two studies for the sensitivity of detecting distant metastases in patients with a perihilar cholangiocarcinoma (random effects, I2: 0%, Chi2 p=0.569), the sensitivity estimate was 72.7% (95%CI: 39 to 94). Pooling two studies (random effects, I2: 52.1%, Chi2 p=0.148) for the specificity, the summary specificity estimate for distant metastases was 77.5% (95%CI: 61.5 to 89.2).
Gall bladder cancer
Lamarca (2019) pooled four studies for the sensitivity of detecting of distant metastases (random effects, I2: 0%, Chi2 p=0.709), the summary sensitivity estimate was 91.1% (95%CI: 82.6 to 96.4). Four studies were pooled (random effects, I2: 85.0%, Chi2 p<0.001) for the specificity in detecting distant metastases, the summary specificity estimate was 82.4% (95%CI: 71.8 to 90.3).
Level of evidence of the literature
The level of evidence regarding survival outcomes were not GRADEd, since this outcome was not examined in a randomized design. The level of evidence regarding cost-effectiveness was not GRADEd, since the included study did not report cost-effectiveness as an outcome.
The level of evidence regarding ‘change in management’ could not be performed because this is a descriptive outcome.
The level of evidence regarding the diagnostic accuracy of PET for detecting distant metastases in patients with any biliary tract cancer and a negative CT-scan for distant metastases is summarized in Table 1.2.
Table 1.2 GRADEing for the diagnostic test accuracy of PET detecting distant metastases in patients with any biliary tract cancer and a negative CT-scan for distant metastases
|
Cancer site |
GRADE* |
|
|
Sensitivity |
Specificity |
|
|
Biliary tract cancer |
MODERATE1 |
MODERATE1 |
|
Cholangiocarcinoma |
MODERATE2,3 |
MODERATE2 |
|
Intrahepatic cholangiocarcinoma |
NO GRADE |
NO GRADE |
|
Perihilar cholangiocarcinoma |
MODERATE4 |
MODERATE2,4 |
|
Gallbladder cancer |
MODERATE4,5 |
MODERATE2,3 |
|
*Publication bias was not assessed since there are no clear statistical methods to assess publication bias in diagnostic test accuracy studies. 2: One level downgraded due to inconsistency. The forest plot was absent, however the provided I2 measure and/or Chi2 test indicated heterogeneity. We downgraded one level; however, this is difficult to assess without the forest plot. 3: Not downgraded for imprecision: Heterogeneity can be a likely the cause of the somewhat wider confidence interval for the pooled estimate. We already downgraded for inconsistency (heterogeneity). 4: One level downgraded due to imprecision. The lower border of the 95%CI potentially leads to a different conclusion about PET than the upper border. |
||
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the diagnostic accuracy of 18F-FDG-PET as an add-on after a CT-scan for detecting distant metastases at initial staging in patients with any biliary tract cancer without evidence of distant metastases on the CT-scan?
| P: | patients with any biliary tract cancer without evidence of distant metastasis on a CT-scan; |
| I: | PET-scan; |
| C: | -; |
| R: | pathology or cytology proven malignancy, or a clinical course with a long enough follow-up; |
| O: | survival, cost-effectiveness, change of management, sensitivity, specificity |
Relevant outcome measures
The guideline development group considered survival and cost-effectiveness for detecting the distant metastases as a critical outcome measure for decision making; and change in management, sensitivity, and specificity as an important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group agreed that an additional PET-scan should detect distant metastasis that was not diagnosed on CT in at least 20% of patients who were otherwise eligible for resection.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched for systematic reviews with relevant search terms until August 31, 2021. Medline (via OVID) and Embase (via Embase.com) were also searched until January 12, 2021 for trials with relevant search terms. The detailed search strategy is depicted under the tab Methods. The systematic literature searches resulted in 1861 hits.
A preselection of potentially relevant literature for sections of the guideline was made by the guideline methodologists supporting the working group, excluding all obvious non-relevant articles for this section. When in slightest doubt the literature remained in the preselection. Potentially relevant studies were divided into four categories: diagnosis, surgery, systemic treatment, and other treatment options. The preselection in the category ‘diagnosis’ included 238 hits from the total of 1861 hits. Thereafter, ten studies were initially selected based on title and abstract screening by members of the working group. Studies were eligible for inclusion based on the following criteria: patients had biliary tract cancer, PET(/CT) was used to detect distant metastases, distant metastases were pathology/cytology proven or confirmed by the clinical course with a long enough follow-up (at least six months of radiological imaging), and at least one of the outcomes of interest were reported. Clinical outcomes of diagnostic tests (e.g., survival), needed to be investigated in a randomized controlled trial in order to be eligible.
Additionally, systematic reviews were excluded when superseded by a more recent systematic review containing identical and newer relevant data. After reading the full text of 10 studies, nine studies were excluded (see the table with reasons for exclusion under the tab Methods), and one systematic review was included.
Results
One systematic review was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Corvera CU, Blumgart LH, Akhurst T, DeMatteo RP, D'Angelica M, Fong Y, Jarnagin WR. 18F-fluorodeoxyglucose positron emission tomography influences management decisions in patients with biliary cancer. J Am Coll Surg. 2008 Jan;206(1):57-65. doi: 10.1016/j.jamcollsurg.2007.07.002. Epub 2007 Oct 1. PMID: 18155569.
- Ferrone C, Goyal L, Qadan M, Gervais D, Sahani DV, Zhu AX, Hong TS, Blaszkowsky LS, Tanabe KK, Vangel M, Amorim BJ, Wo JY, Mahmood U, Pandharipande PV, Catana C, Duenas VP, Collazo YQ, Canamaque LG, Domachevsky L, Bernstine HH, Groshar D, Shih TT, Li Y, Herrmann K, Umutlu L, Rosen BR, Catalano OA. Management implications of fluorodeoxyglucose positron emission tomography/magnetic resonance in untreated intrahepatic cholangiocarcinoma. Eur J Nucl Med Mol Imaging. 2020 Jul;47(8):1871-1884. doi: 10.1007/s00259-019-04558-3. Epub 2019 Nov 8. PMID: 31705172.
- Lamarca A, Barriuso J, Chander A, McNamara MG, Hubner RA, ÓReilly D, Manoharan P, Valle JW. 18F-fluorodeoxyglucose positron emission tomography (18FDG-PET) for patients with biliary tract cancer: Systematic review and meta-analysis. J Hepatol. 2019 Jul;71(1):115-129. doi: 10.1016/j.jhep.2019.01.038. Epub 2019 Feb 21. PMID: 30797051.
- Moulton CA, Gu CS, Law CH, Tandan VR, Hart R, Quan D, Fairfull Smith RJ, Jalink DW, Husien M, Serrano PE, Hendler AL, Haider MA, Ruo L, Gulenchyn KY, Finch T, Julian JA, Levine MN, Gallinger S. Effect of PET before liver resection on surgical management for colorectal adenocarcinoma metastases: a randomized clinical trial. JAMA. 2014 May 14;311(18):1863-9. doi: 10.1001/jama.2014.3740. PMID: 24825641.
- Petrowsky H, Wildbrett P, Husarik DB, Hany TF, Tam S, Jochum W, Clavien PA. Impact of integrated positron emission tomography and computed tomography on staging and management of gallbladder cancer and cholangiocarcinoma. J Hepatol. 2006 Jul;45(1):43-50. doi: 10.1016/j.jhep.2006.03.009. Epub 2006 Apr 19. PMID: 16690156.
- Ruys AT, Bennink RJ, van Westreenen HL, Engelbrecht MR, Busch OR, Gouma DJ, van Gulik TM. FDG-positron emission tomography/computed tomography and standardized uptake value in the primary diagnosis and staging of hilar cholangiocarcinoma. HPB (Oxford). 2011 Apr;13(4):256-62. doi: 10.1111/j.1477-2574.2010.00280.x. Epub 2011 Mar 7. PMID: 21418131; PMCID: PMC3081626.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics
|
Index test (test of interest) |
Reference test
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Lamarca 2019
Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis
Literature search up to 19 September 2018
A: Oe 2006 B:Rodriguez-Fernandez 2004 C: Koh 2003 D: Akcam 2015 E: Fritscher-Ravens 2001 F: Reinhardt 2005 G: Sperti 2006 H: Kato 2002 I: Wakabayashi 2005 J: Nishiyama 2006 K: Kim 2003 L: Remos-Font 2014 M: Furukawa 2009 N: Nishiyama 2007 O: Anderson 2004 P: Gu 2012 Q: Wang 2015 R: Seo 2008 S: Cheng 2013 T: Choi 2013 U: Moon 2008 V: Alkhawaldeh 2011 W: Petrowski 2006 X: Kitamura 2011 Y: Jiang 2016 Z: Lee SW 2010 AA: Corvera 2008 AB: Kim 2008 AC: Cho 2015 AD: Kluge 2001
Study design: A: unclear B: Retrospective C: Retrospective D: Retrospective E: unclear F: unclear G: unclear H: unclear I: prospective J: unclear K: retrospective L: prospective M: retrospective N: retrospective O: unclear P: retrospective Q: retrospective R: unclear S: prospective T: unclear U: retrospective V: retrospective W: prospective X: unclear Y: retrospective Z: retrospective AA: retrospective AB: prospective AC: retrospective AD: prospective
Setting and Country: A: Japan B: Spain C: Japan D: Turkey E: Germany F: Germany G: Italy H: Japan I: Japan J: Japan K: Korea L: Spain M: Japan N: Japan O: USA P: China Q: China R: Japan S: Taiwan T: Korea U: Korea V: Germany W: Switzerland X: Japan Y: China Z: Korea AA: USA AB: Korea AC: Korea AD: Germany
Source of funding and conflicts of interest: Authors report there are no CoI.
Lamarca received funding drom ESMO followship programme, pancreatic cancer research fund SEOM fellowship programme, cholanchiocarcinoma foundation research fellowship grant, ASCO conquer cancer foundation young investigator award, and the Christie Charity.
Barriuso received a ENETS centre of excellence fellowship grant award.
|
Inclusion criteria SR for DTA and change in management: Prospective and retrospective design, studies provide data to construct 2x2 tables for assessment on patient level, studies reporting data of change in management in percentages based on 18F-FDG-PET, pathology-proven malignancy (histology/cytology) or radiologic imaging follow-up of at least 6 months.
Exclusion criteria SR: Case reports, reviews, reference standard other than biopsy-proven cancer
46 studies included
Important patient characteristics of the 30 studies used to detect BTC):
Cancer status: A: Before surgery B: before surgery C: before surgery D: all stages E: Before surgery F: all stages G: all stages H: All stages I: all stages J: All stages K: all stages L: all stages M: all stages N: all stages O: all stages P: before surgery Q: before surgery R: before surgery S: before surgery T: before surgery U: all stages V: advanced stage, before treatment W: all stages X: before surgery Y: all stages Z: all stages AA: all stages AB: before surgery AC: advanced stage, before treatment AD: all stages
Age A: not reported B: 67.75 (range: 51-83) C: not reported D: not reported E: 58 (range: 47-78) F: 63 (SD: 14) G: not reported H: not reported I: not reported J: 69.9 (range: 34-83) K: 57 (range: 34-74) L: 68.6 (SD: 11.3) M: 69 (range: 46-84) N: not reported O: 63 (range: 38-84) P: 56 Q: not reported R: 64 (range: 41-78) S: range: 27-86 T: not reported U: 59.2 (SD: 8.7) V: not reported W: 64 (range: 35-81) X: 66 (SD: 8) Y: not reported Z: 67 (range: 35-91) AA: not reported AB: 60 (range: 28-78) AC: 61 AD: 63 (range 39-85)
Sex (F/M): A: not reported B: 11/5 C: not reported D: not reported E: 6/9 F: 10/10 G: not reported H: not reported I: not reported J: 20/12 K: 10/11 L: 28/21 M: 29/40 N: not reported O: 16/20 P: 14/18 Q: not reported R: 12/15 S: not reported T: not reported U: 20/34 V: not reported W: 30/31 X: 27/46 Y: not reported Z: 41/58 AA: not reported AB: 43/80 AC: 31/75 AD: 11/15
|
Describe index and comparator tests* and cut-off point(s):
Index test: A: PET B: not reported C: PET D: not reported E: PET F: PET G: PET/CT H: PET/CT I: PET J: PET/CT K: PET/CT L: not reported M: PET/CT N: PET O: PET P: PET/CT Q: PET R: not reported S: PET/CT T: NS U: not reported V: PET/CT W: not reported X: not reported Y: PET/CT Z: PET/CT AA: PET/CT AB: not reported AC: PET
18F-FDG injection: A: 3 MBq/kg B: not reported C: 296 (±74) MBq D: not reported E: 320–400 MBq F: NS G: 370 MBq (±7.4) (adjusted to weight) H: NS I: NS J: NS K: 370–555 MBq L: not reported M: NS N: 370 MBq O: 10mCi P: NS Q: 444 MBq R: not reported S: NS T: 5.18 MBq/kg U: not reported V: 370 MBq if <70 kg; 444 MBq if >70 kg W: not reported X: not reported Y: 300MBq Z: 4.8 MBq/kg AA: 5.5 MBq/kg AB: not reported AC: 44–50.0 MBq/kg AD: not reported
Image acquisition time: A: 68 (± 8) min B: not reported C: 50 min D: not reported E: 60 min F: 45 min G: 60 min H: 60 min I: NS J: NS K: 60 min L: not reported M: 60 min N: 60 min O: 60 min P: NS Q: 60 min R: not reported S: 100 min T: 60 min U: not reported V: 60 min W: not reported X: not reported Y: 60 min Z: 60 min AA: 60 min AB: not reported AC: 60 min AD: not reported
Imaging reconstruction: A: NS B: not reported C: 2D D: not reported E: NS F: NS G: 3D H: NS I: NS J: NS K: NS L: not reported M: 2D N: NS O: NS P: NS Q: NS R: not reported S: NS T: 3D U: not reported V: 3D W: not reported X: not reported Y: 3D Z: 3D AA: 3D AB: not reported AC: 3D AD: not reported
Iodinated contrast: A: No B: not reported C: No D: not reported E: No F: No G: Yes H: No I: No J: No K: No L: not reported M: No N: No O: No P: No Q: No R: not reported S: No T: No U: not reported V: No W: not reported X: not reported Y: No Z: No AA: No AB: not reported AC: No AD: not reported
SUV cut-off: A: 4.5 B: not reported C: No D: not reported E: No F: No G: No H: No I: No J: No K: No L: not reported M: No N: No O: No P: No Q: 2.5 R: not reported S: No T: No U: not reported V: 2.4 W: not reported X: not reported Y: No Z: No AA: No AB: not reported AC: No AD: not reported |
Describe reference test and cut-off point(s):
From the eligibility criteria: a pathology-proven malignancy (histology or cytology). Or, at least 6-months follow-up with radiologic imaging (from the Supplement)
From the characteristics table (supplement): A: Pathology ± radiology and follow-up B: not reported C: Pathology confirmed cancer D: not reported E: Pathology confirmed cancer F: Pathology ± radiology and follow-up G: Pathology ± radiology and follow-up H: Pathology confirmed cancer I: Pathology confirmed cancer J: Pathology confirmed cancer K: Pathology confirmed cancer L: not reported M: Pathology ± radiology and follow-up N: Pathology confirmed cancer O: Pathology confirmed cancer P: Pathology confirmed cancer Q: Pathology confirmed cancer R: not reported S: Pathology ± radiology and follow-up T: Pathology confirmed cancer U: not reported V: Pathology confirmed cancer W: not reported X: not reported Y: Pathology confirmed cancer Z: Pathology confirmed cancer AA: Pathology confirmed cancer AB: not reported AC: Pathology confirmed cancer AD: not reported
Prevalence (%): A: 3/12 (25%) B: 5/16 (31%) C: 8/16 (50%) D: 22/22 (100%) E: 13/15 (87%) F: 14/22 (64%) G: 20/25 (80%) H: 8/16 (50%) I: 21/30 (70%) J: 23/32 (72%) K: 21/2 L: 20/37 (54%) M: 36/69 (52%) N: 29/37 (78%) O: 40/50 (80%) P: 32/32 (100%) Q: 30/49 (61%) R: 27/27 (100%) S: 36/62 (58%) T: 34/39 (87%) U: 46/54 (85%) V: 47/64 (73%) W: 61/70 (87%) X: 73/73 (100%) Y: 65/65 (100%) Z: 82/99 (83%) AA: 87/93 (94%) AB: 43/80 (54%) AC: 106/106 (100%) AD: 26/34 (76%)
(median prevalence: 78%, study K was excluded due to a possible reporting error)
For how many participants were no complete outcome data available? Unclear
Reasons for incomplete outcome data described? Unclear/not described
|
Endpoint of follow-up: Not reported |
Outcome measures and effect size (include 95%CI and p-value if available):
Pooled analyses were performed with a random effects model, unless stated otherwise.
T-stage BTC For the diagnosis of the T-stage of BTC the pooled sensitivity was 91.7 (89.8–93.2);(I^2: 68.9% (<0.001)) and the pooled specificity was 51.3 (46.4–56.2);(I^2: 82.0% (<0.001)) from 30 studies.
CCA For the diagnosis of the T-stage of CCA the pooled sensitivity was 95.7 (94.0–97.0);(I^2: 16.1% (0.249)) and the pooled specificity was 38.1 (32.0–44.6);(I^2: 78.7% (<0.001)) from 10 studies.
iCCA For the diagnosis of the T-stage of iCCA the pooled sensitivity was 94.2 (90.1–97.0);(I^2: 47.6% (0.046)) and the pooled specificity was 68.3 (51.9–81.9);(I^2: 4.6% (0.398)) from 13 studies.
eCCA For the diagnosis of the T-stage of eCCA the pooled sensitivity was 95.3 (92.6–97.3);(I^2: 0.0% (0.488)) and the pooled specificity was 27.7 (20.5–35.9);(I^2: 78.6% (<0.001)) from 8 studies.
hCCA For the diagnosis of the T-stage of hCCA was 91.9 (85.6–96.0);(I^2: 0.0% (0.446)) and the pooled specificity was 21.9 (9.30–40.0);(I^2: 0.0% (0.502)) from 8 studies.
GBC For the diagnosis of the T-stage of GBC the pooled sensitivity was 88.4 (82.6–92.8);(I^2: 27.4% (0.183)) and the pooled specificity was 72.3 (60.7–82.1);(I^2: 58.0% (0.008)) from 11 studies.
AMP For the diagnosis of the T-stage of AMP was 79.9 (69.9–87.7);(I^2: 58.8% (0.046)) and the pooled specificity was 43.0 (28.0–59.0);(I^2: 81.2% (<0.001)) from 9 studies.
N-stage BTC For the diagnosis of the N-stage of BTC the pooled sensitivity was 88.4 (82.6–92.8);(I^2: 60.9% (0.003)) and the pooled specificity was 69.1 (63.8–74.1);(I^2: 81.8% (<0.001)) from 12 studies.
CCA For the diagnosis of the N-stage of CCA the pooled sensitivity was 72.7 (57.2–85.0);(I^2: 52.9% (0.059)) and the pooled specificity was 70.3 (63.3–76.7);(I^2: 70.5% (0.005)) from 6 studies.
iCCA For the diagnosis of the N-stage of iCCA the pooled sensitivity was 98.1 (89.7–100);(I^2: 37.5% (0.206)) and the pooled specificity was 48.9 (33.7–64.2);(I^2: 97.0% (<0.001)) from 2 studies.
eCCA For the diagnosis of the N-stage of eCCA the pooled sensitivity was 90.9 (58.7–99.8);(I^2: 0.0% (0.924)) and the pooled specificity was 60.6 (48.3–72.0);(I^2: 0.0% (0.374)) from 2 studies.
hCCA For the diagnosis of the N-stage of hCCA the pooled sensitivity was 55.6 (30.8–78.5);(I^2: 61.1% (0.109)) and the pooled specificity was 63.0 (42.4–80.6);(I^2: 83.9% (0.013)) from 2 studies
GBC For the diagnosis of the N-stage of GBC the pooled sensitivity was 93.8 (82.8–98.7);(I^2: 0.0% (0.720)) and the pooled specificity was 70.4 (49.8–86.2);(I^2: 93.2% (<0.001)) from 2 studies.
AMP Pooled results were not available.
M-stage BTC For the diagnosis of the M-stage of BTC the pooled sensitivity was 85.4 (79.5–90.2);(I^2: 53.2% (0.029)) and the pooled specificity was 89.7 (86.0–92.7);(I^2: 89.1% (<0.001)) from 9 studies.
CCA For the diagnosis of the M-stage of CCA the pooled sensitivity was 76.4 (64.8–85.8);(I^2: 44.0% (0.129)) and the pooled specificity was 86.7 (80.5–91.5);(I^2: 89.0% (<0.001)) from 5 studies.
iCCA Pooled results were not available
eCCA Pooled results were not available
hCCA For the diagnosis of the M-stage of hCCA the pooled sensitivity was 72.7 (39.0–94.0);(I^2: 0.0% (0.569)) and the pooled specificity was 77.5 (61.5–89.2);(I^2: 52.1% (0.148)) from 2 studies.
GBC For the diagnosis of the M-stage of GBC the pooled sensitivity was 91.1 (82.6–96.4);(I^2: 0.0% (0.709)) and the pooled specificity was 82.4 (71.8–90.3);(I^2: 85.0% (<0.001)) from 4 studies.
AMP Pooled results were not available
Tumor relapse BTC For the diagnosis of the tumor relapse of BTC the pooled sensitivity was 90.1 (84.4–94.3);(I^2: 0.0% (0.753)) and the pooled specificity was 83.5 (74.4–90.4);(I^2: 23.8% (0.248)) from 7 studies.
CCA For the diagnosis of the tumor relapse of CCA the pooled sensitivity was 84.0 (70.4–93.1);(I^2: 0.0% (0.785)) and the pooled specificity was 71.1 (46.1–89.2);(I^2: 0.0% (0.898)) from 3 studies.
iCCA Pooled results were not available
eCCA Pooled results were not available
hCCA Pooled results were not available
GBC For the diagnosis of the tumor relapse of GBC the pooled sensitivity was 93.6 (82.5–98.7);(I^2: 0.0% (0.519)) and the pooled specificity was 90.9 (70.8–98.9);(I^2: 0.0% (0.480)) from 2 studies.
AMP Pooled results were not available
Change in management A random effects model showed a pooled proportion of 0.15 (95%CI: 0.11-0.20) change in management when the results of 13 studies (n=591) were pooled. I2: 47%, p=0.03
Three of these studies (n=171) reported the change in the pre-surgical setting, resulting in a pooled proportion of 0.17 (95%CI: 0.09-0.25; random effects). I2: 48%, p=0.15
Five of these studies (n=150) reported the change in the post-surgical setting when assessing relapses. Pooling the results of 5 studies showed a pooled proportion of 0.14 (95%CI: 0.08-0.21; random effects). I2: 24%, p=0.27
In those patients where details were available, 39/50 (78%) were upstaged with identification of previously unknown sites of disease by 18F-FDG-PET. |
Study quality (ROB): authors assessed the RoB using the QUADAS-2
Place of the index test in the clinical pathway: Unclear. The SR aims to evaluate the diagnostic test accuracy of PET in addition to the current standard of care (US/CT/MR), however it is unclear whether PET in the included studies was preceded by US/CT/MR.
Choice of cut-off point: unclear what was considered ‘disease present’ for index test.
For BTC, a heterogeneity analysis was performend through meta-regression.
|
*comparator test equals the C of the PICO; two or more index/ comparator tests may be compared; note that a comparator test is not the same as a reference test (golden standard)
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Ruys 2012 |
Data for PET is superseded by a more recent systematic review |
|
Tamburrino 2016 |
pancreatic & periampullary cancer, included only 2 arcticles which cencerned endoscopic ultrasound as imaging modality. |
|
Annuziata 2014 |
Data for PET is superseded by a more recent systematic review |
|
Hu 2017 |
Data for PET is superseded by a more recent systematic review |
|
Zhang 2015 |
Data for PET is superseded by a more recent systematic review |
|
Annunziata 2015 |
Articles in the meta-analysis for gallbladder were also included by Lamarca 2019, thus data for PET is superseded by a more recent systematic review |
|
Ansari 2013 |
Narrative |
|
Baheti 2014 |
Narrative |
|
Ferrone 2020 |
Descriptive for n=10 cases. Conventional imaging included PET in 27 of 37 cases, no control group |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 03-10-2024
Beoordeeld op geldigheid : 05-09-2023
De geldigheid van de richtlijnmodule komt te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Overzicht modules
Tranche 1 (deze modules zijn in 2023 geautoriseerd)
|
Hoofdstuk |
Nr |
Moduletitel |
Vorm |
|
Diagnostiek |
1 |
Meerwaarde PET bij biliare tumoren |
Nieuw ontwikkeld |
|
Behandeling |
2 |
Preoperatieve galwegdrainage |
Nieuw ontwikkeld |
|
Pathologie |
3 |
Verslag en aanvraag pathologie |
Update van bestaande module |
|
Communicatie en besluitvorming |
4 |
Communicatie en besluitvorming |
Nieuw ontwikkeld |
|
Nazorg |
5 |
Nazorg en nacontrole |
Update van bestaande module |
Tranche 2 (huidige autorisatieronde)
|
Hoofdstuk |
|
Moduletitel |
Vorm |
|
Diagnostiek |
6 |
Cross-sectionele beeldvorming |
Update van bestaande module |
|
Behandeling |
7 |
Locoregionale behandeling met TACE of SIRT voor iCCA |
Nieuw ontwikkeld |
|
Behandeling |
8 |
Preoperatieve vena porta embolisatie |
Update van bestaande module |
|
Behandeling |
9 |
Indicatie resectie |
Update van bestaande module |
|
Behandeling |
10 |
Adjuvante systemische behandeling |
Update van bestaande module |
|
Behandeling |
11 |
Palliatieve systemische behandeling in de 1e lijn |
Update van bestaande module |
|
Behandeling |
12 |
Palliatieve systemische behandeling na de 1e lijn |
Update van bestaande module |
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met galweg- of galblaascarcinoom.
Werkgroep
- Dr. B. (Bas) Groot Koerkamp, Chirurg/ Epidemioloog, Erasmus MC, Rotterdam, NVvH (voorzitter)
- Dr. J.I. (Joris) Erdmann, Chirurg, Amsterdam UMC, Amsterdam, NVvH
- Dr. P.R. (Philip) de Reuver, Chirurg, Radboudumc, Nijmegen, NVvH
- Dr. M.T. (Marieke) de Boer, Chirurg, UMCG, Groningen, NVvH ((tot mei 2022)
- Dr. F.J.H. (Frederik) Hoogwater, Chirurg, UMCG, Groningen, NVvH (vanaf mei 2022)
- Dr. H.J. (Heinz-Josef) Klümpen, Internist-oncoloog, Amsterdam UMC, Amsterdam, NIV
- Dr. N. (Nadia) Haj Mohammad, Internist-oncoloog, UMC Utrecht, Utrecht, NIV
- Drs. F.E.J.A. (Franꞔois) Willemsen, Abdominaal radioloog, Erasmus MC, NVvR
- Prof. dr. O.M. (Otto) van Delden, interventieradioloog, Amsterdam UMC, Amsterdam, NVvR
- Dr. L.M.J.W. van Driel, maag-darm-leverarts, Erasmus MC, Rotterdam, NVMDL
- Prof. dr. J. (Joanne) Verheij, klinisch patholoog, Amsterdam UMC, Amsterdam, NVVP
- Dr. R.S. (Chella) van der Post, patholoog, Radboudumc, Nijmegen, NVVP (vanaf februari 2022)
- C. (Chulja) Pek, Verpleegkundig specialist, Erasmus MC, Rotterdam, V&VN
- Drs. M.A. (Marga) Schrieks, Projectleider Patiëntenplatform Zeldzame Kankers, NFK
- A. (Anke) Bode MSc, Patiëntvertegenwoordiger, NFK (tot april 2023)
- Drs. A.C. (Christine) Weenink, Patiëntvertegenwoordiger/huisarts, NFK (vanaf april 2023)
Met dank aan
- M. (Mike) van Dooren, arts-onderzoeker, Radboudumc, Nijmegen
-
Dr. S. (Stefan) Büttner, AIOS chirurgie, Erasmus MC
Met ondersteuning van
- Drs. M. Oerbekke, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. N. Elbert, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. L.J.M. Oostendorp, Senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Groot Koerkamp |
Chirurg en epidemioloog, Erasmus MC |
Onbetaald: * secretaris wetenschappelijke commisssie van de Ducth Pancreatic Cancer Group (DPCG) * bestuurslid van de Dutch Hepatocellular and Cholangiocarcinoma Group (DHCG) * Lid van de audit commissie van de Nederlandse Vereniging voor Heelkunden (NVvH) * Voorzitter van de werkgroep cholangiocarcinoom van de DHCG * Lid van de wetenschappelijke commissie van de DHCG |
Intellectuele belangen en reputatie Expertise op gebied van intra-arteriele chemotherapie. Ik ben PI vna een door KWF gefinancierde klinische studie van intra-arteriele chemotherapie voor niet-resectabel intrathepatisch cholangiocarcinoom |
Geen (in deze herziening komt het het onderwerp Hepatic Arterial Infusion niet aan de orde) |
|
Erdmann |
Chirurg, Amsterdam UMC |
Geen |
Geen |
Geen |
|
De Reuver |
Chirurg gastro-enterologische chirurgie, Radboudumc, Nijmegen |
Geen |
Extern gefinancierd onderzoek PI van onderzoek naar Galblaascarcinoom, in 2017 gefinancieerd door Stichting ADP. Stichting heeft geen belang in het advies of de richtlijn. |
Geen |
|
De Boer |
Chirurg UMCG afdeling chirurgie, HPB chirurgie en levertransplantatie |
Geen |
Geen |
Geen |
|
Hoogwater |
Chirurg, Hepato-Pancreato-Biliaire Chirurgie en Levertransplantatie, Universitair Medisch Centrum Groningen |
* Bestuurslid - Dutch Hepatocellular & Cholangiocarcinoma Group (DHCG), onbetaald * Commissielid - Continue Professionele Educatie van de NVvH, onbetaald * Lid - Wetendschappelijke Commissie Dutch Hepato Biliary Audit (DHBA), vacatiegeld * Bestuurslid Nederlandse Vereniging Chirurgische Oncologie (NVCO), onbetaald
|
Geen |
Geen |
|
Klümpen |
Internist-oncoloog in Amsterdam UMC |
* Subdomain leader for biliary tract cancer EURACAN (onbetaald) * Lid wetenschappelijke commissie van de DHCG (onbetaald) * Dutch representative for European Cooperation in Science and Technology COST (biliary tract cancer) grant by HORIZON 2020 (onbetaald, wel worden reizen vergoed die door COST georganiseerd worden) * Member of European Network for the Study of Cholangiocarcinoma ENSCCA (onbetaald) * Member international billary tract cancer consortium IBTCC (onbetaald) |
Extern gefinancierd onderzoek KWF financieert de ACTICCA studie en PUMP 2 studie maar deze studies zijn nog ongoing.
Het Amsterdam UMC met mij als lokale PI doet mee en heeft meegedaan aan studies voor galweg en galblaascarcinoom, maar geen hiervan hebben invloed op de richtlijn: * TAS-120 studie van TAIHO (fase I/II) * SIRCCA studie van SIRTEX (fase III, is vroegtijdig gestopt) * KEYNOTE 966 studie van MSD (fase III studie ongoing)
|
Geen actie, tenzij een van de middelen uit het extern gefinancierd onderzoek toch aan de orde komt in deze herziening. In dat geval volgt uitsluiting van de formulering van de aanbevelingen over de middelen in de betreffende trials.
TAS-120: futibatinib (TAIHO)
SIRCCA: selective internal radiotherapy SIRT met 90-Y microspheres i.c.m. chemotherapie (SIRTEX)
KEYNOTE-966: pembrolizumab (MSD)
|
|
Haj Mohammad |
Internist-oncoloog, Universitair Medisch Centrum Utrecht |
Penningmeester Dutch Upper GI Cancer (DUCG), onbetaald |
Intellectuele belangen en reputatie Lid wetenschappelijke raad Dutch Hepato and Cholangio Carcinoma Group (DHCG)
|
Geen |
|
Willemsen |
Abdominaal radioloog Erasmus MC te Rotterdam |
Geen |
Geen |
Geen |
|
Van Delden |
Interventieradioloog, Amsterdam UMC |
Geen |
Geen |
Geen |
|
Van Driel |
MDL-arts, staflid, Erasmus MC Rotterdam - fulltime aanstelling |
Geen |
Geen |
Geen |
|
Verheij |
Klinisch patholoog (1 fte) met specialisme Hepato-pancreatobiliaire pathologie Amsterdam UMC |
* Lid medisch Advies Raad Nederlandse Leverpatiënten Vereniging (NLV), onbezoldigd * Lid Landelijke visitatie commissie Nederlandse Vereniging voor Pathologie (NVVP), onkostenvergoeding |
Geen |
Geen |
|
Van der Post |
Klinisch patholoog, Radboud Universitair medisch centrum |
* Commissie lid Wetenschap NVVP (onbetaald) * Programmacommissie lid Kwaliteitsprojecten SKMS (vacatiegelden) * Voorzitter expertisegroep gastrointestinale pathologen EGIP, onderdeel NVVP (onbetaald) |
Extern gefinancierd onderzoek * Stichting ADP - From bench to bedside, the molecular characteristics of galbladder cancer - Projectleider * KWF kankerbestrijding - Dissecting the role of aberrant E-cadherin signaling in the initiation and progression of diffuse-type gastric cancer - Projectleider * Stichting Hanarth Fonds - Unmasking the invisible cancer: digital detection of diffuse-type gastric carcinomas - Projectleider |
Geen |
|
Pek |
Verpleegkundig specialist Erasmus MC Rotterdam. Pancreas- en galwegchircurgie specialist obstructie icterus |
Geen |
Geen |
Geen |
|
Schrieks |
Projectleider Patiëntenplatform Zeldzame Kanker |
Geen |
Geen |
Geen |
|
Bode |
* Patiënt vertegenwoordiger * Kinderfysiotherapeut MSc in ruste Zorggroep Almere (niet meer werkzaam) * Vrijwilliger bij patiëntenplatform Zeldzame kankers |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van het Patiëntenplatform Zeldzame Kankers om deel te nemen in de werkgroep en aan de schriftelijke knelpuntenanalyse. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn zal tevens voor commentaar worden voorgelegd aan Patiëntenplatform Zeldzame Kankers.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Module ‘Meerwaarde PET bij biliaire tumoren’ |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor patiënten met een galweg- of galblaascarcinoom. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijnmodules (NVvH, 2013) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door de patiëntenvereniging en genodigde partijen tijdens de schriftelijke knelpuntenanalyse (zie aanverwante producten voor het verslag). Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule wordt aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule wordt aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Literature search strategy
Systematic reviews
|
Embase.com |
481 |
471 |
|
Medline Ovid |
251 |
76 |
|
Total |
732 |
547 |
New references: 81
Embase.com
‘biliary tract tumor'/exp/mj OR 'gallbladder carcinoma'/exp/mj OR 'klatskin tumor'/exp/mj OR (((gallbladder* OR gall-bladder* OR biliary OR 'bile duct') NEAR/6 (carcinom* OR cancer* OR tumor* OR tumour* OR neoplasm* OR malign* OR oncolog*)) OR cholangiocarcinom* OR klatskin):ab,ti,kw AND (english)/lim AND (2012-2019)/py NOT 'conference abstract':it NOT ((animals)/lim NOT (humans)/lim) AND ('systematic review'/exp OR 'meta analysis'/exp OR (((systematic*) NEAR/3 (review)) OR meta-analy* OR metaanaly*):ab,ti,kw)
Medline Ovid
exp Gallbladder Neoplasms/ or exp biliary tract neoplasms/ or exp bile duct neoplasms/ or exp cholangiocarcinoma/ or exp klatskin tumor/ OR (((gallbladder* OR gall-bladder* OR biliary OR bile duct) ADJ6 (carcinom* OR cancer* OR tumor* OR tumour* OR neoplasm* OR malign* OR oncolog*)) OR cholangiocarcinom* OR klatskin).ab,ti,kf. AND english.la. AND (2012 OR 2013 OR 2014 OR 2015 OR 2016 OR 2017 OR 2018 OR 2019 OR 2020) NOT (exp animals/ NOT humans/) AND (Systematic Review/ OR Meta-Analysis/ OR (((systematic*) ADJ3 (review)) OR meta-analy* OR metaanaly*).ab,ti,kf.)
Trials
|
Database searched |
via |
Years of coverage |
Records |
Records after duplicates removed |
|
Embase |
Embase.com |
1971 - Present |
767 |
760 |
|
Medline ALL |
Ovid |
1946 - Present |
422 |
80 |
|
Cochrane Central Register of Controlled Trials |
Wiley |
1992 - Present |
643 |
464 |
|
Total |
1832 |
1304 |
||
Embase 766
(‘biliary tract tumor'/exp/mj OR 'gallbladder carcinoma'/exp/mj OR 'klatskin tumor'/exp/mj OR (((gallbladder* OR gall-bladder* OR biliary OR bile-duct*) NEAR/6 (carcinom* OR cancer* OR tumor* OR tumour* OR neoplas* OR malign* OR oncolog*)) OR cholangiocarcinom* OR klatskin*):ti,kw) AND (english)/lim AND (2015-2030)/py NOT 'conference abstract':it NOT ((animal/exp OR animal*:de OR nonhuman/de) NOT ('human'/exp)) AND (('clinical trial'/exp OR (trial):ab,ti,kw) OR (clinical trial number)/lim)
Medline Ovid 422
(exp *Gallbladder Neoplasms/ or exp *biliary tract neoplasms/ or exp *bile duct neoplasms/ or exp *cholangiocarcinoma/ or exp *klatskin tumor/ OR (((gallbladder* OR gall-bladder* OR biliary OR bile-duct*) ADJ6 (carcinom* OR cancer* OR tumor* OR tumour* OR neoplas* OR malign* OR oncolog*)) OR cholangiocarcinom* OR klatskin).ti,kf.) AND english.la. AND 2015:2030.(sa_year). NOT (exp animals/ NOT humans/) AND ((Clinical Trial/ OR (trial).ab,ti,kf.) OR clinicaltrials.si.)
Cochrane (2015-2020) 643
((((gallbladder* OR gall-bladder* OR biliary OR bile-duct*) NEAR/6 (carcinom* OR cancer* OR tumor* OR tumour* OR neoplas* OR malign* OR oncolog*)) OR cholangiocarcinom* OR klatskin):ti)