Galsteenlijden bij gewichtsverlies
Uitgangsvraag
Hoe kan het risico op het ontstaan van asymptomatische en symptomatische cholelithiasis bij gewichtsreductie worden verminderd?
Aanbeveling
Bespreek in de work-up voor bariatrische chirurgie, bij patiënten met een galblaas waarbij preoperatief galstenen werden uitgesloten, dat het postoperatief gebruik van ursodeoxycholzuur (UDCA) de kans op het ontwikkelen van symptomatische cholelithiasis kan verminderen.
Er is geen rol voor ursodeoxycholzuur (UDCA) bij patiënten na bariatrische chirurgie met aangetoonde asymptomatische cholecystolithiasis.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de rol van ursodeoxycholzuur (UDCA), preventieve cholecystectomie en dieetaanpassingen om het risico op asymptomatische cholecystolithiasis en symptomatische cholelithiasis bij patiënten met gewichtsreductie te verminderen. Ontwikkeling van symptomatische cholelithiasis en ontwikkeling van asymptomatische cholecystolithiasis werden als cruciale uitkomstmaten gedefinieerd. Er werden verder geen andere uitkomstmaten geprioriteerd.
Op basis van de literatuur lijkt er redelijk robuuste bewijskracht te zijn voor een positief effect van behandeling met profylactische ursodeoxycholzuur op het ontwikkelen van asymptomatische cholecystolithiasis en symptomatisch cholelithiasis. Echter, alleen bij patiënten die vooraf geen galstenen hadden. Er werd een fors klinisch relevant verschil gevonden voor beide uitkomstmaten in het voordeel van behandeling met profylactisch ursodeoxylcholzuur op basis van elf trials (>4000 patiënten) met een smal betrouwbaarheidsinterval voor het ontwikkelen van asymptomatische cholecystolithiasis (RR 0.32; 95% BHI: 0.24 tot 0.42; elf RCTs; >4000 patiënten) en symptomatisch cholelithiasis (RR 0.30; 95% BHI 0.21 tot 0.43; vijf RCTs; >3000 patiënten), die ruimschoots binnen de grenzen van klinische relevantie viel. Echter, er kan niet met zekerheid worden uitgesloten dat er sprake is geweest van publicatiebias op basis van de funnelplot bij deze uitkomstmaat, waardoor het gevonden effect wellicht enigszins overschat kan zijn ten opzichte van het werkelijke effect. Voor het effect van behandeling met preventieve cholecystectomie werd slechts bewijs met een zeer lage bewijskracht gevonden voor zowel ontwikkeling van asymptomatische cholecystolithiasis als ontwikkeling van symptomatisch cholelithiasis. Er is zodanig veel onzekerheid rondom het gevonden resultaat dat het effect zowel in het voordeel van behandeling met preventieve cholecystectomie als geen behandeling kan liggen. De oorzaak van de zeer lage bewijskracht is gelegen in het feit dat er maar één trial werd geïncludeerd met minder dan 100 patiënten per studiearm, waarin preventieve cholecystectomie werd onderzocht. Door de zeer lage bewijskracht dienen de beschreven relatieve risico’s voorzichtig geïnterpreteerd te worden en kunnen hier in principe geen harde conclusies worden getrokken over het effect van preventieve cholecystectomie ten opzichte van geen preventieve cholecystectomie.
Voor het effect van dieetaanpassingen op de geformuleerde uitkomstmaten werd geen bewijs gevonden.
In de praktijk zal van de meerderheid van de (asymptomatische) patiënten die een bariatrische operatie ondergaan vooraf niet bekend zijn of zij preoperatief galstenen hebben. Haal (2021) vond dat dit bij 189 van de 967 geïncludeerde patiënten (20%) het geval was. Bij de andere zes geïncludeerde RCT’s in deze richtlijnmodule, die het effect van UDCA op het ontwikkelen van symptomatisch galsteenlijden onderzochten (Talha, 2020; Miller, 2003; Pizza, 2020; Sugerman, 1995; Lee, 2020; Worobetz, 1993), werden patiënten met asymptomatische cholecystolithiasis geëxcludeerd. Dit betekent dat de resultaten niet zonder meer in de praktijk kunnen worden toegepast, tenzij patiënten in de work-up voor bariatrische chirurgie een routine echografie van de galblaas zouden krijgen om asymptomatische galstenen uit te sluiten. Uitgaande van het percentage 20% asymptomatische cholecystolithiasis vóór bariatrische chirurgie (Haal, 2021) zou een aanpassing van de gangbare praktijk (geen routine preoperatieve echografie, geen routine postoperatieve UDCA therapie) betekenen dat vijf laparoscopische cholecystectomieën voor symptomatische cholelithiasis kunnen worden voorkomen door 100 patiënten een routine echografie te laten ondergaan in de bariatrische work-up en vervolgens 80 patiënten bij afwezigheid van asymptomatische cholecystolithiasis een routine UDCA therapie aan te bieden na de bariatrische operatie. De vaststelling van asymptomatische cholecystolithiasis bij twintig van deze 100 patiënten (waarvoor verder geen zorgen zijn vereist) kan onzekerheid en ongerustheid veroorzaken bij de patiënt. Er is geen bewijs gevonden voor het gebruik van UDCA ter voorkoming van choledocholithiasis bij patiënten die bariatrische chirurgie ondergaan met een cholecystectomie in de voorgeschiedenis. Bij patiënten met bestaand symptomatisch galsteenlijden, die een bariatrische operatie ondergaan, kan tegelijkertijd een cholecystectomie worden uitgevoerd. Dit staat verder los van de aanbeveling in deze richtlijnmodule.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Niet elke patiënt zal bereid zijn ten minste een half jaar meermaals per dag extra medicijnen te nemen (UDCA) om de kans op het ontwikkelen van symptomatische cholelithiasis (en daarmee de indicatie voor een laparoscopische cholecystectomie) met ‘slechts’ ongeveer 6% te verminderen. Bovendien kan het gebruik van UDCA tot bijwerkingen leiden, hoewel doorgaans mild. Hoewel niet systematisch uitgezocht in deze module heeft een dosering van 900 milligram, op basis van expert opinion, de voorkeur. Voor de patiënt is de uitkomst van de langdurige UDCA-behandeling onduidelijk. Het biedt geen garantie dat galsteenlijden helemaal niet zal ontstaan. Bovendien is er geen indicatie voor een controle echografie om de ontwikkeling van galstenen bij een asymptomatische patiënt uit te sluiten. Voor de asymptomatische patiënten waarbij preoperatief echografisch galstenen werden aangetoond kan deze bevinding leiden tot ongerustheid en onduidelijkheid. Deze patiënten moet worden uitgelegd dat enerzijds door deze bevinding geen UDCA-behandeling aangewezen is, maar anderzijds dat er ook geen ander ingrijpen of surveillance nodig zijn. Indien
Kosten (middelenbeslag)
Het voorkomen van vijf laparoscopische cholecystectomieën voor symptomatische cholelithiasis door bij 100 patiënten in de bariatrische work-up een routine echografie uit te voeren en vervolgens bij 80 patiënten, bij afwezigheid van asymptomatische cholecystolithiasis, een routine UDCA-therapie aan te bieden na de bariatrische operatie kan kosteneffectief zijn. De studie van Haal (2022) heeft deze kosteneffectiviteit kunnen aantonen in een separate publicatie.
Aanvaardbaarheid, haalbaarheid en implementatie
Het aanbieden van UDCA na bariatrische chirurgie behelst een aanpassing aan de preoperatieve work-up. Er moet een gesprek gevoerd worden met de patiënt over voor- en nadelen van het uitvoeren van een echografie en van de UDCA-behandeling zelf. Uiteindelijk zal de patiënt zelf een afweging moeten maken, op basis van een relatief geringe risicoreductie door een langdurige therapie. Dit vergt voldoende inzicht en begrip bij de patiënt en extra inspanning van de chirurg. De beslissing die de patiënt moet maken of hij/zij bereid is om een langdurige UDCA-behandeling te ondergaan om een abstract risico op galsteenlijden te verminderen is complex. Niet elke patiënt zal voldoende inzicht hebben in wat risicoreductie inhoudt. Dit kan leiden tot gezondheidsongelijkheid. De evidentie is niet sterk genoeg om te pleiten voor een ‘one treatment fits all’ benadering.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
De huidige, gangbare work-up voor bariatrische chirurgie in Nederland omvat niet het routinematig aantonen of uitsluiten van galstenen, zoals door middel van een echografie van de galblaas. Voor het starten van UDCA na bariatrische chirurgie is echter een selectie van patiënten middels routine preoperatieve echografie wel zinvol. Profylactische UDCA-therapie na bariatrische chirurgie zal de kans op het ontwikkelen van symptomatisch galsteenlijden immers niet verminderen bij patiënten met asymptomatische cholecystolithiasis. Het effect van UDCA op het ontstaan van symptomatische cholelithiasis bij patiënten met een galblaas waarbij preoperatief galstenen werden uitgesloten is daarentegen wel significant, en in de praktijk relevant. Symptomatische cholelithiasis vormt een indicatie voor laparoscopische cholecystectomie en is een risicofactor voor het ontwikkelen van gecompliceerd galsteenlijden, zoals choledocholithiasis. In het geval van choledocholithiasis bij status na gastric bypasschirurgie is een behandeling door middel van ERCP alleen laparoscopisch geassisteerd mogelijk. Dit maakt de aanbeveling met betrekking tot de behandeling met UDCA van asymptomatische patiënten die bariatrische chirurgie ondergaan sterker voor patiënten met een gastric bypass, dan voor patiënten waarbij het duodenum vrij toegankelijk blijft voor ERCP, zoals bij sleeve gastrectomie of maagband. Het effect van UDCA op het ontstaan van asymptomatische cholecystolithiasis is significant, maar in de praktijk niet relevant. Asymptomatische cholecystolithiasis behoeft immers geen behandeling of surveillance.
Onderbouwing
Achtergrond
Gewichtsreductie is een bekende en belangrijke factor bij het ontwikkelen van galstenen. Onduidelijk is welke maatregelen tijdens een periode van geforceerd afvallen het risico op de vorming van galstenen en (nog belangrijker) het ontstaan van symptomatisch of gecompliceerd galsteenlijden kunnen verminderen. Met name na bariatrische chirurgie is de gewichtsreductie substantieel en daarmee ook het risico op het ontwikkelen van symptomatisch of gecompliceerd galsteenlijden verhoogd. Het gebruik van Ursodeoxycholzuur (UDCA) tijdens het afvallen werd voorgesteld. Ook het preventief verwijderen van de galblaas tegelijkertijd met de bariatrische operatie werd geopperd. Wellicht zijn aanpassingen in de voeding effectief.
Conclusies / Summary of Findings
1. Ursodeoxycholic acid (UDCA)
1.1 Symptomatic cholelithiasis
1.2 Asymptomatic cholecystolithiasis
|
Moderate GRADE |
Treatment with prophylactic UDCA after bariatric surgery likely results in a reduction in asymptomatic cholecystolithiasis when compared with no intervention, in adult patients without gallstones.
Source: Sugerman 1995; Wudel 2002; Miller 2003; Adams 2016; Abouzeid 2018; Nabil 2019; Talha 2020; Pizza 2020; Sakran 2020; Haal 2021; Salman 2022 (from Mulliri, 2022), Lee 2020; William 1993; Worobetz 1993 (from Choi, 2021) |
2. preventive cholecystectomy
2.1 Symptomatic cholelithiasis
|
Very low GRADE |
The evidence is very uncertain about the effect of preventive cholecystectomy on symptomatic cholelithiasis when compared with no intervention in adult patients without gallstones who underwent bariatric surgery
Source: Bencini 2019 (from Choi, 2021)
No information was found regarding the effect of preventive cholecystectomy on symptomatic cholelithiasis when compared with a control group in adult patients with asymptomatic cholecystolithiasis who underwent bariatric surgery. |
2.2 Asymptomatic cholecystolithiasis
|
Very low GRADE |
The evidence is very uncertain about the effect of preventive cholecystectomy on asymptomatic cholecystolithiasis when compared with no intervention in adult patients who underwent bariatric surgery
Source: Bencini 2019 (from Choi, 2021) |
3. Dietary modification
3.1 Symptomatic cholelithiasis
3.2 Asymptomatic cholecystolithiasis
|
No GRADE |
No information was found regarding the effect of dietary modification on asymptomatic cholecystolithiasis when compared with a control group in adult patients who underwent bariatric surgery.
Sources: - |
Samenvatting literatuur
Description of studies
The systematic review of Mulliri (2022) aimed to compare the incidence of gallstone formation, subsequent biliary disease, and the need for cholecystectomy in untreated patients and patients treated with UDCA following bariatric surgery. The databases MEDLINE, CENTRAL and Web of Science were searched for relevant articles, published until February 5th 2022. RCTs evaluating the impact of UDCA on gallstone formation after bariatric surgery were included. Studies with adult morbidly obese patients submitted to bariatric surgery and free of gallstones at randomization were included. Additional inclusion criteria were treatment with UDCA within two weeks postoperative and for a minimum of six months after surgery. In total, eleven RCTs were included in the analysis, which were all considered to be relevant for the purpose of this guideline (Sugerman, 1995; Wudel, 2002; Miller, 2003; Adams, 2016; Abouzeid, 2018; Nabil, 2019; Talha, 2020; Pizza, 2020; Sakran, 2020; Haal, 2021; Salman, 2022). The analysis included 3778 patients (2363 in the UDCA group and 1415 in the control group). Mean age of the patients was 33.1 years in the UDCA group versus 34.1 years in the control group and the mean BMI was 47.5 kg/m2 in the UDCA group and 46.4 kg/m2 in the control group. In these studies patients received either 500 milligram, 600 milligram or 900 milligram UDCA for six or twelve months after bariatric surgery. The study Sugerman (1995) used three different doses of UDCA (300, 600 and 1200 milligram per day). Patients in the control groups received either no intervention or a placebo after surgery. Outcomes included gallstone formation (asymptomatic cholecystolithiasis) at 24 months after surgery (reported in all included studies) and symptomatic gallstone disease (symptomatic cholelithiasis; reported in five out of the eleven included studies). Risk of Bias of the individual studies was considered high in eight of the included studies (assessed with the Cochrane collaboration risk of bias tool)
The systematic review of Choi (2021) aimed to evaluate the efficacy of the prophylactic use of UDCA for lowering gallstone formation and subsequent cholecystectomy in patients who had undergone gastric surgery compared with patients who had undergone a prophylactic cholecystectomy (PC) without any prophylaxis. The databases PUBMED, EMBASE and the Cochrane Library were searched for relevant articles, published until June 30th 2020. Comparative studies reporting the outcome of prophylactic UDCA or a PC in the prevention of gallstone formation following gastric surgery in humans were selected. Only studies including patients without a history of cholecystectomy and patients who did not have gallstones prior to surgery were included. In total, eleven RCTs and ten non-RCTS were included in the analysis of which four RCTs were considered relevant for the purpose of this review (Lee, 2020; Bencini, 2019; Williams, 1993; Worobetz, 1993). The other RCTs were excluded because they were already included in the review from Mulliri (2022). Mean age of the patients ranged from 33.5 years to 69 years. Information on BMI was not available. In the study of Bencini (2019), patients in the intervention group received PC after gastric surgery. In the other studies, patients received UDCA after surgery. The dosage of UDCA was either 300 mg or 600 mg. Two studies did not specify the dosages of UDCA. The interventions were compared to a control condition. None of the studies specifically described the control intervention. Outcomes included gallstone formation (asymptomatic cholecystolithiasis) and symptomatic biliary problems (symptomatic cholelithiasis), the follow-up duration was not specified. Risk of bias of the individual studies was considered low in three of the included studies (assessed with the Cochrane collaboration risk of bias tool)
Results
1. Ursodeoxycholic acid (UDCA)
1.1 Symptomatic cholelithiasis
Five of the studies included in the review from Mulliri (2022) (Talha 2020; Miller 2003; Haal 2021; Pizza 2020; Sugerman 1995) and two studies included in the review from Choi (2021) (Lee 2020; Worobetz 1993) reported the effect of treatment with prophylactic UDCA on the development of symptomatic cholelithiasis in patients without gallstones at baseline. Only one study included in the review from Mulliri (2022) (Haal, 2021) reported the effect of treatment with prophylactic UDCA on developing symptomatic cholelithiasis in patients with asymptomatic cholecystolithiasis at baseline. The results were pooled in a meta-analysis. The pooled number of patients with symptomatic cholelithiasis in the UDCA group was 47/2219 (2.1%), compared to 90/1098 (8.3%) in the control group. This resulted in a pooled relative risk ratio (RR) of 0.30 (95% CI: 0.21 to 0.43), favoring treatment with prophylactic UDCA (figure 2). This difference was considered clinically relevant.

Figure 1. Forest plot showing the comparison between treatment with prophylactic UDCA and no intervention for the outcome symptomatic cholelithiasis. Pooled relative risk ratio, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity
1.2 Asymptomatic cholecystolithiasis
All eleven studies included in the review from Mulliri (2022) (Sugerman, 1995; Wudel, 2002; Miller, 2003; Adams, 2016; Abouzeid, 2018; Nabil, 2019; Talha, 2020; Pizza, 2020; Sakran, 2020; Haal, 2021; Salman, 2022) and three studies included in the review from Choi (2021) (Lee, 2020; William, 1993; Worobetz, 1993) reported the effect of treatment with prophylactic UDCA on asymptomatic cholecystolithiasis. The results were pooled in a meta-analysis. The pooled number of patients with asymptomatic cholecystolithiasis in the UDCA group was 187/2718 (6.9%), compared to 367/1615 (22.7%) in the control group. This resulted in a pooled relative risk ratio (RR) of 0.32 (95% CI: 0.24 to 0.42), favoring treatment with prophylactic UDCA (figure 1). This difference was considered clinically relevant.
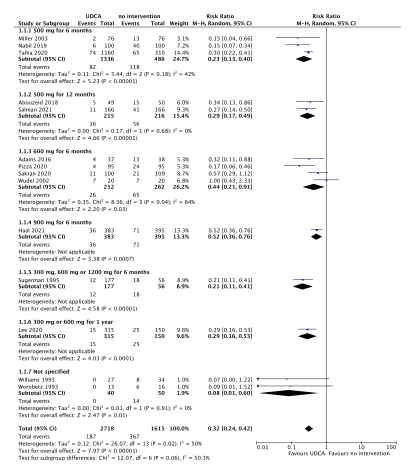
Figure 2. Forest plot showing the comparison between treatment with prophylactic UDCA and no intervention for the outcome Asymptomatic cholecystolithiasis. Pooled relative risk ratio, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity
2. Preventive cholecystectomy
2.1 Symptomatic cholelithiasis
One of the studies included in the systematic review from Choi (2021), reported the effect of preventive cholecystectomy on symptomatic cholelithiasis (Bencini 2019) in patients without gallstones at baseline. The number of patients developing symptomatic cholelithiasis was 0/65 (0%) in the patients undergoing preventive cholecystectomy, compared to 3/65 (4.6%) patients in the control group. This resulted in a relative risk ratio (RR) of 0.14 (95% CI: 0.01 to 2.71). This difference was considered clinically relevant. There were no randomized controlled studies reporting on the effect of preventive cholecystectomy on developing symptomatic cholelithiasis in patients with asymptomatic cholecystolithiasis at baseline.
2.2 Asymptomatic cholecystolithiasis
One of the studies included in the systematic review from Choi (2021), reported the effect of preventive cholecystectomy on developing asymptomatic cholecystolithiasis (Bencini 2019). The number of patients with asymptomatic cholecystolithiasis was 0/65 (0%) in the patients undergoing preventive cholecystectomy, compared to 4/65 (6.2%) patients in the control group. This resulted in a relative risk ratio (RR) of 0.11 (95% CI: 0.01 to 2.02). This difference was considered clinically relevant.
3. Dietary modification
3.1 Symptomatic cholelithiasis
None of the included studies reported information regarding the effect of dietary modification on symptomatic cholelithiasis in adult patients who underwent bariatric surgery.
3.2 Asymptomatic cholecystolithiasis
None of the included studies reported information regarding the effect of dietary modification on asymptomatic cholecystolithiasis in adult patients who underwent bariatric surgery.
Level of evidence of the literature
1. Ursodeoxycholic acid (UDCA)
1.1 Symptomatic cholecystolithiasis
The level of evidence regarding the outcome measure symptomatic cholelithiasis was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by one level because of study limitations including incomplete outcome data and missing data on the control intervention and follow-up duration (-1 risk of bias). The level of evidence was graded ‘moderate’.
1.2 Asymptomatic cholecystolithiasis
The level of evidence regarding the outcome measure asymptomatic cholecystolithiasis
was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by one level because of study limitations including lack of blinding and missing data on the control intervention and follow-up duration (-1 risk of bias). The level of evidence was graded ‘moderate’.
2. Preventive cholecystectomy
2.1 Symptomatic cholelithiasis
The level of evidence regarding the outcome measure symptomatic cholelithiasis was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by 3 levels because of study limitations including lack of blinding (-1 risk of bias) and the confidence intervals crossing the lower and upper boundaries of clinical relevance (-2 imprecision). The level of evidence was graded ‘very low’
2.2 Asymptomatic cholecystolithiasis
The level of evidence regarding the outcome measure asymptomatic cholecystolithiasis was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by three levels because of study limitations including lack of blinding (-1 risk of bias) and the confidence intervals crossing the lower and upper boundaries of clinical relevance (-2 imprecision). The level of evidence was graded ‘very low’
3. Dietary modification
3.1 Symptomatic cholelithiasis
Because of a lack of information in the included studies, it was not possible to grade the literature for symptomatic cholelithiasis for the comparison of dietary modification with a control group in adult patients who underwent bariatric surgery.
3.2 Asymptomatic cholecystolithiasis
Because of a lack of information in the included studies, it was not possible to grade the literature for asymptomatic cholecystolithiasis for the comparison of dietary modification with a control group in adult patients who underwent bariatric surgery.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)beneficial effects of treatment with ursodeoxycholic acid in comparison with no ursodoexycholic acid, preventive cholecystectomy in comparison with no preventive cholecystectomy, or dietary modification in comparison with no dietary modification in adult patients with weight reduction (including bariatric surgery)?
PICO 1
P: Adult patients with weight reduction (including bariatric surgery).
I: Ursodeoxycholic acid
C: No ursodeoxycholic acid
O: Gallstone formation (asymptomatic cholecystolithiasis), gallstone disease (symptomatic cholelithiasis).
PICO 2:
P: Adult patients with weight reduction (including bariatric surgery).
I: Preventive cholecystectomy.
C: No preventive cholecystectomy.
O: Gallstone formation (asymptomatic cholecystolithiasis), gallstone disease (symptomatic cholelithiasis).
PICO 3:
P: Adult patients with weight reduction (including bariatric surgery).
I: Dietary modification
C: No dietary modification
O: Gallstone formation (asymptomatic cholecystolithiasis), gallstone disease (symptomatic cholelithiasis).
Relevant outcome measures
The guideline development group considered symptomatic cholelithiasis as a critical outcome measure for decision making; the predefined outcome asymptomatic cholecystolithiasis was not considered an important outcome measure for decision making.
The guideline development group defined a relative risk (RR) for dichotomous outcomes of <0.80 and >1.25 as a minimal clinically (patient) important difference, this applies to both predefined outcomes.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until the 29th of August. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 388 hits. Studies were selected based on the following criteria: systematic reviews and randomized controlled trials (RCTs) describing the effect of ursodeoxycholic acid (UDCA), diet, or preventive cholecystectomy in the prevention of cholecystolithiasis in adults who experienced weight reduction. Fifteen studies were initially selected based on title and abstract screening. After reading the full text, thirteen studies were excluded (see the table with reasons for exclusion under the tab Methods), and two studies were included.
Results
Two systematic reviews, including fifteen relevant RCTs were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Choi JH, Lee SH, Cho IR, Paik WH, Ryu JK, Kim YT. Ursodeoxycholic acid for the prevention of gallstone and subsequent cholecystectomy following gastric surgery: A systematic review and meta-analysis. J Hepatobiliary Pancreat Sci. 2021 May;28(5):409-418. doi: 10.1002/jhbp.946. Epub 2021 Apr 17. PMID: 33768730.
- Haal S, Guman MSS, de Brauw LM, Schouten R, van Veen RN, Fockens P, Gerdes VEA, Voermans RP, Dijkgraaf MGW. Cost-effectiveness of ursodeoxycholic acid in preventing new-onset symptomatic gallstone disease after Roux-en-Y gastric bypass surgery. Br J Surg. 2022 Oct 14;109(11):1116-1123. doi: 10.1093/bjs/znac273. PMID: 35979609.
- Mulliri A, Menahem B, Alves A, Dupont B. Ursodeoxycholic acid for the prevention of gallstones and subsequent cholecystectomy after bariatric surgery: a meta-analysis of randomized controlled trials. J Gastroenterol. 2022 Aug;57(8):529-539. doi: 10.1007/s00535-022-01886-4. Epub 2022 Jun 15. PMID: 35704084.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Mulliri 2022
Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to February 5th 2022
A: Sugerman, 1995 B: Wudel, 2002 C: Miller, 2003 D: Adams, 2016 E: Abouzeid, 2018 F: Nabil, 2019 G: Pizza, 2020 H: Sakran, 2020 I: Talha, 2020 J: Salman, 2021 K: Haal, 2021
Study design: RCT
Country: A: USA B: USA C: Austria D: USA E: Egypt F: Egypt G: Italy H: Israel I: Egypt J: Egypt K: Netherlands
No information on setting was provided
Source of funding and conflicts of interest: None
For the individual studies not reported
|
Inclusion criteria SR: - RCTS evaluating the impact of UDCA on gallstone formation after bariatric surgery - adult patients - morbidly obese patients submitted to bariatric surgery - patients free of gallstone at randomization - treatment with UDCA in the 2 weeks after surgery, for minimal 6 months - English articles
Exclusion criteria SR: - articles studying the impact of UDCA on gallstone formation after surgeries other than bariatric surgery or after diet
Important patient characteristics at baseline:
N, intervention / control A: i: 177 / c: 56; B: i: 20 / c: 20; C: i: 76 / c: 76; D: i: 37 / c: 38; E: i: 49 / c: 50; F: i: 100/ c: 100; G: c: 95 / c: 95; H: i: 100 / c: 109; I: i: 1160 / c: 310; J: i: 166 / c: 166; K: i: 383 / c: 395;
Mean age; intervention/control A: i: 36.5 / c: 37.4; B: i: 38 / c : 38; () C: i: 34.1 / c: 36.3; D: i: 43.7 / c: 46.0; E: i: 37.8 / c: 38.7; F: i: 30.4 / c: 31.7; G: i: 35.2 / i: 34.2; H: i: 41.2 / c: 43.1; I: i: 31.1 / c: 30.1; J: i: 39.3 / c: 34.7; K: n.a.
Sex: n female (%) intervention / control A: i: 141 (79.7%) / c: 44 (78.6%) B: n.a C: i: 52 (68.4%) / c: 51 (67.1%) D: i: 21 (56.8%) / c: 19 (50%) E: i: 27 (55.1%) / c: 26 (52%) F: i: 79 (79%) / c: 75 (75%) G: i: 62 (65.2%) / c: 59 (62.1%) H: i: 39 (39%) / c: 32 (29.3%) I: i: 716 (61.7%) / c: 171 (55.2%( J: i: 87 (52.4%) / c: 78 (47.0%) K: n.a
BMI (kg/m2) intervention / control A: i: 49 / c: 50.7 B: n.a. C: i: 43.7 / c: 44.3 D: i: 42.7 / c: 43.1 E: i: 47.3 / c: 46.7 F: i: 47.1 / c: 45.8 G: i: 44 / c: 43 H: i: 44.3 / c: 44.5 I: i: 48.6 / c: 49.3 J: i: 42.9 / c: 43.3 K: n.a.
Groups comparable at baseline? Probably yes |
Describe intervention: UDCA (ursodeoxycholic acid)
A: 300 mg, 600 mg or 1200 mg; 6 monhts B: 600 mg; 6 months C: 500 mg; 6 months D: 600 mg; 6 months E: 500 mg; 12 months F: 500 mg; 6 months G: 600 mg; 6 months H: 600 mg; 6 months I: 500 mg; 6 months J: 500 mg; 12 months K: 900 mg; 6 months
|
Describe control:
A: placebo B: placebo C: placebo D: non-placebo controls E: non-placebo controls F: non-placebo controls G: non-placebo controls H: placebo I: placebo J: non-placebo controls K: placebo |
End-point of follow-up:
A: 6 months B: 12 months C: 12 months D: 12 months E: 12 months F: 12 months G: 17 months H: 6 months I: 12 months J: 12 months K: 24 months
Patients in analysis: A: i: 177 (100%) / c: 56 (100%) B: i: 15 (75%) / c: 11 (55%) C: i: 64 (84.2%) / c: 44.3 (78.9%) D: i: 28 (75.7%) / c: 29 (76.3%) E: i: 44 (89.8%) / c: 45/50 (90%) F: i: 100 (100%) / c: 100 (100%) G: i: 95 (95%) / c: 95 (95%) H: i: 46 (46%) / c: 46 (42,2%) I: i: 1137 (98%) / c: 295 (95.1%) J: i: 130 (78.3%) / c: 128 (77.1%) K: i: 381 (99.5%) / c: 392 (99.2%)
|
Outcome measure-1: proportion of patients developing gallstones
Effect measure: RR [95% CI]: A: 0.21 [0.11, 0.41] B: 1.00 [0.43, 2.33] C: 0.15 [0.04, 0.66] D: 0.32 [0.11, 0.88] E: 0.34 [0.13, 0.86] F: 0.15 [0.07, 0.34] G: 0.17 [0.06, 0.46] H: 0.57 [0.29, 1.12] I: 0.30 [0.22, 0.41] J: 0.27 [0.14, 0.50] K: 0.52 [0.36, 0.76]
Pooled effect (random effects model): 0.33 [95% CI 0.24 to 0.45] favoring UDCA Heterogeneity (I2): 58% (intention to treat analysis)
Outcome measure-2: proportion of patients developing symptomatic gallstone disease A: 0.16 [0.01, 1.71] C: 0.25 [0.07, 0.85] G: 0.14 [0.02, 1.14] I: 0.25 [0.15, 0.42] K: 0.47 [0.27, 0.84]
Pooled effect (random effects model): 0.31 [95% CI 0.22 to 0.44 ] favoring UDCA Heterogeneity (I2): 0% (intention to treat analysis)
|
The author’s concluded that: “… the meta-analysis suggests that UDCA seems effective in decreasing the formation of gallstones and the occurrence of symptomatic GD”
In the articles, ORs were calculated (likely to overestimate the effect)
There was hetereogeneity in the results for mean operative time.
Overall RoB of individual studies according to authors (based on Cochrane RoB tool) A: high B: high C: high D: high E: high F: high G: high H: low I: unclear J: high K: low
Surgery types in the studies: A: GBP B: RYGP C: AGB VBG D: SG E: SG F: SG G: OAGB H: OAGB RYGB I: OAGB SG GCP J: SG K: RYGB SG OAGB: one anastomosis gastric bypass; SG: sleeve gastrectomy; GCP: great curvature plication; AGB: adjustable gastric banding; VGB: vertical banded gastroplasty; GBP: gastric bypass; RYGB: Roux-en-Y gastric bypass. |
|
Choi (2021)
Study characteristics and results are extracted from the SR (unless stated otherwise)
|
SR and meta-analysis of RCTs and non-RCTs
Total number of included studies: 11 RCT and 10 non-RCT; of which 4 RCTs were considered relevant
Literature search up to June 30th 2020
A: Bencini, 2019 B: Lee, 2020 C: Williams, 1993 D: Worobetz, 1993
Study design: RCT
Country: A: Italy B: Korea C: Canada D: Canada
No information on setting was provided
Source of funding and conflicts of interest: None
For the individual studies not reported
|
Inclusion criteria SR: - Comparison studies that reported the outcomes of prophylactic UDCA or a PC in the prevention of gallstone formation or SC following gastric surgery - Studies in adults - Patients with no history of cholecystectomy who had no gallstones prior to surgery
Important patient characteristics at baseline:
N, intervention / control A: i: 65 / c: 65 B: i: 315 / c: 150 C: i: 27 / c: 34 D: i: 13 / c: 16
Mean age, intervention / control A: i: 67 / c: 69 B: i: 56 / c: 56 C: n.a. D: i: 33.5 / c: 33.9
Sex: n Female, (%) intervention / control A: i: 27 (41.5%) / c: 28 (43%) B: i: 106 (33.7%) / 48 (32%) C: n.a. D: n.a.
BMI: not specified
Groups comparable at baseline? Probably yes |
Describe intervention:
A: Prophylactic cholecystectomy (PC) B: UDCA 300 mg or 600 mg for 1 year C: UDCA, not specified D: UDCA not specified
|
Describe control:
Not specified |
End-point of follow-up:
Not specified |
Outcome measure-1: proportion of patients developing gallstones
Effect measure: RR [95% CI]: A: 0.11 [0.01, 2.02] B: 0.29 [0.16, 0.53] C: 0.07 [0.00, 1.22] D: 0.09 [0.01, 1.52]
Outcome measure 2: proportion of patients with symptomatic biliary problems
Effect measure: RR [95% CI] A: 0.14 [0.01, 2.71] B: 0.05 [0.00, 0.98] C: not available D: 0.24 [0.01, 4.65]
|
The author’s concluded that: “Prophylactic UDCA seems to be a reasonable preventive method for postsurgical gallstone formation to ensure clinical benefit while reducing the burden of subsequent cholecystectomy for the patient as compared to a PC”
In the articles, ORs were calculated (likely to overestimate the effect)
Indirect comparisons were made on the efficacy of PC and UDCA: The UDCA group showed a tendency to generate more gallstones (OR 3.74 [95% CI 0.88, 15.82]) and the need for SC (OR 2.19 [95% CI 0.47, 10.14]) although no statistical significance was observed
Overall RoB of individual studies according to authors (based on Cochrane RoB tool) A: high B: low C: low D: low
Surgery types in the studies: A: gastrectomy B: gastrectomy C: gastroplasty or gastric band D: gastroplasty or gastric band
|
Quality assessment
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Mulliri 2022 |
Yes
Reason: inclusion criteria were properly formulated |
No
Reason: Embase was not searched |
Yes
Reason: reasons for excluding studies at full text selection were reported with the references |
Yes
Reason: table with baseline characteristics is presented |
Not applicable |
Yes
Reason: Cochrane risk of bias tool was used |
Yes:
Reason: there is some heterogeneity but potential sources of heterogeneity are highlighted (mean operative time) |
Yes:
Reason: mentioned that it is not assessed because at least ten studies should be included |
No
Reason: not reported for the individual studies (but Cochrane tool was used, most studies were ‘free of other bias’. |
|
Choi 2021 |
Yes
Reason: research question and inclusion criteria are predefined |
Yes
Reason: search period and databases are described |
No:
Reason: excluded studies are not referenced |
Yes:
Reason: table with baseline characteristics is presented |
Not applicable |
Yes:
Reason: Cochrane risk of bias tool was used |
Unclear:
Reason: there are some unspecified details (e.g. type of control, dosage of UDCA, follow-up duration) |
Yes:
Reason: funnel plot and eggers test are included. |
No
Reason: not reported for the individual studies (but Cochrane tool was used, most studies were ‘free of other bias’. |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Adams (2016) |
RCT included in included systematic review of Choi (2021). |
|
Fearon (2022) |
Studies in this systematic review were included in the more recent systematic review of Choi (2021) and/or Mulliri (2022). |
|
Haal (2021) |
RCT included in included systematic review of Mulliri (2022). |
|
Leyva-Alvizo (2020) |
Wrong study design. |
|
Magouliotis (2017) |
Studies in this systematic review were included in the more recent systematic review of Choi (2021) and/or Mulliri (2022). |
|
Stokes (2014) |
Studies in this systematic review were included in the more recent systematic review of Choi (2021) and/or Mulliri (2022). |
|
Nabil (2019) |
RCT included in included systematic review of Choi (2021). |
|
Pizza (2020) |
RCT included in included systematic review of Choi (2021). |
|
Warschkow (2013) |
Systematic review includes observationel studies only. |
|
Ying (2022) |
Systematic review includes observationel studies only. |
|
Sakran (2020) |
RCT included in included systematic review of Choi (2021) and/or Mulliri (2022). |
|
Salman (2022) |
RCT included in included systematic review of Choi (2021) and/or Mulliri (2022). |
|
Talha (2020) |
RCT included in included systematic review of Choi (2021) and/or Mulliri (2022). |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 06-06-2024
Beoordeeld op geldigheid : 25-05-2024
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
De modules zijn herzien binnen het cluster gastro-enterologische chirurgie (GE-chirurgie). Het cluster GE-chirurgie bestaat uit vier richtlijnen. De stuurgroep bewaakt het proces van modulair onderhoud binnen het cluster. De expertisegroepsleden worden indien nodig gevraagd om hun expertise in te zetten voor een specifieke richtlijnmodule. De samenstelling van de clusterstuur- en expertisegroep is als volgt:
Clusterstuurgroep
- Mevr. prof. dr. M.A. (Marja) Boermeester, chirurg; NVvH (voorzitter)
- Dhr. dr. B.R. (Boudewijn) Toorenvliet, chirurg; NVvH
- Dhr. dr. C.C. (Charles) van Rossem, chirurg; NVvH
- Dhr. dr. I. (Ian) Faneyte, chirurg; NVvH
- Dhr. prof. dr. M.W. (Markus) Hollmann, anesthesioloog; NVA
- Dhr. prof. dr. P.D. (Peter) Siersema, maag-darm-leverarts; NVMDL
- Mevr. prof. dr. R.G.H. (Regina) Beets-Tan, radioloog; NVvR
- Mevr. E.C. (Esen) Doganer, Stichting Kind & Ziekenhuis
Clusterexpertisegroep
- Mevr. H.S. (Gonneke) Hermanides, internist; NIV
- Dhr. dr. drs. W.P. (Wytze) Oosterhuis, arts klinische chemie; NVKC
- Mevr. A.B. (Bertine) Bruil, maag-darm-leverarts; NVMDL
- Dhr. R.P. (Rogier) Voermans, maag-darm-leverarts; NVMDL
- Dhr. dr. R.C. (Robert) Verdonk, maag-darm-leverarts; NVMDL
- Dhr. dr. G.I. (Gunnar) Andriesse, arts-microbioloog; NVMM
- Mevr. drs. S.P. (Suzan) van Mens, medisch microbioloog; NVMM
- Dhr. dr. P. (Philip) de Reuver, chirurg; NVvH
- Dhr. dr. A. (Arnold) van de Laar, chirurg; NVvH
- Mevr. drs. A.L. (Anne Loes) van den Boom, chirurg; NVvH
- Dhr. dr. C.E.J. (Pim) Sloots, kinderchirurg; NVvH
- Mevr. N. (Nikki) Knijn, patholoog; NVVP
- Dhr. dr. L.P.J. (Lodewijk) Cobben, radioloog; NVvR
- Mevr. dr. M. (Monique) Maas, radioloog; NVvR
Met ondersteuning van
Dhr. M. Griekspoor MSc., adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van de clusterleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Clusterstuurgroep
Tabel 1. Gemelde (neven)functies en belangen stuurgroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Boermeester |
Chirurg |
|
Persoonlijke financiële belangen: Hieronder staan de beroepsmatige relaties met bedrijfsleven vermeld waarbij eventuele financiële belangen via de AMC Research B.V. lopen, dus institutionele en geen persoonlijke gelden zijn: Skillslab instructeur en/of spreker (consultant) voor KCI/3M, Smith&Nephew, Johnson&Johnson, Gore, BD/Bard, TELABio, GDM.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: Institutionele grants van KCI/3M, Johnson&Johnson, en New Compliance.
Intellectuele belangen en reputatie: Ik maak me sterk voor een 100% evidence-based benadering van maken van aanbevelingen, volledig transparant en reproduceerbaar. Dat is mijn enige belang in deze; geen persoonlijk gewin.
Overige belangen: Geen.
|
Geen restricties. |
|
Toorenvliet
|
Chirurg |
|
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: Geen.
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen. |
Geen restricties. |
|
van Rossem
|
Chirurg |
Geen. |
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: Geen.
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen.
|
Geen restricties. |
|
Faneyte
|
Chirurg |
Geen. |
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: Geen.
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen.
|
Geen restricties. |
|
Hollmann
|
Anesthesioloog |
|
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: ZonMw Doelmatigheid.
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen.
|
Geen restricties. |
|
Siersema
|
Maag-darm-leverarts |
Geen.
|
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: Geen.
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen.
|
Geen restricties. |
|
Beets-Tan
|
Radioloog |
Geen.
|
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: Geen.
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen.
|
Geen restricties. |
|
Doganer
|
Beleidsmedewerker Stichting Kind & Ziekenhuis |
Geen.
|
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: Geen.
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen.
|
Geen restricties. |
Clusterexpertisegroep
Tabel 2. Gemelde (neven)functies en belangen expertisegroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Hermanides
|
Internist |
|
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: Geen.
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen.
|
Geen restricties. |
|
Oosterhuis
|
Arts klinische chemie |
|
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: Financiering van twee lopende projecten alleen door de SKMS. Er zijn geen belangen bij de uitkomst van de projecten.
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen.
|
Geen restricties. |
|
Bruil
|
Maag-darm-leverarts
|
Geen.
|
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: Geen.
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen.
|
Geen restricties. |
|
Voermans
|
Maag-darm-leverarts
|
Geen.
|
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: Onderzoeks financiering/ ondersteuning door: - ZonMw - Boston Scientific - Zambon Nederland
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen.
|
Geen restricties. |
|
Verdonk
|
Maag-darm-leverarts
|
Geen.
|
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: COMBO studie.
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen.
|
Geen restricties. |
|
Andriesse
|
Arts-microbioloog
|
|
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: Geen.
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen.
|
Geen restricties. |
|
van Mens
|
Medisch microbioloog
|
|
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: Geen.
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen.
|
Geen restricties. |
|
de Reuver
|
Chirurg
|
Geen.
|
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: ZonMw.
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen.
|
Geen restricties. |
|
van de Laar
|
Chirurg
|
Geen.
|
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: Geen.
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen.
|
Geen restricties. |
|
van den Boom
|
Chirurg
|
Geen.
|
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: Geen.
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen.
|
Geen restricties. |
|
Sloots
|
Kinderchirurg
|
Geen.
|
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: Geen.
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen.
|
Geen restricties. |
|
Knijn
|
Patholoog
|
Geen.
|
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: Geen.
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen.
|
Geen restricties. |
|
Cobben
|
Radioloog
|
Allen betaald:
|
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: Geen.
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen.
|
Geen restricties. |
|
Maas
|
Radioloog
|
|
Persoonlijke financiële belangen: Geen.
Persoonlijke relaties: Geen.
Extern gefinancierd onderzoek: Geen.
Intellectuele belangen en reputatie: Geen.
Overige belangen: Geen.
|
Geen restricties. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de participatie van Stichting Kind & Ziekenhuis in de stuurgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodule is tevens te commentaar voorgelegd aan alle patiëntenorganisaties in de stuur- en expertisegroep. De eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Implementatie
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Tabel 3. Uitkomsten kwalitatieve raming
|
Module |
Uitkomst raming |
Toelichting |
|
Module 2.2.3 ‘Galsteenlijden bij gewichtsverlies’
|
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 3.1 ‘Diagnostiek bij choledocholithiasis’
|
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 4.1 ‘Diagnostiek bij cholecystolithiasis’ Module 7 ‘Behandeling van acute, biliaire pancreatitis’
|
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 7 ‘Behandeling van acute, biliaire pancreatitis’
|
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Need-for-update, prioritering en uitgangsvragen
Tijdens de need-for-update fase (September, 2021) inventariseerde het cluster de geldigheid van de modules binnen het cluster. Naast de partijen die deelnemen aan de stuur- en expertisegroep zijn hier ook andere stakeholders voor benaderd, zie onderstaande tabel.
Tabel 4. Partijen need-for-update
|
Partijen need-for-update |
||
|
Nederlands Huisartsen Genootschap |
Inspectie Gezondheidszorg en Jeugd |
Nederlandse Federatie van Universitair Medische Centra |
|
Nederlandse Vereniging van Ziekenhuizen |
Patiëntenfederatie Nederland |
Samenwerkende Topklinische opleidingsZiekenhuizen |
|
Verpleegkundigen & Verzorgenden Nederland |
Nederlandse Associatie Physician Assistants |
Zorginstituut Nederland |
|
Zelfstandige Klinieken Nederland |
Zorgverzekeraars Nederland |
|
Per module is aangegeven of deze geldig is, kan worden samengevoegd met een andere module, obsoleet is en kan vervallen of niet meer geldig is en moet worden herzien. Ook was er de mogelijkheid om nieuwe onderwerpen voor modules aan te dragen die aansluiten bij één (of meerdere) richtlijn(en) behorend tot het cluster. De modules die uit de need-for-update naar voren kwamen zijn besproken en geprioriteerd door leden van de stuur- en expertisegroep.
Voor de geprioriteerde modules zijn door de het cluster concept-uitgangsvragen herzien of opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde het cluster welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde het cluster tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd zo nodig gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
Tabel 5. Gradaties voor de kwaliteit van wetenschappelijk bewijs
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
Tabel 6. Sterkte van de aanbevelingen
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd ter commentaar voorgelegd aan alle partijen die benaderd zijn voor de need-for-update fase. De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd voorgelegd ter autorisatie aan de partijen die beschreven staan onder het kopje geldigheid en onderhoud (zie verantwoording).
Zoekverantwoording
Algemene informatie
|
Cluster/richtlijn: GE-chirurgie - galsteenlijden |
|
|
Uitgangsvraag/modules: Hoe kan het risico op het ontstaan van asymptomatische en symptomatische cholecystolithiasisbij gewichtsreductie worden verminderd? |
|
|
Database(s): Ovid/Medline, Embase.com |
Datum: 29 augustus |
|
Periode: 2010 - heden |
Talen: Engels, Nederlands |
|
Literatuurspecialist: Miriam van der Maten |
|
|
BMI-zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Voor deze vraag is gezocht op de elementen:
De sleutelartikelen worden allemaal gevonden op basis van terminologie. De artikelen van Di Ciaula, Stokes en Haal (2020), worden niet gevonden op basis van studiedesign.
|
|
|
Te gebruiken voor richtlijnen tekst: Nederlands In de databases Embase.com en Ovid/Medline is op 29 augustus 2022 met relevante zoektermen gezocht naar systematische reviews en RCT over het verminderen van het risico op cholecystolithiasis bij gewichtsreductie. De literatuurzoekactie leverde 388 unieke treffers op.
Engels On the 29th of August 2022 relevant search terms were used to search for systematic reviews and RCT about what could minimize the risks for cholecystolithiasis during weight loss in the databases Embase.com and Ovid/Medline. The search resulted in 388 unique hits. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
161 |
101 |
177 |
|
RCT |
179 |
145 |
211 |
|
Totaal |
340 |
246 |
388 |
Zoekstrategie
Embase.com
|
No. |
Query |
Results |
|
#15 |
#13 OR #14 |
340 |
|
#14 |
#10 AND #12 NOT #13 = RCT |
179 |
|
#13 |
#10 AND #11 = SR |
161 |
|
#12 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1950230 |
|
#11 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#10 |
#8 AND #9 AND ([english]/lim OR [dutch]/lim) AND [2010-2022]/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
2720 |
|
#9 |
'body weight gain'/exp/mj OR 'body weight loss'/exp/mj OR 'body weight management'/exp/mj OR ((weight NEAR/2 (los* OR cut* OR reduc*)):ti,ab,kw) OR 'bariatric surgery'/exp/mj OR (((metabolic OR bariatric) NEAR/2 (surg* OR opera*)):ti,ab,kw) OR 'gastric bypass surgery'/exp/mj OR 'gastric balloon'/exp/mj OR (((gastric OR stomach) NEAR/2 (bypass* OR balloon*)):ti,ab,kw) OR 'roux-en-y':ti,ab,kw OR 'sleeve gastrectom*':ti,ab,kw OR 'low calorie diet'/exp/mj OR 'diet therapy'/exp/mj OR 'diet'/exp/mj OR 'fasting'/exp/mj OR 'dietary intake'/exp/mj OR diet*:ti,ab,kw OR fasting*:ti,ab,kw OR 'obesity'/exp/mj OR obese*:ti,ab,kw OR obesit*:ti,ab,kw OR overweight*:ti,ab,kw OR 'over weight*':ti,ab,kw OR 'ursodeoxycholic acid'/exp OR 'ursodeoxycholic acid':ti,ab,kw |
1726873 |
|
#8 |
'gallstone'/exp/mj OR 'cholelithiasis'/exp/mj OR gallstone*:ti,ab,kw OR 'bile stone*':ti,ab,kw OR 'gall* stone*':ti,ab,kw OR 'gall bladder stone*':ti,ab,kw OR cholelithiasis:ti,ab,kw OR cholecystolithiasis:ti,ab,kw OR cholecystitis:ti,ab,kw OR 'biliary pancreatitis':ti,ab,kw OR 'bile calculosis':ti,ab,kw OR 'bile lithiasis':ti,ab,kw OR 'bile lithogenesis':ti,ab,kw OR 'bile lithogenicity':ti,ab,kw OR 'biliary calculi':ti,ab,kw OR 'biliary calculosis':ti,ab,kw OR 'biliary calculous disease':ti,ab,kw OR 'biliary calculus':ti,ab,kw OR 'biliary lithiasis':ti,ab,kw OR 'biliary lithogenesis':ti,ab,kw OR 'biliary lithogenicity':ti,ab,kw OR 'biliary stone':ti,ab,kw OR 'biliary tract calculi':ti,ab,kw OR 'biliary tract calculosis':ti,ab,kw OR 'biliary tract calculous disease':ti,ab,kw OR 'biliary tract calculus':ti,ab,kw OR 'biliary tract lithiasis':ti,ab,kw OR 'biliary tract stone':ti,ab,kw OR 'cholecystic lithiasis':ti,ab,kw OR 'cholecysto-lithiasis':ti,ab,kw OR 'cholecystolithiasis':ti,ab,kw OR 'cholelith':ti,ab,kw OR 'cholelithiasis':ti,ab,kw OR 'choleliths':ti,ab,kw OR 'cholethiasis':ti,ab,kw OR 'gall bladder calculi':ti,ab,kw OR 'gall bladder calculus':ti,ab,kw OR 'gall bladder concretions':ti,ab,kw OR 'gall bladder lithiasis':ti,ab,kw OR 'gallbladder calculi':ti,ab,kw OR 'gallbladder calculus':ti,ab,kw OR 'gallbladder concrements':ti,ab,kw OR 'gallbladder concretion':ti,ab,kw OR 'gallbladder lithiasis':ti,ab,kw OR 'cholecystectomy'/exp OR cholecystectom*:ti,ab,kw |
111740 |
Ovid/Medline
|
# |
Searches |
Results |
|
10 |
8 or 9 |
246 |
|
9 |
(5 and 7) not 8 = RCT |
145 |
|
8 |
5 and 6 = SR |
101 |
|
7 |
exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. |
1540926 |
|
6 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
614130 |
|
5 |
limit 4 to ((english language or dutch) and yr="2010 -Current") |
2021 |
|
4 |
3 not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
5915 |
|
3 |
1 and 2 |
6766 |
|
2 |
exp Body Weight Changes/ or exp Weight Reduction Programs/ or exp Diet Therapy/ or exp Obesity/ or exp Weight Loss/ or (weight adj2 (los* or cut* or reduc*)).ti,ab,kf. or exp Bariatric Surgery/ or exp Gastric Bypass/ or exp Gastric Balloon/ or ((metabolic or bariatric) adj2 (surg* or opera*)).ti,ab,kf. or ((gastric or stomach) adj2 (bypass* or balloon*)).ti,ab,kf. or 'Roux-en-Y'.ti,ab,kf. or 'sleeve gastrectom*'.ti,ab,kf. or exp Diet Therapy/ or exp diet/ or exp Fasting/ or diet*.ti,ab,kf. or fasting*.ti,ab,kf. or obese*.ti,ab,kf. or obesit*.ti,ab,kf. or overweight*.ti,ab,kf. or 'over weight*'.ti,ab,kf. or exp Ursodeoxycholic Acid/ or 'ursodeoxycholic acid'.ti,ab,kf. |
1272678 |
|
1 |
exp Gallstones/ or exp Cholelithiasis/ or exp Cholecystectomy/ or gallstone*.ti,ab,kf. or 'bile stone*'.ti,ab,kf. or 'gall* stone*'.ti,ab,kf. or 'gall bladder stone*'.ti,ab,kf. or cholelithiasis.ti,ab,kf. or cholecystolithiasis.ti,ab,kf. or cholecystitis.ti,ab,kf. or 'biliary pancreatitis'.ti,ab,kf. or 'bile calculosis'.ti,ab,kf. or 'bile lithiasis'.ti,ab,kf. or 'bile lithogenesis'.ti,ab,kf. or 'bile lithogenicity'.ti,ab,kf. or 'biliary calculi'.ti,ab,kf. or 'biliary calculosis'.ti,ab,kf. or 'biliary calculous disease'.ti,ab,kf. or 'biliary calculus'.ti,ab,kf. or 'biliary lithiasis'.ti,ab,kf. or 'biliary lithogenesis'.ti,ab,kf. or 'biliary lithogenicity'.ti,ab,kf. or 'biliary stone'.ti,ab,kf. or 'biliary tract calculi'.ti,ab,kf. or 'biliary tract calculosis'.ti,ab,kf. or 'biliary tract calculous disease'.ti,ab,kf. or 'biliary tract calculus'.ti,ab,kf. or 'biliary tract lithiasis'.ti,ab,kf. or 'biliary tract stone'.ti,ab,kf. or 'cholecystic lithiasis'.ti,ab,kf. or 'cholecysto-lithiasis'.ti,ab,kf. or 'cholecystolithiasis'.ti,ab,kf. or 'cholelith'.ti,ab,kf. or 'cholelithiasis'.ti,ab,kf. or 'choleliths'.ti,ab,kf. or 'cholethiasis'.ti,ab,kf. or 'gall bladder calculi'.ti,ab,kf. or 'gall bladder calculus'.ti,ab,kf. or 'gall bladder concretions'.ti,ab,kf. or 'gall bladder lithiasis'.ti,ab,kf. or 'gallbladder calculi'.ti,ab,kf. or 'gallbladder calculus'.ti,ab,kf. or 'gallbladder concrements'.ti,ab,kf. or 'gallbladder concretion'.ti,ab,kf. or 'gallbladder lithiasis'.ti,ab,kf. or cholecystectom*.ti,ab,kf. |
80936 |
