Antimicrobiële therapie bij FRI’s
Uitgangsvraag
Welke antimicrobiële therapie (keuze therapie, duur van behandeling) moet gebruikt worden bij fractuur-gerelateerde infecties (FRI’s)?
Aanbeveling
Onderstaande antibiotica adviezen kunnen per ziekenhuis verschillen (bijvoorbeeld andere dosering of een ander maar bijna identiek betalactam antibioticum). Raadpleeg hiervoor zo nodig uw microbioloog/internist-infectioloog.
Start bij FRI met antibiotica nadat er een grondig debridement/osteosynthesemateriaal verwijdering heeft plaatsgevonden en na afname van adequate kweken, of eerder indien patiënt septisch is.
Start bij (verdenking op) FRI postoperatief empirisch met breedspectrum antibiotische therapie
Voeg bij ernstig zieke patiënten of bij patiënten bij wie op grond van de lokale epidemiologie een hoge kans bestaat op gramnegatieve verwekkers een aminoglycoside toe aan de empirische behandeling.
Ga over op gerichte antibiotische therapie als de kweekuitslag bekend is (zie tabel 1 in de overwegingen).
Continueer de intraveneuze behandeling met antibiotica twee weken, waarna geswitcht kan worden naar orale antibiotica.
Figuur 1 Algoritme behandeling FRI’s met osteosynthese
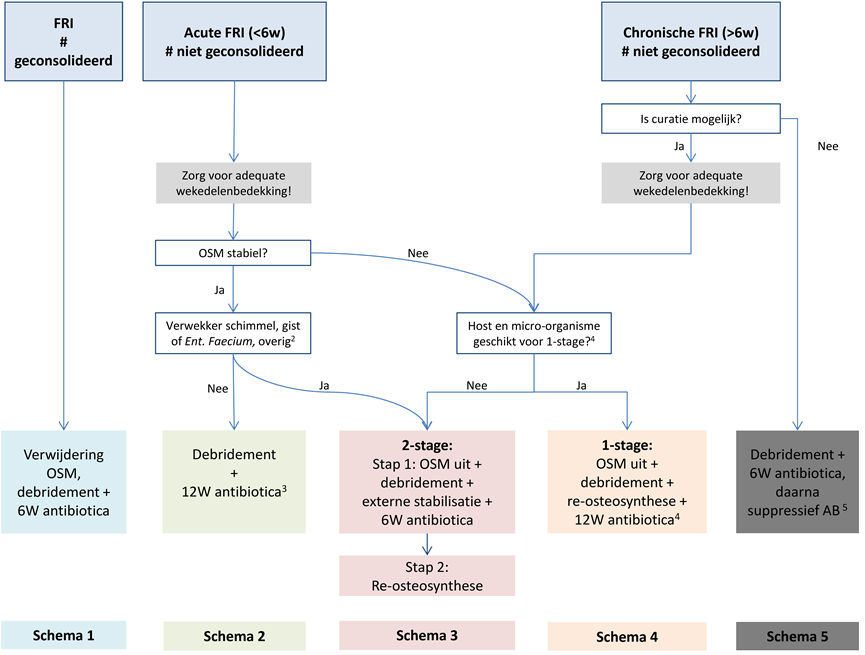
Legenda Figuur 1
FRI=Fractuur-gerelateerde infectie. OSM=osteosynthesemateriaal. AB=antibiotica. #=fractuur.
1 Adequate weke delenbedekking = vitale weke delen die spanningsvrij primair gesloten kunnen worden of door middel van transpositie van weke delen.
2 Het betreft geen schimmels, gisten of enterokokken of andere verwekkers waarvoor langdurig toxische therapie gegeven moet worden.
3 Behandel stafylokokken met rifampicine-combinatietherapie als (1) de stafylokok rifampicine-gevoelig is en (2) als de verwachting is dat het OSM langdurig in situ zal blijven (Zie hiervoor antibiotica tabel 1B in de overwegingen). Bij gramnegatieven bij voorkeur fluorochinolonen indien gevoelig.
4 Er is geen literatuur over 1-stage procedure bij FRI. Hostfactoren (zoals diabetes, reumatoïde artritis, neutropenie of steroidengebruik) en het type micro-organismen (langdurig intraveneuze of toxische therapie geïndiceerd zoals vancomycine) spelen een belangrijke rol in de afweging. Het verdient de voorkeur deze beslissing te nemen in overleg met een regionaal expertisecentrum. Voor keus antibiotica: zie tekst schema 4.
5 Duur suppressieve therapie tenminste 12mnd of tot kort na verwijdering osteosynthese.
6 Het verdient aanbeveling om reimplantatie van osteosynthese indien mogelijk uit te stellen tot 2 weken na staken van de antibiotica, zodat eventueel falen van de voorafgaande behandeling in die periode duidelijk kan worden.
Overwegingen
Keuze van antibiotica
In de besproken studies werden zowel patiënten met prothese infecties als FRI’s geïncludeerd. Beide studies waren underpowered, hebben forse methodologische beperkingen. De hieronder staande behandeladviezen zijn daarom grotendeels gebaseerd op expert opinion.
Tabel 1 Antibiotische behandeling FRI
Leeswijzer: Antibiotica voorschrijvingen kunnen per ziekenhuis verschillen (bijvoorbeeld andere dosering of een andere keus antibioticum). Raadpleeg hiervoor zo nodig uw internist-infectioloog/arts-microbioloog.
|
Start de volgende gerichte therapie zodra de verwekker bekend is en altijd in overleg met de infectioloog/arts-microbioloog: |
|||
|
Tabel 1A: ANTIBIOTISCHE BEHANDELING FRI (zie figuur 1) |
|||
|
Verwekker |
Initiële therapie |
Orale vervolgbehandeling |
Totale duur gerichte therapie |
|
S. aureus (en CNS, indien flucloxacilline gevoelig) |
Flucloxacilline minimaal 6 gram/24 uur i.v.c |
Clindamycine 3dd 600 mg of Cotrimoxazol 2dd960 mg of Flucloxacilline 5dd 1000 mge (alléén na resorptietestf) |
Na 2 wekenb kan overgegaan worden op een oraal alternatief op basis van kliniek en antibiogram
Totale behandelduur is 12 weken |
|
Coagulase-negatieve stafylokokken MRSA |
Vancomycine 15 mg/kg 2 dda, aanpassen dosis op grond van dalspiegel |
Afhankelijk van antibiogram |
|
|
Streptokokken P.acnes |
Penicilline G minimaal 6 milj. E./24 uur# |
Clindamycine 3dd600 mg of Amoxicilline 3dd1000 mg of Feneticilline 5d1000 mg |
|
|
E. coli |
Cefuroxim 3dd1500mg c of ceftriaxon 1dd2 gram |
Cotrimoxazol 2dd960mg of Ciprofloxacine 2dd500mg |
|
|
P. aeruginosa |
Ceftazidim 6 gram / 24 uur c,d |
Ciprofloxacine 2dd750 mg |
|
|
Enterococcus faecalis |
Amoxicilline minimaal 6 gram/24 uur c |
Amoxicilline 3dd1000 mge |
|
|
Enterococcus faecium |
Vancomycine 15 mg/kg 2 dda, aanpassen dosis op grond van dalspiegel |
Afhankelijk van antibiogram |
|
|
Tabel 1B: BIOFILM BEHANDELING BIJ SCHEMA 2 (zie voorwaarden in Legenda van figuur 1) |
|||
|
Verwekker |
Initiële therapie |
Orale vervolgbehandeling |
Totale duur gerichte therapie |
|
S. aureus (en CNS, indien flucloxacilline gevoelig) |
Flucloxacilline 6 gram/24 uur i.v. c + Rifampicine 2dd450 mg p.o. |
Rifampicine 2dd450mg + fluorochinolong |
Rifampicine wordt zo snel mogelijk gestart als wond dicht is en gevoeligheid stafylokok bekend is
Na 2 wekenb switch naar oraal alternatief op basis van kliniek en antibiogram
Totale behandelduur is 12 weken |
|
CNS MRSA |
Vancomycine 15 mg/kg 2 dd a, aanpassen dosis op grond van spiegels + Rifampicine 2 dd 450 mg p.o. |
Rifampicine 2dd450 mg + fluorochinolong |
|
|
E. coli
|
Cefuroxim 4.5 gram per 24 uurc |
Ciprofloxacine 2dd500 mg alternatief: cotrimoxazol 2dd960mg |
|
|
a Overweeg bij Vancomycine continue dosering, mede ook gezien het gemak van monitoring voor de toxiciteit
b Er is nog niet gepubliceerde evidence dat er ook na 1 week intraveneuze therapie al geswitcht kan worden naar orale therapie; per centrum kan besloten worden dit al lokaal te implementeren
c Bij voorkeur worden deze middelen per continue infuus toegediend (op grond van een theoretisch gunstiger Pk/Pd profiel waarbij 100% van de tijd een effectieve antibioticumconcentratie wordt bereikt; daarnaast maakt continue infusie monitoring door middel van spiegels makkelijker)
d Deze dosering kan eventueel naar beneden bijgesteld worden in overleg met het Antibiotica-team van het ziekenhuis op grond van de MIC van het micro-organisme en de gemeten ceftazidim serumspiegel
e Flucloxacilline is gecontra-indiceerd indien er géén resorptiestest is verricht voorafgaand aan de start van flucloxacilline
f Resorptietest flucloxacilline: t=0 min.: dalspiegel afnemen, hierna inname testdosis van 1 gram flucloxacilline met water. t=45 min.: ¾ uurs waarde afnemen. t=90 min.: 1 ½ uurs waarde afnemen, hierna einde test. De patiënt moet ‘nuchter’ zijn voor de test: dit betekent dat deze vanaf 2 uur voor de test tot 1 uur na de inname van de testdosis geen voedsel of dranken mag gebruiken. Water is wel toegestaan. Overige medicamenten mogen worden ingenomen, dit moet dan wel op de aanvraag genoteerd worden. Exacte tijdstippen van inname en bloedafname op formulier noteren (dus niet de gewenste tijden). Indien patiënt een flucloxacilline perfusor heeft, mag deze tijdens de test gewoon gecontinueerd worden. Streefconcentratie: het verschil tussen de dalspiegel (t=0 min) en de spiegel op 45 en/of 90 min. moet ten minste 10 mg/L bedragen.
gDe meest gebruikte combinaties in de literatuur zijn rifampicine en ciprofloxacine of rifampicine en levofloxacine. Zie ook de overwegingen bij ‘de rol van rifampicine’ |
|||
Antibiotische therapie
De keus voor de antibiotische therapie hangt af van een aantal factoren. Op basis van deze factoren kunnen we de behandeling van patiënten met een FRI in vijf schema’s verdelen (zie figuur 1 in de aanbevelingen). Dit schema is gebaseerd op expert opinion vanuit de werkgroep en heeft als doel een praktische hulp te zijn om tot een juiste behandeling te komen.
Richtinggevende vragen bij de keuze van behandeling zijn:
• Is de fractuur geconsolideerd?
• Is de infectie acuut of chronisch?
• Is het osteosynthesemateriaal stabiel of niet-stabiel?
• Is het doel van de behandeling eradicatie van de infectie of alleen onderdrukking van de infectie?
• Zijn er host factoren of micro-organismen betrokken die verwijdering van het osteosynthesemateriaal noodzakelijk maken?
Schema 1
Bij een FRI waarbij de fractuur geconsolideerd is dient de osteosynthese verwijderd te worden en debridement en nettoyage plaats te vinden. De resterende FRI wordt 6 weken behandeld met antibiotica. De empirische therapie wordt hieronder toegelicht. Bij bekend zijn van de kweken wordt geswitcht naar gerichte therapie. Er wordt behandeld met een zo smalspectrum mogelijk antibioticum wat geschikt is voor het behandelen van een osteomyelitis (Landersdorfer, 2009). Voor S.aureus wordt bij start van de behandeling intraveneuze continue infusie met een betalactam (flucloxacilline) geadviseerd. Bij de switch naar orale therapie kunnen zowel clindamycine, flucloxacilline als cotrimoxazol overwogen worden.
Er zijn geen goede studies gedaan naar het oraal uitbehandelen van FRI (Spellberg, 2012). Farmacologische studies bij mensen tonen een betere botpenetratie van cotrimoxazol en clindamycine ten opzichte van flucloxacilline. De vraag is of dit te extrapoleren is naar patiënten met een botinfectie (Landersdorfer. 2009; Navarro, 2009). Het betreft een niet-representatieve populatie en er is veel variabiliteit in uitkomsten. Het is ook mogelijk om oraal flucloxacilline voor te schrijven (Stichting Werkgroep AntibioticaBeleid Nederland (SWAB) Behandeladvies bij chronische osteomyelitis op basis van S. aureus). Een van de voordelen van clindamycine (driemaal daags) en cotrimoxazol (tweemaal daags) is de hogere therapietrouw door lagere doseringfrequentie. Cotrimoxazol heeft een breder werkingsspectrum dan clindamycine en is geassocieerd met meer toxiciteit. Bij behandeling met oraal flucloxacilline dient altijd eerst een resorptietest verricht te worden omdat 10% van de patiënten het middel niet goed absorbeert waardoor te lage spiegels worden bereikt; in deze gevallen is flucloxacilline gecontra-indiceerd (Dijkmans, 2012). Als er geen resorptietest wordt gedaan dient er dus geen oraal flucloxacilline voorgeschreven te worden. Indien er gekozen wordt voor flucloxacilline per os is duidelijke uitleg naar patiënten essentieel, omdat flucloxacilline vijfmaal per dag gedoseerd dient te worden om voldoende effectief te zijn.
Voor oxacilline-resistente CNS is vancomycine de eerste keus, waarbij op basis van het antibiogram beslist wordt of switch naar een oraal antibioticum mogelijk is. Het advies bij overige verwekkers is te vinden in bijgevoegde tabel 1. Bij persisterende inflammatie en/of klachten tijdens antibiotische therapie dient de oorzaak daarvoor nagegaan en behandeld te worden. Falen van behandeling kan bijvoorbeeld veroorzaakt worden door de aanwezigheid van sequesters, een ander micro-organisme, een resistent micro-organisme of non-compliance van de patiënt.
Schema 2
Bij acute FRI en een nog niet geconsolideerde fractuur wordt er gestreefd naar curatie van de infectie met behoud van het osteosynthesemateriaal. Te allen tijde dient hierbij gezorgd te worden voor adequate weke delenbedekking. Als het osteosynthesemateriaal echter instabiel is of als er micro-organismen betrokken zijn waarbij de kans op falen hoog is (zoals gisten, schimmels, enterokokken) of waarbij alleen toxische therapie mogelijk is, dient het osteosynthesemateriaal verwijderd te worden (schema 3 of 4).
Bij debridement wordt het osteosynthesemateriaal zo goed als mogelijk gereinigd (zie de module Chirurgische behandeling), en het weefsel genettoyeerd, waarna antibiotica wordt gestart. De keuze voor antibiotica is toegelicht onder schema 1, waarbij er bij stafylokokken een belangrijk verschil is in de keus van antibiotica bij schema 2: indien de verwachting is dat het osteosynthesemateriaalniet verwijderd kan worden of langdurig (>3 maanden) in situ moet blijven, is het advies om bij rifampicine-gevoelige stafylokokken te behandelen met rifampicine in combinatie met een fluorochinolon. Dit beleid is gericht op het behandelen van resterende biofim en voorkomen van nieuwe biofilm-formatie na debridement van het te behouden osteosynthese materiaal (zie ook hieronder ‘De rol van rifampicine’).
De duur van antibiotische behandeling bedraagt 12 weken. Langer dan 12 weken antibiotica is niet zinvol. Bij persisterende inflammatie en/of klachten is er dan falen van behandeling en dient de oorzaak daarvoor nagegaan en behandeld te worden. Falen van behandeling kan veroorzaakt worden door de aanwezigheid van sequesters, persisterend geïnfecteerd kunstmateriaal, een ander micro-organisme, een resistent-micro-organisme, noncompliance van de patiënt, et cetera.
Schema 3
Bij een niet geconsolideerde chronische FRI of een acute FRI die niet voor schema 2 in aanmerking komt, dient het osteosynthese materiaal verwijderd te worden. Hierbij kan voor zowel een ‘2-stage’ als een ‘1-stage’ vervanging gekozen worden. Een ‘2-stage’ vervanging wordt geadviseerd bij patiënten bij wie de kans op falen van therapie hoog wordt geacht bij het in situ laten van de osteosynthese. Dit kan bijvoorbeeld het geval zijn bij patiënten met diabetes mellitus, gebruik van corticosteroïden, neutropenie, onvoldoende weke delenbedekking of micro-organismen met een hoge kans op falen (enterokokken, schimmels, gisten). Ook langdurige toxische therapie kan een reden zijn voor een 2-stage vervanging. Zo nodig wordt een fixateur externa aangebracht en gefixeerd buiten het geïnfecteerde gebied.
Na verwijdering van het osteosynthese materiaal volgt antibiotische behandeling van de infectie gedurende zes weken (de keuze van antibiotische therapie is vergelijkbaar met schema 1 en wordt samengevat in tabel 1). Hierna kan, als de kliniek goed is de antibiotica gestaakt worden en, indien er nog geen consolidatie is bereikt, re-osteosynthese plaatsvinden of uitbehandeld worden met een fixateur externa. Het verdient aanbeveling om reimplantatie van osteosynthese materiaal indien mogelijk uit te stellen tot 2 weken na staken van de antibiotica, zodat eventueel falen van de voorafgaande behandeling in die periode duidelijk kan worden. Bij reimplantatie wordt vervolgens de reguliere profylaxe na afname van kweken gegeven ter voorkoming van postoperatieve wondinfecties. Bij een FRI met een kritieke osteosynthese (bijvoorbeeld communitieve fracturen waarbij verwijdering van het materiaal niet mogelijk is) wordt schema 2 gevolgd. Er is geen literatuur beschikbaar om de vraag te beantwoorden of er tijdens re-osteosynthese kweken afgenomen dienen te worden en wat de consequenties van een eventuele positieve kweek zijn. De werkgroep adviseert om wel te kweken en opnieuw als FRI te behandelen als de patiënt op basis van die kweken aan de criteria voor FRI voldoet.
Schema 4
In een geselecteerde groep patiënten met een FRI bij wie nog geen consolidatie is bereikt kan besloten worden tot een zogenaamde 1-stage procedure. Hierbij wordt al het osteosynthesemateriaal verwijderd, vindt grondig debridement plaats (zie de module Chirurgische behandeling) en vindt in dezelfde sessie re-osteosynthese plaats. Essentieel hierbij is dat er adequate weke delenbedekking is. Er is geen literatuur over 1-stage procedures bij FRI. Host factoren (zoals diabetes, reumatoïde artritis, neutropenie of corticosteroïdengebruik) het type micro-organisme en de toxiciteit van de therapie (langdurig intraveneuze of toxische therapie geïndiceerd) spelen een rol in de afweging. Het verdient de voorkeur de beslissing over one –of two-stage behandeling te nemen in overleg met een regionaal expertisecentrum. Het antibioticabeleid is in principe als bij schema 2. Bij rifampicine-gevoelige stafylokokken is er een theoretisch voordeel voor het gebruik van rifampicine-combinatietherapie bij een 1-stage procedure. Er is echter geen enkele klinische studie verricht naar 1-stage vervanging bij FRI en rifampicine is veel meer dan andere antibiotica geassocieerd met toxiciteit en interacties en leidt tot antibiotische selectiedruk door de combinatie met fluorochinolonen. De werkgroep adviseert daarom om de beslissing tot het al dan niet gebruik van rifampicine (zie hiervoor tabel 1) altijd in multidisciplinair overleg te nemen en/of in overleg met een regionaal expertisecentrum.
Schema 5
Bij patiënten met een chronische FRI zonder consolidatie waarbij er geen curatieve opties meer zijn en patiënt niet geopereerd wil of kan worden is het advies om zo mogelijk een debridement te doen met als doel het reduceren van de bacteriële load, gevolgd door zes weken antibiotica. Hierna kan overgegaan wordt op laag gedoseerde chronische suppressieve therapie (zie hieronder: ‘Suppressieve antibiotische therapie’). Over de duur van suppressieve therapie bij FRI is geen literatuur beschikbaar. De werkgroep adviseert om tenminste 12 maanden te behandelen met suppressieve therapie. Daarna kan in MDO en in overleg met patiënt het vervolgbeleid besloten worden.
Aandachtspunten bij de antibiotische behandeling
• Empirische antibiotische therapie na debridement
De meeste infecties worden veroorzaakt worden door S. aureus (Trampuz, 2006), waarvoor intraveneus flucloxacilline geschikt is als therapie. Op grond van Pk/Pd overwegingen heeft het de voorkeur om flucloxacilline per continu infuus voor te schrijven alhowel hier geen evidence voor is in de literatuur. Coagulase-negatieve stafylokokken komen ook vaak voor bij FRI; in de empirische therapie hoeft hier bij schema 1,3 en 5 geen rekening mee gehouden te worden, aangezien de kans op systemische complicaties gering is en er geen kunstmateriaal meer in situ is. Een uitzondering betreft de schema’s 2 en 4 waarin het osteosynthesemateriaal mechanisch gereinigd is of waarin nieuwe implantaten geplaatst zijn. In deze gevallen is het essentieel om direct postoperatief met breedspectrum antibiotische therapie te starten om de resterende biofilm te behandelen en nieuwe biofilmvorming te voorkomen. Welke breedspectrum antibiotica precies gestart wordt hangt af van de lokale epidemiologie en resistentie cijfers; dit dient per ziekenhuis(regio) afgesproken te worden. Bij FRI van de enkel/voet heeft het de voorkeur empirisch een aminoglycoside aan de flucloxacilline toe te voegen vanwege het een recent gerapporteerd hoog percentage van Gram-negatieve verwekkers bij enkel- en voetinfecties (Backes, 2018). Ook bij zieke patiënten of bij andere patiënten bij wie op grond van de lokale epidemiologie een hoge kans bestaat op Gram-negatieve verwekkers, is het advies om een aminoglycoside toe te voegen aan de empirische therapie. De aminoglycosiden kunnen binnen 48 uur gestaakt worden als de kweken negatief blijven voor Gram-negatieve micro-organismen. De empirische therapie dient bij bekend worden van de gevoeligheid zo snel mogelijk gewisseld te worden naar gerichte antibiotische therapie.
• Intraveneuze versus orale antibiotica
De IDSA-guideline prothese infecties adviseert bij acute infecties om 2 tot 6 weken intraveneus te behandelen, gevolgd door effectieve orale therapie met goede biologische beschikbaarheid (Osmon, 2013). Bij chronische infecties met verwijdering van de prothese is het advies om minimaal 4 tot 6 weken te behandelen met intraveneuze antibiotica of met orale antibiotica met zeer goede biologische beschikbaarheid. In de RCT van Zimmerli (1998) werden patiënten met een FRI of prothese infectie twee weken intraveneus behandeld, waarna geswitcht werd naar orale therapie (Zimmerli, 1998). Het internationale consensus document over behandeling van prothese infecties (Parvizi, 2013) adviseert om met intraveneuze therapie te starten maar geeft niet aan wanneer geswitcht moet worden naar orale therapie (Parvizi, 2013). In een cohortstudie waarin patiënten met een geïnfecteerde gewrichtsprothese een 1- of 2-stage vervanging kregen en bij wie na 10 tot 14 dagen geswitcht werd naar orale therapie op geleide van kliniek en CRP was het curatiepercentage 100% (Darley, 2011). In een andere serie waarin bij 61 patiënten met een osteomyelitis na 2 weken geswitcht werd naar orale antibiotica was de cure rate 97% (Babouee Flury, 2014).
In 2017 zijn de data van de OVIVA-trial gepresenteerd (Scarborough,2017), waarin 1054 patiënten met osteomyelitis (inclusief geïnfecteerde gewrichtsprotheses en FRI) tijdens de eerste 7 dagen intraveneuze antibiotica gerandomiseerd werden tussen 6 weken orale vervolgtherapie of 6 weken intraveneuze vervolgtherapie (Li, 2015). Het was aan het oordeel van de dokter of er daarna nog langer doorbehandeld diende te worden (bij 74% van de patiënten werd er langer doorbehandeld). Behandelfalen (therapiefalen binnen 1 jaar na randomisatie) in de oralegroep was 13%, in de IV-groep 14%. Resultaten bleven hetzelfde in de modified intention-to-treat analyse en de per protocol analyse.
Bij het schrijven van dit protocol is de POvIV studie gaande, waarbij in een prospectieve, multicenter, gerandomiseerde studie in de VS-patiënten met postoperatieve wondinfecties na fracturen waarvoor interne fixatie of artrodese is verricht, gerandomiseerd worden tussen orale en intraveneuze antibiotica. Dit wordt de eerste studie waarin de veiligheid en effectiviteit van orale antibiotica bij FRI’s wordt onderzocht. De eerste resultaten worden nog verwacht (Obremskey, 2017).
Op basis van de nog niet gepubliceerde resultaten van de OVIVA-studie lijkt het mogelijk om eerder dan de nu gebruikelijke 2 weken te switchen naar orale therapie. In afwachting van de officiële publicaties van de genoemde studies is het raadzaam om dergelijke beslissingen altijd in MDO te nemen.
• De rol van rifampicine
In de meeste cohortstudies over prothese infecties waarbij het doel is de prothese te behouden, wordt bij S. aureus of coagulase-negatieve stafylokokken (CNS) gekozen voor rifampicine in combinatie met een fluorochinolon. Dit beleid is gebaseerd op de reeds genoemde RCT van Zimmerli (1998) waarin de patiëntenpopulatie uit zowel geïnfecteerde gewrichtsprotheses als FRI’s bestond (Zimmerli, 1998). De toegevoegde waarde van rifampicine bij stafylokokken prothese infecties is na deze trial beschreven in meerdere retrospectieve cohortstudies. De achterliggende gedachte van het gebruik van rifampicine is dat na debridement en mechanische reiniging van de prothese voorkomen moet worden dat er een nieuwe biofilm groeit op de prothese door de nog aanwezige bacteriën zo snel mogelijk te eradiceren. Rifampicine penetreert goed in een biofilm en is effectief tegen stafylokokken. Vanwege snelle resistentie-ontwikkeling bij monotherapie (<72uur) (Kadurugamuwa, 2004) dient rifampicine altijd gecombineerd te worden met een tweede antibioticum, meestal een fluorochinolon. De meeste klinische gegevens zijn bekend over de combinatie rifampicine/ciprofloxacine en rifampicine/levofloxacine bij prothese infecties. Bij moxifloxacine en ook cotrimoxazol zijn significante interacties beschreven wat deze combinaties mogelijk minder geschikt maakt of een verhoging van de fluorochinolon noodzakelijk maakt (Nijland CID 2007, Weiner AAC 2007; Ribera, 2001). Van de fluoroquinolonen lijkt levofloxacine op grond van Pk/Pd overwegingen het meest geschikt omdat deze niet via cytochroom P450 gemetaboliseerd wordt en dus geen interactie met rifampicine heeft. De combinatie rifampicine en clindamycine leidt via CYP3A4 interactie tot verlaagde spiegels van clindamycine; dit heeft in klinische studies overigens niet geleid tot slechtere uitkomsten (Perlroth, 2008; Bernard, 2015; Leijtens, 2017).
De waarde van rifampicine bij FRI is nog onvoldoende onderzocht. Anders dan bij een gewrichtsprothese kan geen goed debridement worden uitgevoerd van osteosynthesemateriaal (schroeven, platen, intramedullaire pennen kunnen niet gedebrideerd worden). Het advies van de werkgroep is dan ook om de indicatie van rifampicine te beperken tot schema 2 en alleen als aan de volgende criteria voldaan wordt: (a) de stafylokok is rifampicine-gevoelig en (b) de verwachting is dat het OSM langdurig (>3 maanden) in situ zal blijven. Er is dus geen indicatie voor rifampicine in schema 1 en 3 (waar het kunstmateriaal verwijderd wordt) en schema 5 (niet meer streven naar curatie maar naar onderdrukking van de infectie of tot aan verwijdering osteosynthese). Bij schema 4 adviseert de werkgroep om het al dan niet gebruik van rifampicine altijd in MDO te bespreken en/of in overleg met een regionaal expertisecentrum, zie ook de uitleg bij schema 4 hiervoor. De rifampicine dient zo snel mogelijk postoperatief gestart te worden met als doel het voorkomen van nieuwe biofilmvorming door achtergebleven bacteriën na het chirurgisch debridement. Wel dient de wond dicht en de gevoeligheid van de stafylokok bekendte zijn.
• Antibiotische behandeling van FRI veroorzaakt door gramnegatieven
Bij Gram-negatieve FRI is de keus afhankelijk van de specifieke verwekker en het antibiogram. Over het algemeen zal bij betalactam-gevoelige gramnegatieven gestart worden met intraveneus betalactam, waarbij na bekend worden van de gevoeligheid geswitcht kan worden naar een oraal alternatief. Hierbij hebben ciprofloxacine en cotrimoxazol de voorkeur, omdat deze het bot goed penetreren. Bij schema 2 en 4 hebben fluorochinolonen (indien gevoelig) de voorkeur boven cotrimoxazol.
• De duur van antibiotische therapie
Er zijn geen artikelen gevonden waarin de duur van antibiotica vergeleken wordt bij patiënten met een FRI. De adviezen zijn daarom expert-based en deels afgeleid van de evidence die bestaat voor geïnfecteerde gewrichtsprotheses. De IDSA-guideline (CID 2013) adviseert om bij acute stafylokokken protheseinfectie 2 tot 6 weken intraveneus te behandelen, waarna therapie oraal gecontinueerd wordt, vaak gedurende 3 tot 6 maanden (bij geïnfecteerde heupprotheses) of 6 maanden (bij geïnfecteerde knieprotheses). De duur van behandeling is gebaseerd op de reeds besproken trial van Zimmerli (1998). Cohortstudies na die tijd laten een curatiepercentage zien van 60 tot 90% met dit beleid bij acute prothese infecties (Berdal, 2005; Barberan, 2006; Soriano, 2006; Aboltins, 2007, Byren, 2009; Cobo, 2011; Vilchez, 2011; Lora-Tamayo, 2013; Peel, 2013; Ascione, 2015, Holmberg, 2015). Deze behandelduur was tot voor kort echter nooit vergeleken met een kortere behandelduur. Er zijn één RCT en vier observationele studies gepubliceerd waarin met een kortere behandelduur even goede cure rates werden gehaald als bij langere behandelduur:
- In een cohortstudie werden 132 patiënten 12 weken (bij geïnfecteerde knieprothese) of 8 weken (voor geïnfecteerde heupprotheses) behandeld, waarbij de kans op curatie gelijk was aan een historische controlegroep (Puhto, 2011).
- In een andere grote multicenter Studie over MSSA en MRSA-prothese infecties die behandeld werden met DAIR bleek de kans op falen even groot in de groep die minder dan 8 weken behandeld waren vergeleken met de groep die 8 tot 12 weken of >12 weken behandeld waren met antibiotica (Lora-Tamayo, 2013).
- In een andere cohortstudie was er geen verschil in curatie tussen patiënten met een geïnfecteerde prothese die 6 weken versus 12 weken met antibiotica werden behandeld na DAIR of 2-stage exchange (Bernard, 2010).
- In een retrospectief cohortonderzoek uit Parijs werden 50 patiënten met een (meestal chronische) PJI behandeld met een one-stage procedure gevolgd door 6 weken antibiotica en een follow-up van tenminste 1 jaar. Het behandelsucces was 90% (Chieffo, 2017).
- Recent is een RCT verschenen (Lora-Tamayo, 2016) waarin patiënten met een acute hematogene of postoperatieve rothese infectie gerandomiseerd werd tussen 8 weken rifampicine + fluorochinolon of 12 (heup) tot 24 (knie) weken rifampicine + fluorochinolon. In de per protocolanalyse bleek de korte behandelduur niet inferieur aan de lange behandelduur (Lora-Tamayo, 2016).
Het betreft hier wel (op de RCT na) cohortstudies met hun beperkingen waarbij de groepen door selectiebias niet goed te vergelijken zijn.
Overwegende dat dezelfde chirurgische principes gebruikt worden bij debridement van een FRI valt op grond van bovenstaande literatuur een kortere behandelduur dan de nu vaak geadviseerde behandelduur van 12 weken te overwegen. De werkgroep is echter van mening dat de bewijskracht van de literatuur nog beperkt is en adviseert – in afwachting van betere studies - derhalve om in principe 12 weken met antibiotica te behandelen. Langer dan 12 weken antibiotica is echter niet zinvol (behalve bij schema 5, waarbij geen curatie wordt nagestreefd en vervolgd wordt met chronisch suppressieve therapie). Na 12 weken behandeling zijn er de volgende uitkomsten: (a) de osteomyelitis is gecureerd en antibiotica kan gestopt worden of (b) de fracture related infection persisteert en chirurgische revisie is noodzakelijk.
• Suppressieve antibiotische therapie
Er zijn geen cohorten of vergelijkende studies waarin het effect van chronische suppressieve therapie beschreven wordt bij patiënten met een FRI. Er is wel literatuur over chronisch suppressieve therapie bij geïnfecteerde gewrichtsprotheses (Segreti, 1998; Keller, 2016; Pradier, 2017; Prendki, 2017; Wouthuyzen-Bakker, 2017). De literatuur hiervan wordt in deze richtlijn niet gereviewd. De hieronder gegeven adviezen zijn vooral expert-based.
Er worden voor ‘suppressieve therapie’ verschillende definities in de literatuur gebruikt. In deze richtlijn definiëren wij suppressieve therapie als het chronisch gebruik van laag gedoseerde antibiotica bij een persisterende FRI, waarbij het doel niet meer is om te genezen maar om opvlamming van de infectie vanuit de biofilm op het osteosynthese materiaal te voorkomen. Dit kan daarom met lagere antibiotische doseringen dan de normale doseringen die gelden voor osteomyelitis behandeling. Van belang is te beseffen dat er met suppressieve therapie dus geen weefselinfectie of osteomyelitis meer wordt behandeld. Er wordt daarom pas gestart met (lager gedoseerde) suppressieve therapie nadat eerst de FRI gedurende 6 weken behandeld is met therapeutische doseringen antibiotica. Meerdere antibiotica kunnen gegeven worden als suppressieve therapie, overleg hierbij altijd met uw internist-infectioloog/arts-microbioloog). De suppressieve therapie kan gestaakt worden indien het osteosynthesemateriaal alsnog verwijderd wordt. Het is niet bekend of bij een chronische FRI zonder verwijdering van het OSM na lange tijd kan worden gestopt met chronisch suppressieve therapie. Dit dient in MDO besloten te worden.
• Antibiotica bij open wonden na debridement
Het gebruik van antibiotica bij patiënten met een FRI bij wie wondsluiting na het debridement niet mogelijk is, is erg riskant. Door selectiedruk is de kans op kolonisatie van de wond met resistente micro-organismen groot alsmede het ontstaan van secundaire infecties met andere verwekkers. Er dient daarom te allen tijde gezorgd worden voor adequate weke delenbedekking en sluiten van de wond.
Onderbouwing
Achtergrond
Momenteel zijn er geen evidencebased richtlijnen waarin beschreven wordt wat de beste empirische en gerichte antimicrobiële therapie is voor FRI, wanneer er geswitcht kan worden van intraveneuze naar orale therapie, of wat de optimale duur van antibiotische therapie is. Het gebrek aan richtlijnen leidt tot onduidelijkheid, overmatig antibioticagebruik (door onzekerheid over de optimale behandelduur) en wellicht ook tot langere intraveneuze behandeling dan strikt noodzakelijk. Dit alles leidt tot meer antibioticagebruik, langere opnameduur, toename kosten in de gezondheidszorg en ontwikkeling van antimicrobiële resistentie.
Het doel is om op basis van beschikbare literatuur een behandeladvies te geven waarin de keus van antibiotica, duur van antibiotische therapie en manier van toediening (oraal of intraveneus) wordt vastgesteld, wat moet leiden tot meer uniformiteit van werken, een betere evaluatie van de behandeling, minder voorschrijven van (onnodige) antibiotica, hogere genezingspercentages en een verbeterde kwaliteit van leven voor patiënten met geïnfecteerd osteosynthesemateriaal.
Conclusies / Summary of Findings
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in curatie van infectie na behandeling met betalactam antibiotica gevolgd door ciprofloxacinee monotherapie in vergelijking met gecombineerde therapie (betalactam antibiotica + rifampicine gevolgd door ciprofloxacinee + rifampicine) bij patiënten met FRI’s.
Bronnen (Zimmerli, 1998 (1)) |
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in curatie van infectie na orale behandeling met rifampincine + fusidinezuur in vergelijking tot orale behandeling met rifampicine + ofloxacine bij patiënten met FRI’s.
Bronnen (Drancourt, 1997 (2)) |
Samenvatting literatuur
1. Vergelijkingen tussen behandeling met verschillende soorten intraveneuze antibiotica
Beschrijving studies
Uit de literatuuranalyse kwamen geen studies naar voren die deze vergelijking beschreven.
2. Vergelijkingen tussen behandeling met verschillende soorten orale antibiotica
Beschrijving studies
Twee studies werden geïncludeerd (1, 2). De studie van Zimmerli (1998) onderzocht het effect van behandeling met ciprofloxacinee + rifampicine in vergelijking tot ciprofloxacinee + placebo op curatie van infectie bij patiënten met een prothese of FRI’s (1). De patiënten werden gerandomiseerd tussen enerzijds 2 weken betalactamantibiotica + rifampicine (2dd450mg) gevolgd door ciprofloxacinee + rifampicine (interventiegroep) en anderzijds 2 weken betalactamantibiotica, gevolgd door ciprofloxacinee + placebo (controlegroep). De totale behandelduur bedroeg 12 weken (heup infecties en FRI) of 6 maanden (knie infecties). In deze RCT zijn in totaal 33 patiënten geïncludeerd, waarvan 15 patiënten met knie- of heupprothese en 18 patiënten met FRI’s. Resultaten werden niet apart beschreven voor deze patiëntengroepen. Randomisatie werd vroegtijdig beëindigd door een externe studie-monitor vanwege het falen van behandeling bij patiënten in de placebogroep. Er werd een drop-out van 33% in de rifampicinegroep en 20% in de placebogroep gerapporteerd. In de intention-to-treat analyse werden geen significante verschillen gerapporteerd met een curatie van infectie in 89% van de patiënten in de rifampicine groep en 60% van de patiënten in de placebogroep (logrank-toets P=0.10). Volgens de per-protocol analyse werd curatie van infectie bij 100% van de patiënten in de rifampicinegroep (n=12) en 58% van de patiënten in de placebogroep (n=12) waargenomen (logrank-toets p<0,02). De therapie in de controle arm met ciprofloxacinee monotherapie was niet optimaal, omdat ciprofloxacinee niet als optimale behandeling voor stafylokokken-infecties beschouwd wordt. Tenslotte werden de resultaten niet apart geanalyseerd voor prothese infecties en FRI.
In de niet gerandomiseerde studie van Drancourt (1997) werd het effect van twee combinaties orale antimicrobiële therapie onderzocht, namelijk behandeling met rifampicine + fusidinezuur versus behandeling met rifampicine + ofloxacine bij patiënten met zowel FRI als prothese geassocieerde infectie (2). In deze quasi-RCT werden in totaal 52 patiënten geïncludeerd. Van de 46 patiënten beschikbaar voor analyse, hadden 19 patiënten een prothese infectie en 17 patiënten een FRI. Patiënten werden 12 weken (heup) of 6 maanden (knie) behandeld met verwijdering van kunstmateriaal rond het einde van de behandeling. Resultaten werden niet apart beschreven voor deze patiëntengroepen. Beloop van infectie werd beschreven in 42 patiënten, waarvan curatie van infectie bij 55% van de patiënten in de rifampicine + fusidinezuur groep en bij 50% van de patiënten werd waargenomen. Dit verschil was niet significant. Verklaringen voor de hoge kans op falen waren de late timing van debridement bij los kunstmateriaal en de enkel orale antibiotische therapie. Daarnaast kent de studie forse methodologische beperkingen (underpowered, geen concealment of allocation, geen goede randomisatie, niet geblindeerd).
De overige uitkomstmaten werden niet in de literatuur gerapporteerd.
Bewijskracht van de literatuur
De bewijskracht voor curatie is met drie niveaus verlaagd gezien de beperkingen in de studieopzet (risk of bias; twee niveaus) en het geringe aantal patiënten (imprecisie; één niveau). Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
3. Lokale toepassing van antibiotica
Beschrijving studies
Uit de literatuuranalyse kwamen geen studies naar voren die deze vergelijking beschreven.
4. Vergelijkende studies naar effect van chronische, suppressieve antibiotische therapie
Beschrijving studies
Uit de literatuuranalyse kwamen geen studies naar voren die deze vergelijking beschreven.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
Wat zijn de (on)gunstige effecten van intraveneuze antibiotica ten opzichte van andere antimicrobiële therapieën of geen antibiotica bij patiënten met FRI’s?
P: patiënten met FRI’s;
I: IV-antibioticatherapie;
C: andersoortige antimicrobiële therapie, geen antibiotica (afwachtend beleid);
O: curatie infectie, genezing, tijd tot falen behandeling, kwaliteit van leven, mortaliteit, botconsolidatie, functionele uitkomsten, recidief infectie
Wat zijn de (on)gunstige effecten van orale antibiotica ten opzichte van andere antimicrobiële therapieën of geen antibiotica bij patiënten met fractuurgeralateerde infecties?
P: patiënten met FRI’s;
I: orale therapie;
C: andersoortige antimicrobiële therapie, geen antibiotica (afwachtend beleid);
O: curatie infectie, genezing, tijd tot falen behandeling, kwaliteit van leven, mortaliteit, botconsolidatie, functionele uitkomsten, recidief infectie.
Wat zijn de (on)gunstige effecten van lokale antibiotica ten opzichte van andere antimicrobiële therapieën of geen antibiotica bij patiënten met FRI’s?
P: patiënten met FRI’s;
I: lokale therapie;
C: andersoortige antimicrobiële therapie, geen antibiotica (afwachtend beleid);
O: curatie infectie, genezing, tijd tot falen behandeling, kwaliteit van leven, mortaliteit, botconsolidatie, functionele uitkomsten, recidief infectie
Wat zijn de (on)gunstige effecten van chronische suppressieve therapie ten opzichte van andere antimicrobiële therapieën of geen antibiotica bij patiënten met FRI’s?
P: patiënten met FRI’s;
I: chronische suppressieve therapie;
C: andersoortige antimicrobiële therapie, geen antibiotica (afwachtend beleid)
O: curatie infectie, genezing, tijd tot falen behandeling, kwaliteit van leven, mortaliteit, botconsolidatie, functionele uitkomsten, recidief infectie
Relevante uitkomstmaten
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de database Medline (via OVID) is met relevante zoektermen gezocht naar systematische reviews, RCT’s en vergelijkend observationeel onderzoek gezocht naar FRI’s en de behandeling met antimicrobiële therapie. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 1404 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: full-tekst artikelen beschikbaar in het Nederlands of Engels, primair (origineel) vergelijkend onderzoek, systematische reviews, beschrijving van antimicrobiële therapie overeenkomstig minimaal één van de bovengenoemde uitkomstmaten.
Op basis van titel en abstract werden in eerste instantie 7 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 5 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 2 studies definitief geselecteerd.
Er zijn twee (quasi) randomized controlled trials (RCT’s) opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias-tabellen.
Referenties
- Aboltins CA, et al. Treatment of staphylococcal prosthetic joint infections with debridement, prosthesis retention and oral rifampicin and fusidic acid. Clin. Microbiol. Infect. 2007;13(6):586-591.
- Ascione T, et al. Factors related to outcome of early and delayed prosthetic joint infections. J. Infect. 2015;70(1):30-36.
- Babouee Flury B, et al. Is switching to an oral antibiotic regimen safe after 2 weeks of intravenous treatment for primary bacterial vertebral osteomyelitis? BMC Infect Dis. 2014;14:p. 226.
- Backes M, et al. Determination of Pathogens in Postoperative Wound Infection After Surgically Reduced Calcaneal Fractures and Implications for Prophylaxis and Treatment. The Journal of Foot and Ankle Surgery. 2018;57(1):100-103.
- Barberan J, et al. Conservative treatment of staphylococcal prosthetic joint infections in elderly patients. Am. J. Med. 2006;119(11): 993-10.
- Berdal JE, et al. Use of rifampicin and ciprofloxacin combination therapy after surgical debridement in the treatment of early manifestation prosthetic joint infections. Clin. Microbiol. Infect. 2005;11(10):843-845.
- Bernard L, et al. Six weeks of antibiotic treatment is sufficient following surgery for septic arthroplasty. J Infect. 2010;61(2):125-32.
- Byren I, et al. One hundred and twelve infected arthroplasties treated with 'DAIR' (debridement, antibiotics and implant retention): antibiotic duration and outcome. J. Antimicrob. Chemother. 2009;63(6):1264-1271.
- Chieffo G, et al. Successful treatment of six weeks of antibiotics in hip and knee periprosthetic joint infection after one-stage replacement arthroplasty: a French cohort study. Bone & Joint Journal Orthopaedic Proceedings Supplement. 2017;99-B(SUPP 22):88-88.
- Cobo J, et al. Early prosthetic joint infection: outcomes with debridement and implant retention followed by antibiotic therapy. Clin. Microbiol. Infect. 2011;17(11):1632-1637.
- Darley ES, et al. Role of early intravenous to oral antibiotic switch therapy in the management of prosthetic hip infection treated with one- or two-stage replacement. J Antimicrob Chemother. 2011;66(10):2405-8.
- Dijkmans AC, et al. A simplified oral flucloxacillin absorption test for patients requiring long-term treatment. Ther Drug Monit. 2012;34(3):356-8.
- Drancourt M, et al. Oral treatment of Staphylococcus spp. infected orthopaedic implants with fusidic acid or ofloxacin in combination with rifampicin. J Antimicrob Chemother. 1997;39(2):235-40.
- Holmberg A, et al. 75% success rate after open debridement, exchange of tibial insert, and antibiotics in knee prosthetic joint infections. Acta Orthop. 2015:1-6.
- Kadurugamuwa JL, et al. Noninvasive optical imaging method to evaluate postantibiotic effects on biofilm infection in vivo. Antimicrob. Agents Chemother. 2004;48(6):2283-2287.
- Keller SC, et al. Role of Suppressive Oral Antibiotics in Orthopedic Hardware Infections for Those Not Undergoing Two-Stage Replacement Surgery. Open Forum Infectious Diseases, 2016;3(4):ofw176-ofw176.
- Landersdorfer CB, et al. Penetration of Antibacterials into Bone. Clinical Pharmacokinetics. 2009;48(2):89-124.
- Li HK, et al. Oral versus intravenous antibiotic treatment for bone and joint infections (OVIVA): study protocol for a randomised controlled trial. Trials. 2015;16:p. 583.
- Lora-Tamayo J, et al. A large multicenter study of methicillin-susceptible and methicillin-resistant Staphylococcus aureus prosthetic joint infections managed with implant retention. Clin. Infect. Dis. 2013;56(2):182-194.
- Lora-Tamayo J, et al. Short- versus long-duration levofloxacin plus rifampicin for acute staphylococcal prosthetic joint infection managed with implant retention: a randomised clinical trial. Int J Antimicrob Agents. 2016;48(3):310-6.
- Navarro AS. Relevance of Antibacterial Distribution. Clinical Pharmacokinetics. 2009;48(2):129-130.
- Obremskey WT, et al. A Prospective Randomized Trial to Assess Oral Versus Intravenous Antibiotics for the Treatment of Postoperative Wound Infection After Extremity Fractures (POvIV Study). J Orthop Trauma. 2017;31 Suppl 1:S32-s38.
- Osmon DR, et al. Diagnosis and management of prosthetic joint infection: clinical practice guidelines by the Infectious Diseases Society of America. Clin. Infect. Dis. 2013;56(1):e1-e25.
- Parvizi J, Gehrke T, Chen AF. Proceedings of the International Consensus on Periprosthetic Joint Infection. Bone Joint J. 2013;95-B(11):1450-1452.
- Peel TN, et al. Outcome of debridement and retention in prosthetic joint infections by methicillin-resistant staphylococci, with special reference to rifampin and fusidic acid combination therapy. Antimicrob. Agents Chemother. 2013;57(1):350-355.
- Pradier M, et al. Suppressive antibiotic therapy with oral tetracyclines for prosthetic joint infections: a retrospective study of 78 patients. Infection. 2017.
- Prendki V, et al. Prolonged suppressive antibiotic therapy for prosthetic joint infection in the elderly: a national multicentre cohort study. Eur J Clin Microbiol Infect Dis. 2017;36(9):1577-1585.
- Puhto AP, Puhto T, Syrjala H. Short-course antibiotics for prosthetic joint infections treated with prosthesis retention. Clin Microbiol Infect. 2012;18(11):1143-8.
- Scarborough M, Li HK, Rombach I, et al. Oral versus intravenous antibiotics for the treatment of bone and joint infection (OVIVA): A multicentre randomised controlled trial Orthopaedic Proceedings. 2017;99-B:SUPP_22, 42-42.
- Segreti J, Nelson JA, Trenholme GM, Prolonged suppressive antibiotic therapy for infected orthopedic prostheses. Clin Infect Dis. 1998;27(4): 711-3.
- Soriano A, et al. Treatment of acute post-surgical infection of joint arthroplasty. Clin. Microbiol. Infect. 2006;12(9):930-933.
- Spellberg B, Lipsky BA. Systemic Antibiotic Therapy for Chronic Osteomyelitis in Adults. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 2012;54(3):393-407.
- Stichting Werkgroep AntibioticaBeleid Nederland (SWAB) Behandeladvies bij chronische osteomyelitis op basis van S aureus. https://swabid.nl/node/6571.
- Trampuz A, Zimmerli W. Diagnosis and treatment of infections associated with fracture-fixation devices. Injury. 2006;37.Suppl 2:S59-66.
- Vilchez F, et al. Outcome and predictors of treatment failure in early post-surgical prosthetic joint infections due to Staphylococcus aureus treated with debridement. Clin. Microbiol. Infect. 2011;17(3):439-444.
- Wouthuyzen-Bakker M, et al. Efficacy of Antibiotic Suppressive Therapy in Patients with a Prosthetic Joint Infection. J Bone Jt Infect. 2017;2(2):77-83.
- Zimmerli W, et al. Role of rifampin for treatment of orthopedic implant-related staphylococcal infections: a randomized controlled trial. Foreign-Body Infection (FBI) Study Group. JAMA. 1998;279(19):1537-1541.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Drancourt, 1997 |
Type of study: Quasi-RCT
Setting: Hospital
Country: France
Source of funding: not reported |
Inclusion criteria: Clinical and radiological evidence of an orthopaedic implant infection*
Exclusion criteria: no contraindication of the intervention or control treatment.
N total at baseline: Intervention: 28 Control: 24
Important prognostic factors2: For example age ± SD: I: 53.2 ± 9.5 C: 53.1 ± 20.3
Sex, M:F, N: I: 13:7 C: 17:5
Device, N: Prosthesis: I 16; C 13 Plate: I 5; C 6 Wire: I 2 ; C 1 Nail: I 0; C 2 Pins: I 0; C 1
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
Rifampicin + fusidic acid
|
Describe control (treatment/procedure/test):
Rifampicin + ofloxacin |
Length of follow-up: monthly follow-up of clinical progress, laboratory tests every 3 months. Median follow-up: Intervention: 23 months Control: 21.5 months
Loss-to-follow-up: Intervention: 5 (out of 28) (18%) Reasons: not reported
Control: 1 (out of 24) (4%) Reasons: not reported
Incomplete outcome data: Intervention: 3 (out of 23) (13%) Reasons: 1 died, 1 intolerance after 2 weeks treatment, 1 refused treatment after 2 months
Control: 1 (out of 23) (4%) Reasons: 1 refused treatment after 2 months
|
Outcome measures and effect size (include 95%CI and p-value if available): Fishers Exact test was used to assess group differences
Cure rate, N: I: 11 (out of 20) (55%) C: 11 (out of 22) (50%) NS (no p-value reported)
Failure rate, N: I: 8 (out of 20) (40%) C: 8 (out of 22) (36%) NS (no p-value reported)
Failure was defined as any clinical, radiological or microbiological evidence of infection.
Relapse, N: I: 1 (out of 20) (5%) C: 3 (out of 22) (14%) NS (no p-value reported)
Relapse was defined by the reappearance after eradication of an isolate Staphylococcus spp. which shared the same biotype and antibiogram as the original isolate. |
*pain around the joint, fistulas or loosening of the joint (identified radiographically) were considered evidence for infection.
|
|
Zimmerli, 1998 |
Type of study: RCT (double-blind)
Setting: tertiary care centers
Country: Switzerland
Source of funding: Bayer Ltd. |
Inclusion criteria: diagnosis of orthopaedic device related infection due to S aureus or coagulase-negative straphylococci. Cases with radiological and intraoperative evidence of stability of the implant or prothesis
Exclusion criteria: symptoms for >1 yr, age <16 yrs, expected survival <2 yrs, predictable inability to comply with treatment and follow-up visits, known or suspected allergy to quinolones and/or rifampin, mixed infection with other microorganisms, removal or loosening of implant, refusal to stop wearing soft contact-lenses, use hormonal contraceptives and antimicrobial treatment 2wks after diagnosis.
N total at baseline: Intervention: 18 Control: 15
Important prognostic factors2: For example age ± SD: I: 66 ± 15 C: 67 ± 15
Sex, M:F, N: I: 9:9 C: 5:10
Device, N: Hip prot: I 5 ; C 3 Knee prot: I 3 ; C 4 Osteosynthesis: I 10 ; C 8
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
2wk flucloxacillin or vancomycin (IV) + rifampin (1 tablet of 450mg every 12hrs). After 2wks flucloxacillin or vancomycin was replaced by ciprofloxacine.
|
Describe control (treatment/procedure/test):
2wk flucloxacillin or vancomycin (IV) + placebo (1 matched tablet every 12hrs). After 2wks flucloxacillin or vancomycin was replaced by ciprofloxacine.
|
Length of follow-up: clinical assessment week 1, and 3, then monthly till month 6, then at 9, 12 and 24 months.
Loss-to-follow-up (drop-out): Intervention: 6 (out of 18) (33%) Reasons: 3 nausea, 2 stopped treatment due to allergic exanthema, 1 protocol violation.
Control: 3 (out of 15) (20%) Reasons: 1 nausea, 1 non-compliance, 1 protocol violation.
* patients who took less than 85% of study medication were excluded posteriori and regarded as dropouts. |
Outcome measures and effect size (include 95%CI and p-value if available): Group differences assessed by log-rank test
Cure rate, per protocol N, %: I: 12 (out of 12), 100% C: 7 (out of 12), 58% P<0.02
Cure rate, Intention to Treat N, %: I: 16 (out of 18), 89% C: 9 (out of 15), 60% P=0.10
|
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohortstudies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of bias tabel
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Drancourt, 1997 |
Patients assigned according their year of birth (odd years versus years) |
Likely |
Likely |
Likely |
Unclear |
Unclear |
Likely |
Likely |
|
Zimmerli, 1998 |
Computer generated list |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Likely |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 19-12-2018
Beoordeeld op geldigheid : 14-12-2018
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2023 bepaalt het bestuur van de Nederlandse Vereniging voor Heelkunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Heelkunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Deze richtlijn beoogt een leidraad te geven voor de diagnostiek en behandeling van volwassen patiënten met een fractuur-gerelateerde infectie (FRI).
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met FRI’s.
De richtlijn geldt voor patiënten met een acute FRI of met de verdenking op een chronische FRI.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2016 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten een FRI te maken hebben.
Werkgroep
- Dr. M.F. Termaat, traumachirurg, werkzaam in het Leids Universitair Medisch Centrum te Leiden, NVvH, voorzitter
- Drs. V.M. de Jong, traumachirurg, werkzaam in het Amsterdam Universitair Medische Centra locatie AMC te Amsterdam, NVvH, vicevoorzitter
- Dr. J.A.P. Geurts, orthopedisch chirurg, werkzaam in het Maastricht Universitair Medisch Centrum te Maastricht, NOV
- Dr. A.W.J.M. Glaudemans, nucleair geneeskundige, werkzaam in het Universitair Medisch Centrum Groningen te Groningen, NVNG
- Drs. G.A.M. Govaert, traumachirurg, werkzaam in het Universitair Medisch Centrum te Utrecht, NVvH
- Dr. T. de Jong, plastisch chirurg in opleiding, werkzaam in het Erasmus Medisch Centrum te Rotterdam, NVvP
- Dr. P. Joosse, traumachirurg, werkzaam in het Noordwest ziekenhuisgroep te Alkmaar en Rode Kruis Ziekenhuis te Beverwijk, NVvH
- Drs. J. Overbosch, radioloog, werkzaam in het Universitair Medisch Centrum Groningen te Groningen, NVvR
- Drs. H. Scheper, internist-infectioloog, werkzaam in het Leids Universitair Medisch Centrum te Leiden, NIV
- Dr. I.J.B. Spijkerman, arts-microbioloog, werkzaam in het Amsterdam Universitair Medische Centra locatie AMC te Amsterdam, NVMM
Wij bedanken dr. A. Reuwer, arts-microbioloog in opleiding, werkzaam in het Amphia ziekenhuis te Breda en Elisabeth-TweeSteden Ziekenhuis te Tilburg en dr. P. Croughs, arts-microbioloog in het Erasmus MC te Rotterdam die onder leiding van dr. I.J.B. Spijkerman een belangrijke bijdrage hebben geleverd aan de modules Ontstekingsparameters, Microbiologisch/pathologisch onderzoek en Antimicrobiële therapie van deze richtlijn.
Met ondersteuning van:
- Dr. W.A. van Enst, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- H. Kooijmans MSc, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- D.P. Gutierrez, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Geurts |
Orthopedisch chirurg |
Geen |
Geen (relevante) gemengde belangen |
Geen |
|
Glaudemans |
Nucleair geneeskundige |
Voorzitter Infection and Inflammation Committee European Association of Nuclear Medicine sinds 2018 daarvoor member, onbetaald |
Geen (relevante) gemengde belangen |
Geen |
|
Govaert |
Traumachirurg |
Bestuurslid Nederlandse Vereniging voor Traumachirurgie (NVT), onbetaald |
Geen (relevante) gemengde belangen |
Geen |
|
Enst, van |
Senior-Adviseur |
Geen |
Geen (relevante) gemengde belangen |
Geen |
|
Jong, de V.M. |
Traumachirurg |
Geen |
Geen (relevante) gemengde belangen |
Geen |
|
Jong, de T. |
Plastisch chirurg I.O. |
Geen |
Geen (relevante) gemengde belangen |
Geen |
|
Joosse |
Traumachirurg |
Lid commissie Uitkomst van Zorg (Nederlandse Vereniging voor Traumachirurgie, NVT) onbetaald |
Geen (relevante) gemengde belangen |
Geen |
|
Kooijmans |
Adviseur |
Geen |
Geen (relevante) gemengde belangen |
Geen |
|
Overbosch |
Radioloog |
Geen |
Geen (relevante) gemengde belangen |
Geen |
|
Reuwer |
Arts-microbioloog I.O. |
Geen |
Geen (relevante) gemengde belangen |
Geen |
|
Scheper |
Internist-infectioloog |
Geen |
Geen (relevante) gemengde belangen |
Geen |
|
Spijkerman |
Arts-microbioloog |
Lid van de Regieraad van de Werkgroep Infectiepreventie (onbetaald) |
Geen (relevante) gemengde belangen |
Geen |
|
Termaat |
Traumachirurg |
Geen |
Geen (relevante) gemengde belangen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een focusgroep. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidencebased richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseurs de knelpunten. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Heelkunde, de Nederlandse Vereniging voor Plastische Chirurgie, Nederlandse Orthopaedische Vereniging, de Nederlandse Vereniging voor Medische Microbiologie, Kenniscentrum Wondzorg, Nefemed, de Nederlandse Vereniging voor Medische Microbiologie en Verpleegkundigen & Verzorgenden Nederland via een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen Nice en Sign richtlijnen, systematische reviews via Medline (OVID). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases.
De richtlijnen van Centers for Disease Control (CDC) en European Centre for Disease Prevention and Control (ECDC) hebben een definitie beschreven voor chirurgische wondinfecties (Berríos-Torres, 2017), echter deze is niet geschikt voor de patiënten met fracturen. Derhalve is recentelijk door middel van een internationale consensusmeeting een nieuwe definitie vastgesteld voor deze patiëntengroep; Fractuur-gerelateerde infectie (Fracture-Related Infection (FRI)) (Metsemakers, 2017). Deze definitie wordt gebruikt in de teksten van de richtlijn. Echter omdat deze definitie zeer recentelijk is geïntroduceerd was deze niet geschikt voor de literatuur zoekopdrachten. Hiervoor zijn beschrijvende MESH-termen gebruikt welke overeenkomen met de zoekresultaten voor FRI.
Naast het zoeken in elektronische databases werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Er werden geen interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn wordt aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren zal de conceptrichtlijn aangepast worden en definitief vastgesteld door de werkgroep. Daarna zal de autorisatiefase volgen.
Literatuur
Berríos-Torres SI, Umscheid CA, Bratzler DW, et al. Healthcare Infection Control Practices Advisory Committee. Centers for Disease Control and Prevention Guideline for the Prevention of Surgical Site Infection. JAMA Surg. 2017;152(8):784-791. PMID: 28467526.
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html. 2012.
Metsemakers WJ, Morgenstern M, McNally MA, et al. Fracture-related infection: A consensus on definition from an international expert group. Injury. 2017. PMID: 28867644.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline |
1 exp Fracture Fixation, Internal/ or Orthopedic Procedures/ae or exp "Fractures, Bone"/su or exp internal fixators/ (bone nails/ or bone plates/ or bone screws/ or bone wires/ or suture anchors/ vallen hieronder) (101661) 2 ((internal adj3 fixat*) or nails or plates or screws or wire or anchor* or pin or pins or (("Fracture Fixat*" adj2 Internal) or osteosynthesis) or (fracture* and (surg* or operati*))).ti,ab,kf. (257675) 3 1 or 2 (303477) 4 Surgical Wound Infection/ or "Cross Infection"/ or "Infection Control"/ (96874) 5 Osteomyelitis/ (19622) 6 (Osteomyelitis or infect* or (wound adj3 complication*)).ti,ab,kf. (1616802) 7 bacterial infections/ or exp gram-negative bacterial infections/ or exp gram-positive bacterial infections/ or Soft Tissue Infections/ (821526) 8 4 or 5 or 6 or 7 (2160054) 9 3 and 8 (30670) 10 exp Culture Techniques/ (195919) 11 exp Culture Media/ (154922) 12 9 and 11 (561) 13 exp Polymerase Chain Reaction/ (458919) 14 Sonication/ (4957) 15 9 and 14 (16) 16 (patholog* or histopatholo*).ti,ab. (841550) 17 (culture* or microbiolog* or sonication or polymerase chain reaction or PCR or punctate or enrichtment broth* or swab*).ti,ab. (1524156) 18 10 or 11 or 13 or 14 or 17 (1878500) 19 9 and 18 (4606) 20 exp "Sensitivity and Specificity"/ or (Sensitiv* or Specific*).ti,ab. or (predict* or ROC-curve or receiver-operator*).ti,ab. or (likelihood or LR*).ti,ab. or exp Diagnostic Errors/ or (inter-observer or intra-observer or interobserver or intraobserver or validity or kappa or reliability).ti,ab. or reproducibility.ti,ab. or (test adj2 (re-test or retest)).ti,ab. or "Reproducibility of Results"/ or accuracy.ti,ab. or Diagnosis, Differential/ or Validation Studies.pt. (5875103) 21 19 and 20 (1636) 22 limit 21 to english language (1537) 23 remove duplicates from 22 (1404) |
1404
sel.adv. >25 inclusie? |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Obremskey, 2017 |
Betreft aankondiging RCT, geen data analyse |
|
Tschudin-Sutter, 2016 |
Observationeel, geen vergelijking tussen antimicrobiële therapieën en andersoortige/ geen therapie |
|
Trampuz, 2006 |
Review, geen data analyse |
|
Widmer, 1992 |
n=4 cases OSM, geen vergelijking tussen antimicrobiële therapieën |
|
Makridis, 2013 |
Review van voornamelijk retrospectieve case-series. Geen directe vergelijkingen antimicrobiële therapieën versus andersoortige/ geen therapie |

