Genetisch onderzoek slechthorend kind
Uitgangsvraag
Welk moleculair genetisch onderzoek is binnen het etiologisch onderzoek bij een kind met slechthorendheid van belang?
Aanbeveling
Bij patiënten met autosomaal recessieve, niet syndromale congenitale/prelinguale slechthorendheid, of sporadische patiënten met niet syndromale congenitale/prelinguale slechthorendheid is voor het bepalen van het betrokken gen de eerst aangewezen test DNA analyse van het GJB2/GJB6 gen (DFNB1 locus). Daarnaast kan analyse SLC26A4 overwogen worden, zeker als er sprake is van EVA.
Hoewel Usher syndroom een zeldzame aandoening is, is het belangrijk deze diagnose te overwegen, en de bijbehorende genen te testen, omdat de bijkomende Retinitis Pigmentosa pas op latere leeftijd ontstaat. Het gaat hierbij met name om kinderen met een zeer ernstige vorm van gehoorverlies en vestibulaire afwijkingen.
Wanneer er aanwijzingen zijn voor een autosomaal dominante niet syndromale vorm van slechthorendheid dient op geleide van het familieverhaal, audiogram, leeftijd van diagnose besloten te worden welk gen getest moet worden.
De hoge carrier frequentie van GJB2/GJB6 kan aanleiding geven tot schijnbaar autosomale dominante slechthorendheid. Dit kan reden zijn om in dergelijke situaties GJB2/GJB6 analyse te verrichten.
Bij syndromale vormen van slechthorendheid wordt aanbevolen de meest waarschijnlijk betrokken genen te testen.
Op termijn is testen met (een vorm van) Next Generation Sequencing (bijvoorbeeld Exome Sequencing) een goede vervolgstap wanneer in eerste instantie geen betrokken gen is gevonden, en een genetische oorzaak vermoed wordt.
Overwegingen
De cijfers uit de literatuur zijn niet eenduidig. Pas wanneer bij in principe ieder kind met bij de neonatale gehoorscreening vastgestelde slechthorendheid etiologisch onderzoek wordt verricht, kan geschat worden bij welk percentage kinderen werkelijk sprake is van een genetische oorzaak.
Gezien de extreme heterogeniteit van alle genetische vormen van slechthorendheid, is het kostentechnisch waarschijnlijk een goed idee om met de in de nabije toekomst ter beschikking komende technieken (exome sequentie-analyse, eventueel op termijn genoomwijd), een groot aantal genen voor de verschillende vormen van (genetisch bepaalde) slechthorendheid tegelijkertijd te onderzoeken. Tot die tijd is (sequentieel) testen van genen op grond van hun waarschijnlijke betrokkenheid zoals boven beschreven een goede optie. Zie ook Huygen et al. (2003) en Pennings et al (2003) voor beschrijving van specifieke ARTA’s bij de verschillende vormen van autosomaal dominante doofheid.
Het is echter te verwachten dat de huidige aanbevelingen snel weer herzien zullen moeten worden omdat de technieken voor het diagnostisch testen van veel genen tegelijkertijd binnenkort binnen handbereik zijn (Mac Ardle et al. (2010)). Dit moleculaire onderzoek moet alleen in de context van een klinisch genetisch onderzoek gebeuren, vanwege de mogelijkheid dat de bevindingen allerminst eenduidig zijn, en specialistische kennis nodig is om de uitslagen te kunnen duiden in het kader van de vraag van de patiënt.
Op termijn is testen met (een vorm van) Next Generation Sequencing (bijvoorbeeld Exome Sequencing) een goede vervolgstap wanneer in eerste instantie geen betrokken gen is gevonden, en een genetische oorzaak vermoed wordt. Verwacht wordt dat dit diagnostisch beschikbaar komt eind 2012, begin 2013, op voorwaarde van financiering door de zorgverzekeraars.
Bij unilateraal gehoorverlies wordt geadviseerd om niet routinematig DFNB1 DNA onderzoek te verrichten. Unilaterale slechthorendheid kan voorkomen bij een aantal syndromen, zoals bijvoorbeeld Waardenburg Syndroom, Pendred of BOR. Bij aanwijzingen voor een specifieke syndroomdiagnose kunnen de betrokken genen onderzocht worden.
Onderbouwing
Achtergrond
Volgens recente inzichten bestaan er meer dan 400 verschillende soorten genetische doofheid. Tot op heden zijn er tientallen genen voor syndromaal en non-syndromaal gehoorverlies ontdekt (Kochhar et al.(2007), http://hereditaryhearingloss.org). In de literatuur bestaat een grote mate van diversiteit in samenstelling van otogenetische onderzoeksgroepen, in onderzoeken en onderzoeksprotocollen. Daardoor verschillen de getallen die gevonden worden voor de verdeling tussen erfelijk en niet-erfelijk aanzienlijk. Ook voortschrijdend inzicht door nieuwe onderzoekstechnieken en verandering in zorg in de tijd zullen hierin waarschijnlijk een rol spelen.
In het algemeen wordt aangenomen dat 50-55% van de oorzaken van slechthorendheid/ doofheid op kinderleeftijd erfelijk bepaald is en 45-50% niet erfelijk (Kochar et al.(2007), MacArdle et al (2010), Morton et al (2006)). Binnen de erfelijke groep is ongeveer 75-85% autosomaal recessief, 15-25% autosomaal dominant, 1-4% X-linked en 1-2% mitochondrieel bepaald. Van de erfelijk gehoorverliezen zijn ongeveer 30% syndromaal en 70% non-syndromaal.
Deze getallen weergegeven in figuur 1 zijn gebaseerd op aannames.
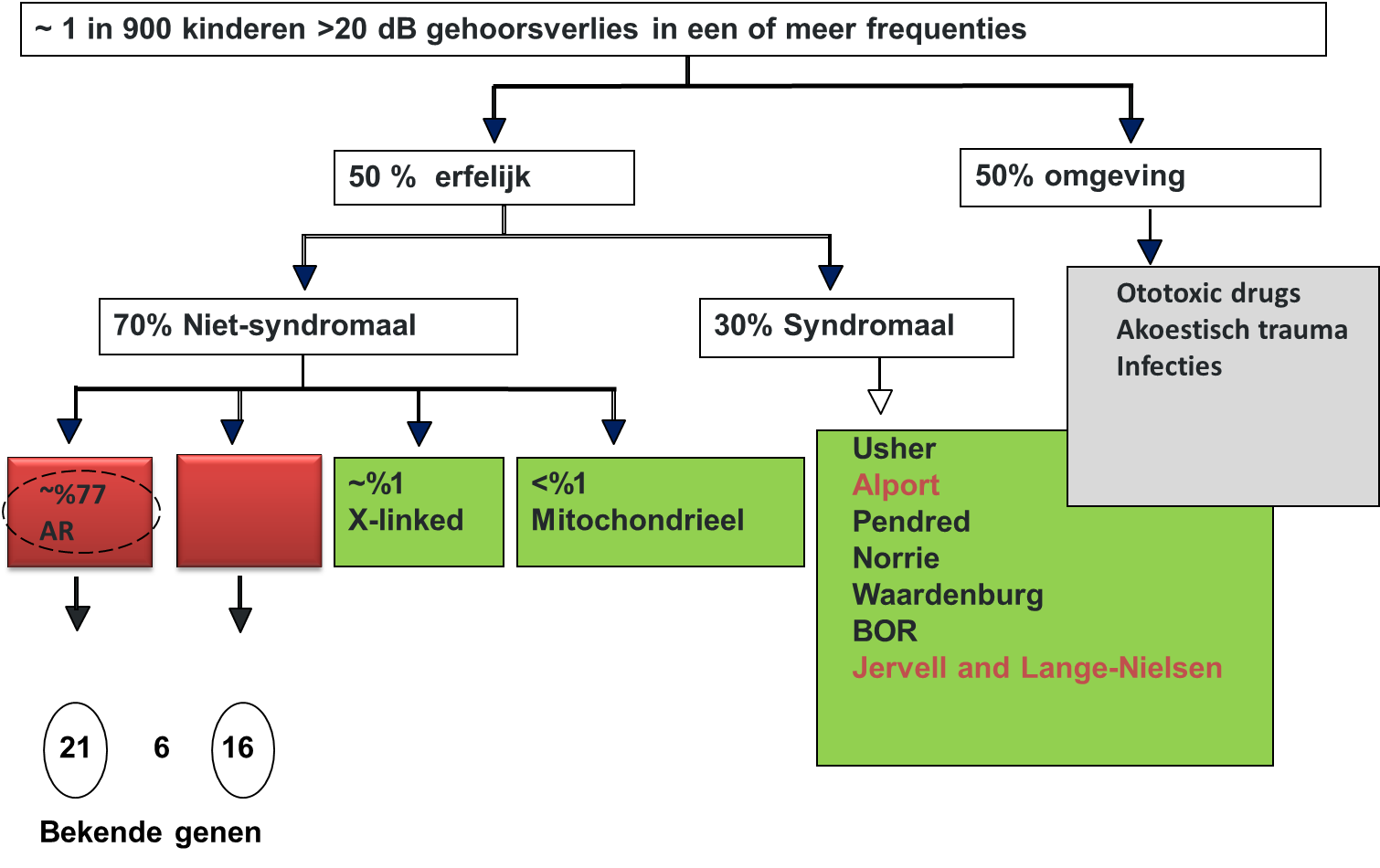
Een systematic review van Morzaria et al. (2004) vermeldt de volgende getallen: onbekend 37,7%, genetisch nonsyndromaal 29,2%, prenataal 12%, perinataal 9,6%, postnataal 8,2%, genetisch syndromaal 3,2%. Korver et al. (2011) vinden een erfelijke oorzaak in 30%, een verworven oorzaak in 30%, en onbekend in 24%. Zij hadden een restgroep van 7%, waarbij de diagnose niet goed te classificeren was. Vermeldenswaard is dat in deze studie systematisch onderzoek gedaan is naar CMV en DNA-afwijkingen. Admiraal (2011) komt tot non-syndromaal autosomaal recessief gehoorverlies in 22%, nonsyndromaal autosomaal dominant in 18%, 27% syndromaal, 7% niet te classificeren oorzaak van gehoorverlies en 26% onbekend in 489 patiënten in een otogenetisch spreekuur.
Het lijkt waarschijnlijk dat de groep van kinderen waarbij de oorzaak als “onbekend” geclassificeerd wordt er mogelijk toch een genetische oorzaak zal zijn.
Wanneer omgevingsfactoren zoals CMV of teratotoxiciteit zijn uitgesloten, is het stellen van de juiste erfelijke diagnose van belang voor de patiënt, de ouders en eventueel verdere familie. Stellen van deze genetische diagnose is echter niet altijd eenvoudig, omdat (niet syndromale) slechthorendheid genetisch zeer heterogeen is. Hierbij kan mogelijk het specifieke fenotype behulpzaam zijn, zoals onder andere de vorm van het audiogram, de leeftijd van onset, en de ernst van het gehoorverlies.
Hiervoor kan gebruik gemaakt worden van onderzoek naar de genotype-fenotype relaties, waarbij de ARTA (Age Related Typical Audiogram) een belangrijke rol speelt. Op basis van de vorm van het audiogram, (bijvoorbeeld hoge tonenverlies, komvormig verlies of juist lage tonenverlies), en door onderscheid te maken tussen progressief of stationair gehoorverlies, en door andere kenmerken zoals de leeftijd van aanvang en de ernst van het gehoorverlies kan een eerste keuze gemaakt worden voor het testen van specifieke genen (Admiraal et al. (2008). Preciado et al. (2004, 2005) geven aan dat GJB2 screening meer oplevert bij ernstiger gehoorverliezen dan milde slechthorendheid. In een recente publicatie van Lin et al. (2011) blijkt de opbrengst van GJB2/6 analyse significant hoger in niet-syndromale slechthorendheid (22%) ten opzichte van sydromale slechthorendheid (0%). Slechts bij 1 patiënt van de 33 patiënten met een GJB2 mutatie had afwijkingen van het binnenoor.
Wanneer sprake is van syndromale doofheid, is het meestal eenvoudiger te bepalen welk moleculair genetisch onderzoek moet plaatsvinden.
Voor deze uitgangsvraag is een literatuur search verricht. Selectie van literatuur is verricht door middel van een Medline search volgens een vooraf opgestelde zoekstrategie (zie zoekverantwoording). Het ruwe aantal van 258 referenties is beperkt met floating subheadings etiologie en diagnostiek (sensitief). Het totaal aantal referenties was 114. Er is behalve op Pendred niet op specifieke aandoeningen/syndromen gezocht, omdat Pendred na DFNB1 de meest voorkomende oorzaak van vroegkinderlijke slechthorendheid is. Deze 114 referenties zijn op titel en abstract bekeken, hiervan bleken vier artikelen bruikbaar. Deze zijn opgenomen in de evidence tabel. Op grond van eigen kennis en referenties is nog een internetbron toegevoegd.
Criteria bij de selectie van de literatuur zijn geweest: grootte van de studiepopulatie, mate van bewijs (inclusie van reviews en richtlijnen), onderwerp (genetische achtergrond van slechthorendheid), artikel niet ouder dan 10 jaar en het artikel geeft mogelijk antwoord op de uitgangsvraag. Verder moest het mogelijk zijn de volledige tekst van het artikel in te zien.
Conclusies / Summary of Findings
|
Niveau 3 |
Het is aangetoond dat mutaties in het GJB2/GJB6 gen (DFNB1 locus) de meest voorkomende vorm van niet-syndromale doofheid veroorzaken.
C Pandya et al. (2003) |
|
Niveau 3 |
In de literatuur zijn aanwijzingen dat het tweede meest voorkomende gen bij deze groep het Pendred-gen (SLC26A4) is.
C Hilgert et al (2009) |
|
Niveau 4 |
Hoewel Usher syndroom een zeldzame aandoening is, is het belangrijk deze diagnose te overwegen omdat de bijkomende Retinitis Pigmentosa pas op latere leeftijd ontstaat.
D McArdle et al. (2010) |
|
Niveau 4 |
Patiënten met een niet-syndromale, autosomaal dominante vorm van slechthorendheid: hierbij kan op geleide van audiogram en andere bijkomende kenmerken een keuze gemaakt worden voor het eerst te testen gen.
D Huygen et al. (2003) |
|
Niveau 4 |
Mitochondriële overerving kan getest worden wanneer aan bepaalde voorwaarden voldaan is (zie boven).
D McArdle et al. (2010) |
|
Niveau 4 |
Voor patiënten met syndromale slechthorendheid wordt op geleide van de bijbehorende klinische kenmerken de test van het betrokken gen aangevraagd.
D McArdle et al. (2010) |
Samenvatting literatuur
In de literatuur die hier besproken wordt, wordt uitgegaan van bilateraal gehoorverlies. Unilateraal gehoorverlies gaat vaak samen met een structurele afwijking, of is geassocieerd met een specifiek syndroom (bijvoorbeeld Waardenburg type 2). Vaak is ook sprake van een verworven oorzaak.
Autosomaal recessieve, niet syndromale congenitale/prelinguale slechthorendheid, of sporadische patiënten met niet syndromale congenitale/prelinguale slechthorendheid.
Uit de literatuur blijkt dat wanneer er een genetische oorzaak vermoed wordt bij vroegkinderlijke niet-syndromale doofheid met een mogelijk autosomaal recessief overervingspatroon in verreweg de meeste gevallen een mutatie gevonden kan worden in het DFNB1 locus (GJB2/GJB6). De getallen lopen uiteen voor de Kaukasische bevolking van 19% in een relatief ongeselecteerde populatie (eigen waarneming, LH) tot 35% (Pandya (2004), Hutchin et al.(2005)) in sibpairs met niet-syndromale doofheid. De aanbeveling is dan ook om te beginnen met dit locus als er genetisch getest gaat worden (Mac Ardle et al. (2010)).
Als tweede gen komt SLC26A4 naar voren, waarbij vaak ook een EVA (verwijd vestibulair aquaduct) gevonden wordt (Pendred syndroom), hiermee valt dit gen dan ook onder de syndromale slechthorendheid. De andere bekende genen voor DFNB (autosomaal recessieve, niet-syndromale doofheid) zijn veel minder vaak gemuteerd. In volgorde zou dat zijn MYO15A (DFNB3), OTOF (DFNB9), CHD23 (DFNB12) en TMC1 (DFNB7/11) (Hilgert et al. (2009)). Kinderen met mutaties in het OTOF gen kunnen in de eerste twee levensjaren zich presenteren als auditieve neuropathie met afwezige ABR (auditieve hersenstam responsies) en aanwezige OAE (Oto-acoustische emissies). Auditieve neuropathie kan ook veroorzaakt worden door mutaties in het PJVK (pejvakin) gen (DFNB59). Echter, de prevalentie van deze mutaties is niet bekend, en waarschijnlijk zeer laag.
Kinderen met Usher syndroom kunnen zich presenteren als een niet-syndromale slechthorendheid, omdat de bijbehorende retinitis pigmentosa pas op latere leeftijd ontstaat. Aanwijzingen voor Usher syndroom kunnen zijn congenitale volledige doofheid en laat leren lopen (vestibulaire areflexie bij Usher type 1) of een prelinguaal gehoorverlies (met een downsloping audiogram) van 60-80dB (Usher type 2).
Patiënten met een niet-syndromale, autosomaal dominante vorm van slechthorendheid.
Bij autosomaal dominante niet-syndromale doofheid is met name de vorm van het audiogram en de leeftijd van onset van belang voor het bepalen van welk gen getest moet worden (zie tabel; uit Smith (2010) GeneReviews). Omdat de frequentie van mutaties in het DFNB1 locus in de bevolking hoog is, kan er echter in families met slechthorendheid in meerdere generaties, toch sprake zijn van een autosomaal recessieve overerving met mutaties in dit locus.
Overzicht autosomaal dominante niet-syndromale loci en de betrokken genen
|
Locus Name |
Gene Symbol |
Onset/Decade |
Audioprofile |
|
DFNA1 |
DIAPH1 |
Postlingual/1st |
Low frequency progressive |
|
DFNA2 |
KCNQ4 |
Postlingual/2nd |
High frequency progressive |
|
DFNA2B |
GJB3 |
Postlingual/4th |
High frequency progressive |
|
DFNA3 |
GJB2 |
Prelingual |
High frequency progressive |
|
GJB6 |
|||
|
DFNA4 |
MYH14 |
Postlingual |
Flat/gently downsloping |
|
DFNA5 |
DFNA5 |
Postlingual/1st |
High frequency progressive |
|
DFNA6/14/38 |
WFS1 |
Prelingual |
Low frequency progressive |
|
DFNA8/12 |
TECTA |
Mid-frequency loss |
|
|
DFNA9 |
COCH |
Postlingual/2nd |
High frequency progressive |
|
DFNA10 |
EYA4 |
Postlingual/3rd, 4th |
Flat/gently downsloping |
|
DFNA11 |
MYO7A |
Postlingual/1st |
|
|
DFNA13 |
COL11A2 |
Postlingual/2nd |
Mid-frequency loss |
|
DFNA15 |
POU4F3 |
Postlingual |
High frequency progressive |
|
DFNA17 |
MYH9 |
Postlingual |
High frequency progressive |
|
DFNA20/26 |
ACTG1 |
Postlingual |
High frequency progressive |
|
DFNA22 |
MYO6 |
Postlingual |
High frequency progressive |
|
DFNA23 |
SIX1 |
Prelingual |
Downsloping |
|
DFNA25 |
SLC17AB |
Postlingual/2nd-6th decades |
High frequency progressive |
|
DFNA28 |
TFCP2L3 |
Postlingual |
Flat/gently downsloping |
|
DFNA36 |
TMC1 |
Postlingual |
Flat/gently downsloping |
|
DFNA39 |
DSPP |
Postlingual |
High frequency progressive |
|
DFNA44 |
CCDC50 |
Postlingual |
Low to mild frequencies progressive |
|
DFNA48 |
MYO1A |
Postlingual |
Progressive |
|
DFNA50 |
MIR96 |
Postlingual/2nd |
Flat progressive |
|
DFNA51 |
TJP2 & FAM189A2 |
Postlingual/4th |
High frequency progressive |
Uit: R. Smith, Genetests/GeneReview 2010
Mitochondriële overerving
Slechthorendheid kan ook veroorzaakt worden door (specifieke) mutaties in het mitochondriële DNA, maar de prevalentie daarvan onder patiënten met vroegkinderlijke doofheid is niet hoog. Daarom wordt testen hiervoor slechts aangeraden onder de volgende voorwaarden (MacArdle et al. (2010):
- Er is sprake van postlinguaal progressief gehoorverlies, en/of gehoorverlies na gebruik van aminoglycosiden, als eerst aangewezen mutatie is de m.1555A>G te onderzoeken, eventueel gevolgd door de andere beschreven mitochondriële mutaties.
- Een familieverhaal waarbij overerving via de maternale lijn plausibel is, is een reden om te testen op mitochondriële mutaties.
Syndromale slechthorendheid
Voor de syndromale vormen van doofheid is het eenvoudiger te bepalen welke genen getest moeten worden vanwege de bijkomende klinische verschijnselen. Relatief vaker voorkomend zijn Waardenburg Syndroom (autosomaal dominant, oa PAX3, MITF), Pendred Syndroom (autosomaal recessief, SLC26A4), Alport syndroom (COL4A5, X-gebonden, COL4A3, autosomaal dominant) en Mohr-Tranebjaerg (TIMM8A, X-gebonden) (zie de online overzichten bij Genetests, Smith et al, 2010). Soms kan er ook sprake zijn van Usher syndroom, waarbij veel verschillende genen betrokken zijn. Omdat de bijbehorende RP (retinitis pigmentosa) pas op latere leeftijd ontstaat, kunnen kinderen met Usher zich presenteren als een niet-syndromale slechthorendheid. Aanwijzingen voor Usher syndroom kunnen zijn congenitale volledige doofheid en laat leren lopen (vestibulaire areflexie bij Usher type 1) of een prelinguaal gehoorverlies van 60-80dB (Usher type 2). Ook bij vormen van mitochondriële aandoeningen komt slechthorendheid voor, bijvoorbeeld Leigh syndroom en MELAS. Hierbij zullen echter de andere klinische verschijnselen op de voorgrond staan.
Referenties
- Admiraal, R.J.C., Kunst, H.P.M., Cremers, C.W.R.J. (2008). Otogenetica. In: J.Meuwese-Jongejeugd & H.L.M. van Straaten (red). Werkboek Neonatale gehoorscreening (pp 95-100). Amsterdam: VU University Press.
- Admiraal, R.J.C., Kremer, H., Hoefsloot, L., van Slobbe-Knoers, N., Kunst, H.P.M., Cremers, C.W.R.J. (2011). Etiological investigation of hearing impairment: an outpatient clinic. Proceedings ASPO (poster 118).
- Hilgert, N., Smith, RJH, Camp, G.van. (2009). Forty-six genes causing nonsyndromic hearing impairment: Which ones should be analyzed in DNA diagnostics? Mutation Research 681, 189196.
- Hilgert, N., Smith, RJH, Camp, G.van. (2009). Forty-six genes causing nonsyndromic hearing impairment: Which ones should be analyzed in DNA diagnostics? Mutation Research 681, 189196.
- Hutchin, T., Coy, N.N., Conlon, H., Telford, E., Bromelow, K., Blaydon,D., Taylor, G., Coghill, E., Brown, S., Trembath, R., Liu, X.Z., Bitner-Glindzicz, M., Mueller, R. (2005). Assessment of the genetic causes of recessive childhood non-syndromic deafness in the UK - implications for genetic testing. Clin. Genet. 68, 506-512.
- Huygen P.L.M., Pennings R.J.E., Cremers C.W.R.J. (2003). Characterizing and distguishing progressive phenotypes in nonsyndromic autosomal dominant hearing impairment. Aud. Med. 1: 37-46
- Kochhar A., Hildebrand, M.S., Smith, R.J.H. (2007). Clinical aspects of hereditary hearing loss. Genetics in Medicine 9, 393-408.
- Korver, A., Admiraal, R., Kant, S., Dekker, F., Wever, C., Kunst, H., Frijns, J., Oudesluys-Murphy A. (2011). Causes of Permanent Childhood Hearing Impairment. The Laryngoscope 121, 409-416.
- Lin, J.W., Chowdhury, N., Mody, A., Tonini, R., Emery, C., Haymond, J., & Oghalai, J.S. (2011). Comprehensive diagnostic battery for evaluating sensorineural hearing loss in children.Otol Neurotol 32 (2), 259-64.
- Mac Ardle, B., Bitner-Glindzicz, M. (2010). Investigation of the child with permanent hearing impairment.Arch. Dis. Child. Educ. Pract. Ed 95, 14-23.
- Morton CC, Nance WE.(2006). Newborn hearing screening--a silent revolution. N Engl J Med. 354, 2151-2164.
- Morzaria, S., Westerberg, B., Kozak, F. (2004). Systematic review of the etiology of bilateral sensorineural hearing loss in children. International Journal of Pediatric Otorhinolaryngology 68, 11931198.
- Pandya, A., Arnos, K.S., Xia, X.J., Welch, K.O., Blanton, S.H., Friedman T.B., Garcia, S.G., Liu, M.D., X, Morell, R., and Nance, W.E. (2003). Frequency and distribution of GJB2 (connexin 26) and GJB6 (connexin 30) mutations in a large North American repository of deaf probands. Genet. Med. 5, 295-303.
- Pandya, A.(2004). [updated 2011 Apr 21]. Nonsyndromic Hearing Loss and Deafness, Mitochondrial. In: RA Pagon, TD Bird, CR Dolan, K Stephens (red). GeneReviews [Internet]. Seattle (WA): University of Washington, Seattle; 1993-. Available from http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=gene&part=mt-deafness
- Pennings, R.J.E., Huygen P.L.M., van Camp G., Cremers C.W.R.J. A (2003). A review of progressive phenotypes in nonsyndromic autosomal dominant hearing impairment. Aud.Med. 1:47-55
- Preciado, D. A., Lim, L. H., Cohen, A. P., Madden, C., Myer, D., Ngo, C., Bradshaw, J. K., Lawson, L., Choo, D. I., Greinwald, J. H. Jr. (2004). A diagnostic paradigm for childhood idiopathic sensorineural hearing loss. Otolaryngol Head Neck Surgery 131, 804-809.
- Preciado DA, Lawson L, Madden C, Myer D, Ngo C, Bradshaw JK, Choo DI, Greinwald JH Jr. Improved diagnostic effectiveness with a sequential diagnostic paradigm in idiopathic pediatric sensorineural hearing loss. Otol Neurotol. 26, 610-615
- Smith, R.J.H., Hildebrand, M.S., Van Camp, G. (1999). [updated 2010 Oct 14]. Deafness and Hereditary Hearing Loss Overview. In: RA Pagon, TD Bird, CR Dolan, K Stephens, editors. GeneReviews [Internet]. Seattle (WA): University of Washington, Seattle; 1993-. Available from
- http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=gene&part=deafness-overview
- Smith, R.J.H., Gurrola, I.I.J.G., Kelley, P.M. (2009). OTOF-Related Deafness. 2008 Feb 29. In: RA Pagon, TD Bird, CR Dolan, K Stephens (red). GeneReviews [Internet]. Seattle (WA): University of Washington, Seattle; 1993-. Available from http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=gene&part=dfnb9
- Smith, R.J.H., Hildebrand, M. (2008). DFNA2 Nonsyndromic Hearing Loss [updated 2011 Feb 17]. In: RA Pagon, TD Bird, CR Dolan, K Stephens (red). GeneReviews [Internet]. Seattle (WA): University of Washington, Seattle; 1993-. Available from http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=gene&part=dfna2
- Smith, R.J.H., Sheffield, A.M., Van Camp, G. (1998). [updated 2009 Apr 30]. Nonsyndromic Hearing Loss and Deafness, DFNA3. In: RA Pagon, TD Bird, CR Dolan, K Stephens (red). GeneReviews [Internet]. Seattle (WA): University of Washington, Seattle; 1993-. Available from
- http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=gene&part=dfna3
- Smith, R.J.H., Van Camp, G. (1998). [updated 2008 Jul 11]. Nonsyndromic Hearing Loss and Deafness, DFNB1. In: RA Pagon, TD Bird, CR Dolan, K Stephens (red). GeneReviews [Internet]. Seattle (WA): University of Washington, Seattle; 1993-. Available from
- http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=gene&part=dfnb1
Evidence tabellen
|
Referentie |
Mate van bewijs
Studie type |
Populatie |
Inclusie criteria |
Index-test |
Controle
|
Uitkomst-maten |
Resultaten |
Overige opmerkingen |
|
Hilgert (2009) |
Literatuurstudie |
Onduidelijk, maar alle (?) artikelen met gepubliceerde mutaties |
Artikelen waar een mutatie beschreven is in een van de 46 (toen bekende) doofheidsgenen |
-- |
-- |
Hoeveel (verschillende) mutaties per gen |
AR:GJB2 heeft meeste mutaties, dan SLC26A4, MYO15A, OTOF, CDH23 en TMC1. |
Bias is dat er niet meegenomen is hoeveel patienten er precies getest zijn, welke populaties, audogrammen, etc. |
|
Hutchin (2005). |
Case-control, grote populatie uit GB |
142 sib-pairs (dan is waarschijnlijk sprake van een monogeen recessief overervende aandoening) |
Niet-syndromale, early onset hearing impairment in beide sibs |
1. GJB2 mutaties, 2. Microsatellietanalyse van 26 DFNB-loci 3. Mutatieanalyse van genen waar sibs concordant voor zijn. |
-- |
Aantal allelen met een (pathogene) mutatie |
47 sibpairs hebben twee GJB2 mutaties, 16 hebben er een, dan volgt SLC26A4 (5 sib pairs met twee, 3,5% 6 sibpairs met een) dan TMPRSS3 (2 sipairs) TECTA, OTOF en PCDH15 |
GJB2 (DFNB1) locus is vaakste gemuteerd, maximaal in 39% van deze populatie, gevolgd door SLC26A4, en daarna TMPRSS3 (latere onset en progressief). Rest is waarschijnlijk zeldzaam, uiteindelijk is in 55 sibpairs een genetische diagnose gesteld (38,7%) |
|
Mac Ardle (2010) |
Expert review, guidelines |
Literatuurstudie |
Relevante artikelen, eerdere guidelines |
-- |
-- |
Voorstel voor aetiologisch onderzoek bij kinderen met bilateraal permanent gehoorverlies |
Uitgebreid protocol |
Zeer relevant artikel voor de hele richtlijn, wat betreft beantwoorden vraag geldt dat genetisch testen op grond van de klinische informatie gaat; voor syndromale doofheid meest frequent Pendred, WS syndroom, Treacher-Collins, BOR en Usher, voor niet-syndromaal DFNB1 (GJB2/GJB6) |
|
Pandya (2003) |
Cohort studie, gebaseerd op Amerikaanse database van bijna 50.000 geregistreerde slechthorende of dove studenten |
608 families, 737 probands (slechthorend) zijn getest voor GJB2/GJB6 (DFNB1) mutaties |
Families die getest konden worden voor mutaties |
Sequentieanalyse exon 1 en 2, deletie in GJB6 (D13S1830); audiologische data; demografische data |
-- |
Frequentie van DFNB1-gerelateerd gehoorverlies in deze populatie, gedifferentieerd naar raciale achtergrond; en mate van gehoorverlies |
DFNB1-gerelateerde doofheid komt in de verschillende bevolkingsgroepen met een verschillende frequentie voor (Caucasisch: 26%, african-america 4%) |
Een van de grotere cohortstudies, en daarom geincludeerd. Laat zien dat er nogal wat verschillen zijn tussen groepen met een verschillende ethnische achtergrond, maar ook dat het percentage DFNB1-gerelateerde doofheid in de Caucasische populatie (dus ook de Nederlandse) rond de 25% ligt in een groep niet-syndromale patiënten waarbij andere oorzaken niet uitputtend zijn uitgesloten. |
|
Smith 1993-1999 [updated 2010 Oct 14]. |
Best practice voor “deafness and hereditary hearing loss” |
Expert opinion, met uitgebreid literatuuroverzicht |
Relevante artikelen |
-- |
-- |
Voorstellen voor aetiologisch onderzoek |
Uitgebreide tabellen en overzichten |
Criteria voor het stellen van een diagnose, tabellen met overzicht van bekende genen, en voor de AD doofheid de klinische parameters waarop gekozen kan worden voor een bepaald gen. |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 14-03-2014
Beoordeeld op geldigheid : 01-01-2012
Uiterlijk in 2016 bepaalt het bestuur van de VKGN of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De VKGN is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Een richtlijn bevat aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering. In de conclusies wordt aangegeven wat de wetenschappelijke stand van zaken is. De aanbevelingen expliciteren optimaal professioneel handelen in de gezondheidszorg en zijn gebaseerd op de resultaten van wetenschappelijk onderzoek, aansluitende meningsvorming en overige overwegingen. Deze richtlijn geeft een leidraad voor etiologisch onderzoek van neonatale vastgestelde slechthorendheid. Het is van belang dat het etiologisch onderzoek in relatie tot de leeftijd van het kind en de setting wordt beschouwd.
Door het vaststellen van de oorzaak kan een uitspraak gedaan worden over het mogelijk beloop van slechthorendheid en eventuele noodzaak tot een aangepaste leeromgeving om het kind optimale kansen te geven in de maatschappij. Afhankelijk van de oorzaak kunnen mogelijke bijkomende verschijnselen worden gecontroleerd en/of behandeld.
Tevens is het etiologisch onderzoek essentieel voor genetic counseling en het vaststellen van de kans op een volgend kind met slechthorendheid.
Doelgroep
Deze richtlijn richt zich op kinderen waarbij slechthorendheid is vastgesteld bij de neonatale gehoorsscreening en hun ouders.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2009 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met etiologisch onderzoek naar slechthorendheid op de kinderleeftijd te maken hebben (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2009-2012 aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. R.J.C. Admiraal, vice voorzitter, KNO-arts, NVKNO
- Drs. L.A. Bok, Kinderarts, NVK
- Dr. E.H. Hoefsloot, staflid DNA-diagnostiek, VKGL
- Dr. S.G. Kant, Klinisch Geneticus, VKGN
- Dr. H.L.M. van Straaten, Neonatoloog, NVK
- Dr. V. Topsakal, KNO-arts, NVKNO
- Drs. N.N. Uilenburg, Manager Onderzoek en Ontwikkeling, NSDSK
- Drs. M-J.H. van den Boogaard, voorzitter, Klinisch Geneticus, VKGN
- Dr. M.F. van Dooren, Klinisch Geneticus, VKGN
- Dr. G.A. van Zanten, Hoofd Audiologisch Centrum, NVA
Met ondersteuning van:
- Drs. A. Hagemeijer, senior adviseur, afdeling Ondersteuning Professionele Kwaliteit, Orde van Medisch Specialisten
- Drs. M. Wessels, literatuurspecialist, afdeling Ondersteuning Professionele Kwaliteit, Orde van Medisch Specialisten
In samenwerking met:
- Nederlandse Stichting voor het Dove en Slechthorende Kind (NSDSK)
- Nederlandse Federatie van ouders van slechthorende kinderen en van kinderen met spraak-taalmoeilijkheden (FOSS)
- Nederlandse Vereniging voor Slechthorenden (NVVS)
Belangenverklaringen
Verklaring omtrent mogelijke belangenverstrengeling en embargo met betrekking tot de richtlijnEtiologisch onderzoek naar slechthorendheid op de kinderleeftijd.
Werkgroeplid in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhield met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp
|
Naam |
Belangenverklaring ingevuld |
Belangen gemeld |
|
Admiraal, R. |
ja |
nee |
|
Boogaard, M.J. van den |
ja |
nee |
|
Bok, L. |
ja |
nee |
|
Dooren, M. van |
ja |
nee |
|
Hoefsloot, L. |
ja |
nee |
|
Kant, S. |
ja |
nee |
|
Straaten, I. van |
ja |
nee |
|
Topsakal, V. |
ja |
nee |
|
Uilenburg, N. |
ja |
nee |
|
Verduyn Lunel, F. |
Ja |
nee |
|
Wit de-Fleer, H. |
ja |
nee |
|
Zanten, B. van |
ja |
nee |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de Nederlandse Stichting voor het Dove en Slechthorende Kind (NSDSK), de Nederlandse Federatie van ouders van slechthorende kinderen en van kinderen met spraak-taalmoeilijkheden (FOSS) en de Nederlandse Vereniging voor Slechthorenden (NVVS) te vragen om te participeren in het richtlijnproces. Dit is vormgegeven door één vertegenwoordiger in de werkgroep. De betreffende vertegenwoordiger heeft op afstand geparticipeerd en kon gevraagd en ongevraagd feedback geven op de voorliggende teksten. Daarnaast is via de websites van de betrokken patiëntenverenigingen een oproep gedaan aan ouders van slechthorende kinderen om zich te melden voor deelname aan een focusgroep. Helaas heeft dit geresulteerd in een minimaal aantal aanmeldingen en is besloten om geen focusgroep te organiseren, een klein aantal ouders is telefonisch gesproken over ervaren knelpunten.
De conceptrichtlijn is voor commentaar voorgelegd aan de betrokken patientenverenigingen en aan de ouders die zich hadden aangemeld voor deelname aan de focusgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
De richtlijn is verspreid onder alle relevante beroepsgroepen en ziekenhuizen. Daarnaast wordt er een samenvatting van de richtlijn gepubliceerd in het Nederlands Tijdschrift voor Geneeskunde en in tijdschriften van de deelnemende wetenschappelijke verenigingen. Ook is de richtlijn te downloaden vanaf de website van de VKGN: [www.vkgn.org] en van de Kwaliteitskoepel: [www.kwaliteitskoepel.nl].
Werkwijze
Knelpuntenanalyse
In het kader van deze richtlijnontwikkeling werd allereerst een knelpunt analyse verricht die inzicht geeft in de behoeften van betrokkenen. Bij deze analyse werden vooral knelpunten geconstateerd op het gebied van de kennis en expertise van de etiologie van slechthorendheid, de indicatiestelling voor de verschillende mogelijkheden van etiologische diagnostiek en problemen in de afstemming en taakverdeling tussen medisch specialisten. De knelpuntanalyse heeft geresulteerd in een rapport waarin een vijftal aanbevelingen zijn geformuleerd (Uphoff, 2010). Deze aanbevelingen hebben gediend als aandachtspunten voor de werkgroep, bij het ontwikkelen van de richtlijn.
Uitgangsvragen en uitkomstmaten
Aan de hand van de knelpunten werden door de werkgroep uitgangsvragen geformuleerd. In deze richtlijn worden 12 uitgangsvragen besproken, die als basis dienen voor de geformuleerde aanbevelingen in de richtlijn. De uitgangsvragen zijn geformuleerd op basis van de literatuur en de eerdergenoemde knelpuntanalyse.
Beoordelen van de kracht van het wetenschappelijke bewijs
Beoordeling van dit soort onderzoeken werd gedaan aan de hand van de EBRO methodiek. Individuele studies werden beschreven in evidence-tabellen. De studies werden individueel beoordeeld op onderzoeksopzet/design. Naar aanleiding van deze beoordeling werd het bewijsniveau van studies bepaald volgens de classificatie in tabel 2. Een samenvatting van de literatuur en het bewijsniveau van de relevante studies zijn in de richtlijntekst terug te vinden onder de kopjes ‘samenvatting van de literatuur’ en ‘conclusie’.
Tabel 2. EBRO indeling van de kwaliteit van individuele studies
|
|
Interventie |
Diagnostische accuratesse onderzoek |
Schade of bijwerkingen, etiologie, prognose* |
|
A1 |
Systematische review van ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau
|
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
Prospectief cohortonderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiënt-controleonderzoek, cohort-onderzoek) |
Onderzoek ten opzichte van een referentietest, maar niet met alle kenmerken die onder A2 zijn genoemd |
Prospectief cohortonderzoek, maar niet met alle kenmerken als genoemd onder A2 of retrospectief cohortonderzoek of patiënt-controleonderzoek |
|
C |
Niet-vergelijkend onderzoek |
||
|
D |
Mening van deskundigen |
||
* Deze classificatie is alleen van toepassing in situaties waarin om ethische of andere redenen gecontroleerde trials niet mogelijk zijn. Zijn die wel mogelijk dan geldt de classificatie voor interventies.
Tabel 2: Niveau van bewijs van de conclusie
|
Conclusie gebaseerd op |
|
|
1 |
Onderzoek van niveau A1 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2 |
|
2 |
Eén onderzoek van niveau A2 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
3 |
Eén onderzoek van niveau B of C |
|
4 |
Mening van deskundigen |
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs nog andere aspecten van belang, zoals de expertise van de werkgroep leden, patiënten voorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische facetten. Deze aspecten worden, voor zover niet wetenschappelijk onderzocht, vermeld onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op zowel het beschikbare wetenschappelijke bewijs als op de belangrijkste overwegingen.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden indicatoren ontwikkeld. Een indicator is een meetbaar kenmerk van de gezondheidszorg met een signaalfunctie voor (een aspect van) de kwaliteit van zorg. Indicatoren maken het de zorgverleners mogelijk om te meten of zij de gewenste zorg leveren en om onderwerpen voor verbeteringen te identificeren.
Kennislacunes
Tijdens de ontwikkeling van de richtlijn ‘Etiologisch onderzoek naar slechthorendheid op de kinderleeftijd’ is systematisch gezocht naar onderzoeksbevindingen die nuttig konden zijn voor het beantwoorden van de uitgangsvragen. Een deel (of een onderdeel) van de uitgangsvragen is met het resultaat van deze zoekacties te beantwoorden, het overgrote deel echter niet. Door gebruik te maken van de Evidence Based Systematiek is duidelijk geworden, of liever gezegd bevestigd, dat er op het terrein van het etiologisch onderzoek naar slechthorendheid nog lacunes in de beschikbare kennis bestaan. De werkgroep is van mening dat (vervolg)onderzoek wenselijk is, om in de toekomst een duidelijker antwoord te kunnen verschaffen. Om deze reden heeft de werkgroep aangegeven op welke vlakken nader onderzoek gewenst is.
Daarbij dient men zich te realiseren dat de mogelijkheden en inzichten betreffende het etiologisch onderzoek bij slechthorendheid veranderen in de tijd. Met name de moleculaire diagnostiek is sterk in ontwikkeling, er lijken mogelijkheden voor behandeling van CMV op komst, de kennis betreffende het beoordelen van beeldvormende technieken neemt toe, en er zijn voortschrijdende ontwikkelingen met betrekking tot hoorapparatuur voor slechthorendheid en cochleaire implantatie voor doofheid. Hierdoor zijn verrichte studies niet meer toepasbaar voor dit moment, en is men op dit moment sterk afhankelijk van de meningen van experts.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de besturen van de betrokken (wetenschappelijke) verenigingen verstuurd voor autorisatie.
Zoekverantwoording
De onderbouwing van de richtlijn is mede gebaseerd op bewijs uit gepubliceerd wetenschappelijk onderzoek. Relevante artikelen werden gezocht door het verrichten van systematische zoekacties. De beperking naar periode waarover is gezocht verschilde per uitgangsvraag. Dit is terug te vinden in de tabel. Voor de oriënterende search werd specifiek gezocht naar al bestaande richtlijnen in online raadpleegbare (inter)nationale guideline clearinghouses en in Medline via OVID.
Hierbij werd de taal gelimiteerd tot Engels en Nederlands, soms ook daarnaast ook Duits en Frans. Daarnaast werden artikelen geëxtraheerd uit referentielijsten van opgevraagde literatuur en aangeleverd door de werkgroepleden. Dit leverde bij enkele uitgangsvragen nog aanvullende artikelen op. De searches zijn verricht tussen juni 2010 en juni 2011. Er is gezocht in de Medline database via OVID.
Incidenteel is gebruikt gemaakt van een zoekfilter voor systematische reviews of voor gerandomiseerde klinische trials. Deze zijn gebaseerd op de zoekfilters van het Scottish Intercollegiate Guidelines Network (www.sign.ac.uk/methodology/filters.html). Incidenteel is ook gebruik gemaakt voor een beperking op exp cohort studies.
|
Onderwerp |
Database |
Zoektermen |
Aantal hits |
|
Patientenperspectief |
|
1 hearing loss/ or hearing loss, bilateral/ or hearing loss, sensorineural/ or hearing loss, unilateral/ (17099) 2 *Hearing Loss, Bilateral/cn, di, et, ge [Congenital, Diagnosis, Etiology, Genetics] (412) 3 exp *Hearing Loss, Sensorineural/cn, di, et, ge [Congenital, Diagnosis, Etiology, Genetics] (5567) 4 exp *Hearing Loss, Unilateral/cn, di, et, ge [Congenital, Diagnosis, Etiology, Genetics] (55) 5 *Deafness/cn, di, et, ge [Congenital, Diagnosis, Etiology, Genetics] (5083) 6 *Hearing Disorders/cn, di, et, ge [Congenital, Diagnosis, Etiology, Genetics] (3566) 7 (deafness or "hearing loss").ti. (14633) 8 "hearing impairment*".ti. (1470) 9 or/1-8 (33087) |
|
|
9. moleculair genetisch onderzoek |
Medline (OVID) 1994-oktober 2010 Engels, Duits, Frans, Nederland |
16 genetics/ or genetics, medical/ (23028) 17 genes, mitochondrial/ or genes, recessive/ (13718) 18 exp Microchip Analytical Procedures/ (53211) 19 Electrophoresis, Microchip/ (754) 20 pendred.mp. (216) 21 16 or 17 or 18 or 19 or 20 (89846) 22 15 and 21 (374) 23 exp Mitochondrial Diseases/ (8929) 24 21 or 23 (98524) 25 15 and 24 (422) 26 limit 25 to (yr="1994 -Current" and (dutch or english or french or german)) (258) 27 DFNB1.mp. (104) 28 24 or 27 (98593) 29 15 and 28 (458) 30 limit 26 to (yr="1994 -Current" and (dutch or english or french or german)) (258) 31 etiology.fs. (1752537) 32 30 and 31 (26) 33 diagnosis.fs. (1637797) 34 30 and 33 (52) 35 32 or 34 (68) 72 limit 30 to "diagnosis (sensitivity)" (108) 75 72 or 35 (114) |
114 divers |
