Hypercholesterolemie op basis van LDL
Uitgangsvraag
Hypercholesterolemie op basis van LDL: familiaire hypercholesterolemie (FH).
Deelvragen
- Welke streefwaarden van welke lipiden en/of (apo)lipoproteïnen moet gehandhaafd worden voor het instellen van behandeling bij preventie in patiënten met familiaire hypercholesterolemie?
- Wat is de optimale behandeling van patiënten met familiaire hypercholesterolemie gelet op hun risico op hart- en vaatziekten?
Aanbeveling
Behandel FH-patiënten zonder hart- en vaatziekten met een statine en/of cholesterolabsorptie remmer, en streef naar LDL-C (lager dan 2,5 mmol/l) of ten minste 50% LDL-C-reductie.
Behandel FH-patiënten met bewezen hart- en vaatziekten met een statine en/of cholesterolabsorptieremmer en streef naar LDL-C onder 1,8 mmol/l.
Overweeg PCSK9-antilichamen bij FH-patiënten onder standaardbehandeling die hun streefwaarden niet halen en waarbij het cardiovasculair risico als zeer hoog wordt ingeschat (bijvoorbeeld bij aanwezigheid andere risicofactoren en/of sterk belaste familieanamnese ten aanzien van hart- en vaatziekten).
Overwegingen
Na het uitvoeren van de zoekactie werden de resultaten van de FOURIER-trial gepubliceerd (Sabatine, 2017). De FOURIER-trial vergeleek een PSCK9-antilichaam met placebo patiënten met hart- en vaatziekten. Patiënten die een PSCK9-antilichaam kregen, hadden na 48 weken een LDL-C lager dan 1,8 mmol/l. Het risico op de primaire uitkomst (cardiovasculaire dood, myocardinfarct, beroerte, ziekenhuisopname voor instabiele angina of coronaire revascularisatie) was 15% lager bij gebruik van een PSCK9-antilichaam vergeleken met een placebo. Ondanks deze veelbelovende resultaten is de studie bij patiënten met hart- en vaatziekten uitgevoerd. Tevens werd niet gefocust op patiënten met FH. De vraag is hoe deze resultaten naar FH-patiënten geëxtrapoleerd kunnen worden.
Behandelen van FH met thans verkrijgbare generieke statines met een LDL-C-verlaging in de orde van 50% verlaagt risico van myocardinfarct naar niveau van algehele populatie in een follow-up periode korter dan 10 jaar (Versmissen, 2008). Kiezen voor een streefdoel van LDL-C-verlaging van ten minste 50% zoals aangegeven in de NICE-richtlijn (NICE, 2013) lijkt voor praktijk haalbaar en adequaat advies, vooral indien kan worden gestart op jonge leeftijd. Overweeg verdere LDL-C-verlaging indien sprake is van verhoogd risico bij FH, bijvoorbeeld in geval van roken of sterk positieve familiaire belasting in de eerste lijn, aanwezige comorbiditeit als DM of bewezen cardiovasculaire morbiditeit van de patiënt. Vanwege het ontbreken van concreet bewijs voor het hanteren van specifieke streefwaarden bij de behandeling verwijst de werkgroep naar bestaande richtlijnen zoals eerder weergeven in tabel 1.
Risicostratificatie bij patiënten met FH is buitengewoon moeilijk vooral omdat ondanks behandeling lipidenconcentraties verhoogd blijven. In 3e lijns centra is in het verleden ervaring opgedaan met onderzoeksmethoden gebaseerd op intermediaire eindpunten zoals Intima Media Dikte (IMT) metingen toegepast om effect van belangrijke LDL-C -verlagingen te koppelen aan (het achterblijven van) veranderingen in IMT-dikte. Ook is het gebruik van coronaire arteriële calcium (CAC) score voor risicostratificatie genoemd in FH. De werkgroep onderkent het gebruik van dergelijke methodieken als vorm van risico-inschatting, maar vanwege het ontbreken van bewijs over voorspellende concentraties bij FH-patiënten kan de werkgroep geen advies hierover geven, het blijft derhalve vooralsnog vooral een expert-opinion.
Onderbouwing
Achtergrond
Deze richtlijn handelt over identificatie en behandeling van patiënten met primaire dyslipidemie. De gehanteerde indeling maakt het mogelijk de (meest) afwijkende component in het lipiden- en lipoproteïnenprofiel te beschouwen, en indien gerelateerd aan bekende verhoogde cardiovasculaire ziekte en sterfte, behandeling te starten. In het kader van familiaire hypercholesterolemie (FH) gaat dit om verlaging van het LDL-C. Reden voor (vroege) behandeling is de levenslange expositie aan (zeer) hoge LDL-C-concentraties ten gevolge van de erfelijke aanleg en de hiermee samenhangende vroegtijdige sterfte aan hart- en vaatziekten. Indien onbehandeld ontwikkelen 50% van de mannelijke FH-patiënten een event voor hun 45e levensjaar en 33% van de vrouwen met FH voor hun 60e (Genest, 2014). Onbehandeld overlijdt de helft van de mannen en 15% van de vrouwen voor het 60e levensjaar (Reiner, 2011). In een recente Noorse studie bleek het risico bij FH-patiënten vergeleken met de algemene populatie verhoogd (HR 2,29 95%BI 1,65 tot 3,19) (Mundal, 2014).
In de praktijk is de behandeling met statines de hoeksteen van de therapie. Vooral van de meer potente statines (rosuvastatine en atorvastatine) kan een belangrijke LDL-cholesterol reductie - nodig om een streefdoel van een LDL-C van 2,5 mmol/l te halen - worden verwacht (Genest, 2014; Reiner, 2011). Diverse richtlijnen noemen een streefdoel van LDL-C <1,8 mmol/l indien sprake is van FH gecombineerd met manifest cardiovasculaire ziekte (Tabel 1) (Walma, 2006; Piepoli, 2016; NICE, 2013).
Het belang van het -indien nodig- toevoegen van een cholesterol absorptie remmer werd bevestigd in een Nederlandse studie waar werd aangetoond dat bij FH het bereiken van een streefdoel van 2,5 mmol/l (in 21% van de gevallen) alleen werd bereikt met de combinatie statine/ezetimibe (Pijlman,2010). In deze context lijkt het advies weergegeven in de NICE-richtlijn om in ieder geval te komen tot een LDL-Cholesterol reductie van ten minste 50% van het uitgang LDL-C in de dagelijkse praktijk bruikbaar (NICE, 2013).
Tabel 1 Overzicht van LDL-C-streefwaarde uit verschillende richtlijnen:
|
|
Richtlijnen |
|
|
|
|
Streefwaarden LDL-C (mmol/l) bij FH |
FH-richtlijn (Walma, 2006) |
ESC/EAS Dyslips 2016 |
ESC 2016 CVD (Piepoli, 2016; Tabel 6, p 17) |
NICE QS41, 2013 |
|
Ongecompliceerde FH, geen manifeste hart- en vaatziekte |
LDL-C <2,5 mmol/ of max. haalbare LDL-C reductie |
LDL-C <2,5 mmol/l |
LDL-C<2,6 mmol/l |
Verlaag LDL-C met >50% |
|
Gecompliceerde FH, aangetoonde/ manifeste hart- en vaatziekte
|
LDL-C <2,5 mmol/l |
LDL-C <1,8 mmol/l |
LDL-C <1,8 mmol/l |
Verlaag LDL-C met >50% |
Indien aangegeven max. haalbare reductie wordt uitgegaan van behandeling met maximaal statine gecombineerd met ezetemibe.
Conclusies / Summary of Findings
Welke streefwaarden van welke lipiden en/of (apo)lipoproteïnen moet gehandhaafd worden voor het instellen van behandeling bij preventie in patiënten met familiaire hypercholesterolemie?
Hart- en vaatziekten
|
- GRADE |
Vanwege het ontbreken van kwantitatieve data is het niet mogelijk om een schatting te geven van het risico op hart- en vaatziekten bij FH-patiënten behandeld met statine.
Bronnen (Versmissen, 2008; Mohrschladt, 2004) |
Mortaliteit
|
- GRADE |
Vanwege het ontbreken van gegevens over mortaliteit is het niet mogelijk een schatting te geven van het risico om te overlijden bij gebruik van een statine ter primaire preventie door FH-patiënten. |
Wat is de optimale behandeling van patiënten met familiaire hypercholesterolemie gelet op hun risico op hart- en vaatziekten?
Hart- en vaatziekten & mortaliteit
|
- GRADE |
Vanwege een te lage power in de individuele trials en daarmee ook de meta-analyse om hart- en vaatziekten of mortaliteit te detecteren bij FH-patiënten die PSCK9-antilichamen of placebo kregen, was het niet mogelijk een conclusie te formuleren.
Bronnen (Navarese, 2015) |
LDL-C-verlaging
|
Redelijk GRADE |
PCSK9-antilichamen bovenop de standaardbehandeling verlaagt LDL-C met ten minste 56% bij patiënten met hyperlipidemie waaronder FH-patiënten onder standaardbehandeling die hun streefwaardes niet halen vergeleken met placebo.
Bronnen (Navarese, 2015) |
Samenvatting literatuur
Welke streefwaarden van welke lipiden en/of (apo)lipoproteïnen moet gehandhaafd worden voor het instellen van behandeling bij preventie in patiënten met familiaire hypercholesterolemie?
Beschrijving studies
Versmissen (2008) bepaalde de effectiviteit van een behandeling met statine op het risico op coronaire hartziekten in FH-patiënten. Patiënten werden van 27 lipidenklinieken gerekruteerd tussen 1989-2002. De diagnose FH was gesteld op basis van een gedocumenteerde LDL-C-receptor mutatie of LDL-C-cholesterol level boven het 95ste percentiel voor geslacht en leeftijd in combinatie met ten minste één van de volgende criteria: a) de aanwezigheid van peesxanthomen in de patiënt of eerstegraads familielid, b) een LDL-C cholesterolconcentratie boven het 95ste percentiel voor geslacht en leeftijd in een eerstegraads familielid of c) bewezen coronaire vaatziekten in de patiënt of in een eerstegraads familielid jonger dan 60 jaar. Patiënten met een coronaire hartziekte voor de start van de studie werden geëxcludeerd. 1950 patiënten werden geïncludeerd en gemiddeld voor acht en een half jaar gevolgd. Samenvallend met de start van de studie kregen 413 patiënten een statine. Tijdens follow-up begonnen 1294 patiënten met een statine. 243 patiënten zijn gedurende studie niet gestart met een statine. Redenen voor geen behandeling waren niet bekend.
Mohrschladt (2004) ondernam een studie om het aantal hart- en vaatziekten events en het risico op mortaliteit in FH-patiënten behandeld met een statine te bepalen. FH-patiënten waren gerekruteerd van een lipidenpolikliniek bij een academisch ziekenhuis tussen 1988 en 1997. De diagnose FH was vastgesteld op basis van een herhaald serum totaalcholesterol hoger dan 8,0 mmol/l en triglyceride lager dan 2,5 mmol/l én een familiegeschiedenis van hypercholesterolemie of premature hart- en vaatziekten of de aanwezigheid van peesxanthomen. 400 patiënten namen deel aan de studie waarvan 345 patiënten een statine kregen. 214 patiënten kregen een statine ter primaire preventie en bij 131 patiënten betrof het secundaire preventie. 55 patiënten kregen geen medicamenteuze behandeling. Redenen voor geen behandeling waren intolerantie tegen statines, weigeren van medicatie, zwangerschap wens of patiënten met een laag risicoprofiel (meestal ging het hierbij om vrouwen zonder familiegeschiedenis van hart- en vaatziekten en een hoog HDL-C). Patiënten geselecteerd uit een tertiaire setting kunnen een selecte groep zijn aangezien veelal gecompliceerde/ernstige patiënten bij deze setting onder behandeling staan. Echter, in de tijdsperiode van inclusie stonden alle patiënten onder behandeling bij een tertiair ziekenhuis.
Beide studies betroffen een Nederlandse patiëntenpopulatie verzameld tijdens eenzelfde tijdsperiode. Het was onbekend of patiënten in beide studies konden zijn geïncludeerd.
Resultaten
Hart- en vaatziekten
Incidentie
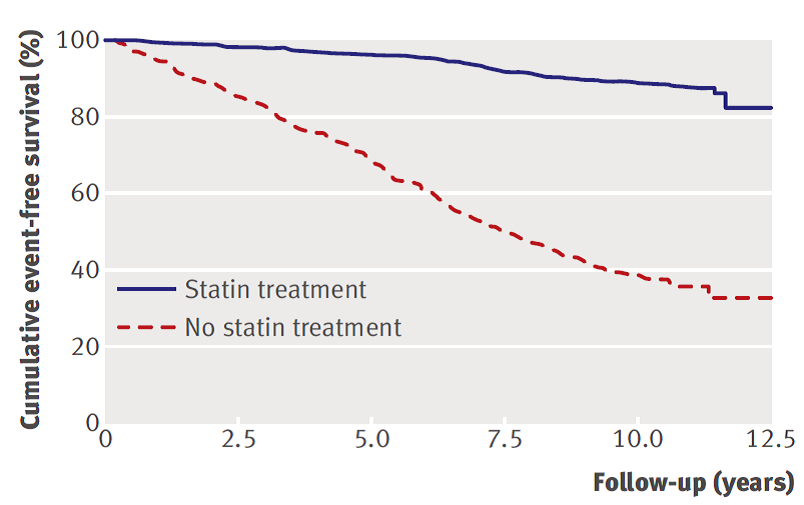
Beide studies rapporteerden een Kaplan-Meier survivalcurve. Versmissen (2008) vergeleek statine behandeling versus geen behandeling (figuur 1). Ruwe data over de cumulatieve coronaire hartziekte-vrije overleving was niet in het artikel gerapporteerd. Afgeleid uit het figuur is het vijf-jaar risico op coronaire hartziekten ongeveer 5% en het tien-jaar risico ongeveer 11% onder FH-patiënten die een statine krijgen.
Figuur 1 Kaplan-Meier grafiek met de cumulatieve coronaire hartziekte-vrije overleving onder FH-patiënten (overgenomen uit Versmissen, 2008)
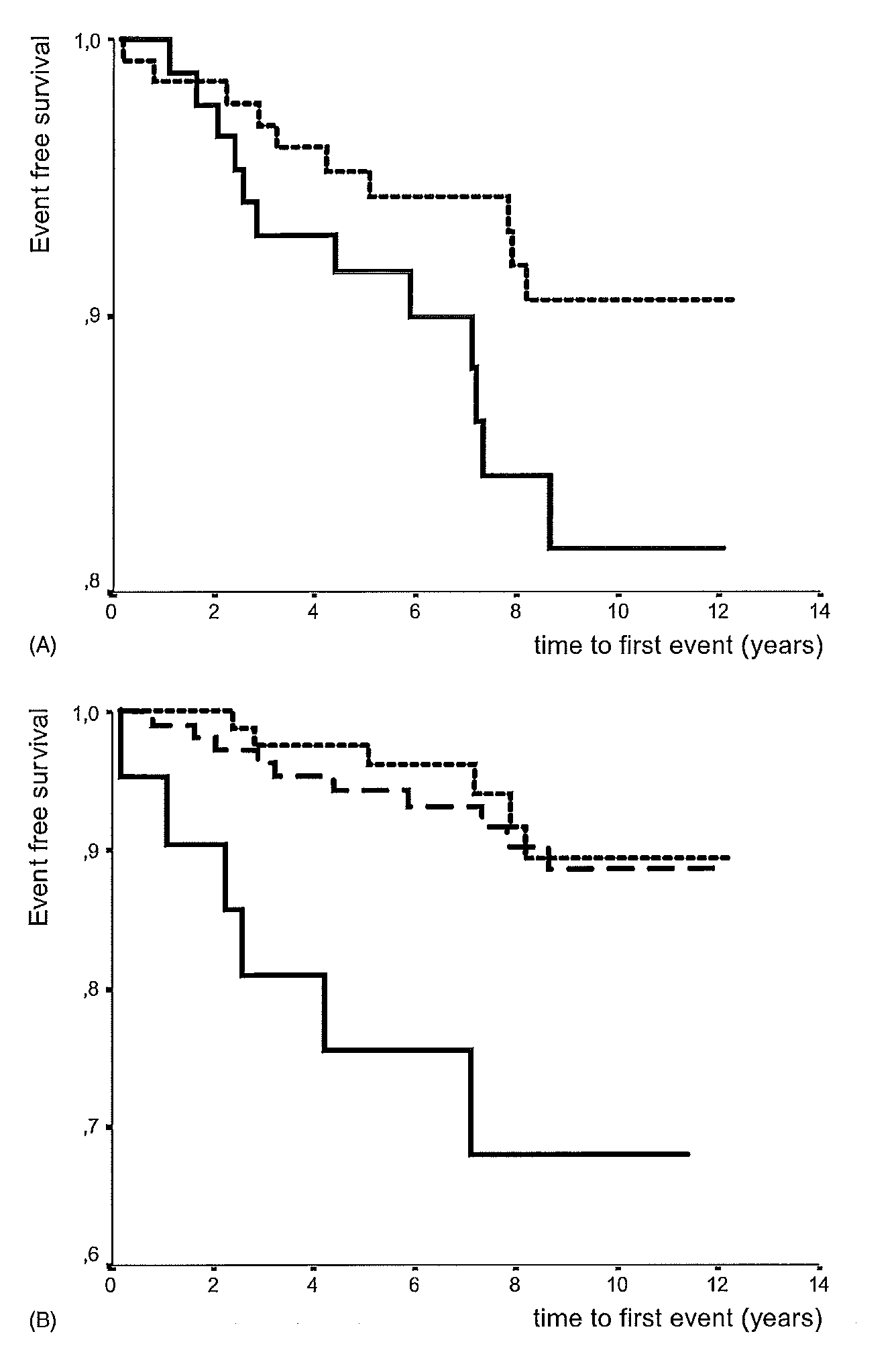
Mohrschladt (2004) rapporteerde geen ruwe data over de cumulatieve hart- en vaatziekte-vrije overleving bij FH-patiënten onder behandeling van een statine ter primaire preventie. Resultaten werden alleen in een survivalcurve weergegeven en gestratificeerd op geslacht of leeftijd (figuur 2). Uit de grafiek is af te leiden dat het vijf-jaar risico op hart- en vaatziekten voor mannen ongeveer 9% is en voor vrouwen ongeveer 5%. Het tien-jaar risico was ongeveer 19% of 9% voor mannen of vrouwen. Vanwege het lage aantal patiënten en doden per leeftijdscategorie is alleen uit de grafiek het vijf-jaar risico afgeleid. Het vijf-jaar risico op hart- en vaatziekte was voor patiënten jonger dan 40 jaar ongeveer 2%, voor patiënten tussen 40 en 59 jaar ongeveer 6% en voor patiënten ouder dan 60 jaar ongeveer 25%.
Figuur 2 Kaplan-Meier grafiek met cumulatieve hart- en vaatziekte-vrije overleving bij FH-patiënten onder behandeling van een statine voor primaire preventie. (A) Vrouwen (…) en mannen (-). (B) <40 jaar (…), 40-59 jaar (- - -) en >59 (-) (overgenomen uit Mohrschladt, 2004)
Mortaliteit
Beide studies hadden geen Kaplan-Meier curve met als uitkomst mortaliteit weergegeven.
Bewijskracht van de literatuur
Hart- en vaatziekten: Vanwege het ontbreken van kwantitatieve data over het risico op hart- en vaatziekten bij FH-patiënten behandeld met een statine is het niet mogelijk de bewijskracht te graderen.
Mortaliteit: Vanwege het ontbreken van gegevens over mortaliteit bij gebruik van een statine ter primaire preventie door FH-patiënten is het niet mogelijk om de bewijskracht te graderen.
Wat is de optimale behandeling van patiënten met familiaire hypercholesterolemie gelet op hun risico op hart- en vaatziekten?
Beschrijving studies
Navarese (2015) beschreef een systematische review en meta-analyse over de effectiviteit van PCSK9-antilichamen bij patiënten met FH. In de databases MEDLINE, Cochrane Central Register of Controlled Trials, Google Scholar, Embase en de websites van TCTMD, EuroPCR, ClinicalTrials.gov, Clinical Trial results, de PCSK9 Education and Research forum, American College of Cardiology Website en grote congresverslagen werd gezocht naar de volgende zoektermen: PCSK9 remmers, evolocumab, alirocumab, bococizumab, RCT en hypercholesterolemie.
Studies werden geïncludeerd wanneer het fase 2 of fase 3 RCT’s betroffen waarbij het gebruik van PCSK9-antilichamen werd vergeleken met geen PCSK9-antilichamen bij volwassenen met hypercholesterolemie die een of meerdere van de benoemde klinische uitkomstmaten rapporteerden. Primaire uitkomstmaten waren mortaliteit en cardiovasculaire mortaliteit. Secundaire uitkomstmaten waren myocardinfarct, instabiele angina, verhoogd serum creatine kinase concentratie en bijwerkingen. Primaire uitkomstmaten waren verandering in LDL-cholesterol en HDL-cholesterolconcentraties vanaf de baseline. Secundaire uitkomstmaten waren veranderingen in totale cholesterol en lipoproteïneconcentraties vanaf de baseline.
Er werden 24 studies geïncludeerd met in totaal 10159 patiënten, waarbij twaalf studies de resultaten van patiënten met FH, negen studies met non FH, twee studies statine-intolerante hypercholesterolemie en één studie met gemixte en non-familiare hypercholesterolemie patiënten beschreven. Vier studies worden niet beschreven, omdat de controlegroep geen statine ontvingen. Met andere woorden, de controlegroep kreeg geen standaardbehandeling.
Resultaten
Hart en vaatziekten & mortaliteit
Navarese (2015) heeft een meta-analyse uitgevoerd bij 24 studies, waarbij het overgrote deel van de geïncludeerde studies een laag aantal events voor de uitkomstmaat hart- en vaatziekten of mortaliteit heeft beschreven. Niet alle beschreven en geïncludeerde trials hadden voldoende power om hart- en vaatziekten of mortaliteit te detecteren. Daarnaast waren het aantal events per groep in trials met meer dan 500 patiënten niet groter dan 10. Het is daarmee lastig een conclusie te kunnen trekken over het risico op hart- en vaatziekten of mortaliteit. Daarom is besloten deze resultaten niet te presenteren.
LDL-C-verlaging
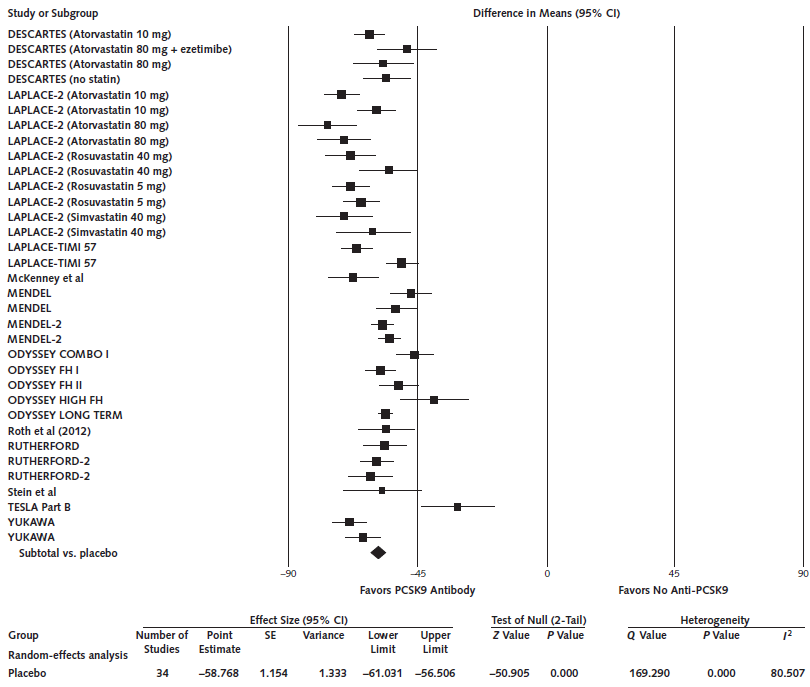
Het merendeel van de geïncludeerde trials uit Navarese (2015) heeft echter wel het effect op LDL-C gemeten. Ondanks dat dit indirect bewijs is voor het effect van PCSK9-antilichamen op hart- en vaatziekten, is deze uitkomstmaat beschreven. Navarese (2015) rapporteerde dat het gebruik van een PSCK9-antilichaam een reductie in het gemiddelde LDL-cholesterolconcentratie van bijna 60% liet zien vergeleken met placebo bovenop standaardbehandeling (gemiddelde verschil: - 58,8% 95%BI: - 61,0 tot -56,5).
Figuur 3 Meta-analyse van het effect van PSCK9-antilichamen op het LDL-C (in percentages) (Aangepast overgenomen uit Navarase, 2015)
FH-patiënten
Navarese (2015) includeerde niet alleen studies met FH-patiënten. Van de negen trials die PCSK9-antilichamen met placebo vergeleken en FH-patiënten includeerden, waren de resultaten vergelijkbaar met de trials met hyperlipidemie patiënten. Dus een behandeling met PCSK9-antilichamen verlaagt het LDL-C in FH-patiënten vergeleken met placebo.
Bewijskracht van de literatuur
Hart- en vaatziekten & mortaliteit: Vanwege een te lage power in de individuele trials en de meta-analyse (te laag totaalaantal events) was het niet mogelijk de bewijskracht te graderen.
LDL-C-verlaging: De bewijskracht voor de uitkomstmaat LDL-C-verlaging is met één niveau verlaagd vanwege extra polaarheid (bias ten gevolge van indirectheid: niet alleen FH-patiënten).
Zoeken en selecteren
Om de eerste uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is het risico op hart- en vaatziekten in patiënten met familiaire hypercholesterolemie?
Patiënten patiënten met familiaire hypercholesterolemie;
Moment start met statine ter primaire preventie;
Uitkomst hart- en vaatziekten, mortaliteit;
Periode tien-jaar risico en ‘lifetime risk’ risico, hart- en vaatziektevrije overleving.
Om de tweede uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de effectiviteit van een behandeling met een PCSK9-antilichamen bij patiënten met FH die hun streefwaardes niet halen bij een behandeling met een statine met of zonder ezetimibe?
P FH-patiënten onder standaardbehandeling die hun streefwaardes niet halen;
I PCSK9-antilichamen bovenop standaardbehandeling (statine met of zonder ezetimibe);
C standaardbehandeling (statine met of zonder ezetimibe);
O hart- en vaatziekten, mortaliteit.
Relevante uitkomstmaten
De werkgroep achtte hart- en vaatziekten voor de besluitvorming kritieke uitkomstmaten.
Hart- en vaatziekten: Gebaseerd op de SCORE-tabel uit de CVRM-richtlijn kan men een absoluut 10-jaarsrisico voor hart- en vaatziekten van ten minste 20% als klinisch relevant benoemen. Echter, deze tabel combineert het resultaat van verschillende risicofactoren voor het bepalen van het risico. Een enkele risicofactor, in dit geval gecombineerde dyslipidemie, die een bijdrage van ten minste 5% aan het absoluut 10-jaarsrisico heeft, wordt als een klinisch (patiënt) relevant risico benoemd.
Mortaliteit: Gebaseerd op de SCORE-tabel uit de CVRM-richtlijn kan men een absoluut 10-jaarsrisico voor mortaliteit van ten minste 10% als klinisch relevant benoemen. Echter, deze tabel combineert het resultaat van verschillende risicofactoren voor het bepalen van het risico. Een enkele risicofactor, in dit geval gecombineerde dyslipidemie, die een bijdrage van ten minste 1% aan het absoluut 10-jaarsrisico heeft, wordt als een klinisch (patiënt) relevant risico benoemd.
Welke streefwaarden van welke lipiden en/of (apo)lipoproteïnen moet gehandhaafd worden voor het instellen van behandeling bij preventie in patiënten met familiaire hypercholesterolemie?
Tienjaarsrisico op hart- en vaatziekten of mortaliteit onder behandeling van statine.
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase en de Cochrane Library is met relevante zoektermen gezocht naar observationele studies of systematische reviews van observationele studies. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 517 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: observationele studies van FH-patiënten waarbij het risico op hart- en vaatziekten of mortaliteit was berekend. Op basis van titel en abstract werden in eerste instantie 66 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 64 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 2 studies definitief geselecteerd.
(Resultaten)
Twee onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Wat is de optimale behandeling van patiënten met familiaire hypercholesterolemie gelet op hun risico op hart- en vaatziekten?
Effectiviteit van PCSK9-antilichamen
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is met relevante zoektermen gezocht naar systematische reviews en RCT’s. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 115 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische reviews met een gedocumenteerde zoekstrategie, evidence-tabellen en beoordeling van het risico op bias en RCT’s naar de effectiviteit van PCSK9-antilichamen bij FH-patiënten die onder standaardbehandeling hun streefwaardes niet halen. Op basis van titel en abstract werden in eerste instantie 15 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 14 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en één studie definitief geselecteerd.
Resultaten
Eén onderzoek is opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Catapano AL, Graham I, De Backer G, et al. 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias: The Task Force for the Management of Dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS) Developed with the special contribution of the European Assocciation for Cardiovascular Prevention & Rehabilitation (EACPR). Atherosclerosis. 2016;253:281-344. doi: 10.1016/j.atherosclerosis.2016.08.018.
- Genest J, Hegele RA, Bergeron J, et al. Canadian Cardiovascular Society position statement on familial hypercholesterolemia. Can J Cardiol. 2014;30(12):1471-81. doi: 10.1016/j.cjca.2014.09.028. Epub 2014 Oct 2.
- Mohrschladt MF, Westendorp RG, Gevers Leuven JA, Smelt AH. Cardiovascular disease and mortality in statin-treated patients with familial hypercholesterolemia. Atherosclerosis. 2004 Feb;172(2):329-35.
- Mundal L, Sarancic M, Ose L, et al. Mortality among patients with familial hypercholesterolemia: a registry-based study in Norway, 1992-2010. J Am Heart Assoc. 2014;3(6):e001236. doi: 10.1161/JAHA.114.001236.
- Navarese EP, Kolodziejczak M, Schulze V, Gurbel PA, Tantry U, Lin Y, Brockmeyer M, Kandzari DE, Kubica JM, D'Agostino RB Sr, Kubica J, Volpe M, Agewall S, Kereiakes DJ, Kelm M. Effects of Proprotein Convertase Subtilisin/Kexin Type 9 Antibodies in Adults With Hypercholesterolemia: A Systematic Review and Meta-analysis. Ann Intern Med. 2015 Jul 7;163(1):40-51. doi: 10.7326/M14-2957.
- NICE quality standard 41. Familial Hypercholesterolemia. Aug 2013. Website: https://www.nice.org.uk/guidance/qs41, accessed on 2 September 2016.
- Piepoli MF, Hoes AW, Agewall S, et al; Authors/Task Force Members. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts) Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur Heart J. 2016;37(29):2315-81. doi: 10.1093/eurheartj/ehw106. Epub 2016 May 23.
- Pijlman AH, Huijgen R, Verhagen SN, et al. Evaluation of cholesterol lowering treatment of patients with familial hypercholesterolemia: a large cross-sectional study in The Netherlands. Atherosclerosis. 2010;209(1):189-94. doi: 10.1016/j.atherosclerosis.2009.09.014. Epub 2009 Sep 15.
- Reiner Z, Catapano AL, De Backer G, et al; ESC Committee for Practice Guidelines (CPG) 2008-2010 and 2010-2012 Committees. ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Eur Heart J. 2011;32(14):1769-818. doi: 10.1093/eurheartj/ehr158. Epub 2011 Jun 28.
- Sabatine MS, Giugliano RP, Keech AC, Honarpour N, Wiviott SD, Murphy SA, Kuder JF, Wang H, Liu T, Wasserman SM, Sever PS, Pedersen TR; FOURIER Steering Committee and Investigators. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med. 2017 May 4;376(18):1713-1722. doi: 10.1056/NEJMoa1615664. Epub 2017 Mar 17.
- Versmissen J, Oosterveer DM, Yazdanpanah M, Defesche JC, Basart DC, Liem AH, Heeringa J, Witteman JC, Lansberg PJ, Kastelein JJ, Sijbrands EJ. Efficacy of statins in familial hypercholesterolaemia: a long term cohort study. BMJ. 2008 Nov 11;337:a2423. doi: 10.1136/bmj.a2423.
- Walma EP, Visseren FL, Jukema JW, et al. [The practice guideline 'Diagnosis and treatment of familial hypercholesterolaemia' of the Dutch Health Care Insurance Board]. Ned Tijdschr Geneeskd. 2006;150(1):18-23. Dutch.
- Wendelhag I, Wiklund O, Wikstrand J. On quantifying plaque size and intima-media thickness in carotid and femoral arteries. Comments on results from a prospective ultrasound study in patients with familial hypercholesterolemia. Arterioscler Thromb Vasc Biol. 1996;16(7):843-50.
Evidence tabellen
PICO1
|
Study reference |
Study characteristics |
Patient characteristics |
Prognostic factor(s) |
Follow-up
|
Outcome measures and effect size |
Comments |
|
Versmissen, 2008 |
Type of study: Cohort study
Setting; 27 outpatient clinics
Country: The Netherlands
Source of funding: Non-commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: 1950 patients
Important prognostic factors2:
Men: 924 (47%) |
Statine treatment
|
Endpoint of follow-up: Coronary heart disease
For how many participants were no complete outcome data available? N = 196 (10%) Reasons: Missing data or loss to follow-up |
Defined as the first onset of coronary heart disease and stratified by statin treatment yes or no
Estimates were displayed in a Kaplan-Meier curve.
Not reported
|
|
|
Mohrschladt, 2004 |
Type of study: Cohort study
Setting: Lipid clinic of a University hospital
Country: The Netherlands
Source of funding: Non-commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 417 (214 primary prevention, 131 secondary prevention and 55 non-treated) Control: general population
Important prognostic factors2: Described by group: Age mean (range): Primary: 44 (15-66) Secondary: 54 (28-72) Non-treated: 21 (38%)
Sex: Primary: 40% M Secondary: 64% M Non-treated: 38% M
Groups comparable at baseline? Not applicable, compared to general population |
Statine treatment |
Endpoint of follow-up: Cardiovascular disease
For how many participants were no complete outcome data available? Intervention: N = 17 (4%) Reasons: 3 lost to follow-up, three refused participation, and 11 non responder to the questionnaire.
|
Defined as the first onset of cardiovascular disease and stratified by sex or age
Estimates were displayed in a Kaplan-Meier curve.
Not reported
|
*The patients were classified into two groups: (1) without clinical manifestations of CVD (and without a history of CVD) as the “the primary prevention group” and, (2) with clinical manifestations of CVD (or with a history of CVD prior to intake) as the “secondary prevention group”. |
|
Study reference
(first author, year of publication) |
Was there a representative and well-defined sample of patients at a similar point in the course of the disease?
(yes/no/unclear) |
Was follow-up sufficiently long and complete?
(yes/no/unclear) |
Was the outcome of interest defined and adequately measured?
(yes/no/unclear) |
Was the prognostic factor of interest defined and adequately measured?
(yes/no/unclear) |
Was loss to follow-up / incomplete outcome data described and acceptable?
(yes/no/unclear) |
Was there statistical adjustment for all important prognostic factors?
(yes/no/unclear) |
|
Versmissen, 2008 |
Yes. |
Yes. (mean 8.5 years) |
Yes |
Yes |
Yes |
Not applicable |
|
Mohrschladt, 2004 |
Unclear. Patients were referred to a University hospital. Unclear if patients were referred because of their suspected risk of CVD. |
Unclear. Total number of follow-up years known |
No |
No |
Yes |
Not applicable |
PICO2
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I)** |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Navarese (2016)
|
SR and meta-analysis of RCTs
Literature search up to April 2015
A: DESCARTES, 2014 B: GAUSS, 2012 C: GAUSS-2, 2014 D: LA PLACE 2, 2014 E: LA PLACE,- TIMI 57 F:Mc Kenny et al, 2012 G: ODYSSEY COMBO I, 2015 H: ODYSSEY COMBO II, 2014 I: ODYSSEY FHI, 2014 J: ODYSSEY FHII, 2014 K: ODYSSEY HIGH FH, 2014 L: ODYSSEY LONG TERM, 2015 M: ODYSSEY OPTIONS I, 2014 N: ODYSSEY OPTIONS II, 2014 O: Roth et al, 2012 P: RUTHERFORD, 2012 Q: RUTHERFORD-2, 2014 R: Stein et al, 2012 S: TESLA PART B, 2014 T: YUKUWA, 2014
Study design: All studies RCT phase 2 or 3
Setting and Country: Multicenter No information reported about individual studies
Source of funding: CRC 1116 Masterswitches in Myocardial Ischemia, German Research Council DFG
|
Inclusion criteria SR: Phase 2 or 3 RCT comparing PCSK9 antibodies with no PCSK9 antibody in adults with hypercholesterolemia
Exclusion criteria SR: Studies in which doses of PCSK9 antibodies were given that had not been used in phase 3 RCT
20 studies included
Important patient characteristics at baseline:
Population*: B: HC, statin-intolerant C: HC, statin-intolerant D: HC E: nFH F: FH G: HC H: HC I: HeFH J: HeFH K: HeFH L: HeFH and HC M: HC N: HC O: FH P: HeFH Q: HeFH R: HeFH S: HoFH T: HC
N, mean age A: N=111, 51.6 yrs N=383, 57.1 yrs N=218, 54.8 yrs N=189, 54.8 yrs B: N=65, 61.2 yrs C: N=307, 61.7 yrs D: N=1896, 59.8 yrs E: N=315, 62.6 yrs F: N=62, 56.6 yrs G: N=316, 63.0 yrs H: N=720, 64.9 yrs I/J: N=735, 52.4 yrs K: N=107, 50.6 yrs L: N=2341, 60.5 yrs M: N=112, 63.9 yrs N=94, 64.1 yrs N:N= 97, 61.3 yrs O: N=61, 56.4 yrs P: N= 112, 50.6 yrs Q: N=331, 51.2 yrs R: N=31, 54.2 yrs S: N=49, 31.0 yrs T: N=207, 60.8 yrs
Sex: A: 45.0 B: 40.6 C: 54.0 D: 54.3 E: 45.0 F: 58.6 G: 65.8 H: 73.6 I/J: 55.1 K: 54.2 L: 62.3 M: 57.1 71.3 N: 50.9 55.2 O: 37.5 P: 52.7 Q: 57.3 R: 71.0 T: 67.6
LDL-C at baseline (mmol/L (mg/dL) A: Intervention: 2.7 (104.2) Placebo: 2.7 (104) D: Intervention: 2.9 (109.7) Placebo: 2.8 (107.7) E: Intervention: 3.1 (119.8) Placebo: 3.2 (123.7) G: Intervention: 2.6 (100.2) Placebo: 2.7 (106.0) I//J: Intervention: 3.6 (139.7) Placebo: 2.6 (139.2) K: Intervention: 5.1 (196.3) Placebo:5.2 (201.0) L: Intervention: 3.2 (122.8) Placebo:3.2 (122.0) O: Intervention: 3.1 (121.2) Placebo: 3.3 (126.9) P: Intervention: 3.9 (150.8) Placebo: 3.1 (121.2) Q: Intervention: 4.1 (158.5) Placebo: 3.9 (150.8) R: Intervention: 3.8 (147.4) Placebo: 3.9 (151) S: Intervention: 9.2 (355.8) Placebo: 8.7 (336.4) T: Intervention: 3.6 (139.2) Placebo: 3.7 (143.1)
Groups comparable at baseline? Yes |
A: Evolocumab 420 mg Q4W B: Evolocumab 420 mg Q4W C: Evolocumab 140 mg Q2W and evolocumab 420 mg Q4W D: Evolocumab 140 mg Q2W and evolocumab 420 mg Q4W E: Evolocumab 140 mg Q2W and evolocumab 420 mg Q4W F: Alirocumab 150 mg Q2W G: Alirocumab 75 mg with potential up-titration to 150 mg Q2W H: Alirocumab 75 mg with potential up-titration to 150 mg Q2W I: Alirocumab 75 mg with potential up-titration to 150 mg Q2W J: Alirocumab 75 mg with potential up-titration to 150 mg Q2W K: Alirocumab 75 mg with potential up-titration to 150 mg Q2W L: Alirocumab 150 mg Q2W M: Alirocumab 150 mg Q2W N: Alirocumab 75 mg with potential up-titration to 150 mg Q2W O: Alirocumab 150 mg Q2W P: Evolocumab 420 mg Q4W Q: Evolocumab 140 mg Q2W and evolocumab 420 mg Q4W R: Alirocumab 150 mg Q2W S: Evolocumab 420 mg Q4W T: Evolocumab 140 mg Q2W and 420 mg Q4W
|
A: Placebo B: Ezetimibe 10 mg C: Ezetimibe 10 mg D: Placebo and ezetimibe 10 mg E: Placebo F: Placebo G: Placebo H: Ezetimibe 10 mg I: Placebo J Placebo K: Placebo L: Placebo M: Ezetimibe 10 mg N: Ezetimibe 10 mg O: Placebo P: Placebo Q: Placebo R: Placebo S: Placebo T: Placebo
|
End-point of follow-up:
A: 52 wk B: 12 wk C: 12 wk D: 12 wk E: 12 wk F: 12 wk G: 52 wk H: 104 wk I: 78 wk J: 78 wk K: 52 – 78 wk L: 78 wk M: 24 wk N: 24 wk O: 8 wk P: 12 wk Q: 12 wk R: 12 wk S: 12 wk T: 12 wk
For how many participants were no complete outcome data available? No information reported about individual studies
|
Outcome measure-1 All cause-mortality, adjusted for follow-up
Effect measure: RR [95% CI]
Pooled effect inverse variance, fixed effects model: 0.48 [95% CI 0.27 to 0.85 favoring PCSK9 antibody Heterogeneity (I2): chi square = 5.75 (p=0.68); I2 = 0%
Outcome measure-2 Cardiovascular mortality, adjusted for follow-up
Effect measure: RR [95% CI]
Pooled effect inverse variance, fixed effects model: 0.49 [95% CI 0.23 to 0.1.07 favoring PCSK9 antibody Heterogeneity (I2): chi square = 4.71 (p=0.79); I2 = 0%
Outcome-measure 3 Low density lipoprotein cholesterol % of change from baseline
|
Conclusion
Limits of the study: - the results are derived from study-level data rather than patient-level data. -few studies have only been reported in abstract form
Level of evidence: GRADE: moderate, downgrading for less events
|
*HC=hypercholesterolemia, HeFH=heterozygous familial hypercholesterolemia, HoFH=homozygous familial hypercholesterolemia
**Q2W = every 2 weeks, Q4W = every 4 weeks
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/ notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/ unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Navarese (2015) |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etcetera)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur, jaar |
Reden |
|
PICO1 |
|
|
Reviewfilter |
|
|
Barkas, 2015 |
Onduidelijk op welke getallen de effectschatters zijn berekend; data uit 1 referentie is niet terug te vinden in het artikel (Mohrschladt, 2004) |
|
Narverud, 2014 |
Betreft kinderen |
|
Thompson, 2013 |
Gezocht in 1 database |
|
Luvai, 2012 |
Behandeling met rosuvastatin |
|
Vuorio, 2011 |
Narratieve review |
|
Nherera, 2010 |
Kosteneffectiviteit van hoog versus laag intensieve statine |
|
Oosterveer, 2009 |
Associatie tussen tendon xanthomas en het risico op HVZ |
|
Thompson, 2006 |
Effect van behandeling op het risico op HVZ |
|
Diverse designsfilter |
|
|
Tada, 2015 |
Alle patiënten hadden FH; aanwezigheid van coronary plaque burden als een voorspeller voor future coronary events |
|
Seguro, 2015 |
Betreft het hebben van hoge LDL-levels |
|
Pereira, 2015 |
Cross-sectionele studie met uitkomst PAD |
|
Lefort, 2015 |
Betreft een chirurgische behandeling in kinderen |
|
Mundal, 2014 |
SMR berekend; Noorse pop; risico voor HVZ niet berekend |
|
Besseling, 2014 |
Geen patiënten zonder FH geïncludeerd; risico van ernstige FH tov milde FH |
|
Alonso, 2014 |
Associatie tussen FH en Lp(a) als risicofactor |
|
Watts, 2012 |
Narratieve review |
|
Jarauta, 2012 |
Marker atherosclerose |
|
Versmissen, 2011 |
Populatie: FH-patiënten; associatie tussen een genotype en HVZ |
|
Raal, 2011 |
Populatie: FH-patiënten; effect van behandeling bij homozygote FH |
|
Nenseter, 2011 |
Populatie: FH-patiënten; associatie tussen Lp(a) levels en HVZ |
|
Mata, 2011 |
Cross-sectionele analyse |
|
Elis, 2011 |
Geen vergelijkende groep zonder FH; Risico op HVZ niet gerapporteerd |
|
Harada-Shiba, 2010 |
Geen vergelijkende groep zonder FH; risicofactoren voor age at first onset van CAD |
|
Claassen, 2010 |
Populatie: FH-patiënten; inschatting van het risico door patiënten |
|
Van der Net, 2009 |
Vergelijking met een gen; populatie FH-patiënten |
|
Guardamagna, 2009 |
Kinderen |
|
Neil, 2008 |
Populatie: FH-patiënten; risico op HVZ niet gerapporteerd |
|
Bouhali, 2008 |
Populatie: FH-patiënten; associatie tussen adiponectin en CAD risico |
|
Alonso, 2008 |
Populatie: FH-patiënten; cross-sectionele analyse; associatie tussen een mutatie en HVZ |
|
Souverein, 2007 |
Populatie: FH-patiënten; Associatie tussen mutatie en leeftijd van HVZ-event |
|
Skoumas, 2007 |
Populatie: FH of FCH-patiënten; cross-sectionele analyse |
|
Murase, 2007 |
Betreft verhoogd Lp(a) vergeleken met patiënten FH, non-FH hypercholestermia en patiënten met DM |
|
Nozue, 2006 |
Populatie: FH-patiënten; risicofactoren voor aortic stenosis |
|
Noto, 2006 |
Populatie: FH-patiënten; voorspellend vermogen van b-flow sonografie |
|
Kramer, 2006 |
Populatie: FH-patiënten; associatie met roken |
|
Neil, 2005 |
SMR berekend; UK pop; geen risico op HVZ berekend |
|
Holmes, 2005 |
Populatie: FH-patiënten; voorspeller Lp(a) levels |
|
Pitsavos, 2004 |
Populatie: FH-patiënten; voorspellers van HVZ |
|
Neil, 2004 |
Populatie: FH-patiënten; corss-sectionele analyse |
|
Jansen, 2004 |
Populatie: FH-patiënten; associatie met risicofactoren |
|
Wiegman, 2003 |
Kinderen |
|
Panagiotakos, 2003 |
Populatie: FH-patiënten; associatie met risicofactoren |
|
Neil, 2003 |
Populatie: FH-patiënten; zelfde als Neil, 2005 |
|
Huxley, 2003 |
Populatie: FH-patiënten; zelfde als Neil, 2005 |
|
De Sauvage Nolting, 2003 |
Populatie: FH-patiënten; cross-sectionele analyse |
|
Umans-Eckenhausen, 2002 |
Associatie tussen mutatie en CVD-risico |
|
De Sauvage Nolting, 2002 |
Populatie: FH-patiënten & effect van behandeling |
|
Austin, 2002 |
Vergelijking met PAF in twee populaties |
|
Real, 2001 |
Populatie: FH-patiënten; lipiden profiel in een selecte groep |
|
Dugi, 2001 |
Associatie tussen HL en CAD |
|
Wittekoek, 1999 |
Populatie: FH-patiënten; associatie tussen een mutatie en lipidenconcentraties |
|
Anonymous, 1999 |
Zelfde bronpopulatie als Neil, 2005 |
|
Rallidis, 1998 |
Populatie: FH-patiënten; frequentie van aortic stenose |
|
Gaudet, 1998 |
Case-control studie met FH-cases |
|
Sidhu, 1996 |
Populatie: FH-patiënten; associatie tussen risicofactoren en CAD |
|
Schmidt, 1996 |
Populatie: FH-patiënten; associatie tussen lipid deposition and duur en ernst FH |
|
Miida, 1996 |
Populatie: FH-patiënten; frequentie van CAD en het effect van behandeling |
|
Hausmann, 1996 |
Populatie: FH-patiënten; cross-sectionele analyse |
|
Bowden, 1994 |
Case-control studie met FH-cases |
|
Gaddi, 1991 |
Behandeling van FH |
|
Betteridge, 1991 |
Zelfde bronpopulatie als Neil, 2005 |
|
Anonymous, 1991 |
Zelfde studie als 422 |
|
Miettinen, 1988 |
Populatie: FH-patiënten; risicofactoren |
|
Kaste, 1988 |
Populatie: FH-patiënten en behandeling van FH |
|
PICO2 |
|
|
Soomro, 2016 |
Conference abstract (poster presentatie) |
|
Sattar, 2016 |
Alleen geïncludeerde studie Rutherford 2 (Raal, 2015) is juiste patiëntenpopulatie (FH); is geïncludeerd in Navarese, 2015 |
|
Sahebkar, 2016 |
Overlap studies inclusie Navarese, 2015 |
|
McDonagh, 2016 |
Niet systematisch gezocht |
|
White, 2015 |
Niet systematisch gezocht |
|
Della Badia, 2016 |
Niet systematisch gezocht en bevat inclusie studies in Navarese, 2015 |
|
Raal, 2015 |
Inclusie in Navarese, 2015 |
|
Raal, 2015 |
Inclusie in Navarese, 2015 |
|
Kastelein, 2015 |
Inclusie in Navarese, 2015 |
|
Stein, 2013 |
Acht patiënten in een open-label trial |
|
Sahebkar, 2013 |
Overlap met studies Navarese, 2015 |
|
Stein, 2012 |
Inclusie in Navarese, 2015 |
|
Raal, 2012 |
Inclusie in Navarese, 2015 |
|
Dias |
Niet juiste uitgangsvraag |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 03-04-2018
Beoordeeld op geldigheid : 03-04-2018
Deze richtlijn is geautoriseerd is door de in de werkgroep participerende partijen; daarnaast ligt deze richtlijn nog ter autorisatie voor bij de VKGN.
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep wel in stand gehouden. Het bestuur van de Nederlandse Internisten Vereniging bepaalt uiterlijk na de autorisatie van de multidisciplinaire richtlijn CardioVasculair RisicoManagement (CVRM) of de modules van deze richtlijn nog actueel zijn. Aangezien de richtlijn naar de huidige CVRM-richtlijn uit 2011 refereert, zal bij een herziene CVRM-richtlijn gecontroleerd moeten worden of de verwijzingen nog kloppen. De geldigheid van deze richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Internisten Vereniging is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van deze richtlijn is het bevorderen van een optimale diagnostiek en behandeling van patiënten met een (erfelijke) dyslipidemie. Door het optimaliseren van de diagnostiek en behandeling bij een (erfelijke) dyslipidemie wordt het risico op het krijgen van hart- en vaatziekten en de andere genoemde aandoeningen verkleind.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen van internisten, cardiologen en kinderartsen. Daarnaast is deze richtlijn bedoeld om zorgverleners die anderzijds betrokken zijn bij patiënten met (erfelijke) dyslipidemie te informeren, waaronder (kader)huisartsen, neurologen, vaatchirurgen, laboratoriumspecialisten klinische chemie, klinisch genetici/genetisch consulenten (klinische genetica), verpleegkundig specialisten hart- en vaatziekten en praktijkondersteuners.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met (erfelijke) dyslipidemie te maken hebben.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Professor dr. J. (Jacqueline) de Graaf, internist-vasculaire geneeskunde, werkzaam in het Radboudumc te Nijmegen, voorzitter, NIV
- Dr. J.E. (Jeanine) Roeters van Lennep, internist-vasculaire geneeskunde, werkzaam in het Erasmus MC te Rotterdam, voorzitter, NIV
- Professor dr. F.L.J. (Frank) Visseren, internist-vasculaire geneeskunde, werkzaam in het UMCU te Utrecht, NIV
- Dr. B.P.M. (Ben) Imholz, internist-vasculaire geneeskunde, werkzaam in het Elisabeth-TweeSteden Ziekenhuis te Tilburg, NIV
- Dr. J.J.J. (Jeroen) de Sonnaville, internist-endocrinoloog, werkzaam in het Tergooi Ziekenhuis te Hilversum, NIV
- Dr. P.E. (Petr) Jira, kinderarts, werkzaam in het Jeroen Bosch Ziekenhuis te ’s-Hertogenbosch, NVK
- Dr. A. (Anho) Liem, cardioloog, werkzaam in het Sint Franciscus Gasthuis te Rotterdam, NVVC
- Dr. T. (Talip) Tumkaya, huisarts, werkzaam in de Huisartsenpraktijk Parkhof te Maassluis, NHG
- H. (Hans) van Laarhoven, manager team collectieve belangenbehartiging, werkzaam bij de Hart&Vaatgroep te Den Haag, De Hart&Vaatgroep
Meelezers:
- J.M.H. (Annette) Galema-Boers, verpleegkundig specialist, werkzaam bij Erasmus MC te Rotterdam, NVHVV
- Dr. R.P. (Raoul) Kloppenborg, neuroloog, werkzaam bij het UMCU te Utrecht, NVN
- Dr. J.C. (Joep) Defesche, staflid Laboratorium voor Genoom diagnostiek, werkzaam bij het AMC te Amsterdam
- Dr. J. (Peter) van Tintelen, klinisch geneticus, werkzaam bij het AMC te Amsterdam, VKGN
- Dr. S. (Sjana) Kos, klinisch chemicus, werkzaam bij het Maasstadziekenhuis te Rotterdam, NVKC
- Dr. B.H.P. (Bernard) Elsman, chirurg, werkzaam bij het Deventer Ziekenhuis te Deventer, NVVH
- Dr. M.E. (Janneke) Wittekoek, cardioloog en medisch directeur Stichting LEEFH, werkzaam bij Heartlife Klinieken & Stichting LEEFH, StLEEFH
Met ondersteuning van:
- Dr. B.H. (Bernardine) Stegeman, adviseur, Kennisinstituut van Medisch Specialisten
- A. (Anouk) Rozeboom, MSc, junior adviseur, Kennisinstituut van Medisch Specialisten
- Ing. L.H.M. (Linda) Niesink-Boerboom, MSc, literatuurspecialist, Kennisinstituut van Medisch Specialisten
- S. (Samara) de Jong-Jaber, MSc, beleidsadviseur, Nederlandse Internisten Vereniging
- G.M. (Maike) van Leeuwen, beleid- en projectondersteuner, Nederlandse Internisten Vereniging
- N.F. (Natalia) Bullock, projectsecretaresse, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventueel belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
De Graaf |
|
Geen |
Ontwikkelaar van de ApoB-app (diagnostisch tool op basis van apoB) |
Geen opsteller aanbevelingen over het gebruik van de ApoB-app |
|
Roeters van Lennep |
Internist-vasculair geneeskundige |
|
|
Geen actie; Lomitapide wordt niet in de richtlijn besproken en lezingen zijn overschrijdend over de hele richtlijn. |
|
Visseren |
|
|
Deelname aan verschillende fase II en III multicenter klinische trials met PCSK9 monoklonale antilichamen of PCSK9 siRNA (Amgen, Sanofi, Pfizer), antisense apoB (GenZyme), antisense Lp(a) (ISIS) antisense apoCIII (ISIS).
|
Geen actie (PCSK9 monoklonale antilichamen: alleen betrokken bij patiënteninclusie; PCSK9 siRNA: nog niet beschikbaar en naar verwachting ook niet binnen twee jaar)
|
|
Imholz |
Internist-vasculair geneeskundige |
|
|
Geen actie; gemelde belangen zijn overschrijdend aan de gehele richtlijn |
|
De Sonnaville |
Internist-endocrinoloog |
Geen |
Geen |
Geen actie |
|
Jira |
Kinderarts |
Geen |
Geen |
Geen actie |
|
Liem |
|
|
|
Geen actie; gemelde belangen zijn overschrijdend aan de gehele richtlijn |
|
Tumkaya |
|
Geen |
Geen |
Geen actie |
|
Van Laarhoven |
|
Lid Raad van Toezicht LAREB (bestuurskostenvergoeding conform NVTZ)
|
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigde patiëntenvereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan De Hart&Vaatgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door De Hart&Vaatgroep, NHG en VIG (voorheen Nefarma) via invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitters en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ROBINS-I – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module 'Randvoorwaarden bij dyslipidemie'.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html. 2012.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten, 2015.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139.
Zoekverantwoording
|
PICO1 |
|
|
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) 1980 – oktober 2015 |
1 *Hyperlipoproteinemia Type II/ or (familial hypercholesterolemia or familial hypercholesterolaemia).ab,ti. (6401) 2 exp Cardiovascular Diseases/ or ((cardiovascular adj1 disease*) or stroke or (coronary artery adj1 disease*) or myocardial infarction).ab,ti. (2109455) 3 1 and 2 (2241) 4 limit 3 to (yr="1980 -Current" and (dutch or english)) (1895) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (253146) 6 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (2470983) 7 4 and 5 (30) 8 4 and 6 (393) 9 7 or 8 (421)
= 421 |
517 |
|
Embase |
'familial hypercholesterolemia'/exp/mj OR 'familial hypercholesterolemia':ab,ti OR 'familial hypercholesterolaemia':ab,ti
AND ('cardiovascular disease'/exp OR (cardiovascular NEAR/1 disease*):ab,ti OR stroke:ab,ti OR ('coronary artery' NEAR/1 disease*):ab,ti OR 'myocardial infarction':ab,ti)
AND [1980-2015]/py AND ([dutch]/lim OR [english]/lim)
Filters: AND ('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp)
AND ('clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR (cohort NEAR/1 (study OR studies)):ab,ti OR (case:ab,ti AND (control NEAR/1 (study OR studies)):ab,ti) OR (follow:ab,ti AND (up NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)):ab,ti OR (epidemiologic NEAR/1 (study OR studies)):ab,ti OR ('cross sectional' NEAR/1 (study OR studies)):ab,ti))
= 304 |
|
|
PICO2 |
|
|
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) 2005 - Juni 2016 |
exp Hyperlipoproteinemia Type II/ or (familial hypercholesterolemia or familial hypercholesterolaemia).ab,ti. and (pcsk9 or 'proprotein convertase subtilisin' or sar236553 or evolocumab or alirocumab).ab,ti. limit to (yr="2005 -Current" and (dutch or english))
Gebruikte filters: Systematische reviews: (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/))
RCTs: (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/)
= 81 (77 uniek) |
115 |
|
Embase (Elsevier) |
'familial hypercholesterolemia'/exp OR 'familial hypercholesterolemia':ab,ti OR 'familial hypercholesterolaemia':ab,ti AND pcsk9:ab,ti OR 'proprotein convertase subtilisin':ab,ti OR sar236553:ab,ti OR 'evolocumab'/exp OR 'alirocumab'/exp OR evolocumab:ab,ti OR alirocumab:ab,ti AND [2005-2016]/py AND ([dutch]/lim OR [english]/lim)
Gebruikte filters: Systematische reviews: 'meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de
RCTs: 'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti NOT 'conference abstract':it
= 52 (50 uniek) |

