Behandeling patiënten met verhoogd Lp(a)
Uitgangsvraag
Behandeling patiënten met verhoogd Lp(a).
Deelvragen
- Welke streefwaarden van lipiden en/of (apo)lipoproteïnen moet gehandhaafd worden voor het instellen van behandeling bij primaire en secundaire preventie in patiënten met verhoogd Lp(a)?
- Wat is de optimale behandeling van patiënten met verhoogd Lp(a) gelet op hun risico op hart- en vaatziekten?
Aanbeveling
Overweeg Lp(a) plasma concentratie te meten bij patiënten met onverklaarde premature hart- en vaatziekte of in de familie.
Overweeg Lp(a) plasma concentratie, indien beschikbaar, mee te wegen bij de behandeling van patiënten met:
- onverklaarde premature hart- en vaatziekte;
- FH;
- een positieve familieanamnese voor hart- en vaatziekte dan wel voor verhoogd Lp(a);
- recidiverende uitingen van hart- en vaatziekte ondanks optimale lipiden behandeling.
Overwegingen
Ofschoon het lastig blijft exact het tienjaarsrisico of lifetime risico op hart- en vaatziekten te formuleren, gaat men er ook in de ESC-richtlijnen van 2016 vanuit dat een hoge concentratie Lp(a) geassocieerd is met een verhoogd risico op hart- en vaatziekte. Het risico wordt verhoogd geacht bij een Lp(a) spiegel boven de 80ste percentiel (50 mg/dl) (Nordestgaard, 2010). Vooralsnog zijn normaalwaarden slechts beschikbaar van het Kaukasische ras. Het risico is verhoogd temeer daar er ook aanwijzingen zijn dat Lp(a) een causale rol speelt op grond van Mendelian randomization studies (Nordestgaard, 2010; Kamstrup, 2014; Kronenberg, 2013).
Op dit moment bestaat er echter geen rechtvaardiging om Lp(a) in de algemene bevolking als screenings instrument te gebruiken. Bepaling van Lp(a) kan overwogen worden bij patiënten met premature hart- en vaatziekte, bij patiënten met FH, een positieve familieanamnese voor hart- en vaatziekte dan wel voor verhoogd Lp(a), recidiverende uitingen van hart- en vaatziekte ondanks optimale lipiden behandeling en tot slot bij patiënten met >5% 10-jaars mortaliteit volgens de SCORE-tabel (Nordestgaard, 2010).
Er zijn geen RCT’s die hebben onderzocht of specifiek Lp(a)-verlaging tot een daling in het aantal cardiovasculaire events. In eerdere trials met nicotinezuur is naast vele andere effecten ook verlaging van Lp(a) geconstateerd zonder dat dit aanleiding heeft gegeven tot minder events (Seed, 1993). Hetzelfde geldt voor hormoonvervangende therapie. Ook PCSK9-antilichamen verlagen onder andere Lp(a) (Robinson, 2015; Sabatine, 2015). Er lopen thans onderzoeken met anti-sense middelen die specifiek Lp(a) remmen; resultaten hiervan zijn vooralsnog onbekend.
Onderbouwing
Achtergrond
Lipoproteïne (a) is een LDL-lipoproteïne een LDL-lipoproteïne met een geconjugeerd eiwit dat apolipoproteine kleine a (apo(a)) heet. Dit eiwit vertoont wat structuur betreft overeenkomsten met plasminogeen. Er wordt verondersteld dat de plasmaspiegel van Lp(a) vooral genetisch is bepaald en verandert vanaf volwassen leeftijd nauwelijks.
In de epidemiologische literatuur zijn vele onderzoeken gepubliceerd en in de loop van de tijd zijn wisselende adviezen verstrekt wanneer het zinvol is Lp(a) te bepalen. Recent zijn middels de ESC-richtlijnen Preventieadviezen verstrekt wanneer het zinvol is Lp(a) te bepalen in het kader van primaire en secundaire preventie. Aansluitend zijn er eveneens in recent uitgebrachte ESC-richtlijnen uitgewerkte adviezen gegeven die we verder zullen behandelen in onze overwegingen.
Conclusies / Summary of Findings
Hart- en vaatziekten
|
- GRADE |
Vanwege het ontbreken van kwantitatieve data is het niet mogelijk een conclusie te formuleren over het tienjaarsrisico of lifetime risico op hart- en ziekten bij verhoogd Lp(a).
Bronnen (Kamstrup, 2008; Suk Danik, 2006, Ohira, 2006; Price, 2001) |
Mortaliteit
|
- GRADE |
Vanwege het ontbreken van data is het niet mogelijk een conclusie te formuleren over mortaliteit bij verhoogd Lp(a). |
Samenvatting literatuur
Beschrijving studies
Kamstrup (2008) beschreef een prospectieve cohortstudie waarbij de voorspellende concentratie van een verhoogd Lp(a) op het risico van myocardinfarct en ischemische hartziekte in een algemene populatie werd bestudeerd. Deelnemers werden geïncludeerd in de periode 1991 – 1994 vanuit de Copenhagen City Heart Study wanneer er geen voorgeschiedenis van hart- en vaatziekten was en het Lp(a) werd na de steekproef bepaald. Exclusiecriteria werden niet gerapporteerd. De deelnemers werden tot ontstaan ischemische hartziekte (inclusief myocardinfarct), dood of tot het einde van de studie gevolgd. Ischemische hartziekte werd gedefinieerd als de gebeurtenis van een myocardinfarct of symptomen van angina pectoris gebaseerd op de locatie, karakter, pijnduur en relatie tussen pijn en beweging. Myocardinfarct werd gediagnosticeerd als er sprake was van ten minste twee van de volgende criteria: pijn op de borst, verhoogde cardiale symptomen of veranderingen op het ECG geïndiceerd voor een myocardinfarct. Absolute tien-jaar risico werden voor myocardinfarct en ischemische hartziekte berekend aan de hand van Lp(a)-concentratie, roken, hypertensie en leeftijd ouder of jonger dan 60 jaar.
Ohira (2006) beschreef een prospectieve cohortstudie waarbij de relatie tussen Lp(a) en de incidentie van ischemische beroerte werd onderzocht. Mannen en vrouwen werden in de leeftijd van 45 tot 64 jaar en zonder voorgeschiedenis van hart- en vaatziekten geïncludeerd die hadden deelgenomen aan de ARIC-studie tussen 1987 – 1989. Deelnemers werden geëxcludeerd wanneer ze niet Kaukasisch of Negroïde waren (N=103), met een missende Lp(a) concentratie (N=570), met een voorgeschiedenis van hart- en vaatziekten (N=713) of een voorgeschiedenis van beroerte (N=185) voor aanvang van de studie. 14.202 deelnemers werden voor analyse geïncludeerd. Bij de deelnemers werden Lp(a), totaalcholesterol, HDL en LDL-concentraties gemeten.
Deelnemers werden gevolgd om als uitkomstmaat de incidentie van ischemische beroerte te bepalen in 2002, waarbij de gemiddelde follow-up tijd 13,5 jaar (13,3 – 14,9 jaar) was. Kaplan Meier curves in een algemene populatie met een verhoogd Lp(a) werden weergegeven en gestratificeerd voor geslacht en ras.
Suk Danik (2006) beschreef een prospectieve cohortstudie om de associatie tussen Lp(a) en de incidentie van toekomstige cardiovasculaire events te bepalen bij gezonde vrouwen. 27.791 vrouwelijke deelnemers ouder dan 45 jaar afkomstig uit de Women Health Study werden tussen november 1992 tot juli 1995 geselecteerd en tien jaar gevolgd. Exclusiecriteria werden niet gerapporteerd.
Lp(a)-concentratie werd gemeten bij aanvang van de studie. De uitkomstmaat was het ontstaan van cardiovasculaire events, inclusief niet-fataal myocardinfarct, niet-fatale beroerte, coronaire re-vascularisatie en cardiovasculaire gerelateerde dood. Kaplan Meier curves werden weergegeven voor de incidentele cardiovasculaire events met Lp(a) groter, kleiner en gelijk aan het 90e percentiel en met of zonder familiegeschiedenis van cardiovasculaire ziekten voor de leeftijd van 60 jaar.
Resultaten
Hart- en vaatziekten
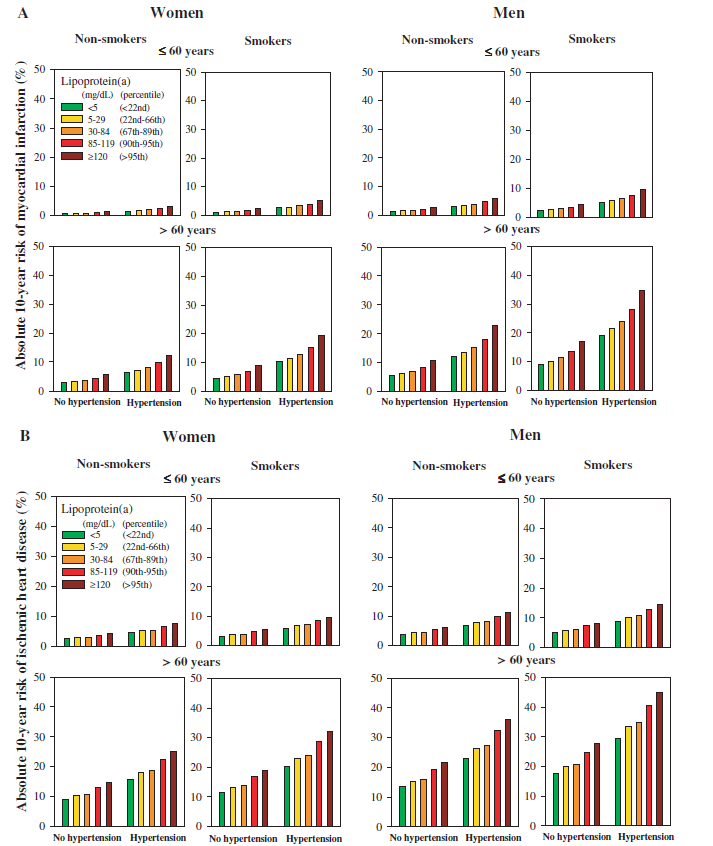
Kamstrup (2008) includeerde 9330 deelnemers, waarvan gedurende tien jaar 1142 deelnemers met een hartziekte werden gediagnosticeerd (waarvan 498 met een myocardinfarct). 8% was loss to follow-up. Kamstrup (2008) rapporteerde het 10 jaar risico op een myocardinfarct en op ischemische hartziekte (figuur 1). Uit dit figuur is af te leiden dat het risico op myocardinfarct of ischemische hartziekte toeneemt met een hogere Lp(a)-concentratie. Tevens is waar te nemen dat bij aanwezigheid van risicofactoren als geslacht, roken, hypertensie en hogere leeftijd het risico nog sterker stijgt met een hogere Lp(a)-concentratie. Ruwe data wordt echter niet in detail in het artikel gerapporteerd.
Figuur 1 Absolute tien jaarrisico op een myocardinfarct (A) en ischemische hartziekte (B) aan de hand van Lp(a), geslacht, roken, hypertensie en leeftijd (overgenomen uit Kamstrup, 2008)
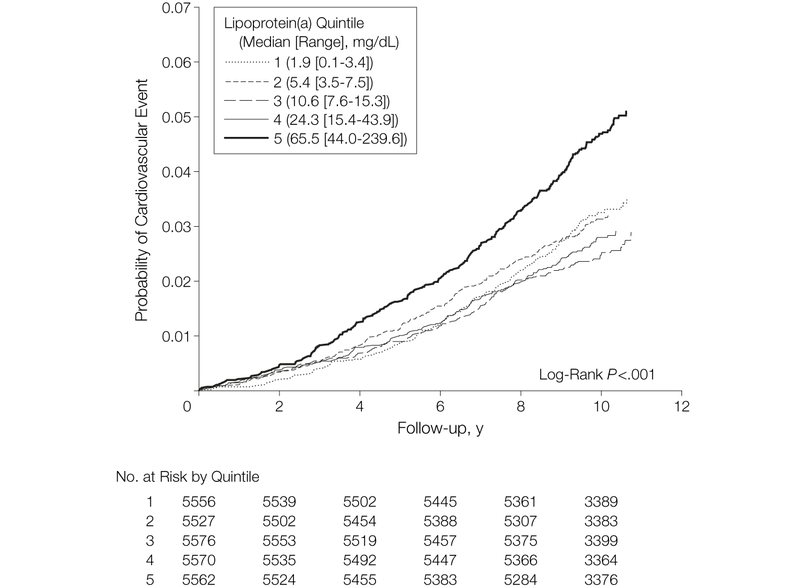
Suk Danik (2006) rapporteerde dat 899 vrouwen een cardiovasculair event ontwikkelden. Loss to follow-up is niet vermeld. Van alle vrouwen hadden 7345 (26,4 %) een verhoogd Lp(a)-concentratie ≥ 30 mg/dl. Uit figuur 2 is te observeren dat het risico op een cardiovasculair event hoger wordt naarmate de duur van follow-up stijgt. Daarnaast is de kans op een cardiovasculair event hoger bij een hogere Lp(a) concentratie. Afgeleid uit figuur 2 is het 10-jaarsrisico op een cardiovasculair event bij een mediaan van 65,5 mg/dl Lp(a) ongeveer 4 à 5%.
Figuur 2 Risico op cardiovasculair event aan de hand van Lp(a) bij gezonde vrouwen (overgenomen uit Suk Danik, 2006).
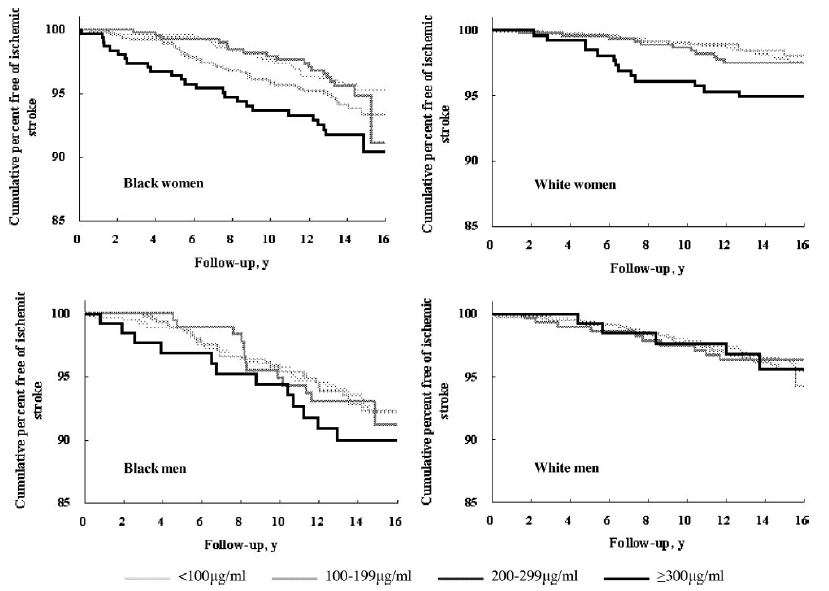
Ohira (2006) rapporteerde dat onder de 14221 deelnemers 83 incidentele hersenbloedingen en 496 ischemische beroertes voorkwamen. Een significant verschil in de Kaplan Meier curve (zie figuur 3) tussen Lp(a) en cumulatieve ischemische beroerte-vrije overleving werd gevonden voor Negroïde vrouwen (p=0,03) en Kaukasische vrouwen (p=0,0005), maar niet voor Negroïde mannen (p=0,69) en Kaukasische mannen (p=0,90).
Uit de grafiek is af te lezen dat de cumulatieve ischemische beroerte-vrije overleving afneemt naarmate de follow-up toeneemt en dat deze sterker afneemt bij een hogere Lp(a) concentratie.
Het tien- jaar risico voor Negroïde vrouwen varieert ongeveer tussen de 3 tot 7 %, bij Kaukasische vrouwen tussen 2 tot 4 %, bij Negroïde mannen tussen de 4 tot 6 % en bij Kaukasische mannen ongeveer 3 %. Opmerkelijk uit figuur 1 is dat er geen verschil is in het risico op een ischemische beroerte met toenemende Lp(a) concentratie bij blanke mannen. Een exact getal is niet te bepalen, omdat er geen ruwe data is gerapporteerd.
Vanwege het ontbreken van kwantitatieve data als ook het verschil in gerapporteerde hart- en vaatziekten als uitkomst is het niet mogelijk om de resultaten te poolen.
Figuur 3 Kaplan Meier grafiek met cumulatieve ischemische beroerte-vriie overleving in een algemene populatie met een verhoogd Lp(a) gestratificeerd door geslacht en ras (overgenomen uit Ohira, 2006)
Mortaliteit
Kamstrup (2008), Ohira (2006) en Suk Danik (2006) rapporteerden geen resultaten over de uitkomst mortaliteit.
Bewijskracht van de literatuur
Vanwege het ontbreken van kwantitatieve data is het niet mogelijk de bewijskracht over de uitkomstmaten hart- en vaatziekten en ziektevrije overleving te graderen.
Zoeken en selecteren
Om de eerste uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
Wat is het risico op hart- en vaatziekten in patiënten met verhoogd Lp(a)?
Patiënten patiënten met verhoogd Lp(a), gedefinieerd als hoger dan 0,30 g/l;
Moment diagnose;
Uitkomst hart- en vaatziekten, mortaliteit;
Periode tien-jaar risico en lifetime risico.
Om de tweede uitgangvraag te kunnen beantwoorden is gebruik gemaakt van zowel de recente Europese richtlijn CVD prevention in clinical practice (Piepoli, 2016) als de ESC/EAS-richtlijn Management of Dyslipidaemias (Catapano, 2016). Deze richtlijnen zijn zeer recent gepubliceerd en sluiten goed aan op de Nederlandse situatie.
Relevante uitkomstmaten
De werkgroep achtte hart- en vaatziekten en mortaliteit voor de besluitvorming kritieke uitkomstmaten.
Hart- en vaatziekten: Gebaseerd op de SCORE-tabel uit de CVRM-richtlijn kan men een absoluut 10-jaarsrisico voor hart- en vaatziekten van ten minste 20% als klinisch relevant benoemen. Echter, deze tabel combineert het resultaat van verschillende risicofactoren voor het bepalen van het risico. Een enkele risicofactor, in dit geval verhoogd Lp(a), die een bijdrage van ten minste 5% aan het absoluut 10-jaarsrisico heeft, wordt als een klinisch (patiënt) relevant risico benoemd.
Mortaliteit: Gebaseerd op de SCORE-tabel uit de CVRM-richtlijn kan men een absoluut 10-jaarsrisico voor mortaliteit van ten minste 10% als klinisch relevant benoemen. Echter, deze tabel combineert het resultaat van verschillende risicofactoren voor het bepalen van het risico. Een enkele risicofactor, in dit geval verhoogd Lp(a), die een bijdrage van ten minste 1% aan het absoluut 10-jaarsrisico heeft, wordt als een klinisch (patiënt) relevant risico benoemd.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) is met relevante zoektermen gezocht naar systematische reviews, meta-analyses en vergelijkende studies. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 437 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: observationele studies over verhoogd Lp(a) (>0,3 g/l) en het risico op cardiovasculaire ziekten vanaf 1990. Op basis van titel en abstract werden in eerste instantie 35 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 32 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en drie studies definitief geselecteerd.
Drie onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Catapano AL, Graham I, De Backer G, et al; Authors/Task Force Members.; Additional Contributor. 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias. Eur Heart J. 2016;37(39):2999-3058.
- Kamstrup PR, Benn M, Tybjaerg-Hansen A, et al. Extreme lipoprotein(a) levels and risk of myocardial infarction in the general population: the Copenhagen City Heart Study. Circulation. 2008;117(2):176-84. Epub 2007 Dec 17.
- Kamstrup PR, Tybjaerg-Hansen A, Nordestgaard BG. Elevated lipoprotein(a) and risk of aortic valve stenosis in the general population. J Am Coll Cardiol. 2014;63: 470477.
- Kronenberg F, Utermann G. Lipoprotein(a): resurrected by genetics. J Intern Med. 2013;273:630.
- Nordestgaard BG, Chapman MJ, Ray K, et al. Lipoprotein(a) as a cardiovascular risk factor: current status. Eur Heart J. 2010;31:28442853.
- Ohira T, Schreiner PJ, Morrisett JD, et al. Lipoprotein(a) and incident ischemic stroke: the Atherosclerosis Risk in Communities (ARIC) study. Stroke. 2006;37(6):1407-12. Epub 2006 May 4.
- Piepoli MF, Hoes AW, Agewall S, et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts) Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Atherosclerosis. 2016;252:207-74. doi: 10.1016/j.atherosclerosis.2016.05.037.
- Robinson JG, Farnier M, Krempf M, et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med. 2015;372:14891499.
- Sabatine MS, Giugliano RP, Wiviott SD, et al. Efficacy and safety of evolocumab in reducing lipids and cardiovascular events. N Engl J Med. 2015;727:15001509.
- Seed M, OConnor B, Perombelon N, et al. The effect of nicotinic acid and acipimox on lipoprotein(a) concentration and turnover. Atherosclerosis. 1993;101:6168.
- Suk Danik J, Rifai N, Buring JE, et al. Lipoprotein(a), measured with an assay independent of apolipoprotein(a) isoform size, and risk of future cardiovascular events among initially healthy women. JAMA. 2006;296(11):1363-70.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Prognostic factor(s) |
Follow-up
|
Outcome measures and effect size |
Comments |
|
Kamstrup, 2008 |
Type of study: Prospective cohort study
Setting: Onecenter, outpatients
Country: Denmark
Source of funding: Non-commercial |
Inclusion criteria: -Population of Copenhagen City Heart Study -Lipoprotein(a) levels determined shortly after sampling -no prior history of ischemic heart disease (IHD)
Exclusion criteria: Not reported
N=9330 Women: 57 % No event: 4743 MI: 220 IHD: 580 Men: 43 % No event: 3445 MI: 278 IHD: 562
Mean age ± SD: Women: No event: 57 (15) MI:69 (10) IHD: 69 (10) Men No event: 54 (15) MI:66 (11) IHD: 66 (11)
Sex: 43 % M/ 57 % F
Other important characteristics (confounders and effect modifiers): Lipoprotein(a), mg/dL Women No event: 18 (6-40) MI:24 (9-59) IHD:22 (9-64) Men: No event: 15 (5-37) MI:17 (6-45) IHD: 17 (6-41)
Total cholesterol, mmol/l Women No event: 6.2 (1.3) MI:7.0 (1.3) IHD:6.8 (1.3) Men: No event: 5.9 (1.2) MI:6.4 (1.2) IHD:6.3 (1.2)
LDL cholesterol, mmol/L Women No event: 3.8 (1.2) MI:4.4 (1.2) IHD: 4.3 (1.3) Men: No event: 3.6 (1.0) MI:4.0 (1.1) IHD:3.9 (1.1)
HDL cholesterol, mmol/L Women No event: 1.7 (0.5) MI: 1.6 (0.5) IHD: 1.7 (0.5) Men: No event: 1.4 (0.4) MI:1.3 (0.4) IHD:1.3 (0.4)
BMI, kg/m2 Women No event: 25 (5) MI:27 (5) IHD:27 (5) Men: No event: 26 (4) MI:27 (4) IHD: 27 (4)
Hypertension Women No event: 48.1% MI: 75.0 % IHD: 72.7 % Men: No event: 55.2 % MI: 81.2 % IHD: 76.5 %
Smokers Women No event: 45.6 % MI: 53.6 % IHD: 48.5 % Men: No event: 52.8 % MI:60.7 % IHD: 56.0 % |
Describe prognostic factor(s) and method of measurement: Patients were included who had lipoprotein levels determined after sampling.
All individuals were followed from baseline in 1991-1994 until the occurrence of IHD (including MI), death or beginning of 2004.
Two lipoprotein measurements were done and absolute 10 years risk by levels lipoprotein, hypertension no/yes, smoking no/yes and age ≤ 60 yrs and >60 yrs were estimated. |
Endpoint of follow-up: Occurrence of ischemic heart disease, death or start of 2004
For how many participants were no complete outcome data available? N (%): 8 %
Reasons for incomplete outcome data described? No determination of lipoprotein(a) levels and history of ischemic heart disease |
10 years risk: Absolute 10-years risk of myocardial infarction increased with increasing lipoprotein(a) levels , from women and men and with smoking, hypertension and increasing age. In men, absolute risk was 19 % and 35% respectively
|
Conclusion
Comments Absolute 10 years risk were not corrected for regression dilution bias and therefore underestimate risk estimates |
|
Suk Danik, 2006 |
Type of study: RCT
Setting: Outpatients, multicenter
Country: USA
Source of funding: National Heart, Long and Blood Institute |
Inclusion criteria: -Healthy women aged >45 yrs; participants from Women’s Health Study were enrolled between November 1992 and July 1995
Exclusion criteria: Not reported
N= 27 791
Mean age ± SD: 54.2 ± 7.1
Sex: Female
Other important characteristics (confounders and effect modifiers): Lp(a), median: 5th: 1.30 10th: 1.90 25th: 4.40 50th: 10.60 75th: 32.80 90th: 65.50 95th: 83.00 |
Describe prognostic factor(s) and method of measurement: Among the study participants , blood samples were stored and Lp(a) were measured.
Kaplan Meier curves were constructed for incident cardiovascular events with lipoprotein(a) levels at, above or less than 90th percentile and with or without a family history of myocard infarct in a parent before age of 60 yrs. |
Endpoint of follow-up: Follow-up prospectively for 10 yrs for occurrence of cardiovascular events and cardiovascular-related death
For how many participants were no complete outcome data available? Not reported
Reasons for incomplete outcome data described? Not reported |
There were 899 incident cardiovascular events during follow-up
Women in the highest quintile of Lp(a) were 1.47 times more likely to develop cardiovascular event, after adjustment for age, smoking, blood pressure, BMI, total cholesterol, HDL, diabetes, hormone use, C—reactive protein and randomization treatment groups.
|
Conclusion |
|
Ohira, 2006 |
Type of study: Prospective cross sectional study
Setting: Outpatients, multicenter
Country: USA
Source of funding: Non-commercial |
Inclusion criteria: Reported in ARIC study
Exclusion criteria: -Not white or black -Missing data Lp(a) on baseline - History of heart disease at baseline - History of stroke or TIA at baseline
N=14 221 -Lp(a) range (µg/ml) <100: N=9123 -Lp(a) range (µg/ml) 100 – 199: N=2914 -Lp(a) range (µg/ml) 200 -299: N=1342 -Lp(a) range (µg/ml) <≤ 300: N=842
Mean age: -Lp(a) range (µg/ml) <100: 54.0 -Lp(a) range (µg/ml) 100 – 199: 53.9 -Lp(a) range (µg/ml) 200 -299: 54.1 -Lp(a) range (µg/ml) <≤ 300: 54.0
Sex (% Male): -Lp(a) range (µg/ml) <100: M= 45.6 -Lp(a) range (µg/ml) 100 – 199: M= 43.3 -Lp(a) range (µg/ml) 200 -299: M=37.1 -Lp(a) range (µg/ml) <≤ 300: M=33.2
Other important characteristics (confounders and effect modifiers): BMI (kg/m2) -Lp(a) range (µg/ml) <100: 27.6 -Lp(a) range (µg/ml) 100 – 199: 27.7 -Lp(a) range (µg/ml) 200 -299: 27.7 -Lp(a) range (µg/ml) <≤ 300: 27.6
Current smoking (%) -Lp(a) range (µg/ml) <100: 26.3 -Lp(a) range (µg/ml) 100 – 199: 24.1 -Lp(a) range (µg/ml) 200 -299: 23.7 -Lp(a) range (µg/ml) <≤ 300: 25.5
LDL cholesterol (mg/dl) -Lp(a) range (µg/ml) <100: 132 -Lp(a) range (µg/ml) 100 – 199: 141 -Lp(a) range (µg/ml) 200 -299: 148 -Lp(a) range (µg/ml) <≤ 300: 159
HDL cholesterol (mg/dl) -Lp(a) range (µg/ml) <100: 52 -Lp(a) range (µg/ml) 100 – 199: 52 -Lp(a) range (µg/ml) 200 -299: 53 -Lp(a) range (µg/ml) <≤ 300: 53 |
Describe prognostic factor(s) and method of measurement:
Participants aged 45 – 64 yrs were included from ARIC study between 1987 and 1989.
Lp(a), total cholesterol, triglycerides, HDL and LDL were measured at baseline.
|
Endpoint of follow-up: Incidence of stroke in 2002 (average follow-up time 13.5 yrs (13.3 – 14.9))
For how many participants were no complete outcome data available? N = 1468
Reasons for incomplete outcome data described? - missing data Lp(a) on baseline: N=570 - History of heart disease at baseline: N=713 - History of stroke or TIA at baseline: N=185
|
Kaplan Meier plots shows for ischemic stroke were significantly different by Lp(a) level in black women (log-rank test, p =0.03) and white women (p=0.0005), but not black men (p=0.69) and white men (p=0.90)
|
Conclusion The authors conclude that a high Lp(a) concentration is associated with a higher incidence of ischemic stroke in black and with women, but not in men.
Limits |
|
Study reference
(first author, year of publication) |
Was there a representative and well-defined sample of patients at a similar point in the course of the disease?
(yes/no/unclear) |
Was follow-up sufficiently long and complete?
(yes/no/unclear) |
Was the outcome of interest defined and adequately measured?
(yes/no/unclear) |
Was the prognostic factor of interest defined and adequately measured?
(yes/no/unclear) |
Was loss to follow-up / incomplete outcome data described and acceptable?
(yes/no/unclear) |
Was there statistical adjustment for all important prognostic factors?
(yes/no/unclear) |
|
Kamstrup, 2008 |
Yes |
Yes |
Unclear (no raw data published) |
Unclear |
Yes |
No |
|
Suk Danik, 2006 |
Yes |
Unclear |
Unclear (no raw data published) |
Unclear |
No, not reported |
No |
|
Ohira, 2006 |
Yes |
Yes |
Unclear (no raw data published) |
Unclear |
Yes |
Yes |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Reviewfilter |
|
|
Genser, 2011 |
Geen 10-jaars risico of lifetime risico berekend, alleen de RR Geen informatie over individuele studies beschikbaar |
|
Nordestgaard, 2010 |
Narratieve review, mogelijk te gebruiken voor de overwegingen |
|
Ergou, 2009 |
Geen 10-jaars risico of lifetime risico berekend |
|
Smolders, 2007 |
Alleen als eindpunt beroerte beoordeeld; geen 10-jaars risico of lifetime risico gegeven |
|
RCT-filter |
|
|
Klingel, 2015 |
Geen 10-jaars risico of lifetime risico berekend |
|
Heigl, 2015 |
Geen 10-jaars risico of lifetime risico berekend |
|
Rosada, 2014 |
Vergelijking voor en na behandeling |
|
Li, 2014 |
Case-control studie; risico op HVZ kan niet worden afgeleid |
|
Khera, 2014 |
Subgroep analyses van een RCTs met een follow-up van mediaan twee jaar |
|
Gaudet, 2014 |
Effect van behandeling op Lp(a) levels |
|
Leebmann, 2013 |
Twee jaar follow-up |
|
Virani, 2012 |
Geen 10-jaars risico of lifetime risico berekend |
|
Gurdasani, 2012 |
Geen 10-jaars risico of lifetime risico berekend |
|
Stefanutti, 2010 |
RCT naar behandeling |
|
Solfrizzi, 2009 |
Geen 10-jaars risico of lifetime risico berekend |
|
Kamstrup, 2009 |
Geen 10-jaars risico of lifetime risico berekend |
|
Jaeger, 2009 |
Mogelijk over het effect van behandeling en ook geen algemene populatie |
|
Bennet, 2008 |
Geen 10-jaars risico of lifetime risico berekend |
|
Hong, 2005 |
Geen 10-jaars risico of lifetime risico berekend |
|
Gaw, 2005 |
Oudere patiënten >70 jaar |
|
Catena, 2003 |
Narratieve review |
|
Ariyo, 2003 |
Oudere patiënten >65 jaar |
|
Luc, 2002 |
Gaat om HDL |
|
Luc, 2002 |
Geen 10-jaars risico is berekend |
|
Dieplinger, 1999 |
Narratieve review |
|
Cantin, 1998 |
Geen 10-jaars risico of lifetime risico berekend |
|
Nguyen, 1997 |
Oude methode voor het vaststellen van Lp(a) levels |
|
Bostom, 1996 |
Oude methode voor het vaststellen van Lp(a) levels |
|
Assmann, 1996 |
Geen 10-jaars risico of lifetime risico is berekend |
|
Cremer, 1994 |
Geen 10-jaars risico of lifetime risico is berekend |
|
Ridker, 1993 |
Geen 10-jaars risico of lifetime risico is berekend |
|
Sigurdsson, 1992 |
Geen 10-jaars risico of lifetime risico is berekend |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 03-04-2018
Deze richtlijn is geautoriseerd is door de in de werkgroep participerende partijen; daarnaast ligt deze richtlijn nog ter autorisatie voor bij de VKGN.
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep wel in stand gehouden. Het bestuur van de Nederlandse Internisten Vereniging bepaalt uiterlijk na de autorisatie van de multidisciplinaire richtlijn CardioVasculair RisicoManagement (CVRM) of de modules van deze richtlijn nog actueel zijn. Aangezien de richtlijn naar de huidige CVRM-richtlijn uit 2011 refereert, zal bij een herziene CVRM-richtlijn gecontroleerd moeten worden of de verwijzingen nog kloppen. De geldigheid van deze richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Internisten Vereniging is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van deze richtlijn is het bevorderen van een optimale diagnostiek en behandeling van patiënten met een (erfelijke) dyslipidemie. Door het optimaliseren van de diagnostiek en behandeling bij een (erfelijke) dyslipidemie wordt het risico op het krijgen van hart- en vaatziekten en de andere genoemde aandoeningen verkleind.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen van internisten, cardiologen en kinderartsen. Daarnaast is deze richtlijn bedoeld om zorgverleners die anderzijds betrokken zijn bij patiënten met (erfelijke) dyslipidemie te informeren, waaronder (kader)huisartsen, neurologen, vaatchirurgen, laboratoriumspecialisten klinische chemie, klinisch genetici/genetisch consulenten (klinische genetica), verpleegkundig specialisten hart- en vaatziekten en praktijkondersteuners.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met (erfelijke) dyslipidemie te maken hebben.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Professor dr. J. (Jacqueline) de Graaf, internist-vasculaire geneeskunde, werkzaam in het Radboudumc te Nijmegen, voorzitter, NIV
- Dr. J.E. (Jeanine) Roeters van Lennep, internist-vasculaire geneeskunde, werkzaam in het Erasmus MC te Rotterdam, voorzitter, NIV
- Professor dr. F.L.J. (Frank) Visseren, internist-vasculaire geneeskunde, werkzaam in het UMCU te Utrecht, NIV
- Dr. B.P.M. (Ben) Imholz, internist-vasculaire geneeskunde, werkzaam in het Elisabeth-TweeSteden Ziekenhuis te Tilburg, NIV
- Dr. J.J.J. (Jeroen) de Sonnaville, internist-endocrinoloog, werkzaam in het Tergooi Ziekenhuis te Hilversum, NIV
- Dr. P.E. (Petr) Jira, kinderarts, werkzaam in het Jeroen Bosch Ziekenhuis te ’s-Hertogenbosch, NVK
- Dr. A. (Anho) Liem, cardioloog, werkzaam in het Sint Franciscus Gasthuis te Rotterdam, NVVC
- Dr. T. (Talip) Tumkaya, huisarts, werkzaam in de Huisartsenpraktijk Parkhof te Maassluis, NHG
- H. (Hans) van Laarhoven, manager team collectieve belangenbehartiging, werkzaam bij de Hart&Vaatgroep te Den Haag, De Hart&Vaatgroep
Meelezers:
- J.M.H. (Annette) Galema-Boers, verpleegkundig specialist, werkzaam bij Erasmus MC te Rotterdam, NVHVV
- Dr. R.P. (Raoul) Kloppenborg, neuroloog, werkzaam bij het UMCU te Utrecht, NVN
- Dr. J.C. (Joep) Defesche, staflid Laboratorium voor Genoom diagnostiek, werkzaam bij het AMC te Amsterdam
- Dr. J. (Peter) van Tintelen, klinisch geneticus, werkzaam bij het AMC te Amsterdam, VKGN
- Dr. S. (Sjana) Kos, klinisch chemicus, werkzaam bij het Maasstadziekenhuis te Rotterdam, NVKC
- Dr. B.H.P. (Bernard) Elsman, chirurg, werkzaam bij het Deventer Ziekenhuis te Deventer, NVVH
- Dr. M.E. (Janneke) Wittekoek, cardioloog en medisch directeur Stichting LEEFH, werkzaam bij Heartlife Klinieken & Stichting LEEFH, StLEEFH
Met ondersteuning van:
- Dr. B.H. (Bernardine) Stegeman, adviseur, Kennisinstituut van Medisch Specialisten
- A. (Anouk) Rozeboom, MSc, junior adviseur, Kennisinstituut van Medisch Specialisten
- Ing. L.H.M. (Linda) Niesink-Boerboom, MSc, literatuurspecialist, Kennisinstituut van Medisch Specialisten
- S. (Samara) de Jong-Jaber, MSc, beleidsadviseur, Nederlandse Internisten Vereniging
- G.M. (Maike) van Leeuwen, beleid- en projectondersteuner, Nederlandse Internisten Vereniging
- N.F. (Natalia) Bullock, projectsecretaresse, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventueel belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
De Graaf |
|
Geen |
Ontwikkelaar van de ApoB-app (diagnostisch tool op basis van apoB) |
Geen opsteller aanbevelingen over het gebruik van de ApoB-app |
|
Roeters van Lennep |
Internist-vasculair geneeskundige |
|
|
Geen actie; Lomitapide wordt niet in de richtlijn besproken en lezingen zijn overschrijdend over de hele richtlijn. |
|
Visseren |
|
|
Deelname aan verschillende fase II en III multicenter klinische trials met PCSK9 monoklonale antilichamen of PCSK9 siRNA (Amgen, Sanofi, Pfizer), antisense apoB (GenZyme), antisense Lp(a) (ISIS) antisense apoCIII (ISIS).
|
Geen actie (PCSK9 monoklonale antilichamen: alleen betrokken bij patiënteninclusie; PCSK9 siRNA: nog niet beschikbaar en naar verwachting ook niet binnen twee jaar)
|
|
Imholz |
Internist-vasculair geneeskundige |
|
|
Geen actie; gemelde belangen zijn overschrijdend aan de gehele richtlijn |
|
De Sonnaville |
Internist-endocrinoloog |
Geen |
Geen |
Geen actie |
|
Jira |
Kinderarts |
Geen |
Geen |
Geen actie |
|
Liem |
|
|
|
Geen actie; gemelde belangen zijn overschrijdend aan de gehele richtlijn |
|
Tumkaya |
|
Geen |
Geen |
Geen actie |
|
Van Laarhoven |
|
Lid Raad van Toezicht LAREB (bestuurskostenvergoeding conform NVTZ)
|
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigde patiëntenvereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan De Hart&Vaatgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door De Hart&Vaatgroep, NHG en VIG (voorheen Nefarma) via invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitters en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ROBINS-I – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module 'Randvoorwaarden bij dyslipidemie'.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html. 2012.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten, 2015.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) 1990 – mei 2016 |
*"Lipoprotein(a)"/ or (('lipoprotein a' or lipa or lpa) adj2 (increas* or elevat*)).ab,ti. and *Cardiovascular Diseases/ or ((cardiovascular adj1 disease*) or stroke or (coronary artery adj1 disease*) or myocardial infarction).ab,ti. limit to (yr="1990 -Current" and (dutch or english))
Gebruikte filters:Z (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/))
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies]
= 442 (437 uniek) |
437 |

