Behandeling van kinderen met FH
Uitgangsvraag
Wat is de optimale lipidenverlagende behandeling bij kinderen met FH?
Deelvragen
- Is er een indicatie om te starten met cholesterolverlagende medicatie in kinderen met erfelijke dyslipidemie?
- Wat is de optimale leeftijd om te starten met cholesterolverlagende medicatie in kinderen met erfelijke dyslipidemie?
Aanbeveling
Geef kinderen en ouders leefstijladviezen met betrekking tot beweging, gewicht, dieet en roken.
Overweeg te starten met statinebehandeling bij kinderen met heterozygote FH vanaf de leeftijd van 8-10 jaar.
Start met een lage dosering statine zoals 10 mg simvastatine, 10 mg pravastatine, 5 mg rosuvastine of 5 mg atorvastatine (halve tablet).
Streef naar LDL-C < 3,5 mmol/l.
Controleer de effectiviteit (LDL-C) en veiligheid (aanhoudende spierklachten, ASAT, ALAT (voor beide driemaal bovenconcentratie) en creatine kinase concentraties (vijfmaal bovenconcentratie)) bij kinderen met FH iedere 6 maanden en na goede instelling controle iedere 12 maanden.
Overwegingen
Kinderen hebben op basis van hun genetische aandoening vanaf de geboorte reeds een verhoogd LDL-C. Hoewel zij geen klachten hebben, is het wenselijk om op jonge leeftijd te starten met het verlagen van de LDL-C-concentratie en daarmee het verbeteren van het cardiovasculair risico op volwassen leeftijd.
Vuorio (2014) onderzocht acht RCT’s met in totaal 1074 kinderen (4-18 jaar). Statinetherapie is zeer effectief gebleken bij kinderen en kan op jonge leeftijd reeds een sterke verbetering geven van het lipidenprofiel. In tientallen trials en meta-analyses (Carreau, 2011; Vuorio, 2013; Vuorio, 2014; Braamskamp, 2015a) is, zoals eerder vermeld, bij kinderen onderzocht in hoeverre statinebehandeling bijwerkingen kan geven. Met name is onderzocht of kinderen tijdens de behandeling last hebben van (intermitterende) spierpijn, gastro-intestinale klachten, vermoeidheid, hoofdpijn of huidreacties. Bij kinderen leiden deze klachten in minder dan 2% van de gevallen tot het staken van de behandeling. Het percentage bijwerkingen is bij kinderen opmerkelijk lager dan bij volwassenen met FH die met statine worden behandeld (Braamskamp, 2015b). Bij kinderen is niet gebleken dat statinebehandeling de groei in lengte/gewicht of puberteitsontwikkeling negatief beïnvloedt (Braamskamp, 2015c).
Overwogen dient te worden om kinderen zonder klachten niet onnodig te belasten met medicatie en te medicaliseren door polikliniekbezoeken en bloedafnames. Bij ouders van kinderen met FH bestaat in het algemeen terughoudendheid om kinderen op jonge leeftijd reeds bloot te stellen aan medicatie. Bovendien zal eenmaal gestart de behandeling tot en met de volwassenleeftijd dienen te worden gecontinueerd. De rol van de arts is derhalve om met ouders van FH-kinderen in gesprek te blijven, uitleg te geven en met hen uitgebreid de voor- en tegenargumenten van medicamenteuze behandeling af te wegen. Ook als ouders niet direct instemmen met behandeling is het informeren van de kinderen en hun ouders een uitgelezen kans om eventueel op latere leeftijd alsnog een beslissing voor medicatie te nemen. Controles van BMI, bloeddruk, het bespreken van niet starten met roken, gezonde voeding, sportbeoefening en het vervolgen van de LDL-concentratie zijn daartoe belangrijke interventies.
Het vroeg opsporen en behandelen van kinderen die nog in de groei en ontwikkeling zijn heeft als voordeel dat de bespreking van lifestyle-adviezen, sportbeoefening, niet roken, streven naar een normale bloeddruk en BMI, normale gezonde voeding de bewustwording van cardiovasculair risico mogelijk maakt. Kinderen vanaf de leeftijd van 8 tot 10 jaar begrijpen de uitleg van hun aandoening en medicamenteuze behandeling en kunnen daarmee actief en bewust instemmen. Ouders zijn vaak gemotiveerd voor medicamenteuze behandeling daar het voor hen een mogelijkheid kan bieden om de gevolgen van de erfelijke aandoening (via vader of moeder doorgegeven) op reeds jonge leeftijd positief te beïnvloeden.
Bij kinderen met heterozygote FH zijn er voor de correctie van LDL-C en hoogte van streefwaarden geen harde eindpunten aan te geven, daar er zich bij kinderen onder de 18 jaar met heterozygote FH geen verschijnselen van hart- en vaatziekten voordoen. In enkele studies zijn intima-mediadikte concentraties van kinderen met FH vergeleken met leeftijdsgematchte controles of broers/zussen uit hetzelfde gezin zonder FH. Een meta-analyse (Narverud 2014) toonde in acht studies een duidelijk verschil aan in intima-mediadikte ten nadele van kinderen met FH in vergelijking met leeftijdgenoten zonder FH. Deze bevindingen versterken uiteraard het streven kinderen met FH op jonge leeftijd reeds te behandelen om naast verlaging van LDL-concentratie, de intima-mediadikte reeds op jonge leeftijd positief te beïnvloeden en daarmee het risico op hart en vaatziekten op latere leeftijd te verlagen. Er is ervaring met statinebehandeling bij kinderen vanaf 1993. De adviezen over de behandeling met betrekking tot start van de leeftijd en streefwaarden zijn expert opinions. Zowel in Europa als daarbuiten adviseert de Expert Consensus te streven naar een LDL-C <3,5 mmol/l (Kavey, 2006; Descamps, 2011; Martin, 2013; Wiegman, 2015; Watts, 2015).
Gestart dient te worden met een lage dosis statine om een LDL-C-streefwaarde <3,5 mmol/l te bereiken en eventueel op te hogen per 3-6 maanden met poliklinische controle van bijwerkingen, transaminase- en creatine kinaseconcentraties.
Wiegman, 2015 (namens de European Atherosclerosis Society Consensus Panel, 2015) onderschrijft naast het geven van leefstijladviezen het starten van statinebehandeling op de leeftijd van 8-10 jaar. Uit onderzoek is gebleken dat kinderen met FH een ongunstige LDL-C en intima-mediadikte hebben vergeleken met onaangedane broers of zussen (Braamskamp, 2015b; Braamskamp, 2015c).
Bij de behandeling van FH bij kinderen dient de winst van de behandeling altijd kritisch afgewogen te worden tegen de nadelen en bijwerkingen.
Onderbouwing
Achtergrond
FH is een veelvoorkomende genetische ziekte en zorgt bij aangedane individuen voor een verhoogd LDL-cholesterol vanaf de geboorte. FH is tevens een van de belangrijkste erfelijke dyslipidemieën onder kinderen. De start van de behandeling op jonge leeftijd is wenselijk om de levensverwachting op basis van het cardiovasculaire risico te normaliseren. Uiteraard moet de effectiviteit en veiligheid van therapie voor kinderen in verhouding staan met de gezondheidswinst. De afgelopen twee decennia is ervaring opgedaan met de behandeling van FH bij kinderen.
In Nederland zijn er geschat op een prevalentie van 1 op 240 ongeveer 13.000 kinderen met een heterozygote vorm van FH. Kinderen met een homozygote FH hebben door hun extreme lipiden-profiel een groot risico op hart en vaatziekten op relatief jonge leeftijd en dienen dan ook in een gespecialiseerd centrum behandeld te worden. Deze richtlijn richt zich op kinderen met heterozygote FH.
Conclusies / Summary of Findings
Cholesterolverlaging (LDL-C)
|
Hoog GRADE |
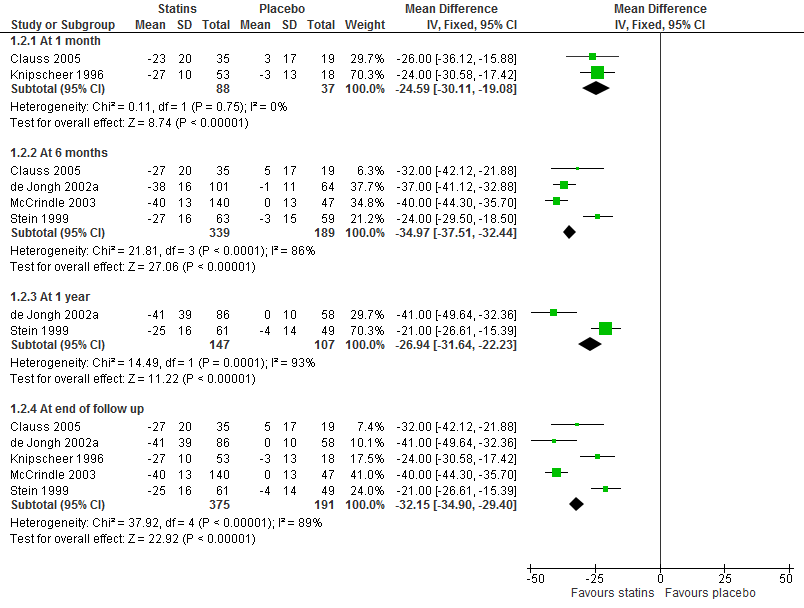
Behandeling met een statine bij patiënten met FH jonger dan 19 jaar leidt tot een klinisch relevante daling in LDL-C vergeleken met placebo. Gemiddeld is een daling in LDL-C tussen 25% en 36% geobserveerd.
Bronnen (Vuorio, 2014) |
Bijwerkingen
|
Laag GRADE |
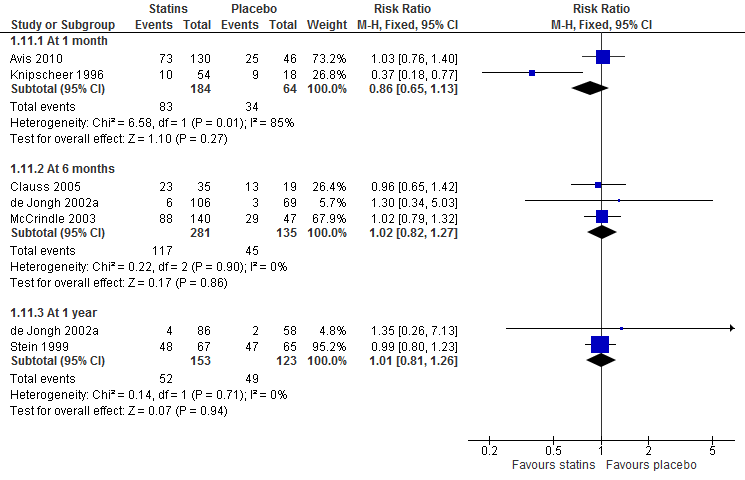
Het risico op bijwerkingen lijkt niet verhoogd te zijn bij behandeling met statine bij patiënten met FH jonger dan 19 jaar vergeleken met placebo.
Bronnen (Vuorio, 2014) |
Risico op hart- en vaatziekten
|
Laag GRADE |
Het risico op hart- en vaatziekten, gemeten met de marker intimamediadikte, is mogelijk verlaagd met een statine bij patiënten met FH jonger dan 19 jaar vergeleken met een placebo.
Bronnen (Vuorio, 2014) |
Samenvatting literatuur
Is er een indicatie om te starten met cholesterolverlagende medicatie in kinderen met erfelijke dyslipidemie?
Beschrijving studies
Vuorio (2014) ondernam een systematische zoekactie om de effectiviteit en veiligheid van statines bij kinderen met FH te bepalen. De auteurs hebben de Group’s Inborn Errors and Metabolism Trials Register en Medline tot oktober 2013 doorgezocht. Gerandomiseerd gecontroleerde trials met deelnemers tot 18 jaar oud bij de start van de studie waarbij een statine werd vergeleken met placebo of een dieet, kwamen in aanmerking. In totaal werden acht trials met 1074 deelnemers geïncludeerd. In alle geïncludeerde trials werd een statine (rosuvastatine, lovastatine, simvastatine, pravastatine of atorvastine) vergeleken met placebo. Twee trials hebben verschillende doseringen van een statine (rosuvastatine of pravastatine) onderzocht. Voor de huidige meta-analyse is de data van de verschillende tezamen genomen. Vier trials hebben de doseringen van een statine (lovastatine, simvastatine of atorvastatine) geleidelijk opgebouwd. Eén trial onderzocht simvastine in een vaste dosering (20mg) en één trial heeft de dosis van pravastatine laten afhangen van de leeftijd van de patiënt. De totale follow-up duur liep uiteen van zes tot 104 weken.
Resultaten
Cholesterolverlaging (LDL-C)
In figuur 1 zijn de resultaten gestratificeerd naar het meetmoment na het starten van de behandeling. Eén maand na starten met een statine of placebo was het gemiddeld verschil in percentuele afname van LDL-C 25% (-24,59% 95%BI: -30,11 tot -19,08) ten gunste van statine. Na zes maanden was het gemiddeld verschil -35% (-34,97% 95%BI: -37,51 tot -32,44) ten gunste van statine en na één jaar -27% (-26,94% 95%BI: -31,64 tot -22,23). De auteurs van de review hebben ervoor gekozen om de resultaten op het eind van de studie te poolen. Het verschil in follow-up tijd maakt het resultaat van deze analyse lastig te interpreteren.
Figuur 1 Meta-analyse van statine versus placebo op verandering in serum LDL-cholesterol (%) (overgenomen uit Vuorio, 2014)
Bijwerkingen
De resultaten wat betreft bijwerkingen zijn weergegeven in figuur 2. Ook deze resultaten zijn weergegeven per tijdsmoment na het starten van behandeling. Het effect op bijwerkingen na één maand is niet gelijk duidelijk. Eén trial rapporteerde geen verschil in het risico op een bijwerkingen tussen statine of placebo (RR 1,03 95%BI: 0,76 tot 1,40) en één trial rapporteerde een verlaagd risico op bijwerkingen (RR 0,37 95%BI: 0,18 tot 0,77). Vanwege deze discrepantie in resultaten is moeilijk om de gepoolde schatter te kunnen interpreteren. Na zes maanden rapporteerden drie trials geen verschil in het risico op een bijwerking tussen statine of placebo (RR 1,02 95%BI: 0,82 tot 1,27) en na één jaar was er ook geen verschil in het risico op een bijwerking (RR 1,01 95%BI: 0,81 tot 1,26). De trials rapporteerden echter niet om welke bijwerkingen het ging.
Figuur 2 Meta-analyse van statine versus placebo op het risico op een bijwerking (overgenomen uit Vuorio, 2014)
Risico op hart- en vaatziekten
Als marker voor het risico op hart- en vaatziekten is de verandering in intima-media dikte van de halsslagader genomen. Eén trial heeft na twee jaar intima-media dikte gemeten en vond een afname van 0,01 mm (95%BI: -0,03 tot -0,00) (figuur 3).
Figuur 3 Resultaat van statine versus placebo op verandering in intimamediadikte van de halsslagader (mm) (overgenomen uit Vuorio, 2014)

Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat bijwerkingen is met twee niveaus verlaagd gezien extrapoleerbaarheid (bias ten gevolge van indirectheid, onduidelijke om welke bijwerkingen het ging) en brede betrouwbaarheidsintervallen (imprecisie).
De bewijskracht voor de uitkomstmaat risico op hart- en vaatziekten is met twee niveaus verlaagd gezien het geringe aantal patiënten en brede betrouwbaarheidsintervallen (imprecisie).
Wat is de optimale leeftijd om te starten met cholesterolverlagende medicatie in kinderen met erfelijke dyslipidemie?
Er zijn geen systematische reviews, gerandomiseerde trials of observationele studies gevonden die voldeden aan de selectiecriteria.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
Is er een indicatie om te starten met cholesterolverlagende medicatie bij kinderen met erfelijke dyslipidemie?
P: kinderen met FH;
I: cholesterolverlagende medicatie;
C: afwachtend beleid, leefstijladviezen;
O: cholesterolverlaging, bijwerkingen, risico op hart- en vaatziekten.
Wat is de optimale leeftijd om te starten met cholesterolverlagende medicatie bij kinderen met erfelijke dyslipidemie?
P: kinderen met FH;
I: cholesterolverlagende medicatie (fibraten, niacine of statine) starten op leeftijd jonger dan 10 jaar;
C: cholesterolverlagende medicatie (fibraten, niacine of statine) starten op volwassen leeftijd 10 jaar of ouder;
O: cholesterolverlaging, bijwerkingen, risico op hart- en vaatziekten.
Relevante uitkomstmaten
De werkgroep achtte cholesterolverlaging en bijwerkingen voor de besluitvorming kritieke uitkomstmaten; en risico op hart- en vaatziekten voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Cholesterolverlaging: de werkgroep definieerde een daling van het LDL-C van ten minste 25% bij kinderen (jonger dan 18 jaar) als een klinisch (patiënt) relevant verschil.
Bijwerkingen: de werkgroep definieerde elke bijwerking die resulteert in het staken van medicamenteuze behandeling als een klinisch (patiënt) relevant verschil.
Risico op hart- en vaatziekten: Aangezien dat hart- en vaatziekten zelden voorkomen bij kinderen is het niet mogelijk om een klinisch (patiënt) relevant verschil te definiëren.
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase en de Cochrane Library is met relevante zoektermen gezocht naar systematische reviews, gerandomiseerde trials en observationele studies. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 407 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
Is er een indicatie om te starten met cholesterolverlagende medicatie in kinderen met erfelijke dyslipidemie?
- systematische review (gezocht in ten minste twee databases met een gedetailleerde zoekstrategie beschikbaar);
- gerandomiseerde trials of observationele studies waarbij cholesterolverlagende medicatie met afwachtend beleid werd vergeleken bij kinderen met FH.
Wat is de optimale leeftijd om te starten met cholesterolverlagende medicatie in kinderen met erfelijke dyslipidemie?
- systematische review (gezocht in ten minste twee databases met een gedetailleerde zoekstrategie beschikbaar);
- gerandomiseerde trials of observationele studies waarbij cholesterolverlagende medicatie bij kinderen jonger dan 10 jaar werd vergeleken met cholesterolverlagende medicatie bij kinderen van 10 jaar of ouder.
Op basis van titel en abstract werden in eerste instantie 12 potentiele systematische reviews voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 11 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en één review definitief geselecteerd. De auteurs van de geselecteerde review hebben een systematische zoekactie in oktober 2013 uitgevoerd. Vier potentiele studies waren gepubliceerd na deze datum, waarvan geen studie definitief geselecteerd werd voor een update van de review.
(Resultaten)
Is er een indicatie om te starten met cholesterolverlagende medicatie in kinderen met erfelijke dyslipidemie?
Eén onderzoek is opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Wat is de optimale leeftijd om te starten met cholesterolverlagende medicatie in kinderen met erfelijke dyslipidemie?
Geen onderzoek is opgenomen in de literatuuranalyse.
Referenties
- Braamskamp MJ, Hutten BA, Wiegman A. Early initiation of statin treatment in children with familial hypercholesterolaemia. Curr Opin Lipidol. 2015a;26(3):236-239.
- Braamskamp MJ, Kusters DM, Avis HJ, et al. Long-term statin treatment in children with familial hypercholesterolemia: more insight into tolerability and adherence. Paediatr Drugs. 2015b;17(2):159-66. doi: 10.1007/s40272-014-0116-y.
- Braamskamp MJ, Kusters DM, Wiegman A, et al. Gonadal steroids, gonadotropins and DHEAS in young adults with familial hypercholesterolemia who had initiated statin therapy in childhood. Atherosclerosis. 2015c;241(2):427-32. doi: 10.1016/j.atherosclerosis.2015.05.034.
- Carreau V, Girardet JP, Bruckert E. Long-term follow-up of statin treatment in a cohort of children with familial hypercholesterolemia: efficacy and tolerability. Paediatr Drugs. 2011;13(4):267-275.
- Descamps OS, Tenoutasse S, Stephenne X, et al. Management of familial hypercholesterolemia in children and young adults: consensus paper developed by a panel of lipidologists, cardiologists, paediatricians, nutritionists, gastroenterologists, general practitioners and a patient organization. Atherosclerosis. 2011;218:272-280.
- Kavey RE, Allada V, Daniels SR, et al; American Heart Association Expert Panel on Population and Prevention Science; American Heart Association Council on Cardiovascular Disease in the Young; American Heart Association Council on Epidemiology and Prevention; American Heart Association Council on Nutrition, Physical Activity and Metabolism; American Heart Association Council on High Blood Pressure Research; American Heart Association Council on Cardiovascular Nursing; American Heart Association Council on the Kidney in Heart Disease; Interdisciplinary Working Group on Quality of Care and Outcomes Research. Cardiovascular risk reduction in high-risk pediatric patients: a scientific statement from the American Heart Association Expert Panel on Population and Prevention Science; the Councils on Cardiovascular Disease in the Young, Epidemiology and Prevention, Nutrition, Physical Activity and Metabolism, High Blood Pressure Research, Cardiovascular Nursing, and the Kidney in Heart Disease; and the Interdisciplinary Working Group on Quality of Care and Outcomes Research: endorsed by the American Academy of Pediatrics. Circulation. 2006;114(24):2710-38. Epub 2006 Nov 27.
- Martin AC, Coakley J, Forbes DA, et al. Familial hypercholesterolaemia in children and adolescents: a new paediatric model of care. J Paediatr Child Health. 2013;49(4):E263-72. doi: 10.1111/jpc.12036. Epub 2012 Dec 16.
- Narverud I, Retterstøl K, Iversen PO, et al. Markers of atherosclerotic development in children with familial hypercholesterolemia: a literature review. Atherosclerosis. 2014;235(2):299-309. doi: 10.1016/j.atherosclerosis.2014.05.917. Epub 2014 May 20.
- Vuorio A, Docherty KF, Humphries SE, et al. Statin treatment of children with familial hypercholesterolemia--trying to balance incomplete evidence of long-term safety and clinical accountability: are we approaching a consensus? Atherosclerosis 2013;226(2):315-320.
- Vuorio A, Kuoppala J, Kovanen PT, et al. Statins for children with familial hypercholesterolemia. Cochrane Database Syst Rev. 2014;(7).
- Watts GF, Gidding S, Wierzbicki AS, et al. Integrated guidance on the care of familial hypercholesterolaemia from the International FH Foundation. Int J Cardiol. 2014;171(3):309-25. doi: 10.1016/j.ijcard.2013.11.025. Epub 2013 Nov 20.
- Wiegman A, Gidding SS, Watts GF, et al; European Atherosclerosis Society Consensus Panel. Familial hypercholesterolaemia in children and adolescents: gaining decades of life by optimizing detection and treatment. Eur Heart J. 2015;36(36):2425-37. doi: 10.1093/eurheartj/ehv157. Epub 2015 May 25.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Vuorio, 2014
[individual study characteristics deduced from Vuorio, 2014]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to October 2013
A: Avis, 2010 B: Clauss, 2005 C: Couture, 1998 D: de Jongh, 2002 E: Knipscheer, 1996 F: McCrindle, 2003 G: Stein, 1999 H: Wiegman, 2004
Study design: RCT A: Parallel RCT B: Parallel RCT C: Parallel RCT D: Parallel RCT E: Parallel RCT F: Parallel RCT G: Parallel RCT H: parallel RCT
Setting and Country: A: Netherlands, Canada, Norway, USA B: USA C: Canada D: Canada, Costa Rica, Netherlands, New Zealand, Norway E: Netherlands F: USA, Canada, Ireland, France, Spain, England, Sweden, Norway, South Africa G: USA, Finland H: Netherlands
Source of funding: A: Not stated B: Not stated C: Not stated D: Not stated E: Not stated F: Not stated G: Not stated H: Not stated
|
Inclusion criteria SR:
Eight studies included
Important patient characteristics at baseline:
N, mean age A: 177 patients, 10-17 yrs B: 54 patients, 11-18 yrs C: 63 patients, 8-17 yrs D: 175 patients, 10-17 yrs E: 72 patients, 8-16 yrs F: 187 patients, 10-17 yrs G: 132 patients, 11-17 yrs H: 214 patients, 8-18 yrs
Sex: A: 55% Male B: 0% Male C: 59% Male D: 57% Male E: 35% Male F: 69% Male G: 100% Male H: 47% Male
|
A: Rosuvastatin in 3 treatment arms:
B: Lovastatin 20mg daily for 4 weeks followed by 40mg till end of follow-up (n=35) C: Simvastatin 20mg daily (n=47) D: Simvastatin 40mg daily (n=101) Started with 10mg, doubled every 8 weeks up to 40 mg E: Pravastatin in 3 treatment arms (n=53):
F: Atorvastatin 10-20mg daily (n=140); median dose 20 mg, increased to 20mg if LDL-C ≥ 3.4 mmol/L at 4 weeks G: Lovastatin 40 mg in the evening (n=63); started with 10mg, increased to 20/40 mg at weeks 8/16 H: Pravastatin 20 to 40 mg daily in the evening depending on age (n=104)
|
A: Placebo (n=46)
B: Placebo (n=19)
C: Placebo (n=16)
D: Placebo (n=64)
E: Placebo (n=18)
F: Placebo (n=47)
G: Placebo (n=59)
H: Placebo (n=107)
|
End-point of follow-up:
A: 12 weeks B: 4 and 24 weeks C: 6 weeks D: 24 and 48 weeks E: 12 weeks F: 26 weeks G: 24 and 48 weeks H: 104 weeks
For how many participants were no complete outcome data available? A: Dropout: 2% Losses to follow up: 1% B: Dropout: 6% Losses to follow up: 6% C: Dropout: not stated Losses to follow up: 0% D: Dropout: 6% Losses to follow up: 6% E: Dropout: not stated Losses to follow up: 1% F: Dropout: 2% Losses to follow up: 0% G: Dropout: 8% Losses to follow up: 8% H: Dropout: 5% Losses to follow up: 1%
|
Outcome measure-1 Defined as cholesterol levels (LDL and total)
1.1 Change in serum LDL (%) Effect measure: mean difference [95% CI]: At 1 month B: -26.00 (-36.12 to -15.88) E: -24.00 (-30.58 to -17.42)
Pooled effect (fixed effects model): -24.59 [95% CI -30.11 to -19.08] favoring statins Heterogeneity (I2): 0%, p=0.75
At 6 months B: -32.00 (-42.12 to -21.88) D: -37.00 (-41.12 to -32.88) F: -40.00 (-44.30 to -35.70) G: -24.00 (-29.50 to -18.50)
Pooled effect (fixed effects model): -34.97 [95% CI -37.51 to -32.44] favoring statins Heterogeneity (I2): 86%, p<0.0001
At 1 year D: -41.00 (-49.64 to -32.36) G: -21.00 (-26.61 to -15.39)
Pooled effect (fixed effects model): -26.94 [95% CI -31.64 to -22.23] favoring statins Heterogeneity (I2): 93%, p<0.0001
1.2 Change in serum total cholesterol (%) Effect measure: mean difference [95% CI]: At 1 month B: -19.00 (-26.67 to -11.33) E: -18.00 (-23.10 to -12.90)
Pooled effect (fixed effects model): -18.31 [95% CI -22.55 to -14.06] favoring statins Heterogeneity (I2): 0%, p=0.83
At 6 months B: -27.00 (-34.67 to -19.33) D: -27.00 (-30.53 to -23.47) F: -29.00 (-32.48 to -25.52) G: -19.00 (-21.84 to -16.16)
Pooled effect (fixed effects model): -24.28 [95% CI -26.09 to -22.47] favoring statins Heterogeneity (I2): 87%, p<0.0001
At 1 year D: -32.00 (-35.61 to -28.39) G: -17.00 (-22.61 to -11.39)
Pooled effect (fixed effects model): -27.60 [95% CI -30.64 to -24.57] favoring statins Heterogeneity (I2): 95%, p<0.0001
Outcome measure-2 Defined as adverse events
Effect measure: RR [95% CI]: At 1 month A: 1.03 (0.76-1.40) E: 0.37 (0.18-0.77)
At 6 months B: 0.96 (0.65-1.42) D: 1.30 (0.34-5.03) F: 1.02 (0.79-1.32)
Pooled effect (fixed effects model): RR 1.02 [95% CI 0.82 to 1.27] Heterogeneity (I2): 0%, p=0.90
At 1 year D: 1.35 (0.26-7.13) G: 0.99 (0.80-1.23)
Pooled effect (fixed effects model): RR 1.01 [95% CI 0.81 to 1.26] Heterogeneity (I2): 0%, p=0.71
Outcome measure-3 Defined as the risk of CVD and measured as change in carotid intima-media thickness (mm)
Effect measure: mean difference [95% CI]: At 2 years H: -0.02 (-0.03 to 0.00) |
Facultative:
Author’s conclusion: Statin treatment is an efficient lipid-lowering therapy in children with FH. No safety issues were identified in the short term up to two years. Since statin treatment in children with FH is not acutely or sub-acutely a life-saving treatment, it is difficult to accept any clinically significant adverse events in this patient group. This treatment should be combined with a careful paediatric follow up.
None of the trials reported on the manner of allocation concealment.
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Outcome-1 1.1 LDL: HIGH 1.2 Total cholesterol: HIGH
Outcome-2: LOW Downgraded due to indirectness (unclear which adverse events were reported) and imprecision (confidence interval includes clinical relevant difference)
Outcome-3: LOW Downgraded due to imprecision (low number of participants and confidence interval includes zero)
|
|
Study reference
|
Appropriate and clearly focused question?1
|
Comprehensive and systematic literature search?2
|
Description of included and excluded studies?3
|
Description of relevant characteristics of included studies?4 |
Appropriate adjustment for potential confounders in observational studies?5
|
Assessment of scientific quality of included studies?6
|
Enough similarities between studies to make combining them reasonable?7 |
Potential risk of publication bias taken into account?8
|
Potential conflicts of interest reported?9
|
|
Vuorio, 2014 |
Yes |
Yes |
Yes |
Yes |
NA |
Yes |
Yes |
Yes |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etcetera)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Review filter |
|
|
Malhotra, 2014 |
Dieetinterventie |
|
Vuorio, 2010 |
Update van de review al geïncludeerd (Vuoria, 2014) |
|
Shafiq, 2010 |
Dieetinterventie |
|
Lebenthal, 2010 |
Streefwaarden in kinderen |
|
O’Gorman, 2009 |
Geïncludeerde trials zijn ook geïncludeerd in Cochrane review van Vuorio, 2014 |
|
Belay, 2009 |
Subgroepanalyse |
|
-, 2007 |
Erratum |
|
Vuorio, 2007 |
Update van review al geëxcludeerd (Vuoria, 2014) |
|
Shafiq, 2008 |
Recentere review al geïncludeerd |
|
Avis, 2007 |
Recentere review al geïncludeerd |
|
Arambepola, 2007 |
Recentere review al geïncludeerd |
|
RCTs |
|
|
Harada-Shiba, 2016 |
Geen controlegroep |
|
Kusters, 2015 |
Geen statine |
|
Kusters, 2014 |
Vergelijking tussen FH en non-FH siblings op cIMT |
|
Davidson, 2013 |
Betreft een behandeling met colesevelam |
|
Guardamagna, 2011 |
Geen statine |
|
Gandelman, 2011 |
Open-label trial; geen controlegroep |
|
Carreau, 2011 |
Geen vergelijkende groep; case series |
|
Stein, 2010 |
Geen statine |
|
Perry, 2010 |
Geen originele studie |
|
Avis, 2010 |
Reeds geïncludeerd in review van Vuorio, 2014 |
|
Yeste, 2009 |
Geen vergelijkende groep; caseseries |
|
Van der Graaf, 2008 |
Co-administratie van ezetimibe en simvastatine vergeleken met placebo |
|
Rodenburg, 2007 |
Voorspellers van IMT; data over starten op een jongere leeftijd is niet te interpreteren. |
|
Ferreira, 2007 |
FH vergeleken met patiënten zonder FH |
|
Van der Graaf, 2006 |
Geen vergelijkende groep |
|
Koeijvoets, 2005 |
Effect van mutatie op cholesterol levels |
|
Clauss, 2005 |
Reeds geïncludeerd in review van Vuorio, 2014 |
|
Wiegman, 2004 |
Reeds geïncludeerd in review van Vuorio, 2014 |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 03-04-2018
Beoordeeld op geldigheid : 03-04-2018
Deze richtlijn is geautoriseerd is door de in de werkgroep participerende partijen; daarnaast ligt deze richtlijn nog ter autorisatie voor bij de VKGN.
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep wel in stand gehouden. Het bestuur van de Nederlandse Internisten Vereniging bepaalt uiterlijk na de autorisatie van de multidisciplinaire richtlijn CardioVasculair RisicoManagement (CVRM) of de modules van deze richtlijn nog actueel zijn. Aangezien de richtlijn naar de huidige CVRM-richtlijn uit 2011 refereert, zal bij een herziene CVRM-richtlijn gecontroleerd moeten worden of de verwijzingen nog kloppen. De geldigheid van deze richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Internisten Vereniging is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van deze richtlijn is het bevorderen van een optimale diagnostiek en behandeling van patiënten met een (erfelijke) dyslipidemie. Door het optimaliseren van de diagnostiek en behandeling bij een (erfelijke) dyslipidemie wordt het risico op het krijgen van hart- en vaatziekten en de andere genoemde aandoeningen verkleind.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen van internisten, cardiologen en kinderartsen. Daarnaast is deze richtlijn bedoeld om zorgverleners die anderzijds betrokken zijn bij patiënten met (erfelijke) dyslipidemie te informeren, waaronder (kader)huisartsen, neurologen, vaatchirurgen, laboratoriumspecialisten klinische chemie, klinisch genetici/genetisch consulenten (klinische genetica), verpleegkundig specialisten hart- en vaatziekten en praktijkondersteuners.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met (erfelijke) dyslipidemie te maken hebben.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Professor dr. J. (Jacqueline) de Graaf, internist-vasculaire geneeskunde, werkzaam in het Radboudumc te Nijmegen, voorzitter, NIV
- Dr. J.E. (Jeanine) Roeters van Lennep, internist-vasculaire geneeskunde, werkzaam in het Erasmus MC te Rotterdam, voorzitter, NIV
- Professor dr. F.L.J. (Frank) Visseren, internist-vasculaire geneeskunde, werkzaam in het UMCU te Utrecht, NIV
- Dr. B.P.M. (Ben) Imholz, internist-vasculaire geneeskunde, werkzaam in het Elisabeth-TweeSteden Ziekenhuis te Tilburg, NIV
- Dr. J.J.J. (Jeroen) de Sonnaville, internist-endocrinoloog, werkzaam in het Tergooi Ziekenhuis te Hilversum, NIV
- Dr. P.E. (Petr) Jira, kinderarts, werkzaam in het Jeroen Bosch Ziekenhuis te ’s-Hertogenbosch, NVK
- Dr. A. (Anho) Liem, cardioloog, werkzaam in het Sint Franciscus Gasthuis te Rotterdam, NVVC
- Dr. T. (Talip) Tumkaya, huisarts, werkzaam in de Huisartsenpraktijk Parkhof te Maassluis, NHG
- H. (Hans) van Laarhoven, manager team collectieve belangenbehartiging, werkzaam bij de Hart&Vaatgroep te Den Haag, De Hart&Vaatgroep
Meelezers:
- J.M.H. (Annette) Galema-Boers, verpleegkundig specialist, werkzaam bij Erasmus MC te Rotterdam, NVHVV
- Dr. R.P. (Raoul) Kloppenborg, neuroloog, werkzaam bij het UMCU te Utrecht, NVN
- Dr. J.C. (Joep) Defesche, staflid Laboratorium voor Genoom diagnostiek, werkzaam bij het AMC te Amsterdam
- Dr. J. (Peter) van Tintelen, klinisch geneticus, werkzaam bij het AMC te Amsterdam, VKGN
- Dr. S. (Sjana) Kos, klinisch chemicus, werkzaam bij het Maasstadziekenhuis te Rotterdam, NVKC
- Dr. B.H.P. (Bernard) Elsman, chirurg, werkzaam bij het Deventer Ziekenhuis te Deventer, NVVH
- Dr. M.E. (Janneke) Wittekoek, cardioloog en medisch directeur Stichting LEEFH, werkzaam bij Heartlife Klinieken & Stichting LEEFH, StLEEFH
Met ondersteuning van:
- Dr. B.H. (Bernardine) Stegeman, adviseur, Kennisinstituut van Medisch Specialisten
- A. (Anouk) Rozeboom, MSc, junior adviseur, Kennisinstituut van Medisch Specialisten
- Ing. L.H.M. (Linda) Niesink-Boerboom, MSc, literatuurspecialist, Kennisinstituut van Medisch Specialisten
- S. (Samara) de Jong-Jaber, MSc, beleidsadviseur, Nederlandse Internisten Vereniging
- G.M. (Maike) van Leeuwen, beleid- en projectondersteuner, Nederlandse Internisten Vereniging
- N.F. (Natalia) Bullock, projectsecretaresse, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventueel belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
De Graaf |
|
Geen |
Ontwikkelaar van de ApoB-app (diagnostisch tool op basis van apoB) |
Geen opsteller aanbevelingen over het gebruik van de ApoB-app |
|
Roeters van Lennep |
Internist-vasculair geneeskundige |
|
|
Geen actie; Lomitapide wordt niet in de richtlijn besproken en lezingen zijn overschrijdend over de hele richtlijn. |
|
Visseren |
|
|
Deelname aan verschillende fase II en III multicenter klinische trials met PCSK9 monoklonale antilichamen of PCSK9 siRNA (Amgen, Sanofi, Pfizer), antisense apoB (GenZyme), antisense Lp(a) (ISIS) antisense apoCIII (ISIS).
|
Geen actie (PCSK9 monoklonale antilichamen: alleen betrokken bij patiënteninclusie; PCSK9 siRNA: nog niet beschikbaar en naar verwachting ook niet binnen twee jaar)
|
|
Imholz |
Internist-vasculair geneeskundige |
|
|
Geen actie; gemelde belangen zijn overschrijdend aan de gehele richtlijn |
|
De Sonnaville |
Internist-endocrinoloog |
Geen |
Geen |
Geen actie |
|
Jira |
Kinderarts |
Geen |
Geen |
Geen actie |
|
Liem |
|
|
|
Geen actie; gemelde belangen zijn overschrijdend aan de gehele richtlijn |
|
Tumkaya |
|
Geen |
Geen |
Geen actie |
|
Van Laarhoven |
|
Lid Raad van Toezicht LAREB (bestuurskostenvergoeding conform NVTZ)
|
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigde patiëntenvereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan De Hart&Vaatgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door De Hart&Vaatgroep, NHG en VIG (voorheen Nefarma) via invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitters en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ROBINS-I – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module 'Randvoorwaarden bij dyslipidemie'.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html 2012.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten, 2015.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) 1990 – februari 2016
|
(exp Child/ or exp Pediatrics/ or child*.ab,ti. or pediatr*.ab,ti. or paediatr*.ab,ti. or infant*.ab,ti.) AND (exp Hyperlipoproteinemia Type II/ or (familial adj1 hypercholesterol*).ab,ti.) AND (exp Anticholesteremic Agents/ or Hypolipidemic Agents/ or simvastatin/ or pravastatin/ or Lovastatin/ or rosuvastatin*.ab,ti. or fluvastatin*.ab,ti. or cerivastatin*.ab,ti. or pitavastatin*.ab,ti. or atorvastatin*.ab,ti. or ezetrol*.ab,ti. or fibrat*.ab,ti. or ciprofibrat*.ab,ti. or bezafibrat*.ab,ti. or gemfibrozil*.ab,ti. or colesevelam*.ab,ti. or (cholesterol adj1 lowering).ab,ti.) AND limit to (yr="1990 -Current" and (dutch or english))
= 249 |
407
|
|
Embase (Elsevier) |
'child'/exp OR 'pediatrics'/exp OR child*:ab,ti OR pediatr*:ab,ti OR paediatr*:ab,ti OR infant*:ab,ti AND ('familial hypercholesterolemia'/exp OR (familial NEXT/1 hypercholesterol*):ab,ti) AND ('hypocholesterolemic agent'/exp/mj OR 'statin (protein)'/exp/mj OR statin*:ab,ti OR simvastatin*:ab,ti OR pravastatin*:ab,ti OR rosuvastatin*:ab,ti OR lovastatin*:ab,ti OR fluvastatin*:ab,ti OR cerivastatin*:ab,ti OR pitavastatin*:ab,ti OR atorvastatin*:ab,ti OR ezetrol*:ab,ti OR fibrat*:ab,ti OR ciprofibrat*:ab,ti OR bezafibrat*:ab,ti OR gemfibrozil*:ab,ti OR colesevelam*:ab,ti OR 'antilipemic agent'/exp/mj OR (cholesterol NEXT/1 lowering):ab,ti OR 'nicotinic acid'/exp OR niacin*:ab,ti) AND ([dutch]/lim OR [english]/lim) AND [1990-2016]/py NOT 'conference abstract':it NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp)
= 343 |

