Postoperatieve radiotherapie bij epitheliale thymustumor, Masaoka-Koga stadium II en III, na volledige resectie
Uitgangsvraag
Is er een toegevoegde waarde van postoperatieve radiotherapie bij patiënten met een epitheliale thymustumor, Masaoka-Koga stadium II met volledige resectie?
Aanbeveling
Na een R0-resectie:
- Verricht bij stadium I en IIA bij voorkeur geen postoperatieve radiotherapie
- Overweeg bij stadium IIB en III wel postoperatieve radiotherapie uit te voeren
In de overweging kan histologisch type van de tumor worden meegenomen. Bij de agressievere subtypes kan eerder worden overgegaan op postoperatieve radiotherapie.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In deze uitgangsvraag hebben we gezocht naar literatuur die informatie geeft over het wel of niet verrichten van postoperatieve radiotherapie (PORT) bij patiënten met een epitheliale thymustumor, Masaoka-Koga stadium II met volledige resectie. In de literatuur komen alleen observationele studies naar voren, waar in sommige gevallen met propensity score matching is gewerkt om te corrigeren voor confounding factors. Uit de resultaten wordt de conclusie getrokken dat voor MK-stadium III de HR net onder de tevoren vastgestelde klinisch relevante grens van 0.7 ligt. Voor MK-stadium II ligt de HR nog iets lager, waarmee we concluderen dat er voor zowel stadium II als stadium III toegevoegde waarde is van PORT. Echter is de GRADE zeer laag. Voor de uitkomstmaat toxiciteit of complicaties is geen evidence gevonden.
In deze uitgangsvraag is data over stadium III ook meegenomen, waarmee in de aanbeveling hier een uitspraak over is gedaan. Dit is echter ook al standard of care.
In de literatuursamenvatting is een aantal artikelen niet uitgewerkt, omdat daar de stadia II en III werden samengevoegd met andere stadia (I samen met II en III samen met IV). In een observationele studie waarin 462 patiënten werden geëvalueerd werd een effect gezien van stadium op overall survival bij PORT, waarbij een lager stadium een mindere effectiviteit voorspelde van PORT dan een hoger stadium (Rimner, 2023). In een systematic review (Falkson, 2023) wordt een meta-analyse uitgevoerd van de effectiviteit van PORT op Overall Survival op deze twee groepen, waarbij de HR van PORT in stadium I-II boven de grens van 0.7 valt, en bij stadium III-IV eronder (zie figuur 11).
Figuur 11 Forest plots van de effectiviteit van PORT op OS bij stadium I-II en stadium III-IV
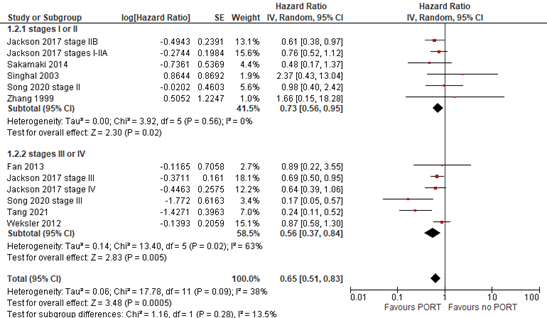
In één retrospectief observationeel onderzoek (Zhang, 2022) werd onderscheid gemaakt tussen stadium I-IIA, IIB en II-IV en gekeken naar overall survival na wel of geen PORT bij deze groepen. In deze observationele studie werden 2558 patiënten met zowel thymoom als thymuscarcinoom geïncludeerd en gematched met propensity scores. Uit de subgroepanalyses kwam naar voren dat bij thymomen er een toegevoegde waarde was van PORT op overall survival bij stadium IIB, en stadium III en IV. Bij thymuscarcinomen kwam alleen een significant voordeel van PORT op OS uit de data bij stadium IIB. Hiermee lijkt er een voorzichtige richting te kunnen worden gegeven aan het besluit om wel of niet postoperatieve radiotherapie toe te passen bij stadium II; bij stadium IIA lijkt er geen toegevoegde waarde, waar bij stadium IIB de toegevoegde waarde groter is.
Voor de uitkomst toxiciteit bestaat er een retrospectieve studie (Fernandes, 2010) waarin bij 1334 patiënten gekeken werd naar percentage cardiale mortaliteit van bestraalde versus niet-bestraalde patiënten met een maligne thymoom. Hier kwam geen verschil uit tussen deze twee groepen.
Op basis van de gevonden literatuur kan geen aanbeveling gedaan worden over de waarde van het WHO histologisch subtype thymoom bij de beslissing tot adjuvante bestraling.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Postoperatieve bestraling is een extra ingreep, die ook bijwerkingen met zich meebrengt. Om deze reden is het altijd belangrijk de voor- en nadelen van postoperatieve bestraling aan de patiënt voor te leggen, en duidelijk te zijn over de bijwerkingen, en de kans daarop. Het is op basis van de literatuur niet duidelijk wat het langetermijneffect is van eventuele bijwerkingen.
Kosten (middelenbeslag)
De aanbeveling neemt geen extra kosten met zich mee, omdat in de huidige praktijk wisselend wordt besloten over te gaan op postoperatieve bestraling.
Aanvaardbaarheid, haalbaarheid en implementatie
Deze aanbeveling zal naar verwachting niet tot meer bestralingen leiden. Hiermee zal de implementatie geen verwachte problemen met zich meebrengen.
Rationale van de aanbeveling: weging van argumenten voor en tegen de diagnostische procedure
Uit de literatuursamenvatting komt naar voren dat er voor stadium II wel degelijk een toegevoegde waarde is voor postoperatieve radiotherapie. Wanneer we naar meer studies kijken, lijkt het zo te zijn dat er onderscheid kan worden gemaakt tussen stadium IIA en IIB. Omdat er ook bijwerkingen zijn verbonden aan postoperatieve bestraling, wordt de aanbeveling wat conservatiever ingestoken; alleen bij stadium IIB wordt postoperatieve bestraling aanbevolen. Omdat de evidence nog niet van hoge kwaliteit is, formuleren we de aanbeveling voorzichtig.
Onderbouwing
Achtergrond
In de praktijk is de vraag of deze patiënten beter wel of niet bestraald moeten worden na een R0-resectie. Op het MDO komt naar voren dat hier tussen centra anders mee omgegaan wordt. Er bestaan systematic reviews/meta analyses over dit onderwerp. Specifiek is onze vraag: Moet je patiënten adjuvant bestralen met een epitheliale thymustumor, Masaoka-Koga stadium II, na volledige resectie? Nu worden factoren ook meegenomen, zoals leeftijd van patiënt, de cardiovasculaire status van de patiënt, ligging van de tumor ten opzichte van het hart, performance status/levensverwachting van de patiënt.
For the international exchange of this literature review, the next part is written in English.
Conclusies / Summary of Findings
Overall Survival
|
Very low GRADE |
The evidence is very uncertain about the effect of surgery plus postoperative radiotherapy (PORT) on Overall Survival when compared with surgery alone in adult patients with TET, MK stage II, with complete resection.
Source: Tateishi, 2021; Song, 2020 |
Overall Survival
|
– GRADE |
No evidence was found regarding the effect of surgery plus postoperative radiotherapy (PORT) on Toxicity when compared with surgery alone in adult patients with TET, MK stage II, with complete resection. |
Samenvatting literatuur
Description of studies
Tateishi (2021) systematically reviewed clinical evidence to assess whether postoperative radiotherapy (PORT) improves the survival of patients with Masaoka/Masaoka-Koga (M/MK) stages II or III completely resected thymomas. The literature search was performed as of June 12, 2020. Inclusion criteria were randomized clinical trials and observational studies that compared surgery alone with surgery plus PORT for M/MK stages II and III thymomas. From studies that included stage I or IV patients along with stage II/III patients, the data for the stage II/III subgroup were extracted. Other inclusion criteria were articles published as full reports, brief reports, or conference abstracts, regardless of their primary end point.
The systematic review excluded non-English reports. The primary and secondary end-points were overall survival and disease-free survival. In the analyses five observational studies were included. Two studies separately provided data on patients with stages II and III thymoma. Therefore, the meta-analysis includes seven independent comparisons. The authors report that the median age ranged from 50 to 60 years, and approximately one-third of the included patients had myasthenia gravis. For more details about the included studies, please see Tateishi (2021).
In the retrospective cohort study by Song (2020), the database of the Korean Association for Research on the Thymus (KART) was used to determine the efficacy of postoperative radiotherapy (PORT) in patients with thymomas, especially those with Masaoka-Koga (M-K) stages II and III disease. The database contains the electronic medical records of 1.663 patients that underwent surgery between January 2000 and December 2013, at four Korean hospitals. Exclusion criteria were patients with benign diseases, M-K stage I and IV thymomas, thymic carcinomas, or neuroendocrine carcinomas, and patients with missing data. For this study, 668 patients were eligible, and after propensity score matching 404 patients were included for the analyses. The PORT and non-PORT groups consisted both of 202 patients, of which 346 patients with stage II and 58 with stage III thymoma. After propensity score matching, the median age was 51.5 years in the non-PORT group and 50.0 years in the PORT group (P=0.420). Follow-up time was unclear. The article reports the outcomes overall survival and the recurrence free survival. For more details about the study, please see Song (2020).
Results
Overall Survival – Critical outcome:
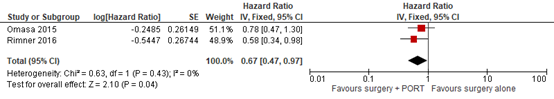
Five studies in the systematic review of Tateishi (2021) (Fan, 2013; Ruffini, 2014; Omasa, 2015; Rimner, 2016; Jackson, 2017) and the study of Soon (2020) reported the effect of surgery plus PORT on overall survival in observational cohorts. The pooled HR in the SR of Tateishi (2021) is 0.68 (95% CI 0.57 to 0.83) favoring the intervention group. However, for the stage II group the pooled HR is 0.63 (95% CI 0.44 to 0.91), and for the stage III group the pooled HR is 0.72 (95% CI 0.55 to 0.95). In Soon (2020) the HR of OS in stage II is 0.78 (95% CI 0.28 to 2.14), and 0.35 in stage III (95% CI 0.12 to 1.00).
When pooling the data, for stage II the HR is 0.65 (95% CI 0.46 to 0.91) favoring surgery plus PORT. For stage III, the HR is 0.69 (95% CI 0.53 to 0.90) favoring surgery plus PORT. For stage II and III combined, the HR is 0.67 (95% CI 0.47 to 0.97), favoring surgery plus PORT. The HR for all subgroup analyses exceeds the minimal clinically (patient) important difference of 0.7.
Figure 8 Forest plot for the Hazard ratio of OS – Stage II

Figure 9 Forest plot for the Hazard ratio of OS – stage III
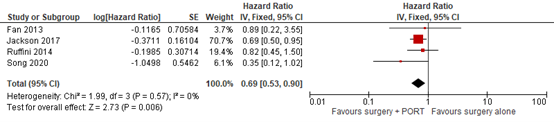
Figure 10 Forest plot for the Hazard ratio of OS – stages II and III combined
Toxicity – critical outcome
No studies were found reporting this outcome.
Level of evidence of the literature
Overall survival:
The level of evidence regarding the outcome measure OS started at low (due to the observational design of the included studies), and was downgraded by 1 level because of study limitations (risk of bias).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
P: adult patients with TET, Masaoka-Koga stage II, with complete resection;
I: postoperative radiotherapy/radiotherapy C: comparator test / diagnostic trajectory B;
C: no postoperative radiotherapy/postoperative radiotherapy;
O: survival (overall, progression-free survival rate at 6 months), (complications) toxicity.
Relevant outcome measures
The guideline development group considered survival as a critical outcome measure for decision making; and toxicity as an important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
Per outcome measure:
The working group defined a difference in OS of >5% or >3% and HR <0.7 as clinically relevant.
Search and select (Methods)
The databases Embase and Ovid/Medline were searched from January 2007 to November 2023 with relevant search terms. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 225 hits. Studies were selected based on the following criteria:
- The study population had to meet the criteria as defined in the PICO;
- The intervention and comparison had to be as defined in the PICO;
- One or more reported outcomes had to be as defined in the PICO;
- Research type: Systematic review of randomized controlled trials or observational studies;
- Articles written in English or Dutch
Results
17 publications were initially selected based on title and abstract screening. After reading the full text of those articles, the most recent meta-analysis was selected, in which three observational studies were included that were also found in our search strategy. We added one trial that was published more recent than the search date that was used in the meta-analysis. Other less recent meta-analyses were also used for study selection in the included meta-analysis that we used as a basis for this module, and were therefore not used in our literature selection (see the table with reasons for exclusion under the tab Methods).
Referenties
- Falkson CB, Vella ET, Ellis PM, Maziak DE, Ung YC, Yu E. Surgical, Radiation, and Systemic Treatments of Patients With Thymic Epithelial Tumors: A Systematic Review. J Thorac Oncol. 2023 Mar;18(3):299-312. doi: 10.1016/j.jtho.2022.10.016. Epub 2022 Nov 4. PMID: 36343922.
- Fernandes AT, Shinohara ET, Guo M, Mitra N, Wilson LD, Rengan R, Metz JM. The role of radiation therapy in malignant thymoma: a Surveillance, Epidemiology, and End Results database analysis. J Thorac Oncol. 2010 Sep;5(9):1454-60. doi: 10.1097/JTO.0b013e3181e8f345. PMID: 20651611.
- Rimner A, Ahmad U, Lobaugh SM, Zhang Z, Shepherd AF, Huang J, Antonicelli A, Girard N, Moser B, Filosso P, Lucchi M, Marom EM, Roden A, Detterbeck F, Ruffini E, Simone CB 2nd. Postoperative Radiation Therapy for Thymic Carcinoma: An Analysis of the International Thymic Malignancy Interest Group/European Society of Thoracic Surgeons Database. J Thorac Oncol. 2023 Dec 8:S1556-0864(23)02416-4. doi: 10.1016/j.jtho.2023.12.011. Epub ahead of print. PMID: 38070599.
- Tateishi Y, Horita N, Namkoong H, Enomoto T, Takeda A, Kaneko T. Postoperative Radiotherapy for Completely Resected Masaoka/Masaoka-Koga Stage II/III Thymoma Improves Overall Survival: An Updated Meta-Analysis of 4746 Patients. J Thorac Oncol. 2021 Apr;16(4):677-685. doi: 10.1016/j.jtho.2020.12.023. Epub 2021 Jan 27. PMID: 33515812.
- Song SH, Suh JW, Yu WS, Byun GE, Park SY, Lee CY, Kim DJ, Paik HC, Chung KY, Lee GD, Choi S, Kim HR, Kim YH, Kim DK, Park SI, Cho JH, Kim HK, Choi YS, Kim J, Zo JI, Shim YM, Hwang Y, Park S, Park IK, Kang CH, Kim YT, Lee JG. The role of postoperative radiotherapy in stage II and III thymoma: a Korean multicenter database study. J Thorac Dis. 2020 Nov;12(11):6680-6689. doi: 10.21037/jtd-20-1713. PMID: 33282369; PMCID: PMC7711424.
- Zhang C, Wang Q, Hu L, Cong Z, Qiang Y, Xu F, Zhang Z, Luo C, Qiu B, Li X, Shen Y. The Prognostic Value of Postoperative Radiotherapy for Thymoma and Thymic Carcinoma: A Propensity-Matched Study Based on SEER Database. Cancers (Basel). 2022 Oct 8;14(19):4938. doi: 10.3390/cancers14194938. PMID: 36230861; PMCID: PMC9563976.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Tateishi, 2021
Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of 5 observational studies to answer our clinical question.
Literature search performed as of June 12, 2020.
A: Fan, 2013 B: Ruffini, 2014 C: Omasa, 2015 D: Rimner, 2016 E: Jackson, 2017
Study design: All observational Single centre: A Database: B, D, E Multicentre: C
Country and recruitment year: A. People’s Republic of China, 1982–2010 B. Italy, 1990–2010 C. Japan, 1991–2010 D. United States, 1990–2012 E. United States, 2004–2012
Source of funding and conflicts of interest: Systematic review:
|
Inclusion criteria SR:
Exclusion criteria SR: Non- English reports
The meta-analyses are based on five retrospective studies. Two studies separately provided data on patients with stages II and III thymoma. Therefore, the meta-analyses include seven independent comparisons.
Stage, N, median age In years A: MIII, N=65, early 50s B: MII, N=612, 56 MIII, N=295 C. MII/MIII, N=1110, 58 D: M/MK II/III, N=1263, 54 E. MK II, N=633, 60, MK III, N=768
Groups were comparable at baseline. |
Surgery plus PORT.
A: 53 (81.5%) Conventional radiotherapy: N=25 3D-CRT/IMRT: N=28 Dsose: 56 Gy. B: Stage II: 316 (51.6%) Stage III: 217(73.6) C. 323 (29.1%) D: 689 (54.6%) E: Stage II: 359 (56.7%) Stage III: 451 (58.7%)
Only Fan, 2013 reported the radiotherapy methodology. |
Surgery alone.
A: 12 (18.5%) B: Stage II: 296 (48.4%) Stage III: 78 (26.4%) C. 787 (71.0%) D: 574 (45.4%) E: Stage II: 274 (43.3%) Stage III: 317 (41.3%) |
Not reported |
Overall survival (N=5) Effect measure: HR (95% CI) Stage II only: B: 0.67 (0.38; 1.18) E: 0.61 (0.38; 0.97) Stage III only: A: 0.89 (0.22;3.55) B: 0.82 (0.45; 1.50) E: 0.69 (0.50; 0.95) Stage II and III mixed: C: 0.78 (0.47;1.30) D: 0.58 (0.34; 0.98)
Pooled effect (random effects model): 0.68 (95% CI 0.57 to 0.83) favouring the intervention group. Heterogeneity (I2): 0%
|
Risk of bias: Newcastle-Ottawa scale used by the authors of the systematic review: Tateishi, 2021.
A: 6 B: 6 C: 6 D: 7 E: 6
Author’s conclusion In conclusion, our systematic review and meta-analysis, incorporating five observational studies published since 2013, evaluating 4746 patients with completely resected M/MK stage II/III thymomas (which are almost equivalent to TNM stage I–III diseases), indicated that PORT substantially improves the OS of this population (HR ¼ 0.68, 95% CI: 0.57–0.83, p <0.001). Currently available evidence from observational studies suggests conducting PORT for patients with completely resected M/MK stage II/III thymoma. A randomized trial is warranted for stronger evidence.
Level of evidence GRADE: Overall survival: Very LOW* *Downgraded 1 point because of risk of bias
Disease-free survival: VERY LOW*
* Downgraded 1 point because of inconsistency: strength of effect differs between studies
|
|
Song, 2020 |
Study design: Retrospective cohort study.
Treatment period: Between January 2000 and December 2013, at four Korean hospitals.
Source of funding and conflicts of interest: onflicts of Interest: All authors completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/jtd-20-1713). The authors have no conflicts of interest to declare. Funding: None. |
Inclusion criteria: Patients with thymomas, with Masaoka-Koga (M-K) stages II and III disease.
Exclusion criteria: patients with benign diseases, M-K stage I and IV thymomas, thymic carcinomas, or neuroendocrine carcinomas, and patients with missing data.
Median age In years: I: 50.0 [19–79] C: 51.5 [16–84]
After propensity score matching, groups were comparable at baseline. |
Postoperative radiotherapy (PORT): N=202 |
No postoperative radiotherapy (non-PORT): N=202 |
Follow-up time not reported. |
Overall survival (N=5) was significantly longer in stage III patients receiving PORT (Figure 2).
5-year OS rate among stage III patients: I: 86.5% C: 54.7%
10-year OS rate among stage III patients: I: 86.5% C: 30.4%
5-year OS among stage II patients: I: 94.6% C: 93.8%
10-year OS among stage II patients: I: 84.3% C: 87.5%
5-year I: 93.1% C: 87.5%
10-year OS rates: I: 85.1% C: 77.9%
Deaths within 1st postoperative year among stage III thymoma: C: N=3 (1 myocardial infarction, 1 thymoma related death, and 1 unknown cause). |
Author’s conclusion:
|
Risk of bias table
|
Author, year |
Selection of participants
Was selection of exposed and non-exposed cohorts drawn from the same population?
|
Exposure
Can we be confident in the assessment of exposure?
|
Outcome of interest
Can we be confident that the outcome of interest was not present at start of study?
|
Confounding-assessment
Can we be confident in the assessment of confounding factors?
|
Confounding-analysis
Did the study match exposed and unexposed for all variables that are associated with the outcome of interest or did the statistical analysis adjust for these confounding variables?
|
Assessment of outcome
Can we be confident in the assessment of outcome?
|
Follow up
Was the follow up of cohorts adequate? In particular, was outcome data complete or imputed?
|
Co-interventions
Were co-interventions similar between groups?
|
Overall Risk of bias
|
|
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Low, Some concerns, High |
|
|
Tateishi, 2021 |
Probably no
Reason: SR with several observational studies, with differing inclusion criteria
|
Definitely yes
Reason: Patients received either postoperative radiotherapy, or no postoperative radiotherapy |
Definitely yes
Reason: Overall survival was the primary endpoint |
Definitely no
Reason: No mention of confounding assessment in manuscript |
Definitely no
Reason: No presumed counfounding factors were taken into account |
Definitely yes
Reason: Overall survival was the primary endpoint |
Probably no
Reason: Follow-up or time to follow-up was not reported, missing data was also not reported |
Definitely no
Reason: In some included studies, co-interventions differed. Sensitivity analysis was performed for these studies. |
High (OS)
|
|
Song, 2020 |
Definitely yes
Reason: Participants were selected from a registry |
Definitely yes
Reason: Patients received either postoperative radiotherapy, or no postoperative radiotherapy |
Definitely yes
Reason: Overall survival was the primary endpoint |
Probably yes
Reason: registry data was used |
Probably yes
Reason: Propensity score matching was perfomed to adjust for relevant factors |
Definitely yes
Reason: Overall survival was the primary endpoint |
Probably no
Reason: Follow-up or time to follow-up was not reported, missing data was also not reported |
Definitely yes
Reason: Groups were selected from registry and compared and propensity score matching was perfomed to adjust for relevant factors, such as co-interventions |
Some concerns (OS) |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Korst, 2009 |
Less recent SR compared Tateishi, 2021 |
|
Zhou, 2016 |
Less recent SR compared Tateishi, 2021 |
|
Hamaji, 2017 |
Less recent SR compared Tateishi, 2021 |
|
Hamaji, 2014 |
Less recent SR compared Tateishi, 2021 |
|
Ma, 2016 |
Less recent SR compared Tateishi, 2021 |
|
Lim, 2016 |
Less recent SR compared Tateishi, 2021 |
|
Rena, 2007 |
Not included in Tateishi, 2021 |
|
Chang, 2011 |
Not included in Tateishi, 2021 |
|
Vogel, 2016 |
Wrong intervention |
|
Hao, 2017 |
Wrong intervention |
|
Chen, 2010 |
Not included in Tateishi, 2021 |
|
Lim, 2015 |
Not included in Tateishi, 2021 |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 08-11-2024
Beoordeeld op geldigheid : 31-08-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met epitheliale thymustumoren.
Werkgroep
- Dr. M.M.H. Hochstenbag, Longarts, Maastricht UMC, Maastricht, NVALT (voorzitter)
- Dr. F.D. Marcuse, Longarts, Maastricht UMC, Maastricht, NVALT
- Dr. D. Dumoulin, Erasmus MC, Rotterdam, NVALT
- Dr. K.J. Hartemink, Chirurg, Antoni van Leeuwenhoek, Amsterdam, NVvH
- Dr. J.G.J. Hoeijmakers, Neuroloog, Maastricht UMC, Maastricht, NVN
- Dr. T.A. Mulders, Nucleair Geneeskundige, Erasmus MC, Rotterdam, NVNG
- Dr. M.A. den Bakker, Patholoog, Maasstadziekenhuis, Rotterdam, NVvP
- Dr. J.H. van der Thüsen, Patholoog, Erasmus MC, Rotterdam, NVvP
- Dr. A.B. Donkers-van Rossum, Radioloog, Catharinaziekenhuis, Eindhoven, NVvR
- Dr. S. Peeters, Radiotherapeut, Maastro clinic, Maastricht, NVRO
- Drs. S. M. van der Heide, Cardio-thoracale chirurg, Radboud UMC, Nijmegen, NVT
- Drs. L. Barberio, Directeur Longkanker Nederland, Utrecht
Met ondersteuning van
- Dr. C. Gaasterland, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. D. Nieboer, Senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. N. Zielonke, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. Lisanne Verbruggen, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. M. te Lintel Hekkert, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. S van Duijn, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- D.P. Gutierrez, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie |
|
Hochstenbag* |
Longarts met aandachtsgebied long oncologie. Werkgever: MUMC |
Geen |
Nee |
Nee |
Nee |
Nee |
Nee |
16-9-2021 |
Geen |
|
Hartemink |
Dr. K.J. Hartemink, chirurg |
Onbetaald: |
1. Expert panel; behandeling van vroeg-stadium NSCLC (eenmalige vergoeding MSD; euro 420,-) (6-2021). |
Geen |
KWF-grant ontvangen (2021) voor het doen van onderzoek naar radiotherapie en chirurgie bij het vroeg-stadium NSCLC. |
Geen |
Geen |
4-6-2021 |
Geen restricties, tenzij producten van Medtronic in de richtlijn besproken worden |
|
Donkers- van Rossum |
Radioloog, werkzaam sinds 1998 Catharina ziekenhuis Eindhoven |
* Screeningsradioloog Borstkanker Regio Zuid Nederland. Betaald via vakgroep |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
8-6-2021 |
Geen |
|
Peeters |
Radiotherapeut-oncoloog bij Maastro, Maastricht |
Geen |
Geen |
Neen |
Niet van toepassing |
Geen |
Geen |
15-6-2021 |
Geen |
|
Hoeijmakers |
Neuroloog Maastricht Universitair Medisch Centrum+ (Maastricht UMC+), Maasticht. Binnen deze functie gespecialiseerd in neuromusculaire aandoeningen |
* Bestuurslid Spierzieken Centrum Nederland (SCN), als vertegenwoordiger van het Maastricht UMC+. SCN is een samenwerkingsverband van artsen en onderzoekers uit alle universitaire medische centra die gespecialiseerd zijn in neuromusculaire aandoeningen. |
De richtlijn zal geen persoonlijk financieel voordeel opleveren |
Er zijn geen voordelen voor persoonlijke relaties |
Er is geen sprake van deelname aan onderzoek dat wordt gefinancierd door (semi)overheid, fondsen of industrie, waarbij de finacier belangen kan hebben bij (een bepaalde uitkomst van ) het advies of de richtlijn |
Er zijn geen intellectuele belangen |
Er zijn geen overige belangen in relatie tot de richtlijn |
17-6-2021 |
Geen |
|
Thüsen, von der |
Patholoog, Erasmus MC |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
* Mede-organisator Thymoompanel |
Niet van toepassing |
10-8-2021 |
Geen |
|
Marcuse |
Longarts in opleiding (AIOS), Maastricht Universitair Medisch Centrum |
* Promovenda: Universiteit Maastricht - onbetaald |
Geen |
Geen |
Geen |
Geen |
Geen |
16-9-2021 |
Geen |
|
Bakker, den |
Patholoog in het Maasstad Ziekenhuis, in Maatschapsverband |
Gastvrijheisovereenkomst afdeling pathologie Erasmus MC |
Geen |
Geen |
Beter Keten project - Anser promotietraject - Projecteider |
Geen |
Geen |
23-11-2021 |
Geen |
|
Mulders |
Nucleair Geneeskundige / Radioloog Erasmus MC |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
24-11-2021 |
Geen |
|
Heide, van der |
Cardiothoracaal chirurg werkzaam in het RadboudUMC |
Geen |
Geen |
Geen |
Geen |
Geen, derhalve dat de afdeling Cardiothoracale chirurgie, waaronder ikzelf, operaties met betrekking tot mediastinale tumoren verricht |
Geen |
25-11-2021 |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname van de directeur van de stichting Longkanker Nederland in de werkgroep. Deze afgevaardigde heeft samen met adviseurs van het Kennisinstituut een focusgroep georganiseerd met een zestal patiënten om de knelpunten vorm te geven en de overwegingen en aanbevelingen te informeren. Daarnaast heeft zij meebeslist bij het opstellen van de overwegingen.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er geen substantiële financiële gevolgen zijn voor deze richtlijn, gezien het aantal patiënten kleiner is dan 5000.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep en aangeschreven verenigingen de knelpunten in de zorg voor patiënten met Epitheliale Thymustumoren in een Invitational Conference. Er werden knelpunten aangedragen door de deelnemende WV-en, Longkanker Nederland en de patiënten die deelnamen aan de focusgroep.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
|
Cluster/richtlijn: NVALT Mediastinale tumoren |
|
|
Uitgangsvraag/modules: Is er een toegevoegde waarde van postoperatieve radiotherapie bij patiënten met een epitheliale thymustumor, Masaoka-Koga stadium II met volledige resectie? |
|
|
Database(s): Embase.com, Ovid/Medline |
Datum: 10 november 2023 |
|
Periode: vanaf 2007 |
Talen: geen restrictie |
|
Literatuurspecialist: Alies van der Wal |
Rayyan review: https://rayyan.ai/reviews/840058 |
|
BMI-zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Deduplication: voor het ontdubbelen is gebruik gemaakt van http://dedupendnote.nl/ |
|
|
Toelichting: Voor deze vraag is gezocht op de elementen:
De sleutelartikelen worden gevonden met deze search |
|
|
Te gebruiken voor richtlijntekst: In de databases Embase.com en Ovid/Medline is op 10 november 2023 systematisch gezocht naar systematische reviews en RCTs over postoperatieve radiotherapie bij een thymustumor. De literatuurzoekactie leverde 225 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SR |
77 |
42 |
79 |
|
RCT |
120 |
57 |
146 |
|
Totaal |
197 |
99 |
225* |
*in Rayyan
Zoekstrategie
Embase.com
|
No. |
Query |
Results |
|
#1 |
'thymic neoplasm'/exp OR (((thymus OR thymic) NEAR/4 (carcinoma* OR adenocarcinoma*)):ti,ab,kw) OR 'thymoma*':ti,ab,kw OR 'good syndrom*':ti,ab,kw OR 'good s syndrom*':ti,ab,kw OR 'lipofibroadenoma*':ti,ab,kw OR thymolipoma*:ti,ab,kw OR 'thymofibrolipoma*':ti,ab,kw OR (((thymus OR thymic) NEAR/3 (cancer* OR neoplasm* OR malignan* OR tumor* OR tumour* OR metasta* OR carcinoid* OR lymphoma* OR neoplastic OR neoplasia* OR sarcoma* OR choriocarcinoma* OR seminoma* OR teratoma* OR melanoma* OR neuroblastoma* OR ganglioneuroblastoma* OR hemangioma*)):ti,ab,kw) |
25584 |
|
#2 |
'radiotherapy'/exp OR 'bioradiant therapy':ti,ab,kw OR 'bucky ray':ti,ab,kw OR 'bucky therapy':ti,ab,kw OR 'radio therapy':ti,ab,kw OR 'radio treatment':ti,ab,kw OR 'radiohypophysectomy':ti,ab,kw OR 'radiotherapy':ti,ab,kw OR 'roentgen therapy':ti,ab,kw OR 'roentgen treatment':ti,ab,kw OR 'rontgen therapy':ti,ab,kw OR 'therapeutic radiology':ti,ab,kw OR 'x radiotherapy':ti,ab,kw OR 'x ray therapy':ti,ab,kw OR 'x ray treatment':ti,ab,kw OR 'x-ray therapy':ti,ab,kw OR irradiati*:ti,ab,kw OR radiati*:ti,ab,kw OR port:ti,ab,kw |
1314619 |
|
#3 |
'postoperative period'/exp OR 'postoperative care'/exp OR postoperati*:ti,ab,kw OR 'post operati*':ti,ab,kw OR postsurg*:ti,ab,kw OR 'post surg*':ti,ab,kw OR 'surgery'/exp OR surgic*:ti,ab,kw OR surger*:ti,ab,kw OR operation*:ti,ab,kw OR operative:ti,ab,kw OR laparoscop*:ti,ab,kw OR 'mini* invasive':ti,ab,kw OR resect*:ti,ab,kw OR (((thymus OR thymic OR thymo* OR lipofibroadenoma*) NEAR/3 (extirpat* OR exci*)):ti,ab,kw) OR vats:ti,ab,kw OR rats:ti,ab,kw OR robot*:ti,ab,kw OR 'video assisted':ti,ab,kw OR 'thoracoscopic surgery'/exp OR thymectom*:ti,ab,kw OR sternotom*:ti,ab,kw OR hemisternotom*:ti,ab,kw OR ministernotom*:ti,ab,kw OR 'clamshell thoracotomy'/exp OR thoracotom*:ti,ab,kw OR minithoracotom*:ti,ab,kw OR 'adjuvant therapy'/exp OR 'adjuvant'/exp OR adjuvan*:ti,ab,kw OR adjunct*:ti,ab,kw |
8760589 |
|
#4 |
#1 AND #2 AND #3 |
2980 |
|
#5 |
#4 NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
2063 |
|
#6 |
#5 AND [2007-2024]/py |
1352 |
|
#7 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
976433 |
|
#8 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3911098 |
|
#9 |
#6 AND #7 = SR |
77 |
|
#10 |
#6 AND #8 NOT #9 = RCT |
120 |
|
#11 |
#9 OR #10 |
197 |
Ovid/Medline
|
# |
Searches |
Results |
|
1 |
exp Thymus Neoplasms/ or ((thymus or thymic) adj4 (carcinoma* or adenocarcinoma*)).ti,ab,kf. or 'thymoma*'.ti,ab,kf. or 'good syndrom*'.ti,ab,kf. or 'good s syndrom*'.ti,ab,kf. or 'lipofibroadenoma*'.ti,ab,kf. or thymolipoma*.ti,ab,kf. or 'thymofibrolipoma*'.ti,ab,kf. or ((thymus or thymic) adj3 (cancer* or neoplasm* or malignan* or tumor* or tumour* or metasta* or carcinoid* or lymphoma* or neoplastic or neoplasia* or sarcoma* or choriocarcinoma* or seminoma* or teratoma* or melanoma* or neuroblastoma* or ganglioneuroblastoma* or hemangioma*)).ti,ab,kf. |
18535 |
|
2 |
exp Radiotherapy/ or (bioradiant therapy or bucky ray or bucky therap* or radio therap* or radio treatment or radiohypophysectomy or radiotherap* or roentgen therap* or roentgen treatment or rontgen therap* or therapeutic radiology or x radiotherapy or x ray therap* or x ray treatment or x-ray therapy or irradiati* or radiati* or port).ti,ab,kf. |
860347 |
|
3 |
Postoperative Care/ or exp Postoperative Period/ or postoperati*.ti,ab,kf. or (post operati* or postsurg* or post surg*).ti,ab,kf. or exp Surgical Procedures, Operative/ or exp Specialties, Surgical/ or surgic*.ti,ab,kf. or surger*.ti,ab,kf. or operation*.ti,ab,kf. or operative.ti,ab,kf. or laparoscop*.ti,ab,kf. or 'mini* invasive'.ti,ab,kf. or resect*.ti,ab,kf. or ((thymus or thymic or thymo* or lipofibroadenoma*) adj3 (extirpat* or exci*)).ti,ab,kf. or vats.ti,ab,kf. or rats.ti,ab,kf. or robot*.ti,ab,kf. or 'video assisted'.ti,ab,kf. or thymectom*.ti,ab,kf. or sternotom*.ti,ab,kf. or hemisternotom*.ti,ab,kf. or ministernotom*.ti,ab,kf. or thoracotom*.ti,ab,kf. or minithoracotom*.ti,ab,kf. or (adjuvan* or adjunct*).ti,ab,kf. |
6343546 |
|
4 |
1 and 2 and 3 |
1460 |
|
5 |
4 not (comment/ or editorial/ or letter/) not ((exp animals/ or exp models, animal/) not humans/) |
1357 |
|
6 |
limit 5 to yr="2007 -Current" |
772 |
|
7 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
705919 |
|
8 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2654379 |
|
9 |
6 and 7 = SR |
42 |
|
10 |
(6 and 8) not 9 = RCT |
57 |
|
11 |
9 or 10 |
99 |
