Minimaal invasieve chirurgie
Uitgangsvraag
Wat is de plaats van minimaal invasieve chirurgie voor patiënten met (verdenking op) een epitheliale thymustumor (TET)?
Aanbeveling
Verricht bij voorkeur een resectie van een TET middels een minimaal invasieve benadering*.
*Denk hierbij aan markeringen op het randresectievlak in geval van dubieuze radicaliteit in verband met eventuele postoperatieve bestraling. Een mogelijkheid om te markeren is met clips.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Voor de drie cruciale uitkomstmaten (R0 resectie, 30- en 90-dagen mortaliteit) zijn er resultaten gerapporteerd in de geïncludeerde studies.
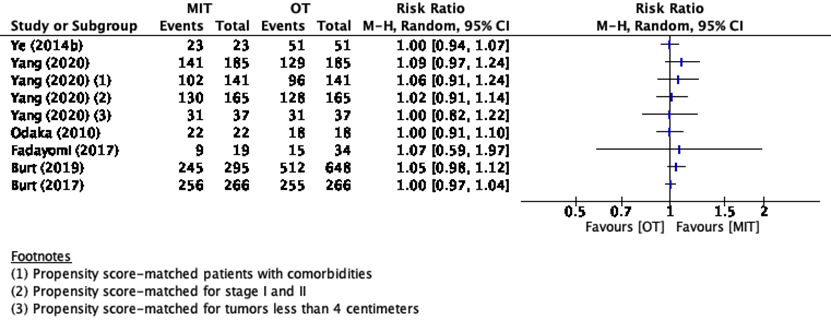
Zes studies rapporteerden R0 resectie (Ye, 2014b; Odaka, 2010; Burt, 2017; Burt, 2019; Fadayomi, 2017; Yang, 2020). Deze studies lieten geen klinisch relevant effect zien tussen de behandeling met minimaal invasieve chirurgie of open chirurgie.
Over de uitkomsten 30- en 90-dagen mortaliteit werd er door respectievelijk drie en één studie uitkomsten gerapporteerd (Chung, 2012; Allakverdiev, 2019; Yang, 2020). Gezien het relatief lage aantal events, is ook hier geen klinisch relevant verschil gevonden voor behandeling met minimaal invasieve chirurgie in vergelijking met open chirurgie.
Voor de belangrijke uitkomstmaat opnameduur zijn er door zeven studies uitkomsten gerapporteerd (Ye, 2014b; Chung, 2012; Odaka, 2010; Allakverdiev, 2019; Burt, 2019; Fadayomi, 2017; Yang, 2020). Hier lijkt een klinisch relevant effect te zijn voor de behandeling met minimaal invasieve chirurgie, gepaard gaand met een kortere opnameduur wanneer vergeleken werd met open chirurgie.
Voor de andere uitkomstmaten; postoperatief herstel, heropname en kwaliteit van leven, zijn in de geïncludeerde studies geen resultaten gerapporteerd.
De overall bewijskracht is zeer laag. Ten eerste omdat alleen observationele (retrospectieve) cohortstudies gevonden zijn. Daarnaast was er in sommige gevallen sprake van risico op bias of een laag patiënten- of event aantal.
Er is in deze search geen onderzoek gedaan naar de mogelijke betere esthetische resultaten na minimaal invasieve chirurgie (kleinere incisies) en/of de (reden van) voorkeur van de opererend chirurg voor welke benadering te kiezen.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
De overweging om voor MIC te gaan boven open chirurgie is met name om de hersteltijd van de patiënt te versnellen. Hiermee heeft MIC over het algemeen de voorkeur van de patiënt. De chirurg kan beide opties aan de patiënt voorleggen en in gezamenlijkheid een keuze maken.
Kosten (middelenbeslag)
Kosten zijn niet meegenomen in het formuleren van de aanbevelingen. Echter kan verondersteld worden dat met de kortere opnameduur van MIC de kosten lager zullen uitkomen dan bij open chirurgie.
Aanvaardbaarheid, haalbaarheid en implementatie
MIC heeft de voorkeur boven open chirurgie. MIC kan uitgevoerd worden met een robot (RATS), of via een VATS (de vergelijking tussen deze twee opties in deze module niet uitgewerkt). In de meeste ziekenhuizen is een van deze opties een haalbare mogelijkheid.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Er lijkt een voorkeur te bestaan ten aanzien van een minimaal invasieve resectie van een TET gezien de gunstige invloed hiervan op het postoperatieve herstel en ontslag naar huis, wanneer dit vergeleken wordt met een open benadering.
Onderbouwing
Achtergrond
Resectie van een TET kan middels diverse benaderingen uitgevoerd worden: mediane sternotomie, (hemi-)clamshell, thoracotomie of minimaal invasief middels video-assisted thoracoscopie (VATS) of robot-assisted thoracoscopische resectie (RATS). Het is onduidelijk welke benadering de voorkeur geniet en of een open benadering of minimaal invasieve benadering beter is in deze.
Conclusies / Summary of Findings
|
Very low GRADE |
The effect of minimally invasive surgery on R0 resection compared to open thoracotomy in patients with a suspected thymoma is very uncertain.
Source: Ye, 2014b; Odaka, 2010; Burt, 2017; Burt, 2019; Fadayomi, 2017; Yang, 2020 |
|
Very low GRADE |
The effect of minimally invasive surgery on 30-day mortality compared to open thoracotomy in patients with a suspected thymoma is very uncertain.
Source: Chung, 2012; Allakhverdiev,2019; Yang, 2020 |
|
Very low GRADE |
The effect of minimally invasive surgery on 90-day mortality compared to open thoracotomy in patients with a suspected thymoma is very uncertain.
Source: Yang, 2020 |
|
Very low GRADE |
The evidence is very uncertain
The effect of minimally invasive surgery on length of hospital stay compared to open thoracotomy in patients with a suspected thymoma is very uncertain.
Source: Ye, 2014b; Chung, 2012; Odaka, 2010; Allakhverdiev, 2019; Burt, 2019; Fadayomi, 2017; Yang, 2020 |
|
- GRADE |
No evidence was found reporting the effect of minimally invasive surgery on postoperative recovery compared to open thoracotomy in patients with a suspected thymoma.
Source: - |
|
- GRADE |
No evidence was found reporting the effect of minimally invasive surgery on readmission compared to open thoracotomy in patients with a suspected thymoma.
Source: - |
|
- GRADE |
No evidence was found reporting the effect of minimally invasive surgery on quality of life compared to open thoracotomy in patients with a suspected thymoma.
Source: - |
Samenvatting literatuur
Description of studies
Hess (2016) performed a systematic review assessing minimally invasive thymectomy (MIT) versus open thymectomy (OT). An electronic search of the PubMed database was conducted from June 2015 to August 2015. A total of twenty studies were included in the final analysis. Ten of these studies were conducted on patients with a thymoma, of which five studies reported data without myasthenia gravis (Ye, 2014a; Ye, 2014b; Kimura, 2013; Chung, 2012; Odaka, 2010). In total, 240 patients underwent MIT and 280 patients underwent OT. Four out of five studies used video-assisted thoracoscopy (VATS) (Ye, 2014a; Kimura, 2013; Chung, 2012; Odaka, 2010) and one study used a robotic video-assisted thoracoscopic approach (R-VATS) (Ye, 2014b). The age of patients in the MIT group ranged from mean age of 45.8 years to 55 years, and in the OT group from a mean age of 50.0 years to 57 years. Patient gender in the MIT group ranged from 42% male to 64% male, and in the OT group from 34% male to 61% male. Reported relevant outcome measures were R0 resection rate, mean hospital length of stay days, and 30-day mortality.
Allakhverdiev (2019) conducted a retrospective cohort study comparing thoracoscopic thymectomy (TT) with open thymectomy in patients non-invasive thymomas in the Russian Cancer Research Center. In total 59 patients were included in the study with a mean age of 50.4 years. Of the 59 patients 39.4% was male. The TT group consisted of 33 patients and the OT group consisted of 26 patients. In the TT group 22 patients (67%) had a tumor of < 7 centimeter compared to 14 patients (54%) in the OT group. In the TT group 11 patients (33%) had a tumor of > 7 centimeters compared to 12 patients (46%) in the OT group.
Allakhverdiev (2019) reported the outcomes mortality and length of hospital stay. The length of follow-up was not reported.
Burt (2017) conducted a retrospective cohort study using data from the International Thymic Malignancies Interest Group (ITMIG) between 1997 and 2012. Patients who underwent minimally invasive thymectomy (MIT) (Video-assisted thoracoscopic surgical approach, VATS or Robotic-assisted thoracoscopic surgical approach, RATS) or open thymectomy (OT) (sternotomy or thoracotomy) for thymoma were included. Patients who underwent thoracosternotomy and clamshell approaches, cervical thymectomy and mediastinotomy approaches were excluded from the analysis. The MIT group consisted of 461 patients with a mean age of 51.4 years. The OT group consisted of 2053 patients with a mean age of 51.5 years. The mean tumor size in the MIT group was 4.0 centimeters (range 0.4 to 15.5) and in the OT group the mean tumor size was 6.0 centimeters (range 0.1 to 28.0).
Burt (2017) reported R0 resection and performed propensity score matching regarding the outcome R0 resection. The length of follow-up was not reported.
Burt (2019) conducted a retrospective cohort study using data from the National Cancer Data Base (NCDB) comparing thoracoscopic and robot-assisted approaches (MIT) with open thymectomy (OT). Patients aged 18 to 90 and diagnosed between 2010 and 2014 with Masaoka-Koga stage I or II thymoma were included.
The MIT group consisted of 295 patients with a mean age of 60.4 years. The OT group consisted of 648 patients with a mean age of 59.2 years. In the MIT group 41.5% of the patients had a tumor of 3 centimeter or smaller compared to 28.3% in the OT group. In the MIT group 32.8% of the patients had a tumor between 3 and 5 centimeters compared to 27.2% in the OT group. 17.1% of the patients in the MIT group had a tumor between 5 and 8 centimeters compared to 17.7% in the OT group. Finally in the MIT group 8.7% of the patients had a tumor of more than 8 centimeters compared to 17.7% in the OT group.
Burt (2019) reported R0 resection and length of hospital stay. The length of follow-up was not reported.
Fadayomi (2017) conducted a retrospective cohort study using data from electronical medical records from patients with a diagnosis of thymoma and underwent thymectomy at an academic center between 2005 and 2015. Patients with pathologically confirmed stage II and II thymoma were included. Patients with thymic carcinoma, hyperplasia, atrophy, lymphomas and benign thymic pathologies, were excluded. Patients who underwent a concurrent extra pleural pneumonectomy and had stage III and IV thymoma were also excluded. In total, 53 patients were included in the analysis. Fadayomi (2017) compared minimally invasive thymectomy (MIT) (video-assisted thoracoscopic surgery or robotic thymectomy) with open thymectomy (OT) (sternotomy, hemi-clamshell or thoracotomy). The MIT group consisted of 19 patients with a median age of 60 years and the OT group consisted of 34 patients with a median age of 60.5 years. Median tumor size in the MIT group was 4.9 centimeters and in the OT group 5.5 centimeters.
Fadayomi (2017) reported R0 resection and length of stay. Median follow-up time for the MIT group was 27 months and for the OT group 52.5 months.
Yang (2020) conducted a retrospective cohort study using data from the National Cancer Data Base (NCDB). Patients who underwent thymectomy for stage I to II thymoma from 2010 to 2014, were included. Patients with non-malignant pathology, a history of unrelated malignancy and with an age less than 18 years, were excluded. Yang (2020) compared minimally invasive thymectomy (MIT) with open thymectomy (OT). The MIT group consisted of 317 patients with a mean age of 59.6 years. The OT group consisted of 906 patients with a mean age of 57.4 years. Median tumor size in the MIT group was 49.5 millimeters and in the OT group 65 millimeters.
Yang (2020) reported R0 resection, 30- and 90-day mortality and length of stay. Yang (2020) performed multiple propensity score-matched analyses regarding patients without comorbidities, stage I and II and for patients with tumors less than 4 centimeters.
Median length of follow-up in the MIT group was 36.4 months and in the OT group 35.9 months.
Results
R0 resection rate
Two studies from the systematic review of Hess (2016) reported R0 resection rate (Ye, 2014b; Odaka, 2010) and four additional observational studies (Burt, 2017; Burt, 2019; Fadayomi, 2017; Yang, 2020). The results of the studies are presented in Figure 5. Because of the heterogeneity of the studies due to difference in study population and duration of follow-up, the pooled results are not displayed.
Figure 5 R0 resection rate
30-day mortality
One study in the systematic review of Hess (2016) reported 30-day mortality (Chung, 2012). Yang (2020) reported 30-day mortality for different propensity score-matched groups. The results are presented in table 6.
Table 6 30-day mortality
|
Study |
30-day mortality |
|
|
Minimally Invasive Thoracotomy (MIT) group |
Open Thoracotomy (OT) group |
|
|
Chung (2012) |
N=0 |
N=0 |
|
Yang (2020) – Propensity score-matched |
N<10/185 |
N<10/185 |
|
Yang (2020) – Propensity score-matched patients without comorbidities |
N<10/141 |
N=0/141 |
|
Yang (2020) – Propensity score-matched stage I and II |
N<10/165 |
N=0/165 |
|
Yang (2020) – Propensity score-matched patients with tumors less than 4 centimeters |
N<10/137 |
N=0/137 |
Allakhverdiev (2019) reported overall mortality with no patients in the MIT group and 3 patients (11.5%) in the OT group.
90-day mortality
Only the study of Yang (2020) reported 90-day mortality for different propensity score-matched groups. The results are presented in table 7.
Table 2. 90-day mortality
|
Study |
90-day mortality |
|
|
Minimally Invasive Thoracotomy (MIT) group |
Open Thoracotomy (OT) group |
|
|
Yang (2020) – Propensity score-matched |
N<10 |
N<10 |
|
Yang (2020) – Propensity score-matched patients without comorbidities |
N<10 |
N=0 |
|
Yang (2020) – Propensity score-matched stage I and II |
N<10 |
N<10 |
|
Yang (2020) – Propensity score-matched patients with tumors less than 4 centimeters |
N<10 |
N=0 |
Postoperative recovery
None of the included studies reported the outcome postoperative recovery.
Readmission
None of the included studies reported the outcome readmission.
Length of stay
Five studies in the review of Hess (2016) reported length of hospital stay (Ye ,2014b; Chung, 2012; Odaka, 2010). Four additional observational studies reported length of stay (Allakhverdiev, 2019; Burt, 2019; Fadayomi, 2017; Yang, 2020). The length of stay reported by Ye (2014a), Ye (2014b), Kimura (2013), Chung (2012), Odaka (2010), Allakhverdiev (2019) and Yang (2020) is presented in figure 8.
Figure 8 Length of hospital stay
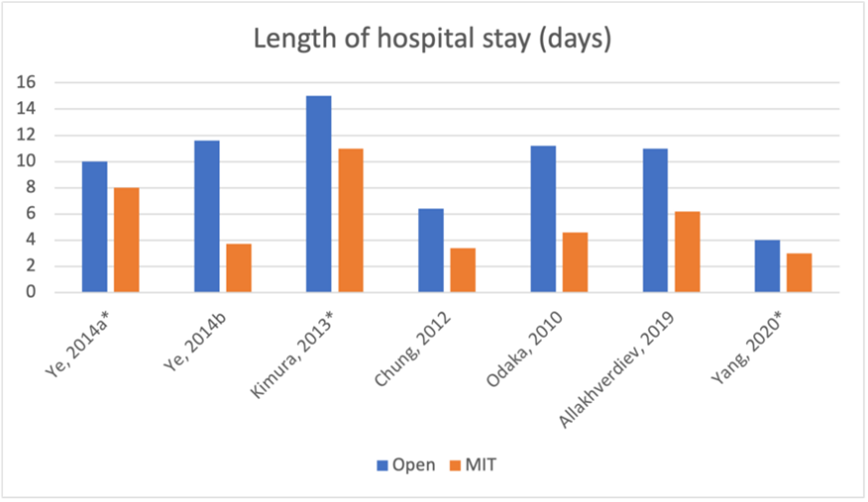
* Median number of days
Burt (2019) reported a mean number of hospital days of -1.03 (95%CI -1.68 to -0.38) for the MIT group compared to the OT group.
Fadayomi (2017) reported length of hospital stay of ≥4 days. In the MIT group 16% reported ≥4 days of hospital stay compared to 71% in the OT group. These differences are clinically relevant.
Quality of life
None of the included studies reported the outcome quality of life.
Level of evidence of the literature
The level of evidence of observational cohort studies is considered low according to the GRADE methodology. Therefore, the level of evidence of these cohort studies starts at low GRADE.
The level of evidence regarding the outcome measure R0 resection was downgraded to very low GRADE because of study limitations (-1; risk of bias).
The level of evidence regarding the outcome measure 30-day mortality was downgraded to very low GRADE because of study limitations (-1; risk of bias) and number of included patients (-1; imprecision because of small number of events)
The level of evidence regarding the outcome measure 90-day mortality was downgraded to very low GRADE because of number of included patients (-1; imprecision because of the small sample size).
The level of evidence regarding the outcome measure length of hospital stay was downgraded to very low GRADE because of study limitations (-1; risk of bias).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What is the effect of minimally invasive surgery compared with open surgery on R0 resection, 30- and 90-day mortality, postoperative recovery, readmission, length of stay and quality of life in patients with suspected TET.
P: patients with suspected TET;
I: minimally invasive surgery (VATS, RATS);
C: open surgery (sternotomy, (hemi-)clamshell, thoracotomy);
O: R0 resection, (30- and 90-day) mortality, complications, postoperative recovery, readmission, hospital length of stay and quality of life.
Relevant outcome measures
The guideline development group considered R0-resection and 30- and 90-day mortality as critical outcome measures for decision making and postoperative recovery, readmission, length of stay and quality of life as important outcome measures for decision making.
The working group defined the outcome measures as follows:
- Postoperative recovery: Time to return to work or sport
Regarding the other outcomes, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined the following differences as minimal clinically (patient) important differences:
- R0 resection: >5%
- 30- and 90-day mortality: >5% or >3% and HR<0.70
- Postoperative recovery: >5%
- Readmission rate: >5%
- Length of stay: >1 day
- Quality of life: A difference of 10 points on the quality of life instrument EORTC QLQ-C30 or a difference of a similar magnitude on other quality of life instruments.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 14-06-2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 442 hits. At first, systematic reviews were selected based on the following criteria:
- Minimum of two databases searched;
- Detailed search strategy with search date;
- In- and exclusion criteria;
- Evidence table for included studies;
- The study population had to meet the criteria as defined in the PICO;
- The intervention and comparison had to be as defined in the PICO or reported at least one of the outcomes as defined in the PICO;
- Full text available;
- Articles written in English or Dutch.
Seven systematic reviews were initially selected based on title and abstract screening. After reading the full text, six systematic reviews were excluded (see the table with reasons for exclusion under the tab Methods), and one systematic review was included.
Additional observational studies after the search date of the included systematic review were selected based on the following criteria:
- The study population had to meet the criteria as defined in the PICO;
- The intervention and comparison had to be as defined in the PICO or reported at least one of the outcomes as defined in the PICO;
- Minimum of N>5 patients in the intervention and control group;
- Full text available;
- Articles written in English or Dutch.
In total, 55 additional observational studies were initially selected based on title and abstract screening. After reading the full text, 50 studies were excluded (see the table with reasons for exclusion under the tab Methods), and five studies were included.
Results
One systematic review and five additional retrospective cohort studies published after the search date of the systematic review were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence table. The assessment of the risk of bias is summarized in the risk of bias table.
Referenties
- Allakhverdiev A, Davydov M, Allakhverdieva G, Akhmedov P. Thoracoscopic thymectomy - The method of choise in surgical treatment of non-invasive thymomas. Ann Med Surg (Lond). 2018 Dec 23;42:29-34. doi: 10.1016/j.amsu.2018.12.005. PMID: 31193429; PMCID: PMC6527944.
- Burt BM, Yao X, Shrager J, Antonicelli A, Padda S, Reiss J, Wakelee H, Su S, Huang J, Scott W. Determinants of Complete Resection of Thymoma by Minimally Invasive and Open Thymectomy: Analysis of an International Registry. J Thorac Oncol. 2017 Jan;12(1):129-136. doi: 10.1016/j.jtho.2016.08.131. Epub 2016 Aug 24. PMID: 27566187; PMCID: PMC5428544.
- Burt BM, Nguyen D, Groth SS, Palivela N, Ripley RT, Makris KI, Farjah F, Cornwell L, Massarweh NN. Utilization of Minimally Invasive Thymectomy and Margin-Negative Resection for Early-Stage Thymoma. Ann Thorac Surg. 2019 Aug;108(2):405-411. doi: 10.1016/j.athoracsur.2019.03.010. Epub 2019 Apr 3. PMID: 30953650.
- Chung JW, Kim HR, Kim DK, Chun MS, Kim YH, Park SI, Kim SR, Lee DH. Long-term results of thoracoscopic thymectomy for thymoma without myasthenia gravis. J Int Med Res. 2012;40(5):1973-81. doi: 10.1177/030006051204000539. PMID: 23206481.
- Hess NR, Sarkaria IS, Pennathur A, Levy RM, Christie NA, Luketich JD. Minimally invasive versus open thymectomy: a systematic review of surgical techniques, patient demographics, and perioperative outcomes. Ann Cardiothorac Surg. 2016 Jan;5(1):1-9. doi: 10.3978/j.issn.2225-319X.2016.01.01. PMID: 26904425; PMCID: PMC4740099.
- Fadayomi AB, Iniguez CEB, Chowdhury R, Coppolino A, Jacobson F, Jaklitsch M, Mody GN. Propensity Score Adjusted Comparison of Minimally Invasive versus Open Thymectomy in the Management of Early Stage Thymoma. Thorac Cardiovasc Surg. 2018 Jun;66(4):352-358. doi: 10.1055/s-0037-1604205. Epub 2017 Aug 14. PMID: 28806823.
- Kimura T, Inoue M, Kadota Y, Shiono H, Shintani Y, Nakagiri T, Funaki S, Sawabata N, Minami M, Okumura M. The oncological feasibility and limitations of video-assisted thoracoscopic thymectomy for early-stage thymomas. Eur J Cardiothorac Surg. 2013 Sep;44(3):e214-8. doi: 10.1093/ejcts/ezt305. Epub 2013 Jun 12. PMID: 23761417.
- Odaka M, Akiba T, Yabe M, Hiramatsu M, Matsudaira H, Hirano J, Morikawa T. Unilateral thoracoscopic subtotal thymectomy for the treatment of stage I and II thymoma. Eur J Cardiothorac Surg. 2010 Apr;37(4):824-6. doi: 10.1016/j.ejcts.2009.10.003. Epub 2009 Nov 12. PMID: 19913436.
- Yang CJ, Hurd J, Shah SA, Liou D, Wang H, Backhus LM, Lui NS, D'Amico TA, Shrager JB, Berry MF. A national analysis of open versus minimally invasive thymectomy for stage I to III thymoma. J Thorac Cardiovasc Surg. 2020 Aug;160(2):555-567.e15. doi: 10.1016/j.jtcvs.2019.11.114. Epub 2019 Dec 14. PMID: 32245668.
- Ye B, Li W, Ge XX, Feng J, Ji CY, Cheng M, Tantai JC, Zhao H. Surgical treatment of early- stage thymomas: robot-assisted thoracoscopic surgery versus transsternal thymectomy. Surg Endosc. 2014 Jan;28(1):122-6. doi: 10.1007/s00464-013-3137-7. Epub 2013 Aug 21. PMID: 23963682.
- Ye B, Tantai JC, Ge XX, Li W, Feng J, Cheng M, Shi JX, Zhao H. Surgical techniques for early-stage thymoma: video-assisted thoracoscopic thymectomy versus transsternal thymectomy. J Thorac Cardiovasc Surg. 2014 May;147(5):1599-603. doi: 10.1016/j.jtcvs.2013.10.053. Epub 2013 Nov 28. PMID: 24290709.
Evidence tabellen
Research question: What is the effect of minimally invasive thoracotomy compared with open thoracotomy in patients with suspected thymoma?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Hess, 2016 |
SR and meta-analysis of non-randomized observational studies
Literature search up to August 2015
A: Ye, 2014a B: Ye, 2014b C: Kimura, 2013 D: Chung, 2012 E: Odaka, 2010
Study design: A: Retrospective cohort B: Retrospective cohort C: Retrospective cohort D: Retrospective cohort E: Cohort
Setting and Country: A: University hospital, China B: University hospital, China C: University hospital, Japan D: University hospital, Japan E: University hospital, Japan
Source of funding and conflicts of interest: A: Disclosures: Authors have nothing to disclose with regard to commercial support. B: The authors no conflicts of interest or financial ties to disclose. C: Conflict of interest: none declared. Funding not reported. D: The authors had no conflicts of interest to declare in relation to this article. Funding not reported. E: NR
|
Inclusion criteria SR: Comparative studies reporting clinical outcomes of patients who underwent MIT and OT were eligible for inclusion. To be included, studies were required to have at least 15 patients in each surgical arm.
Exclusion criteria SR: Not reported
20 studies included
Important patient characteristics at baseline:
N; age (mean, unless noted otherwise)
A: MIT: n=125; 51.9yrs OT: n=137; 50.0yrs B: MIT: n=23; 52.5yrs OT: n=51; 50.1yrs C: MIT: n=45; 55yrs OT: n=29; 57yrs D: MIT: n=25; 45.8yrs OT: n=45; 51.7yrs E: MIT: n=22; 51.9yrs OT: n=18; 51.1yrs
Sex: A: MIT: 52% Male OT: 54% Male B: MIT: 52% Male OT: 61% Male C: MIT: 42% Male OT: 34% Male D: MIT: 52% Male OT: 47% Male E: MIT: 64% Male OT: 39% Male
Groups comparable at baseline? Yes |
A: VATS: right, 90 (72%) or left 35 (28%) B: R-VATS: right, 15 (65%) or left, 8 (35%) C: VATS: side not indicated D: VATS: right, 16 (64%) or left, 9 (36%) E: VATS: right, 16 (73%) or left, 6 (27%)
|
A: Median sternotomy B: Median sternotomy C: Median sternotomy D: Median sternotomy E: Median sternotomy
|
End-point of follow-up in years (mean, unless noted otherwise)
A: MIT: 3.4 (median) OT: 3.5 (median) B: MIT: 1.4 OT: 1.5 C: NR D: MIT: 6.5 OT: 5.8 E: MIT: 4.6 OT: 11.2
For how many participants were no complete outcome data available? (intervention/control) A: NR B: NR C: NR D: NR E: NR
|
R0 resection A: NR B: MIT: 100% OT: 100% C: NR D: NR E: MIT: 100% OT: 100%
Average hospital days (mean, unless noted otherwise) A: MIT: 8 (median) OT: 10 (median) B: MIT: 3.7 OT: 11.6 C: MIT: 11 (median) OT: 15 (median) D: MIT: 3.4 OT: 6.4 E: MIT: 4.6 OT: 11.2
30d mortality (%) A: NR B: NR C: NR D: MIT: 0 OT: 0 E: NR
|
Risk of bias: NR
Facultative:
Brief description of author’s conclusion
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroupanalysis)
A: B: C: D: E:
|
|
Allakhverdiev, 2019 |
Type of study: Retrospective cohort
Setting and country: Hospital, Russia
Funding and conflicts of interest: No sources of funding was provided. All the authors declare no conflicts of interest. |
Inclusion criteria: Patients that underwent surgery at the hospital
Exclusion criteria: NR
N total at baseline: Intervention: 33 Control: 26
Important prognostic factors2: age mean 50.4 years (range 17 to 71)
Sex 39.4% M / 60.6% F
Tumor size <7cm I: N=22 (67%) C: N=14 (54%)
Tumor size >7cm I: N=11 (33%) C: N=12 (46%) |
Thoracoscopic thymectomy
|
Open thymectomy
|
Length of follow-up: NR
Loss-to-follow-up: Intervention: 0 Control: 0
Incomplete outcome data: Intervention: 0 Control: 0 |
Mortality Intervention: 0 Control: 3 (11.5%)
Length of hospital stay Intervention: 6.2 days Control: 11 days |
|
|
Burt, 2017 |
Type of study: Retrospective cohort
Setting and country: Hospitals, USA
Funding and conflicts of interest: No funding and no conflict of interest reported |
Inclusion criteria: Patients who underwent MIT or OT for thymoma
Exclusion criteria: Thoracosternotomy and clamshell approaches, cervical thymectomy and mediastinotomy approaches
N total at baseline: Intervention: 461 Control: 2053
Important prognostic factors2: Mean age I: 51.4 years C: 51.5 years
Sex I: 48% M / 52% F C: 49% M / 51% F
Tumor stage I: 868 (39%) II: 838 (38) III: 371 (17%) IV: 142 (6%)
Tumor size (mean cm (range)) I: 4.0 (0.4 to 15.5) C: 6.0 (0.1 to 28.0)
|
VATS or RATS
|
Sternotomy or thoracotomy
|
Length of follow-up: NR
Loss-to-follow-up: Intervention: 0 Control: 0
Incomplete outcome data: Intervention: 0 Control: 0
|
R0 resection Intervention: 256 (96%) Control: 255 (96%)
|
|
|
Burt, 2019 |
Type of study: Retrospective cohort
Setting and country: Hospitals, USA
Funding and conflicts of interest: NR |
Inclusion criteria: - Masaoka-Koga Stage I or II thymoma - Diagnosed between 2010 and 2014 Aged 18 to 90
Exclusion criteria: Thymic carcinoma
N total at baseline: Intervention: 295 Control: 648
Important prognostic factors2: Age ± SD I: 60.4 ± 12.7 C: 59.2 ± 14.3
Sex I: 44.4% M / 55.6% F C: 45.5% M /54.5% F
Tumor stage and size MIT I: 72.5% II: 27.5%
≤3cm: 41.5% >3 and ≤5 cm: 32.8% >5 and ≤8: 17.1% >8 cm: 8.7%
OT I: 69% II: 31%
≤3cm: 28.3% >3 and ≤5 cm: 27.2% >5 and ≤8: 26.8% >8 cm: 17.7% |
Thoracoscopic and robot-assisted approaches
|
Open thymectomy
|
Length of follow-up: NR
Loss-to-follow-up: Intervention: 0 Control: 0
Incomplete outcome data: Total: 8.6% missing covariate data
|
R0 resection Intervention: 83.1% Control: 79.0%
Length of stay Mean -1.03 days (95% CI; -1.68 to -0.38) compared to the OT
|
|
|
Fadayomi, 2017 |
Type of study: Retrospective cohort
Setting and country: Hospitals, USA
Funding and conflicts of interest: None and none |
Inclusion criteria: Masaoka Stage I and II
Exclusion criteria: Patients with thymic carcinoma, hyperplasia, atrophy, lymphomas, and benign thymic pathologies were excluded. Patients who underwent a concurrent extrapleural pneumonectomy and had stage III and IV thymoma were also excluded
N total at baseline: Intervention: 19 Control: 34
Important prognostic factors2: Age median in years (range) I: 60 (47 to 72) C: 60.5 (46 to 71)
Sex I: 53% M / 47% F C: 56% M / 44% F
Tumor type and median size MIT I: 5 (26%) II: 14 (74%)
4.9 cm (2.5 to 8)
OT I: 11 (32%) II: 23 (68%)
5.5cm (4 to 9) |
MIT
|
OT
|
Length of follow-up: I: Median 27 months C: Median 52.5 months
Loss-to-follow-up: Intervention: 0 Control: 0
Incomplete outcome data: Intervention: 0 Control: 0
|
R0 resection Intervention: 47% Control: 44%
Length of stay (≥4 days) Intervention: 16% Control: 71%
|
|
|
Yang, 2020 |
Type of study: Retrospective cohort
Setting and country: Hospitals, USA
Funding and conflicts of interest:
Dr D’Amico is a consultant for Scanlan (<$10,000) and Medtronic (<$5000). All other authors have nothing to disclose with regard to commercial support. |
Inclusion criteria: Patients diagnosed with stage I to III Thymoma
Exclusion criteria: Nonmalignant pathology, history of unrelated malignancy, and age less than 18 years.
N total at baseline: Intervention: 317 Control: 906
Propensity score-matched analysis Intervention: 185 Control: 185
Propensity score-matched analysis of patients without comorbidities Intervention: 141 Control: 141
Propensity score-matched analysis for stage I and II Intervention: 165 Control: 165
Propensity score-matched analysis for patients with tumors less than 4 centimeters Intervention: 37 Control: 37
Important prognostic factors2: Age in years ± SD I: 59.6 ± 12.7 C: 57.4 ± 14.1
Sex I: 46.4% M / 53.6% F C: 46.4% M / 53.6% F
Tumor size median (IQR) I: 49.5 mm (35-70) C: 65 mm (45 to 90)
|
VATS or RATS
|
Open thymectomy
|
Median length of follow-up (in propensity score-matched groups): I: 36.4 months (IQR 25.8-55.4) C: 35.9 months (IQR 25.4-50.5)
Loss-to-follow-up: Not reported
Incomplete outcome data: Not reported
|
Propensity score-matched analysis R0 resection I: N=141 (76.2%) C: N=129 (69.7%)
30-day mortality I: N<10 C: N<10
90-day mortality I: N<10 C: N<10
Length of stay median (IQR) I: 3 days (2-4) C: 4 days (3-5)
Propensity score-matched analysis of patients without comorbidities R0 resection I: N=102 (72.3%) C: N=96 (68.1%)
30-day mortality I: N<10 C: N=0
90-day mortality I: N<10 C: N=0
Length of stay median (IQR) I: 3 days (2-4) C: 4 days (3-5)
Propensity score-matched analysis for stage I and II R0 resection I: N=130 (78.8%) C: N=128 (77.6%)
30-day mortality I: N<10 C: N=0
90-day mortality I: N<10 C: N<10
Length of stay median (IQR) I: 3 days (1-4) C: 4 days (3-5)
Propensity score-matched analysis for patients with tumors less than 4 centimeters R0 resection I: N=31 (83.8%) C: N=31 (83.8%)
30-day mortality I: N<10 C: N=0
90-day mortality I: N<10 C: N=0
Length of stay median (IQR) I: 2 days (1-4) C: 2.5 days (2-4) |
|
|
MIT = minimally invasive thymectomy; OT = open thymectomy; NR = Not reported; VATS = video-assisted thoracoscopy; RATS = robotic-assisted thoracoscopy |
|||||||
Risk of bias table for interventions cohort studies
|
Author, year |
Selection of participants
Was selection of exposed and non-exposed cohorts drawn from the same population?
|
Exposure
Can we be confident in the assessment of exposure?
|
Outcome of interest
Can we be confident that the outcome of interest was not present at start of study?
|
Confounding-assessment
Can we be confident in the assessment of confounding factors?
|
Confounding-analysis
Did the study match exposed and unexposed for all variables that are associated with the outcome of interest or did the statistical analysis adjust for these confounding variables?
|
Assessment of outcome
Can we be confident in the assessment of outcome?
|
Follow up
Was the follow up of cohorts adequate? In particular, was outcome data complete or imputed?
|
Co-interventions
Were co-interventions similar between groups?
|
Overall Risk of bias
|
|
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Low, Some concerns, High |
|
|
Ye, 2014a |
Definitely yes
Reason: all patients that underwent treatment were selected
|
Definitely yes
Reason: surgical records
|
Definitely yes
Reason: patients had their tumors removed
|
Definitely yes
Reason: patients were dismissed when recovered
|
Definitely yes /
Reason: propensity score showed no influence by possible confounders
|
Probably yes
Reason: medical records |
Definitely yes
Reason: No lost to follow-up
|
Definitely yes
Reason: same conditions
|
Low |
|
Ye, 2014b |
Definitely
Reason: : all patients that underwent treatment were selected |
Definitely yes
Reason: surgical records
|
Definitely yes
Reason: patients had their tumors removed
|
Definitely yes
Reason: pathology confirmed resection
|
Probably no
Reason: No adjustment matching or propensity score mentioned
|
Probably yes
Reason: pathology confirmed resection |
Probably no
Reason: No lost to follow-up reported
|
Definitely yes
Reason: same conditions
|
Low: R0 resection
Some concerns: hospital stay |
|
Kimura, 2013 |
Definitely yes
Reason: consecutive cases |
Definitely yes
Reason: surgical records
|
Definitely yes
Reason: patients had their tumors removed
|
Definitely yes
Reason: patients were dismissed when recovered
|
Probably no
Reason: No adjustment matching or propensity score mentioned
|
Probably yes
Reason: medical records |
Definitely yes
Reason: no lost to follow-up
|
Definitely yes
Reason: same conditions
|
Some concerns |
|
Chung, 2012 |
Definitely yes
Reason: : all patients that underwent treatment were selected |
Definitely yes Definitely yes
Reason: surgical records
|
Definitely yes
Reason: patients had their tumors removed
|
Definitely yes
Reason: patients were dismissed when recovered
|
Probably no
Reason: No adjustment matching or propensity score mentioned |
Probably yes
Reason: medical records |
Probably no
Reason: No lost to follow-up reported
|
Definitely yes
Reason: same conditions
|
Some concerns |
|
Odaka, 2010 |
Definitely yes
Reason: All patients that underwent treatment were selected |
Definitely yes
Reason: surgical records
|
Definitely yes
Reason: patients had their tumors removed
|
Definitely yes
Reason: pathology confirmed resection
|
Probably no
Reason: No adjustment matching or propensity score mentioned |
Probably yes
Reason: medical records |
Probably no
Reason: No lost to follow-up reported
|
Definitely yes
Reason: same conditions
|
Some concerns |
|
Allakhverdiev, 2019 |
Probably yes
Reason: All patients that underwent treatment were selected |
No information Reason: No information regarding exposure assessment |
Definitely yes
Reason: patients had their tumors removed
|
No information Reason: No information on assessment of confounding factors |
Probably no:
Reason: No information on assessment of confounding factors. Probably no adjustment. |
No information Reason: No information on assessment of outcome |
Probably no
Reason: No lost to follow-up reported
|
No information |
High |
|
Burt, 2017 |
Probably yes
Reason: Patients were drawn from same database |
Probably yes
Reason: Database study |
Definitely yes
Reason: patients had their tumors removed
|
Definitely yes
Reason: Baseline characteristic were reported |
Definitely yes
Reason: Propensity matching was performed |
Definitely yes Reason: R0 outcome was defined in database from surgical report |
Probably no
Reason: No lost to follow-up reported
|
No information |
Low |
|
Burt, 2019 |
Probably yes
Reason: Patients were drawn from same database |
Probably yes
Reason: Database study |
Definitely yes
Reason: patients had their tumors removed
|
Definitely yes
Reason: Baseline characteristic were reported |
Probably no
Reason: No adjustment for confounding factors in analysis |
Definitely yes Reason: R0 outcome was defined in database from surgical report |
Probably yes
Reason: Loss-to-follow-up was reported and data was imputed
|
Noinformation |
Some concerns |
|
Fadayomi, 2017 |
Probably yes
Reason: Patients were drawn from same database |
Probably yes
Reason: Database study |
Definitely yes
Reason: patients had their tumors removed
|
Definitely yes
Reason: Baseline characteristic were reported |
Definitely yes
Reason: No propensity score estimation regarding outcomes of interest |
Definitely yes Reason: Outcomes from medical records |
Probably no
Reason: No lost to follow-up reported
|
No information |
Some concerns |
|
Yang, 2020 |
Probably yes
Reason: Patients were drawn from same database |
Probably yes
Reason: Database study |
Definitely yes
Reason: patients had their tumors removed
|
Probably yes
Reason: Baseline characteristic were reported |
Definitely yes
Reason: Propensity matching was performed |
Probably yes
Reason: Data was obtained from medical records |
Probably no
Reason: No loss to follow-up reported
|
No information |
Low |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Tianci C, Shen Z, Chen S, Lin Y, Gao L, Zhang Z, Kang M, Lin J. Median sternotomy versus minimally invasive thymectomy for early-stage thymoma: A systematic review and meta-analysis protocol. Medicine (Baltimore). 2019 Dec;98(51):e18359. doi: 10.1097/MD.0000000000018359. PMID: 31860993; PMCID: PMC6940122. |
Wrong design: Study protocol |
|
Friedant AJ, Handorf EA, Su S, Scott WJ. Minimally Invasive versus Open Thymectomy for Thymic Malignancies: Systematic Review and Meta-Analysis. J Thorac Oncol. 2016 Jan;11(1):30-8. doi: 10.1016/j.jtho.2015.08.004. PMID: 26762737; PMCID: PMC7560956. |
Includes single arm studies |
|
Lee Y, Samarasinghe Y, Patel J, Khondker A, McKechnie T, Samarasinghe N, Finley C, Hanna W, Shargall Y, Agzarian J. The short and long-term effects of open vs minimally invasive thymectomy in myasthenia gravis patients: a systematic review and meta-analysis. Surg Endosc. 2023 May;37(5):3321-3339. doi: 10.1007/s00464-022-09757-y. Epub 2022 Dec 20. PMID: 36539629. |
Wrong population: Myasthenia Gravis patients alone
|
|
O'Sullivan KE, Kreaden US, Hebert AE, Eaton D, Redmond KC. A systematic review of robotic versus open and video assisted thoracoscopic surgery (VATS) approaches for thymectomy. Ann Cardiothorac Surg. 2019 Mar;8(2):174-193. doi: 10.21037/acs.2019.02.04. PMID: 31032201; PMCID: PMC6462547. |
Wrong comparison: robot versus open (no VATS) |
|
Yang Y, Dong J, Huang Y. Thoracoscopic thymectomy versus open thymectomy for the treatment of thymoma: A meta-analysis. Eur J Surg Oncol. 2016 Nov;42(11):1720-1728. doi: 10.1016/j.ejso.2016.03.029. Epub 2016 Apr 12. PMID: 27139936. |
Thoracoscopy versus open; thymoma; also patients with myastenia Gravis; subgroep analysis for stage I-II |
|
Buentzel J, Straube C, Heinz J, Roever C, Beham A, Emmert A, Hinterthaner M, Danner BC, Emmert A. Thymectomy via open surgery or robotic video assisted thoracic surgery: Can a recommendation already be made? Medicine (Baltimore). 2017 Jun;96(24):e7161. doi: 10.1097/MD.0000000000007161. PMID: 28614249; PMCID: PMC5478334. |
RVATS versus open; thymoma |
|
Rusidanmu A, Feng M, Xu J, Wang L, He C, Hu J. Trans-sternotomy versus video-assisted thoracic surgery for early-stage thymoma patients: a meta-analysis. Gland Surg. 2020 Apr;9(2):342-351. doi: 10.21037/gs.2020.03.10. PMID: 32420258; PMCID: PMC7225494. |
VATS versus trans sternotomy; early-stage thymoma |
|
Xie A, Tjahjono R, Phan K, Yan TD. Video-assisted thoracoscopic surgery versus open thymectomy for thymoma: a systematic review. Ann Cardiothorac Surg. 2015 Nov;4(6):495-508. doi: 10.3978/j.issn.2225-319X.2015.08.01. PMID: 26693145; PMCID: PMC4669250. |
VATS versus open; Includes atients with MG |
|
Lv L, Li W, Men W, Liu Z, Jiang C. Comparing the safety and efficacy of thoracoscopic surgery and thoracotomy for thymoma: a systematic review and meta-analysis. Gland Surg. 2021 Dec;10(12):3378-3388. doi: 10.21037/gs-21-786. PMID: 35070898; PMCID: PMC8749091. |
Thoracoscopic versus open; thymoma
|
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 31-08-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met epitheliale thymustumoren.
Werkgroep
- Dr. M.M.H. Hochstenbag, Longarts, Maastricht UMC, Maastricht, NVALT (voorzitter)
- Dr. F.D. Marcuse, Longarts, Maastricht UMC, Maastricht, NVALT
- Dr. D. Dumoulin, Erasmus MC, Rotterdam, NVALT
- Dr. K.J. Hartemink, Chirurg, Antoni van Leeuwenhoek, Amsterdam, NVvH
- Dr. J.G.J. Hoeijmakers, Neuroloog, Maastricht UMC, Maastricht, NVN
- Dr. T.A. Mulders, Nucleair Geneeskundige, Erasmus MC, Rotterdam, NVNG
- Dr. M.A. den Bakker, Patholoog, Maasstadziekenhuis, Rotterdam, NVvP
- Dr. J.H. van der Thüsen, Patholoog, Erasmus MC, Rotterdam, NVvP
- Dr. A.B. Donkers-van Rossum, Radioloog, Catharinaziekenhuis, Eindhoven, NVvR
- Dr. S. Peeters, Radiotherapeut, Maastro clinic, Maastricht, NVRO
- Drs. S. M. van der Heide, Cardio-thoracale chirurg, Radboud UMC, Nijmegen, NVT
- Drs. L. Barberio, Directeur Longkanker Nederland, Utrecht
Met ondersteuning van
- Dr. C. Gaasterland, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. D. Nieboer, Senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. N. Zielonke, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. Lisanne Verbruggen, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. M. te Lintel Hekkert, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. S van Duijn, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- D.P. Gutierrez, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie |
|
Hochstenbag* |
Longarts met aandachtsgebied long oncologie. Werkgever: MUMC |
Geen |
Nee |
Nee |
Nee |
Nee |
Nee |
16-9-2021 |
Geen |
|
Hartemink |
Dr. K.J. Hartemink, chirurg |
Onbetaald: |
1. Expert panel; behandeling van vroeg-stadium NSCLC (eenmalige vergoeding MSD; euro 420,-) (6-2021). |
Geen |
KWF-grant ontvangen (2021) voor het doen van onderzoek naar radiotherapie en chirurgie bij het vroeg-stadium NSCLC. |
Geen |
Geen |
4-6-2021 |
Geen restricties, tenzij producten van Medtronic in de richtlijn besproken worden |
|
Donkers- van Rossum |
Radioloog, werkzaam sinds 1998 Catharina ziekenhuis Eindhoven |
* Screeningsradioloog Borstkanker Regio Zuid Nederland. Betaald via vakgroep |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
8-6-2021 |
Geen |
|
Peeters |
Radiotherapeut-oncoloog bij Maastro, Maastricht |
Geen |
Geen |
Neen |
Niet van toepassing |
Geen |
Geen |
15-6-2021 |
Geen |
|
Hoeijmakers |
Neuroloog Maastricht Universitair Medisch Centrum+ (Maastricht UMC+), Maasticht. Binnen deze functie gespecialiseerd in neuromusculaire aandoeningen |
* Bestuurslid Spierzieken Centrum Nederland (SCN), als vertegenwoordiger van het Maastricht UMC+. SCN is een samenwerkingsverband van artsen en onderzoekers uit alle universitaire medische centra die gespecialiseerd zijn in neuromusculaire aandoeningen. |
De richtlijn zal geen persoonlijk financieel voordeel opleveren |
Er zijn geen voordelen voor persoonlijke relaties |
Er is geen sprake van deelname aan onderzoek dat wordt gefinancierd door (semi)overheid, fondsen of industrie, waarbij de finacier belangen kan hebben bij (een bepaalde uitkomst van ) het advies of de richtlijn |
Er zijn geen intellectuele belangen |
Er zijn geen overige belangen in relatie tot de richtlijn |
17-6-2021 |
Geen |
|
Thüsen, von der |
Patholoog, Erasmus MC |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
* Mede-organisator Thymoompanel |
Niet van toepassing |
10-8-2021 |
Geen |
|
Marcuse |
Longarts in opleiding (AIOS), Maastricht Universitair Medisch Centrum |
* Promovenda: Universiteit Maastricht - onbetaald |
Geen |
Geen |
Geen |
Geen |
Geen |
16-9-2021 |
Geen |
|
Bakker, den |
Patholoog in het Maasstad Ziekenhuis, in Maatschapsverband |
Gastvrijheisovereenkomst afdeling pathologie Erasmus MC |
Geen |
Geen |
Beter Keten project - Anser promotietraject - Projecteider |
Geen |
Geen |
23-11-2021 |
Geen |
|
Mulders |
Nucleair Geneeskundige / Radioloog Erasmus MC |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
24-11-2021 |
Geen |
|
Heide, van der |
Cardiothoracaal chirurg werkzaam in het RadboudUMC |
Geen |
Geen |
Geen |
Geen |
Geen, derhalve dat de afdeling Cardiothoracale chirurgie, waaronder ikzelf, operaties met betrekking tot mediastinale tumoren verricht |
Geen |
25-11-2021 |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname van de directeur van de stichting Longkanker Nederland in de werkgroep. Deze afgevaardigde heeft samen met adviseurs van het Kennisinstituut een focusgroep georganiseerd met een zestal patiënten om de knelpunten vorm te geven en de overwegingen en aanbevelingen te informeren. Daarnaast heeft zij meebeslist bij het opstellen van de overwegingen.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er geen substantiële financiële gevolgen zijn voor deze richtlijn, gezien het aantal patiënten kleiner is dan 5000.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep en aangeschreven verenigingen de knelpunten in de zorg voor patiënten met Epitheliale Thymustumoren in een Invitational Conference. Er werden knelpunten aangedragen door de deelnemende WV-en, Longkanker Nederland en de patiënten die deelnamen aan de focusgroep.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
