Antibiotica profylaxe
Uitgangsvraag
Wat is de toegevoegde waarde van het profylactisch toedienen van antibiotica aan patiënten die plaatsing van een percutane endoscopische gastrostomie (PEG) katheter of een percutane radiologische gastrostomie (PRG) katheter ondergaan.
Deze module bevat de onderstaande vragen:
- Op welke manier en wanneer wordt de antibiotica aan de patiënt toegediend?
- Welk profylactisch antibioticum moet worden toegediend?
Aanbeveling
Geef antibiotica profylaxe bij patiënten die een PEG plaatsing ondergaan*.
Het type antibioticum welke voorafgaand aan PEG plaatsing wordt gegeven, dient in overleg met de lokale antibiotica commissie gekozen te worden. De Nederlandse SWAB Richtlijn Perioperatieve profylaxe adviseert bij volwassenen het eerste generatie cefalosporine, cefazoline i.v. (1-2 gram binnen 60 minuten voor incisie). Bij allergie clindamycine en een aminoglycoside.
* Praktisch gezien zou het antibiotica beleid uniform moeten worden toegepast voor zowel een pull (PEG, PEG-J en PEJ) als push PEG, inclusief de percutane radiologische gastrostomie (PRG) sonde.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Op basis van de beschikbare studies lijkt het profylactisch gebruik van systemische antibiotica het risico op de cruciale uitkomstmaat peristomale infecties te verkleinen, in vergelijking met placebo of geen behandeling. De geïncludeerde studies werden echter beperkt door het lage aantal events (redelijk GRADE). We zijn onzeker over het effect van profylactische systemische antibiotica op de cruciale uitkomstmaat mortaliteit. De geïncludeerde studies werden beperkt door het lage aantal events en risico op bias (zeer laag GRADE). Er waren te weinig data beschikbaar om een conclusie te trekken over het effect van profylactische antibiotica op de cruciale uitkomstmaat verwijdering van de PEG of PRG sonde. De overall bewijskracht is hiermee zeer laag.
In de meeste geïncludeerde studies werd er 30 minuten voorafgaand aan de PEG plaatsing een enkele dosis antibiotica toegediend. In twee van de geïncludeerde studies (Akkersdijk, 1995 en Jonas, 1985) werden ook in de uren na de PEG plaatsing nog twee doses antibiotica toegediend. De resultaten uit deze studies waren vergelijkbaar met de resultaten uit de overige geïncludeerde studies, wat suggereert dat er geen additionele waarde lijkt te zijn om profylactisch antibiotica voor én na de PEG plaatsing toe te dienen. Dit komt overeen met de Nederlandse Stichting Werkgroep Antibioticabeleid (SWAB) Richtlijn Perioperatieve profylaxe (Bauer, 2019).
Manier van toediening van de antibiotica
Er zijn diverse manieren om de antibiotica toe te dienen. Klassiek is de intraveneuze toediening voorafgaand aan de ingreep, zoals deze ook voor chirurgische procedures plaatsvindt. Echter, is niet altijd duidelijk of de intraveneuze toediening daadwerkelijk heeft plaatsgevonden of blijkt na de toediening van de antibiotica dat de procedure niet kan worden uitgevoerd. Deze issues spelen niet bij toediening van de antibiotica door de endoscopist, direct na de procedure via de net geplaatste PEG of PRG sonde. In een RCT van Blomberg (2010) wordt de toediening van cotrimoxazol (800 mg sulfamethoxazol en 160 mg trimethoprim) in 20 mL via de net geplaatste PEG sonde vergeleken met de intraveneuze toediening van cefuroxim 1,5 gram een uur voorafgaand aan de PEG plaatsing. Het toedienen van de antibiotica via de PEG was even effectief als de intraveneuze toediening van antibiotica. Om zo flexibel mogelijk te zijn op de endoscopie afdeling, kan er daarom gekozen worden om de antibiotica zelf toe te dienen via de geplaatste PEG of PRG sonde. Op deze manier is men niet afhankelijk van een verpleegafdeling waar het antibioticum wel of niet op tijd is gegeven voorafgaand aan de PEG of PRG plaatsing en krijgen patiënten ook niet onnodig een gift antibioticum als de PEG of PRG plaatsing onverhoopt niet is gelukt.
Soort antibiotica
In alle geïncludeerde studies werden breedspectrum antibiotica toegepast. Welk soort antibioticum werd gebruikt, was grotendeels afhankelijk van het land waar de studie op dat moment werd uitgevoerd. Er zijn enkele studies die onderzoek gedaan hebben naar verschillende soorten antibiotica, gegeven voorafgaand aan PEG plaatsing. Gossner (1999) vergeleek cefotaxim 2 gr (n=101) met piperacilline/tazobactam 4,5 gr (n=100). In deze studie werd geen statistisch significant verschil tussen de groepen gevonden in de preventie van peristomale infecties na PEG plaatsing. In een systematisch review van Jafri (2007) vond men dat patiënten die voorafgaand aan PEG plaatsing een antibioticum uit de penicilline-groep kregen, gelijke peristomale wondinfectie percentages hadden als patiënten die een antibioticum uit de cefalosporinen-groep hadden gekregen. De number needed to treat (NNT) voor cefalosporine was tien in vergelijking met zes voor penicilline; dit verschil was echter niet statistisch significant. Omdat er geen studies zijn waaruit duidelijk een voorkeur voor een bepaald soort antibioticum naar voren komt, is de werkgroep van mening dat het type profylaxe voorafgaand aan PEG plaatsing in overleg met de lokale antibiotica commissie gekozen moet worden. Praktisch gezien zou het antibiotica beleid ons inziens uniform moeten worden toegepast voor zowel een pull (PEG, PEG-J en PEJ) als push PEG, inclusief de percutane radiologische gastrostomie (PRG) sonde.
In de Nederlandse SWAB Richtlijn Peri-operatieve profylaxe staat geen duidelijk advies omtrent het wel of niet geven van antibiotica voorafgaand aan een PEG of PRG sonde plaatsing. Mogelijk dat een PEG of PRG plaatsing valt onder het hoofdstuk perioperatieve profylaxe bij “schoon-besmette wonden”. Dit is gedefinieerd als ingrepen waarbij een met bacteriën gekoloniseerde, maar niet geïnfecteerde tractus is geopend onder gecontroleerde omstandigheden. In deze gevallen adviseert de SWAB richtlijn voor volwassenen het eerste generatie cefalosporine cefazoline i.v. (1-2 gram binnen 60 minuten voor incisie). Bij allergie clindamycine en een aminoglycoside. De commissie beschouwt als belangrijkste voorwaarde voor de infusieduur dat de volledige gift antibioticum toegediend is op het moment van incisie. Dit is echter in strijd met de resultaten uit de RCT van Blomberg (2010) waarbij er geen verschil werd waargenomen tussen het geven van antibiotica via de direct geplaatste PEG-sonde versus één uur voorafgaand aan de PEG-sonde plaatsing. Ondanks dat dit een prospectieve studie is die zich toespitst op onze specifieke zoekvraag, is dit slechts een enkele studie. De werkgroep is van mening dat dit issue meer onderzoek behoeft. In de European Society of Gastrointestinal Endoscopy (ESGE) Guideline (Gkolfakis, 2021) wordt deze methode - 20 mL co-trimoxazol via de zojuist geplaatste PEG-sonde - als een alternatief voorgesteld bij patiënten met een penicilline allergie. Tevens wordt geadviseerd om geen profylactische antibiotica voor te schrijven aan patiënten die reeds antibiotica krijgen.
Toegevoegde waarde van gazen met antibiotica
In de RCT van Radhakrishnan (2006) werd de profylactische toediening van antibiotica (A) vergeleken met een huiddesinfectans (povidone-iodine, B) of een combinatie van antibiotica en huiddesinfectans (C). In zowel groep A als groep B werd er voor 32% van de patiënten een peristomale infectie gerapporteerd. Dit gold voor 3% van de patiënten in groep C. In een retrospectieve studie (Strijbos, 2016) werden gegevens van 331 patiënten geanalyseerd, waarbij na de PEG plaatsing gedurende drie dagen een antibacterieel gaas (polyhexamethylene biguanide) rondom de insteekopening werd geplaatst. Deze patiënten kregen geen periprocedurele antibiotica toegediend. Na twee weken was er bij 31/331 (9,4%) van de PEG plaatsingen een peristomale infectie opgetreden. Dit komt overeen met internationaal gerapporteerde incidentie cijfers betreffende peristomale infecties tussen de 9 en 15%. De auteurs concludeerden daarom dat antibacteriële gazen vergelijkbaar zijn met profylactische antibiotica in de preventie van peristomale infecties. De werkgroep is van mening dat dit belangrijke data zijn, maar dat er nog te weinig gegevens zijn om het gebruik van antibacteriële gazen landelijk te implementeren.
Steriel werken
De werkgroep is van mening dat er onvoldoende gegevens beschikbaar zijn om goede adviezen te geven met betrekking tot de mate van steriel werken rondom PEG of PRG plaatsing. Ze bevelen aan om hier lokaal goede afspraken over te maken.
Mondspoeling met chloor hexidine
Er zijn geen goede data beschikbaar om een advies te geven met betrekking tot mondspoeling met chloor hexidine.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Het toepassen van antibiotica profylaxe zal niet leiden tot een grotere belasting voor de patiënt. Bij vrijwel elke patiënt die een PEG of PRG plaatsing ondergaat, zal een infuusnaald reeds zijn ingebracht. Hierdoor zal het voor de patiënt niet veel uitmaken of de antibiotica intraveneus of via de sonde wordt toegediend. Er zijn mogelijk wel patiënten die allergisch of intolerant zijn voor antibiotica. In deze gevallen kan in overleg met de patiënt er voor worden gekozen om geen antibiotica toe te dienen.
Kosten (middelenbeslag)
Külling (2000) voerde op basis van zeven RCT’s een kosteneffectiviteitsanalyse uit naar het gebruik van profylactische antibiotica bij PEG sonde plaatsing. Hierbij keken ze naar de kosten die gepaard gaan met het geven van profylactische antibiotica versus het behandelen van een peristomale infectie als gevolg van de PEG plaatsing. Uitgaande van de gemiddelde kosten van $13.10 voor antibiotica, leverde het gebruik van profylactische antibiotica bij PEG plaatsing een kostenbesparing op van $76.72 per PEG sonde plaatsing. In deze one-way sensitiviteitsanalyse is er niet gekeken naar eventuele secundaire complicaties als gevolg van de infectie. Het oordeel van deze Amerikaanse auteurs was dat het geven van profylactische antibiotica voorafgaand aan PEG plaatsing een kosteneffectieve behandeling is.
Aanvaardbaarheid, haalbaarheid en implementatie
Er zijn geen relevante punten met betrekking tot aanvaardbaarheid, haalbaarheid en implementatie.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Uit de internationale literatuur blijkt dat de toediening van profylactische antibiotica het risico op peristomale infecties lijkt te verminderen. Dit komt overeen met de ervaringen die zijn opgedaan binnen deze kwetsbare patiënten populatie. Het soort toe te dienen antibiotica is afhankelijk van het lokale antibiotica formularium. Dit dient dan ook per ziekenhuis te worden vastgesteld. De manier waarop de antibiotica wordt toegediend, is met name gebaseerd op praktische klinische toepasbaarheid.
Onderbouwing
Achtergrond
Patiënten die een PEG- of PRG-plaatsing ondergaan, zijn vaak vatbaar voor infecties vanwege onder andere hun leeftijd, slechte voedingsstatus, het gebruik van immuun-suppressiva, of onderliggende ziekte zoals een maligniteit of diabetes mellitus. Er bestaat een hypothese dat met behulp van de zogenaamde ‘pull methode’ bacteriën vanuit het oro-pharyngeale gebied worden meegesleept en op die manier bijdragen aan het optreden van peri-stomale infecties. Mede daarom wordt in het algemeen geadviseerd om profylactisch antibiotica toe te dienen aan patiënten die een PEG- of PRG-plaatsing ondergaan. Echter, wat is hiervoor het wetenschappelijke bewijs?
Conclusies / Summary of Findings
Peristomal infections
|
Moderate GRADE |
Prophylactic use of systemic antibiotics is likely to decrease the risk of peristomal infections, as compared to placebo or no treatment in patients undergoing PEG placement.
Sources: (Lipp, 2013; Ingraham, 2017) |
Mortality
|
Very low GRADE |
It is unclear what the effect is ofprophylactic use of systemic antibiotics on mortality, as compared to placebo or no treatment in patients undergoing PEG placement.
Sources: (Lipp, 2013; Ingraham, 2017) |
Systemic infections
|
Low GRADE |
Prophylactic use of systemic antibiotics might decrease risk on systemic infections, as compared to placebo or no treatment in patients undergoing PEG placement.
Sources: (Lipp, 2013; Ingraham, 2017) |
Peritonitis
|
- GRADE |
Due to few events, it was not possible to draw conclusions on the effect of prophylactic use of systemic antibiotics on peritonitis, as compared to placebo or no treatment in patients undergoing PEG placement.
Sources: (Lipp, 2013) |
Length of hospital stay
|
- GRADE |
None of the included studies reported on the outcome measure length of hospital stay. |
PEG or PRG removal
|
- GRADE |
Due to few events, it was not possible to draw conclusions on the effect of prophylactic use of systemic antibiotics on PEG removal, as compared to placebo or no treatment in patients undergoing PEG placement.
Sources: (Lipp, 2013) |
Samenvatting literatuur
Summary of literature
Description of studies
Lipp (2013) performed a systematic review and meta-analysis to find out whether prophylactic use of systemic antibiotics reduces the risk of peristomal infections in patients receiving PEG (third update). They searched several databases, including the Cochrane Central Register of Controlled Trials, Ovid Medline and Ovid Embase. Thirteen eligible RCTs were included with a total of 1,637 patients. Indications for PEG placement included malignancy, neurological conditions or other conditions. All trials took place in industrial countries. In all trials antibiotics were administered intravenously. PEG was inserted using the pull or push method. Length of follow-up ranged from three to 30 days, with most of the trials following patients until day seven. The included studies were assessed using the Cochrane Collaboration tool, which revealed low risk on bias in most of the trials. Primary outcome was peristomal infection as defined by the study authors, up to 30 days after placement of PEG tube. One of the trials was not included in the pooled analysis on peristomal infections, since they compared intravenous antibiotics with antibiotics via PEG. For our analysis, we excluded another trial, because of the use of skin antiseptic (povidone-iodine) in the control group. A total of 11 trials were therefore included in our analysis. Table 3.1 lists more details of the interventions that were applied in the included studies.
Ingraham (2017) performed a double blind, randomized placebo-controlled trial in the United States of America, which was aimed to find out the effect of prophylactic antibiotics on peristomal infections in patients undergoing PEG placement. A total of 68 patients were included. Indications for PEG placement included neurologic disease or head and neck cancer. Patients in the antibiotic treatment group (n=34) received a single dose of antibiotics 30 minutes prior to the PEG placement (cefazolin 1 g intravenously, or clindamycin 600 mg intravenously if allergic to b-lactams (n = 4)). A similar volume of normal saline was given 30 minutes prior to the PEG procedure to patients in the control group (Table 3.1). Patients receiving antibiotics due to other infections are included in the intention to treat analysis, which might have led to a reduction in infections in placebo group. Primary outcome was peristomal infections, reported as early (3 to 5 days after, 7 to 10 days after PEG placement) or late infections (14 to 17 days after, 28 to 30 days after placement of PEG tube). Patients were followed for 30 days.
Table 1: Description of the interventions, number and timing of gifts of the included studies (Lipp, 2013) and the study of Ingraham (2017)
|
Study |
Intervention |
Control |
Number of gifts |
Timing of gifts |
|
Ahmad, 2003 |
Cefuroxime 750 mg IV |
Saline IV |
Single gift |
30 min prior to PEG |
|
Akkersdijk, 1995 |
Augmentin 1.2 g IV |
No treatment |
3 doses |
30 min prior to PEG, 2 further doses over 24h |
|
Dormann, 2000 |
Ceftriaxone 1 g IV |
No treatment |
Single gift |
30 min prior to PEG |
|
Gossner, 1999 |
Cefotaxime 2 g by infusion or piperacillin 2 g + 0.5 g tazobactam |
No treatment |
Single gift |
30 min prior to PEG (cefotaxime), infusion given over 20 min (piperacillin / tazobactam) |
|
Jain, 1987 |
Cefazolin 1 g IV |
Saline IV |
Single gift |
30 min prior to PEG |
|
Jonas, 1985 |
Cefoxitin 1 g IV |
Saline IV |
3 doses (not stated for placebo) |
30 min prior to PEG, 2 further doses at 6h intervals |
|
Panigrahi, 2000 |
Co-amoxiclav IV (dose not stated) |
Saline IV |
Single gift |
15-30 min prior to PEG |
|
Preclik, 1999 |
Co-amoxiclav 2.2 g by short infusion |
Saline by short infusion |
Single gift |
30 min prior to PEG |
|
Saadeddin, 2005 |
Co-amoxiclav 2.2 g or cefotaxime 2 g (in case of allergy) |
Placebo (not stated) |
Single gift |
At time of PEG tube insertion |
|
Shastri, 2008 |
Ceftriaxone 2 g IV |
Placebo IV (similar looking & volume) |
Single gift |
Not stated |
|
Sturgis, 1996 |
Cefazolin 1 g IV |
Saline IV |
Single gift |
Within 30 min of PEG |
|
Ingraham, 2017 |
Cefazolin 1 g IV or clindamycin 600 mg IV (in case of allergy) |
Saline (similar volume) |
Single gift |
30 min prior to PEG |
Results
Peristomal infection
All included studies reported on peristomal infections. Results are stratified by pull technique versus push or unknown technique. Using the pull method, 42/557 (7.5%) patients in the antibiotic group developed peristomal infections, compared to 112/466 (24.0%) patients in the control group. The relative risk (95%CI) was 0.40 (0.27 to 0.58), in favor of the antibiotic group (Figure 3.2). This difference was statistically significant and clinically relevant (RR<0.8). Using push or unknown method, 10/114 (8.8%) patients in the antibiotic treatment group developed peristomal infections compared to 28/140 (20%) patients in the control group. The relative risk (95%CI) was 0.51 (0.26 to 1.02), in favor of the antibiotic group (Figure 3.2). This difference was statistically not significant, but clinically relevant (RR< 0.8).
Figure 1: The effect of prophylactic use of antibiotics in patients undergoing PEG placements compared to placebo or no treatment
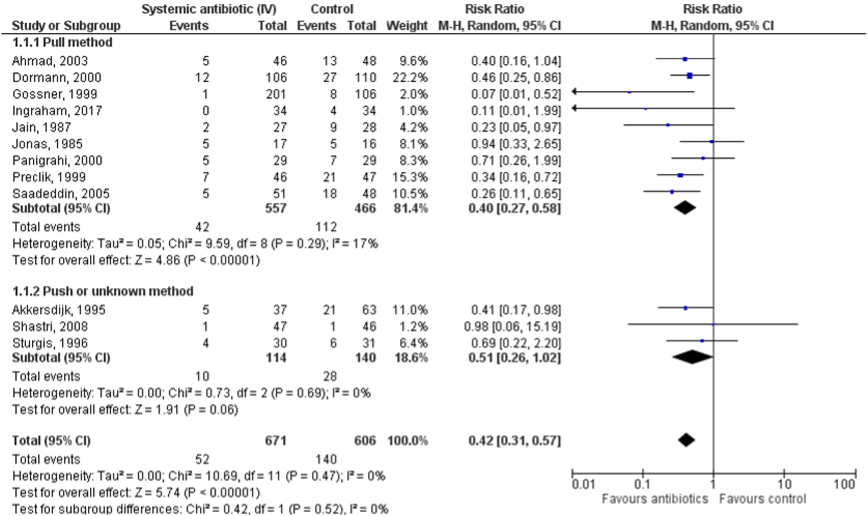
Mortality
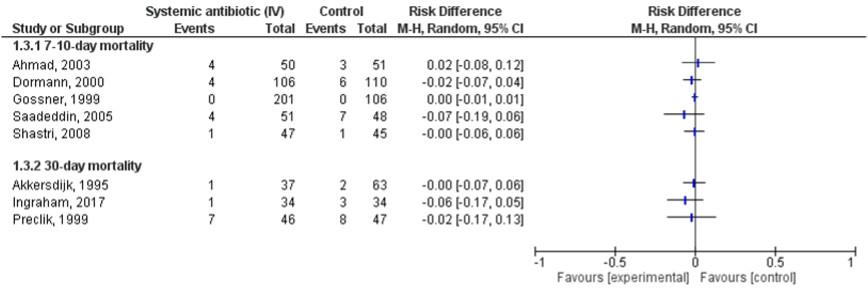
Lipp (2013) included nine studies which reported on mortality (Ahmad, 2003; Akkersdijk, 1995; Dormann, 2000; Gossner, 1999; Panigrahi, 2000; Preclik, 1999; Saadeddin, 2005; Shastri, 2008; Sturgis, 1996). Ingraham (2017) also reported on mortality. Ahmad (2003), Gossner (1999), Saadeddin (2005) and Shastri (2008) reported on 7-day mortality and Dormann (2000) on 10-day mortality. Akkersdijk (1995), Preclik (1999) and Ingraham (2017) reported on 30-day mortality. The results of Panigrahi (2000) and Sturgis (1996) were excluded because it was not clear in which treatment group the decedent patient were allocated to. In the study of Panigrahi (2000) seven patients died and in the study of Sturgis (1996) three patients died. Due to low numbers, data were not pooled (Figure 3.3). In most studies deaths were stated as not associated with prophylactic antibiotics.
Figure 3.3 The effect of prophylactic use of antibiotics on mortality in patients undergoing PEG placement compared to placebo or no treatment
Systemic infection
Lipp (2013) included two studies which reported on systemic infections (Dormann, 2000; Saadeddin, 2005). Dormann (2000) reported systemic infections over 10 days, which included pneumonia, sepsis, peritonitis, pyrexia and urinary tract infection (UTI). In the antibiotic group, 8/106 (7.5%) patients developed systemic infection, compared to 22/110 (20%) patients in the control group. The relative risk (95%CI) was 0.38 (0.18 to 0.81), in favor of the antibiotic group. This difference was statistically significant and clinically relevant (RR<0.8). In the antibiotic group there were cases with sepsis (n=1) and UTI (n=6). In the control group there were cases with pneumonia (n=8), sepsis (n=3), pyrexia (n=1) and UTI (n=9). In the antibiotic group 4/106 (3.8%) patients received additional antibiotics because of the systemic infection, compared to 22/110 (20%) patients in the control group. Saadeddin (2005) reported systemic infections over at least seven days, defined as persistent fever or clinical, radiological or microbiological evidence of invasive sepsis, and this was treated with systemic antibiotics. In the antibiotic group 8/50 (16%) patients developed systemic infection, compared to 18/47 (38.3%) patients in the placebo group. The relative risk (95%CI) was 0.42 (0.20 to 0.87), in favor of the antibiotic group. This difference was statistically significant and clinically relevant (RR<0.8). Ingraham (2017) reported one case of pneumonia in the placebo group. Due to differences in definitions used, data were not pooled.
Peritonitis
Lipp (2013) included four studies which reported on peritonitis (Ahmad, 2003; Akkersdijk, 1995; Gossner, 1999; Dormann, 2000). Ingraham (2012) also reported on peritonitis. Ahmad (2003) and Ingraham (2017) reported no cases with peritonitis during the whole study period, which lasted respectively seven and 30 days. Gossner (1999) reported cases of peritonitis over seven days. In the antibiotic group one patient developed peritonitis, compared to three patients in the control group. Dormann (2000) reported peritonitis over ten days, which included one case of peritonitis in the control group. Akkersdijk (1995) reported three cases of peritonitis in the control group over 30 days. Due to low numbers, data were not pooled.
Length of hospital stay
None of the included studies reported on the outcome measure length of hospital stay.
PEG or PRG removal
Lipp (2013) included three studies which reported on PEG removal (Preclik, 1999; Gossner, 1999; Dormann, 2000). Preclik (1999) reported one reinsertion of a PEG tube due to leakage leading to peritonitis. In the study of Gossner (1999) four patients required PEG removal due to local peritonitis. This was also the case for one patient in the study of Dormann (2000). In all studies, it was not clear in which treatment group these patients were allocated to. Ingraham (2017) also reported on PEG removal, but in all 68 patients there was no need to remove the PEG tube.
Level of evidence of the literature
The level of evidence of the literature was assessed per comparison and outcome, using the GRADE-methodology. Evidence from RCTs started at HIGH certainty. The level of evidence was downgraded to MODERATE, LOW or VERY LOW certainty, in case of risk of bias, inconsistency, indirectness, imprecision, or publication bias. GRADE-methodology was not applied in the Cochrane review of Lipp (2013), which might have led to differences in recommendations between the Cochrane review and this guideline document.
Peristomal infection
The level of evidence regarding the outcome measure peristomal infections is moderate. The level of evidence for RCT’s starts high, but was downgraded by 1 level due to imprecision. The 95%CI of the effect estimate did not cross the threshold for clinical relevance (RR 0.80/RR 1.25), but number of events was low (< 300). This was the reason that we downgraded for imprecision.
Mortality
The level of evidence regarding the outcome measure mortality is very low. The level of evidence for RCT’s starts high, but was downgraded to low due to serious imprecision (2 levels) and risk of bias (1 level). Total number of events was very low (< 300, imprecision). There was risk of bias in part of the included trials, since allocation concealment was not clear (Akkersdijk, 1995; Dormann, 2000; Gossner, 1999). Furthermore, is not clear which cases of mortality were related to use of prophylactic antibiotics. In most studies deaths were stated as not associated with antibiotics.
Systemic infection
The level of evidence regarding the outcome measure systemic infections is low. The level of evidence for RCT’s starts high but was downgraded by 2 levels because of imprecision (1 level) and risk of bias (1 level). The 95%CI of the effect estimate crossed the threshold for clinical relevance (RR 0.80/RR 1.25, imprecision). There was risk of bias in the study of Dormann (2000) since allocation concealment was not clear and trial was not placebo controlled. Furthermore, at baseline more patients in the control group had concomitant diseases (P>0.05). And lastly, the included studies differed with regard to the definition of systemic infections.
Peritonitis
Due to few events, it was not possible to draw conclusions on the effect of prophylactic use of systemic antibiotics on peritonitis, compared to placebo or no treatment in patients undergoing PEG placement.
Length of hospital stay
None of the included studies did report on the outcome measure length of hospital stay.
PEG or PRG removal
Due to few events, it was not possible to draw conclusions on the effect of prophylactic use of systemic antibiotics on PEG removal, compared to placebo or no treatment in patients undergoing PEG placement.
Although our literature search focused on the effects of prophylactic antibiotic in patients undergoing PEG or PRG tube placement, most research is performed with PEG procedures. Strictly, we can therefore not draw conclusions on the effects of prophylactic antibiotics in patients undergoing PRG placement. However, the working group does not expect that different results will be found for patients undergoing PRG tube placements.
Zoeken en selecteren
Search and select
A systematic review of the literature was performed to answer the following question:
What are the (un)desirable effects of a gift prophylactic antibiotic in patients undergoing PEG or PRG placement?
P: patients undergoing placement of a percutaneous endoscopic gastrostomy or percutaneous radiologic gastrostomy;
I: prophylactic antibiotic;
C: no intervention, placebo;
O: mortality, peristomal infection, systemic infection, peritonitis, length of hospital stay, PEG or PRG removal.
Relevant outcome measures
The guideline development group considered mortality, peristomal infection and PEG or PRG removal as critical outcome measures for decision making; and systemic infection and length of hospital stay as important outcome measures for decision making.
The working group defined the outcome measures as follows:
- Peristomal infection is defined as peristomal infections up to 30 days after PEG or placement.
- Mortality is defined as mortality up to 30 days after PEG or placement.
- Peritonitis is defined as peritonitis up to 30 days after PEG or placement.
A priori, the working group did not define the outcome measure systemic infections, length of hospital stay and PEG or removal but used the definitions used in the studies.
For the outcome measures mortality, peritonitis and removal of PEG or a difference of at least 10% in relative risk was defined as a clinically relevant difference (RR< 0.91/RR> 1.10). To clarify; this means that a relative risk on mortality of 0.85 in favor of the antibiotic group as compared to the placebo group is a clinically relevant difference. On the other hand, a relative risk on mortality of 0.95 in favor of the antibiotic group is not clinically relevant different from the placebo group. For other outcome measures, a difference of at least 25% in relative risk was defined as a clinically relevant difference (RR< 0.8/RR> 1.25; default). For the continuous outcome measure length of hospital stay a difference of 0.5SD (default) was defined as a clinically relevant difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 2 December 2019. The detailed search strategy is depicted under the tab Methods. Studies were selected based on the following criteria: systematic reviews or RCT’s focusing on adult patients undergoing PEG placement and use of antibiotic prophylaxis.
Results
The systematic literature search resulted in 284 hits. 18 studies were selected based on title and abstract screening, of which one Cochrane review (Lipp, 2013). 13 of the additional 17 studies were already included in this Cochrane review of Lipp (2013). Two of the four remaining studies were systematic reviews which were published before 2013 and focused on studies that were also included in Lipp (2013). These two studies were therefore excluded. The two remaining studies were published after Lipp (2013). One of these trials was excluded, since it focused on surgical gastropexy placement. One trial was included (Ingraham, 2017). See the table with reasons for exclusion under the tab Methods. Therefore, a total of two publications were included and used for this systematic review (Lipp, 2013 and Ingraham, 2017). Important study characteristics and results of Lipp (2013) and Ingraham (2012) are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Akkersdijk, W. L., van Bergeijk, J.D., van Egmond, T. et al (1995). Percutaneous endoscopic gastostomy: comparison of push and pull methods and evaluation of antibiotic prophylaxis. J Endoscopy, 27, 313-6.
- Bauer, M.P., van de Garde, E.M.W., van Kasteren, M.E.E. et al (2019). SWAB Richtlijn Perioperatieve profylaxe. Geraadpleegd op 28 november 2020 via https://swab.nl/nl/peri-operatieve-profylaxe
- Blomberg, J., Lagergren, P., Martin, L. et al (2010). Novel approach to antibiotic prophylaxis in percutaneous endoscopic gastrostomy (PEG): randomised controlled trial. Bmj, 341, c3115.
- Dormann, A. J., Wigginghaus, B., Risius, H. et al (2000). Antibiotic prophylaxis in percutaneous endoscopic gastrostomy (PEG)-results from a prospective randomized multicenter trial. Zeitschrift für Gastroenterologie, 38(03), 229-234.
- Gkolfakis, P., Arvanitakis, M., Despott, E.J. et al (2021). Endoscopic management of enteral tubes in adult patients – Part 2: Peri- and post-procedural management. European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 53: 178–195.
- Gossner, L., Keymling, J., Hahn, E. G., & Ell, C. (1999). Antibiotic prophylaxis in percutaneous endoscopic gastrostomy (PEG): a prospective randomized clinical trial. Endoscopy, 31(02), 119-124.
- Ingraham, C. R., Johnson, G. E., Albrecht, E. L. et al (2018). Value of antibiotic prophylaxis for percutaneous gastrostomy: a double-blind randomized trial. Journal of Vascular and Interventional Radiology, 29(1), 55-61.
- Jafri, N. S., Mahid, S. S., Minor, K. S. et al (2007). Meta‐analysis: antibiotic prophylaxis to prevent peristomal infection following percutaneous endoscopic gastrostomy. Alimentary pharmacology & therapeutics, 25(6), 647-656.
- Jonas, S. K., Neimark, S., & Panwalker, A. P. (1985). Effect of antibiotic prophylaxis in percutaneous endoscopic gastrostomy. American Journal of Gastroenterology, 80(6).
- Külling, D., Sonnenberg, A., Fried, M., & Bauerfeind, P. (2000). Cost analysis of antibiotic prophylaxis for PEG. Gastrointestinal endoscopy, 51(2), 152-156.
- Lipp, A., & Lusardi, G. (2006). Systemic antimicrobial prophylaxis for percutaneous endoscopic gastrostomy. Cochrane Database of Systematic Reviews, (4).
- Radhakrishnan, N. V., Shenoy, A. H., Cartmill, I. et al (2006). Addition of local antiseptic spray to parenteral antibiotic regimen reduces the incidence of stomal infection following percutaneous endoscopic gastrostomy: a randomized controlled trial. European journal of gastroenterology & hepatology, 18(12), 1279-1284.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Is antibiotic prophylaxis (periprocedural) necessary for the placement of a percutaneous endoscopy gastrostomy (PEG)?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Lipp, 2013
Individual study characteristics and results are deduced from Lipp, 2013
|
SR and meta-analysis of RCTs
Literature search up to August 2013
A: Ahmad, 2003 B: Akkersdijk, 1995 C: Blomberg, 2010 D: Dormann, 2000 E: Gossner, 1999 F: Jain, 1987 G: Jonas, 1985 H: Panigrahi, 2000 I: Preclik, 1999 J: Radhakrishnan, 2006 K: Saadeddin, 2005 L: Shastri, 2008 M: Sturgis, 1996
Study design: RCT
Setting and Country: Industrial countries (Germany, USA, Netherlands, Sweden, UK)
Source of funding and conflicts of interest: No declarations of interest were known. Sources of support: Faculty of Health, university of Glamorgan, UK & NIHR, Cochrane Wounds Group, UK.
|
Inclusion criteria SR: Studies in people of any age, gender or diagnosis, undergoing placement of a PEG tube. Besides, studies involving antimicrobial prophylaxis compared with placebo or usual care; and comparisons between different antimicrobial regimens were eligible for inclusion.
Exclusion criteria SR: Studies in people undergoing replacement of PEG tubes were excluded, along with those undergoing percutaneous endoscopic jejunostomy (PEJ), or percutaneous endoscopic duodenostomy (PED).
13 studies included
Important patient characteristics at baseline: Adults aged 16 years or over, both males and females are included.
Groups comparable at baseline? None of the differences were judged to be at a level where they were likely to affect the outcomes/introduce serious bias. |
Describe intervention:
A: cefuroxime, 750 mg IV 30 min prior to PEG B: augmentin 1.2 g IV 3 doses given of which one 30 min prior to PEG and other two over 24 hours. C: co-trimoxazole (800 mg sulfamethoxazole & 160 mg trimethoprim) in 20 ml in the PEG immediately after insertion. D: ceftriaxone 1 g IV 30 min prior to PEG E: cefotaxime 2 g by infusion 30 min prior to PEG (group 1)/piperacillin 2 g + 0.5 g tazobactam by infusion (group 2) F: cefazolin 1 g IV 30 min prior to PEG G: cefoxitin 1 g IV 30 min prior to PEG (2 further doses given at 6 h intervals) H: co-amoxiclav (dose not stated) IV 15-30 min prior to PEG I: co-amoxiclav 2.2 g, by short infusion 30 min prior to PEG J: cefuroxime 750 mg IV immediately prior to PEG (2 further doses given at 8 h intervals, group 1) or combined with povidone-iodine (group 3) K: co-amoxiclav 2.2 g (n = 43), or cefotaxime 2 g (if allergic to penicillin) at time of PEG tube insertion. L: ceftriaxone 2 g IV M: cefazolin 1 g IV within 30 min of PEG
|
Describe control:
A: saline placebo IV 30 min prior to PEG B: no placebo/no antibiotic C: cefuroxime 1.5g IV given 1 hour before PEG insertion D: no placebo/no antibiotic E: no placebo/no antibiotic F: saline placebo IV 30 min prior to PEG G: saline placebo IV 30 min prior to PEG H: saline placebo IV 15-30 min prior to PEG I: saline placebo, by short infusion 30 min prior to PEG J: povidone-iodine spray only (group 2) K: placebo (not stated) at time of PEG tube insertion. L: placebo ('similar looking') IV M: saline placebo IV within 30 min of PEG
|
Endpoint of follow-up:
A: assessment immediately after procedure plus three, five and seven days. B: assessment twice weekly for one month. C: 7-14 days D: assessment at one, two, four and ten days (mean 8.7). E: assessment daily for 7 days F: assessment daily for 7 days G: assessment at more than three days (endpoint not stated). H: assessment daily for seven days, and then day 28. I: assessment daily for seven days and mortality at 30 days J: assessment on day three or four and day seven K: assessment daily for 7 days L: assessment daily for 7 days M: assessment daily for one week
For how many participants were no complete outcome data available?
A: 8 B: 4 C: 34 D: 21 E: 40 F: 0 G: 4 H: 17 I: 13 J: 0 (5 deaths in 1 week) K: 11 L: 4 M: 0
|
Peristomal infection The number of criteria and the way in which scores were calculated differed between trials. Some trials used revised criteria by Jain, others use ASEPSIS etc.
Effect measure: OR (95% CI): A: 0.33 (0.11-1.01) B: 0.31 (0.11-0.92) C: not included D: 0.39 (0.19-0.82) E: 0.06 (0.01-0.5) F: 0.17 (0.03-0.87) G: 0.92 (0.21-4.05) H: 0.65 (0.18-2.37) I: 0.22 (0.08-0.6) J: 1.01 (0.35-2.94) K: 0.18 (0.06-0.54) L: 0.98 (0.06-16.12) M: 0.64 (0.16-2.55)
Pooled effect (fixed effects model): 0.36 (95% CI 0.26-0.5) favoring systemic antibiotic treatment. Heterogeneity (I2): 16.9%
Mortality (n/N) A: I 4/50 versus C 3/51 B: I 1/37 versus C2/63 D: I 4/106 versus C 6/110 E: I 0/201 versus C 0/106 I: I 7/46 versus C 8/47 K: I 4/51 versus C 7/48
Peritonitis (n/N) A: I 0/46 versus C 0/48 B: I 0/37 versus C 3/63 D: I 0/106 versus C 1/110 E: I 1/201 versus C 3/106
Systemic infection (n/N) D: I 1.9% versus C 11.8%* K: I 8/50 versus C 18/47
*Pneumonia (0 versus 8), sepsis (1 versus 3), pyrexia (0 versus 1), UTI (6 versus 9)
|
Authors conclude that administration of systemic prophylactic antibiotics for PEG tube placement reduces peristomal infection.
Some remarks: The push method was used in at least two studies. It is possible that pushing the PEG device through the abdominal wall could avoid the risk of contamination by naso-pharyngeal organisms including MRSA. This route may therefore negate the need for systemic prophylactic antibiotics.
Follow-up was insufficient in some trials (3-30 days) which may have reduced the statistical power of the studies, particularly in the light of the CDC recommendation for a 30-day follow-up period to ensure that all surgical site infections are captured.
The finding was robust to exclusion of studies with inadequate allocation concealment. Eight trials with adequate allocation concealment were pooled using the fixed-effect model (I2 = 61%) and this difference was statistically significant (OR 0.58, 95% CI 0.38 to 0.88), although if a random effects model is used this difference disappears. The four trials with unclear or inadequate allocation concealment were pooled using the fixed-effect model (I2 = 25%) (OR 0.34, 95% CI 0.21 to 0.58).
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))
Research question: Is antibiotic prophylaxis (periprocedural) necessary for the placement of a percutaneous endoscopy gastrostomy (PEG)?
Risk of bias table for systematic reviews of RCTs and observational studies
(Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097))
Research question: Is antibiotic prophylaxis (periprocedural) necessary for the placement of a percutaneous endoscopy gastrostomy (PEG)?
|
Study
|
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Lipp, 2013 |
Yes
This review seeks to establish whether prophylactic use of systemic antimicrobial drugs reduces the risk of peristomal infection in people undergoing the placement of tubes via percutaneous endoscopic gastrostomy (PEG). |
Yes
Search period and strategy are described, both Medline and Embase are searched. |
Yes
Reasons of exclusion are described. Included studies are reported. |
Yes
Characteristics of studies were described, including intervention and control group. |
Not applicable
Only RCT’s are included. |
Yes
Cochrane collaboration tool for assessing risk of bias was used. |
Unclear
Clinical and statistical heterogeneity were assessed. Differences at baseline were not judged to have an impact on the results. However, FU time differed between studies (3-30 days), studies used different definitions of peristomal infections and in two studies push technique was used. |
No
Potential risk of publication bias was not described. |
Yes
Source of funding was reported, also for each of the included studies. |
Risk of bias table for intervention studies (randomized controlled trials)
Research question: Is antibiotic prophylaxis (periprocedural) necessary for the placement of a percutaneous endoscopy gastrostomy (PEG)?
|
Study reference
(first author, publication year) |
Describe method of randomisation |
Bias due to inadequate concealment of allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?
(unlikely/likely/unclear) |
Bias due to loss to follow-up?
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?
(unlikely/likely/unclear) |
|
Ingraham, 2017 |
Randomisation using a random number generator to assign patients to treatment or placebo arms. |
Unlikely
Randomisation was done using a random number generator. |
Unlikely
All patients, operators, nursing staff, and study staff were blinded to patient assignments |
Unlikely
All patients, operators, nursing staff, and study staff were blinded to patient assignments |
Unlikely
All patients, operators, nursing staff, and study staff were blinded to patient assignments |
Unlikely
Outcome measures as stated on clinicaltrials.gov were reported. |
Unclear
Numbers of lost to follow-up are not clearly stated.
|
Unlikely
ITT analysis was performed. (NB: patients receiving antibiotics due to other infections are included in ITT analysis, which might have led to a reduction in infections in placebo group.) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 13-09-2022
Beoordeeld op geldigheid : 05-09-2022
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werkgroep aangesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met een gastrostomiekatheter.
Werkgroep
- Dr. I.A.M. Gisbertz, MDL-arts, Bernhoven, Uden, NVMDL (voorzitter)
- Dr. L.P.L. Gilissen, MDL-arts, Catharina Ziekenhuis, Eindhoven, NVMDL
- Drs. J.F. Monkelbaan, MDL-arts, Universitair Medisch Centrum, Utrecht, NVMDL
- Dr. A.H.C. van Roon, MDL-arts, Albert Schweitzer ziekenhuis, Dordrecht, NVMDL
- Dr. D. Strijbos, AIOS MDL, Catharina Ziekenhuis, Eindhoven & Maastricht Universitair Medisch Centrum, Maastricht, NVMDL
- Dr. A.J. van der Kooi, neuroloog, Academisch Universitair Medisch Centrum, Amsterdam, NVN
- Dr. J.R. de Jong, chirurg, Academisch Universitair Medisch Centrum, Amsterdam, NVvH
- J. Beurskens, verpleegkundig specialist Darmfalenteam, Radboud UMC, Nijmegen, V&VN MDL-Voeding
- Prof. dr. P.M.T. Pattynama, radioloog, Groene Hart Ziekenhuis, Gouda, NVvR
Klankbordgroep
- Prof. dr. M.W.M. van den Brekel, KNO-arts, Antoni van Leeuwenhoek, Amsterdam, NVKNO
- Dr. M.J. Serlie, internist-endocrinoloog, Academisch Universitair Medisch Centrum, Amsterdam, NIV
- Dr. W.J. Kruithof, revalidatiearts, Universitair Medisch Centrum, Utrecht, VRA
Met ondersteuning van
- Dr. B.H. Stegeman, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. A.J.G. Wirix, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- H. Olthuis-van Essen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Gisbertz |
MDL arts |
Lid NESPEN bestuur (onbetaald) |
Geen |
Geen actie |
|
Strijbos |
AIOS MDL, Catharina Ziekenhuis |
Promovendus MUMC+ (onbetaald) |
Geen |
Geen actie |
|
Gilissen |
MDL arts, oprichter PEG- en later Enteraal voedingsteam, Catharina ziekenhuis Eindhoven |
Lesgeven aan de Duodopaverpleegkundigen over PEG-J en PEJ (landelijk, via Abbvie) (betaald) |
Geen |
Geen actie |
|
Monkelbaan |
MDL-Arts UMC Utrecht, 60% aanstelling, drie dagen per week. |
Bestuurslid en secretaris Stichting HAL-UD. De stichting HAL-UD is intermediair voor huisartsen op het gebied van commerciële laboratorium verrichtingen. Betaald. |
Lid van een UMC Utrecht team, wat zich bezighoudt met de ontwikkeling van een device wat de Neus-Maag-Sonde plaatsingen veiliger moet gaan maken. |
Geen actie (Neus-maagsonde komt niet terug in de richtlijn) |
|
Van Roon |
MDL-arts, Albert Schweitzer ziekenhuis Dordrecht |
Geen |
Geen |
Geen actie |
|
Van der Kooi |
Neuroloog, Amsterdam UMC 0,8FTE |
Voorzitter SCN (Spierziekten Centrum Nederland) |
Geen |
Geen actie |
|
De Jong |
Chirurg/kinderchirurg Amsterdam Universitaire Meidsche Centra (AUMC) |
Geen |
Geen |
Geen actie |
|
Beurskens |
Verpleegkundig specialist Darmfalen |
voorzitter voeding V&VN MDL/ |
Geen |
Geen actie |
|
Pattynama |
Radioloog Zelfstandig in maatschap MIB Gouda, Groene Hart ziekenhuis Gouda |
Geen |
Geen |
Geen actie |
|
Wirix |
Adviseur, Kennisinstituut |
- |
- |
Geen actie |
|
Olthuis-van Essen |
Adviseur, Kennisinstituut |
- |
- |
Geen actie |
|
Stegeman |
Senior adviseur, Kennisinstituut |
- |
- |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het voorleggen van het raamwerk aan de patiëntenfederatie. De Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK), Parkinson Vereniging, en de ALS-diagnosewerkgroep hebben input op het raamwerk gegeven. De verkregen input is besproken in de werkgroepvergadering en meegenomen bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de NFK, Parkinson vereniging, ALS-diagnosewerkgroep, Spierziekten Nederland, en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming WKKGZ
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Module Contra-indicaties |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Keuze van procedure en timing bij specifieke patiëntengroepen |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module antibiotica profylaxe |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module PPI gebruik rondom PEG-plaatsing |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Sedatie bij neuromusculaire aandoeningen |
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module Opstarten van voeding |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Optimale methode voor PEG-verwijdering |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Beleid bij veelvoorkomende complicaties |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Organisatie van zorg - Voorzorg |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Organisatie van zorg – Uitvoering |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Organisatie van zorg – Rapportage |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Organisatie van zorg – Afspraken over nazorg |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Methode ontwikkeling
Evidence based
Implementatie
Inleiding
Dit implementatieplan is opgesteld ter bevordering van de implementatie van de richtlijn Enterale toegang. Voor het opstellen van dit plan is een inventarisatie gedaan van de mogelijk bevorderende en belemmerende factoren voor het naleven van de aanbevelingen. Daarbij heeft de richtlijnwerkgroep een advies uitgebracht over het tijdspad voor implementatie, de daarvoor benodigde randvoorwaarden en de acties die door verschillende partijen ondernomen dienen te worden.
Werkwijze
Om tot dit plan te komen heeft de werkgroep per aanbeveling in de richtlijn nagedacht over:
- per wanneer de aanbeveling overal geïmplementeerd moet kunnen zijn;
- de verwachtte impact van implementatie van de aanbeveling op de zorgkosten;
- randvoorwaarden om de aanbeveling te kunnen implementeren;
- mogelijk barrières om de aanbeveling te kunnen implementeren;
- mogelijke acties om de implementatie van de aanbeveling te bevorderen;
- verantwoordelijke partij voor de te ondernemen acties.
Lezers van dit implementatieplan dienen rekening te houden met verschillen tussen “sterk geformuleerde aanbevelingen” en “zwak geformuleerde aanbevelingen”. In het eerste geval doet de werkgroep een duidelijke uitspraak over iets dat wel of niet gedaan moet worden. In het tweede geval wordt de aanbeveling minder zeker gesteld en spreekt de werkgroep haar voorkeur of advies uit, maar laat zij meer ruimte voor alternatieven. Een reden hiervoor is bijvoorbeeld dat er onvoldoende wetenschappelijk bewijs is om de aanbeveling te onderbouwen. Een zwakke aanbeveling is te herkennen aan de formulering en begint bijvoorbeeld met “Overweeg om …”. Zowel voor de sterke als voor de zwakke aanbevelingen heeft de werkgroep nagedacht over de implementatie. Alleen voor sterk geformuleerde aanbevelingen worden implementatietermijnen gegeven.
Implementatietermijnen
Voor “sterk geformuleerde aanbevelingen” geldt dat zij zo spoedig mogelijk geïmplementeerd dienen te worden. Voor de meeste “sterk geformuleerde aanbevelingen” betekent dat dat zij binnen een jaar geïmplementeerd moeten zijn. Veel aanbevelingen zijn al onderdeel van de huidige praktijk en brengen daarom geen implementatie inspanningen met zich mee.
Voor sommige aanbevelingen geldt echter dat zij niet (direct) overal kunnen worden ingevoerd, bijvoorbeeld vanwege een gebrek aan middelen, expertise of de juiste organisatievormen. In sommige gevallen dient ook rekening te worden gehouden met een leercurve. Daarnaast kan de aanwezigheid van personeel of faciliteiten of de afstemming tussen professionals een belemmering zijn om de aanbevelingen (op korte termijn) in te voeren. Dit geldt voor de volgende aanbevelingen:
|
Aanbeveling |
Toelichting |
|
Deze aanbevelingen kunnen wellicht niet direct worden ingevoerd vanwege een gebrek aan expertise en/of juiste organisatie. Daarnaast is aanwezigheid van en afstemming tussen professionals en faciliteiten nodig om de handelingen op betrouwbare wijze te kunnen uitvoeren.
|
|
Deze aanbeveling kan wellicht niet direct worden ingevoerd vanwege een gebrek aan expertise en/of juiste organisatie. |
|
Overweeg de indicaties voor het plaatsen van een PEG of PRG katheter te laten beoordelen door een multidisciplinair team |
Het ontbreken van een multidisciplinair team is een barrière voor deze aanbeveling. |
|
Het ontbreken van een multidisciplinair team is een barrière voor deze aanbeveling. |
|
Registreer alle complicaties in een complicatieregistratie en bespreek deze op reguliere basis in het team.
|
Deze aanbeveling kan wellicht niet direct worden ingevoerd vanwege een gebrek aan expertise en/of juiste organisatie. |
Impact op zorgkosten
Geen van de gemaakte aanbevelingen brengt gevolgen met zich mee voor de zorgkosten.
Te ondernemen acties per partij
Hieronder wordt per partij toegelicht welke acties zij kunnen ondernemen om de implementatie van de richtlijn te bevorderen.
Alle direct betrokken wetenschappelijk verenigingen/beroepsorganisaties (NVMDL, NVN, NVvH, V&VN, NVvR, NVKNO, NIV, VRA)
- Bekend maken van de richtlijn onder de leden.
- Publiciteit voor de richtlijn maken door over de richtlijn te publiceren in tijdschriften en te vertellen op congressen.
- Ontwikkelen van gerichte bijscholing/trainingen, onder andere voor longartsen, chirurgen, fysiotherapeuten en longverpleegkundigen.
- Ontwikkelen en aanpassen van patiëntinformatie/keuzehulpen.
De lokale vakgroepen/individuele medisch professionals
- Het bespreken van de aanbevelingen in de vakgroepsvergadering en lokale werkgroepen.
- Het volgen van bijscholing die bij deze richtlijn ontwikkeld gaat worden.
- Aanpassen lokale patiëntinformatie op grond van de materialen die door de verenigingen beschikbaar gesteld zullen worden.
- Afstemmen en afspraken maken met andere betrokken disciplines om de toepassing van de aanbevelingen in de praktijk te borgen.
De systeemstakeholders (onder andere zorgverzekeraars, (koepelorganisaties van) ziekenhuisbestuurders, IGJ)
Van de bestuurders wordt verwacht dat zij bij de betrokken medisch professionals nagaan op welke wijze zij kennis hebben genomen van de nieuwe richtlijn Enterale toegang en deze toepassen in de praktijk. Het verzorgen van een goed ingericht ziekenhuisinformatiesysteem kan bijdragen aan de implementatie van de aanbevelingen die betrekking hebben op de verslaglegging van de geplaatste gastrostomiekatheters en de terugkoppeling van complicaties aan andere zorgverleners.
Het Kennisinstituut van de Federatie Medisch Specialisten
Toevoegen van richtlijn aan Richtlijnendatabase. Daarbij opnemen van dit implementatieplan op een voor alle partijen goed te vinden plaats.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg rondom plaatsing van een gastrostomiekatheter. Door gebrek aan aanmeldingen is de invitational conference niet doorgegaan.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
|
Clinical question: Is antibiotic prophylaxis (periprocedural) necessary for the placement of a percutaneous endoscopy gastrostomy (PEG)? |
|
|
Database(s): Medline, Embase |
Date: 02 december 2019 |
|
Period: until current |
Language: English |
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
|
1 exp Gastrostomy/ or peg.ti,ab,kw. or ppeg.ti,ab,kw. or prg.ti,ab,kw. or fpg.ti,ab,kw. or rig.ti,ab,kw. or gastrostom*.ti,ab,kw. (60219) 2 exp Antibiotic Prophylaxis/ or ((antimicrobial or antibiotic*) adj2 (prevent* or prophyla*)).ti,ab,kw. (26620) 3 1 and 2 (170) 4 limit 3 to english language (143) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (421081) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1920845) 7 4 and 5 (12) 8 (4 and 6) not 7 (36) 9 7 or 8 (48) 10 4 not 9 (95)
12 SRs + 36 RCTs + 95 overige = 143 |
284 |
|
Embase
|
'gastrostomy'/exp OR 'gastrostomy catheter'/exp OR 'laparoscopic gastrostomy'/exp OR 'percutaneous endoscopic gastrostomy'/exp OR 'percutaneous radiologic gastrostomy'/exp OR peg:ti,ab OR ppeg:ti,ab OR prg:ti,ab OR fpg:ti,ab OR rig:ti,ab OR gastrostom*:ti,ab AND 'antibiotic prophylaxis'/exp OR (((antimicrobial OR antibiotic*) NEAR/2 (prevent* OR prophyla*)):ti,ab) AND (english)/lim NOT 'conference abstract':it
Sytematische reviews ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) = 22
RCT’s ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it = 54
+ 183 overig = 259 |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Adachi, 2016 |
PEG-placement by gastropexy |
|
Ahmad, 2003 |
Included in Lipp, 2013 |
|
Akkersdijk, 1995 |
Included in Lipp, 2013 |
|
Blomberg, 2010 |
Included in Lipp, 2013 |
|
Dormann, 2000 |
Included in Lipp, 2013 |
|
Gossner, 1999 |
Included in Lipp, 2013 |
|
Jain, 1987 |
Included in Lipp, 2013 |
|
Jonas, 1985 |
Included in Lipp, 2013 |
|
Panigrahi, 2002 |
Included in Lipp, 2013 |
|
Preclik, 1999 |
Included in Lipp, 2013 |
|
Radhakrishnan, 2006 |
Included in Lipp, 2013 |
|
Saadeddin, 2005 |
Included in Lipp, 2013 |
|
Shastri, 2008 |
Included in Lipp, 2013 |
|
Sturgis, 1996 |
Included in Lipp, 2013 |
|
Jafri, 2007 |
All articles included in Lipp, 2013 |
|
Sharma, 2000 |
All articles included in Lipp, 2013 |
