Farmacologisch beleid bij ECT
Uitgangsvraag
Welk farmacologisch beleid dient gevoerd te worden bij de toepassing van ECT, rekening houdend met de stoornis?
Aanbeveling
Door de psychiater, in overleg met de patient, moeten de voor- en nadelen vooraf worden afgewogen van het combineren van (psycho-)farmaca en de ECT-kuur.
Indien tijdens de ECT-kuur psychofarmaca bij voorkeur moeten worden gecontinueerd of gestart, dan zal de psychiater daarvan de anesthesioloog op de hoogte brengen.
Hoewel vóórdelen van een gecombineerde behandeling slechts in een enkele studie zijn vastgesteld, kunnen de meeste psychofarmaca zonder te verwachten problemen gecombineerd worden met ECT.
Overwegingen
Kwaliteit van bewijs
Er is maar zeer beperkte wetenschappelijke onderbouwing van de invloed op effectiviteit en bijwerkingen/complicaties van comedicatie tijdens een ECT-kuur.
Balans tussen gewenste en ongewenste effecten
Per medicament zal de psychiater moeten afwegen of de kans op verminderde effectiviteit en/of bijwerkingen bij het betreffende medicament toeneemt (of afneemt), en vervolgens of het betreffende middel gestaakt kan worden voor de ECT-kuur.
Patiëntenperspectief
De patiënt moet uitleg krijgen over de mogelijkheid en reden om ECT eventueel te combineren met medicatie, waarin de patiënt bij voorkeur daarover meedenkt.
Professioneel perspectief
De werkgroep is van mening dat het niet noodzakelijk is om alle psychofarmaca voor aanvang van ECT te stoppen. ECT wordt meestal gegeven nadat gebleken is dat de psychofarmaca onvoldoende effectief waren. Dat zou een argument zijn om de betreffende psychofarmaca af te bouwen en te staken. Anderzijds kost afbouwen tijd, kan onttrekkingsverschijnselen geven en verdwijnen van partiële remissie kan de patiënt doen verslechteren vooraf de start van ECT. Na staken van succesvolle ECT zal een patiënt op medicatie worden ingesteld voor terugval preventie. Dit kan soms dezelfde medicatie zijn waarop hij voordien niet in remissie kwam.
Er zijn slechts beperkte aanwijzingen voor een synergistisch effect van antidepressiva en antipsychotica in combinatie met ECT. De gedachte dat benzodiazepinen een negatief effect op de ECT-respons hebben wordt niet door onderzoek ondersteund. Bij het gebruiken van lithiumcarbonaat tijdens de ECT-kuur is het advies de dosis af te bouwen of zorgen voor lagere bloedspiegel (dosis overslaan ’s avonds bijvoorbeeld).
Middelenbeslag
Het continueren van ineffectieve medicamenten is niet wenselijk, omdat deze wel kosten genereren. Indien ingeschat wordt dat het betreffende medicament tijdens of direct na de ECT-kuur wel effectief zal zijn, dan kan dit argument het middelenbeslag daarvan verantwoorden.
Organisatie van zorg
Het afbouwen en staken van psychofarmaca voordat ECT gegeven wordt, kan in de praktijk lastig zijn en (veel) tijd in beslag nemen. Daarom kan in de praktijk gekozen worden om de start van de ECT-kuur niet uit te stellen vanwege comedicatie die nog afgebouwd kan worden.
Maatschappelijk perspectief
Vanuit maatschappelijk perspectief is het gebruik van comedicatie weinig essentieel.
Onderbouwing
Achtergrond
Deze module is deels een samenvatting van een overzichtsartikel naar het gebruik van psychofarmaca bij ECT (Kho e.a., 2008). Hoewel ECT meestal wordt toegepast bij medicatieresistentie, waarbij het continueren van de onwerkzame psychofarmaca discutabel is, komt het regelmatig voor dat patiënten die voor ECT worden geïndiceerd nog steeds deze medicatie gebruiken. Stoppen van deze psychofarmaca voor ECT kan gepaard gaan met onttrekkingsverschijnselen, en het kost tijd voordat tot ECT kan worden overgegaan. Bij ernstig zieke patiënten met een indicatie voor het snel toepassen van ECT kan dit nadelig zijn. Daarom is het van belang om te weten of ECT veilig gecombineerd kan worden met psychofarmaca.
Publicaties die betrekking hebben op combinatiebehandelingen bij depressieve patiënten werden geselecteerd. Voor de combinatiebehandeling met antipsychotica werden ook publicaties over behandeling van schizofrenie geselecteerd. Daarnaast werden referenties uit verkregen relevante publicaties opgezocht. Indien er over een combinatiebehandeling een overzichtsartikel aanwezig was, werden de in dit artikel besproken publicaties niet geselecteerd. De verschillende combinatiebehandelingen leverden 383 publicaties op, waarvan 38 voldeden aan de selectiecriteria. Er werden slechts twee dubbelblind gerandomiseerde onderzoeken gevonden (Lauritzen e.a., 1996; Mayur e.a., 2000). De meeste publicaties zijn gevalsbeschrijvingen en retrospectieve onderzoeken.
In deze bespreking wordt gekeken naar aanwijzingen voor een schadelijke interactie bij het gelijktijdig gebruik van ECT met psychofarmaca. Tevens wordt gekeken naar de evidentie voor een synergistisch therapeutisch effect van deze combinatiebehandeling.
Conclusies / Summary of Findings
Op basis van de nieuwe literatuur zijn er enkele aanpassingen gedaan op de conclusies vanuit de richtlijn van 2010.
|
XΟΟΟ† |
Er zijn voorzichtige aanwijzingen dat er een synergistisch effect optreedt bij de combinatiebehandeling ECT met psychofarmaca in de behandeling van depressieve episode.
(Baghai e.a., 2006; Lauritzen e.a., 1996; Sackeim 2009; Mayur e.a., 2000) |
|
XXΟΟ* |
Er zijn aanwijzingen dat de combinatie ECT met lithiumcarbonaat een toegenomen kans geeft op postictale verwardheid.
(Patel e.a., 2020) |
|
XΟΟΟ† |
Er zijn voorzichtige aanwijzingen dat het gebruik van carbamazepine, valproaat, gabapentine en topiramaat het induceren van een insult met ECT kan bemoeilijken. Er zijn voorzichtige aanwijzingen dat lamotrigine een mogelijke uitzondering hierop vormt. Effect op de respons is onduidelijk. Er worden geen ernstige interacties beschreven.
(Sienaert & Peuskens, 2007; Ak & Yalcin, 2018) |
|
XΟΟΟ† |
Er zijn voorzichtige aanwijzingen dat benzodiazepinen een verkorting van de insultduur bij ECT kunnen veroorzaken als er géén dosistitratie wordt toegepast. Er zijn voorzichtige aanwijzingen dat er in die situatie een beperktere respons is.
(Pettinati, 1990; Jha & Stein, 1996; Strömgren e.a., 1980; Standish-Barry e.a., 1985; Krueger e.a., 1993; Boylan e.a., 2000; Delamarre e.a., 2019) |
|
XΟΟΟ† |
Er zijn voorzichtige aanwijzingen dat er geen ernstige interacties ontstaan bij de combinatie van ECT met TCA’s, SSRI’s, SNRI;s, klassieke MAO-remmers, clozapine, klassieke en atypische antipsychotica.
(Lauritzen e.a., 1996; Mayur e.a., 2000; Nelson & Benjamin, 1989; Baghai e.a., 2006; Freese e.a., 1985; Remick e.a., 1987; Klapheke e.a., 1997; Gutierrez-Esteinou & Pope, 1989; Curran e.a., 1995; Tobiansky e.a., 1995; Serfaty e.a., 1996; Braga & Petrides, 2005; Kho e.a., 2004, Baghai e.a., 2006; Lally e.a., 2016) |
* Narratieve GRADING toegepast. Het niveau van de Grading start op ‘zeer laag’ omdat het een cohort studie betreft. De GRADING kon opgewaardeerd worden aangezien er sprake is van “een groot effect”.
Samenvatting literatuur
Het is mogelijk dat er een synergistisch therapeutisch effect is van de combinatie van ECT met psychofarmaca bij patiënten met een depressieve episode (Baghai e.a., 2006; Lauritzen e.a., 1996; Sackeim e.a., 2009). Andere auteurs vonden dit niet (Mayur e.a., 2000).
Combinatie met TCA
Bij de combinatiebehandeling met tricyclische antidepressiva (TCA) wordt gevreesd voor het optreden van cardiale complicaties, echter hiervoor zijn in de literatuur geen aanwijzingen gevonden (Lauritzen e.a., 1996; Mayur e.a., 2000; Nelson & Benjamin, 1989; Baghai, 2006; Sackeim e.a., 2009). Ook de combinatie met monoamine-oxidase (MAO) remmers geeft geen toename van cardiale bijwerkingen (Freese, 1985; Remick e.a., 1987; Klapheke, 1997).
Combinatie met SSRI/SNRI
Bij de combinatie van een SSRI met ECT is een verlengde (Baghai e.a., 2006; Curran, 1995; Serfaty e.a., 1996; Tobiansky e.a., 1995;) of verkorte insultduur (Gutierrez-Esteinou & Pope, 1989) beschreven. Ernstige interacties tussen SSRIs en ECT zijn niet beschreven. De combinatie van ECT met venlafaxine leek meer kans te geven op bradycardie en asystolie bij 4 van 13 patiënten die hogere dosis 300 mg per dag of hoger kregen (Gonzalez-Pinto e.a., 2002). Enkele casus meldden bradycardie en een verlengd insult (Agelink e.a., 1998; Conway & Nelson, 2001; Jha & Tomar, 2002). Lagere doseringen venlafaxine tot 150 mg, bleken bij 9 patiënten veilig gecombineerd te kunnen worden (Bernardo e.a., 2000).
Combinatie met benzodiazepinen
Het effect op de respons van het gebruik van benzodiazepines tijdens ECT is onzeker. De combinatie met een benzodiazepine kan een verkorting van de insultduur geven (Stromgren e.a., 1980; Standish-Barry e.a., 1985; Krueger e.a., 1993; Boylan e.a., 2000). De publicaties van Pettinati (1990) en Jha & Stein (1996) vonden weliswaar een verband tussen toediening van benzodiazepinen en een beperkter resultaat van ECT, maar dit betrof alleen de patiënten die met unilaterale ECT waren behandeld zonder dosistitratie. Minelli e.a. (2016) vonden een afgenomen insultkwaliteit uitgedrukt in verscheidene parameters en significant afgenomen respons bij het gebruik van high potency benzodiazepinen. Ook angst - als comorbide stoornis - was geassocieerd met een slechtere respons, zodat nog onduidelijk is of het gebruik van benzodiazepinen als causale factor moet worden gezien. In een retrospectieve studie van Delamarre e.a. (2019), die dosistitratie toepasten, werd een significant hogere respons in de benzodiazepine comedicatiegroep gevonden.
Combinatie met lithiumcarbonaat
De oudere literatuur over de combinatiebehandelingen met lithiumcarbonaat is door Dolenc & Rasmussen (2005) samengevat. Ernstige cognitieve bijwerkingen, postictale verwardheid, verlenging van de tijd tot wakker worden of spontane ademhaling, verlenging van insulten en het optreden van spontane insulten zijn beschreven bij de combinatie van ECT en lithiumcarbonaat, tegenover ongecompliceerde combinatiebehandelingen. Een placebo-gecontroleerde prospectieve studie, waarin van de patiënten 27 wél en 28 geen lithiumcarbonaat gebruikten (Thirtalli e.a., 2011), vond geen verschil wat betreft insult parameters, apnoe tijd en herstel van anesthesie. De lithium-groep had gemiddeld een lagere piek hartfrequentie, lagere maximale systolische bloeddruk en gemiddelde maximale rate-pressure product. Echter, een recente studie (Patel e.a., 2020) vergeleken patiënten met lithiumcarbonaat (N= 158), patiënten die ECT kregen (N = 64148) en patiënten die lithiumcarbonaat kregen tijdens de ECT (N= 422), waarbij de kans op het ontwikkelen van een delier zeer verhoogd bleek voor de combinatie van ECT met lithiumcarbonaat (OR= 11.7; 95% CI 7.55-17.99, P < 0.001).
Combinatie met anti-epileptica
Literatuur met gevalsbeschrijvingen van de combinatiebehandeling van ECT met carbamazepine, valproaat, gabapentine en topiramaat geeft aan dat deze anti-epileptica het induceren van een convulsie bemoeilijken. Lamotrigine vormt hierop een mogelijke uitzondering (Sienaert & Peuskens, 2007). Er worden geen ernstige interacties beschreven.
Combinatie met clozapine
In een redelijk goed uitgevoerde systematic review met meta-analyse (Lally 2016) werden het effect van ECT augmentatie met clozapine op response bij therapieresistente patiënten met schizofrenie onderzocht. De data was gebaseerd op vier open label studies en één RCT met in totaal 71 patiënten. Er was in de behandelde groep 54% (95% CI: 21.8–83.6%; I2 = 69%) respons. Omdat de analysen zijn gebaseerd op observationele data en er geen reden is om te upgraden, is de kwaliteit zeer laag (downgrade voor inconsistentie van het bewijs).
Combinatie met antipsychotica
Een ouder overzichtsartikel besprak de combinatiebehandeling met antipsychotica bij patiënten die lijden aan schizofreni& Petrides, 2005). De conclusie lijkt te moeten zijn dat ECT veilig te combineren is met antipsychotica (zie de module Evaluatie van de behandeling). Tabel 8 (zie evidence tabellen) toont de resultaten van de meta-analyse rond de vraag: Welk farmacologisch beleid dient gevoerd te worden bij de toepassing van ECT, rekening houdend met de stoornis?
Referenties
- Ak, S., & Yalcin, N. (2018). Do Antiepileptic Drugs Used During Electroconvulsive Therapy Impact Treatment Process? Journal of Clinical Psychopharmacology, 38(4), 344-348.
- Baghai, T.C., Marcuse, A., Brosch, M., e.a. (2006). The influence of concomitant antidepressant medication on safety, tolerability and clinical effectiveness of electroconvulsive therapy. World Journal of Biological Psychiatry, 7, 82-90.
- Bernardo, M., Navarro, V., Salva, J., e.a. (2000). Seizure activity and safety in combined treatment with venlafaxine and ECT: a pilot study. Journal of ECT, 16, 38-42.
- Boylan, L.S., Haskett, R.F., Mulsant, B.H., e.a. (2000). Determinants of seizure threshold in ECT: benzodiazepine use, anesthetic dosage, and other factors. Journal of ECT, 16, 3-18.
- Braga, R.J., & Petrides, G. (2005). The combined use of electroconvulsive therapy and antipsychotics in patients with schizophrenia. Journal of ECT, 21, 75-83.
- Conway, C.R., & Nelson, L.A. (2001). The combined use of bupropion, lithium, and venlafaxine during ECT: a case of prolonged seizure activity. Journal of ECT, 17, 216-218.
- Curran, S. (1995). Effect of paroxetine on seizure length during electroconvulsive therapy. Acta Psychiatrica Scandinavica, 92, 239-240.
- Delamarre, L., Galvao, F., Gohier, B., Poulet, E., & Brunelin, J. (2019). How Much Do Benzodiazepines Matter for Electroconvulsive Therapy in Patients With Major Depression? Journal of ECT, 35(3), 184-188. doi:10.1097/YCT.0000000000000574
- Freese, K.J. (1985). Can patients safely undergo electroconvulsive therapy while receiving monoamine oxidase inhibitors? Convulsive Therapy, 1, 190-194.
- Gonzalez-Pinto, A., Gutierrez, M., Gonzalez, N., e.a. (2002). Efficacy and safety of venlafaxine-ECT combination in treatment-resistant depression. Journal of Neuropsychiatry and Clinical Neuroscience, 14, 206-209.
- Gutierrez-Esteinou, R., & Pope, H.G. (1989). Does fluoxetine prolong electrically induced seizures? Convulsive Therapy, 5, 344-348.
- Jha, A., & Stein, G. (1996). Decreased efficacy of combined benzodiazepines and unilateral ECT in treatment of depression. Acta Psychiatrica Scandinavica, 94, 101-104.
- Jha, A., & Tomar, R. (2002). Interaction between ECT and venlafaxine. International Journal of Geriatric Psychiatry, 17, 979-980.
- Kho, K.H. (2008). Combinatiebehandeling van elektroconvulsietherapie met psychofarmaca. Tijdschrift voor Psychiatrie, 50, 99-104.
- Kho, K.H., Blansjaar, B.A., de Vries, S., e.a. (2004). Electroconvulsive therapy for the treatment of clozapine nonresponders suffering from schizophrenia--an open label study. European Archives of Psychiatry and Clinical Neuroscience, 254, 372-379.
- Klapheke, M.M. (1997). Electroconvulsive therapy consultation: an update. Convulsive Therapy, 13, 227-241.
- Krueger, R.B., Fama, J.M., Devanand, D.P., e.a. (1993). Does ECT permanently alter seizure threshold? Biological Psychiatry, 15, 272-276.
- Lally, J., Tully, J., Robertson, D., e.a. (2016). Augmentation of clozapine with electroconvulsive therapy in treatment resistant schizophrenia: A systematic review and meta-analysis, Schizophrenia Research, 171, 215-224.
- Lauritzen, L., Odgaard, K., Clemmesen, L., e.a. (1996). Relapse prevention by means of paroxetine in ECT-treated patients with major depression: a comparison with imipramine and placebo in medium-term continuation therapy. Acta Psychiatrica Scandinavica, 94, 241-251.
- Mayur, P.M., Gangadhar, B.N., Subbakrishna, D.K., e.a. (2000). Discontinuation of antidepressant drugs during electroconvulsive therapy: a controlled study. Journal of Affective Disorders, 58, 37-41.
- Nelson, J.P., & Benjamin, L. (1989). Efficacy and safety of combined ECT and tricyclic antidepressant drugs in the treatment of depressed geriatric patients. Convulsive Therapy, 5, 321-329.
- Patel, R. S., Bachu, A., & Youssef, N. A. (2020). Combination of lithium and electroconvulsive therapy (ECT) is associated with higher odds of delirium and cognitive problems in a large national sample across the United States. Brain Stimulation, 13(1), 15-19. doi:10.1016/j.brs.2019.08.012
- Pettinati, H. (1990). Benzodiazepines and unilateral ECT. Nursing Times, 86, 50.
- Remick, R.A., Jewesson, P., & Ford, R.W. (1987). Monoamine oxidase inhibitors in general anesthesia: a reevaluation. Convulsive Therapy, 3, 196-203.
- Sackeim, H. A., Dillingham, E. M., Prudic, J., Cooper, T., McCall, W. V., Rosenquist, P., . . . Haskett, R. F. (2009). Effect of concomitant pharmacotherapy on electroconvulsive therapy outcomes: short-term efficacy and adverse effects. Archives of General Psychiatry, 66(7), 729-737.
- Serfaty, M.A., Martin, L.M., Lingham, R., e.a. (1996). The effect of psychotropic medication on seizure duration during bilateral electroconvulsive therapy: a retrospective study. Journal of Psychopharmacology, 10, 303-308.
- Sienaert, P., & Peuskens, J. (2007). Anticonvulsants during electroconvulsive therapy: review and recommendations. Journal of ECT, 23, 120-123.
- Standish-Barry, H.M., Deacon, V., & Snaith, R.P. (1985). The relationship of concurrent benzodiazepine administration to seizure duration in ECT. Acta Psychiatrica Scandinavica, 71, 269-271.
- Strömgren, L.S., Dahl, J., Fjeldborg, N., e.a. (1980). Factors influencing seizure duration and number of seizures applied in unilateral electroconvulsive therapy. Anaesthetics and benzodiazepines. Acta Psychiatrica Scandinavica, 62, 158-165.
- Tobiansky, R.I., Lloyd, G.G., Tobiansky, I., e.a. (1995). ECT seizure threshold and fluoxetine. British Journal of Psychiatry, 166, 263.
Evidence tabellen
Uitgangsvraag: Welk farmacologisch beleid dient gevoerd te worden bij de toepassing van ECT, rekening houdend met de stoornis?
Tabel 8. Meta-analyse rond de vraag: Welk farmacologisch beleid dient gevoerd te worden bij de toepassing van ECT, rekening houdend met de stoornis?
|
Uitkomst |
Effect |
№ participanten |
Vertrouwen in het bewijs |
Opmerkingen |
||
|
Respons (Verbetering) |
54% |
71 |
⨁◯◯◯ |
Er zijn voorzichtig aanwijzingen dat ECT-augmentatie aan een behandeling met clozapine leidt tot respons, bij patiënten met schizofrenie. |
||
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 30-09-2021
Beoordeeld op geldigheid : 01-08-2021
Uiterlijk in 2026 bepaalt de Nederlandse Vereniging voor Psychiatrie (NVvP) in samenspraak met de betrokken partijen of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen wanneer nieuwe ontwikkelingen aanleiding geven een vervroegd herzieningstraject te starten. In beide gevallen is de huidige richtlijn geldig tot het daadwerkelijk verschijnen van de definitieve herziene versie.
Algemene gegevens
Op initiatief van de Nederlandse Vereniging voor Psychiatrie (NVvP) is door de werkgroep Richtlijn Elektroconvulsietherapie (ECT) een update ontwikkeld van de multidisciplinaire richtlijn uit 2010. De ontwikkeling van de module werd methodologisch en organisatorisch ondersteund door het Trimbos-instituut.
Doel en doelgroep
De module is ontwikkeld als hulpmiddel. De Richtlijn ECT geeft aanbevelingen en handelingsinstructies voor de indicaties van ECT, technische aspecten, anesthesiologische zorg, vervolgbehandeling na ECT en organisatie van zorg.
De module geeft aanbevelingen ter ondersteuning van de praktijkvoering van alle professionals die betrokken zijn bij het bieden van ECT aan de groepen patiënten die deze nodig hebben. Op basis van de resultaten van wetenschappelijk onderzoek en overige overwegingen geeft de module een overzicht van goed (‘optimaal’) handelen als waarborg voor kwalitatief hoogwaardige zorg. De module kan tevens richting geven aan de onderzoeksagenda voor wetenschappelijk onderzoek op het gebied van ECT.
Vanuit de multidisciplinaire ontwikkelprocedure poogt de richtlijn een positief effect te hebben op de multidisciplinaire samenwerking in de dagelijkse praktijk. Daarnaast moet de richtlijn gezien worden als een leidende tekst, waarvan een vertaling kan plaatsvinden naar lokale zorgprogramma’s en protocollen. Het opstellen van lokale zorgprogramma’s en protocollen op basis van deze module wordt door de werkgroep aangemoedigd, omdat het voor de implementatie van de in de richtlijn beschreven optimale zorg bevorderlijk is.
Indien de aanbevelingen uit deze richtlijn in de concrete situatie niet aansluiten bij de wensen of behoeften van de patiënt voor wie ECT wordt overwogen of overwogen zou moeten worden, dan moet het mogelijk zijn beredeneerd af te wijken van de richtlijn, tenzij de wensen of behoeften van de patiënt naar de mening van de psychiater hem/haar kunnen schaden dan wel geen toegevoegde waarde hebben.
Afbakening
Deze module betreft indicaties, technische aspecten, anesthesiologische zorg, vervolgbehandeling en zorgorganisatie rond het aanbieden van ECT aan patiënten met een depressieve-, een suïcidale-, een manische-, een katatone-, of een psychotische episode, een episode met bewustzijnsdaling, of een motorisch ontregelde episode.
Met uitzondering van de module over ECT bij adolescenten, zijn studies over personen vanaf 18 jaar meegenomen. In de module is gezocht systematische reviews en meta-analyses met een publicatiedatum van 2008 tot en met 1 maart 2019. Nog niet gepubliceerde onderzoeken zijn niet meegenomen (wel onderzoeken 'in press'). Zie voor meer informatie over de afbakening van de module in de bijlagen. Per module is een bijlage opgenomen met toelichting over de gebruikte reviewstrategie (reviewprotocollen per uitgangsvraag).
Samenstelling werkgroep
De Multidisciplinaire Richtlijn ECT is ontwikkeld door de werkgroep ECT, in opdracht van de Nederlandse Vereniging voor Psychiatrie.
De werkgroep, onder voorzitterschap van prof. dr. Walter van den Broek, psychiater en opleider psychiatrie bij het Erasmus Medisch Centrum in Rotterdam, bestond uit: psychiaters, verpleegkundigen, verpleegkundig specialisten GGZ, anesthesiologen, een klinisch neuropsycholoog en een ervaringsdeskundige, die door de beroepsverenigingen en patiëntenvereniging werden afgevaardigd.
Voorafgaande aan het ontwikkeltraject werden kennismakingsgesprekken gevoerd met verscheidene kandidaatleden voor de werkgroep. Uit deze groep belangstellenden werden de huidige werkgroep leden geselecteerd. Naast de werkgroep is een groep van adviseurs samengesteld, die werd gevraagd voorafgaand aan de commentaarfase schriftelijk en telefonisch te reageren op onderdelen van de concepttekst. De werkgroep werd methodologisch en organisatorisch ondersteund door het technisch team van het Trimbos-instituut. Dit technisch team bestond uit een projectleider, literatuur reviewers, een gezondheidseconoom, een notulist en een projectassistente. Onderstaande schema's geven een overzicht van de samenstelling van de werkgroep, de adviesgroep en het ondersteunend technisch team.
Leden werkgroep
|
|
Naam |
Organisatie |
Beroepsvereniging |
|
1. |
Walter van den Broek |
Erasmus MC |
Psychiater, NVvP |
|
2. |
Jeroen van Waarde |
Rijnstate |
Psychiater, NVvP |
|
3. |
Martijn van Noorden |
LUMC |
Psychiater, NVvP |
|
4. |
Harm Pieter Spaans |
Parnassia |
Psychiater, NVvP |
|
5. |
Pascal Sienaert |
Upcku Leuven |
Psychiater, VVP België |
|
5. |
Mark Koning |
Rijnstate |
Anesthesioloog-Intensivist, NVA |
|
6. |
Nick Koning |
Rijnstate |
Anesthesioloog, NVA |
|
7. |
Lianneke Egberink |
GGz InGeest |
Verpleegkundig specialist GGz, V&VN |
|
8. |
Franklin Dik |
GGz Rivierduinen |
Verpleegkundig specialist GGz, V&VN |
|
9. |
Esmée Verwijk |
AMC |
Klinisch neuropsycholoog, NIP |
|
10. |
Hector van den Boorn |
AMC |
Clientvertegenwoordiger, MIND |
Leden Adviesgroep
|
Module |
Naam |
Organisatie |
Beroep |
|
Indicatie voor ECT |
Eric van Exel |
GGzIngeest |
Psychiater, voorzitter WEN |
|
Technische aspecten |
Metten Somers |
UMCU |
Psychiater, voorzitter WEN |
|
Hans Warning |
UMCG |
Verpleegkundig specialist psychiatrie |
|
|
Anesthesiologische zorg |
Theo Groenland |
Park Medisch Centrum |
Anesthesioloog |
|
Zorgorganisatie |
Judith Godschalx |
Spaarne Gasthuis |
Psychiater |
|
Bijwerkingen (verschillende modules) |
Mike van Kessel |
Antes |
Psycholoog |
Methodologische ondersteuning
|
Naam
|
Ondersteuning |
|
Danielle van Duin |
Projectleider, Trimbos-instituut |
|
Matthijs Oud |
Reviewer, Trimbos-instituut |
|
Egbert Hartstra |
Reviewer, Trimbos-instituut |
|
Ben Wijnen |
Gezondheidseconoom, Trimbos-instituut |
|
Diana de Ruijter Korver |
Projectassistent, Trimbos-instituut |
In totaal kwam de werkgroep ECT voorafgaand aan de commentaarfase 7 keer bijeen in een periode van 13 maanden (januari 2019 – februari 2020). In deze periode werden de stappen van de methodiek voor evidence-based richtlijnontwikkeling (EBRO) doorlopen. Op systematische wijze werd literatuuronderzoek gedaan, waarna de reviewers een selectie maakten in de gevonden onderzoeken (zie voor informatie over de selectiecriteria: de per module bijgevoegde reviewprotocollen). De reviewers beoordeelden de kwaliteit en inhoud van de aldus verkregen literatuur en verwerkten deze in evidence tabellen, Risk of bias tabellen, forest plots, GRADE profielen en beschrijvingen van de wetenschappelijke onderbouwing en wetenschappelijke (gewogen) conclusies. Leden van de werkgroep gingen op basis van de gevonden literatuur met elkaar in discussie over praktijkoverwegingen en aanbevelingen. De werkgroepleden schreven samen met het technisch team van het Trimbos-instituut de concepttekst, die ter becommentariëring openbaar is gemaakt. De ontvangen commentaren zijn verzameld in een commentaartabel, die tijdens een werkgroepbijeenkomst is besproken. Na het verwerken van de op deze bijeenkomst voorgestelde wijzigingen is de definitieve richtlijn ter autorisatie aangeboden aan de betrokken beroepsverenigingen en patiëntorganisatie.
Inbreng patiëntenperspectief
Zie het verslag van de patiënt focusgroep bijeenkomst in de bijlagen.
Methode ontwikkeling
Evidence based
Implementatie
Recent onderzoek laat zien dat er bij trajecten rond kwaliteitsstandaarden voornamelijk aandacht is voor de ontwikkeling van de kwaliteitstandaard. Planmatige opgezette en onderbouwde invoering komt maar heel beperkt van de grond. Hierop dient gericht te worden aangestuurd door financiers, zodat hier al bij de start geld voor beschikbaar is. De Regieraad voor richtlijntrajecten onderschrijft dan ook een programmatische aanpak van de ontwikkeling, invoering én evaluatie van kwaliteitsstandaarden inclusief (financiële en organisatorische) middelen, om het gebruik van de standaarden te stimuleren, monitoren en evalueren[1]. TNO, CBO en het Trimbos-instituut besloten deze opdracht samen uit te voeren, met als doel de complementaire inzichten en expertise te vertalen in een gemeenschappelijke visie op richtlijnen en andere kwaliteitsstandaarden. Dit resulteerde in een praktisch instrument voor een analyse van richtlijntrajecten: Kwaliteit Richtlijnontwikkeling, Invoering en Evaluatie (KRIE).
Werkwijze
De multidisciplinaire richtlijn ECT is ontwikkeld volgens de methodiek van de evidence based richtlijnontwikkeling (EBRO).
Uitgangsvragen
De module is ontwikkeld op geleide van uitgangsvragen, die gebaseerd zijn op knelpunten die worden ervaren rondom indicaties, technische aspecten, anesthesiologische zorg, vervolgbehandeling, en organisatie van zorg bij ECT.
De module is geen leerboek waarin zoveel mogelijk beschikbare kennis over een onderwerp wordt opgenomen, maar een document met praktische aanbevelingen rondom knelpunten uit de praktijk. Dat betekent dat praktijkproblemen zoveel als mogelijk uitgangspunt zijn van de teksten in de module. Dat betekent ook dat méér aandacht gegeven wordt aan de wijze waarop die praktijkproblemen worden opgelost, dan aan degene door wie die problemen worden aangepakt of opgelost. De module is een document waarin staat hoe indicatiestelling, technische uitvoering, anesthesiologische begeleiding, vervolgbehandeling bij ECT er inhoudelijk uitziet. Daarnaast worden in een apart module aanbevelingen gedaan voor de organisatie van zorg bij ECT en over de kosteneffectiviteit en budget impact van het aanbieden van ECT. In deze module worden de hieronder beschreven ‘klinische uitgangsvragen’ behandeld in de verschillende modules.
Uitgangsvragen in de richtlijn ECT zijn:
|
Module |
Uitgangsvragen |
|
Indicaties voor ECT |
Stemmingsstoornissen
Primair psychotische stoornissen
Overige therapieresistente aandoeningen
|
|
Technische Aspecten van ECT |
|
|
Anesthe-siologische zorg |
|
|
Vervolg behandeling na ECT |
|
|
Organisatie van zorg |
|
|
Perspectief patiënten en naasten |
|
|
Economische analyse ECT |
volwassenen (18+) met een therapieresistente psychotische episode? |
Zoekstrategie
Om de klinische uitgangsvragen te beantwoorden is, in overleg met de werkgroepleden, op systematische wijze literatuuronderzoek verricht en is een selectie gemaakt binnen de gevonden onderzoeken volgens vooraf vastgestelde selectiecriteria. Er is gezocht naar bestaande (buitenlandse) evidence-based richtlijnen voor ECT, systematische reviews en meta-analyses. In de literatuur searches is gezocht naar literatuur in de Engelse, Nederlandse, Franse, en Duitse taalgebieden. Voor het zoeken naar publicaties is gebruik gemaakt van de volgende informatiebronnen:
- Psychological Information Database (PsycINFO)
- PubMed
- Cumulative Index to Nursing and Allied Health Literature (CINAHL)
- Excerpta Medica database (Embase)
Selectiestrategie
Bij de selectie van artikelen zijn de volgende criteria gehanteerd:
- Geeft het onderwerp van het gevonden onderzoek voldoende antwoord op de uitgangsvraag: worden de binnen GRADE vastgestelde kritische en belangrijke uitkomstmaten in het onderzoek geëvalueerd? (zie voor meer informatie over GRADE verderop in deze module);
- Sluit de doelgroep van het gevonden onderzoek voldoende aan bij de doelgroep van de module?;
- Is er sprake van een meta-analyse of systematic-review van randomised controlled trials (RCT), cohort onderzoeken, cross-sectioneel onderzoek, patiëntcontrole onderzoek of wetenschappelijke verantwoord kwalitatief onderzoek? Bij een longitudinaal onderzoek: Is er sprake van een voldoende lange follow-up periode?;
Zie voor meer informatie over de zoekstrategie de bijlagen per module en voor meer informatie over de selectiecriteria per uitgangsvraag de reviewprotocollen in de bijlagen per module.
Beoordeling van de kwaliteit van het bewijs
Studies werden indien mogelijk door twee personen beoordeeld op het risico op bias met behulp van de Cochrane Collaboration Risico van Bias Assessment Tool (Higgins 2008). Elke studie werd gewaardeerd op de wijze van randomisatie en toewijzing; blindering van de deelnemers, beoordelaars, en therapeuten; gehanteerde methode om met uitval van deelnemers om te gaan; en of alle uitkomsten zijn gerapporteerd. Risico op bias kon als hoog (serieuze kans op beïnvloeding van het resultaat), laag (waarschijnlijk geen invloed op het resultaat), of onduidelijk worden beoordeeld. Indien een geselecteerde studie al een risico op bias analyses had uitgevoerd is deze overgenomen.
Voor het bewijs rondom interventies is daarna het bewijs van de onderzoeken per uitkomstmaat gegradeerd met behulp van GRADE[1]. De kwaliteit van het bewijs kent daarbij vier niveaus, te weten; zeer laag, laag, matig en hoog. In deze module is gekozen om de GRADE niveaus weer te geven met behulp van de volgende neutrale en internationaal toepasbare weergave:
|
Hoog |
XXXX |
|
Matig |
XXXO |
|
Laag |
XXOO |
|
Zeer laag |
XOOO |
Het studiedesign bepaalt de uitgangspositie van de kwaliteit van bewijs. Gerandomiseerde, gecontroleerde studies (RCT's) hebben over het algemeen meer bewijskracht dan observationele studies. Daarom is hun uitgangspositie hoog, terwijl de uitgangspositie van observationele studies laag is. De kwaliteit van het bewijs per uitkomstmaat wordt, behalve door de methodologische kwaliteit van de individuele onderzoeken, ook bepaald door andere factoren, zoals de mate van consistentie van de gevonden resultaten uit de verschillende onderzoeken en de precisie van de gevonden uitkomst (zie tabel 1).
Tabel 1 GRADE Factoren voor downgraden en upgraden
Het niveau van de kwaliteit van het bewijs (zeer laag, laag, matig en hoog) verwijst naar de mate van vertrouwen dat men heeft in de schatting van het effect van een behandeling.
|
We downgraden het niveau van de kwaliteit van bewijs van studies met een hoge uitgangspositie (RCT’s), bij:
|
We upgraden het niveau van de kwaliteit van bewijs van observationele studies bij:
|
|
|
|
|
|
|
|
|
|
|
Samenvatten van resultaten
Van elk artikel is een samenvatting gemaakt, waarin de belangrijkste kenmerken van het onderzoek zijn opgenomen (bij een RCT zijn dat bijvoorbeeld het doel van het onderzoek, het onderzoeksdesign, patiëntkenmerken, interventies, uitkomstmaten en de resultaten). Bij de uitgangsvragen over interventies is waar mogelijk voor elke kritische uitkomstmaat een meta-analyse uitgevoerd, om de omvang van het klinisch effect van de interventie samen te vatten. De data uit oorspronkelijke onderzoeken worden hiervoor verwerkt in een forest plot, welke een grafische weergave van de meta-analyse geeft (zie tabel 2 voor een voorbeeld van een forest plot). In het geval dat een geselecteerde studie een meta-analyses betrof, is gebruik gemaakt van de al uitgevoerde meta-analyses uit de desbetreffende publicatie.
Tabel 2 Voorbeeld van een forest plot met toelichting
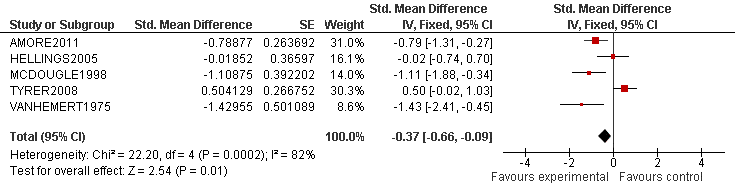
De verticale lijn is de lijn van geen effect.
- Elke blokje geeft de puntschatting van het interventie effect van een onderzoek aan
- De grootte van het blokje correspondeert met het gewicht van het onderzoek binnen de meta-analyse
- De horizontale lijn is een weergave van het betrouwbaarheidsinterval (95% BI)
- De diamant is een weergave van het overall effect (gemiddeld gewogen effect)
- De significantie van het overall effect wordt onderaan de plot gegeven (z-score en p-waarde)
- De I2 geeft de mate van heterogeniteit van de studies aan (consistentie van de resultaten)
Wanneer er onvoldoende data beschikbaar waren om een meta-analyse uit te voeren, stelden de reviewers in enkele gevallen een narratieve (beschrijvende) review van het beschikbare bewijs op (zonder ‘gepoolde’ resultaten en berekening van mate van heterogeniteit, maar met een beschrijving van de kwaliteit). De kwaliteitsbeoordeling en een samenvattende beschrijving van de verschillende onderzoeken die zijn geselecteerd vanuit de systematische literatuur search worden voor elke uitgangsvraag beschreven onder het kopje ‘wetenschappelijke onderbouwing’.
Conclusies
De formulering van de conclusies, gebaseerd op de studies uit de systematische literatuur search, is afgestemd op het GRADE niveau (zie tabel 3). Deze formulering sluit ook aan bij de ‘levels of evidence’ welke indeling (niveau 1 t/m 4) voorheen werd gebruikt in onder andere de multidisciplinaire richtlijn Schizofrenie.
Tabel 3 Formulering conclusies n.a.v. GRADE niveau
|
GRADE |
Levels of evidence |
Formulering conclusies |
|
XXXX |
Niveau 1 |
“Het is aangetoond dat…” |
| XXXO |
Niveau 2 |
“Het is aannemelijk dat…” |
|
XXOO |
Niveau 3 |
“Er zijn aanwijzingen dat…” |
|
XOOO |
Niveau 4 |
“Er zijn voorzichtige aanwijzingen dat…” |
Conversie van levels of evidence naar GRADE
In de huidige richtlijn is er gekeken of de uitgangsvragen in de modules Indicaties, Technische en verpleegkundige aspecten en Anesthesiologische zorg beantwoord kunnen worden aan de hand van recent uitgevoerde systematische reviews en meta-analyses (en de losse randomized controlled trials daarbinnen). In het geval dat er geen recente systematische reviews en/of meta-analyses zijn gevonden zijn in de huidige richtlijn de conclusies uit de vorige richtlijn Elektroconvulsietherapie (2de herziene versie; NVvP, 2010) omgezet van ‘levels of evidence’ naar ‘GRADE’. Kort samengevat worden conclusies getrokken op basis van bewijs waarvan de sterkte wordt aangegeven doormiddel van niveau 1 (sterk) t/m niveau 4 (zwak) (zie tabel 4). Deze niveaus worden bepaald aan de hand van de methodologische kwaliteit van de individuele onderzoeken waar de conclusies op gebaseerd zijn (zie tabel 2). In de GRADE methode wordt kwaliteit van het bewijs gerangschikt in vier niveaus, te weten; zeer laag, laag, matig en hoog (zie tabel 5). Bij het omzetten van ‘levels of evidence’ naar ‘GRADE’ kwam deze rangschikking als volgt tot stand.
Conclusies met de niveaus 3 of 4 werden omgezet naar ‘zeer laag’. Wanneer een niveau 3 conclusie gebaseerd was op observationele studies (methodologische kwaliteitsniveau B), werd er gekeken of er stapsgewijs geüpgraded kon worden. Dit werd gedaan in het geval dat de observationele studie een groot effect liet zien, wanneer mogelijke confounders het ware effect verminderd hadden, en wanneer er bewijs is van een verband tussen de dosering en de respons.
Bij niveau 2 conclusies is er gekeken naar de methodologische kwaliteit van de individuele onderzoeken. In het geval dat dit een non-RCT/observationele studie betrof was het GRADE startpunt ‘zeer laag’ en werd er gekeken of er stapsgewijs geüpgraded kon worden. Wanneer het een RCT betrof was het GRADE startpunt ‘hoog’. Vervolgens werd op basis van de full tekst gedowngraded voor risk of bias (tekortkoming[en] in de studie), inconsistentie van de resultaten, indirect bewijs, onnauwkeurigheid van de resultaten en publicatie bias.
Bij niveau 1 conclusies werd er gekeken naar de methodologische kwaliteit van de individuele onderzoeken. Wanneer dit een RCT was (methodologische kwaliteitsniveau A2) was het GRADE startpunt ‘hoog’ en werd de full tekst gebruikt om GRADE uit te voeren. In het geval van een narratieve review werd er in de referentielijst van de review gezocht naar relevante RCTs, wanneer deze er niet waren was het GRADE startpunt ‘zeer laag’ en werd er gekeken of er geüpgraded kon worden op basis van individuele observationele studies. Wanneer er wel een relevante RCT was gebruikt was het GRADE startpunt ‘hoog’ en werd op basis van de full tekst GRADE uitgevoerd. Als de niveau 1 conclusie gebaseerd was op een systematische review/meta-analyse (methodologische kwaliteitsniveau A1) werd alle informatie van de relevante RCTs uit de full tekst gehaald en waar nodig aangevuld met informatie uit de originele artikelen. De GRADE score was in deze gevallen ‘hoog’ en de standaard GRADE methode werd uitgevoerd om het uiteindelijke kwaliteitsniveau van het bewijs te bepalen.
De conclusies afkomstig uit de vorige richtlijn Elektroconvulsietherapie waarvan de levels of evidence zijn omgezet naar GRADE worden in de modules aangeduid met een †.
Tabel 4 Levels of evidence zoals gebruikt in de vorige Richtlijn Elektroconvulsietherapie (2de herziene versie, NVvP, 2010)*
|
Level of evidence |
Conclusie gebaseerd op** |
|
Niveau 1 |
onderzoek van niveau A1 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2 |
|
Niveau 2 |
één onderzoek van niveau A2 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
Niveau 3 |
één onderzoek van niveau B of C |
|
Niveau 4 |
mening van deskundigen |
*Tabel is een aangepaste versie zoals weergegeven in Richtlijn Elektroconvulsietherapie (2de herziene versie, NVvP 2010) ** Zie tabel 5 voor overzicht van bepaling methodologische kwaliteit van individuele onderzoeken.
Tabel 5 Bepaling van de methodologische kwaliteit van individuele onderzoeken zoals gebruikt in de Richtlijn Elektroconvulsietherapie (2de herziene versie, NVvP, 2010)*
|
Interventie |
Diagnostische accuratesse-onderzoek |
Schade of bijwerkingen, etiologie, prognose |
|
A1: Systematische review van ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
|
|
|
A2: Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
Prospectief cohort-onderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten |
|
B: Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiëntcontrole-onderzoek, cohortonderzoek) |
Onderzoek ten opzichte van een referentietest, maar niet met alle kenmerken die onder A2 zijn genoemd |
Prospectief cohort-onderzoek, maar niet met alle kenmerken als genoemd onder A2, of retrospectief cohort-onderzoek of patiënt-controleonderzoek |
|
C: Niet-vergelijkend onderzoek |
|
|
|
D: Mening van deskundigen |
|
|
*Tabel is een aangepaste versie zoals weergegeven in Richtlijn Elektroconvulsietherapie (2de herziene versie, NVvP, 2010)
Praktijkoverwegingen
Naast de wetenschappelijke onderbouwing, waarin vanuit de systematische literatuursearch de conclusies zijn getrokken op basis van het best beschikbare bewijs, is voor elke uitgangsvraag expert kennis verzameld. Hiervoor hebben de leden van de werkgroep gebruik gemaakt van een GRADE checklist ‘Van bewijs naar aanbeveling’, waarmee systematisch wordt nagegaan of er relevante praktijkoverwegingen zijn voor een aantal vooraf bepaalde factoren, waaronder: balans tussen gewenste en ongewenste effecten, patientenperspectief, middelenbeslag en maatschappelijk perspectief. Deze overwegingen werden onderbouwd vanuit ‘grijze literatuur’ (studies, rapporten en andere teksten die niet vanuit de systematische literatuursearch en -selectie zijn verwerkt in de wetenschappelijke conclusies). De aanbevelingen werden gebaseerd op de combinatie van de wetenschappelijke conclusies en de praktijkoverwegingen.
Aanbevelingen
Aanbevelingen kunnen gegradeerd worden als ‘sterk’ (onvoorwaardelijk) of ‘zwak’ (voorwaardelijk). Wanneer de kwaliteit van het bewijs voor de positieve en negatieve effecten van een interventie hoog is, kan dit leiden tot een sterke aanbeveling, en omgekeerd, wanneer de bewijskracht laag tot zeer laag is, kan dit een zwakke aanbeveling opleveren. Een zwakke aanbeveling geeft meer ruimte om af te wijken en aandacht te schenken aan alternatieven die passen bij de behoeften van de patiënt, terwijl bij een sterke aanbeveling die ruimte beperkt is. Echter, de kracht van het wetenschappelijke bewijs is niet de enige factor die de sterkte van de aanbevelingen bepaalt. De aanbevelingen zijn gebaseerd op wetenschappelijk bewijs enerzijds, en overige overwegingen, zoals praktijkervaringen van de werkgroepleden, ervaringen en voorkeuren van patiënten, kosten, beschikbaarheid en organisatorische aspecten, anderzijds.
Voor de formulering van ‘sterke’ (onvoorwaardelijke) en ‘zwakke’ (voorwaardelijke) aanbevelingen is de volgende indeling aangehouden (zie tabel 6):
Tabel 6 GRADE Voorkeursformulering sterke / zwakke aanbevelingen
|
Gradering aanbeveling |
Betekenis |
Voorkeursformulering |
|
STERK VOOR |
De voordelen zijn groter dan de nadelen voor bijna alle patiënten. Alle of nagenoeg alle geïnformeerde patiënten zullen waarschijnlijk deze optie kiezen. |
We bevelen [interventie] aan. |
|
ZWAK VOOR |
De voordelen zijn groter dan de nadelen voor een meerderheid van de patiënten, maar niet voor iedereen. De meerderheid van geïnformeerde patiënten zal waarschijnlijk deze optie kiezen. |
Overweeg [interventie], bespreek de voor- en nadelen). |
|
ZWAK TEGEN |
De nadelen zijn groter dan de voordelen voor een meerderheid van de patiënten, maar niet voor iedereen. De meerderheid van geïnformeerde patiënten zal waarschijnlijk deze optie kiezen. |
Wees terughoudend met [interventie], bespreek de voor- en nadelen). |
|
STERK TEGEN |
De nadelen zijn groter dan de voordelen voor bijna alle patiënten. Alle of nagenoeg alle geïnformeerde patiënten zullen waarschijnlijk deze optie kiezen. |
We bevelen [interventie] niet aan. |
Methode: economische analyse
Het doel van de economische evaluatie was om bij te dragen aan de ontwikkeling van de richtlijn door het leveren van bewijs over de kosteneffectiviteit van ECT. Dit werd bereikt door het uitvoeren van een systematische literatuur search naar bestaand economisch bewijs. Systematische literatuur searches naar economisch bewijs zijn uitgevoerd voor ECT bij therapieresistente depressie.
Zoekstrategie
Er werd een systematische literatuur zoekstrategie uitgevoerd om al het relevante bewijs te identificeren. Zoekstrategieën werden beperkt tot economische onderzoeken en Health Technology Assessment Reports, en uitgevoerd in de volgende databases:
- Health Technology Assessment (HTA) database
- NHS Economic Evaluation Database (NHS EED)
- EMBASE
- PsychINFO
- CINAHL
- PubMed
- Cochrane Database of Systematic Reviews (CDSR)
Daarnaast werd Google en Google Scholar doorzocht op onderzoeken welke mogelijk ontbraken in de elektronische databases. Verder werd literatuur in eerdere richtlijnen gecheckt. Enig relevant bewijs vanuit de klinische literatuursearch werd in deze periode aan de Health Economist beschikbaar gesteld. De HTA en NHS EED databases zijn relatief beperkt in omvang, waardoor werd gekozen voor een brede zoekstrategie gebaseerd op een klinische Cochrane review van Peng et al. (2014) gecombineerd met een zoekstrategie van Wilczynski et al. (2004) die speciaal ontwikkeld is voor het identificeren van economische studie.
Selectiestrategie
De volgende selectiecriteria zijn toegepast om vanuit de resultaten van economische searches onderzoeken te selecteren voor nadere evaluatie:
- Richten op patiënten met depressie.
- Volledige economische evaluatie (d.w.z. dat tenminste twee behandelingen met elkaar vergeleken werden in termen van kosten en effecten) gebaseerd op een klinische studie of een modelleringsstudie.
- ECT als een van de armen in de studie.
- Selectiecriteria rond soorten klinische condities, gebruikers van zorg en interventies die worden beoordeeld waren identiek aan die in de klinische literatuur reviews.
- Een voorwaarde voor inclusie van onderzoeken was dat deze voldoende details beschreven over methoden en resultaten en dat de gegevens en de resultaten van het onderzoeken extraheerbaar waren. Dit om het mogelijk te maken om de methodologische kwaliteit van het onderzoeken te beoordelen. Poster presentaties en abstracts werden geëxcludeerd.
Beschrijving van de resultaten en conclusies
Het economisch bewijs dat is geselecteerd in deze module is apart weergegeven.
Literatuur
Gevers, J.K.M., & Aalst, A. van (1998). De rechter en het medisch handelen (3e druk). Deventer: Kluwer.
Higgins, J.P.T., Green, S., & Cochrane Collaboration (2008). Cochrane handbook for systematic Reviews of interventions. Chichester, England/Hoboken, NJ: Wiley-Blackwell.
[1] GRADE: Grading of Recommendations Assessment, Development and Evaluation
[2] Het blinderen van deelnemers en therapeuten is in deze richtlijn niet meegenomen in de beoordeling van studies rond psychosociale interventies, omdat blinderen van de deelnemers en therapeuten niet goed mogelijk is bij deze interventies.
