Inductie medicatie (hypnotica) bij ECT
Uitgangsvraag
Welke hypnotica zijn eerste keus bij het toepassen van ECT?
Aanbeveling
Kies een standaard hypnoticum: etomidaat, propofol of methohexital.
Overweeg propofol en methohexital te combineren met een opiaat, zodat een lagere dosering hypnoticum gebruikt kan worden, om de invloed op het insult zo klein mogelijk te maken.
Overweeg om van hypnoticum te veranderen naar etomidaat als een patiënt moeilijk opwekbare insulten heeft.
Overweeg van hypnoticum te veranderen naar propofol als er sprake is van te lange insultduur, ernstige postictale misselijkheid en braken, en een excessieve hemodynamische reactie na de ECT-sessie.
Overweeg sevofluraan als inductie van anesthesie te gebruiken wanneer patiënten panisch zijn voor het prikken van een infuus, mits de luchtbeheersing goed geregeld is met afzuig van volatiele anesthetica en er geen cardiovasculaire risico’s bestaan.
Het gebruik van ketamine als racemisch mengsel wordt afgeraden om te gebruiken bij ECT.
Er bestaat geen indicatie voor thiopental als hypnoticum tijdens ECT, vanwege de anticonvulsieve eigenschappen.
Overwegingen
Professioneel perspectief
De werkgroep is van mening dat er met de anesthesiologen een keuze gemaakt moet worden tussen etomidaat, propofol, en methohexital. De werkgroep beveelt aan een standaard hypnoticum te kiezen uit etomidaat, propofol of methohexital en daar ervaring mee op te doen in de eigen instelling. Voorkomen moet worden dat een patiënt telkens wisselende hypnotica krijgt tijdens de ECT-kuur, vandaar het advies om een standaard hypnoticum vast te stellen. Hypnotica kunnen gecombineerd worden met alfentanil of remifentanil, zodat de inductiedosis van het hypnoticum verlaagd kan worden.
Indicaties voor verandering van deze keuze dient gemotiveerd te gebeuren. Zo kan bijvoorbeeld gekozen worden voor etomidaat, als het insult moeilijk opwekbaar blijkt bij gebruik van propofol. Andersom kan gekozen worden voor propofol als de duur van het insult te lang is, en/of als ernstige postictale misselijkheid en braken en/of als een excessieve hemodynamische reactie tijdens de ECT-sessie wordt waargenomen bij het gebruik van etomidaat. Bij ernstige postictale misselijkheid kan overwogen worden om geen opiaat te gebruiken.
De werkgroep is van mening dat sevofluraan als inductie van anesthesie gebruikt kan worden wanneer een intraveneuze inductie niet mogelijk is. Met de huidige gegevens biedt sevofluraan geen voordeel ten opzichte van de andere hypnotica. De invloed op insultduur is onduidelijk en de cardiovasculaire effecten van sevofluraan tijdens een ECT-sessie kunnen een nadeel zijn.
Het gebruik van ketamine als racemisch mengsel wordt ontraden bij ECT. Er bestaat geen indicatie voor thiopental als hypnoticum tijdens ECT, vanwege de anticonvulsieve eigenschappen, bovendien kan extravasatie uitgebreide necrose veroorzaken.
Middelen beslag
Hypnotica kunnen niet beschikbaar zijn door een verminderde productie. In dat geval dient een alternatief uit bovengenoemde medicatie worden gekozen. Het verschil in kosten tussen middelen is klein en vormt geen beweegreden om eerder voor een bepaald middel te kiezen.
Onderbouwing
Achtergrond
Een ECT-kuur zonder algehele anesthesie is niet meer denkbaar. Algemene richtlijnen ten aanzien van anesthesie worden geacht nageleefd te worden (preoperatieve screening, nuchter zijn, voorschrijven van medicatie), zoals in voorgaande module is beschreven.
Voor de narcose wordt gebruikgemaakt van een hypnoticum gecombineerd met een spierverslapper, en eventueel een opiaat. Voor de keuze van een hypnoticum bij een ECT-sessie zijn enkele criteria van belang:
- het middel moet snel inwerken;
- het middel moet een korte werkingsduur bezitten;
- de patiënt moet hemodynamisch stabiel zijn;
- er moeten geen of nauwelijks bijwerkingen zijn;
- de patiënt moet snel en prettig wakker worden en adequaat reageren;
- de invloed op de insultduur met therapeutische consequenties moet bekend zijn.
Hoewel er geen duidelijke aanwijzingen zijn voor een lineair verband tussen insultduur en het therapeutisch effect van ECT wordt wel aangenomen dat een therapeutisch insult een minimale duur moet hebben.
Spierverslapping is vereist om de nadelige effecten van de door het insult veroorzaakte spiercontracties, zoals spierpijn, gewrichtsluxaties en fracturen, tegen te gaan. Spierverslapping wordt bereikt met succinylcholine 0,5-1,0 mg/kg. De patiënt wordt op de kap beademd met 100% zuurstof en de ECT-stimulus wordt toegediend na volledige inwerking van succinylcholine. Rocuronium (0,4-0,6 mg/kg) wordt veelal als alternatief gebruikt bij contra-indicaties voor succinylcholine. Dit kan geantagoneerd worden met sugammadex op geleide van een Train-of-Four (TOF) meting. Indien er een volgende ECT-sessie gepland staat > 24 uur later, is van sugammadex zeer waarschijnlijk geen effect meer van te verwachten (Cammu e.a., 2010; Iwasaki e.a., 2016).
Goede oxygenatie en adequate ventilatie is van belang, aangezien tijdens het insult het zuurstofverbruik van de hersenen toeneemt en zowel hypoxie als hypercapnie de insultduur verkorten (Räsänen e.a., 1988; Chater & Simpson, 1988). Bij hypocapnie zou er een positieve correlatie bestaan met de lengte van het insult (Bergsholm e.a., 1993). Normocapnie heeft geen correlatie met de insultduur (Bergsholm e.a., 1993). Tevens blijkt dat mogelijk bij te lage en te hoge arteriële pCO2-waarden de hemodynamische veranderingen na de ECT-sessie meer uitgesproken te zijn (Bergsholm e.a., 1993; Saito e.a., 2003). Normoventilatie heeft dan ook de voorkeur om de invloed van de beademing, in de zin van hypo- en hyperventilatie, op de insultduur en de hemodynamische veranderingen na de ECT-sessie te minimaliseren.
Een gebitsbeschermer is nodig om beschadiging van het gebit tijdens de kaakkramp, veroorzaakt door de kortdurende elektrische stimulus, te voorkomen.
Te allen tijde moet ingespeeld kunnen worden op een moeilijke kapbeademing en een belemmerde luchtweg. Een intubatie moet direct uitgevoerd kunnen worden; laryngoscoop en endotracheale tube dienen aanwezig te zijn. Alle materialen en medicatie om in een reanimatiesetting adequaat te kunnen handelen moeten direct beschikbaar zijn.
De keuze voor een bepaald hypnoticum moet een weloverwogen keuze zijn. De gebruikte hypnotica en opiaten worden in de dagelijkse ECT-praktijk al lang gebruikt en veel van hun werking en bijwerkingen met betrekking tot ECT zijn bekend (Van den Broek e.a., 2005).
Conclusies / Summary of Findings
|
XΟΟΟ |
Er zijn voorzichtige aanwijzingen dat etomidaat een langer insult geeft dan propofol, thiopental en methohexital. (Avramov e.a., 1995; Singh et al., 2015; Stripp et al., 2018; Conca e.a., 2003; Gazdag e.a., 2004) |
|
XΟΟΟ† |
Er zijn voorzichtige aanwijzingen dat bij een moeilijk opwekbaar insult en wanneer met een maximale stimulus onder een ander hypnoticum geen adequaat motorisch insult bereikt wordt, moet overwogen worden om etomidaat te gebruiken. (Ding & White, 2002) |
|
XΟΟΟ† |
Er zijn voorzichtige aanwijzingen dat methohexital een langer insult geeft dan propofol, maar een korter insult dan etomidaat. (Avramov e.a., 1995) |
|
XΟΟΟ† |
Er zijn voorzichtige aanwijzingen dat een te lange insultduur, ernstige postictale misselijkheid en braken na ECT en een excessieve hemodynamische reactie na ECT mogelijke indicaties zijn voor het gebruik van propofol. (Bailine e.a., 2003; Kadoi e.a., 2003; Villalonga e.a., 1993) |
|
XXΟΟ† |
Er zijn aanwijzingen dat thiopental geen plaats meer heeft als hypnoticum voor ECT. (Ding & White, 2002; Grundmann & Oest, 2007) |
|
XXΟΟ† |
Er zijn geen duidelijke aanwijzingen over het effect van sevofluraan op de insultduur. Er zijn wel aanwijzingen dat sevofluraan een toename geeft van de bloeddruk en hartfrequentie tot tien minuten na de behandeling, waarvoor een strenge selectie van patiënten noodzakelijk is. (Toprak e.a., 2005; Wajima e.a., 2003; Loughnan e.a., 2004) |
|
XXXΟ |
Het is aannemelijk dat er geen klinisch relevant verschil is in de kans op response en remissie na een ECT-kuur tussen wel en geen gebruik van ketamine bij patiënten met een depressieve episode. (Ren et al., 2018) |
|
XXΟΟ* |
Er zijn aanwijzingen dat het gebruik van ketamine bij ECT bijwerkingen geeft (cardiovasculaire incidenten, verhoogde bloeddruk of hypertensie, en verhoogde hartslag of tachycardie) bij patiënten met een depressie. (Ren et al., 2018) |
|
XΟΟΟ† |
Er zijn voorzichtige aanwijzingen dat het gebruik van ketamine (racemisch mengsel) als hypnoticum voor ECT wordt afgeraden. (Ding & White, 2002; Saito, 2005; Grundmann & Oest, 2007) |
|
XΟΟΟ† |
Er zijn voorzichtige aanwijzingen dat het toevoegen van kortwerkende opiaten aan methohexital of propofol een langer motorisch- en EEG-insult geeft in geval van dosisreductie van het anestheticum. (Nguyen e.a., 1997; Akcaboy e.a., 2005; Andersen e.a., 2001) |
* Grade startpunt was ‘hoog’. Afgewaardeerd voor risk of bias en klein aantal events (onnauwkeurigheid).
Samenvatting literatuur
De literatuur voor het beantwoorden van deze uitgangsvraag is grotendeels overgenomen uit de vorige richtlijn ECT (2010) en aangevuld met recente literatuur. De literatuur werd destijds onderzocht naar publicaties over de hypnotica die gebruikt worden bij een ECT-kuur (etomidaat, propofol, methohexital, thiopental, sevofluraan en ketamine) en werd beperkt tot clinical trials en reviews van de laatste vijf jaar. De literatuur wordt per hypnoticum besproken.
Etomidaat
Etomidaat geeft een langere insultduur dan methohexital, thiopental en propofol (Avramov e.a., 1995; Conca e.a., 2003; Gazdag e.a., 2004). In een recente meta-analyse (k=17) (Singh e.a., 2015) werden de effecten van etomidaat op insultduur (zowel motorisch als in EEG) vergeleken met propofol, thiopental, en methohexital. Hieruit kwam naar voren dat vergeleken met propofol en thiopental, etomidaat een langere EEG-insultduur bewerkstelligde (langer dan propofol: 17.65 sec. (95% CI, 9.72 – 25.57, P <.001); langer dan thiopental: 11.81 sec. (95% CI, 4.26 –19.35, P = .003)). Er werd geen significant verschil gevonden tussen etomidaat en methohexital (met etomidaat 2.23 sec. langer (95% CI, -3.62 – 8.01, P = .456). Een vergelijkbaar langere insultduur met etomidaat kwam naar voren qua motorische insult (langer dan propofol: 11.13 sec. (95% CI, 6.64 – 15.62, P <.001); langer dan thiopental: 3.60 sec. (95% CI, 2.15 –5.06, P < .001); en langer dan methohexital: 1.45 sec. (95% CI, -4.79 – 7.69, P = .649)). Een ander voordeel van etomidaat is dat ook een hogere dosering geen invloed heeft op de duur van het insult (Avramov e.a., 1995). Inleiding van anesthesie met etomidaat en alfentanil gaf geen verschil in insultduur ten opzichte van etomidaat alleen (Van den Broek e.a., 2003). In dit onderzoek was de dosering van etomidaat niet aangepast. Het is echter niet te verwachten dat een lagere dosering etomidaat een langer insult zou geven (Avramov e.a., 1995). Een combinatie van etomidaat met remifentanil laat ook geen verandering van insultduur zien (Conca e.a., 2003). In een recente narratieve review werd gesuggereerd dat het gebruik van etomidaat mogelijk de beste manier was voor het toepassen van algemene anesthesie bij ECT (Stripp e.a., 2018).
Bij patiënten met een moeilijk opwekbaar insult wordt geadviseerd om etomidaat als hypnoticum te gebruiken (Trzepacz e.a., 1993; Avramov e.a., 1995). Etomidaat kan ook gebruikt worden wanneer onder maximale elektrische stimulus geen adequaat motorisch insult bereikt wordt (Ding & White, 2002). De bloeddrukstijging tijdens een ECT-sessie is onder etomidaat wat meer uitgesproken ten opzichte van propofol. De stijging van hartfrequentie verschilt niet (Gazdag e.a., 2004; Avramov e.a., 1995).
Een veelvoorkomende bijwerking van etomidaat is bijnierschorsinsufficiëntie door reversibele inhibitie van 11‐beta‐hydroxylase die na eenmalige toediening tot 24 uur kan aanhouden (Schenarts e.a., 2001). Dit werd vooral onderzocht bij patiënten die werden geïntubeerd voor een IC opname. In deze patiëntencategorie lijkt deze bijnierschorsinsufficiëntie niet tot een slechtere uitkomst voor de patiënten te leiden bij eenmalig gebruik (Bruder e.a., 2015). Patiënten die ECT-sessies ondergaan kunnen echter herhaaldelijk worden blootgesteld aan etomidaat. In een gerandomiseerde studie kregen patiënten propofol of etomidaat toegediend voor een serie van 6 ECT-sessies en werd de cortisolproductie gemeten (Wang e.a., 2011). Hoewel etomidaat na een minderheid van de behandelingen een significante daling in het cortisolniveau gaf 24 uur na de behandeling, bleven de cortisolwaarden in alle gevallen binnen de normale grenzen. Er zijn geen studies uitgevoerd met ACTH-suppressietesten bij ECT-patiënten. Vooralsnog zijn er derhalve geen aanwijzingen voor het optreden van klinisch relevante bijnierschorsinsufficiëntie na herhaaldelijke toediening van etomidaat voor ECT.
Methohexital
Methohexital is een kortwerkend intraveneus barbituraat. Methohexital geeft een langer insult dan propofol, maar een korter insult dan etomidaat (Avramov e.a., 1995).
In 1995 beschreven Avramov e.a. dat wat betreft herstel van cognitieve functies na ECT er geen duidelijk verschil bestaat tussen methohexital, propofol en etomidaat. Dit werd nog een keer bevestigd in een onderzoek van Geretsegger e.a. (2007) waar methohexital en propofol vergeleken werden. In dit onderzoek werd ook de kwaliteit van het insult vergeleken op basis van de Postical Suppression Index, die voor propofol duidelijk hoger (dus adequater) was, en op basis van Seizure Efficacy Index, die geen verschil tussen beide liet zien. Deze indices om de kwaliteit van het insult te meten, worden echter in Nederland en België klinisch niet standaard gebruikt voor beslissingen aangaande de behandeling met ECT. Een combinatie van methohexital en het opiaat remifentanil laat een langer insult zien in vergelijking met methohexital alleen, wanneer de dosering van methohexital naar beneden is aangepast (Andersen e.a., 2001). Geen aanpassing van de dosering laat een vergelijkbare insultduur zien (Recart e.a., 2003).
Propofol
Propofol geeft een snel en compleet herstel en het geeft een dosisgerelateerde verkorting van de insultduur in vergelijking tot etomidaat en methohexital (Avramov e.a., 1995). Nguyen e.a. (1997) nemen een langer insult waar, door bij de inductie van anesthesie propofol te combineren met het opiaat alfentanil dan bij propofol alleen. Als mogelijke verklaring hiervoor werd gegeven dat de inductiedosis van propofol in combinatie met alfentanil werd verlaagd. Het onderzoek van Akcaboy e.a. (2005) laat zien dat het toevoegen van alfentanil of remifentanil met een lagere dosis van propofol een langer motorisch- en EEG-insult geeft dan bij propofol alleen. Toch bestaan er wel indicaties om propofol als inductiedosis te gebruiken. Een te lange insultduur, ernstige postictale misselijkheid en braken en een excessieve hemodynamische reactie na de ECT-sessie zijn mogelijke indicaties voor het gebruik van propofol (Bailine e.a., 2003; Kadoi e.a., 2003; Villalonga e.a., 1993).
Thiopental
Thiopental geeft een insultduur dat korter is dan wanneer methohexital als hypnoticum wordt gebruikt (Mokriski e.a., 1992). Tevens worden onder thiopental vaker aritmieën gezien in vergelijking tot methohexital (Mokriski e.a., 1992). Verschillende overzichtsartikelen zien dan ook geen plaats meer voor thiopental als hypnoticum bij ECT (Ding & White, 2002; Grundmann & Oest, 2007). In twee recente onderzoeken werd thiopental vergeleken met het inhalatieanestheticum sevofluraan (Rasmussen e.a., 2006, 2007). Gebruik van thiopental leidde tot een langere insultduur, zowel motorisch als op het EEG, in vergelijking met sevofluraan. De absolute waarden voor het motorisch insult waren voor beide binnen de normale range. Echter, de postictale oriëntatie na twintig minuten was voor sevofluraan significant beter.
Sevofluraan
ECT vindt soms plaats op een buitenlocatie en alleen wanneer de luchtbeheersing goed geregeld is met afzuiging van volatiele anesthetica kan sevofluraan gebruikt worden. Een inleiding van anesthesie met sevofluraan neemt meer tijd in beslag dan met intraveneuze anesthetica. De verschillen tussen sevofluraan en thiopental werden bij thiopental al beschreven. In enkele onderzoeken worden sevofluraan en propofol vergeleken. De resultaten wisselen nogal. In het onderzoek van Wajima e.a. (2003) geeft sevofluraan in vergelijking met propofol een significant korter EEG-insult zonder beschrijving van het motorisch insult. In een tweede onderzoek wordt niet veel verschil gevonden tussen de twee anesthetica (Loughnan e.a., 2004). In een derde onderzoek werd voor sevofluraan een significant langer motorisch insult gevonden in vergelijking met propofol, zonder dat het resultaat van het EEG-insult genoemd wordt (Toprak e.a., 2005). Opvallend is dat alle onderzoeken laten zien dat onder sevofluraan de piekhartfrequentie en -bloeddruk, en hartfrequentie en bloeddruk tien minuten na insult significant hoger zijn in vergelijking met propofol.
Ketamine (als enige inductiemiddel)
Ketamine, dat zowel sedatieve als analgetische eigenschappen heeft, kan als hypnoticum bij ECT gebruikt worden. Ketamine bezit psychomimetische effecten en een intrinsieke sympathicomimetische activiteit, waardoor bloeddrukverhoging en polsversnelling kan ontstaan. Daarbij verhoogt het ook de intracraniële druk. Op grond van deze eigenschappen wordt het toch minder raadzaam geacht ketamine bij ECT te gebruiken (Ding & White, 2002; Saito, 2005; Grundmann & Oest, 2007). Toch bestaat er nu een hernieuwde belangstelling voor ketamine, onder andere door de komst van de actieve enantiomeer S-ketamine met aanzienlijk minder psychomimetische effecten. In een review beschrijven MacPherson & Loo (2008) naar aanleiding van een retrospectief onderzoek en een klein prospectief onderzoek dat in termen van cognitieve en antidepressieve uitkomst van de ECT-kuur ketamine gunstiger is dan methohexital en etomidaat. De hemodynamische verschillen, in de zin van piekbloeddruk, waren marginaal; deze was in de ketaminegroep iets hoger (Krystal e.a., 2003). Van ketamine worden nu ook mogelijke antidepressieve effecten en synergistische antidepressieve effecten beschreven, wanneer dit gegeven wordt voor inductie van anesthesie voor ECT (zie ook de module Add-on strategieën). In recente reviews wordt echter geen eenduidig positief effect gevonden van het gebruik van ketamine als inductiemiddel op depressieve symptomen aan het einde van de ECT-kuur (zie tabel 1), terwijl er wel zorgen zijn over mogelijke bijwerkingen (Jankauskas e.a., 2018; Ren e.a., 2018).
Tabel 1. GRADE tabel ECT + ketamine versus ECT + control bij depressieve episode (Ren e.a., 2018).
|
ECT + ketamine versus ECT + control bij depressieve symptomen |
||||||
|
Uitkomsten |
Absolute effecten* (95% CI) |
Relatief effect |
Aantal deelnemers |
Vertrouwen in het bewijs |
Opmerkingen |
|
|
Effect met ECT + control |
Effect met ECT + ketamine |
|||||
|
Response-rate |
566 per 1,000 |
606 per 1,000 |
RR 1.07 |
564 |
⨁⨁⨁◯ |
Het is aannemelijk dat er geen klinisch relevant verschil is in de kans op response na een ECT-kuur tussen wel en geen gebruik van ketamine. |
|
Remissie-rate |
316 per 1,000 |
348 per 1,000 |
RR 1.10 |
564 |
⨁⨁⨁◯ |
Het is aannemelijk dat er geen klinisch relevant verschil is in de kans op remissie na een ECT-kuur tussen wel en geen gebruik van ketamine. |
a. één of meerdere RCTs laten een verhoogde risk of bias zien.
Referenties
- Akcaboy, Z.N., Akcaboy, E.Y., Yigitbasl, B., e.a. (2005). Effects of remifentanil and alfentanil on seizure duration, stimulus amplitudes and recovery parameters during ECT. Acta Anaesthesiologica Scandinavica, 49, 1068-1071.
- Andersen, F.A., Arsland, D., & Holst-Larsen, H. (2001). Effects of combined methohexitone-remifentanil anaesthesia in electroconvulsive therapy. Acta Anaesthesiologica Scandinavica, 45, 830-833.
- Avramov, M.N., Husain, M.M., & White, P. (1995). The comparative effects of methohexital, propofol and etomidate for electroconvulsive therapy. Anesthesia and Analgesia, 81, 596-602.
- Bailine, S.H., Petrides, G., Doft, M., e.a. (2003). Indications for the use of propofol in electroconvulsive therapy. The Journal of ECT, 19, 129-132.
- Bergsholm, P., Bleie, H., Gran, L., e.a. (1993). Cardiovascular response and seizure duration as determined by electroencephalography during unilateral electroconvulsive therapy. Acta Psychiatrica Scandinavica, 88, 25-28.
- Broek, W.W. van den, Groenland, T.H.N., Kusuma, A., e.a. (2003). Alfentanil has no proconvulsive effect during electroconvulsive therapy. Canadian Journal of Anaesthesia, 50, 198-199.
- Broek, W.W. van den, Groenland, T.H.N., Kusuma, A., e.a. (2004). Double-blind placebo controlled study of the effects of etomidate-alfentanil anesthesia in electroconvulsive therapy. The Journal of ECT, 20, 107-111.
- Broek, W.W. van den, Leentjens, A.F.G., van Vliet, I.M., e.a. (Red.). (2005). Handboek Elektroconvulsietherapie. Assen: Koninklijke Van Gorkum.
- Bruder, E.A., Ball, I.M., Ridi, S., e.a. (2015). Single induction dose of etomidate versus other induction agents for endotracheal intubation in critically ill patients. Cochrane Database Syst Rev, 1, CD010225.
- Cammu G, de Kam PJ, De Graeve K, e.a. (2010). Repeat dosing of rocuronium 1.2 mg kg-1 after reversal of neuromuscular block by sugammadex 4.0 mg kg-1 in anaesthetized healthy volunteers: a modelling-based pilot study. British Journal of Anaesthesia 105,487-92.
- Chater, S.N., & Simpson, K.H. (1988). Effect of passive hyperventilation on seizure duration in patients undergoing electroconvulsive therapy. British Journal of Anaesthesia, 60, 70-73.
- Conca, A., Germann, R., & König, P. (2003). Etomidate vs. thiopentone in electroconvulsive therapy. An interdisciplinary challenge for anesthesiology and psychiatry. Pharmacopsychiatry, 36, 94-97.
- Ding, Z., & White, P.F. (2002). Anesthesia for electroconvulsive therapy. Anesthesia and Analgesia, 94, 1351-1364.
- Gazdag, G., Kocsis, N., Tolna, J., e.a. (2004). Etomidate versus propofol for electroconvulsive therapy in patients with schizophrenia. The Journal of ECT, 20, 225-229.
- Geretsegger, C., Nickel, M., Judendorfer, B., e.a. (2007). Propofol and methohexital as anesthetic agents for electroconvulsive therapy: a randomized, double-blind comparison of electroconvulsive therapy seizure quality, therapeutic efficacy, and cognitive performance. The Journal of ECT, 23, 239-243.
- Gómez-Arnau, J., de Arriba-Arnau, A., Correas-Lauffer, J., e.a. (2018). Hyperventilation and electroconvulsive therapy: A literature review, General Hospital Psychiatry, 50, 54-62.
- Grundmann, U., & Oest, M. (2007). Anästhesiologische Aspekte bei Elektrokrampftherapie. Der Anaesthesist, 56, 202-211.
- Iwasaki H, Sasakawa T, Takahoko K, e.a. (2016).A case series of re-establishment of neuromuscular block with rocuronium after sugammadex reversal. Journal of Anesthesia 30,534-7.
- Jankauskas, V., Necyk, C., Cheu, J., e.a. (2018). A review of ketamine’s role in ECT and non-ECT settings. Neuropsychiatric Disease and Treatment, 14, 1437-1450.
- Kadoi, Y., Saito, S., Ide, M., e.a. (2003). The comparative effects of propofol versus thiopentone on left ventricular function during electroconvulsive therapy. Anaesthesia and Intensive Care, 31, 172-175.
- Krystal, A.D., Weiner, R.D., Dean, M.D., e.a. (2003). Comparison of seizure duration, ictal EEG, and cognitive effects of ketamine and methohexital anesthesia with ECT. The Journal of Neuropsychiatry and Clinical Neurosciences, 15, 27-34.
- Loughnan, T., McKenzie, G., & Leong, S. (2004). Sevoflurane versus propofol for induction of anaesthesia for electroconvulsive therapy: a randomized crossover trial. Anaesthesia and Intensive Care, 32, 236-240.
- MacPherson, R.D., & Loo, C.K. (2008). Cognitive impairment following electroconvulsive therapy – does the choice of anesthetic agent make a difference? The Journal of ECT, 24, 52-56.
- Mokriski, B.K., Nagle, S.E., Papuchis, G.C., e.a. (1992). Electroconvulsive therapy-induced cardiac arrhythmias during anesthesia with methohexital, thiamylal, or thiopental sodium. Journal of Clinical Anesthesia, 4, 208-212.
- Nederlandse Vereniging voor Anesthesiologie (mei 2004). Anesthesiologische zorgverlening; Apparatuur; Verenigingsstandpunt bijlage 1; Verkoeverperiode en organisatie verkoeverafdeling. Link: www.anesthesiologie.nl/verenigingsstandpunten
- Nguyen, T.T., Chhibber, A.K., Lustik, S.J., e.a. (1997). Effect of methohexitone and propofol with or without alfentanil on seizure duration and recovery in electroconvulsive therapy. British Journal of Anaesthesia, 79, 801-803.
- Räsänen, J., Martin, D.J., Downs, J.B., e.a. (1988). Oxygen supplementation during electroconvulsive therapy. British Journal of Anaesthesia, 61, 593-597.
- Rasmussen, K.G., Laurila, D.R., Brady, B.M., e.a. (2006). Seizure length with sevoflurane and thiopental for induction of general anesthesia in electroconvulsive therapy: a randomized double-blind trial. The Journal of ECT, 22, 240-242.
- Rasmussen, K.G., Laurila, D.R., Brady, B.M., e.a. (2007). Anesthesia outcomes in a randomized double-blind trial of sevoflurane and thiopental for induction of general anesthesia in electroconvulsive therapy. The Journal of ECT, 23, 236-238.
- Recart, A., Rawal, S., White, P.F., e.a. (2003). The effect of remifentanil on seizure duration and acute hemodynamic responses to electroconvulsive therapy. Anesthesia and Analgesia, 96, 1047-1050.
- Ren, L., Deng, J., Min, S., e.a. (2018). Ketamine in electroconvulsive therapy for depressive disorder: A systematic review and meta-analysis, Journal of Psychiatric Research, 104, 144-156.
- Saito, S. (2005). Anesthesia management for electroconvulsive therapy: hemodynamic and respiratory management. Journal of Anesthesia, 19, 142-149.
- Saito, S., Kadoi, Y., Nihishara, Y., e.a. (2003). End-tidal carbon dioxide monitoring stabilized hemodynamic changes during ECT. The Journal of ECT, 19, 26-30.
- Schenarts, C.L., Burton, J.H. & Riker, R.R. (2001). Adrenocortical dysfunction following etomidate induction in emergency department patients. Acad Emerg Med, 8, 1-7.
- Singh, P.M., Arora, S., Borle, A., e.a. (2015). Evaluation of Etomidate for Seizure Duration in Electroconvulsive Therapy: A Systematic Review and Meta-analysis. The Journal of ECT, 31(4), 213-25.
- Stripp, T., Jorgensen, M., & Olsen, N. (2018). Anaesthesia for electroconvulsive therapy – new tricks for old drugs: A systematic review. Acta Neuropsychiatrica, 30(2), 61-69.
- Toprak, H.I., Gedik, E., Begeç, Z., e.a. (2005). Sevoflurane as an alternative anaesthetic for electroconvulsive therapy. The Journal of ECT, 21, 108-110.
- Trzepacz, P.T., Weniger, F.C., & Greenhouse, J. (1993). Etomidate anesthesia increases seizure duration during ECT. A retrospective study. General Hospital Psychiatry, 15, 115-120.
- Villalonga, A., Bernardo, M., Gomar, C., e.a. (1993). Cardiovascular response and anesthetic recovery in electroconvulsive therapy with propofol or thiopental. Convulsive Therapy, 9, 108-111.
- Wajima, Z., Shiga, T., Yoshikawa, T., e.a. (2003). Propofol alone, sevoflurane alone, and combined propofol-sevoflurane anaesthesia in electrconvulsive therapy. Anaesthesia and Intensive Care, 31, 396-400.
- Wang, N., Wang, X.H., Lu, J., e.a. (2011). The effect of repeated etomidate anesthesia on adrenocortical function during a course of electroconvulsive therapy. J ECT, 27, 281-285.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 30-09-2021
Beoordeeld op geldigheid : 01-08-2021
Uiterlijk in 2026 bepaalt de Nederlandse Vereniging voor Psychiatrie (NVvP) in samenspraak met de betrokken partijen of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen wanneer nieuwe ontwikkelingen aanleiding geven een vervroegd herzieningstraject te starten. In beide gevallen is de huidige richtlijn geldig tot het daadwerkelijk verschijnen van de definitieve herziene versie.
Algemene gegevens
Op initiatief van de Nederlandse Vereniging voor Psychiatrie (NVvP) is door de werkgroep Richtlijn Elektroconvulsietherapie (ECT) een update ontwikkeld van de multidisciplinaire richtlijn uit 2010. De ontwikkeling van de module werd methodologisch en organisatorisch ondersteund door het Trimbos-instituut.
Doel en doelgroep
De module is ontwikkeld als hulpmiddel. De Richtlijn ECT geeft aanbevelingen en handelingsinstructies voor de indicaties van ECT, technische aspecten, anesthesiologische zorg, vervolgbehandeling na ECT en organisatie van zorg.
De module geeft aanbevelingen ter ondersteuning van de praktijkvoering van alle professionals die betrokken zijn bij het bieden van ECT aan de groepen patiënten die deze nodig hebben. Op basis van de resultaten van wetenschappelijk onderzoek en overige overwegingen geeft de module een overzicht van goed (‘optimaal’) handelen als waarborg voor kwalitatief hoogwaardige zorg. De module kan tevens richting geven aan de onderzoeksagenda voor wetenschappelijk onderzoek op het gebied van ECT.
Vanuit de multidisciplinaire ontwikkelprocedure poogt de richtlijn een positief effect te hebben op de multidisciplinaire samenwerking in de dagelijkse praktijk. Daarnaast moet de richtlijn gezien worden als een leidende tekst, waarvan een vertaling kan plaatsvinden naar lokale zorgprogramma’s en protocollen. Het opstellen van lokale zorgprogramma’s en protocollen op basis van deze module wordt door de werkgroep aangemoedigd, omdat het voor de implementatie van de in de richtlijn beschreven optimale zorg bevorderlijk is.
Indien de aanbevelingen uit deze richtlijn in de concrete situatie niet aansluiten bij de wensen of behoeften van de patiënt voor wie ECT wordt overwogen of overwogen zou moeten worden, dan moet het mogelijk zijn beredeneerd af te wijken van de richtlijn, tenzij de wensen of behoeften van de patiënt naar de mening van de psychiater hem/haar kunnen schaden dan wel geen toegevoegde waarde hebben.
Afbakening
Deze module betreft indicaties, technische aspecten, anesthesiologische zorg, vervolgbehandeling en zorgorganisatie rond het aanbieden van ECT aan patiënten met een depressieve-, een suïcidale-, een manische-, een katatone-, of een psychotische episode, een episode met bewustzijnsdaling, of een motorisch ontregelde episode.
Met uitzondering van de module over ECT bij adolescenten, zijn studies over personen vanaf 18 jaar meegenomen. In de module is gezocht systematische reviews en meta-analyses met een publicatiedatum van 2008 tot en met 1 maart 2019. Nog niet gepubliceerde onderzoeken zijn niet meegenomen (wel onderzoeken 'in press'). Zie voor meer informatie over de afbakening van de module in de bijlagen. Per module is een bijlage opgenomen met toelichting over de gebruikte reviewstrategie (reviewprotocollen per uitgangsvraag).
Samenstelling werkgroep
De Multidisciplinaire Richtlijn ECT is ontwikkeld door de werkgroep ECT, in opdracht van de Nederlandse Vereniging voor Psychiatrie.
De werkgroep, onder voorzitterschap van prof. dr. Walter van den Broek, psychiater en opleider psychiatrie bij het Erasmus Medisch Centrum in Rotterdam, bestond uit: psychiaters, verpleegkundigen, verpleegkundig specialisten GGZ, anesthesiologen, een klinisch neuropsycholoog en een ervaringsdeskundige, die door de beroepsverenigingen en patiëntenvereniging werden afgevaardigd.
Voorafgaande aan het ontwikkeltraject werden kennismakingsgesprekken gevoerd met verscheidene kandidaatleden voor de werkgroep. Uit deze groep belangstellenden werden de huidige werkgroep leden geselecteerd. Naast de werkgroep is een groep van adviseurs samengesteld, die werd gevraagd voorafgaand aan de commentaarfase schriftelijk en telefonisch te reageren op onderdelen van de concepttekst. De werkgroep werd methodologisch en organisatorisch ondersteund door het technisch team van het Trimbos-instituut. Dit technisch team bestond uit een projectleider, literatuur reviewers, een gezondheidseconoom, een notulist en een projectassistente. Onderstaande schema's geven een overzicht van de samenstelling van de werkgroep, de adviesgroep en het ondersteunend technisch team.
Leden werkgroep
|
|
Naam |
Organisatie |
Beroepsvereniging |
|
1. |
Walter van den Broek |
Erasmus MC |
Psychiater, NVvP |
|
2. |
Jeroen van Waarde |
Rijnstate |
Psychiater, NVvP |
|
3. |
Martijn van Noorden |
LUMC |
Psychiater, NVvP |
|
4. |
Harm Pieter Spaans |
Parnassia |
Psychiater, NVvP |
|
5. |
Pascal Sienaert |
Upcku Leuven |
Psychiater, VVP België |
|
5. |
Mark Koning |
Rijnstate |
Anesthesioloog-Intensivist, NVA |
|
6. |
Nick Koning |
Rijnstate |
Anesthesioloog, NVA |
|
7. |
Lianneke Egberink |
GGz InGeest |
Verpleegkundig specialist GGz, V&VN |
|
8. |
Franklin Dik |
GGz Rivierduinen |
Verpleegkundig specialist GGz, V&VN |
|
9. |
Esmée Verwijk |
AMC |
Klinisch neuropsycholoog, NIP |
|
10. |
Hector van den Boorn |
AMC |
Clientvertegenwoordiger, MIND |
Leden Adviesgroep
|
Module |
Naam |
Organisatie |
Beroep |
|
Indicatie voor ECT |
Eric van Exel |
GGzIngeest |
Psychiater, voorzitter WEN |
|
Technische aspecten |
Metten Somers |
UMCU |
Psychiater, voorzitter WEN |
|
Hans Warning |
UMCG |
Verpleegkundig specialist psychiatrie |
|
|
Anesthesiologische zorg |
Theo Groenland |
Park Medisch Centrum |
Anesthesioloog |
|
Zorgorganisatie |
Judith Godschalx |
Spaarne Gasthuis |
Psychiater |
|
Bijwerkingen (verschillende modules) |
Mike van Kessel |
Antes |
Psycholoog |
Methodologische ondersteuning
|
Naam
|
Ondersteuning |
|
Danielle van Duin |
Projectleider, Trimbos-instituut |
|
Matthijs Oud |
Reviewer, Trimbos-instituut |
|
Egbert Hartstra |
Reviewer, Trimbos-instituut |
|
Ben Wijnen |
Gezondheidseconoom, Trimbos-instituut |
|
Diana de Ruijter Korver |
Projectassistent, Trimbos-instituut |
In totaal kwam de werkgroep ECT voorafgaand aan de commentaarfase 7 keer bijeen in een periode van 13 maanden (januari 2019 – februari 2020). In deze periode werden de stappen van de methodiek voor evidence-based richtlijnontwikkeling (EBRO) doorlopen. Op systematische wijze werd literatuuronderzoek gedaan, waarna de reviewers een selectie maakten in de gevonden onderzoeken (zie voor informatie over de selectiecriteria: de per module bijgevoegde reviewprotocollen). De reviewers beoordeelden de kwaliteit en inhoud van de aldus verkregen literatuur en verwerkten deze in evidence tabellen, Risk of bias tabellen, forest plots, GRADE profielen en beschrijvingen van de wetenschappelijke onderbouwing en wetenschappelijke (gewogen) conclusies. Leden van de werkgroep gingen op basis van de gevonden literatuur met elkaar in discussie over praktijkoverwegingen en aanbevelingen. De werkgroepleden schreven samen met het technisch team van het Trimbos-instituut de concepttekst, die ter becommentariëring openbaar is gemaakt. De ontvangen commentaren zijn verzameld in een commentaartabel, die tijdens een werkgroepbijeenkomst is besproken. Na het verwerken van de op deze bijeenkomst voorgestelde wijzigingen is de definitieve richtlijn ter autorisatie aangeboden aan de betrokken beroepsverenigingen en patiëntorganisatie.
Inbreng patiëntenperspectief
Zie het verslag van de patiënt focusgroep bijeenkomst in de bijlagen.
Methode ontwikkeling
Evidence based
Implementatie
Recent onderzoek laat zien dat er bij trajecten rond kwaliteitsstandaarden voornamelijk aandacht is voor de ontwikkeling van de kwaliteitstandaard. Planmatige opgezette en onderbouwde invoering komt maar heel beperkt van de grond. Hierop dient gericht te worden aangestuurd door financiers, zodat hier al bij de start geld voor beschikbaar is. De Regieraad voor richtlijntrajecten onderschrijft dan ook een programmatische aanpak van de ontwikkeling, invoering én evaluatie van kwaliteitsstandaarden inclusief (financiële en organisatorische) middelen, om het gebruik van de standaarden te stimuleren, monitoren en evalueren[1]. TNO, CBO en het Trimbos-instituut besloten deze opdracht samen uit te voeren, met als doel de complementaire inzichten en expertise te vertalen in een gemeenschappelijke visie op richtlijnen en andere kwaliteitsstandaarden. Dit resulteerde in een praktisch instrument voor een analyse van richtlijntrajecten: Kwaliteit Richtlijnontwikkeling, Invoering en Evaluatie (KRIE).
Werkwijze
De multidisciplinaire richtlijn ECT is ontwikkeld volgens de methodiek van de evidence based richtlijnontwikkeling (EBRO).
Uitgangsvragen
De module is ontwikkeld op geleide van uitgangsvragen, die gebaseerd zijn op knelpunten die worden ervaren rondom indicaties, technische aspecten, anesthesiologische zorg, vervolgbehandeling, en organisatie van zorg bij ECT.
De module is geen leerboek waarin zoveel mogelijk beschikbare kennis over een onderwerp wordt opgenomen, maar een document met praktische aanbevelingen rondom knelpunten uit de praktijk. Dat betekent dat praktijkproblemen zoveel als mogelijk uitgangspunt zijn van de teksten in de module. Dat betekent ook dat méér aandacht gegeven wordt aan de wijze waarop die praktijkproblemen worden opgelost, dan aan degene door wie die problemen worden aangepakt of opgelost. De module is een document waarin staat hoe indicatiestelling, technische uitvoering, anesthesiologische begeleiding, vervolgbehandeling bij ECT er inhoudelijk uitziet. Daarnaast worden in een apart module aanbevelingen gedaan voor de organisatie van zorg bij ECT en over de kosteneffectiviteit en budget impact van het aanbieden van ECT. In deze module worden de hieronder beschreven ‘klinische uitgangsvragen’ behandeld in de verschillende modules.
Uitgangsvragen in de richtlijn ECT zijn:
|
Module |
Uitgangsvragen |
|
Indicaties voor ECT |
Stemmingsstoornissen
Primair psychotische stoornissen
Overige therapieresistente aandoeningen
|
|
Technische Aspecten van ECT |
|
|
Anesthe-siologische zorg |
|
|
Vervolg behandeling na ECT |
|
|
Organisatie van zorg |
|
|
Perspectief patiënten en naasten |
|
|
Economische analyse ECT |
volwassenen (18+) met een therapieresistente psychotische episode? |
Zoekstrategie
Om de klinische uitgangsvragen te beantwoorden is, in overleg met de werkgroepleden, op systematische wijze literatuuronderzoek verricht en is een selectie gemaakt binnen de gevonden onderzoeken volgens vooraf vastgestelde selectiecriteria. Er is gezocht naar bestaande (buitenlandse) evidence-based richtlijnen voor ECT, systematische reviews en meta-analyses. In de literatuur searches is gezocht naar literatuur in de Engelse, Nederlandse, Franse, en Duitse taalgebieden. Voor het zoeken naar publicaties is gebruik gemaakt van de volgende informatiebronnen:
- Psychological Information Database (PsycINFO)
- PubMed
- Cumulative Index to Nursing and Allied Health Literature (CINAHL)
- Excerpta Medica database (Embase)
Selectiestrategie
Bij de selectie van artikelen zijn de volgende criteria gehanteerd:
- Geeft het onderwerp van het gevonden onderzoek voldoende antwoord op de uitgangsvraag: worden de binnen GRADE vastgestelde kritische en belangrijke uitkomstmaten in het onderzoek geëvalueerd? (zie voor meer informatie over GRADE verderop in deze module);
- Sluit de doelgroep van het gevonden onderzoek voldoende aan bij de doelgroep van de module?;
- Is er sprake van een meta-analyse of systematic-review van randomised controlled trials (RCT), cohort onderzoeken, cross-sectioneel onderzoek, patiëntcontrole onderzoek of wetenschappelijke verantwoord kwalitatief onderzoek? Bij een longitudinaal onderzoek: Is er sprake van een voldoende lange follow-up periode?;
Zie voor meer informatie over de zoekstrategie de bijlagen per module en voor meer informatie over de selectiecriteria per uitgangsvraag de reviewprotocollen in de bijlagen per module.
Beoordeling van de kwaliteit van het bewijs
Studies werden indien mogelijk door twee personen beoordeeld op het risico op bias met behulp van de Cochrane Collaboration Risico van Bias Assessment Tool (Higgins 2008). Elke studie werd gewaardeerd op de wijze van randomisatie en toewijzing; blindering van de deelnemers, beoordelaars, en therapeuten; gehanteerde methode om met uitval van deelnemers om te gaan; en of alle uitkomsten zijn gerapporteerd. Risico op bias kon als hoog (serieuze kans op beïnvloeding van het resultaat), laag (waarschijnlijk geen invloed op het resultaat), of onduidelijk worden beoordeeld. Indien een geselecteerde studie al een risico op bias analyses had uitgevoerd is deze overgenomen.
Voor het bewijs rondom interventies is daarna het bewijs van de onderzoeken per uitkomstmaat gegradeerd met behulp van GRADE[1]. De kwaliteit van het bewijs kent daarbij vier niveaus, te weten; zeer laag, laag, matig en hoog. In deze module is gekozen om de GRADE niveaus weer te geven met behulp van de volgende neutrale en internationaal toepasbare weergave:
|
Hoog |
XXXX |
|
Matig |
XXXO |
|
Laag |
XXOO |
|
Zeer laag |
XOOO |
Het studiedesign bepaalt de uitgangspositie van de kwaliteit van bewijs. Gerandomiseerde, gecontroleerde studies (RCT's) hebben over het algemeen meer bewijskracht dan observationele studies. Daarom is hun uitgangspositie hoog, terwijl de uitgangspositie van observationele studies laag is. De kwaliteit van het bewijs per uitkomstmaat wordt, behalve door de methodologische kwaliteit van de individuele onderzoeken, ook bepaald door andere factoren, zoals de mate van consistentie van de gevonden resultaten uit de verschillende onderzoeken en de precisie van de gevonden uitkomst (zie tabel 1).
Tabel 1 GRADE Factoren voor downgraden en upgraden
Het niveau van de kwaliteit van het bewijs (zeer laag, laag, matig en hoog) verwijst naar de mate van vertrouwen dat men heeft in de schatting van het effect van een behandeling.
|
We downgraden het niveau van de kwaliteit van bewijs van studies met een hoge uitgangspositie (RCT’s), bij:
|
We upgraden het niveau van de kwaliteit van bewijs van observationele studies bij:
|
|
|
|
|
|
|
|
|
|
|
Samenvatten van resultaten
Van elk artikel is een samenvatting gemaakt, waarin de belangrijkste kenmerken van het onderzoek zijn opgenomen (bij een RCT zijn dat bijvoorbeeld het doel van het onderzoek, het onderzoeksdesign, patiëntkenmerken, interventies, uitkomstmaten en de resultaten). Bij de uitgangsvragen over interventies is waar mogelijk voor elke kritische uitkomstmaat een meta-analyse uitgevoerd, om de omvang van het klinisch effect van de interventie samen te vatten. De data uit oorspronkelijke onderzoeken worden hiervoor verwerkt in een forest plot, welke een grafische weergave van de meta-analyse geeft (zie tabel 2 voor een voorbeeld van een forest plot). In het geval dat een geselecteerde studie een meta-analyses betrof, is gebruik gemaakt van de al uitgevoerde meta-analyses uit de desbetreffende publicatie.
Tabel 2 Voorbeeld van een forest plot met toelichting
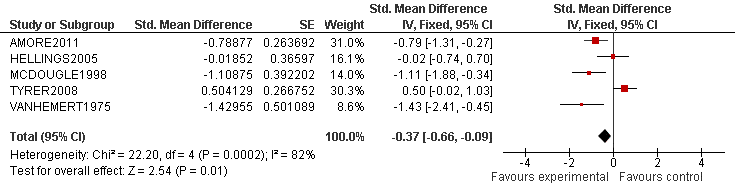
De verticale lijn is de lijn van geen effect.
- Elke blokje geeft de puntschatting van het interventie effect van een onderzoek aan
- De grootte van het blokje correspondeert met het gewicht van het onderzoek binnen de meta-analyse
- De horizontale lijn is een weergave van het betrouwbaarheidsinterval (95% BI)
- De diamant is een weergave van het overall effect (gemiddeld gewogen effect)
- De significantie van het overall effect wordt onderaan de plot gegeven (z-score en p-waarde)
- De I2 geeft de mate van heterogeniteit van de studies aan (consistentie van de resultaten)
Wanneer er onvoldoende data beschikbaar waren om een meta-analyse uit te voeren, stelden de reviewers in enkele gevallen een narratieve (beschrijvende) review van het beschikbare bewijs op (zonder ‘gepoolde’ resultaten en berekening van mate van heterogeniteit, maar met een beschrijving van de kwaliteit). De kwaliteitsbeoordeling en een samenvattende beschrijving van de verschillende onderzoeken die zijn geselecteerd vanuit de systematische literatuur search worden voor elke uitgangsvraag beschreven onder het kopje ‘wetenschappelijke onderbouwing’.
Conclusies
De formulering van de conclusies, gebaseerd op de studies uit de systematische literatuur search, is afgestemd op het GRADE niveau (zie tabel 3). Deze formulering sluit ook aan bij de ‘levels of evidence’ welke indeling (niveau 1 t/m 4) voorheen werd gebruikt in onder andere de multidisciplinaire richtlijn Schizofrenie.
Tabel 3 Formulering conclusies n.a.v. GRADE niveau
|
GRADE |
Levels of evidence |
Formulering conclusies |
|
XXXX |
Niveau 1 |
“Het is aangetoond dat…” |
| XXXO |
Niveau 2 |
“Het is aannemelijk dat…” |
|
XXOO |
Niveau 3 |
“Er zijn aanwijzingen dat…” |
|
XOOO |
Niveau 4 |
“Er zijn voorzichtige aanwijzingen dat…” |
Conversie van levels of evidence naar GRADE
In de huidige richtlijn is er gekeken of de uitgangsvragen in de modules Indicaties, Technische en verpleegkundige aspecten en Anesthesiologische zorg beantwoord kunnen worden aan de hand van recent uitgevoerde systematische reviews en meta-analyses (en de losse randomized controlled trials daarbinnen). In het geval dat er geen recente systematische reviews en/of meta-analyses zijn gevonden zijn in de huidige richtlijn de conclusies uit de vorige richtlijn Elektroconvulsietherapie (2de herziene versie; NVvP, 2010) omgezet van ‘levels of evidence’ naar ‘GRADE’. Kort samengevat worden conclusies getrokken op basis van bewijs waarvan de sterkte wordt aangegeven doormiddel van niveau 1 (sterk) t/m niveau 4 (zwak) (zie tabel 4). Deze niveaus worden bepaald aan de hand van de methodologische kwaliteit van de individuele onderzoeken waar de conclusies op gebaseerd zijn (zie tabel 2). In de GRADE methode wordt kwaliteit van het bewijs gerangschikt in vier niveaus, te weten; zeer laag, laag, matig en hoog (zie tabel 5). Bij het omzetten van ‘levels of evidence’ naar ‘GRADE’ kwam deze rangschikking als volgt tot stand.
Conclusies met de niveaus 3 of 4 werden omgezet naar ‘zeer laag’. Wanneer een niveau 3 conclusie gebaseerd was op observationele studies (methodologische kwaliteitsniveau B), werd er gekeken of er stapsgewijs geüpgraded kon worden. Dit werd gedaan in het geval dat de observationele studie een groot effect liet zien, wanneer mogelijke confounders het ware effect verminderd hadden, en wanneer er bewijs is van een verband tussen de dosering en de respons.
Bij niveau 2 conclusies is er gekeken naar de methodologische kwaliteit van de individuele onderzoeken. In het geval dat dit een non-RCT/observationele studie betrof was het GRADE startpunt ‘zeer laag’ en werd er gekeken of er stapsgewijs geüpgraded kon worden. Wanneer het een RCT betrof was het GRADE startpunt ‘hoog’. Vervolgens werd op basis van de full tekst gedowngraded voor risk of bias (tekortkoming[en] in de studie), inconsistentie van de resultaten, indirect bewijs, onnauwkeurigheid van de resultaten en publicatie bias.
Bij niveau 1 conclusies werd er gekeken naar de methodologische kwaliteit van de individuele onderzoeken. Wanneer dit een RCT was (methodologische kwaliteitsniveau A2) was het GRADE startpunt ‘hoog’ en werd de full tekst gebruikt om GRADE uit te voeren. In het geval van een narratieve review werd er in de referentielijst van de review gezocht naar relevante RCTs, wanneer deze er niet waren was het GRADE startpunt ‘zeer laag’ en werd er gekeken of er geüpgraded kon worden op basis van individuele observationele studies. Wanneer er wel een relevante RCT was gebruikt was het GRADE startpunt ‘hoog’ en werd op basis van de full tekst GRADE uitgevoerd. Als de niveau 1 conclusie gebaseerd was op een systematische review/meta-analyse (methodologische kwaliteitsniveau A1) werd alle informatie van de relevante RCTs uit de full tekst gehaald en waar nodig aangevuld met informatie uit de originele artikelen. De GRADE score was in deze gevallen ‘hoog’ en de standaard GRADE methode werd uitgevoerd om het uiteindelijke kwaliteitsniveau van het bewijs te bepalen.
De conclusies afkomstig uit de vorige richtlijn Elektroconvulsietherapie waarvan de levels of evidence zijn omgezet naar GRADE worden in de modules aangeduid met een †.
Tabel 4 Levels of evidence zoals gebruikt in de vorige Richtlijn Elektroconvulsietherapie (2de herziene versie, NVvP, 2010)*
|
Level of evidence |
Conclusie gebaseerd op** |
|
Niveau 1 |
onderzoek van niveau A1 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2 |
|
Niveau 2 |
één onderzoek van niveau A2 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
Niveau 3 |
één onderzoek van niveau B of C |
|
Niveau 4 |
mening van deskundigen |
*Tabel is een aangepaste versie zoals weergegeven in Richtlijn Elektroconvulsietherapie (2de herziene versie, NVvP 2010) ** Zie tabel 5 voor overzicht van bepaling methodologische kwaliteit van individuele onderzoeken.
Tabel 5 Bepaling van de methodologische kwaliteit van individuele onderzoeken zoals gebruikt in de Richtlijn Elektroconvulsietherapie (2de herziene versie, NVvP, 2010)*
|
Interventie |
Diagnostische accuratesse-onderzoek |
Schade of bijwerkingen, etiologie, prognose |
|
A1: Systematische review van ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
|
|
|
A2: Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
Prospectief cohort-onderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten |
|
B: Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiëntcontrole-onderzoek, cohortonderzoek) |
Onderzoek ten opzichte van een referentietest, maar niet met alle kenmerken die onder A2 zijn genoemd |
Prospectief cohort-onderzoek, maar niet met alle kenmerken als genoemd onder A2, of retrospectief cohort-onderzoek of patiënt-controleonderzoek |
|
C: Niet-vergelijkend onderzoek |
|
|
|
D: Mening van deskundigen |
|
|
*Tabel is een aangepaste versie zoals weergegeven in Richtlijn Elektroconvulsietherapie (2de herziene versie, NVvP, 2010)
Praktijkoverwegingen
Naast de wetenschappelijke onderbouwing, waarin vanuit de systematische literatuursearch de conclusies zijn getrokken op basis van het best beschikbare bewijs, is voor elke uitgangsvraag expert kennis verzameld. Hiervoor hebben de leden van de werkgroep gebruik gemaakt van een GRADE checklist ‘Van bewijs naar aanbeveling’, waarmee systematisch wordt nagegaan of er relevante praktijkoverwegingen zijn voor een aantal vooraf bepaalde factoren, waaronder: balans tussen gewenste en ongewenste effecten, patientenperspectief, middelenbeslag en maatschappelijk perspectief. Deze overwegingen werden onderbouwd vanuit ‘grijze literatuur’ (studies, rapporten en andere teksten die niet vanuit de systematische literatuursearch en -selectie zijn verwerkt in de wetenschappelijke conclusies). De aanbevelingen werden gebaseerd op de combinatie van de wetenschappelijke conclusies en de praktijkoverwegingen.
Aanbevelingen
Aanbevelingen kunnen gegradeerd worden als ‘sterk’ (onvoorwaardelijk) of ‘zwak’ (voorwaardelijk). Wanneer de kwaliteit van het bewijs voor de positieve en negatieve effecten van een interventie hoog is, kan dit leiden tot een sterke aanbeveling, en omgekeerd, wanneer de bewijskracht laag tot zeer laag is, kan dit een zwakke aanbeveling opleveren. Een zwakke aanbeveling geeft meer ruimte om af te wijken en aandacht te schenken aan alternatieven die passen bij de behoeften van de patiënt, terwijl bij een sterke aanbeveling die ruimte beperkt is. Echter, de kracht van het wetenschappelijke bewijs is niet de enige factor die de sterkte van de aanbevelingen bepaalt. De aanbevelingen zijn gebaseerd op wetenschappelijk bewijs enerzijds, en overige overwegingen, zoals praktijkervaringen van de werkgroepleden, ervaringen en voorkeuren van patiënten, kosten, beschikbaarheid en organisatorische aspecten, anderzijds.
Voor de formulering van ‘sterke’ (onvoorwaardelijke) en ‘zwakke’ (voorwaardelijke) aanbevelingen is de volgende indeling aangehouden (zie tabel 6):
Tabel 6 GRADE Voorkeursformulering sterke / zwakke aanbevelingen
|
Gradering aanbeveling |
Betekenis |
Voorkeursformulering |
|
STERK VOOR |
De voordelen zijn groter dan de nadelen voor bijna alle patiënten. Alle of nagenoeg alle geïnformeerde patiënten zullen waarschijnlijk deze optie kiezen. |
We bevelen [interventie] aan. |
|
ZWAK VOOR |
De voordelen zijn groter dan de nadelen voor een meerderheid van de patiënten, maar niet voor iedereen. De meerderheid van geïnformeerde patiënten zal waarschijnlijk deze optie kiezen. |
Overweeg [interventie], bespreek de voor- en nadelen). |
|
ZWAK TEGEN |
De nadelen zijn groter dan de voordelen voor een meerderheid van de patiënten, maar niet voor iedereen. De meerderheid van geïnformeerde patiënten zal waarschijnlijk deze optie kiezen. |
Wees terughoudend met [interventie], bespreek de voor- en nadelen). |
|
STERK TEGEN |
De nadelen zijn groter dan de voordelen voor bijna alle patiënten. Alle of nagenoeg alle geïnformeerde patiënten zullen waarschijnlijk deze optie kiezen. |
We bevelen [interventie] niet aan. |
Methode: economische analyse
Het doel van de economische evaluatie was om bij te dragen aan de ontwikkeling van de richtlijn door het leveren van bewijs over de kosteneffectiviteit van ECT. Dit werd bereikt door het uitvoeren van een systematische literatuur search naar bestaand economisch bewijs. Systematische literatuur searches naar economisch bewijs zijn uitgevoerd voor ECT bij therapieresistente depressie.
Zoekstrategie
Er werd een systematische literatuur zoekstrategie uitgevoerd om al het relevante bewijs te identificeren. Zoekstrategieën werden beperkt tot economische onderzoeken en Health Technology Assessment Reports, en uitgevoerd in de volgende databases:
- Health Technology Assessment (HTA) database
- NHS Economic Evaluation Database (NHS EED)
- EMBASE
- PsychINFO
- CINAHL
- PubMed
- Cochrane Database of Systematic Reviews (CDSR)
Daarnaast werd Google en Google Scholar doorzocht op onderzoeken welke mogelijk ontbraken in de elektronische databases. Verder werd literatuur in eerdere richtlijnen gecheckt. Enig relevant bewijs vanuit de klinische literatuursearch werd in deze periode aan de Health Economist beschikbaar gesteld. De HTA en NHS EED databases zijn relatief beperkt in omvang, waardoor werd gekozen voor een brede zoekstrategie gebaseerd op een klinische Cochrane review van Peng et al. (2014) gecombineerd met een zoekstrategie van Wilczynski et al. (2004) die speciaal ontwikkeld is voor het identificeren van economische studie.
Selectiestrategie
De volgende selectiecriteria zijn toegepast om vanuit de resultaten van economische searches onderzoeken te selecteren voor nadere evaluatie:
- Richten op patiënten met depressie.
- Volledige economische evaluatie (d.w.z. dat tenminste twee behandelingen met elkaar vergeleken werden in termen van kosten en effecten) gebaseerd op een klinische studie of een modelleringsstudie.
- ECT als een van de armen in de studie.
- Selectiecriteria rond soorten klinische condities, gebruikers van zorg en interventies die worden beoordeeld waren identiek aan die in de klinische literatuur reviews.
- Een voorwaarde voor inclusie van onderzoeken was dat deze voldoende details beschreven over methoden en resultaten en dat de gegevens en de resultaten van het onderzoeken extraheerbaar waren. Dit om het mogelijk te maken om de methodologische kwaliteit van het onderzoeken te beoordelen. Poster presentaties en abstracts werden geëxcludeerd.
Beschrijving van de resultaten en conclusies
Het economisch bewijs dat is geselecteerd in deze module is apart weergegeven.
Literatuur
Gevers, J.K.M., & Aalst, A. van (1998). De rechter en het medisch handelen (3e druk). Deventer: Kluwer.
Higgins, J.P.T., Green, S., & Cochrane Collaboration (2008). Cochrane handbook for systematic Reviews of interventions. Chichester, England/Hoboken, NJ: Wiley-Blackwell.
[1] GRADE: Grading of Recommendations Assessment, Development and Evaluation
[2] Het blinderen van deelnemers en therapeuten is in deze richtlijn niet meegenomen in de beoordeling van studies rond psychosociale interventies, omdat blinderen van de deelnemers en therapeuten niet goed mogelijk is bij deze interventies.
