Fysieke training bij DMD
Uitgangsvraag
Wat is de waarde van fysieke training bij Duchenne spierdystrofie?
Aanbeveling
Alle zorgverleners
Stimuleer de patiënt om een actieve leefstijl aan te houden, en het doen van fysieke (dagelijkse) activiteiten (bijvoorbeeld verplaatsen en zelfverzorging) zoveel mogelijk in het dagelijkse leven te incorporeren.
Overweeg, in overleg met de patiënt en ouders, aanvullende fysieke training aan te bieden indien er sprake is van:
- Bewegingsarmoede (minder dan 2 tot 3 keer per week matig intensief bewegen (zoals bijvoorbeeld hydrotherapie of gym) op het moment dat dit fysiek nog wel mogelijk zou zijn;[1] en/of
- Verminderde fitheid; en/of
- Dreigend verlies van functionele vaardigheden (bijvoorbeeld opstappen van stoepjes, opstaan vanuit zit, heffen van de armen, omrollen et cetera); en/of
- Aanwezigheid van een hulpvraag op het gebied van uithoudingsvermogen of duurkracht (bijvoorbeeld verminderd vermogen tot volhouden van activiteiten zoals het overbruggen van afstanden of het staande transfers kunnen blijven maken bij overgangsperiodes van ambulante naar non-ambulante fase, of bijvoorbeeld bij dreigend verlies van specifieke door de patiënt aangegeven belangrijke vaardigheden).
(Kinder)fysiotherapeuten of ergotherapeuten
Overweeg de volgende componenten in het trainingsschema op te nemen:
- Training van het uithoudingsvermogen met een lage/matige intensiteit (aerobe training met een lage/matige intensiteit (Omni schaal score 5 tot 7) voor tenminste 20 tot 25 minuten). En
- Training van krachtuithoudingsvermogen (de intensiteit laag (50 tot 60% van het 1 herhalingsmaximum volgens het Holten diagram, waarbij de 50-60% bij benadering bepaald wordt en niet middels een daadwerkelijk 1RM bepaling om overbelasting te voorkomen) en per te trainen onderdeel tenminste 2 series met 25 herhalingen).
Kies ervoor om de training zo functioneel mogelijk te maken en afgestemd op de wensen van de patiënt en de haalbaarheid. Heb hiernaast aandacht voor de emotionele impact en mogelijke demotivatie die lichamelijke achteruitgang tijdens een trainingsperiode kan hebben op zowel patiënt als ouders.
Betrek bij (jongere) patiënten ouders actief bij het oefenen. Bied hen een mogelijkheid om een actieve bijdrage te leveren waardoor zij medeverantwoordelijk zijn in het behandelproces.
Zie ook de bijlage voor handvatten met betrekking tot de inhoud van de training per ziektefase.
Vermijd:
- het trainen op hartslag; meestal is de rusthartslag verhoogd en kan de maximale hartslag niet worden behaald in verband met perifere beperkingen (de hartslag kan wel indicatief gebruikt worden om te zien of er sprake is van verhoging van de inspanning); en
- excentrische bewegingen (waarbij spieren verlengen terwijl ze kracht leveren); en
- trainen met een hoge mechanische weerstand welke leidt tot overbelasting.
Overleg bij symptomen van klinische cardiomyopathie met de zorgcoördinator.
Pas bij tekenen van overbelasting het trainingsschema aan. Symptomen van overbelasting zijn:
- langer aanhoudende spierpijn (> 24 uur);
- bruine urine (hemoglobinuremie); en
- verminderd vermogen tot uitvoeren van dagelijkse activiteiten gerelateerd aan de training.
Overleg waar nodig met een (kinder)fysiotherapeut en/of ergotherapeut met specifieke expertise op het gebied van Duchenne Spierdystrofie.
[1] Neem hierbij de verschillende ziekte fases in ogenschouw!
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Het doel van training voor jongens en mannen met Duchenne spierdystrofie (DMD) is het verkrijgen en behouden van een actieve leefstijl waardoor secundaire lichamelijke achteruitgang als gevolg van disuse wordt tegengegaan en patiënten zo lang mogelijk, zo zelfstandig mogelijk kunnen functioneren.
Er is echter tot op heden nog weinig onderzoek verricht naar de effectiviteit van fysieke training bij patiënten met DMD. Er is een klein aantal studies uitgevoerd die geen overtuigend bewijs leveren dat een bepaalde trainingsinterventie beter is dan reguliere zorg; door de kleine patiënten aantallen en door de beperkingen in studieopzet is de bewijskracht zeer laag. Op basis van de cruciale uitkomstmaat ‘functionele vaardigheden’ kan derhalve geen eenduidig besluit genomen worden over de exacte inhoud en vorm van training.
De geïncludeerde studies onderzoeken allen een fysieke training interventie en vergelijken deze met reguliere zorg. Helaas werd de reguliere zorg vaak niet goed beschreven, en varieerde de reguliere zorg behoorlijk tussen de studies (meestal fysiotherapie, van passief rekken tot krachttraining). Men kan zich afvragen of de reguliere zorg beschreven door Alemdaroglu (2015) als reguliere zorg gezien kan worden in de Nederlandse situatie. Hoewel onbekend is wat het effect is van ‘reguliere zorg’ ten opzichte van ‘niets doen’ (aangezien er geen studies beschikbaar zijn waarin een vergelijking is gemaakt met ‘niets doen’), valt op dat de patiënten in de geïncludeerde studies relatief weinig achteruitgaan. Dit wijst erop dat ‘iets doen’ in ieder geval beter is dan ‘niets doen’.
Wat verder opvalt aan de geïncludeerde studies is de grote heterogeniteit in de patiëntenpopulatie: in sommige studies waren de deelnemers ambulant en in andere studies waren de deelnemers rolstoelafhankelijk (non-ambulant). Ook de armfunctie was niet gelijk voor de patiënten in de verschillende studies. Dit maakt het lastig om de resultaten van de verschillende studies te vergelijken.
Er komt wel in de gevonden studies naar voren dat er geen nadelige gevolgen lijken te zijn voor de gebruikte interventies. Dit zou een aanwijzing kunnen zijn dat de aangeboden vormen van training wel veilig zijn.
Ondanks de beperkte literatuur, is de werkgroep op basis van expert opinion wel van mening dat het aanbieden van training effect kan hebben op functionele vaardigheden, en de voor DMD specifieke achteruitgang, kan vertragen. Daarnaast is algemeen bekend dat lichamelijke inactiviteit kan zorgen voor een secundaire deconditionering en spierverval (‘rust roest’). De werkgroep is daarom ook van mening dat patiënten aangeraden moet worden om een actieve levensstijl aan te houden, en ook fysieke training aangeboden moeten krijgen onder leiding van bij voorkeur een (kinder)fysiotherapeut indien de levensstijl van de patiënt niet ‘actief’ genoeg is. Dit laatste geldt zeker voor de patiënten waarbij er sprake is van 1) bewegingsarmoede (minder dan 2 tot 3 keer per week matig intensief bewegen op het moment dat dit fysiek nog wel mogelijk zou zijn); 2) verminderde fitheid (de patiënt heeft bijvoorbeeld moeite met het volhouden van dagelijkse taken en vaardigheden of eigen sport/gym/participatie momenten; 3) dreigend verlies van functionele vaardigheden; en/of 4) aanwezigheid van een hulpvraag op het gebied van fysiek functioneren en training.
De aan te bieden fysieke training moet zo functioneel mogelijk zijn, en voldoen aan het FITT (Frequentie, Intensiteit, Tijdsduur, Type activiteit) principe. De werkgroep acht het belangrijk dat het schema zowel oefeningen gericht op het uithoudingsvermogen, als oefeningen gericht op de duurkracht bevat. Excentrisch trainen (waarbij spieren verlengen terwijl ze kracht leveren) en trainen met een hoge mechanische weerstand kunnen leiden tot overbelasting (bijvoorbeeld extra spierschade, te herkennen aan langer aanhoudende spierpijn, bruine urine (hemoglobinuremie) en verminderd vermogen tot uitvoeren van dagelijkse activiteiten gerelateerd aan de training), en moeten voorkomen worden (Abresch, 2012; Bushby, 2010; Jansen, 2013).
Een goede optie lijkt het aanbieden van fietstraining met ondersteuning voor zowel de armen als de benen (Jansen, 2103; Alemdaroglu,2015) of training van de armen met ondersteuning (Heutinck, 2018) in combinatie met vrije oefeningen zonder weerstand voor het hele lichaam (Alemdaroglu,2015; Scott, 1981), welke ook eventueel ondersteund uitgevoerd kunnen worden. Ook hydrotherapie is een goede optie om vrije oefeningen zonder weerstand uit te voeren, omdat in het water makkelijker en vrijer geoefend kan worden zonder grote invloed van de zwaartekracht. Om de implementatie te bevorderen is het van belang om bij het opstellen van het trainingsprogramma de patiëntvoorkeuren mee te nemen. Voor een overzicht van de handvatten/mogelijkheden, tips en adviezen voor de verschillende fases van de ziekte wordt verwezen naar de bijlage. De training dient uiteraard bijgesteld te worden als de situatie daarom vraagt.
Naar de mening van de werkgroep dient het opstarten van de training en de monitoring van de trainingsprogressie onder supervisie van een (kinder)fysiotherapeut te gebeuren, om onder- of overtraining te voorkomen. Zolang er regelmatig contact is over de vorm en inhoud van de training met de behandelend (kinder)fysiotherapeut, kan de training ook bij lokale (sport)verenigingen, in een zwembad (hydrotherapie) of thuis plaatsvinden. Hiernaast kunnen ook het uitvoeren van dagelijkse functionele vaardigheden en activiteiten gezien worden als een onderdeel van training en daarmee kunnen deze bijdragen aan het behouden van functionele vaardigheden
Om inzicht te krijgen in de fysieke activiteit van een patiënt gedurende de week, raadt de werkgroep aan om samen met ouders en patiënt periodiek (bijvoorbeeld eens per 6 maanden en indien nodig vaker) een beweegdagboek voor de periode van bijvoorbeeld een week bij te houden. Dit kan helpen bepalen welke extra inzet aan training noodzakelijk is voor de desbetreffende patiënt.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Voor patiënt en ouders is een belangrijk doel het behouden van de functionele vaardigheden op zowel activiteiten- als functie- en structuurniveau, zodat de patiënt in het dagelijks leven zo zelfstandig mogelijk kan functioneren. Fysieke training zou hier mogelijk aan bij kunnen dragen. Hoe de patiënt en zijn ouders aankijken tegen fysieke training, zal zeer individueel bepaald zijn. In ieder geval is het van belang om aan te geven aan de patiënt dat training uitgevoerd wordt om activiteiten te onderhouden, maar dat vooruitgang niet in de lijn der verwachting ligt. Patiënten en ouders weten dat er sprake is van achteruitgang, maar als dit optreedt tijdens een trainingsperiode kan dit als frustrerend ervaren worden en demotiverend werken. De (kinder)fysiotherapeut en ergotherapeut dienen zich hier bewust van te zijn en daar op te letten tijdens de therapie/training.
De voordelen van training voor de patiënt en zijn ouders zijn het actief kunnen bijdragen aan een actieve leefstijl en het behouden van mogelijkheden om zo goed en zelfstandig mogelijk te kunnen functioneren. Training vergt echter inzet, tijd en commitment, maar is ook leuk om (gezamenlijk) uit te voeren, zeker als de patiënt ook zelf actief betrokken wordt bij het vormgeven van de training/kiezen van de activiteiten. Daarnaast dient de training comfortabel uitgevoerd te kunnen worden en onderdeel te zijn van het dagelijks leven/dagelijkse activiteiten. Om de drempel zo laag mogelijk te houden, is het dus belangrijk om zoveel mogelijk rekening te houden met de patiëntvoorkeuren, de belastbaarheid van de patiënt en ook de training zoveel mogelijk in te passen in het dagelijks leven. Het is van belang dat training in goed overleg wordt vormgegeven en uitgevoerd en dat daarbij rekening wordt gehouden met de mogelijke individuele barrières voor patiënt en gezin. Patiënt en ouders ‘moeten’ vaak al heel veel. Hierbij kan naast de (kinder)fysiotherapeut ook bij uitstek de ergotherapeut een rol spelen.
Kosten (middelenbeslag)
Gezien het feit dat DMD een ernstig progressieve aandoening is die achteruitgang kent gedurende het hele leven van de patiënt zal er in meer of mindere mate levenslange paramedische en revalidatiezorg nodig zijn. De inzet van zorg is hierbij wel afhankelijk van de ziektefase waarin de patiënt zich bevindt en zijn huidige activiteitenniveau (e.g. in de vroeg ambulante en laat non-ambulante fase zal de inzet anders van aard en frequentie zijn). Mogelijk zullen de huidige aanbevelingen zorgen voor een toename in de hoeveelheid fysiotherapieconsulten per patiënten. Er zijn echter geen gegevens over de kosteneffectiviteit bekend, en de kosten hebben daarom verder geen invloed op de besluitvorming.
Aanvaardbaarheid, haalbaarheid en implementatie
Voor ouders en patiënten zal het aanvaardbaar zijn om een actieve leefstijl te hanteren, mits dit makkelijk te incorporeren valt in de dagelijkse situatie en als er merkbare effecten in functionele vaardigheden optreden (dat wil ook zeggen het behouden van vaardigheden en vertraging van de achteruitgang). Zoals bekend heeft gedragsverandering tijd en de juiste ondersteuning nodig. De (kinder)fysiotherapeut kan hier heel goed voor samenwerken met de ergotherapeut.
De haalbaarheid en implementatie van training is niet systematisch onderzocht. De vraag is hoe ervoor gezorgd kan worden dat training leuk, interessant, comfortabel en haalbaar gehouden wordt over de tijd. Mogelijk zal het voor een patiënt niet altijd haalbaar zijn om aan de voorgestelde frequentie van training te voldoen. Vooral de benodigde tijd van zowel patiënt, als ouders, kunnen een belemmering vormen om de aanbevelingen te implementeren. De werkgroep is zich ervan bewust dat het niet haalbaar is voor patiënten met DMD om gedurende het hele leven 2 tot 3 keer per week naar bijvoorbeeld de fysiotherapeut te gaan, alhoewel de in de geïncludeerde studies gehanteerde trainingsintensiteit en duur door de deelnemers als haalbaar werd beoordeeld (Jansen, 2013; Heutinck, 2018; Alemdaroglu, 2015). De werkgroep is van mening dat samen met de patiënt en het gezin gekeken moet worden hoe ‘training’ ingezet kan worden om functionele vaardigheden op activiteitenniveau (met als belangrijkste doel voor de patiënt waardevolle participatie in het dagelijks leven) zo goed mogelijk te behouden, dit functioneren goed te monitoren en daar waar nodig de invulling van de ‘training’ te wijzigen. De training zou wat de werkgroep betreft ook thuis of bij een lokale (sport)vereniging plaats kunnen vinden. Hiernaast kunnen ook het uitvoeren van dagelijkse functionele vaardigheden en activiteiten, al dan niet met mechanische ondersteuning, gezien worden als een onderdeel van training en daarmee bijdragen aan het behouden van functionele vaardigheden. Denk hierbij aan het actief verplaatsen middels een handbewogen rolstoel met hoepelondersteuning, en het zoveel mogelijk betrokken zijn bij de persoonlijke verzorging (helpen met aan-/uitkleden waar mogelijk et cetera). Op deze manier zal ook de belasting op patiënt en gezin beter te overzien en vol te houden zijn.
Door de opbouw van de zorg (i.e., fysiotherapie en ergotherapie in ziekenhuizen, revalidatiecentra en eerstelijns praktijken met elk hun eigen mogelijkheden en beperkingen) en de kleine patiëntaantallen is mogelijk de kennis met betrekking tot DMD niet overal afdoende. In de opleiding kinderfysiotherapie en ergotherapie wordt er kort aandacht besteed aan het ziektebeeld, maar binnen de reguliere opleiding fysiotherapie wordt dit nauwelijks tot niet gedaan. In het algemeen worden fysiotherapeuten en ergotherapeuten aangeraden om contact met een (kinder)fysiotherapeut en/of ergotherapeut met ervaring met DMD te onderhouden indien de eigen ervaring op dit gebied beperkt is. Daarnaast is het wenselijk voor de (kinder)fysiotherapeut om samen met een ergotherapeut te kijken hoe lichamelijke activiteiten in het dagelijks leven ingebouwd kunnen worden.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Ondanks dat de bewijskracht vanuit de literatuur zeer laag is, is de werkgroep positief over fysieke training bij patiënten met Duchenne Spierdystrofie (DMD). Hierbij is het belangrijk dat de training zo functioneel mogelijk, en volgens het FITT principe, wordt ingericht. Bij voorkeur wordt training aan iedere patiënt met DMD aangeboden, maar zou in ieder geval beschikbaar moeten zijn voor patiënten die verminderd fit zijn, een laag of verminderd activiteitenniveau hebben of een hulpvraag hebben op het gebied van bewegen en fysieke fitheid. Bij voorkeur richt de training zich zowel op:
- het uithoudingsvermogen: 2 tot 3 maal per week aerobe training met een lage intensiteit (Omni schaal score 5 tot 7) voor tenminste 20 tot 25 minuten; als
- de duurkracht: 2 tot 3 maal per week training met een lage intensiteit (50 tot 60% van het 1 herhalingsmaximum volgens het Holten diagram (waarbij de 50-60% bij benadering bepaald wordt en niet middels een daadwerkelijk 1RM bepaling om overbelasting te voorkomen; Figuur 1), en tenminste 2 series met 25 herhalingen per oefening (Gisolfi, 1991, Van Empelen, 2013).
Figuur 1 Diagram volgens Holten (Gisolfi, 1991)
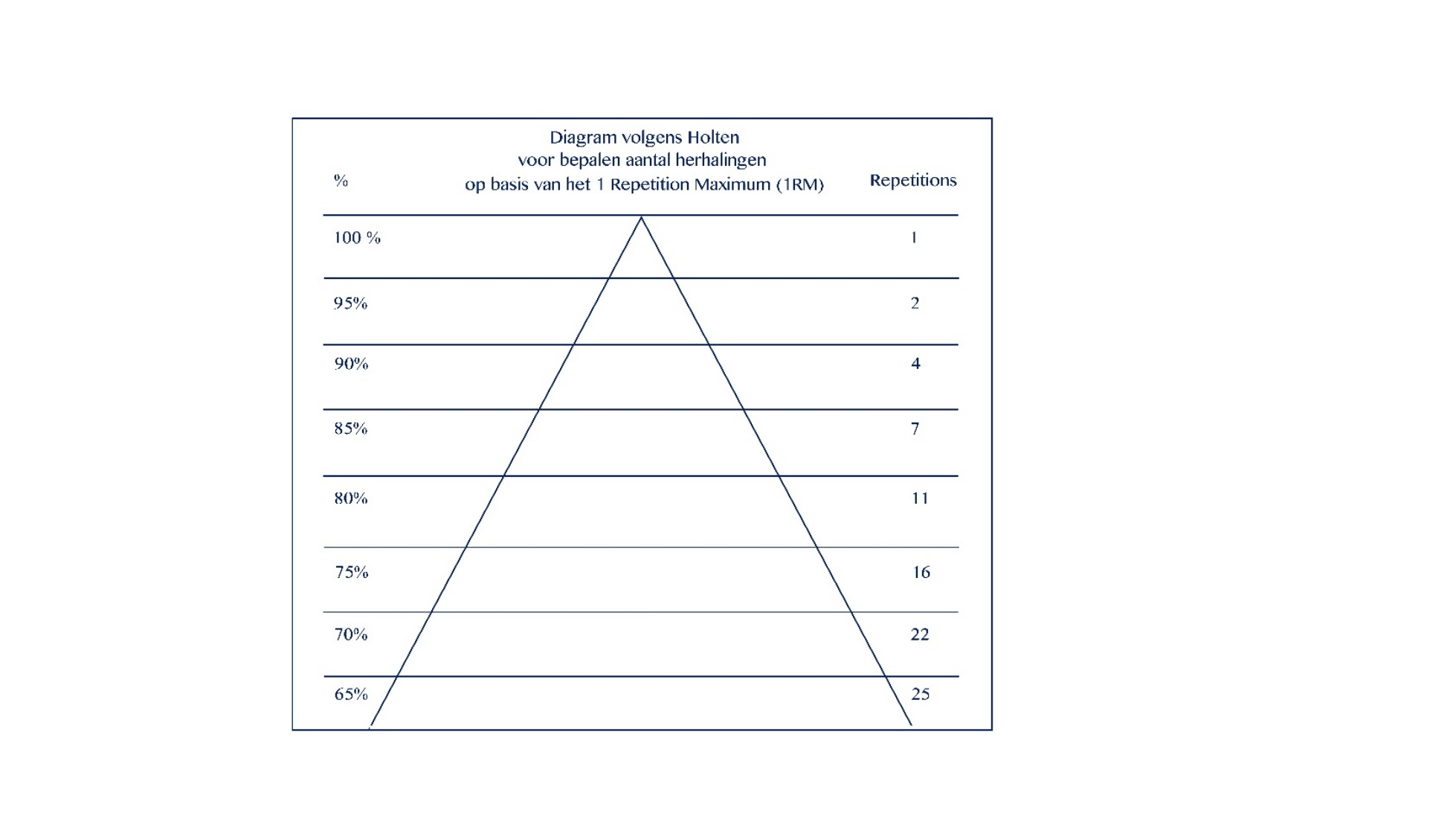
In de bijlage is een voorbeeld van een specificatie van de training (uithoudingsvermogen en duurkracht) per ziektefase opgenomen. Overtraining moet worden voorkomen, en waar relevant is het belangrijk dat contact op wordt genomen met een (kinder)fysiotherapeut met specifieke expertise op het gebied van DMD.
Onderbouwing
Achtergrond
Bij Duchenne spierdystrofie (DMD) wordt er door een fout in het Duchenne-gen geen, of bijna geen dystrofine aangemaakt. Door de afwezigheid van het dystrofine eiwit is spierweefsel extra gevoelig voor schade en kan het bovendien niet goed herstellen. Hierdoor is er progressief verlies van spiermassa en spierkracht. Functionele activiteiten zoals lopen en het optillen van de armen zijn daardoor op termijn niet meer mogelijk. Om schade, en dus achteruitgang in functie, zoveel mogelijk te voorkomen werd in het verleden voornamelijk passief geoefend met jongens en mannen met DMD waarbij met name spier- en bindweefsel passief werd gerekt. Inmiddels zijn de inzichten wel veranderd en worden ook actieve oefeningen uitgevoerd. Oefenen (training) op een lage intensiteit is waarschijnlijk veilig, en zou mogelijk deconditionering als gevolg van weinig lichamelijke beweging (disuse) tegen kunnen gaan (‘rust roest’) (Birnkrant, 2018; Jansen, 2013). In de huidige standards of care, een recent gepubliceerde internationale richtlijn over Duchenne spierdystrofie, worden ook actieve oefeningen aangeraden (Birnkrant, 2018). Er wordt verder aanbevolen om verschillende vormen van training (‘exercise’) voor te schrijven aan jongens en mannen met DMD, bijvoorbeeld middels fysiotherapie, hydrotherapie, sport en/of oefeningen met mechanische ondersteuning (Birnkrant, 2018). Er wordt hierbij wel specifiek gerefereerd aan submaximale aerobe oefentherapie, voornamelijk in de eerste ziektefases (vroeg en laat ambulant en vroeg non-ambulant), waarbij overbelasting moet worden voorkomen. De voorgestelde vormen van training (‘exercise’) zijn ook gangbaar in Nederland, maar aan goede onderbouwing van deze aanbevelingen ontbreekt het. Excentrisch trainen (waarbij spieren verlengen terwijl ze kracht leveren) en trainen met een hoge mechanische weerstand die leidt tot overbelasting, kan leiden tot extra spierschade en dit dient dan ook vermeden te worden (Birnkrant, 2018).
Het doel van training voor jongens en mannen met DMD is het verkrijgen en behouden van een actieve leefstijl waardoor secundaire lichamelijke achteruitgang als gevolg van disuse wordt tegengegaan en patiënten zo lang mogelijk, zo zelfstandig mogelijk kunnen functioneren. In de standards of care wordt echter geen duidelijk richting of specifieke inhoud en vorm van training beschreven. Om training voor het behouden van een actieve leefstijl vorm te geven is er vanuit de praktijk dan ook behoefte aan concreet advies over trainingsparameters die aansluiten bij de genoemde aanbevelingen in de standards of care bij jongens en mannen met DMD waarbij duidelijk ook de vorm, intensiteit, duur en frequentie voor training aangegeven wordt.
Conclusies / Summary of Findings
1. Uitkomstmaat functionele vaardigheden
|
Zeer laag GRADE |
Het is onduidelijk of ergometer fietstraining met ondersteuning effect heeft op functionele vaardigheden vergeleken met reguliere zorg bij ambulante en rolstoelafhankelijke patiënten met Duchenne spierdystrofie.
Bronnen: (Jansen, 2013; Alemdaroglu, 2015) |
|
Zeer laag GRADE |
Het is onduidelijk of zwaartekracht- gecompenseerde 3D arm training effect heeft op functionele vaardigheden vergeleken met reguliere zorg bij ambulante en rolstoelafhankelijke patiënten met Duchenne spierdystrofie.
Bronnen: (Heutinck, 2018) |
Zeer laag GRADE |
Het is onduidelijk of een oefenprogramma in de thuissituatie met oefeningen met weerstand effect heeft op functionele vaardigheden vergeleken met oefeningen zonder weerstand bij ambulante patiënten met Duchenne spierdystrofie.
Bronnen: (Scott, 1981) |
2a. Uitkomstmaat spierkracht: explosieve kracht
|
Zeer laag GRADE |
Het is onduidelijk of ergometer fietstraining effect heeft op explosieve kracht vergeleken met reguliere zorg bij ambulante en rolstoelafhankelijke patiënten met Duchenne spierdystrofie.
Bronnen: (Jansen, 2013; Alemdaroglu, 2015) |
|
Zeer laag GRADE |
Het is onduidelijk of zwaartekracht- gecompenseerde 3D arm effect heeft op explosieve kracht van de schouder abductoren en de elleboogflexoren vergeleken met reguliere zorg bij ambulante en rolstoelafhankelijke patiënten met Duchenne spierdystrofie.
Bronnen: (Heutinck, 2018) |
|
Zeer laag GRADE |
Het is onduidelijk of een oefenprogramma in de thuissituatie met oefeningen met weerstand effect heeft op explosieve kracht vergeleken met oefeningen zonder weerstand bij ambulante patiënten met Duchenne spierdystrofie.
Bronnen: (Scott, 1981) |
2b. Uitkomstmaat spierkracht: duurkracht (aantal herhalingen)
|
Zeer laag GRADE |
Het is onduidelijk of armfietstraining effect heeft op duurkracht van de armen vergeleken met reguliere zorg bij patiënten met Duchenne spierdystrofie.
Bronnen: (Alemdaroglu, 2015) |
|
- GRADE |
Wegens het ontbreken van studies is er geen conclusie mogelijk over het effect van zwaartekracht- gecompenseerde 3D arm training ten opzichte van reguliere zorg op duurkracht bij patiënten met Duchenne spierdystrofie. |
|
- GRADE |
Wegens het ontbreken van studies is er geen conclusie mogelijk over het effect van een oefenprogramma in de thuissituatie met oefeningen met weerstand ten opzichte van oefeningen zonder weerstand op duurkracht bij patiënten met Duchenne spierdystrofie. |
3. Uitkomstmaat uithoudingsvermogen
|
Zeer laag GRADE |
Het is onduidelijk of fietstraining effect heeft op uithoudingsvermogen vergeleken met reguliere zorg bij ambulante en rolstoelafhankelijke patiënten met Duchenne spierdystrofie.
Bronnen: (Jansen, 2013) |
|
Zeer laag GRADE |
Het is onduidelijk of zwaartekracht- gecompenseerde 3D arm training effect heeft op uithoudingsvermogen vergeleken met reguliere zorg bij ambulante en rolstoelafhankelijke patiënten met Duchenne spierdystrofie.
Bronnen: (Heutinck, 2018) |
|
- GRADE |
Wegens het ontbreken van studies is er geen conclusie mogelijk over het effect van een oefenprogramma in de thuissituatie met oefeningen met weerstand ten opzichte van oefeningen zonder weerstand op uithoudingsvermogen bij patiënten met Duchenne spierdystrofie. |
4. Uitkomstmaat ROM/spierlengte
|
Zeer laag GRADE |
Het is onduidelijk of fietstraining effect heeft op range of motion van de knie extensoren, de enkel dorsaalflexoren en de elleboog extensoren vergeleken met reguliere zorg bij ambulante en rolstoelafhankelijke patiënten met Duchenne spierdystrofie.
Bronnen: (Jansen, 2013) |
|
Zeer laag GRADE |
Het is onduidelijk of zwaartekracht- gecompenseerde 3D arm effect heeft op range of motion van de schouder, elleboog en pols vergeleken met reguliere zorg bij ambulante en rolstoelafhankelijke patiënten met Duchenne spierdystrofie.
Bronnen: (Heutinck, 2018) |
|
Zeer laag GRADE |
Het is onduidelijk of een oefenprogramma in de thuissituatie met oefeningen met weerstand effect heeft op range of motion vergeleken met oefeningen zonder weerstand bij ambulante en rolstoelafhankelijke patiënten met Duchenne spierdystrofie.
Bronnen: (Scott, 1981) |
5. Uitkomstmaat adverse events
|
Zeer laag GRADE |
Het is onduidelijk of fietstraining leidt tot meer adverse events vergeleken met reguliere zorg bij ambulante en rolstoelafhankelijke patiënten met Duchenne spierdystrofie.
Bronnen: (Jansen, 2013) |
|
Zeer laag GRADE |
Het is onduidelijk of zwaartekracht- gecompenseerde 3D arm training leidt tot meer adverse events vergeleken met reguliere zorg bij ambulante en rolstoelafhankelijke patiënten met Duchenne spierdystrofie.
Bronnen: (Heutinck, 2018) |
|
- GRADE |
Wegens het ontbreken van studies is er geen conclusie mogelijk over het effect van een oefenprogramma in de thuissituatie met oefeningen met weerstand ten opzichte van oefeningen zonder weerstand op adverse events bij patiënten met Duchenne spierdystrofie.
Bronnen: (Scott, 1981) |
6. Uitkomstmaat dagelijkse activiteiten
|
- GRADE |
Wegens het ontbreken van studies is er geen conclusie mogelijk over het effect van fysieke training ten opzichte van reguliere zorg op dagelijkse activiteiten bij patiënten met Duchenne spierdystrofie |
7. Uitkomstmaat kwaliteit van leven
|
- GRADE |
Wegens het ontbreken van studies is er geen conclusie mogelijk over het effect van fietstraining ten opzichte van reguliere zorg op kwaliteit van leven bij patiënten met Duchenne spierdystrofie.
Bronnen: (Jansen, 2013; Alemdaroglu, 2015) |
|
Zeer laag GRADE |
Het is onduidelijk of zwaartekracht- gecompenseerde 3D arm effect heeft op kwaliteit van leven vergeleken met reguliere zorg bij ambulante en rolstoelafhankelijke patiënten met Duchenne spierdystrofie.
Bronnen: (Heutinck, 2018) |
|
- GRADE |
Wegens het ontbreken van studies is er geen conclusie mogelijk over het effect van een oefenprogramma in de thuissituatie met oefeningen met weerstand ten opzichte van oefeningen zonder weerstand op kwaliteit van leven bij patiënten met Duchenne spierdystrofie.
Bronnen: (Scott, 1981) |
Samenvatting literatuur
Beschrijving studies
Twee studies onderzochten het effect van fietstraining met ondersteuning voor armen en benen (Jansen, 2013) of met alleen de armen (Alemdaroglu, 2015), één studie onderzocht een zwaartekracht-gecompenseerde 3D arm training (Heutinck, 2018) en één studie onderzocht weerstandstraining (in de thuis-setting) (Scott, 1981). De reguliere zorg bestond uit het handhaven van reguliere activiteiten en fysiotherapie (Jansen, 2013), (ROM) oefeningen thuis (Alemdaroglu, 2015; Scott, 1981) of geen specifieke interventie (Heutinck, 2018).
Vergelijking 1: (ergometer) fietstraining versus reguliere zorg
Beschrijving studies
Jansen, 2013 was een RCT waarin de vergelijking wordt gemaakt tussen 1) fietstraining met ondersteuning (N=16) en 2) reguliere zorg (N=13), bij patiënten met Duchenne spierdystrofie (DMD) ouder dan zes jaar. In de trainingsgroep namen acht ambulante en acht rolstoelafhankelijke jongens deel en in de controlegroep 10 ambulante en drie rolstoelafhankelijke jongens. De trainingsgroep fietste per sessie 15 minuten met benen en armen gebruikmakende van een fietstrainer met elektrische ondersteuning op vijf dagen per week gedurende 24 weken. De intensiteit waarop ze fietsten was een ‘beetje moe’ tot ‘iets meer moe’ (OMNI < 6). Deelnemers trainden afhankelijk van hun voorkeur, thuis of op school. Ouders en/of leerkrachten werden geïnstrueerd om de jongens te begeleiden. De reguliere zorg groep mocht hun reguliere activiteiten handhaven, inclusief fysiotherapie en ontving na de reguliere zorg periode van 24 weken ook de interventie. Functionele vaardigheden (Motor function measure (MFM), timede testen), spierkracht (MRC; Medicial Research Council), uithoudingsvermogen (A6MCT; Assisted 6 min cycling test), range of motion (ROM) werden na 24 weken interventie gemeten en adverse events werden gerapporteerd. Er was een totale follow-up duur van 60 weken.
Alemdaroglu, 2015 was een RCT waarin de vergelijking wordt gemaakt tussen 1) armtraining op een armergometer op drie dagen per week gedurende acht weken onder supervisie van een fysiotherapeut (N=12) en 2) een versterkende ROM thuis-trainingsprogramma onder supervisie van de familie (N=12), bij patiënten met DMD tussen de acht en 12 jaar oud. In de trainingsgroep namen 11 kinderen deel met een Brooke Upper Extremity Functional Classification (BUEFC) classificatie I en één jongen met classificatie II. In de controlegroep namen negen kinderen deel met een BUEFC classificatie I en drie jongens met classificatie II. De trainingsgroep trainde 40 minuten per sessie op een fietstrainer met armen, drie dagen per week gedurende acht weken. Iedere sessie begon met vijf minuten warming-up in passieve modus gevolgd door 30 minuten in actieve modus met vijf minuten cooling-down in passieve modus. De intensiteit waarop werd getraind was op 50% van maximale uitvoering bepaald in een drie-minuten maximaal test. De controlegroep volgde een thuistrainingsprogramma dat bestond uit ROM oefeningen (passief, geleid actief, actief en tegen weerstand) waaronder schouderflexie, -abductie, -extensie, -interne en -externe rotatie, elleboogflexie en -extensie en polsflexie en -extensie oefeningen, waarbij de intensiteit was gebaseerd op het functionele niveau en kracht van de armen. Iedere oefening werd vijf tot 10 keer herhaald met een gemiddelde van 40 minuten per sessie, vijf dagen per week. Functionele vaardigheden (NSAA (North Star Ambulatory Assessment), AREA (Arm Elevation Assessment) en timede testen), spierkracht (explosieve kracht) (HHD en handgreepkracht) en duurkracht (MMDT (Minnesota Manual Dexterity test)) werden gemeten na 8 weken interventie.
Resultaten
1. Functionele vaardigheden (cruciaal)
Jansen (2013) onderzocht functionele vaardigheden met behulp van de MFM waarvan de score wordt uitgedrukt op een schaal van 0 tot 100% en vond een verschil van 4,9% (95%BI 2,2 tot 7,6, p=0,002) in het voordeel van de fietstraining. Jansen (2013) onderzocht functionele vaardigheden ook door middel van getimede testen (in seconden) en vond niet statistisch significante verschillen voor opstaan van de vloer (MD: 16,3; p=0,961), 10 meter rennen (0,7; 95% BI van -3,1 tot 2,5, p=0,784) en de nine-hole-peg-test (0,6; 95%BI -3,1 tot 2,4, p=0,784).
Alemdaroglu (2015) onderzocht functionele vaardigheden met behulp van getimede testen (in seconden) en vond statistisch significante verschillen in seconden in het voordeel van fietstraining voor opstaan van de vloer (I: 8,27 ± 7,35 en C:13,04 ± 10,85 ; p=0,04) en t-shirt aantrekken (I: 11,16 ± 6,94 en C: 18,04 ± 13,27; p=0,02) en een niet statistisch significant verschil voor t-shirt uittrekken (I: 6,62 ± 4,41 en C: 12,72 ± 16,74; p=0,13). Voor de North Star Ambulatory Assessment (NSAA), op een schaal van 0 tot 34, werd geen statistisch significant verschil gevonden (I: 20,17 ± 8,79 en C: 16,33 ± 9,88; p=0,26) (Alemdaroglu, 2015).
2. Spierkracht
a. Explosieve kracht
Jansen (2013) vond een niet statistisch significant gemiddeld verschil van 1,4 (95% BI van -0,3 tot 3,1, p=0,098), op een schaal van 0 tot 5 gemeten met de MRC.
Alemdaroglu (2015) onderzocht explosieve kracht met behulp van een hand held dynamometer (HHD) en vond geen statistisch significante verschillen voor zowel de rechter (I: -0,34 ± 1,19 en C: -0,22 ± 0,60; p=0,93) als de linker arm (I: -0,31 ± 1,31 en C: -0,17 ± 0,62; p=0,95). Er bleek ook geen verschil in de handgreepkracht in de fietsgroep ten opzichte van de controlegroep (p>0,05).
b. Duurkracht (aantal herhalingen)
Alemdaroglu (2015) onderzocht manuele vaardigheid door middel van de MMDT (Minnesota Manual Dexterity test) en vond geen verschil tussen de groepen voor unilateraal plaatsen (I: 100,50 ± 16,63 en C: 116,08±29,08; p=0,66) en bilateraal draaien van de handen (I: 100,50 ± 37,14 en C: 134,50; p=0,89).
Jansen (2013) heeft deze uitkomstmaat niet gerapporteerd.
3. Uithoudingsvermogen
Jansen (2013) vond geen statistisch significant verschil in uithoudingsvermogen, gemeten met de Assisted 6 min cycling test (A6MCT) (in omwentelingen) MD: 5,6 (95% BI van -56,2 tot 67,3, p=0,848).
Alemdaroglu (2015) heeft deze uitkomstmaat niet gerapporteerd.
4. ROM/spierlengte
Jansen (2013) vond geen statistisch significant verschil in range of motion (ROM) bij de knie extensoren: MD: -1,0 (95% BI van -8,8 tot 6,7), de enkel dorsaalflexoren; MD: -2,9 (95% BI van -12,9 tot 7,1, p=0,540), en de elleboog extensoren MD: -2,3 (95% BI van -6,9 tot 2,3, p=0,303).
Alemdaroglu (2015) heeft deze uitkomstmaat niet gerapporteerd.
5. (Serious) adverse events
Jansen (2013) rapporteerde dat drie van de 24 jongens pijn kreeg aan de laterale zijde van de knie of de voet waardoor de houding moest worden aangepast. Een jongen kreeg een inversietrauma na 12 weken en stopte met lopen, maar kon wel blijven fietsen. Er trad één serieuze adverse event op: één jongen liep een femur fractuur op. Deze serieuze adverse event was niet gerelateerd aan de interventie.
Alemdaroglu (2015) heeft deze uitkomstmaat niet gerapporteerd.
6. Dagelijkse activiteiten
Jansen (2013) en Alemdaroglu (2015) hebben deze uitkomstmaat niet gerapporteerd.
7. Kwaliteit van leven
Jansen (2013) en Alemdaroglu (2015) hebben deze uitkomstmaat niet gerapporteerd.
Bewijskracht van de literatuur
Functionele vaardigheden (cruciaal), spierkracht (explosieve kracht), uithoudingsvermogen, ROM/spierlengte en adverse events
De bewijskracht voor de uitkomstmaat functionele vaardigheden, spierkracht (explosieve kracht), uithoudingsvermogen, ROM/spierlengte en adverse events is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (-1, risk of bias) en gezien het zeer geringe aantal patiënten (-2, imprecisie). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘zeer laag’.
Spierkracht (duurkracht), dagelijkse activiteiten, kwaliteit van leven
Er is geen GRADE-beoordeling voor duurkracht, dagelijkse activiteiten en kwaliteit van leven in verband met het ontbreken van studies.
Vergelijking 2 Zwaartekracht- gecompenseerde 3D arm training versus reguliere zorg
Beschrijving studie
Heutinck, 2018 was een RCT waarin 19 patiënten met DMD werden gerandomiseerd in 1) een zwaartekracht-gecompenseerde 3D arm training (N=9) en 2) reguliere zorg (N=10). Patiënten waren, ambulant of rolstoelafhankelijk en ouder dan zeven jaar. Door uitval van in totaal 3 jongens voltooiden uiteindelijk drie ambulante jongens en vier rolstoelafhankelijke jongens de trainingsinterventie. In de controlegroep voltooiden drie ambulante jongens en zes rolstoelafhankelijke jongens het onderzoek. De trainingsgroep trainde de armen met ondersteuning door reik- en tiloefeningen, waarbij de arm in de ruimte bewogen moet worden, te doen tijdens een 15 minuten durende virtual reality computer game sessies. Er waren vijf sessies per week gedurende 20 weken. Deelnemers met verminderde armfunctie kregen additionele ondersteuning om het optillen van de armen mogelijk te maken. Functionele vaardigheden (MFM, PUL en Abilhand-plus), spierkracht (HHD en MVC), uithoudingsvermogen (A6MCT), ROM en kwaliteit van leven (kidscreen-52 en global question health) werden na 20 weken interventie gemeten en adverse events werden gerapporteerd. Er was een totale follow-up duur van 52 weken.
Resultaten
1. Functionele vaardigheden (cruciaal)
Heutinck (2018) vond geen statistisch significant verschil op de MFM (dimensie 3), op een schaal van 0 tot 100%, tussen de 3D armtraining (T2: 95,2 ± 3,8) en de usual care groep (T2: 93,8 ± 6,5; p=0,819). Functionele vaardigheden gemeten met de PUL, op een schaal van nul tot 72, toonde een gemiddeld verschil voor de 3D armtraining groep van -1,6 ± 2,9 en voor de reguliere zorg groep van 3,1 ± 3,4, wat niet statistisch significant van elkaar verschilde (p=0,361). Ook voor de Abilhand-plus werd geen statisch significant verschil gevonden zowel bij scoring door de kinderen (I: 1,4 ± 3,0 en C: 0,8 ± 3,2; p= 0,705) als door de ouders (I: 1,4 ± 4,7 en C: -1,6 ± 7,1; p=0,427).
2. Spierkracht
a. Explosieve kracht
Heutinck (2018) onderzocht explosieve kracht door middel van HHD en vond geen statistisch significante verschillen (R/L) voor schouder abductoren (p=0,604 / p=0,513) en elleboogflexoren (p=0,234/p=0,627) en de rechter elleboogflexoren (p=0,208). Alleen de linker elleboogextensoren waren statistisch significant sterker geworden in de 3D armtraining groep (1,5 ± 1,8 lbs) ten opzichte van de reguliere zorg groep (-0,2 ± 1,6 lbs; p=0,038). De maximale vrijwillige contractie (MVC) was niet verschillend in de 3D armtraining ten opzichte van de reguliere zorggroep (p=0,338).
b. Duurkracht (aantal herhalingen)
Heutinck (2018) heeft deze uitkomstmaat niet gerapporteerd.
4. Uithoudingsvermogen
Heutinck (2018) vond geen statistisch verschil in uithoudingsvermogen gemeten met de A6MCT (in omwentelingen) tussen de 3D arm training MD±SD: -6,7 ± 85,6 en de reguliere zorg groep MD ± SD: 19,1 ±6 3,1 (p=0,532).
5. ROM/spierlengte
Heutinck (2018) vond geen statistisch verschil in ROM, bepaald met een totaal score over de schouder, de elleboog en de pols: het gemiddelde voor de 3D arm trainingsgroep was -21,7 ± 66,6 en voor de reguliere zorg groep 70,8 ± 43,3; p=0,063. Ook was er geen statistisch significant verschil voor de schouder en de pols apart. Er was wel een statistisch significant verschil in actieve elleboog ROM in het voordeel van de interventie groep (toename 15,7 ± 22,1 graden), ten opzichte van een afname in de controle groep van 18,9 ± 25,3 graden, p=0,0018).
6. (Serious) adverse events
Heutinck (2018) beschreef dat de patiënten geen pijn hadden gerapporteerd. De gerapporteerde blessures waren niet gerelateerd aan de training.
7. Dagelijkse activiteiten
Heutinck (2018) heeft deze uitkomstmaat niet gerapporteerd.
8. Kwaliteit van leven
Heutinck (2018) onderzocht kwaliteit van leven (QoL) door middel van de Kidscreen 52, dimensie fysiek welbevinden (waarbij de QoL op baseline goed was voor beide groepen) en vond geen verschil tussen de 3D arm training groep en de reguliere zorggroep bij rapportage door de kinderen (p = 0,488) of door de ouders (p= 0,130). De global health question werd aan het einde van de interventie periode afgenomen en evalueert de verandering in gezondheidsgerelateerde kwaliteit van leven over de voorgaande zes maanden. Er werd geen statistisch significant verschil gevonden tussen de 3D arm training groep en de reguliere zorggroep.
Bewijskracht van de literatuur
Functionele vaardigheden (cruciaal), spierkracht (explosieve kracht), uithoudingsvermogen, ROM/spierlengte, adverse events en kwaliteit van leven
De bewijskracht voor de uitkomstmaat functionele vaardigheden, spierkracht (explosieve kracht), uithoudingsvermogen, ROM/spierlengte, adverse events en kwaliteit van leven is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (-1, risk of bias) en gezien het zeer geringe aantal patiënten (-2, imprecisie). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘zeer laag’.
Spierkracht (duurkracht) en dagelijkse activiteiten
Er is geen GRADE-beoordeling voor duurkracht en dagelijkse activiteiten in verband met het ontbreken van studies.
Vergelijking 3 Oefenprogramma in thuissituatie: oefeningen met versus zonder weerstand
Beschrijving studies
Scott, 1981 was een RCT waarin de vergelijking wordt gemaakt tussen 1) weerstandstraining (N=9) en 2) oefenprogramma thuis met oefeningen zonder weerstand (N=9) bij ambulante patiënten met DMD die in staat waren om trap te lopen. De jongens waren bij de start van de studie in de leeftijd van vijf tot negen jaar oud. In beide groepen werden de ouders geïnstrueerd om de kinderen iedere dag gedurende 15 minuten thuis oefeningen te laten doen. Groep één voerde een set oefeningen uit tegen manueel toegepaste weerstand. Groep twee voerde oefeningen zonder weerstand uit. De inhoud van de oefeningen is verder niet beschreven. Na drie en zes maanden werden de deelnemers geëvalueerd op functionele vaardigheden (loopvaardigheid, timede testen), spierkracht (explosieve kracht) (MRC) en ROM.
Resultaten
1. Functionele vaardigheden (cruciaal)
Scott (1981) onderzocht locomotor ability door de vooruitgang op 20 verschillende bewegingen te scoren (op een schaal van nul tot 40) en vond geen significante verschillen (gemiddeld verschil na 6 maanden: 2,4; p=0,15). Ook werden getimede testen uitgevoerd, waarbij er geen statistisch significante verschillen werden gevonden tussen de groepen in scores bij de 8,4 meter en 45 meter condities.
2. Spierkracht
a. Explosieve kracht
Scott (1981) onderzocht explosieve kracht met behulp van de MRC en rapporteerde een gemiddeld verschil in de weerstandsgroep van -3,1 en in de groep met oefeningen zonder weerstand van -3,2. Dit werd niet statisch getoetst in de studie. Het geleverde moment van de m. quadriceps femoris was niet statistisch significant verschillend van elkaar na zes maanden (p=0,46).
b. Duurkracht (aantal herhalingen)
Scott (1981) heeft deze uitkomstmaat niet gerapporteerd.
3. Uithoudingsvermogen
Scott (1981) heeft deze uitkomstmaat niet gerapporteerd.
4. ROM/spierlengte
Scott (1981) vond geen statistisch significante verschillen in ROM tussen de weerstandsgroep (T0: 27,2 ± 6,2; T6: 23,3 ± 4,33) en de groep met oefeningen zonder weerstand (T0: 23,3 ± 4,33; T6: 25,0 ± 10,6).
5. (Serious) adverse events
Scott (1981) heeft deze uitkomstmaat niet gerapporteerd.
6. Dagelijkse activiteiten
Scott (1981) heeft deze uitkomstmaat niet gerapporteerd.
7. Kwaliteit van leven
Scott (1981) heeft deze uitkomstmaat niet gerapporteerd.
Bewijskracht van de literatuur
Functionele vaardigheden (cruciaal), spierkracht (explosieve kracht) en ROM/spierlengte.
De bewijskracht voor de uitkomstmaat functionele vaardigheden, explosieve kracht en ROM/ spierlengte is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (-1, risk of bias) en gezien het zeer geringe aantal patiënten (-2, imprecisie). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘zeer laag’.
Duurkracht, uithoudingsvermogen, adverse events, dagelijkse activiteiten en kwaliteit van leven
Er is geen GRADE-beoordeling voor duurkracht, uithoudingsvermogen, adverse events, dagelijkse activiteiten en kwaliteit van leven in verband met het ontbreken van studies.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de gunstige en ongunstige effecten van fysieke training bij patiënten met Duchenne spierdystrofie (DMD)?
P: patiënten met Duchenne spierdystrofie;
I: fysieke training (training gericht op spierkracht, het uithoudingsvermogen of ADL/ functionele vaardigheden);
C: reguliere zorg (onder andere niet door zorgprofessionals begeleide trainingsprogramma’s, zoals bijvoorbeeld thuis oefenen met ouders)/ andere trainingsprogramma’s;
O: functionele vaardigheden (functionele vaardigheidstesten zoals bijvoorbeeld timed testen), spierkracht, uithoudingsvermogen, range of motion (ROM)/spierlengte, adverse events, dagelijkse activiteiten en kwaliteit van leven.
Relevante uitkomstmaten
De werkgroep achtte functionele vaardigheden een voor de besluitvorming cruciale uitkomstmaat; en spierkracht, uithoudingsvermogen, ROM/spierlengte, adverse events, dagelijkse activiteiten en kwaliteit van leven voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde a priori de Performance of the Upper Limb (PUL), de North Star Ambulatory Assessment (NSAA), de Arm Elevation Assessment (AREA), de Motor Function Measure of gestandaardiseerde getimede testen (rise from floor, 10 meter run/walk, 4 stairs climb) als geschikte meetmethoden voor de uitkomstmaat functionele vaardigheden. Voor de uitkomstmaat spierkracht werden dynamometrie (in kg, newton of lbs) en de Medicial Research Council (MRC) schaal aangehouden voor het onderdeel explosieve kracht en voor duurkracht het aantal herhalingen. Voor de uitkomstmaat uithoudingsvermogen werd de 6 minuten wandel of fietstest, of de afgelegde zwem-, fiets- of loopafstand gedefinieerd. Met betrekking tot de uitkomstmaat kwaliteit van leven definieerde de werkgroep gestandaardiseerde en gevalideerde kwaliteit van leven vragenlijsten als geschikte meting. De uitkomstmaat dagelijkse activiteiten diende gemeten te worden middels versnellingsmeters of met een gevalideerde vragenlijst.
De overige uitkomstmaten werden niet a priori gedefinieerd, de werkgroep hanteerde de definities zoals gebruikt in de geïncludeerde artikelen.
De werkgroep definieerde ‘behoud van functionele vaardigheden (bijvoorbeeld mogelijkheid om te lopen, traplopen, op te staan van de grond, de armen tegen de zwaartekracht te heffen, een game controller te hanteren et cetera)’ of ‘het minder snel achteruitgaan ten opzichte van de controlegroep’ als een klinisch (patiënt) relevant verschil (McDonald, 2013), volgens de default grenzen van GRADE. Voor de getimede testen werd een klinisch relevant verschil voor de patiënt van 3,6 seconden (31,3%) voor het opstaan van de grond, 1,4 seconden (18,9%) voor het lopen/rennen van 10 meter en 2,2 seconden (31,9%) voor het beklimmen van 4 traptreden en 31,7 m (8-9%) voor 6 minuten wandeltest aangehouden (McDonald, 2013). Voor de NSAA wordt een verschil van 9 punten op de 0 tot 100 schaal als klinisch relevant gezien (Mayhew, 2013).
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 23 april 2019 met relevante zoektermen gezocht naar systematische reviews en gerandomiseerd gecontroleerd onderzoek (RCTs). De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 340 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische review (gezocht in ten minste twee databases, risk of bias beoordeling aanwezig en de resultaten van individuele studies voldoende gepresenteerd) of RCT waarin een vergelijking is gemaakt tussen fysieke training en reguliere zorg bij > 18 (9 per arm) patiënten met Duchenne spierdystrofie (DMD). Daarnaast moest tenminste één van de bovengenoemde uitkomstmaten zijn gerapporteerd.
Op basis van titel en abstract werden in eerste instantie negen studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens vijf studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en vier studies definitief geselecteerd.
Resultaten
Vier onderzoeken zijn opgenomen in de literatuuranalyse. In deze studies werden verschillende vergelijkingen gemaakt: 1) (ergometer) fietstraining versus reguliere zorg; 2) zwaartekracht- gecompenseerde 3D arm training versus reguliere zorg; en 3) oefenprogramma in thuissituatie: oefeningen met versus zonder weerstand. De analyse is gemaakt per vergelijking.
De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Abresch, R. T., Carter, G. T., Han, J. J., & McDonald, C. M. (2012). Exercise in neuromuscular diseases. Physical medicine and rehabilitation clinics of North America, 23(3), 653–673.
- Alemdaroğlu, I., Karaduman, A., Yilmaz, Ö. T., & Topaloğlu, H. (2015). Different types of upper extremity exercise training in Duchenne muscular dystrophy: effects on functional performance, strength, endurance, and ambulation. Muscle & nerve, 51(5), 697-705.
- Birnkrant, D. J., Bushby, K., Bann, C. M., Apkon, S. D., Blackwell, A., Brumbaugh, D., ... & Street, N. (2018). Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and neuromuscular, rehabilitation, endocrine, and gastrointestinal and nutritional management. The Lancet Neurology, 17(3), 251-267.
- Birnkrant, D. J., Bushby, K., Bann, C. M., Alman, B. A., Apkon, S. D., Blackwell, A., ... & Sheehan, D. W. (2018). Diagnosis and management of Duchenne muscular dystrophy, part 2: respiratory, cardiac, bone health, and orthopaedic management. The Lancet Neurology, 17(4), 347-361.
- Birnkrant, D. J., Bushby, K., Bann, C. M., Apkon, S. D., Blackwell, A., Colvin, M. K., ... & Naprawa, J. (2018). Diagnosis and management of Duchenne muscular dystrophy, part 3: primary care, emergency management, psychosocial care, and transitions of care across the lifespan. The Lancet Neurology, 17(5), 445-455.
- Bushby, K., Finkel, R., Birnkrant, D. J., Case, L. E., Clemens, P. R., Cripe, L., Kaul, A., Kinnett, K., McDonald, C., Pandya, S., Poysky, J., Shapiro, F., Tomezsko, J., Constantin, C., & DMD Care Considerations Working Group (2010). Diagnosis and management of Duchenne muscular dystrophy, part 2: implementation of multidisciplinary care. The Lancet. Neurology, 9(2), 177–189.
- Van Empelen, R., Nijhuis-van der Sanden, R., Hartman, A., (2013); Kinderfysiotherapie, derde herziene druk, pag 210-211. Reed Business Education, Amsterdam.
- Heutinck, L., Jansen, M., van den Elzen, Y., van der Pijl, D., & de Groot, I. J. (2018). Virtual Reality Computer Gaming with Dynamic Arm Support in Boys with Duchenne Muscular Dystrophy. Journal of neuromuscular diseases, 5(3):359-372.
- Jansen, M., van Alfen, N., Geurts, A. C., & de Groot, I. J. (2013). Assisted bicycle training delays functional deterioration in boys with Duchenne muscular dystrophy: the randomized controlled trial “no use is disuse”. Neurorehabilitation and neural repair, 27(9), 816-827.
- Gisolfi, C. V., & Lamb, D. R. (1991). Perspective in Exercise Science and Sports Medicine. Volume 2: Youth, Exercise and Sport. Medicine & Science in Sports & Exercise, 23(3), 392.
- McDonald, C. M., Henricson, E. K., Abresch, R. T., Florence, J., Eagle, M., Gappmaier, E., ... & Elfring, G. (2013). The 6‐minute walk test and other clinical endpoints in Duchenne muscular dystrophy: reliability, concurrent validity, and minimal clinically important differences from a multicenter study. Muscle & nerve, 48(3), 357-368.
- Scott, O. M., Hyde, S. A., Goddard, C., Jones, R., & Dubowitz, V. (1981). Effect of exercise in Duchenne muscular dystrophy. Physiotherapy, 67(6), 174.
Evidence tabellen
Risk of bias tabel
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome accessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Jansen, 2013 |
Stratified randomization (ambulant versus wheelchair-dependent) was used to allocate participants to either the intervention or the control group in a 2:1 ratio |
unlikely |
Likely: not possible to blind |
Unlikely: not possible to blind but bias not expected |
Likely
Note: Participants and outcome assessor were not blinded to treatment allocation but had no information about previous test results at each assessment. |
Unlikely |
Likely, incomplete outcome data |
likely
note: per protocol analysis |
|
Alemdaroglu, 2015 |
coin-toss method. |
unlikely |
Likely: not possible to blind |
Unlikely: not possible to blind but bias not expected |
Likely, not reported |
Unlikely |
Unlikely |
Unlikely |
|
Heutinck, 2018 |
computer randomization by a coach; Stratified according to upper limb capacity |
Unlikely |
Likely: not possible to blind
Note: Participants were not blinded to treatment allocation, but had no information about previous test results during each assessment. |
Unlikely: not possible to blind but bias not expected |
Unlikely
Note: The clinical evaluators (MJ and LH) were blinded to treatment allocation. |
Unlikely |
Likely, intervention 22.2% drop-out, controlgroup 40% drop out. |
Per protocol analysis and no missing data handling |
|
Scott, 1981 |
Paired for age and randomly allocated by the medical registrar |
Unclear |
Likely: not possible to blind |
Independent observer (PT) |
Likely, not reported |
Unlikely |
Unlikely |
Unlikely, no missing data Statistics dated |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Gianola, 2013 |
Systematische review met 1 protocol artikel en 1 artikel met N=4 |
|
Moreira, 2017 |
Systematische review over niet vergelijkend onderzoek |
|
Pradnya, 2019 |
O voldoet niet aan PICO |
|
Sackley, 2009 |
Alleen chirurgische interventies bij Duchenne |
|
Vry, 2014 |
Niet vergelijkend onderzoek |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 31-03-2021
Beoordeeld op geldigheid : 12-02-2021
Algemene gegevens
De VRA heeft de richtlijn voorlopig geautoriseerd. Definitieve autorisatie volgt na goedkeuren door de ALV.
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met Duchenne spierdystrofie (DMD).
Werkgroep
- Dr. I.J.M. de Groot, revalidatiearts, Radboudumc, VRA, voorzitter
- Drs. S.E. Nawijn, revalidatiearts, Roessingh Centrum voor Revalidatie, VRA
- Drs. E.T. Kruitwagen-van Reenen, revalidatiearts, UMC Utrecht, VRA
- Dr. E.H. Niks, neuroloog-kinderneuroloog, Leids Universitair Medisch Centrum, NVN en NVKN
- Dr. C.E. Erasmus, kinderneuroloog-neuromyoloog, Radboudumc, Amalia Kinderziekenhuis, NVN
- Dr. C.S.M. Straathof, neuroloog, Leids Universitair Medisch Centrum, NVN
- Prof. Dr. P.J. Wijkstra, longarts, Universitair Medisch Centrum Groningen, NVALT
- Drs. J.J.M. Renkens, orthopeed, Erasmus MC, NOV
- Y. van den Elzen, ergotherapeut, Radboudumc, EN
- Dr. M. van der Holst, (kinder)fysiotherapeut, Leids Universitair Medisch Centrum, KNGF/NVFK
- Dr. M. Jansen, (kinder)fysiotherapeut, Radboudumc, De Hoogstraat Revalidatie, KNGF/NVFK
- J.C. Wijnen, diëtist, Spierziekten Nederland, NVD
- Dr. L. van den Engel-Hoek, logopedist, Radboudumc, NVLF
- Dr. J.G.M. Hendriksen, klinisch neuropsycholoog, Kempenhaeghe, NIP
- Dr. A.M.C. Horemans, patiëntvertegenwoordiger, Spierziekten Nederland
- Drs. E. Vroom, patiëntvertegenwoordiger, Duchenne Parent Project
Klankbordgroep
- Dr. H.J. (Hetty) van der Kamp, kinderarts-endocrinoloog, Wilhelmina Kinderziekenhuis, Universitair Medisch Centrum te Utrecht, NVK
Met ondersteuning van
- L. Niesink-Boerboom, literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S. Persoon, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. A.C.J. Balemans, adviseur, Kennisinstituut van de Federatie Medisch Specialisten.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
De Groot, voorzitter |
Radboudumc, Nijmegen |
Post academisch onderwijs, cursusleider, betaling gaat naar afdeling Revalidatie
Meerdere ‘masterclasses’ in het buitenland, onder andere gefinancierd door firma PTC, betaling gaat naar de afdeling Revalidatie.
|
Adviseurschap bij een bedrijf op uur basis (nu 3 uur geweest in I jaar)
Grants en gefinancierd onderzoek van: -Reveragen |
Geen, de onderzoeken gefinancierd door farmaceutische bedrijven zijn niet gerelateerd aan de onderwerpen in deze richtlijn. |
|
Horemans |
Hoofd kwaliteit van zorg, Spierziekten Nederland |
Geen |
Geen |
Geen |
|
Van der Holst |
Kinderfysiotherapeut Leids Universitair Medisch Centrum (16 uur/week) |
Consultant fysiotherapeut/trainer uitkomstmaten in Duchenne spierdystrofie bij ATOM (Advancing Trial Outcome Measures) International Itd. (betaald).
Docent workshop Physical therapy and outcome measures voor fysiotherapeuten. Gegeven via ATOM, gesponsord door PTC pharmaceuticals (betaald). |
Fysiotherapeut/assessor bij verschillende Duchenne (medicatie) trials Reveragen |
Geen, de onderzoeken gefinancierd door farmaceutische bedrijven zijn niet gerelateerd aan de onderwerpen in deze richtlijn.
Heeft zelf geen invloed op de keuze voor de uitkomstmaten die in trials worden afgenomen. |
|
Jansen |
Radboudumc, afdeling kinderfysiotherapie: kinderfysiotherapeut (20 uur p/w) en |
Avans +, intern begeleider thesisfase opleiding MPPT (betaald)
Verschillende scholingen gegeven op het gebied van NMA (onder andere voor het NPI)
Trainer Motor Function Measure (MFM; meetinstrument)/verzorgen scholing MFM |
Fysiotherapeut/assessor bij verschillende clinical trils bij Duchenne, onder andere Biomarin (natural history), AFM (natural history), Italfarmaco, Roche, WAVE DMD, Tamoxifen.
ln het verleden onderzoek gedaan naar het effect van training bij Duchenne, wat |
Geen, de onderzoeken gefinancierd door farmaceutische bedrijven zijn niet gerelateerd aan de onderwerpen in deze richtlijn.
|
|
Wijnen |
Diëtist, onbetaalde vrijwilliger bij Spieziekten Nederland sinds ruim 25 jaar. |
Als onbetaalde diëtist voor Spieziekten Nederland heb ik onder andere de dieetbehandelingsrichtlijn voor mensen met ALS (en PSMA) geschreven, en de dieetbehandelingsrichtlijn voor mensen met Duchenne spierdystrofie en de algemene patiëntenbrochure Voeding bij spieziekten. Verder vaker als adviseur gevraagd bij richtlijnontwikkeling.
lk heb vele presentaties gegeven voor de diverse diagnosegroepen over voeding bij hun specifieke spierziekte tijdens de landelijke dag.
De rol van het NVD-netwerk is het informeren van collegae, artsen en patiënten over kennis die er is op het gebied van voeding bij spieziekten en ontwikkelingen daarin. Het feit dat ik dit alzo lang doe is het gevolg van mijn eigen spieziekte. |
Geen |
Geen |
|
Van den Elzen |
Ergotherapeut bij Radboudumc Nijmegen |
Werkgroepen: -Kerngroep consulenten netwerk FT/ET van SN -Zit/lig werkgroep van SN -Landelijk overleg ET ALS Onderwijs: -Lessen NMA / zithouding -Begeleiden studenten HAN Onderzoek: Deelname interne onderzoeken Radboudumc |
Medewerking (werkgroep en protocolontwikkeling) aan onderzoek OMARM van L vd Heijden, Hogeschool Zuyd. Betaald. |
Geen |
|
Kruitwagen-van Reenen |
Revalidatiearts UMCU |
Voorzitter IKNL Richtlijn ALS. Expertisecentrum ALS. |
Geen |
Geen |
|
Vroom |
Directeur Duchenne Parent Project (fulltime) |
Voorzitter World Duchenne Organisation (UPPMD) onbezoldigd |
geen |
Geen |
|
Nawijn |
80% 4dagen werkzaam als revalidatiearts (kinderrevalidatie) en medisch manager binnen Roessingh Centrum voor Revalidatie, te Enschede |
Geen |
Geen |
Geen |
|
Straathof |
Neuroloog LUMC, aandachtsgebied neuromusculaire ziekten |
Medisch coördinator multidisciplinair zorgpad jong volwassenen met Duchenne spierdystrofie |
PI Sideros trial en DELOS trial en SYROS studie: Idebenone bij Duchenne MD sponsor is firma Santhera. SI bij diverse andere medicatietrials voor DMD |
Geen, de onderzoeken gefinancierd door farmaceutische bedrijven zijn niet gerelateerd aan de onderwerpen in deze richtlijn. |
|
Erasmus |
kinderneuroloog Radboudumc, aandachtsgebied neuromusculaire ziekten en slikstoornissen |
|
Consultancy voor Eurocept Group Nederland
Grant PBS voor landelijke studie naar FSHD bij kinderen
Medisch adviseur Moebius Stichting Nederland Medisch adviseur diagnose werkgroep congenitale myopathieen en werkgroep myotone dystrofie (Spierziekten Nederland) |
Deelname zoals gebruikelijk, met uitzondering van de module met betrekking tot slikken. Was niet betrokken bij deze vraag.
|
|
van den Engel |
Logopediewetenschapper, universitair docent afdeling Revalidatie Radboudumc, Nijmegen |
Patiëntenzorg, betaald |
Geen |
Geen |
|
Niks |
Neuroloog in het Leids Universitair Medisch Centrum |
Ad hoc wetenschappelijk advies voor BioMarin, PTC Therapeutics en Summit Therapeuctics. |
Lokale (hoofd)onderzoeker in het LUMC voor klinisch trials uitgevoerd in samenwerking met WAVE Life Sciences, Roche, Italfamaco, Santhera, Lilly, Prosensa, GSK en BioMarin, NS-Pharma en Sarepta.
Medisch adviseur voor Spierziekten Nederland. |
Geen, de onderzoeken gefinancierd door farmaceutische bedrijven zijn niet gerelateerd aan de onderwerpen in deze richtlijn. |
|
Van Heeswijk |
Ergotherapeut St. Maartenskliniek 20 uur pw |
Ergotherapeut, behandelend, betaald |
Geen |
Geen. Mevr. Van Heeswijk heeft mevr. Van Elzen vervangen tijdens de eerste Werkgroepvergadering. |
|
Renkens |
Orthopedisch chirurg, subspecialisme Spinale chirurgie, Erasmus MC |
Geen |
Geen |
Geen |
|
Hendriksen |
Kempenhaeghe centrum voor neurologische leerstoornissen (0,8 fte), |
Geen |
Externe financiering van twee fondsen (onderzoeksgelden): |
Geen |
|
Wijkstra |
Longarts, UMCG |
Geen |
Geen |
Geen |
|
Balemans |
Adviseur Kennisinstituut |
Onderzoeker VU Medisch Centrum, afdeling revalidatiegeneeskunde en Revalidatiecentrum De Hoogstraat. Onbetaalde functie; alleen het afronden van publicaties over inspanningsfysiologie binnen de revalidatie. |
Geen belangenverstrengeling. De onderzoeken waar ik nog bij betrokken ben worden gesubsidieerd door Fonds Nutsohra of La Fondation Motrice. |
Geen actie nodig. |
|
Persoon |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Tot oktober 2018 Gastvrijheidsaanstelling afdeling Revalidatie Academisch Medisch Centrum, Amsterdam, in verband met promotietraject. Project: Physical fitness to improve fitness and combat fatigue in patients with multiple myeloma or lymphoma treated with high dose chemotherapy.
April 2018-september 2018: Docent Team Technologie, Fontys Paramedische Hogeschool. Begeleiden van studenten bij afstudeerstages. Max 1 dag in de week, betaald. |
Geen, promotieonderzoek werd gefinancierd door KWF, financier had geen invloed op uitkomsten onderzoek of op huidige werkzaamheden. |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door participatie van Spierziekten Nederland en Duchenne Parent Project in de werkgroep. Voorafgaand aan de Invitational conference is door Spierziekten Nederland en Duchenne Parent Project ook een vragenlijst afgenomen bij familieleden (n=59) van patiënten met DMD (de belangrijkste resultaten zijn opgenomen in het verslag van de invitational conference) en is een focusgroep georganiseerd waarin de aanbevelingen besproken zijn met ouders van patiënten met Duchenne spierdystrofie. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Spierziekten Nederland, Duchenne Parent Project en Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor patiënten met DMD. Tevens zijn er knelpunten aangedragen door Duchenne Parent project, Spierziekten Nederland, V&VN, NVD, Duchenne Centrum Nederland, NVN, EN, KNGF, VSCA/NVALT, NAPA, VRA, NVVC en IGJ tijdens een Invitational conference. Een verslag hiervan is opgenomen in de bijlagen.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risico op bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1946 – april 2019
|
1 exp Muscular Dystrophy, Duchenne/ or duchenne.ti,ab,kw. (11423) 2 exp *Exercise/ or exp "activities of daily living"/ or exp exercise therapy/ or exp Kinesiology, Applied/ or exercise*.ti,kw. or physiotherap*.ti,kw. or ((physical or occupational) adj2 (therap* or activit*)).ti,ab,kw. or ((muscle* or exercise* or concentric or eccentric) adj2 (strength* or power)).ti,ab,kw. or kinesiolog*.ti,ab,kw. or ((aerobic or anaerobic or sprint or 'high intensity') adj2 (exercise* or training)).ti,ab,kw. or endurance.ti,kw. or (activit* adj3 'daily living').ti,ab,kw. or 'functional skill*'.ti,kw. or training.ti,kw. or sport*.ti,kw. or gaming.ti,kw. (540161) 3 1 and 2 (647) 4 limit 3 to english language (606) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (390300) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1849815) 7 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3165806) 8 4 and 5 (17) 9 4 and 6 (137) 10 4 and 7 (155) 11 8 or 9 or 10 (252)
= 252 (250 uniek) |
340 |
|
Embase (Elsevier) |
('duchenne muscular dystrophy'/exp OR duchenne:ab,ti)
AND ('exercise'/exp/mj OR 'physiotherapy'/exp/mj OR exercise*:ti OR physiotherap*:ti OR (((physical OR occupational) NEAR/2 (therap* OR activit*)):ab,ti) OR (((muscle* OR exercise* OR concentric OR eccentric) NEAR/2 (strength* OR power)):ab,ti) OR 'kinesiology'/exp/mj OR kinesiolog*:ab,ti OR (((aerobic OR anaerobic OR sprint OR 'high intensity') NEAR/2 (exercise* OR training)):ab,ti) OR endurance:ti OR ((activit* NEAR/3 'daily living'):ab,ti) OR 'functional skill*':ti OR training:ti OR sport*:ti OR gaming:ti)
AND (english)/lim NOT 'conference abstract':it
Gebruikte filters:
Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it
Observationeel onderzoek: ‘major clinical study’/exp OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)
= 225 (219 uniek) |
