Tocolyse bij dreigende vroeggeboorte
Uitgangsvraag
1 Reduceert 48 uur behandelen met tocolytica (om de werking van corticosteroïden te optimaliseren) van vrouwen met een dreigende vroeggeboorte de kans op morbiditeit en mortaliteit van het kind?
2 β-sympathicomimetica
a. Wat is de effectiviteit t.a.v. verlenging van de zwangerschapsduur?
b. Wat zijn de bijwerkingen van tocolytica bij het kind?
c. Wat zijn de bijwerkingen van tocolytica bij de moeder?
d. Reduceert het langer dan 48 uur behandelen met tocolytica van vrouwen met een dreigende vroeggeboorte de kans op morbiditeit en mortaliteit van het kind?
3 Calciumantagonisten
a. Wat is de effectiviteit t.a.v. verlenging van de zwangerschapsduur?
b. Wat zijn de bijwerkingen van tocolytica bij het kind?
c. Wat zijn de bijwerkingen van tocolytica bij de moeder?
d. Reduceert het langer dan 48 uur behandelen met tocolytica van vrouwen met een dreigende vroeggeboorte de kans op morbiditeit en mortaliteit van het kind?
4 Oxytocinereceptorantagonisten
a. Wat is de effectiviteit t.a.v. verlenging van de zwangerschapsduur?
b. Wat zijn de bijwerkingen van tocolytica bij het kind?
c. Wat zijn de bijwerkingen van tocolytica bij de moeder?
d. Reduceert het langer dan 48 uur behandelen met tocolytica van vrouwen met een dreigende vroeggeboorte de kans op morbiditeit en mortaliteit van het kind?
5 Prostaglandinesynthetaseremmers
a. Wat is de effectiviteit t.a.v. verlenging van de zwangerschapsduur?
b. Wat zijn de bijwerkingen van tocolytica bij het kind?
c. Wat zijn de bijwerkingen van tocolytica bij de moeder?
d. Reduceert het langer dan 48 uur behandelen met tocolytica van vrouwen met een dreigende vroeggeboorte de kans op morbiditeit en mortaliteit van het kind?
6 Magnesiumsulfaat
a. Wat is de effectiviteit t.a.v. verlenging van de zwangerschapsduur?
b. Wat zijn de bijwerkingen van tocolytica bij het kind?
c. Wat zijn de bijwerkingen van tocolytica bij de moeder?
d. Reduceert het langer dan 48 uur behandelen met tocolytica van vrouwen met een dreigende vroeggeboorte de kans op morbiditeit en mortaliteit van het kind?
7 Stikstofmonoxidedonoren.
a. Wat is de effectiviteit t.a.v. verlenging van de zwangerschapsduur?
b. Wat zijn de bijwerkingen van tocolytica bij het kind?
c. Wat zijn de bijwerkingen van tocolytica bij de moeder?
d. Reduceert het langer dan 48 uur behandelen met tocolytica van vrouwen met een dreigende vroeggeboorte de kans op morbiditeit en mortaliteit van het kind?
8 Tocolyse bij dreigende vroeggeboorte voor 28 weken
Aanbeveling
Onderzoek
De waarde van weeënremming bij dreigende vroeggeboorte tussen de 30 en 34 weken werd onderzocht in de APOSTEL 8 studie. De inclusieperiode is afgerond. De NVOG is in afwachting van de resultaten van de studie die begin 2025 worden verwacht. Zie voor informatie over de studie www.zorgevaluatienederland.nl.
Bij een spontane dreigende vroeggeboorte < 34+0 weken waarbij de bevalling binnen 2-10 dagen verwacht wordt, is tocolyse geïndiceerd voor het laten inwerken van de corticosteroïden en/of het overplaatsen van de patiënte naar een perinatologisch centrum (dit laatste is in de regel tot 32 weken).
Onderhoudsbehandeling met tocolyse is niet geïndiceerd.
Bij de keuze voor een tocolyticum zijn nifedipine en atosiban gelijkwaardig. op basis van het bijwerkingenprofiel heeft atosiban mogelijk een lichte voorkeur bij gecompliceerde zwangerschappen.
Overwegingen
-
- Studies over tocolyse en vroeggeboorte zijn lastig te analyseren aangezien er maar weinig placebogecontroleerde studies zijn en vergelijkende studies vaak niet goed zijn opgezet of te weinig power hebben. Veel van de studies hebben daarom een hoge kans op vertekening door selectie-, performance-, attrition- (selectieve uitval van patiënten) en detectiebias(Peltoniemi 2007).
- Voor geen van de onderzochte tocolytica werd een significante verbetering in neonatale uitkomst vastgesteld. Derhalve blijft er twijfel bestaan over het nut van tocolyse. De werkgroep is van mening dat tocolyse waarschijnlijk nuttig is voor het kortdurend verlengen van de zwangerschapsduur om corticosteroïden in te kunnen laten werken en de mogelijkheid te genereren om patiënte (indien nodig) over te plaatsen naar een derdelijnscentrum.
- De andere onderzochte middelen zijn vergelijkbaar in effectiviteit voor het verlengen van de zwangerschapsduur. De werkgroep heeft voor het bepalen van een middel van voorkeur de voor- en nadelen afgewogen:
- Bètasympathicomimetica: hebben de meeste bijwerkingen en zijn daardoor niet eerste keus.
- Nifedipine: veelgebruikt in Nederland, bestaat ervaring mee. Geen ongunstige kortetermijneffecten op het kind gerapporteerd. Langetermijneffecten op het kind zijn onbekend (op 9-jarige leeftijd geen verschil met ritodrine). Ernstige bijwerkingen zijn niet gerapporteerd. Wel gaat gebruik van nifedipine soms gepaard met hypotensie, misselijkheid, hoofdpijn, palpitaties en gastro-intestinale bijwerkingen. (de Heus 2009, Al-Omari 2006, Sanu 2010, Lyndrup 2007).
- Atosiban: het effect op verlenging van de zwangerschapsduur werd in eerdere cochranereviews niet aangetoond. In de meta-analyse van Haas wel (Haas 2009). Het middel is geregistreerd voor tocolyse in Nederland en er is ervaring mee. Kortetermijneffecten zijn niet verschillend van placebo. Langetermijneffecten zijn onbekend. De kosten van atosiban zijn aanzienlijk hoger dan die van nifedipine.
- Magnesiumsulfaat: het effect op verlenging van de zwangerschapsduur werd in eerdere cochranereviews niet aangetoond (Crowther 2002). In de meta-analyse van Haas wel.
- Prostaglandinesynthetaseremmers: lijken de effectiefst tocolytica. Alleen te gebruiken voor 32 weken wegens verhoogd risico op voortijdig sluiten van de ductus Botalli. Tegenstrijdige evidence over risico op periventriculaire leukomalacie en necrotiserende enterocolitis, waardoor enige terughoudendheid geboden lijkt. In RCT’s is deze samenhang niet aangetoond.
- Stikstofmonoxidedonoren: onvoldoende gegevens om dit middel aan te bevelen voor tocolyse.
- Een probleem van het gebruik van enkele tocolytica zoals nifedipine, magnesiumsulfaat en indometacine is dat deze middelen niet voor deze indicatie geregistreerd zijn. Wel is het zo dat middelen die in richtlijnen geadviseerd worden, gedoogd worden. In tabel 1 zijn mogelijke doseringsschema’s weergegeven (samenvatting literatuur).
- Recente ontwikkelingen die meegewogen kunnen worden bij het starten van medicatie voor tocolyse zijn de analyse van bijwerkingen (de Heus 2009), het groeiende marktaandeel van atosiban (gezien de registratie, de kans op minder bijwerkingen bij vrouwen met reeds andere zwangerschapscomplicaties) en de te verwachte resultaten van de APOSTEL-studie. Het aantal verwijzingen naar perinatologische centra die reeds behandeld worden met atosiban stijgt. In het algemeen is het niet gebruikelijk dan de therapiekeuze te wijzigen.
- Het is logisch dat patiënten een langere periode van tocolyse vaak zelf wenselijker vinden dan stoppen na 48 uur. Goede uitleg over de geringe en slechts kortdurende effectiviteit van weeënremming is van belang.
- Hypertensie: indien zich bij een patiënte met een hypertensieve aandoening van de zwangerschap een spontane dreigende vroeggeboorte ontwikkelt, is het onwaarschijnlijk dat tocolyse zinnig is, aangezien hierbij niet zelden een indicatie voor het beëindigen van de zwangerschap bestaat op basis van maternale morbiditeit en foetale risico’s.
- Bloedverlies en contracties: vaginaal bloedverlies (‘randvenebloeding’) is geen absolute contra-indicatie om de eventuele daaropvolgende uteruscontracties te remmen. Onduidelijk is of dit een vroeggeboorte voorkomt en of het zinnig is om de foetale uitkomst te verbeteren. Bij een placenta praevia worden geen middelen gegeven die invloed hebben op circulatie (dus alleen atosiban). Abruptio placentae wordt in Nederland over het algemeen als contra-indicatie voor weeënremming beschouwd.
- Er is zeer weinig onderzoek naar langetermijneffecten op het alsnog te vroeggeboren kind, en ook naar de groep die behandeld is, maar nog weken in utero blijft zitten.
- Wanneer bij dreigende vroeggeboorte magnesiumsulfaat gegeven wordt als neuroprotectivum voor het kind (zie hoofdstuk 7), kan de combinatie met tocolyse van invloed zijn op de keuze van het tocolyticum. Er werd een systematische search gedaan naar de effectiviteit en veiligheid van de verschillende tocolytica in combinatie met magnesiumsulfaat in de zwangerschap. Van de 88 gevonden artikelen bleek er niet 1 relevant voor onze onderzoeksvraag. Ook in de door apothekers veelgebruikte informatiebronnen zoals het Farmacotherapeutisch kompas en het Informatorium medicamentorum wordt de combinatie van de verschillende tocolytica met magnesiumsulfaat niet als bekende interactie genoemd. In een derde (Amerikaanse) database, Micromedex, wordt wel een interactie vermeld, namelijk een versterking van het hypotensieve effect en mogelijke neuromusculaire blokkade. Gegevens zijn afgeleid uit 3 cases (onderbouwing/evidence tabellen).
- Het hoofdstuk beperkt zich tot eenlingzwangerschappen. De situatie bij meerlingen behoeft speciale aandacht. Hoewel een significant verband nooit is aangetoond, wordt in de literatuur gesuggereerd dat meerlingzwangerschappen een hoger risico hebben op complicaties bij tocolyse dan eenlingzwangerschappen. Een Nederlands cohortonderzoek met 441 meerlingzwangerschappen vond een relatief risico van 1,5 (95%-BI 0,39-5,0). In deze studie werden in de totale groep van 441 meerlingen 4 ernstige complicaties waargenomen, waarvan 2 met nifedipinegebruik en 2 met gecombineerd tocolyticumgebruik (De Heus 2009).
Onderbouwing
Achtergrond
Gezien de samenhang van vroeggeboorte (gedefinieerd als geboorte vóór 37 weken amenorroeduur) met verhoogde neonatale morbiditeit en mortaliteit, lijkt het in principe nuttig om bij dreigende vroeggeboorte (uteruscontracties met cervixveranderingen) de zwangerschapsduur te verlengen door toediening van weeënremmende medicatie (tocolytica). Er worden wereldwijd verschillende tocolytica gebruikt (β-sympathicomimetica, magnesiumsulfaat, stikstofmonoxidedonoren, calciumantagonisten, oxytocinereceptorantagonisten en prostaglandinesynthetaseremmers). Dit hoofdstuk bespreekt de effectiviteit van behandeling met tocolyse bij dreigende vroeggeboorte op de zwangerschapsuitkomst. Ook komen de bijwerkingen op moeder en kind aan bod, uitgesplitst voor de verschillende tocolytica.
Voor beantwoording van deze vraag werd gebruikgemaakt van nationale (NVOG 2004) en internationale richtlijnen uit de Verenigde Staten (ICSI 2009, ACOG 2007) en het Verenigd Koninkrijk (RCOG 2007). Bovendien werd gezocht in de Cochrane Library en PubMed.
Conclusies / Summary of Findings
|
Niveau 1 |
Bij de behandeling van dreigende vroeggeboorte is tocolyse (tot 48 uur) effectief voor het kortdurend uitstellen van de partus. Van de verschillende groepen tocolytica (bèta-sympathicomimetica, calciumantagonisten, oxytocinereceptorantagonisten, prostaglandinesynthetaseremmers en magnesiumsulfaat) lijken de prostaglandinesynthetaseremmers het effectiefst voor weeënremming tussen de 28 en 32 weken.
Bewijskrachtniveau A1 (Haas 2009) |
|
Niveau 1 |
Voor geen van de onderzochte tocolytica werd een significant effect gevonden op de neonatale morbiditeit en prevalentie van RDS tussen de 28 en 32 weken AD.
Bewijskrachtniveau A1 (Haas 2009)
Er zijn aanwijzingen dat calciumantagonisten vergeleken met andere tocolytica (voornamelijk bètamimetica) effectiever zijn in het reduceren van neonatale RDS, necrotiserende enterocolitis, intraventriculaire hemorragie en neonatale icterus.
Bewijskrachtniveau A2 (King 2005) |
|
Niveau 1 |
Met uitzondering van bètasympathicomimetica waren er geen grote verschillen tussen de groepen wat betreft de maternale bijwerkingen.
Bewijskrachtniveau A1 (Haas 2009) |
|
Niveau 2 |
De eerder beschreven effecten op het voortijdig sluiten van de ductus Botalli bij gebruik van prostaglandinesynthetaseremmers werden niet teruggevonden in meta-analyses. Wel werd een verhoogd risico periventriculaire leukomalacie en necrotiserende enterocolitis gevonden.
Bewijskrachtniveau A2 (Amin 2009) |
|
Niveau 4 |
Gegevens over effectiviteit en bijwerkingen van tocolyse bij dreigende extreme vroeggeboorte (< 28 weken) zijn niet beschikbaar. |
|
Niveau 2 |
Behandeling met tocolyse als onderhoudstherapie langer dan 48 uur bij kinderen boven de 26 weken is niet effectief gebleken voor het verbeteren van perinatale uitkomsten.
Bewijskrachtniveau A2 (Thornton 2005, Berkman 2003, Sanchez-Ramos 1999). |
|
Niveau 2 |
Gelijktijdig toediening van verschillende soorten tocolytica gaat samen met een verhoogd risico op ernstige maternale bijwerkingen.
Bewijskrachtniveau A2 (De Heus 2009) |
Samenvatting literatuur
1 Reduceert 48 uur behandelen met tocolytica (om de werking van corticosteroïden te optimaliseren) van vrouwen met een dreigende vroeggeboorte de kans op morbiditeit en mortaliteit van het kind?
In een meta-analyse uit 2009 (58 RCT’s, zie evidencetabel) worden verschillende groepen tocolytica (bètamimetica, calciumantagonisten, magnesiumsulfaat, oxytocinereceptorantagonisten, prostaglandinesynthetaseremmers en stikstofmonoxidedonoren) niet alleen met placebo of geen behandeling vergeleken, maar ook met elkaar. Studies over vrouwen met een dreigende vroeggeboorte tussen 28 en 32 weken werden geïncludeerd. De studies werden individueel bekeken en de onderzochte cohorten bij elkaar genomen, waarna deze werden vergeleken met een ‘random effects model’ om bias van heterogeniteit zo veel mogelijk te beperken. Hierna werd gestratificeerd voor gebroken of staande vliezen en voor eenling- of meerlingzwangerschappen, waarna alleen de resultaten voor staande vliezen en eenlingzwangerschappen werden geanalyseerd voor de meta-analyse. Er werd geen onderscheid gemaakt in behandelingsschema en duur van de behandeling (kortdurende behandeling of onderhoudsbehandeling). Voor de neonatale uitkomst werden alleen studies geïncludeerd waarvan zeker was dat ook corticosteroïden antenataal toegediend waren.
Gevonden resultaten toonden dat alle onderzochte tocolytica effectiever waren dan placebo of geen therapie voor het verlengen van de zwangerschapsduur tot 48 uur (53% voor placebo versus 75–93% voor tocolytica) en tot 7 dagen (39% voor placebo versus 61–78% voor tocolytica) na start van de behandeling. Voor geen van de tocolytica werd een significant resultaat gevonden ten aanzien van neonatale uitkomsten (RDS, neonatale overleving). Prostaglandinesynthetaseremmers waren significant effectiever in het verlengen van de zwangerschapsduur tot 48 uur dan bètamimetica. Voor de overige tocolytica en uitkomstmaten was de effectiviteit niet significant verschillend, behoudens dat bètasympathicomimetica gepaard gingen met significant meer bijwerkingen dan de overige tocolytica of placebo (zie overzicht tabel 1 en fig. 1) (Haas 2009).Opgemerkt dient te worden dat voor geen van de tocolytica een significant effect op neonatale uitkomsten (neonatale sterfte, RDS) werd gevonden, ten opzicht van placebo.
Tabel 1 Effectiviteit en toxiciteit van tocolytica (gewogen percentages) (bron Haas 2006)
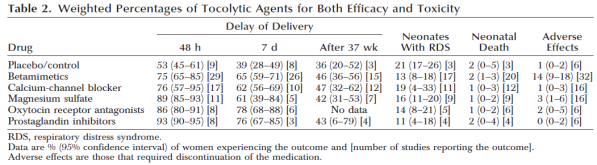
Fig. 1 Effectiviteit en toxiciteit van tocolytica (gewogen percentages) (bron Haas 2006)
|
De beschikbare evidence wordt in het onderstaande gepresenteerd voor de verschillende tocolytica voor kortetermijneffectiviteit, onderhoudstherapie en bijwerkingen op kind en moeder.
2 β-adrenerge receptoragonisten
( ritodrine, fenoterol, isoxsuprine, terbutaline, salbutamol, orciprenaline)
a. Effectiviteit van β-adrenerge receptoragonisten voor verlenging van de zwangerschapsduur
Bovenstaande meta-analyse includeerde 39 studies over het effect van β-adrenerge receptoragonisten versus placebo, geen behandeling of andere tocolytica. De 2567 vrouwen hadden bij randomisatie een gemiddelde amenorroeduur van 29,6 weken. β-adrenerge receptoragonisten waren significant effectiever in het verlengen van de zwangerschap tot 48 uur en tot 7 dagen dan placebo of geen behandeling, maar niet voor uitstellen van de geboorte tot na 37 weken (zie tabel 1 voor gewogen percentages) (Haas 2009).
b. Wat zijn de bijwerkingen van β-adrenerge receptoragonisten bij het kind?
De meta-analyse (Haas 2009) toonde geen verschil in neonatale uitkomsten (aantal neonaten met RDS en neonatale sterfte) in beide groepen (zie aanverwant product 'Figuren en tabellen' voor gewogen percentages). Een cochranereview uit 2004 onderzocht ook de neonatale effecten van β-sympathicomimetica als tocolyticum bij dreigende vroeggeboorte ten opzichte van placebo. Er werd ook hierbij geen onderscheid gemaakt in studies die kortdurend tocolyse gaven of als onderhoudsbehandeling. De 11 geïncludeerde trials (1320 vrouwen; merendeel kreeg langer dan 48 uur behandeling, 6 studies behandelde tot 36 of 38 weken AD) toonden geen significant verschil in effect met placebo voor de uitkomstmaten perinatale sterfte (RR 0,84, 95%-BI 0,46-1,55; 7 studies, n = 1332), neonatale sterfte (RR 1,00; 95%-BI 0,48-2,09; 5 studies, n = 1174), of aantal kinderen met respiratory distress syndrome (RDS) (RR 0,87; 95%-BI 0,71-1,08; 8 studies, n = 1239). Ook voor de uitkomsten cerebrale parese, kindsterfte en necrotiserende enterocolitis werd geen verschil in beide groepen gevonden (Anotayanonth 2004).
Er bestaat controverse over de relatie tussen β-sympathicomimetica en intraventriculaire bloedingen (IVH) bij de pasgeborene. De meeste studies concluderen dat β-sympathicomimetica een verlaagd of geen effect hebben op het risico op IVH (Ozcan 1995, Palta 1998, Weintraub 2001), terwijl andere studies een verhoogd risico suggereren (Groome 1992, Papatsonis 2000). De genoemde studies zijn alle retrospectief en hebben daarom een hoge kans op vertekening, vooral ook omdat er zoveel andere interventies zijn durante partu die van invloed kunnen zijn op de neonatale uitkomst.
β-sympathicomimetica passeren de placenta. Effecten die bij de moeder optreden, zoals tachycardie, kunnen ook bij de foetus optreden. Een studie waarin ritodrine werd vergeleken met atosiban toonde een verhoogd foetaal hartritme en verminderde variabiliteit van het hartritme bij ritodrinegebruik (Neri 2009).Een RCT waarin ritodrine werd vergeleken met nifedipine onderzocht bovendien de langetermijneffecten op het kind en toonde geen significante verschillen in psychosociale en motorische uitkomsten bij een gemiddelde leeftijd van 9 jaar (Houtzager 2006).
c. Wat zijn de bijwerkingen van β-adrenerge receptoragonisten bij de moeder?
Verschillende studies over bètamimetica als tocolyticum rapporteren dat behandeling met β-adrenerge receptoragonisten significant vaker gepaard gaat met dusdanig ernstige maternale bijwerkingen dat de behandeling gestaakt moest worden of patiënte overgezet op een ander tocolyticum (Haas 2009, Anotayanonth 2004, Dodd 2006, Van de Water 2008).
In bovengenoemde review hing de behandeling met β-sympathicomimetica significant samen met het staken van de behandeling wegens bijwerkingen, pijn op de borst, dyspnoe, tachycardie, palpitaties, tremor, hypokaliëmie, hyperglykemie, misselijkheid en braken, nasale verstopping en foetale tachycardie (Dodd 2006).
d. Reduceert het langer dan 48 uur behandelen met β-adrenerge receptoragonisten van vrouwen met een dreigende vroeggeboorte de kans op morbiditeit en mortaliteit van het kind?
Een cochranereview vergeleek onderhoudstherapie van orale β-sympathicomimetica met andere tocolytica, placebo of geen behandeling (Dodd 2006). In totaal werden 11 studies over 1238 vrouwen geïncludeerd. Het aantal vroeggeboorten (< 37 weken) was niet significant verschillend in 4 RCT’s waarvan er 2 ritodrine met placebo of geen behandeling vergeleken, en twee terbutaline met placebo of geen behandeling (RR 1,08; 95%-BI 0,88-1,32, over 384 vrouwen). Er werd geen verschil gezien in het aantal opnamen op de NICU als bètamimetica vergeleken werden met placebo (RR 1,29; 95%-BI 0,64-2,60; 1 RCT over terbutaline, 140 vrouwen) of met magnesium (RR 0,80; 95%-BI 0,43-1,46; 1 RCT over 137 vrouwen). Er werden geen verschillen gezien tussen bètamimetica en placebo, geen behandeling, of andere tocolytica voor de uitkomstmaten perinatale mortaliteit en morbiditeit. Sommige ongunstige effecten zoals tachycardie werden vaker gezien in de bètamimeticagroep dan in een van de andere groepen (Dodd 2006). De conclusie dat wetenschappelijk onderzoek onderhoudstherapie met bètamimetica niet ondersteunt, houdt stand na beoordeling van een nog nadien gepubliceerde RCT(Matijevic 2006).
3 Calciumantagonist (nifedipine)
a. Wat is de effectiviteit van calciumantagonisten (voor tocolyse) t.a.v. verlenging van de zwangerschapsduur?
De meta-analyse van Haas et al includeerde 20 studies. De 868 vrouwen hadden bij randomisatie een gemiddelde amenorroeduur van 30,6 weken. Calciumantagonisten waren significant effectiever in het verlengen van de zwangerschap tot 48 uur en tot 7 dagen dan placebo of geen behandeling, maar niet voor het uitstellen van de geboorte tot na 37 weken (zie aanverwant tabel 1 voor gewogen percentages).
b. Wat zijn de bijwerkingen van calciumantagonisten (voor tocolyse) bij het kind?
De meta-analyse toonde geen significant verschil in neonatale uitkomsten (aantal neonaten met RDS en neonatale sterfte) tussen calciumantagonisten en placebo, of een van de andere tocolytica (zie tabel 1 voor gewogen percentages) (Haas 2006).
Een cochranereview van King et al. vergeleek calciumantagonisten met andere tocolytica en includeerde 12 RCT’s (n = 1029)(King 2003). Vergeleken met andere tocolytica (voornamelijk bètamimetica) waren calciumantagonisten effectiever in het reduceren van neonatale RDS (RR 0,63; 95%-BI 0,46-0,88), necrotiserende enterocolitis (RR 0,21; 95%-BI 0,05-0,96), intraventriculaire hemorragie (RR 0,59; 95%-BI 0,36-0,98) en neonatale icterus (RR 0,73; 95%-BI 0,57-0,93).
Overige bijwerkingen: Kortetermijnfollow-up liet geen nadelige effecten op de pasgeborene zien. Langetermijnfollow-up ontbreekt. De belangrijkste zorg is dat calciumantagonisten potentieel de doorstroming van de uteriene bloedvaten en navelstrengbloedvaten verminderen. Dierstudies tonen een afname in bloeddoorstroming van de uterus, en een afgenomen foetale zuurstofsaturatie bij toediening van calciumantagonisten, maar dit is niet aangetoond in studies bij mensen en bovendien bleken studies over doppleronderzoek van de navelstreng- en uteroplacentaire bloeddoorstroming bij de mens geruststellend (Ray 1995).Bij het gebruik van lage doseringen voor hypertensie tijdens de zwangerschap zijn geen nadelige effecten op kinderen gevonden (Bortolus 2000). Op basis van het pathofysiologisch mechanisme is bij vrouwen met hypertensie toch voorzichtigheid geboden bij gebruik van nifedipine als tocolyticum gezien de potentieel snelle bloeddrukdaling bij deze populatie.
b. Wat zijn de bijwerkingen van calciumantagonisten (voor tocolyse) bij de moeder?
Nifedipine is een perifere vasodilatator en kan zorgen voor klachten van opvliegers, hoofdpijn, duizeligheid en palpitaties. De meta-analyse van Haas toonde dat bij behandeling met calciumantagonisten niet vaker dusdanig ernstige bijwerkingen gerapporteerd werden dat de behandeling gestaakt moest worden, dan bij de placebogroep of de overige tocolytica. Een uitzondering hierop zijn bètamimetica die significant meer bijwerkingen gaven (Haas 2009). De cochranereview van King vergeleek calciumantagonisten met alle andere tocolytica en vond dat bij vrouwen uit de eerste groep minder vaak de noodzaak bestond om de behandeling te staken wegens bijwerkingen (RR 0,14; 95%-BI 0,05-0,36)(King 2003). In een prospectief cohortonderzoek uitgevoerd in Nederland en België traden bij nifedipinegebruik voor tocolyse in 0,9% van de gevallen complicaties op die als serieus gedefinieerd waren (hypotensie, dyspnoe, longoedeem, hypoxie), en bij 1,1% lichte complicaties(waardoor de medicatie gestaakt moest worden). In vergelijking met atosiban werden significant vaker bijwerkingen gezien (RR 12; 95%-BI 1,9-69; n = 542) (De Heus 2009), conform een andere vergelijkende studie (Al-Omari 2006).
Maternale complicaties van nifedipine kunnen optreden bij cardiovasculair gecompromitteerde vrouwen (hypertensie, congenitale hartafwijkingen, pulmonale hypertensie, geleidingsstoornissen of linksdecompensatie). Gelijktijdig gebruik van nifedipine en β-sympathicomimetica wordt sterk afgeraden (de Heus 2009). Sublinguale toediening en kauwen van nifedipine wordt afgeraden wegens de mogelijkheid van maternale hypotensie, in het bijzonder bij (relatief) ondervulde patiënten en bij foetus met een verslechterde navelstrengdoorbloeding (van Veen 2005, Nassar 2007).In de eerder genoemde cochranereview (King 2003) kwam deze complicatie bij de 833 geïncludeerde vrouwen (met vrijwel uitsluitend eenlingzwangerschappen) niet voor.
Bij gecombineerd gebruik met magnesiumsulfaat (als anticonvulsivum of neuroprotectivum) kan hypotensie optreden. Sequentieel toediening wordt daarom aangeraden.
d. Reduceert het langer dan 48 uur behandelen met calciumantagonisten van vrouwen met een dreigende vroeggeboorte de kans op morbiditeit en mortaliteit van het kind?
Twee systematische reviews (Meirowitz 1999; Sanchez-Ramos 1999) en een cochranereview (Gaunekar 2004) over onderhoudstherapie met nifedipine concluderen aan de hand van een klein aantal studies (respectievelijk 7, 12 en 1) dat er onvoldoende betrouwbare evidence bestaat over de effectiviteit van onderhoudsbehandeling met nifedipine voor de neonatale uitkomst. Ook een nadien gepubliceerde vergelijkende studie had onvoldoende power (n = 71) om een verschil in effect aan te kunnen tonen (Lyell 2008).Onlangs is in Nederland de APOSTEL-II-studie (Roos 2009) afgerond waarin deze onderzoeksvraag door middel van een placebogecontroleerde multicenterstudie gerandomiseerd is uitgezocht bij vrouwen met dreigende vroeggeboorte tussen 26+0 en 32+2 weken amenorroeduur. De resultaten van deze studie zijn bij het schrijven van deze richtlijn nog niet gepubliceerd.
4 Oxytocinereceptorantagonist (atosiban)
a. Wat is de effectiviteit oxytocinereceptorantagonisten (voor tocolyse) t.a.v. verlenging van de zwangerschapsduur?
De meta-analyse van Haas et al includeerde 8 studies. De 1249 vrouwen hadden bij randomisatie een gemiddelde amenorroeduur van 30,1 weken. Oxytocinereceptorantagonisten waren significant effectiever in het verlengen van de zwangerschap tot 48 uur en tot 7 dagen dan placebo of geen behandeling, maar niet voor uitstellen van de geboorte tot na 37 weken (zie tabel 1 voor gewogen percentages) (Haas 2009).
Een cochranereview van Papatsonis uit 2005 kwam tot andere conclusies. Deze studie analyseerde 6 RCT’s (n = 1695 vrouwen) waarin atosiban vergeleken werd met placebo (Papatsonis 2005). Het was in de twee hierin geïncludeerde studies (Goodwin 1994; Romero 2000) mogelijk om naar klinische inschatting van de zorgverlener om patiënten te behandelen met een rescue treatment (ander tocolyticum dan atosiban). Hoewel geen van de gevonden samenhangen statistisch significant waren, ging het gebruik van atosiban gepaard met een verhoogd risico op geboorte binnen 48 uur na start van de behandeling (RR 2,50; 95%-BI 0,51-12,35), verhoogd risico op vroeggeboorte voor 28 weken AD (RR 2,25; 95%-BI 0,80-6,35), en voor 37 weken (RR 1,17; 95%-BI 0,99-1,37). Wanneer atosiban vergeleken werd met een β-sympathicomimetica bleken beide middelen even effectief in het voorkomen van vroeggeboorte binnen 48 uur (RR 0,98; 95%-BI 0,68-1.41) of 7 dagen (RR 0,91; 95%-BI 0,69-1,20) na het starten van de behandeling. Het gebruik van atosiban hing samen met een significant minder vaak staken van de behandeling wegens maternale bijwerkingen (RR 0,04; 95%-BI 0,02-0,11). De studie is echter bekritiseerd omdat er sprake was van een disbalans in allocatie van vrouwen met dreigende vroeggeboorte voor 26 weken: significant meer vrouwen in die subgroep werden toegewezen aan de atosibangroep. Bovendien kregen meer vrouwen in de placebogroep dan in de atosibangroep rescue treatment, waardoor mogelijk sprake is van ‘confounding’. Dit geeft een hoog risico op vertekening, mede omdat criteria voor het wisselen van de therapie niet duidelijk gedefinieerd waren. Ook werd in het protocol niet vastgelegd hoe corticosteroïden gebruikt zouden moeten worden, waardoor aanzienlijke variatie in handelen tussen deelnemende centra optrad. Mogelijk zijn deze beperkingen van de studie een oorzaak voor het gevonden verschil met de meta-analyse van Haas.
b. Wat zijn de bijwerkingen van oxytocinereceptorantagonisten (voor tocolyse) bij het kind?
De meta-analyse van Haas et al. toonde geen significant verschil in neonatale uitkomsten (aantal neonaten met RDS en neonatale sterfte) tussen oxytocinereceptorantagonisten en placebo, of een van de andere tocolytica (zie tabel 1 voor gewogen percentages) (Haas 2006).Ook de cochranereview van Papatsonis vond geen verschil in neonatale mortaliteit en morbiditeit tussen oxytocinereceptorantagonisten en placebo (Papatsonis 2005).
Atosiban passeert de placenta. Er zijn echter geen aanwijzingen dat gebruik ervan neonatale cardiovasculaire of verstoringen in het zuur-basenevenwicht veroorzaakt bij dieren (Greig 1993) of bij mensen (de Heus 2009). Een andere zorg is dat atosiban mogelijk de foetale vasopressinereceptoren zou blokkeren, wat zou kunnen leiden tot verandering in de nierontwikkeling van de foetus, het concentrerend vermogen van de nier, de hoeveelheid en de samenstelling van het vruchtwater, en foetale longontwikkeling. Mogelijk zou het bij de foetus ook het compensatiemechanisme bij stress verstoren, zoals bij hypoxie en hypovolemie. Langetermijneffecten op blootgestelde kinderen zijn niet bekend.
c. Wat zijn de bijwerkingen van oxytocinereceptorantagonisten (voor tocolyse) bij de moeder?
De meest bekende bijwerkingen bij het gebruik van atosiban zijn overgevoeligheid en reacties bij de insteekopening. Cardiovasculaire complicaties zijn niet gerapporteerd. De meta-analyse van Haas et al. toonde geen verschil in bijwerkingen tussen oxytocinereceptorantagonisten en placebo of andere tocolytica, behoudens bètamimetica welke significant meer bijwerkingen gaven. In vergelijking tot de andere geneesmiddelengroepen die gebruikt worden voor tocolyse geeft atosiban significant minder vaak bijwerkingen (zie tekst bij calciumantagonisten), hoewel een grootschalige goed opgezette gerandomiseerde studie met een directe vergelijking tussen atosiban en nifedipine ontbreekt (de Heus 2009; Gyetvai 1999).
d. Reduceert het langer dan 48 uur behandelen met oxytocinereceptorantagonisten van vrouwen met een dreigende vroeggeboorte de kans op morbiditeit en mortaliteit van het kind?
In een cochranereview (Papatsonis 2009) onderzocht men het effect van onderhoudstherapie met oxytocineantagonisten na een episode van dreigende vroeggeboorte, met als doel het uitstellen van de geboorte of het voorkomen van vroeggeboorte. Er werd één studie gevonden (RCT; 513 vrouwen) waaruit bleek dat onderhoudstherapie met atosiban in vergelijking met placebo geen reductie gaf in het aantal vroeggeboorten voor 37 weken (RR 0,89; 95%-BI 0,71-1,12), 32 weken (RR 0,85; 95%-BI 0,47-1,55), of 28 weken (RR 0,75; 95%-BI 0,28-2,01) (Valenzuela 2000). Er werd bovendien geen verschil gezien in beide groepen wat betreft de neonatale morbiditeit of perinatale mortaliteit (Papatsonis 2009).
5 Prostaglandinesynthetaseremmer (indometacine)
a. Wat is de effectiviteit van prostaglandinesynthetaseremmers (voor tocolyse) t.a.v. verlenging van de zwangerschapsduur?
Door remming van de productie van prostaglandinen is het mogelijk de uteruscontractiliteit te verminderen (Vermillion 2001). De meta-analyse van Haas et al. includeerde 12 studies. Zoals eerder vermeld, includeerde men in deze meta-analyse alleen vrouwen met een amenorroeduur van 28 tot 33 weken. De 442 vrouwen hadden bij randomisatie een gemiddelde amenorroeduur van 30,2 weken. Prostaglandinesynthetaseremmers waren significant effectiever in het verlengen van de zwangerschap tot 48 uur en tot 7 dagen dan placebo of geen behandeling, maar niet voor uitstellen van de geboorte tot na 37 weken (zie tabel 1 voor gewogen percentages). Behandeling met prostaglandinesynthetaseremmers werd door de zwangere vrouwen goed geaccepteerd (Haas 2009).
b. Wat zijn de bijwerkingen van prostaglandinesynthetaseremmers (voor tocolyse) bij het kind?
De meta-analyse van Haas et al. toonde geen significant verschil in neonatale uitkomsten (aantal neonaten met RDS en neonatale sterfte) tussen prostaglandinesynthetaseremmers en placebo, of een van de andere tocolytica (zie tabel 1 voor gewogen percentages).Het beste bewijs zijn RCT’s waarin indometacine wordt vergeleken met een placebo. Daar zijn er maar weinig van en het aantal inclusies is relatief laag. Er is wel een cochranereview uit 2005 beschikbaar waarin deze RCT’s worden geïncludeerd (13 studies betreffende 713 vrouwen), en waarin geen nadelige effecten op de pasgeborene (risico op IVH, NEC, perinatale sterfte, RDS, voortijdige sluiting van de ductus Botalli, persisterende hypertensie van de pasgeborene en neonataal nierfalen) worden gezien in vergelijking tot placebo of andere tocolytica (King 2005).
Gezien de vele ernstige beperkingen van deze RCT’s hebben Amin et al. een meta-analyse van observationeel onderzoek uitgevoerd. Hierin werden observationele onderzoeken geïncludeerd waarin specifiek de ongunstige neonatale uitkomsten bij gebruik van prostaglandinesynthetaseremmers (al of niet in combinatie met andere tocolytica) werden onderzocht. Het betrof in totaal 15 retrospectieve cohortstudies en 6 patiënt-controlestudies. Antenatale behandeling met indometacine hing samen met een toegenomen risico op periventriculaire leukomalacie (OR 2,0; 95%-BI 1,3-3,1) en bij recente blootstelling ook met necrotiserende enterocolitis (OR 2,2; 95%-BI 1,1-4,2). Er was geen samenhang met intraventriculaire hemorragie, RDS, bronchopulmonaire dysplasie, mortaliteit en doorgankelijke (‘patent’) ductus arteriosus (PDA; 14 studies, 2936 kinderen; OR 1,03; 95%-BI 0,78-1,37) (Amin 2007).Het feit dat prostaglandinesynthetaseremmers niet in alle studies het enige tocolyticum waren, kan een bron van vertekening zijn.
Er is casuïstiek die laat zien dat indometacine mogelijk prematuur de ductus Botalli kan sluiten en sterfte veroorzaakt na 32 weken AD (Moise 1993, Moise 1988). Bovenstaande meta-analyses en een groot aantal cohortstudies met gebruik van indometacine laten echter zien dat het middel naar alle waarschijnlijkheid geen ongewenste neveneffecten heeft (Amin 2007, King 2005).
c. Wat zijn de bijwerkingen van prostaglandinesynthetaseremmers (voor tocolyse) bij de moeder?
Bij 4% van de vrouwen die wegens dreigende vroeggeboorte met prostaglandinesynthetaseremmers behandeld worden, treden gastro-enterale klachten op, zoals misselijkheid, oesofageale reflux, gastritis en braken. Een disfunctie van de trombocyten kan worden waargenomen. Veranderingen in het maternale cardiovasculaire systeem zijn minimaal. Indometacine heeft een grote variatie in halfwaardetijd (1,5-16 uur) door individuele verschillen in enterohepatische circulatie. Er zal dus laag, maar frequent worden gedoseerd. Pre-eclampsie, ulcuslijden, CARA of nierfunctiestoornissen bij de moeder zijn relatieve contra-indicaties. Indometacine kan een maternale infectie maskeren.
d. Reduceert het langer dan 48 uur behandelen met prostaglandinesynthetaseremmers n van vrouwen met een dreigende vroeggeboorte de kans op morbiditeit en mortaliteit van het kind?
Vergelijkende trials over onderhoudsbehandeling met prostaglandinesynthetaseremmers voor tocolyse werden niet gevonden.
6 Magnesiumsulfaat
a. Wat is de effectiviteit van magnesiumsulfaat t.a.v. verlenging van de zwangerschapsduur?
In de meta-analyse van Haas et al. includeerde men 19 studies. De 935 vrouwen hadden bij randomisatie een gemiddelde amenorroeduur van 30,9 weken (Haas 2009). Magnesiumsulfaat was significant effectiever in het verlengen van de zwangerschap tot 48 uur en tot 7 dagen dan placebo of geen behandeling, maar niet voor uitstellen van de geboorte tot na 37 weken (zie Tabel 1 voor gewogen percentages).
In eerder gepubliceerde cochranereviews (23 studies, meer dan 2000 vrouwen) werd geen significant effect van magnesiumsulfaat op verlenging van de zwangerschapsduur tot 48 uur of tot 34 of 37 weken AD gevonden, noch t.o.v. placebo, noch t.o.v. andere tocolytica (Crowther 2002).
b. Wat zijn de bijwerkingen van magnesiumsulfaat (voor tocolyse) bij het kind?
De meta-analyse van Haas et al toonde geen significant verschil in neonatale uitkomsten (aantal neonaten met RDS en neonatale sterfte) tussen magnesiumsulfaat en placebo, of een van de andere tocolytica (zie tabel 1 voor gewogen percentages) (Haas 2006).In de genoemde cochranereview werd wel een verhoogd risico op foetale sterfte en sterfte op de kinderleeftijd (‘pediatric’) waargenomen (RR 2,82 95%-BI 1,20-6,62; 7 studies, 727 kinderen). De twee gevallen van foetale sterfte kwamen uit dezelfde trial (Crowther 2002).
Antenataal kan magnesiumsulfaat leiden tot een lichte daling in de basale foetale hartfrequentie en een verminderde variabiliteit van deze hartfrequentie. Beide zijn echter klinisch niet van betekenis (Atkinson 1994, Hallak 1999). Bij kinderen van moeders die met magnesiumsulfaat behandeld zijn kunnen tekenen van hypermagnesiëmie (Mg > 1,2 mmol/l) worden gezien. De symptomen treden meestal pas op bij Mg-serumwaarden > 2,5 mmol/l. Symptomen kunnen zijn: spierzwakte en daardoor minder goed doorademen, sloomheid, flushing en daarbij hypotensie, voedingsproblemen. Meestal zijn deze symptomen gering, zelden ernstig.
c. Wat zijn de bijwerkingen van magnesiumsulfaat (voor tocolyse) bij de moeder?
De meta-analyse van Haas et al. toonde geen verschil in bijwerkingen tussen magnesiumsulfaat en placebo of andere tocolytica, behoudens bètamimetica, welke significant meer bijwerkingen gaven.
De frequentst gerapporteerde klachten zijn transpireren en opvliegers. Afhankelijk van de serumconcentratie verdwijnt eerst de patellareflex (4-5 mmol/l), treedt een ademdepressie op (ca 6,5 mmol/l) of zelfs een hartstilstand (ca. 13 mmol/l) (richtlijn NVOG).
d. Reduceert het langer dan 48 uur behandelen met magnesiumsulfaat van vrouwen met een dreigende vroeggeboorte de kans op morbiditeit en mortaliteit van het kind?
Een cochranereview includeerde 4 RCT’s over 422 vrouwen. Drie van deze studies hadden een hoog risico op vertekening, en geen van de 4 studies rapporteerde langetermijneffecten. Er werd geen effect aangetoond van onderhoudsbehandeling met magnesiumsulfaat voor het verlengen van de zwangerschapsduur tot 37 weken, of voor perinatale mortaliteit, in vergelijking tot placebo of andere tocolytica (Han 2000).
7 Stikstofmonoxidedonoren (nitraten)
a. Wat is de effectiviteit van stikstofmonoxidedonoren (voor tocolyse) t.a.v. verlenging van de zwangerschapsduur?
Er is momenteel onvoldoende bekend over het gebruik van stikstofmonoxidedonoren als tocolyticum om gebruik ervan te ondersteunen. In de meta-analyse van Haas et al. werd het gebruik van stikstofmonoxidedonoren voor tocolyse niet onderzocht (Haas 2009). Wel is er een cochranereview waarin 5 RCT’s geïncludeerd werden (466 vrouwen)(Duckitt 2002). In al deze studies werd nitroglycerine gebruikt. Nitroglycerine verlengde de zwangerschapsduur niet en gaf ook geen verbetering in neonatale uitkomsten ten opzichte van placebo, geen behandeling, of andere tocolytica zoals ritodrine, albuterol en magnesiumsulfaat.
b. Wat zijn de bijwerkingen van stikstofmonoxidedonoren (voor tocolyse) bij het kind?
Bij hypotensie bestaat in theorie het risico op hypoperfusie van de placenta, maar foetale complicaties zijn vooralsnog niet beschreven. Langetermijneffecten zijn niet onderzocht.
c. Wat zijn de bijwerkingen van stikstofmonoxidedonoren (voor tocolyse) bij het kind?
Stikstofmonoxidedonoren zorgen voor een dilatatie van de gladde spierlaag in de arteriën, waardoor het risico op hypotensie bestaat. Bijwerkingen zijn vrijwel gelijk aan die van calciumantagonisten, bestaande uit duizeligheid, palpitaties en flushing.
d. Reduceert het langer dan 48 uur behandelen met stikstofmonoxidedonoren van vrouwen met een dreigende vroeggeboorte de kans op morbiditeit en mortaliteit van het kind?
Vergelijkende trials over onderhoudsbehandeling met stikstofmonoxidedonoren voor tocolyse werden niet gevonden.
Tocolyse bij dreigende vroeggeboorte voor 28 weken
Zoals eerder genoemd, werden in de meta-analyse van Haas alleen studies geïncludeerd waarin randomisatie tussen 28 en 32 weken plaatsvond. Kinderen geboren bij een zwangerschapsduur van minder dan 26 weken hebben echter een extreem hoog risico op mortaliteit en morbiditeit, en derhalve lijkt het van belang om het effect van tocolyse juist in die groep te analyseren. Hiertoe werd opnieuw in de literatuur gezocht naar studies specifiek over tocolyse bij dreigende vroeggeboorte onder de 28 weken. Ook werden de inclusiecriteria voor zwangerschapsduur bestudeerd van alle individuele studies die geïncludeerd werden in andere systematische (cochrane)reviews over kortdurende tocolyse (Anotayanonth 2004, King 2003, King 2005, Mercer 2009, Papatsonis 2005, Vermillion 2001). Geen van de 63 gevonden studies includeerde specifiek vrouwen met een zwangerschapsduur van minder dan 28 weken. Eén studie over prostaglandinesynthetaseremmers includeerde tussen 24 en 25 weken, echter de studiepopulatie was klein (n = 32) (Niebyl 1980).Zoals eerder vermeld, werd recentelijk in Nederland de APOSTEL-II-studie (Roos 2009) afgerond, waarin door middel van een placebogecontroleerde multicenterstudie gerandomiseerd is uitgezocht wat het effect is van onderhoudsbehandeling met tocolyse (nifedipine) bij vrouwen met een dreigende vroeggeboorte tussen 26+0 en 32+2 weken amenorroeduur. De resultaten van deze studie zijn bij het schrijven van deze richtlijn nog niet gepubliceerd. Het is op basis van de beschikbare literatuur derhalve niet mogelijk een uitspraak te doen over de effectiviteit en bijwerkingen van tocolyse bij extreem prematuren.
Referenties
- ACOG practice bulletin. 2003 guideline Management of preterm labor.
- Al-Omari WR, Al-Shammaa HB, Al-Tikriti EM, Ahmed KW. Atosiban and nifedipine in acute tocolysis: a comparative study. Eur J Obstet Gynecol Reprod Biol 2006 Sep;128(1-2):129-34.
- Amin SB, Sinkin RA, Glantz JC. Metaanalysis of the effect of antenatal indomethacin on neonatal outcomes.Am J Obstet Gynecol. 2007 Nov;197(5):486.e1-10.
- Anotayanonth S, Subhedar NV, Garner P, Neilson JP, Harigopal S. Betamimetics for inhibiting preterm labour. Cochrane Database Syst Rev 2004;(4):CD004352.
- Bortolus R, Ricci E, Chatenoud L, Parazzini F. Nifedipine administered in pregnancy: effect on the development of children at 18 months. BJOG 2000 Jun;107(6):792-4.
- Crowther CA, Hiller JE, Doyle LW. Magnesium sulphate for preventing preterm birth in threatened preterm labour. Cochrane Database Syst Rev 2002;(4):CD001060.
- de Heus R, Mol BW, Erwich JJ, van Geijn HP, Gyselaers WJ, Hanssens M, et al. Adverse drug reactions to tocolytic treatment for preterm labour: prospective cohort study. BMJ 2009;338:b744.
- Dodd JM, Crowther CA, Dare MR, Middleton P. Oral betamimetics for maintenance therapy after threatened preterm labour. Cochrane Database Syst Rev 2006;(1):CD003927.
- Duckitt K, Thornton S. Nitric oxide donors for the treatment of preterm labour. Cochrane Database Syst Rev. 2002;(3):CD002860. Review.
- Feldman S, Karalliedde L. Drug interactions with neuromuscular blockers. Drug Saf 1996 Oct;15(4):261-73.
- Gaunekar NN, Crowther CA. Maintenance therapy with calcium channel blockers for preventing preterm birth after threatened preterm labour. Cochrane Database Syst Rev 2004;(3):CD004071.
- Goodwin TM, Paul R, Silver H, Spellacy W, Parsons M, Chez R, et al. The effect of the oxytocin antagonist atosiban on preterm uterine activity in the human. Am J Obstet Gynecol 1994 Feb;170(2):474-8.
- Greig PC, Massmann GA, Demarest KT, Weglein RC, Holland ML, Figueroa JP. Maternal and fetal cardiovascular effects and placental transfer of the oxytocin antagonist atosiban in late-gestation pregnant sheep. Am J Obstet Gynecol. 1993 Oct;169(4):897-902.
- Grimes DA, Nanda K. Magnesium sulfate tocolysis: time to quit. Obstet Gynecol. 2006 Oct;108(4):986-9.
- Groome LJ, Goldenberg RL, Cliver SP, Davis RO, Copper RL. Neonatal periventricular-intraventricular hemorrhage after maternal beta-sympathomimetic tocolysis. The March of Dimes Multicenter Study Group. Am J Obstet Gynecol. 1992 Oct;167(4 Pt 1):873-9.
- Gyetvai K, Hannah ME, Hodnett ED, Ohlsson A. Tocolytics for preterm labor: a systematic review. Obstet Gynecol 1999 Nov;94(5 Pt 2):869-77.
- Haas DM, Imperiale TF, Kirkpatrick PR, Klein RW, Zollinger TW, Golichowski AM. Tocolytic therapy: a meta-analysis and decision analysis. Obstet Gynecol 2009 Mar;113(3):585-94.
- Han S, Crowther CA, Moore V. Magnesium maintenance therapy for preventing preterm birth after threatened preterm labour.Cochrane Database Syst Rev. 2010 Jul 7;7:CD000940. Review.
- Holleboom CA, Merkus JM, van Elferen LW, Keirse MJ. Randomised comparison between a loading and incremental dose model for ritodrine administration in preterm labour. Br J Obstet Gynaecol 1996 Jul;103(7):695-701.
- Houtzager BA, Hogendoorn SM, Papatsonis DN, Samsom JF, van Geijn HP, Bleker OP, van Wassenaer AG. Long-term follow up of children exposed in utero to nifedipine or ritodrine for the management of preterm labour.BJOG. 2006 Mar;113(3):324-31.
- Institute for Clinical Systems Improvement (ICSI). Management of labor. ICSI 2009
- King JF, Flenady VJ, Papatsonis DN, Dekker GA, Carbonne B. Calcium channel blockers for inhibiting preterm labour. Cochrane Database Syst Rev 2003;(1):CD002255.
- King J, Flenady V, Cole S, Thornton S. Cyclo-oxygenase (COX) inhibitors for treating preterm labour. Cochrane Database Syst Rev 2005;(2):CD001992.
- Lyell DJ, Pullen KM, Mannan J, Chitkara U, Druzin ML, Caughey AB, et al. Maintenance nifedipine tocolysis compared with placebo: a randomized controlled trial. Obstet Gynecol 2008 Dec;112(6):1221-6.
- Lyndrup J, Lamont RF. The choice of a tocolytic for the treatment of preterm labor: a critical evaluation of nifedipine versus atosiban. Expert Opin Investig Drugs. 2007 Jun;16(6):843-53. Review.
- Matijevic R, Grgic O, Vasilj O. Ritodrine in oral maintenance of tocolysis after active preterm labor: randomized controlled trial. Croat Med J 2006 Feb;47(1):25-31.
- Meirowitz NB, Ananth CV, Smulian JC, Vintzileos AM. Value of maintenance therapy with oral tocolytics: a systematic review. J Matern Fetal Med 1999 Jul;8(4):177-83.
- Mercer BM, Merlino AA. Magnesium sulfate for preterm labor and preterm birth. Obstet Gynecol 2009 Sep;114(3):650-68.
- Mittendorf R, Pryde PG, Lee KS. Association between use of antenatal magnesium sulfate in preterm labor and adverse health outcomes in infants. Am J Obstet Gynecol. 2003 Aug;189(2):613. No abstract available.
- Moise KJ Jr. Effect of advancing gestational age on the frequency of fetal ductal constriction in association with maternal indomethacin use. Am J Obstet Gynecol. 1993 May;168(5):1350-3.
- Moise KJ Jr, Huhta JC, Sharif DS, Ou CN, Kirshon B, Wasserstrum N, Cano L. Indomethacin in the treatment of premature labor. Effects on the fetal ductus arteriosus. N Engl J Med. 1988 Aug 11;319(6):327-31.
- Nassar AH, Ghazeeri G, Usta IM. Nifedipine-associated pulmonary complications in pregnancy. Int J Gynaecol Obstet 2007 May;97(2):148-9.
- Nederlandse Vereniging voor Obstetrie en Gynaecologie. Dreigende vroeggeboorte. NVOG richtlijn 2010
- Niebyl JR, Johnson JW. Inhibition of preterm labor. Clin Obstet Gynecol 1980 Mar;23(1):115-26.
- Neri I, Monari F, Valensise H, Vasapollo B, Facchinetti F, Volpe A. Computerized evaluation of fetal heart rate during tocolytic treatment: comparison between atosiban and ritodrine. Am J Perinatol. 2009 Apr;26(4):259-63. Epub 2008 Nov 19.
- Ozcan T, Turan C, Ekici E, Gökmen O, Dogan M, Kaleli B, Uludag H, Karayalçin R. Ritodrine tocolysis and neonatal intraventricular-periventricular hemorrhage. Gynecol Obstet Invest. 1995;39(1):60-2.
- Palta M, Sadek M, Lim TS, Evans M, McGuinness G. Association of tocolytic therapy with antenatal steroid administration and infant outcomes. Newborn Lung Project. Am J Perinatol. 1998 Feb;15(2):87-92.
- Papatsonis DN, Kok JH, van Geijn HP, Bleker OP, Adèr HJ, Dekker GA.Neonatal effects of nifedipine and ritodrine for preterm labor. Obstet Gynecol. 2000 Apr;95(4):477-81.
- Papatsonis D, Flenady V, Cole S, Liley H. Oxytocin receptor antagonists for inhibiting preterm labour. Cochrane Database Syst Rev 2005;(3):CD004452.
- Peltoniemi OM, Kari MA, Tammela O, Lehtonen L, Marttila R, Halmesmaki E, et al. Randomized trial of a single repeat dose of prenatal betamethasone treatment in imminent preterm birth. Pediatrics 2007 Feb;119(2):290-8.
- RCOG guideline (Royal College of Obstetricians and Gynaecologists). Preterm prelabour rupture of membranes. Guideline No. 44: November 2006. http://www.rcog.org.uk/files/rcog-corp/uploaded-files/GT44PretermPrelabourRupture2006.pdf (geraadpleegd augustus 2010)
- Ray D, Dyson D. Calcium channel blockers. Clin Obstet Gynecol. 1995 Dec;38(4):713-21.
- Romero R, Sibai BM, Sanchez-Ramos L, Valenzuela GJ, Veille JC, Tabor B, et al. An oxytocin receptor antagonist (atosiban) in the treatment of preterm labor: a randomized, double-blind, placebo-controlled trial with tocolytic rescue. Am J Obstet Gynecol 2000 May;182(5):1173-83.
- Roos C, Scheepers LH, Bloemenkamp KW, Bolte A, Cornette J, Derks JB, et al. Assessment of perinatal outcome after sustained tocolysis in early labour (APOSTEL-II trial). BMC Pregnancy Childbirth 2009;9:42.
- Sanchez-Ramos L, Kaunitz AM, Gaudier FL, Delke I. Efficacy of maintenance therapy after acute tocolysis: a meta-analysis. Am J Obstet Gynecol 1999 Aug;181(2):484-90.
- Sanu O, Lamont RF. Critical appraisal and clinical utility of atosiban in the management of preterm labor. Ther Clin Risk Manag. 2010 Apr 26;6:191-9.
- Simhan HN, Caritis S. Inhibition of acute preterm labor. Uptodate 2010 May 3.
- Thornton JG. Maintenance tocolysis. BJOG 2005 Mar;112 Suppl 1:118-21.
- Thornton JG. The quality of randomised trials of tocolysis. BJOG 2006 Dec;113 Suppl 3:93-5.
- Valenzuela GJ, Sanchez-Ramos L, Romero R, Silver HM, Koltun WD, Millar L, et al. Maintenance treatment of preterm labor with the oxytocin antagonist atosiban. The Atosiban PTL-098 Study Group. Am J Obstet Gynecol 2000 May;182(5):1184-90.
- Van De Water M, Kessel ET, De Kleine MJ, Oei SG. Tocolytic effectiveness of nifedipine versus ritodrine and follow-up of newborns: a randomised controlled trial. Acta Obstet Gynecol Scand. 2008;87(3):340-5
- van Veen AJ, Pelinck MJ, van Pampus MG, Erwich JJ. Severe hypotension and fetal death due to tocolysis with nifedipine. BJOG 2005 Apr;112(4):509-10.
- Vermillion ST, Landen CN. Prostaglandin inhibitors as tocolytic agents. Semin Perinatol 2001 Aug;25(4):256-62.
- Weintraub Z, Solovechick M, Reichman B, Rotschild A, Waisman D, Davkin O, Lusky A, Bental Y; Israel Neonatal Network. Effect of maternal tocolysis on the incidence of severe periventricular/intraventricular haemorrhage in very low birthweight infants. Arch Dis Child Fetal Neonatal Ed. 2001 Jul;85(1):F13-7.
Evidence tabellen
|
Referentie |
Type studie |
In- en exclusie Criteria (studie/ patiënten) |
Kenmerken (studie/ patiënten) |
Interventie (I) |
Controle (C)
|
Uitkomst maten en follow-up duur |
Resultaten |
Opmerkingen |
Bewijsniveau |
|
Haas 2009 |
Systematische review, meta-analyse
N= 58 studies |
verschillende groepen tocolytica worden met elkaar vergeleken of met placebo of geen behandeling. Studies over vrouwen met een dreigende vroeggeboorte tussen 28 en 32 weken werden geïncludeerd. De studies werden individueel bekeken en de onderzochte cohorten bij elkaar genomen, waarna deze werden vergeleken met een ‘random effects model’ om bias van heterogeniteit zo veel mogelijk te beperken. Hierna werd gestratificeerd voor gebroken of staande vliezen en voor eenling- of meerlingzwangerschappen, waarna alleen de resultaten voor staande vliezen en eenlingzwangerschappen werden geanalyseerd voor de meta-analyse.
Geen taalbarrière. Abstracts alleen werden niet geaccepteerd wegens onvoldoende info. |
- |
Tocolytica (bètamimetica, calciumantagonisten, magnesiumsulfaat, oxytocinereceptor-antagon-isten, prostaglandinesynthe-taseremmers en stikstofmonoxide-donoren)
Er werd geen onderscheid gemaakt in behandelingsschema en duur van de behandeling (kortdurende behandeling of onderhouds-behandeling). |
Andere tocolytica, geen behandeling of placebo |
Uitgestelde geboorte met 48 uur, 7 dagen, en tot 37 weken. Het aantal vrouwen met ongunstige bijwerkingen van dusdanige ernst dat de behandeling onderbroken moet worden.
Als de auteurs aangaven dat antenatale corticosteroiden werden gegeven dan werd de aanwezigheid van RDS en neonatale sterfte gemeten als uitkomstmaat. .
Voor de neonatale uitkomst werden alleen studies geïncludeerd waarvan zeker was dat ook corticosteroïden antenataal toegediend waren. |
Alle tocolytica waren beter dan placebo in het uitstellen van de partus voor minimal 48 uur (53% voor placebo vergeleken met 75–93% voor tocolyse) en 7 dagen (39% voor placebo vs 61–78% voor tocolyse)
Er werd geen significant verschil gevonden voor de ander uitkomstmaten
Het beslismodel toonde dat prostaglandine remmers de beste combinatie toonden van acceptatie en bevalling.
|
Randomisatie: +
Toewijzing verborgen:+
Blindering: +/- voor zover mogelijk
Interventie- en controlegroep vergelijkbaar:+/-
Follow-up voldoende (≥80%):+
Intention-to-treat analyse:+
Financiering: geen conflict
Overig: 2 onafhankelijke reviewers
Meta-analyse uitgevoerd volgens QUORUM
Beoordeling van de studies aan de hand van cochrane criteria |
A1 |
|
King 2005
Calciumkanaalblokkers voor tocolyse |
Cochrane systematische review, meta-analyse
N=1029 vrouwen (12 studies) |
Alle studies over het gebruik van calciumantagonisten voor tocolyse bij vrouwen met een zwangerschapsduur tussen 20 en 36 weken en een dreigende vroeggeboorte.
|
- |
Calciumantagonisten voor tocolyse |
Andere tocolytica
(vergelijkingen met placebo of geen behandeling bleek niet mogelijk, geen studies geïdentificeerd) |
Verlenging van de zwangerschapsduur. Geboorte<37 wk, geboorte<34 wk, geboorte<7 dagen, geboorte<48 uur
Tevens neonatale uitkomstmaten, zie artikel. |
Vergeleken met andere tocolytica (voornamelijk betamimetica) reduceerde calciumblokkers het risico op geboorte binnen 7 dagen na start behandeling: RR 0,76; 95% BI 0,60-0,97
En<34 weken: RR 0,83; 95% BI 0,69- 0,99
Bovendien was bij calcium-blokkers minder kans dat overgestapt moest worden op een andere behandeling wegens bijwerkingen (RR 0,14; 95% BI 0,05-0,36), minder vaak neonatele RDS (RR 0,63; 95% BI 0,46- 0,88), NEC (RR 0,21; 95%-BI 0,05-0,96), IVH (RR 0.,9; 95%-BI 0,36- 0,98) en neonatale icterus (RR 0,73; 95%-BI 0,57-0,93). |
Beoordeling m.b.v. de cochrane criteria
Randomisatie: +
Toewijzing verborgen:+
Blindering: +/- voor zover mogelijk
Interventie- en controlegroep vergelijkbaar:+/-
Follow-up voldoende (≥80%):+
Intention-to-treat analyse:+
Financiering: geen conflict
Overig: 2 onafhankelijke reviewers
|
A1 |
|
Amin 2009 |
Systematische review van 15 retrospectieve cohort studies en 6 case-controle onzerdoeken (tot 2005).
N=21 studies |
Inclusie: Studies waarin indomethacine als tocolyticum geëvalueerd werden. Publicatie in Engels, meer dan dertig bevallingen, zwangerschapsduur<37 weken,. In ieder geval meer dan 2 observationele studies per uitkomstmaat. Per uitkomstmaat worden specifieke criteria benoemd waaraan voldaan moet zijn.
Exclusie: case-reports, case-series, meerdere publicaties van dezelfde auteur. |
- |
Indomethacine alleen of in combinatie met een ander tocolyticum |
Geen, of een ander tocolyticum. |
IVH, IVH graad III en IV, PVL, NEC, BPD, persisterende ductus botalli, RDS, mortaliteit |
Antenatale indomethacine hing samen met een verhoogd risico op PVL (OR 2,0; 95%-BI 1,3-3,1). Recente blootstelling aan antenatale indomethacine was geassocieerd met NEC (OR 2,2; 95%-BI 1,1-4,2). Antenatale indomethacine was niet geassocieerd met IVH, open ductus Botalli, RDS, BPD en mortaliteit. |
Publicatie bias werd onderzocht.
Sensitiviteits analyse uitgevoerd om het effect van antenatale CCS en van eerdere behandeling met indomethacine te onderzoeken. |
A2 |
|
Berkman 2003 |
Systematische review.
N=24 studies |
Inclusie: studies (RCT’s, cohort studies, case-series) over het effect van tocolyse bij dreigende vroeggeboorte, gepubliceerd in Engels, Duits of Frans.
Exclusie: meerlingen, PPROM, iatrogene vroeggeboorte, |
|
Betamimetica, calciumkanaal-blokkers, magnesiumsulfaat, NSAID’s of ethanol. |
Een ander tocolyticum of geen controle. |
Foetale, neonatale en matarnale uitkomsten (niet duidelijk gespecificeerd). |
Studies die kwalitatief redelijk goed waren toonden verschillende uitkomsten met een matige trend richting verlenging van de zwangerschapsduur. Er was onvoldoende data om een verband te onderzoeken met neonatale morbiditeit en mortaliteit.
Ethanol was minder effectief dan betamimetica. Betamimetica hadden significant meer bijwerkingen dan de andere tocolytica. |
Selectiecriteria duidelijk gerapporteerd in tabellen.
De meeste geïncludeerde studies rapporteren bepaalde kwaliteits criteria matig.
|
A1 |
|
Sanchez-Ramos 1999 |
Systematische review van RCT’s
N=1590 vrouwen (12 studies)
Doel: effectiviteit en veiligheid van onderhouds behandeling met nifedipine |
Inclusie: gepubliceerde RCT’sdie medicatie versus placebo of geen therapie vergelijken om de zwangerschapsduur te verlengen bij patienten met acute episodes van voortijdige weeën die reeds een eerste tocolytische therapie gehad hebben. |
|
Onderhoudstherapie met nifedipine |
- |
Frequentie van terugkerende voortijdige contracties/ dreigende vroeggeboorte, incidentie van vroeggeboorte, interval tot aan de eerste recidief van vroegtijdige contracties, zwangerschapsduur, gewonnen dagen vanaf randomizatie tot bevalling, 5-minuten Apgar scores <7, aantal opnames op NICU, en perinatale mortaliteit.
|
Vergeleken met geen behandeling heeft ondehouds therapie met nifedipine een gepoolde OR van 0,95 (95%-BI 0,77-1,17) voor het voorkomen van vroeggeboorte, en de OR voor herhaalde preterme contracties was 0,81 (95%-BI 0,64-1,03). Onderhouds therapie met Tocolyse was niet geassocieerd toegenomen risico op neonatal RDS, perinatale sterfte of verschil in geboortegewicht. Hoewel er geen verschil werd gevonden in gemiddelde AD bij de bevalling, hadden vrouwen die onderhoudstherapie kregen een langere latentie tijd. |
Zie tabel 1 voor kwaliteit van geïncludeerde studies.
Randomisatie: +
Toewijzing verborgen:+
Blindering: +/- voor zover mogelijk
Interventie- en controlegroep vergelijkbaar:+/-
Follow-up voldoende (≥80%):niet gerapporteerd
Intention-to-treat analyse: niet gerapporteerd
Financiering: niet gerapporteerd
Overig: 2 onafhankelijke reviewers, artikelen geanonimiseerd voor beoordeling
|
A1 |
|
De Heus 2009 |
Prospectieve cohort studie (open label)
N=1920 (28 ziekenhuizen)
Doel: evalueren van de incidentie van ernstige maternale complicaties na behandeling van verschillende tocolytische medicatie bij de behandeling van dreigende vroeggeboorte |
Inclusie: opeenvolgende zwangeren die volgens de het lokale protocol van de deelnemende centra in aanmerking komen voor tocolyse, in de periode tussen januari 2006 en juni 2007.
Exclusie: vrouwen die al behandeld waren met tocolytica (bijv. voor uitwendige versie of bij foetale nood).
Een panel beoordeelde de ongunstige uitkomsten en of deze aan de medicatie gerelateerd waren (bijwerkingen) en de ernst hiervan. |
Setting: 28 ziekenhuizen in Nederland en Belgie |
Een enkele behandeling met tocolyse, opeenvolgende behandelingen of gecombineerde behandelingen.
Onderzochte tocolytica: Nifedipine, betamimetica, atosiban, prostaglandine synthetase remmers |
De drie eerder genoemde groepen worden vergeleken. |
Ongunstige zwangerschaps uitkomsten/ bijwerkingen
Ernstige ongunstige bijwerkingen werden gedefinieerd volgens de richtlijn van de Council for International Organizations of Medical Sciences.
Ernstige bijwerkingen waren: ernstige hypotensie (DBD <100 mm Hg en >20% daling vergeleken met de uitgangsmeting), ernstige dyspnoe, long oedeem, myocard infarct, anafylactische shock, opname op de IC of maternale sterfte.
Milde bijwerkingen: Bijwerking die leidde tot staken van de medicatie (bijvoorbeeld wegens tachycardie, misselijkheid, duizeligheid, hoofdpijn) maar die niet voldeden aan de criteria voor ernstige bijwerkingen. |
Een onafhankelijk panel onderzocht de gerapporteerde bijwerkingen zonder kennis van het type tocolyticum. Van de 1920 ontvingen 1327 vrouwen een enkele behandeling met tocolyse (69,1%), 282 Opeenvolgende kuren (14,7%), en 311 gecombineerde kuren (16,2%). Bijwerkingen werden gecategoriseerd als ernstig of mild in 14 gevallen. De totale incidentie van ernstige bijwerkingen was 0,7%. Vergeleken met atosiban is het RR op een ernstige bijwerking na een enkele behandeling met betamimetica was 22,0 (95%-BI 3,6- 138,0) en voor een enkele behandeling met calciumantagonist was 12 (1,9-69). Meerder medicamenten voor Tocolyse leidde tot 5 ernstige bijwerkingen (1,6%). Meerlingen, PPROM en comorbiditeit waren geen onafhankelijke risicofactoren voor ernstige bijwerkingen. |
Randomisatie: nvt
Toewijzing verborgen: nvt
Blindering: +
Financiering: geen conflict
|
A1 |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-02-2012
Uiterlijk in 2014 bepaalt het bestuur van de Nederlandse Vereniging voor Obstetrie en Gynaecologie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Obstetrie en Gynaecologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante nieuwe ontwikkelingen.
Algemene gegevens
De richtlijnontwikkeling werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Met ondersteuning van de Orde van Medisch Specialisten.
Aanleiding voor het maken van de richtlijn
Spontane vroeggeboorte is een omvangrijke complicatie binnen de obstetrie. Het is niet alleen de belangrijkste oorzaak van perinatale sterfte in Nederland, maar ook van complicaties op de lange termijn van het kind.
Multidisciplinaire zorgverlening
In de tweede lijn wordt de zorg voor moeder en kind van de gynaecoloog en de kinderarts aangevuld door onder andere de arts-medisch microbioloog en de internist. De zorg voor moeder en kind is bij spontane vroeggeboorte veelal gedetailleerd uitgewerkt in monodisciplinaire richtlijnen gemaakt door de afzonderlijke beroepsgroepen. Een voorbeeld van een dergelijk document is de NVOG-richtlijn dreigende vroeggeboorte. Ook de neonatologie kent binnen de NVK monodisciplinaire richtlijnen zoals die over actieve levensbeëindiging bij pasgeborenen, reanimatie, hyperbilirubinemie, therapie neonatale convulsies en beslissingen rond het levenseinde in de neonatologie. Zowel de artsen-microbiologen als de internisten hebben geen specifieke richtlijnen op het gebied van zwangerschap en vroeggeboorte.
Bij monodisciplinaire richtlijnen vindt vaak pas laat in het ontwikkelproces (of in het geheel niet) wederzijdse toetsing plaats van de inhoud van de richtlijn. De afgelopen jaren blijkt dat dergelijke toetsing in een laat stadium niet optimaal is. Vaak is een richtlijn al gevormd door keuzes die vroegtijdig in het proces van richtlijnontwikkeling gemaakt zijn en blijkt het moeilijk om in een laat stadium in dat proces in te breken. Implicaties voor de samenwerking kunnen door deze aanpak niet goed verwerkt worden in de richtlijn. Dit terwijl de zorg rond veel onderwerpen inherent multidisciplinair is, zoals weeënremming, behandeling van infectie en het geven van corticosteroïden aan de moeder bij dreigende vroeggeboorte. Om het zorgproces van zwangere vrouwen met een door vroeggeboorte gecompliceerde zwangerschap te optimaliseren is een multidisciplinaire aanpak, met als doel een uniform beleid van belang.
Probleemomschrijving en afbakening
Omdat dreigende vroeggeboorte een van de meest omvangrijke complicatie is in de obstetrie, achtte de NVOG het noodzakelijk hierover multidisciplinaire afspraken te maken voor de dagelijkse praktijkvoering. Gezien de omvang van de problematiek rondom dreigende vroeggeboorte werd door de werkgroep besloten de richtlijn af te bakenen tot de belangrijkste knelpunten op dit gebied, en de mogelijkheid te bieden om deze later als bouwstenen te integreren in nog te ontwikkelen richtlijnen door de eigen vereniging(en). Het nu volgende document bevat derhalve de systematische uitwerking en bediscussiëring van de belangrijkste multidisciplinaire knelpunten rondom dreigende vroeggeboorte.
Delen van deze richtlijn komen overeen met de gelijktijdig ontwikkelde richtlijn Hypertensieve aandoeningen tijdens de zwangerschap (www.nvog.nl). Er is voor gekozen deze opverlap te laten bestaan om de zelfstandige leesbaarheid van de documenten te bevorderen.
Definities
Vroeggeboorte:geboorte voor 37 weken amenorroeduur
- Late prematuriteit: 34 tot 36 weken
- Matige prematuriteit: 32 tot 34 weken
- Vroege prematuriteit: 28 tot 32 weken
- Extreme prematuriteit: 24 tot 28 weken
- (Termijnbepaling volgens regels van de werkgroep ultrageluid NVOG)
Juridische betekenis van richtlijnen
Richtlijnen bevatten geen wettelijke voorschriften, maar aanbevelingen die zoveel mogelijk op bewijs gebaseerd zijn. Zorgverleners kunnen aan de aanbevelingen voldoen in het streven kwalitatief goede of ‘optimale’ zorg te verlenen. Omdat deze aanbevelingen gebaseerd zijn op ‘algemeen bewijs voor optimale zorg’ en de inzichten van de werkgroep hierover, kunnen zorgverleners op basis van hun professionele autonomie zo nodig in individuele gevallen afwijken van de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, zelfs noodzakelijk. Wanneer van deze richtlijn wordt afgeweken, is het verstandig om dit beargumenteerd en gedocumenteerd, waar relevant in overleg met de patiënt, te doen.
Doel en doelgroep
Een richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering. In de conclusies wordt aangegeven wat de wetenschappelijke stand van zaken is. De aanbevelingen zijn gericht op het expliciteren van optimaal medisch handelen en zijn gebaseerd op de resultaten van wetenschappelijk onderzoek en overwegingen van de werkgroep.
Aan richtlijnen worden steeds meer eisen gesteld; ze moeten wetenschappelijk onderbouwd, transparant en bruikbaar zijn in de praktijk. Er is bij voorkeur inbreng door patiënten (patiëntenperspectief). Daarnaast is het belangrijk dat de beroepsgroepen die in de praktijk met de richtlijn werken, betrokken zijn bij de ontwikkeling en de richtlijn ook breed dragen (autoriseren).
Deze richtlijn beoogt een leidraad te geven voor de dagelijkse praktijk van de zorg van zwangere vrouwen met een dreigende vroeggeboorte.
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die aan de ontwikkeling van de richtlijn hebben bijgedragen. Deze staan vermeld bij de samenstelling van de werkgroep. Tot de beroepsgroepen die geen zitting hadden in de werkgroep maar wel beoogd gebruikers zijn van deze richtlijn behoren o.a. klinisch verloskundigen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2009 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die met de diagnostiek en behandeling van vroeggeboorte te maken hebben (zie hiervoor de samenstelling van de werkgroep). Aangezien dezelfde werkgroep betrokken was bij de uitwerking van de multidisciplinaire aanbevelingen voor de richtlijn ‘Hypertensieve aandoeningen in de zwangerschap’, was bij dit project ook vertegenwoordiging van de interne geneeskunde aanwezig.
De werkgroepleden zijn door de wetenschappelijke verenigingen gemandateerd voor deelname aan deze werkgroep.
Samenstelling van de werkgroep
Prof. dr. B.W. Mol, gynaecoloog, Academisch Medisch Centrum, Amsterdam (voorzitter)
Dr. F.A.B.A. Schuerman, kinderarts, Flevoziekenhuis, Almere
Dr. R.A. van Lingen, kinderarts, Isala-Klinieken, Zwolle
Dr. A.H.L.C. van Kaam, kinderarts, Academisch Medisch Centrum, Amsterdam
Dr. P.H. Dijk, kinderarts, Universitair Medisch Centrum Groningen, Groningen
Mw. dr. L.M. Kortbeek, medisch microbioloog, RIVM, Bilthoven
Dr. B.J.H. van den Born, internist, Academisch Medisch Centrum, Amsterdam
Dr. G.D. Mantel, gynaecoloog, Isala-Klinieken, Zwolle
Dr. J.J.H.M. Erwich, gynaecoloog, Universitair Medisch Centrum Groningen, Groningen
Dr. H. Wolf, gynaecoloog, Academisch Medisch Centrum, Amsterdam
Ir. T.A. van Barneveld, klinisch epidemioloog, Orde van Medisch Specialisten, Utrecht
Mw. drs. M.M. Wiegerinck, arts-onderzoeker en richtlijnondersteuner, Nederlandse Vereniging voor Obstetrie en Gynaecologie, Utrecht
Belangenverklaringen
Geen van de werkgroepleden hebben belangen aan te geven. De originele belangenverklaringen zijn op te vragen bij het secretariaat van de NVOG. De inhoud van de conclusies en aanbevelingen uit deze (concept)richtlijn werd onafhankelijk opgesteld van en niet beoordeeld door de financier van deze richtlijn, de Stichting Kwaliteitsgelden Medisch Specialisten.
Belangenverklaringsformulier
Verklaring omtrent mogelijke belangenverstrengeling en embargo met betrekking tot de richtlijn ‘hypertensieve ziekten in de zwangerschap en dreigende vroeggeboorte’ op initiatief van ‘NVOG’
Utrecht, …. … 2010
Betreft: Richtlijn hypertensieve ziekten in de zwangerschap en dreigende vroeggeboorte
Geachte heer, mevrouw,
In verband met uw deelname aan de ontwikkeling van de richtlijn ‘hypertensieve ziekten in de zwangerschap en dreigende vroeggeboorte’ vragen wij u bijgevoegde verklaring in te vullen.
Mogelijke belangenverstrengeling:
Mogelijke belangenverstrengeling valt niet steeds valt te vermijden, maar de Orde van Medisch Specialisten en NVOG vindt het wel van belang dat hierover openheid bestaat. U wordt daarom gevraagd op bijgaand formulier te vermelden of u in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhield met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn ‘hypertensieve ziekten in de zwangerschap en dreigende vroeggeboorte’.
Hetgeen u in uw verklaring vermeldt zal bij het secretariaat van de NVOG opvraagbaar zijn.
Embargo
Gedurende de richtlijnontwikkeling rust een embargo op de teksten van de conceptrichtlijn.
Dit betekent dat het zonder schriftelijke toestemming van de opdrachtgever niet is toegestaan om passages uit de conceptrichtlijn, of de gehele conceptrichtlijn inclusief bijlagen zoals evidence-tabellen te verstrekken aan derden.
Ondergetekende verklaart zich door ondertekening akkoord met het bovenstaande.
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––– (naam)
––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––(handtekening)
Formulier belangenverklaring
Heeft u naar uw mening in de afgelopen vijf jaar en/of gedurende de looptijd van het project belangen die mogelijk kunnen interfereren met de besluitvorming in de werkgroep ten aanzien van de interpretatie van het wetenschappelijk bewijs en het opstellen van aanbevelingen?
Ja / Neen
Zo ja, wilt u aangeven uit welke activiteiten deze belangen voortvloeien en welke organisaties/bedrijven het betreft? Voorbeelden van activiteiten kunnen gevonden worden in consultatie/advisering, (na)scholing / cursus en ondersteuning van wetenschappelijk onderzoek.
1. –––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
2. –––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
3. –––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
Bij meer dan deze drie vermeldingen graag een extra blad bijvoegen.
Ondergetekende verklaart bovenstaande informatie naar waarheid te hebben ingevuld en mutaties t.a.v. bovenstaande te vermelden aan de voorzitter en secretaris van de werkgroep:
Betreft: richtlijn ‘hypertensieve ziekten in de zwangerschap en dreigende vroeggeboorte’
Naam: ––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
Afgevaardigde namens: ––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––(handtekening)
Inbreng patiëntenperspectief
Voor de ontwikkeling van een kwalitatief goede richtlijn is de input van patiënten nodig. Een behandeling moet immers voldoen aan de wensen en eisen van patiënten en zorgverleners. Patiënten kunnen zorgverleners die een richtlijn ontwikkelen helpen om te begrijpen hoe het is om met een ziekte of aandoening te leven of om er mee geconfronteerd te worden. Op deze manier kan bij het ontwikkelen van een richtlijn beter rekening gehouden worden met de betekenis van verschillende vormen van diagnostiek, behandeling en zorg voor patiënten. Het in kaart brengen van de behoeften, wensen en ervaringen van patiënten met de behandeling biedt tevens de gelegenheid om de knelpunten in kaart te brengen. Wat zou er volgens patiënten beter kunnen? Een patiënt doorloopt het hele zorgtraject, een behandelaar ziet vaak slechts het stukje behandeling waarin hij zich heeft gespecialiseerd. Het is dus heel zinvol om voor verbetering van de kwaliteit van de behandeling ook knelpunten vanuit patiëntenperspectief in kaart te brengen. Bij deze richtlijn is er in de beginfase van de richtlijnontwikkeling een knelpuntenanalyse door middel van een groepsinterview met een patiëntengroep (focusgroep) van vrouwen met een doorgemaakte dreigende vroeggeboorte gedaan. Een verslag van de focusgroep bijeenkomst is besproken in de werkgroep en de belangrijkste knelpunten zijn geadresseerd in de richtlijn. Niet alle genoemde knelpunten waren direct van toepassing op deze richtlijn, derhalve wordt verwezen naar het focusgroep verslag voor het totale overzicht (zie aanverwant). De hier voorliggende conceptrichtlijn is voor commentaar voorgelegd aan deelnemers van het focusgroep gesprek.
Verslag patiëntenfocusgroep 'dreigende vroeggeboorte'
In dit document worden de aandachtspunten die volgen uit het focusgroepgesprek van 26 april 2010 uitgelicht.
Doel van het focusgroep gesprek
Vanuit het patiëntenperspectief inzichtelijk maken hoe de zorg aan vrouwen met een (dreigende) vroeggeboorte, patiënt gerichter kan.
Deelneemsters aan het focusgroep gesprek
In samenwerking met de Vereniging voor Ouders van Couveusekinderen en de stichting HELLP, werden deelnemers benaderd en geselecteerd. Alleen patiënten bij wie de bevalling minder dan 5 jaar geleden had plaatsgevonden, werden geïncludeerd. Er namen in totaal 7 vrouwen deel, van wie er 2 een spontane vroeggeboorte hadden en 5 een geïnduceerde vroeggeboorte wegens een hypertensieve aandoening. Ten tijde van het gesprek was één van de deelnemers (opnieuw) zwanger.
De gespreksstructuur
Het gesprek werd gestructureerd door chronologisch het zorgproces door te spreken: de begeleiding in de vroege zwangerschap, het moment waarop duidelijk werd dat het kind te vroeg geboren zou worden, de begeleiding tot aan de partus, de partus zelf, het kraambed, en de nazorg. De belangrijkste aandachtspunten worden in dit verslag uitgelicht, gegroepeerd naar bovenstaande zorgmomenten.
Algemene punten, voor verbetering van het multidisciplinaire zorgproces
Informatievoorziening in de vroege zwangerschap (voor optreden van klachten)
- Aan geen van de deelnemers was, voordat complicaties van de zwangerschap optraden, informatie verstrekt over symptomen (zoals van hypertensie) waarop de zwangeren bedacht zouden moeten zijn.
- Deelnemers zijn het erover eens dat er wel behoefte is aan informatie vooraf, maar goed getimed, zonder dat er angst ontstaat, en met mededeling van de belangrijkste klachten die je in je zwangerschap tegen kan komen.
- De meeste deelnemers zijn op de hoogte van de blocnotejes die sinds enkele maanden door de stichting HELLP (in samenwerking met KNOV en NVOG) worden verstrekt, en waarop alarmsymptomen van hypertensieve aandoeningen vermeld staan. Deze worden als een positieve ontwikkeling gezien.
- Er wordt aangegeven dat zorgverleners zich wel goed moeten realiseren dat veel vrouwen eventuele klachten niet durven aan te geven (‘Ik stel me aan’), of aan kunnen geven omdat ze niet weten wat belangrijke klachten zijn, waardoor het extra van belang is om goed door te vragen. Het is erg belangrijk dat er een goede vertrouwensband is, en voldoende gelegenheid om alles te durven zeggen.
- Niet alleen de zwangeren, maar ook de verloskundigen moeten uiteraard de klachten zoals aangegeven door de vrouwen goed kunnen herkennen.
De begeleiding van de zwangerschap nadat de eerste complicaties opgetreden zijn
- De wens is dat je als patiënt zoveel mogelijk door één persoon gevolgd wordt. Het is belangrijk voor de continuïteit van zorg en voor de vertrouwensband.
- Ook het goed informeren van de partner wordt als zeer belangrijk benoemd. Dat is wisselend gegaan, bij de een beter dan bij de ander. De zwangere is niet altijd even helder van geest door alles wat er gebeurt, en de partner kan dan nog informatie voor patiënte onthouden en herhalen. Ook was er een positieve ervaring van het bijhouden van een dagboek en het maken van foto’s voor de latere verwerking.
- Eenduidige informatie van de verschillende zorgverleners (o.a. verpleegkundigen), om onrust en onzekerheid bij de patiënt te voorkomen. Daarbij ook rekening houdend met de situatie van de vrouw (begrijpt ze wat er verteld wordt?).
- Informatievoorziening over de prognose van het kind werd bij vrijwel alle deelnemers verstrekt door de neonatoloog. Dit werd als erg prettig ervaren. De ene deelnemer had behoefte aan duidelijke rechttoe rechtaan informatie, terwijl andere deelnemers liever een wat genuanceerder gesprek hadden. Er dient dus ook rekening te worden gehouden met het type patiënt. De deelnemers geven aan dat zij voor het gesprek met de neonatoloog nauwelijks informatie over de prognose van het kind hadden gekregen van de gynaecoloog, maar dat zij deze informatie ook niet gemist hebben.
- ‘Het is de arts die je maakt of breekt, zo is het. En je moet maar net die klik hebben. Dat maakt heel veel uit.’
Partus
- Het is essentieel dat je partner erbij kan zijn.
- Duidelijkheid over wanneer de inleiding gaat starten (‘als ze zeggen dat je die dag ingeleid wordt, dat ze dat dan ook doen’). En als de bevalling begint, zet dan ook door.
- Het werd door deelnemers erg gewaardeerd dat de verpleging/artsen zorgde dat er een fototoestel was bij de partus, aangezien zij deze in alle haast vergeten waren (acute situatie). Het is zo belangrijk voor ouders, en dus fijn dat er meegedacht wordt.
Na de bevalling/kraamperiode
- Het wordt als erg belangrijk benoemd dat de partner bij de opvang van het kind mag zijn, en ook bij het installeren op de NICU. Hierdoor kan de partner ook de vrouw inlichten over alles wat er gebeurd en gedaan is. Dat geeft veel rust.
- Er is behoefte aan direct, zo spoedig mogelijk na de bevalling of keizersnee, een gesprek over hoe het is gegaan.
- Er wordt aangegeven dat patiënten het belangrijk vinden dat er nagedacht wordt over op welke kamer, met wat voor patiënten zij worden geplaatst als zij terugkeren naar de afdeling (‘niet naast een blakende baby’). Bij voorkeur in overleg met patiënt (omgekeerd wil bijvoorbeeld ook niet iedereen op een kamer alleen).
- Er zou goede mogelijkheid moeten zijn om je kind op de couveuse afdeling te bezoeken, en dat er niet hoeft te worden gewacht op de partner ’s middags.
- Er is wisselende ervaring met het videosysteem waarmee moeders vanaf de kraamafdeling hun kind op de NICU kunnen zien op scherm. Op zich wordt het als heel prettig ervaren dat je je kind ook vanaf de afdeling kan zien, maar in sommige gevallen kan het ook juist voor onrust zorgen (bijvoorbeeld door de ervaring dat er af en toe een doek over de camera werd gehangen, zonder dat duidelijk was waarom en wat er gebeurde).
- Het gaat uiteindelijk om de menselijke maat. Kijk niet alleen naar de medische problemen maar ook naar de angst en de zorg eromheen. Want die vrouw is in een roes. Het zou fijn zijn als er een vertrouwenspersoon was, dat zou in principe iedereen kunnen zijn (‘Hoe voel je je, trek je het nog wel’). Als voorbeeld wordt ook gegeven dat het al veel zou schelen als de arts bij de informatievoorziening een stoel zou pakken (zij die daar goede ervaring mee hebben beamen dat).
- Deelnemers verwachten van professionals dat zij rekening houden met belangrijke pijlers voor ouders en hen daarbij betrekken, zoals het eerste badje en eerste flesje. Dat is voor alle ouders belangrijk, maar in ieder geval voor ouders die een heftige situatie rondom de geboorte hebben meegemaakt extra emotioneel.
- Probeer, als een kind van de NICU overgeplaatst moet worden naar een ander ziekenhuis, de ouders op deze overplaatsing voor te bereiden en als zorgverlener bewust te zijn wat dit voor impact op ouders kan hebben.
Nazorg
- De meeste deelnemers hebben ervaren dat er nauwelijks nazorg is. Bij de nacontrole zou meer aandacht moeten zijn voor het bespreken van de gebeurtenissen en hoe het nu gaat, en niet alleen de bloeddruk meten en de wond bekijken. Zo’n nagesprek zou standaard aangeboden moeten worden. Ook voorlichting over wat voor effect zo een ervaring op je kan hebben is belangrijk, zowel geestelijk als lichamelijk met eventueel aanbieden van extra hulpverlening.
- De overgang van ziekenhuis naar huis wordt als groot ervaren. De patiënten bij wie het ontslag in overleg had plaatsgevonden, vonden dit erg prettig. Het ontslaggesprek is ook erg belangrijk.
- Kraamzorg: wanneer kinderen na langdurige opnamen naar huis mogen, wordt er meestal geen kraamzorg meer vergoed, terwijl hier vaak wel veel behoefte aan is.
- Een van de deelnemers heeft in onderzoeksverband wel een nazorgtraject doorlopen, en zij heeft dit als zeer prettig ervaren. Het ging dan vooral om ‘Hoe gaat het? Niet medisch, maar hoe gaat het met jou?’ en ‘Als je je over een jaar niet goed voelt en alles komt weer naar boven, dan is dat normaal, dat hoort erbij’. Ook een andere deelnemer had een duidelijk nazorgtraject als routinezorg met psychologische begeleiding en maatschappelijk werk, en beoordeelde dit zeer positief. Er werd begeleiding geboden aan het hele gezin. Er wordt geconcludeerd dat dit eigenlijk in ieder ziekenhuis routine zou moeten zijn.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is geprobeerd rekening te houden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Aangezien de gemaakte aanbevelingen niet in een op zichzelf staande richtlijn zullen worden aangeboden, maar geïntegreerd in de nog te ontwikkelen richtlijn ‘Vroeggeboorte’, zal implementatie van deze aanbevelingen afhangen van de implementatie van de nog te maken richtlijnen. Wel zal een samenvatting van het in dit project gemaakte document worden gepubliceerd in het Nederlands Tijdschrift voor Geneeskunde of het Nederlands Tijdschrift voor Obstetrie en Gynaecologie. Bovendien zal het document te downloaden zijn via de website van de Vereniging van Obstetrie en Gynaecologie (www.nvog.nl).
De bestaande NVOG indicatoren op het gebied van zorg tijdens de zwangerschap blijven van kracht en zijn niet verder aangevuld (zie website www.nvog.nl).
Werkwijze
De werkgroep werkte gedurende 1 jaar aan de totstandkoming van de conceptrichtlijn. De richtlijnondersteuner en werkgroepleden zochten systematisch literatuur en beoordeelden de kwaliteit en inhoud ervan. Zij gingen hierbij uit va bestaande richtlijnen. Vervolgens schreven de richtlijnondersteuner en werkgroepleden een paragraaf of hoofdstuk voor de conceptrichtlijn, waarin de beoordeelde literatuur werd verwerkt. Tijdens vergaderingen lichtten zij hun teksten toe, dachten mee en discussieerden over andere hoofdstukken. De conceptteksten werden aan de betrokken verenigingen aangeboden voor commentaar. De uiteindelijke aangepaste teksten vormen samen de hier voorliggende richtlijn.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.


