Progesteron ter preventie van vroeggeboorte na een opname wegens dreigende vroeggeboorte
Uitgangsvraag
Wat is de waarde van (rescue) progesteron bij een zwangere met een dreigende spontane vroeggeboorte met staande vliezen bij opname ter remming en toediening corticosteroïden?
Aanbeveling
Geef niet routinematig vaginaal progesteron tot 36 weken AD bij zwangeren die opgenomen zijn (geweest) met een dreigende vroeggeboorte en staande vliezen die na 48 uur nog niet zijn bevallen.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In de literatuuranalyse werd onderzocht wat de waarde is van progesteron (ongeacht de wijze van toediening) bij een zwangere met een dreigende spontane vroeggeboorte met staande vliezen bij een opname na toegediende corticosteroïden. Er werd één systematische review gevonden (Breuking, 2023). De bewijskracht voor de cruciale uitkomstmaat ‘neonatale sterfte’ was zeer laag vanwege methodologische beperkingen en spreiding in de richting van het effect. Voor de belangrijke uitkomstmaten ‘verlenging van de duur van de zwangerschap’, ‘vroeggeboorte voor 34 weken’, ‘respiratoir distress syndroom’ en ‘neonatale sepsis’ is een lage bewijskracht gevonden. Er zijn aanwijzingen dat progesteron resulteert in een verlenging van de zwangerschapsduur en een verlaging van respiratoir distress syndroom en neonatale sepsis. Echter, in een subgroep analyse van studies met een lage risk of bias valt het effect van de verlenging van de duur van de zwangerschap nagenoeg weg (gemiddeld genomen 2.44 dagen). Voor de cruciale uitkomstmaat ‘neurologische uitkomst op 2 jaar’ werd geen bewijs gevonden. De overall bewijskracht is daarom zeer laag. Andere studies kunnen leiden tot nieuwe inzichten. Er kunnen op basis van de literatuur geen sterke aanbevelingen geformuleerd worden over de waarde van rescue progesteron bij een zwangere met een dreigende spontane vroeggeboorte met staande vliezen bij opname en toegediende corticosteroïden.
Bij vrouwen met een vroeggeboorte in de voorgeschiedenis en bij vrouwen met een asymptomatische korte cervix zonder vroeggeboorte in de voorgeschiedenis adviseren we progesteron conform de richtlijn preventie recidief spontane vroeggeboorte. Dit is ook conform internationale richtlijnen. Er is reeds veel onderzoek gedaan naar het gebruik van progesteron in de zwangerschap bij vrouwen met een verhoogd risico op vroeggeboorte.
Specifiek voor onze uitgangsvraag is er minder onderzoek verricht, m.n. de subgroep van patienten met een verkorte cervixlengte is onvoldoende onderzocht.
Op basis van de literatuur en de huidige richtlijn preventie recidief vroeggeboorte, is het aannemelijke dat progesteron een positief effect kan hebben op het verlengen van de zwangerschapsduur bij een verkorte cervix.
Hoewel er op basis van de gepubliceerde resultaten uit drie studies (Norman, 2007, Northen, 2007 en Willing, 2016) geen redenen zijn om aan te nemen dat er negatieve effecten zijn op lange termijn, zijn de lange-termijn-effecten van progesteron op de foetus nog onvoldoende uitgezocht (zie ook RL preventie recidief spontane vroeggeboorte). Een systematische review van Simons uit 2020 laat zien dat er geen nadelige effecten lijken van progesteron gebruik tijdens de zwangerschap ter preventie van vroeggeboorte.
Er zijn echter wel diverse beperkingen, de studies zijn heterogeen met ook merendeels subjectief bepaalde uitkomstmaten (ouder gerapporteerde vragenlijsten) en de follow-up leeftijden variëren van 6 maanden tot maximaal 8 jaar. Er is dan ook meer en kwalitatief beter onderzoek nodig hierin.
De gangbare dosering in Nederland is 1 dd 200 mg van 16 tot 36 weken AD, vaginale toediening. De 17-hydroxyprogesteron wordt niet of nauwelijks meer toegepast vanwege leveringsproblemen, beschikbaarheid en toediening is 1 maal per week I.M. Verder lijken er op basis van de literatuur qua bijwerkingen geen nadelige effecten te zijn.
M.b.t. de kosten zal het geen grote impact hebben gezien de lage medicijn kosten en de specifieke (kleine) groep patiënten waar het om gaat.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het doel van de toediening van progesteron aan een zwangere met een verhoogd risico op vroeggeboorte is om de zwangerschapsduur te verlengen en daarmee de neonatale uitkomsten te verbeteren. Wanneer er sprake is van een dreigende vroeggeboorte, zonder voorafgaande risicofactoren voor een vroeggeboorte, lijken er (ook) positieve effecten betreffende de duur van de zwangerschap, kans op RDS en sepsis. Echter, bij een subgroep analyse betreffende enkel low risk of bias studies valt het effect op de duur van de zwangerschap nagenoeg weg. Dit effect lijkt vooral aanwezig te zijn in de high risk of bias studies. De voor- en nadelen van progesteron (vaginale toediening) dienen te worden besproken met de zwangere. Er lijken geen ernstige nadelen wat betreft de (korte termijn) bijwerkingen voor de zwangere. Naast de genoemde systemische bijwerkingen van vaginaal progesteron in het Farmacotherapeutisch Kompas, kunnen vrouwen ook lokaal klachten ervaren en last hebben van fluor. De gewenste toedieningsvorm kan uitmaken voor de vrouw, waarbij het meest gangbaar dagelijks vaginaal is. Echter als dit bezwaarlijk is, is een orale toediening een alternatief. Er lijken geen bekende nadelige effecten van progesteron voor het kind op korte termijn, maar de lange termijn effecten zijn minder goed uitgezocht. Dit gegeven dient met de aanstaande ouder(s) te worden besproken.
Kosten (middelenbeslag)
Utrogestan 200mg capsules voor vaginaal gebruik kosten 19 cent per stuk. Het middel is reeds gangbaar in gebruik binnen specifieke obstetrische patiënt groepen.
Er lijken mogelijke gunstige effecten op een verlenging van de zwangerschapsduur en een vermindering van respiratoir distress syndroom en neontale sepsis. De werkgroep is van mening dat dit opweegt tegen de kosten.
Aanvaardbaarheid, haalbaarheid en implementatie
Wij verwachten als werkgroep geen problemen hierin, het huidige beleid is ongewijzigd.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het toedienen van progesteron aan zwangeren met een verhoogd risico op een vroeggeboorte vanwege een vroeggeboorte in de voorgeschiedenis wordt reeds wereldwijd aanbevolen. De uitgangsvraag in deze richtlijn gaat over een specifieke groep zwangeren zonder een verhoogd risico op een vroeggeboorte in het begin van de zwangerschap, maar wel een opname en behandeling voor dreigende vroeggeboorte met staande vliezen in de huidige zwangerschap. Voor de meest gangbare toediening van progesteron, namelijk vaginaal progesteron, zien wij vanuit de literatuur een very low grade positief effect op mortaliteit en een low grade positief effect op RDS bij de neonaat. Daarnaast zien we een low grade positief effect op de duur van de zwangerschap (gemiddeld 4,32 dagen), terwijl dit effect veel minder positief lijkt wanneer enkel low risk of bias studies worden geanalyseerd (gemiddeld 2,44 dagen) en dit gegeven de interpretatie van uitkomsten ter discussie stelt. Bij een dreigende extreme vroeggeboorte kan het verschil van enkele dagen mogelijk wel klinisch relevant zijn. De zwangerschapsduur kan in de counseling over rescue progesteron worden meegenomen. Gezien het beperkte onderzoek en de kwaliteit van deze studies willen we dit als een kennishiaat vaststellen.
Er is geen significant verschil in vroeggeboorte voor 34 weken gevonden. Er is geen subgroepanalyse beschikbaar voor een specifieke groep met een verkorte cervix. Derhalve is het advies vanuit de werkgroep om niet standaard progestron voor te schrijven na een episode van dreigende vroeggeboorte. Maar gezien de acceptatie van vaginaal progesteron gebruik tijdens de zwangerschap, de lage kosten en de mogelijke positieve effecten zijn wij als werkgroep van mening om progesteron in specifieke gevallen bij vrouwen, die opgenomen en behandeld zijn met corticosteroïden voor een dreigende vroeggeboorte met staande vliezen te overwegen (bijvoorbeeld in geval van een dreigende extreme vroeggeboorte en/of verkorte cervix). Bespreek tijdens de counseling wel de bijwerkingen van progesteron en dat de lange termijn effecten van progesteron voor het kind nog onbekend zijn.
Onderbouwing
Achtergrond
In case of a threatened preterm birth before 34 weeks, a pregnant woman is given tocolysis during 48 hours for the benefit of the antenatal corticosteroids therapy for fetal lung maturation. After the administration of the corticosteroids, tocolysis is stopped and a wait-and-see policy follows. Pregnant women with a previous history of preterm birth are given progesterone in their next pregnancy to reduce their risk of preterm birth by approximately 30% (RL preventie recidief spontane vroeggeboorte). In case of a threatened preterm birth (with a shortened cervix) without prelabor rupture of membranes, starting rescue progesterone might possibly have a positive effects.
Conclusies / Summary of Findings
|
Very low GRADE |
The evidence is very uncertain about the effect of progesterone on neonatal death when compared with no progesterone in pregnant women with threatened preterm birth between 24 and 34 weeks.
Source: Breuking, 2023 |
|
No GRADE |
No evidence was found regarding the effect of giving progesterone on neurological outcomes at 2 years when compared with no progesterone in pregnant women with threatened preterm birth between 24 and 34 weeks. |
|
Low GRADE |
The evidence suggests that progesterone results in an increase in latency time when compared with no progesterone in pregnant women with threatened preterm birth between 24 and 34 weeks.
In a subgroup of low risk of bias studies, the evidence suggests that progesterone results in little to no difference in latency time in pregnant women with threatened preterm birth between 24 and 34 weeks.
Source: Breuking, 2023 |
|
Low GRADE |
The evidence suggests that progesterone results in little to no difference in preterm birth <34 weeks when compared with no progesterone in pregnant women with threatened preterm birth between 24 and 34 weeks.
Source: Breuking, 2023 |
|
Low GRADE |
The evidence suggests that progesterone results in a reduction in respiratory distress syndrome when compared with no progesterone in pregnant women with threatened preterm birth between 24 and 34 weeks.
Source: Breuking, 2023 |
|
Very low GRADE |
The evidence is very uncertain about the effect of progesterone on broncho-pulmonary dysplasia when compared with no progesterone in pregnant women with threatened preterm birth between 24 and 34 weeks.
Source: Breuking, 2023 |
|
No GRADE |
No evidence was found regarding the effect of giving progesterone on retinopathy of prematurity when compared with no progesterone in pregnant women with threatened preterm birth between 24 and 34 weeks. |
|
Very low GRADE |
The evidence is very uncertain about the effect of progesterone on periventricular leukomalacia when compared with no progesterone in pregnant women with threatened preterm birth between 24 and 34 weeks.
Source: Breuking, 2023 |
|
Very low GRADE |
The evidence is very uncertain about the effect of progesterone on intraventricular hemorrhage when compared with no progesterone in pregnant women with threatened preterm birth between 24 and 34 weeks.
Source: Breuking, 2023 |
|
Very low GRADE |
The evidence is very uncertain about the effect of progesterone on necrotizing enterocolitis when compared with no progesterone in pregnant women with threatened preterm birth between 24 and 34 weeks.
Source: Breuking, 2023 |
|
Low GRADE |
The evidence suggests that progesterone results in a reduction in neonatal sepsis when compared with no progesterone in pregnant women with threatened preterm birth between 24 and 34 weeks.
Source: Breuking, 2023 |
Samenvatting literatuur
Description of studies
Breuking (2023) performed a systematic review to assess the effectiveness of progesterone for preventing preterm labor. Central Cochrane, Ovid Embase and Ovid Medline were searched for randomized controlled trials on the 1st of October, 2020 and was updated on 11 October 2021 and on 22 February 2023, without any language restrictions. References of included studies and relevant review articles were studied for additional publications. Besides, ClinicalTrials.gov, ISRCTN registry, WHO International Clinical Trials Registry Platform and Cochrane Central Register of Controlled Trials were searched. Inclusion criteria of this systematic review were randomized controlled trials including women diagnosed with an episode of preterm labor with intact membranes in the second or third trimester of pregnancy (between 16+0 and 37+0 weeks of gestation) who were randomized to progesterogene maintenance therapy consisting of 17-OHPc (intramuscular injection), natural or micronised progesterone (oral, vaginal or rectal administration) or a control group (placebo, no treatment or standard care). Studies with maintenance regimens of magnesium sulphate, β-adrenergic agonists or nifedipine as control group were also included. Exclusion criteria were women with signs of intrauterine infection, an obstetric indication for immediate delivery (signs of fetal distress, abruption, cord prolapse or advanced labour), or a confirmed fetal abnormality. Besides, studies with any uncertainty regarding data integrity (for which data trustworthiness could not be assessed) were excluded. In total, 13 studies were included. Outcomes of interest were latency time, preterm birth <34 weeks, respiratory distress syndrome, bronchopulmonary dysplasia, intraventricular hemorrhage, periventricular leukomalacia, necrotizing enterocolitis, neonatal sepsis and neonatal death. Breuking used the random effects model of DerSimonian and Laird for the meta-analysis. This was converted to the Mantel-Haenszel (MH) method, resulting in differences in the risk ratios. For determining clinically relevant effects, the MH method was used for consistency with other modules in the guideline.
Table 1. Description of included studies in systematic review of Breuking 2023.
|
Study |
Intervention |
Comparator |
||
|
|
Characteristics |
Intervention type/dose |
Characteristics |
Type of control |
|
Areja, 2013 |
Arm 1 (n= 26) Gestational age (mean±SD): 28.3 ± 2.8 weeks Cervical length (median): 18.3 mm (IQR: 16 to 22 mm) |
Vaginal progesterone (200mg per day) |
Arm 2 (n= 26) Gestational age (mean±SD): 29.4 ± 2.3 weeks Cervical length (median): 18.5 mm (IQR: 14 to 23 mm) |
No treatment |
|
Arikan, 2011 |
Arm 1 (n= 43) Gestational age (mean±SD): 31.7 ± 2.0 weeks Cervical length (mean±SD): 25.6 ± 9.1 mm |
Vaginal progesterone (200mg per day) |
Arm 2 (n= 40) Gestational age (mean±SD): 32.2 ± 2.4 weeks Cervical length (mean±SD): 24.9 ± 8.7 mm |
No treatment |
|
Borna, 2008 |
Arm 1 (n= 37) Gestational age (mean±SD): 31.1 ± 2.9 weeks Cervical length: NR |
Vaginal progesterone (400mg per day) |
Arm 2 (n= 33) Gestational age (mean±SD): 32.4 ± 2.1 weeks Cervical length: NR |
No treatment |
|
Briery, 2014 |
Arm 1 (n= 22) Gestational age (mean±SD): 28.6 ± 2.7 weeks Cervical length (mean±SD): 26 ± 11 mm |
17OHPc (250mg per week) |
Arm 2 (n= 23) Gestational age (mean±SD): 27.3 ± 2.8 weeks Cervical length (mean±SD): 30 ± 11 mm |
Placebo |
|
Choudhary, 2014 |
Arm 1 (n= 45) Gestational age (mean±SD): 31.9 ± 2.1 weeks Cervical length: NR |
Oral progesterone (200mg per day) |
Arm 2 (n= 45) Gestational age (mean±SD): 32.4 ± 1.7 weeks Cervical length: NR |
Placebo |
|
Facchinetti, 2007 |
Arm 1 (n= 30) Gestational age (mean±SD): 208.4 ±22.1 days Cervical length (mean±SD): 24.5 ± 8.9 mm |
17OHPc (341mg every 4 days) |
Arm 2 (n= 30) Gestational age (mean±SD): 212.3 ± 18.1 days Cervical length: (mean±SD): 22.8 ± 9.6 mm |
No treatment |
|
Facchinetti, 2017 |
Arm 1a (n= 87) Gestational age (mean±SD): 28.1 ± 2.8 weeks Cervical length (mean±SD): 16.7 ± 5.6 mm
Arm 1b (n= 86) Gestational age (mean±SD): 28.4 ± 2.3 weeks Cervical length (mean±SD): 18.4 ± 4.7 mm |
Vaginal progesterone (200mg per day)
17OHPc (341mg every 4 day) |
Arm 2 (n= 81) Gestational age (mean±SD): 28.4 ± 2.5 weeks Cervical length (mean±SD): 16.6 ± 5.5 mm |
No treatment |
|
Frey, 2022 |
Arm 1 (n= 18) Gestational age (median±interquartile range): 30.6 (29.9 to 32.9) weeks Cervical length (mean±SD): NR |
Vaginal progesterone (200mg per day) |
Arm 2 (n= 18) Gestational age (median±interquartile range): 30.4 (28.1 to 32.6) weeks Cervical length (mean±SD): NR |
Placebo |
|
Kashanian, 2020 |
Arm 1 (n= 80) Gestational age (mean±SD): 31.9 ± 2.0 weeks Cervical length (mean±SD): NR |
Rectal progesterone (200mg per day) |
Arm 2 (n= 80) Gestational age (mean±SD): 32.5 ± 2.3 weeks Cervical length (mean±SD): NR |
Placebo |
|
Martinez de Tejada, 2014 |
Arm 1 (n= 193) Gestational age (mean±SD): 29.5 ± 2.7 weeks Cervical length (mean±SD): 19.4 ± 8.4 mm |
Vaginal progesterone (200mg per day) |
Arm 2 (n= 186) Gestational age (mean±SD): 29.5 ± 2.7 weeks Cervical length (mean±SD): 19.6 ± 8.2 mm |
Placebo |
|
Palacio, 2016 |
Arm 1 (n= 130) Gestational age (mean±SD): 31.7 ± 2.7 weeks Cervical length (mean±SD): 17.5 ± 6.5 mm |
Vaginal progesterone (200mg per day) |
Arm 2 (n= 135) Gestational age (mean±SD): 31.9 ± 2.3 weeks Cervical length (mean±SD): 17.4 ± 6.3 mm |
Placebo |
|
Rozenberg, 2012 |
Arm 1 (n= 94) Gestational age (median±interquartile range): 28.57 (IQR 26.29 to 30.29) weeks Cervical length (median): 17 mm (IQR: 10 to 20 mm) |
17OHPc (500mg twice a week) |
Arm 2 (n= 94) Gestational age (mean±SD): 27.86 (IQR 26.0 to 29.43) weeks Cervical length (median): 15 mm (IQR: 10 to 20 mm) |
No treatment |
|
Wood, 2017 |
Arm 1 (n= 19) Gestational age (mean±SD): 29.0 ± 2.29 weeks Cervical length: NR |
Vaginal progesterone (200mg per day) |
Arm 2 (n= 22) Gestational age (mean±SD): 28.6 ± 2.71 weeks Cervical length: NR |
Placebo |
Abbreviations: 17OHPc=17-hydroxyprogesterone caproate; NR=not reported
Results
1. Neonatal death
Breuking (2023) reported that 5 of the 656 infants (0.8%) whose mother received progesterone died as compared to 8 of the 578 infants (1.4%) whose mother did not receive progesterone (RR=0.55, 95%CI 0.18 to 1.67).
2. Neurological outcomes at 2 years
Not reported.
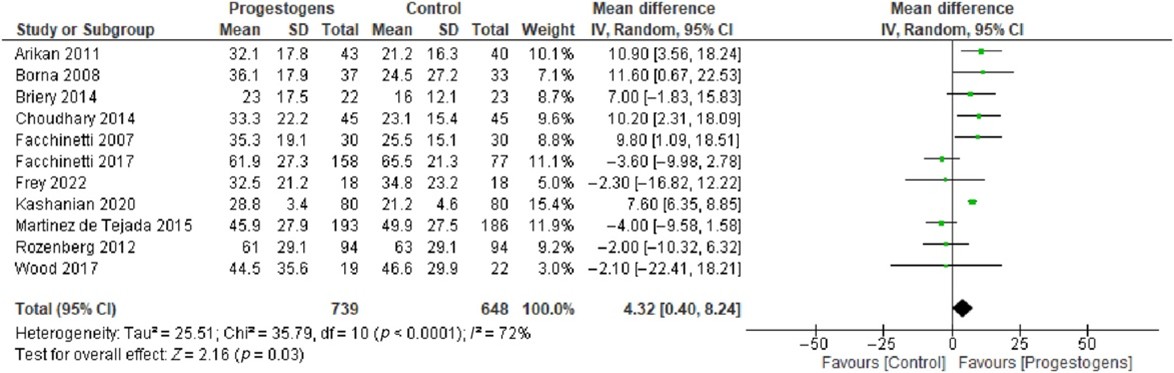
3. Latency time
Breuking (2023) included 11 studies that reported about latency time from randomization to delivery (figure 1). A mean difference of 4.32 days (95%CI 0.40 to 8.24) in latency time was found between progesterone and no progesterone. This difference is clinically relevant favoring progesterone.
Figure 1. Latency time (adapted from Breuking, 2023).
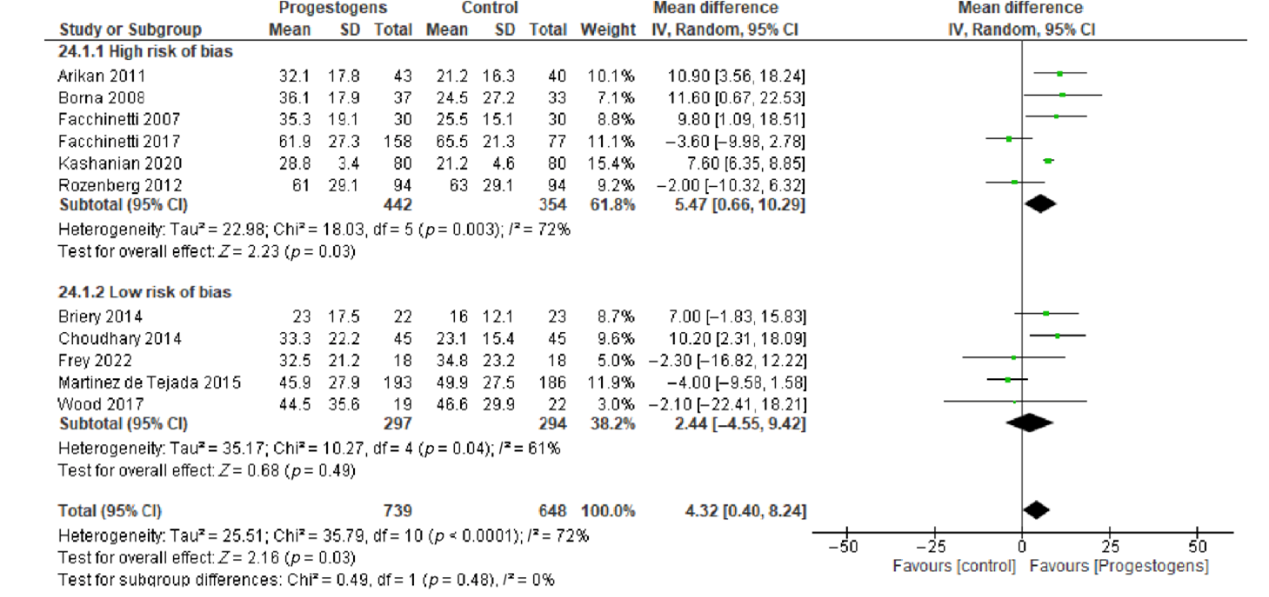
Breuking (2013) also provided a forest plot for a subgroup analysis based on high risk of bias versus low risk of bias (figure 1b). In the low risk of bias studies, a mean difference of 2.44 days (95%CI -4.55 to 9.42) in latency time was found between progesterone and no progesterone.
Figure 1b. Subgroup analysis of latency time based on high risk of bias and low risk of bias
studies (adapted from Breuking, 2023).
4. Preterm birth <34 weeks
Breuking (2023) reported that 100 of the 701 infants (14.3%) whose mother received progesterone were born before 34 weeks as compared to 104 of the 621 infants (16.7%) whose mother did not received progesterone (RR=0.85, 95%CI 0.66 to 1.10).
5. Respiratory distress syndrome (RDS)
Breuking (2023) reported that 79 of the 852 infants (9.3%) whose mother received progesterone had RDS as compared to 97 of the 768 infants (12.6%) whose mother did not receive progesterone (RR=0.73, 95%CI 0.55 to 0.97). This difference is clinically relevant favoring progesterone.
6. Broncho-pulmonary dysplasia (BPD)
Breuking (2023) reported that 8 of the 518 infants (1.5%) whose mother received progesterone had BPD as compared to 8 of the 432 infants (1.9%) whose mother did not receive progesterone (RR=0.83, 95%CI 0.32 to 2.20).
7. Retinopathy of prematurity (ROP)
Not reported.
8. Periventricular leukomalacia (PVL)
Breuking (2023) reported that 3 of the 486 infants (0.6%) whose mother received progesterone had PVL as compared to 6 of the 397 infants (1.5%) whose mother did not receive progesterone (RR=0.41, 95%CI 0.10 to 1.62).
9. Intraventricular hemorrhage (IVH)
Breuking (2023) reported that 10 of the 590 infants (1.7%) whose mother received progesterone had IVH as compared to 14 of the 501 infants (2.8%) whose mother did not receive progesterone (RR=0.61, 95%CI 0.27 to 1.35).
10. Necrotizing enterocolitis (NEC)
Breuking (2023) reported that 7 of the 604 infants (1.2%) whose mother received progesterone had NEC as compared to 9 of the 515 infants (1.7%) whose mother did not receive progesterone (RR=0.66, 95%CI 0.25 to 1.77).
11. Neonatal sepsis
Breuking (2023) reported that 17 of the 449 infants (3.8%) whose mother received progesterone had neonatal sepsis as compared to 27 of the 440 infants (6.1%) whose mother did not receive progesterone (RR=0.62, 95%CI 0.34 to 1.12). This difference is clinically relevant favoring progesterone.
Level of evidence of the literature
According to GRADE, the level of evidence of systematic reviews with randomized controlled trials start high.
The level of evidence regarding the outcome measure neonatal death was downgraded by three levels to very low because uncertainty about the quality of the data analysis (-1, risk of bias) and the 95% confidence interval crossed both lines of no (clinically relevant) effect (-2, imprecision).
The level of evidence regarding the outcome measure neurological outcomes at 2 years could not be assessed with GRADE as this outcome measure was not studied in the included studies.
The level of evidence regarding the outcome measure latency time was downgraded by two levels to low because of uncertainty about the quality of the data analysis (-1, risk of bias) and heterogeneity between the studies (-1, inconsistency).
The level of evidence regarding the outcome measure preterm birth <34 weeks was downgraded by two levels to low because of uncertainty about the quality of the data analysis (-1, risk of bias) and the 95% confidence interval crossed the line of no (clinically relevant) effect (-1, imprecision).
The level of evidence regarding the outcome measure respiratory distress syndrome was downgraded by two levels to low because of uncertainty about the quality of the data analysis (-1, risk of bias) and the 95% confidence interval crossed the line of no (clinically relevant) effect (-1, imprecision).
The level of evidence regarding the outcome measure broncho-pulmonary dysplasia was downgraded by three levels to very low because of uncertainty about the quality of the data analysis (-1, risk of bias) and the 95% confidence interval crossed both lines of no (clinically relevant) effect (-2, imprecision).
The level of evidence regarding the outcome measure retinopathy of prematurity could not be assessed with GRADE as this outcome measure was not studied in the included studies.
The level of evidence regarding the outcome measure periventricular leukomalacia was downgraded by thee levels to very low because of uncertainty about the quality of the data analysis (-1, risk of bias) and the 95% confidence interval crossed both lines of no (clinically relevant) effect (-2, imprecision).
The level of evidence regarding the outcome measure intraventricular hemorrhage was downgraded by three levels to very low because of uncertainty about the quality of the data analysis (-1, risk of bias) and the 95% confidence interval crossed both lines of no (clinically relevant) effect (-2, imprecision).
The level of evidence regarding the outcome measure necrotizing enterocolitis was downgraded by three levels to very low because of uncertainty about the quality of the data analysis (-1, risk of bias) and the 95% confidence interval crossed both lines of no (clinically relevant) effect (-2, imprecision).
The level of evidence regarding the outcome measure neonatal sepsis was downgraded by two levels to low because of uncertainty about the quality of the data analysis (-1, risk of bias) and the 95% confidence interval crossed the line of no (clinically relevant) effect (-1, imprecision).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)favorable effects of giving progesterone to pregnant women with a threatened spontaneous preterm birth between 24 and 34 weeks without prelabor rupture of membranes compared to no administration of progesterone on the morbidity and mortality of the child?
| P: | pregnant women between 24 and 34 weeks with a threatened spontaneous preterm birth without prelabor rupture of membranes |
| I: | progesterone |
| C: | no progesterone |
| O: |
= short term: RDS (respiratory distress syndrome), BPD (broncho-pulmonary dysplasia), ROP (retinopathy of prematurity), PVL (periventricular leukomalacia), IVH (intraventricular hemorrhage), NEC (necrotizing enterocolitis), neonatal sepsis, neonatal death, latency time, preterm birth <34 weeks = long term: neurological outcomes at 2 years (Bayley, CP (cerebral palsy)) |
Relevant outcome measures
The guideline development group considered neonatal death and neurological outcome at 2 years as a critical outcome measure for decision making; and respiratory distress syndrome, broncho-pulmonary dysplasia, retinopathy of prematurity, periventricular leukomalacia, intraventricular hemorrhage, necrotizing enterocolitis, neonatal sepsis, latency time and preterm birth <34 weeks as an important outcome measure for decision making.
The working group defined the outcome measures as follows:
- Neurological outcomes at 2 years: measured with Bayley or cerebral palsy
For the other outcomes, the working group did not define the outcome measures but used the definitions used in the studies.
The working group defined a 1% difference for neonatal death (RR < 0.99 or > 1.01) and 10% difference for neurological outcomes at 2 years (RR < 0.9 or > 1.10) as minimal clinically (patient) important differences. For the other outcomes, a 25% difference for dichotomous outcomes (RR < 0.8 or > 1.25) and 0.5 SD for continuous outcomes was taken as minimal clinically (patient) important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2010 until the 19th of April, 2024. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 460 hits.
Studies were selected based on the following criteria:
- Systematic review (searched in at least two databases, and detailed search strategy, risk of bias assessment and results of individual studies available), randomized controlled trial, or observational studies comparing progesterone with no progesterone;
- The study population had to meet the criteria as defined in the PICO; and
- Full-text English language publication;
Seventeen studies were initially selected based on title and abstract screening. After reading the full text, sixteen studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study was included.
Results
One systematic review was included in the analysis of the literature (Breuking, 2023). Important study characteristics and results are summarized in table 1 and the evidence table. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Breuking SH, De Ruigh AA, Hermans FJR, Schuit E, Combs CA, de Tejada BM, Oudijk MA, Mol BW, Pajkrt E. Progestogen maintenance therapy for prolongation of pregnancy after an episode of preterm labour: A systematic review and meta-analysis. BJOG. 2023 Oct;130(11):1306-1316. doi: 10.1111/1471-0528.17499. Epub 2023 Apr 19. PMID: 37077041.
- Simons NE, Leeuw M, Van't Hooft J, Limpens J, Roseboom TJ, Oudijk MA, Pajkrt E, Finken M, Painter RC. The long-term effect of prenatal progesterone treatment on child development, behaviour and health: a systematic review. BJOG. 2021 May;128(6):964-974. doi: 10.1111/1471-0528.16582. Epub 2020 Nov 28. PMID: 33112462; PMCID: PMC8246867.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 03-06-2025
De Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV) heeft een formele verklaring van geen bezwaar gegeven.
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor zwangeren waarbij sprake is van een dreigende vroeggeboorte.
Werkgroep
- Dr. C.J. (Caroline) Bax, gynaecoloog-perinatoloog, NVOG (voorzitter)
- Dr. J.B. (Jan) Derks, gynaecoloog-perinatoloog, NVOG
- Dr. A. (Ayten) Elvan-Taşpınar, gynaecoloog-perinatoloog, NVOG
- Dr. H.M. (Marieke) Knol, gynaecoloog-perinatoloog, NVOG
- Dr. M.A. (Marjon) de Boer, gynaecoloog-perinatoloog, NVOG
- Dr. D.N.M. (Dimitri) Papatsonis, gynaecoloog, NVOG
- Dr. D.E. (Lia) Wijnberger, gynaecoloog, NVOG
- Dr. P.H. (Dijk), kinderarts-neonatoloog, NVK
- Drs. L. (Leanne) Erkelens-de Vetten, kinderarts-neonataloog, NVK
- Drs. C. (Christel) Rolf, klinisch verloskundige, KNOV (tot maart 2023)
- Drs. C. (Cedric) van Uytrecht, klinisch verloskundige, KNOV (tot 15 augustus 2023)
- Drs. D. (Daphne) de Jong, eerstelijns verloskundige, KNOV (vanaf september 2023)
- Drs. M.A.M. (Machteld) van der Noll, verloskundige, KNOV
- Dr. I.F. (Igna) Kwint-Reijnders, patiëntenvertegenwoordiging Care4Neo
Klankbordgroep
- Drs. H.I. (Herma) Davelaar – van Zanten, V&VN Voortplanting, Obstetrie & Gynaecologie (tot mei 2024)
- Dhr. M. (Maikel) Hustinx, bestuurslid afdeling Vrouw & Kind V&VN (vanaf mei 2024)
Met ondersteuning van
- Drs. D.A.M. (Danique) Middelhuis, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. T. (Tessa) Geltink, adviseur, Kennisinstituut van de Federatie Medsich Specialisten (tot april 2023)
- Dr. M.L. (Marja) Molag, adviseur, Kennisinstituut van de Federatie Medsich Specialisten (vanaf april 2023)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroep |
||||
|
Achternaam werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bax (voorzitter) |
Gynaecoloog-perinatoloog AmsterdamUMC |
Allen onbetaald: Adviesraad MADAM project Lid Raad kwaliteit FMS Organisatie en docent basiscursus prenatale counseling Amsterdam UMC Audit voorzitter in regio Amsterdam Lid Dagelijks bestuur koepel kwaliteit |
ZonMW subsidie voor onderzoek naar NIPT |
Geen restricties |
|
Knol |
Perinataloog Isala Kliniek Zwolle |
Lid werkgroep Otterlo NVOG Lid wetenschapscommissie NVOG Lokale hoofdonderzoeker consortiumstudie apostel 8 |
Geen |
Geen restricties |
|
Elvan-Taspinar |
Perinatoloog UMCG |
Instructeur MOET onbetaald |
Geen |
Geen restricties |
|
Van Uytrecht |
Physician Assistant- Obstetrie |
Training acute verloskunde te Medsim. Verloskundige/ Physician Assistant te Maxima Medisch Centrum te Veldhoven |
Geen |
Geen restricties |
|
Rolf |
Physician Assistant Obstetrie; functie van afdelingsarts op de high care verloskunde( OHC), Máxima MC. Betaalde functie |
Klinisch verloskundige, Máxima MC, betaalde functie |
Geen |
Geen restricties |
|
Papatsonis |
Gynaecoloog Amphia Ziekenhuis Breda |
Geen |
Geen |
Geen restricties |
|
Kwint-Reijnders |
Patientvertegenwoordiger namens Care4Neo, experienced expert |
Gynaecoloog i.o. VAGO afgevaardigde in het pijlerbestuur NVOG werkgroep foetomaternale geneeskunde |
In mijn werkzaamheden als gynaecoloog in opleiding werk ik zelf met dreigende vroeggeboorte casuïstiek en met collega's die uitvoering geven aan deze richtlijn. Daarnaast heb ik zitting als VAGO-afgevaardigde in het pijlerbestuur van de NVOG werkgroep foetomaternale geneeskunde, waarin ook onderwerpen geadresseerd worden die gerelateerd zijn aan dreigende vroeggeboorte. |
Geen restricties |
|
Derks |
Gynaecoloog, afdeling verloskunde, WKZ, UMCU.
|
Betrokken bij de richtlijn preventie vroeggeboorte, onderdeel van de Otterlo, deze commissie schrijft de verloskunde richtlijnen voor de NVOG |
Ik ben binnen mijn kliniek betrokken bij de behandeling van patienten met vroeggeboorte (in de anamnese). Gezien mijn expertise op dit gebied zie ik veel patienten met vroeggeboorte |
Geen retricties |
|
De Vetten |
Kinderarts-neonatoloog, Martini ziekenhuis Groningen |
Geen |
Geen |
Geen restricties |
|
Wijnberger |
Gynaecoloog en perinatoloog Rijnstate Ziekenhuis Arnhem |
Lid werkgroep Otterlo (richtlijnontwikkeling) onbetaald Opleider, onbetaald |
Geen |
Geen restricties |
|
Van der Noll |
Klinisch verloskundige - Master Physician Assistant (inactief) Docent Verloskunde Ba-VKV Rotterdam (actief) |
Geen |
Geen |
Geen restricties |
|
De Boer |
Gynaecoloog |
Geen |
Geen |
Geen restricties |
|
Dijk |
Kinderarts-neonatoloog UMC Groningen |
Lidmaatschap Neonatologie Netwerk Nederland Lid LNR werkgroep Perined/NVK Lid werkgroep Nedederlands Kinderformularium NKFK Lid consortium PedMed-Nl Lid werkgroep revisie RL Hyperbilirubinemie Adviesraad N3 Adviesraad Zwangerschap en Geboorte Consortium Noord Nederland Lid werkgroep Kinderformularium Lid Pedmed Lid sectie Neonatologie Lid werkgroep SPIN |
Geen |
Geen restricties |
|
De Jong |
Eerstelijns verloskundige De Geboortezaak Nieuwegein Klinisch epidemioloog |
Klinisch epidemioloog Lid werkgroep HPP in de 1e lijn Lid werkgroep Handreiking indicaties vitaliteitsecho |
Geen |
Geen restricties |
|
Klankbordgroep |
||||
|
Achternaam klankbordgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Davelaar-Van Zanten |
Adviseur kwaliteit en veiligheid (betaalde functie/reguliere baan) Spaarne Gasthuis |
Geen |
Geen |
Geen restricties |
|
Maikel Hustinx |
Verpleegkundig Specialist, Albert Schweitzer Ziekenhuis, 36u p.w. |
Algemeen bestuurslid V&VN afdeling Vrouw en Kind, vrijwillig. Vice-voorzitter Vereniging Verpleegkundig Specialisten Albert Schweitzer Ziekenhuis, vrijwillig Lid landelijke tafel College Perinatale Zorg, Utrecht, vrijwillig |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van Patiëntenfederatie Nederland en Care4Neo voor de schriftelijke knelpuntenanalyse en afvaardiging namens Care4Neo in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen zie per module ook “Waarden en voorkeuren van patiënten”). De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland en Care4Neo en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Progesteron ter preventie van vroeggeboorte na een opname wegens dreigende vroeggeboorte
|
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 3.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor zwangeren waarbij sprake is van dreigende vroeggeboorte. Tevens zijn er knelpunten aangedragen door Inspectie Gezondheidszorg en Jeugd, Nederlandse Vereniging voor Obstetrie en Gynaecologie, de Koninklijke Nederlandse Organisatie van Verloskundigen en Care4Neo via een schriftelijke knelpuntenanalyse. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.